Method Article
Peptit-Poloksamin Nanopartikülleri Kullanılarak Kültürlenmiş Hücrelerde In vitro Transkribe mRNA'nın Verimli Transfeksiyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Kendinden montajlı bir peptid-poloksamin nanopartikülü (PP-sNp), in vitro transkribe edilmiş mesajcı RNA'yı kapsüllemek ve iletmek için mikroakışkan bir karıştırma cihazı kullanılarak geliştirilmiştir. Tanımlanan mRNA / PP-sNp, in vitro kültürlenmiş hücreleri verimli bir şekilde transfekt edebilir.
Özet
In vitro transkribe edilmiş mesajcı RNA (mRNA) aşıları, koronavirüs hastalığı 2019 (COVID-19) pandemisine karşı mücadelede muazzam bir potansiyel göstermiştir. mRNA'nın kırılgan özelliklerinden dolayı mRNA aşılarına etkin ve güvenli dağıtım sistemleri dahil edilmelidir. Kendinden montajlı bir peptid-poloksamin nanopartikül (PP-sNp) gen dağıtım sistemi, nükleik asitlerin pulmoner iletimi için özel olarak tasarlanmıştır ve başarılı mRNA transfeksiyonuna aracılık etmede umut verici yetenekler gösterir. Burada, PP-sNp'nin Metridia lusiferaz (MetLuc) mRNA'sını nasıl kapsüllediğini ve kültürlenmiş hücreleri başarıyla nasıl transfekte ettiğini detaylandırmak için PP-sNp hazırlamak için geliştirilmiş bir yöntem açıklanmaktadır. MetLuc-mRNA, lineer bir DNA şablonundan in vitro transkripsiyon işlemi ile elde edilir. Bir PP-sNk, sentetik peptit/poloksaminin mikroakışkan bir karıştırıcı kullanılarak mRNA çözeltisi ile karıştırılmasıyla üretilir ve PP-sNp'nin kendi kendine montajına izin verir. PP-sNp yükü daha sonra zeta potansiyeli ölçülerek değerlendirilir. Bu arada, PP-sNp nanopartiküllerinin polidispersitesi ve hidrodinamik boyutu, dinamik ışık saçılması kullanılarak ölçülür. mRNA / PP-sNp nanopartikülleri kültürlenmiş hücrelere transfekte edilir ve hücre kültüründen süpernatanlar lusiferaz aktivitesi için test edilir. Temsili sonuçlar in vitro transfeksiyon kapasitelerini göstermektedir. Bu protokol, yeni nesil mRNA aşı dağıtım sistemlerinin geliştirilmesine ışık tutabilir.
Giriş
Aşılama, bulaşıcı hastalıkların neden olduğu morbidite ve mortaliteyi azaltmaya yönelik en etkili tıbbi müdahalelerden biri olarak müjdelenmiştir1. Aşıların önemi, koronavirüs hastalığının 2019 (COVID-19) salgınından bu yana gösterilmiştir. Geleneksel inaktive edilmiş veya canlı zayıflatılmış patojenlerin enjekte edilmesi kavramının aksine, nükleik asit bazlı aşılar gibi son teknoloji aşı yaklaşımları, geleneksel bütün mikrobiyal virüs veya bakteri bazlı aşılarla ilişkili potansiyel güvenlik sorunlarından kaçınırken, hedef patojenlerin bağışıklık uyarıcı özelliklerini korumaya odaklanır. Hem DNA hem de RNA (yani, in vitro transkribe edilmiş mesajcı RNA, IVT mRNA) bazlı aşılar, bulaşıcı hastalıklar ve kanserler de dahil olmak üzere çeşitli hastalıklara karşı profilaktik ila terapötik potansiyel sergiler 2,3. Prensip olarak, nükleik asit bazlı aşıların potansiyeli, üretimleri, etkinlikleri ve güvenlikleri ile ilgilidir4. Bu aşılar, uygun maliyetli, ölçeklenebilir ve hızlı üretime izin vermek için hücresiz bir şekilde üretilebilir.
Tek bir nükleik asit bazlı aşı, birden fazla antijeni kodlayabilir, bu da çok sayıda viral varyantın veya bakterinin daha az sayıda aşılama ile hedeflenmesini sağlar ve dirençli patojenlere karşı bağışıklık tepkisini güçlendirir 5,6. Ayrıca, nükleik asit bazlı aşılar, virüs veya bakteriyel enfeksiyonun doğal istila sürecini taklit edebilir ve hem B hücresi hem de T hücresi aracılı bağışıklık tepkileri getirebilir. Bazı virüs veya DNA bazlı aşıların aksine, IVT mRNA bazlı aşılar güvenlik açısından büyük bir avantaj sunar. Sitosolde istenen antijeni hızlı bir şekilde eksprese edebilirler ve konakçı genomuna entegre edilmezler, bu da yerleştirme mutajenezi7 ile ilgili endişeleri ortadan kaldırır. IVT-mRNA başarılı translasyondan sonra otomatik olarak parçalanır, bu nedenle protein ekspresyon kinetiği kolayca kontrol edilebilir 8,9. Şiddetli akut solunum sendromu koronavirüs 2 (SARS-CoV-2) pandemisi tarafından katalize edilen dünya çapındaki şirketlerin/kurumların çabaları, birçok aşı türünün piyasaya sürülmesini sağlamıştır. IVT mRNA tabanlı aşı teknolojisi büyük bir potansiyel göstermektedir ve ilk kez, hızlı tasarımı ve birkaç ay içinde herhangi bir hedef antijene uyum sağlama esnekliği sayesinde daha önce beklenen başarısını göstermiştir. IVT mRNA aşılarının COVID-19'a karşı klinik uygulamalardaki başarısı sadece IVT mRNA aşısı araştırma ve geliştirmede yeni bir çağ açmakla kalmadı, aynı zamanda bulaşıcı hastalık salgınlarıyla başa çıkmak için etkili aşıların hızlı bir şekilde geliştirilmesi için değerli deneyimler biriktirdi10,11.
IVT mRNA aşılarının umut verici potansiyeline rağmen, IVT mRNA'nın etki bölgesine (yani sitoplazmaya) etkili hücre içi iletimi, özellikle hava yolları 4 yoluyla uygulananlar için büyük bir engel12 oluşturmaya devam etmektedir. IVT mRNA, doğası gereği son derece kısa bir yarı ömre (~ 7 saat) 13 sahip kararsız bir moleküldür ve bu da IVT mRNA'yı her yerde bulunan RNaz14 tarafından bozulmaya oldukça eğilimli hale getirir. Doğuştan gelen bağışıklık sisteminin lenfositleri, in vivo uygulama durumlarında tanınan IVT mRNA'yı yutma eğilimindedir. Ayrıca, IVT mRNA'nın yüksek negatif yük yoğunluğu ve büyük moleküler ağırlığı (1 x 104-1 x 106 Da), hücresel membranların anyonik lipid çift katmanı boyunca etkili geçirgenliğini bozar15. Bu nedenle, IVT mRNA moleküllerinin bozulmasını inhibe etmek ve hücresel alımı kolaylaştırmak için belirli biyo-fonksiyonel materyallere sahip bir dağıtım sistemi gereklidir16.
Çıplak IVT mRNA'nın in vivo araştırmalar için doğrudan kullanıldığı birkaç istisnai durum dışında, IVT mRNA'yı terapötik etki bölgesine taşımak için çeşitli dağıtım sistemleri kullanılmaktadır17,18. Önceki çalışmalar, bir dağıtım sisteminin yardımı olmadan sitosolde sadece birkaç IVT mRNA'nın tespit edildiğini ortaya koymuştur19. Protamin yoğuşmasından lipit kapsüllemesine kadar sahada sürekli çabalarla RNA iletimini iyileştirmek için çok sayıda strateji geliştirilmiştir20. Lipid nanopartikülleri (LNP'ler), klinik kullanım için onaylanmış tüm mRNA COVID-19 aşılarının LNP tabanlı dağıtım sistemleri kullanması gerçeğiyle kanıtlandığı gibi, mRNA dağıtım araçları arasında klinik olarak en gelişmiş olanlardır21. Bununla birlikte, LNP'ler, formülasyonlar solunum yolu22 üzerinden verildiğinde etkili mRNA transfeksiyonuna aracılık edemez, bu da bu formülasyonların mukozal immün yanıtları indüklemede veya kistik fibroz veya α1-antitripsin eksikliği gibi pulmoner ile ilişkili hastalıkların ele alınmasında uygulanmasını önemli ölçüde sınırlar. Bu nedenle, IVT mRNA'nın hava yolu ile ilgili hücrelerde verimli bir şekilde verilmesini ve transfeksiyonunu kolaylaştırmak için yeni bir dağıtım sistemi geliştirmek, bu karşılanmamış ihtiyacı çözmek için gereklidir.
Peptit-poloksamin kendinden montajlı nanopartikül (PP-sNp) dağıtım sisteminin, farelerin solunum yollarındaki nükleik asitlerin verimli transfeksiyonuna aracılık edebileceği doğrulanmıştır23. PP-sNap, hızlı tarama ve optimizasyon için farklı fonksiyonel modülleri nanopartiküllere entegre edebilen çok işlevli bir modüler tasarım yaklaşımıbenimser23. PP-sNp içindeki sentetik peptitler ve elektriksel olarak nötr amfifilik blok kopolimerleri (poloksamin), kompakt bir yapıya ve pürüzsüz bir yüzeye sahip düzgün dağılmış nanopartiküller üretmek için IVT mRNA ile kendiliğinden etkileşime girebilir23. PP-sNb, kültürlü hücrelerde IVT mRNA moleküllerinin gen transfeksiyon etkisini ve farelerin solunum yollarını artırabilir23. Bu çalışmada, Metridia lusiferazı (MetLuc-mRNA) kodlayan IVT mRNA içeren PP-sNp üretmek için bir protokol tanımlanmaktadır (Şekil 1). Bu protokolde, kademeli balıksırtı karıştırma tasarımını kullanan bir mikroakışkan karıştırma cihazı aracılığıyla kontrollü ve hızlı karıştırma kullanılmaktadır. Prosedürün uygulanması kolaydır ve daha düzgün boyutlarda PP-sNp oluşturulmasına izin verir. Mikroakışkan karıştırıcı kullanılarak PP-sNp üretiminin genel amacı, mRNA kompleksi için PP-sNp'yi iyi kontrol edilen bir şekilde oluşturmak ve böylece in vitro olarak verimli ve tekrarlanabilir hücre transfeksiyonuna izin vermektir. Mevcut protokol, MetLuc-mRNA içeren PP-sNp'nin hazırlanmasını, birleştirilmesini ve karakterizasyonunu açıklamaktadır.
Protokol
1. Kimyasal olarak modifiye edilmiş mRNA'nın in vitro transkripsiyonu
NOT: Nükleaz içermeyen tüplerin, reaktiflerin, cam eşyaların, pipet uçlarının vb. kullanılması gerekir, çünkü RNazlar laboratuvar çözeltileri, cihaz yüzeyleri, saç, cilt, toz vb. gibi ortamlarda her yerde bulunur. Kullanmadan önce tezgah yüzeylerini ve pipetleri iyice temizleyin ve RNase kontaminasyonunu önlemek için eldiven giyin.
- DNA kalıbının lineerleştirilmesini gerçekleştirin.
- Bir T7 polimeraz promotörü, 5' çevrilmemiş bölge (UTR), 3'UTR ve poli (A) kuyrukları ile çevrili Metridia lusiferazın (MetLuc) açık okuma çerçevesini (ORF) sentezleyin ve bakterilerle ifade edilen PUC57 vektörüne klonlayın (bkz.
NOT: DNA şablonunun kodlama dizisi Ek Dosya 1'de verilmiştir. - Bakterileri kültüre alın, bakterileri lize edin ve plazmid DNA'sını karşılık gelen sütunla saflaştırın ( Malzeme Tablosundaki plazmid DNA ekstraksiyon kitine bakınız).
- 1 saat boyunca 37 °C'de 2 μL BamHI, 2 μL KpnI (bakınız Malzeme Tablosu) ve 2 μg plazmid DNA içeren tek bir 50 μL reaksiyon gerçekleştirin ve DNA şablonunun doğrusallaştırılmasını sağlayın.
- Bir T7 polimeraz promotörü, 5' çevrilmemiş bölge (UTR), 3'UTR ve poli (A) kuyrukları ile çevrili Metridia lusiferazın (MetLuc) açık okuma çerçevesini (ORF) sentezleyin ve bakterilerle ifade edilen PUC57 vektörüne klonlayın (bkz.
- Unapped-IVT mRNA üretmek için in vitro transkripsiyon gerçekleştirin.
- Bir T7 transkripsiyon kiti ve psödoüridin kullanarak tek bir 20 μL reaksiyonu ile mRNA sentezi gerçekleştirin (bakınız Malzeme Tablosu): 10 μL (0.8-1 μg) doğrusallaştırılmış DNA şablonu, 1.5 μL (150 mM) ATP, psödo-UTP, GTP ve CTP, 2 μL 10x transkripsiyon tamponu, 1 μL T7 enzimi ve 1 μL nükleaz içermeyen su (NF-su). Yukarıda belirtilen bileşenleri iyice karıştırın ve 3 saat boyunca 37 ° C'de inkübe edin.
- Şablon DNA'sını kaldırın.
- Transkripsiyon işleminden sonra 1 μL (1 U) DNaz (RNaz içermeyen) ekleyin ve 15 dakika boyunca 37 ° C'de inkübe edin.
- Lityum klorür çökeltmesi kullanarak açılmamış-IVT mRNA saflaştırması gerçekleştirin.
- Açılmamış-IVT mRNA'yı lityum klorür kullanarak ( bakınız Malzeme Tablosu) 10 mM'lik bir çalışma konsantrasyonu ile saflaştırın. 20 μL açılmamış-IVT mRNA çözeltisine 50 μL 10 mM lityum klorür ekleyin.
- Tüm hacmi iyice karıştırın ve 1 saat boyunca -20 ° C'de soğutun. Açılmamış-IVT mRNA'yı 12.000 x g'de 12 dakika boyunca toplayın, bu da rutin olarak her bir 20 μL reaksiyondan 80-120 μg açılmamış-IVT mRNA üretir.
- IVT mRNA kapağı gerçekleştirin.
- IVT mRNA kapağını, kapak 1 kapak sistemini kullanarak gerçekleştirin (bkz. Kısaca, 50 μg açılmamış-IVT mRNA'nın ikincil yapısını 10 dakika boyunca 65 °C'de ısıtarak çıkarın, ardından 30-60 dakika boyunca 37 °C'de 100 μL reaksiyonda 2.5 μL s-adenosilmetiyonin (SAM) (20 mM) ve 4 μL 2'-O-metiltransferaz (100 U) kullanılarak m7G kapak yapısının değiştirilmesiyle hazırlanan kapak 1 ile bağlayın.
- 250 μL 10 mM lityum klorür kullanarak kapaklı IVT mRNA'nın 100 μL'sini saflaştırın ve 50 μL NF-su içinde seyreltin.
- Kapaklı-IVT mRNA'nın saflığını ve moleküler boyutunu belirleyin.
- UV-görünür spektrofotometre ile kapaklı-IVT mRNA konsantrasyonunu ölçün. Bir RNA belirteci kullanarak (bakınız Malzeme Tablosu), kapaklı-IVT mRNA'nın moleküler boyutunu% 18 formaldehit içeren% 1 formaldehit denatüre edici agaroz jelinde analiz edin (voltaj 120 V'tur). Açılmamış-IVT mRNA ve kapaklı-IVT mRNA'nın -80 ° C'de saklandığından emin olun.
NOT: IVT mRNA'nın 1.8-2.1'lik bir A 260 / A280 oranında ve 2.0 veya biraz daha yüksek bir A260 / A 230 oranında iyi saflığa sahip olduğu düşünülmüştür.
- UV-görünür spektrofotometre ile kapaklı-IVT mRNA konsantrasyonunu ölçün. Bir RNA belirteci kullanarak (bakınız Malzeme Tablosu), kapaklı-IVT mRNA'nın moleküler boyutunu% 18 formaldehit içeren% 1 formaldehit denatüre edici agaroz jelinde analiz edin (voltaj 120 V'tur). Açılmamış-IVT mRNA ve kapaklı-IVT mRNA'nın -80 ° C'de saklandığından emin olun.
2. IVT mRNA/PP-sNp üretimi
- 10 mg/mL'lik bir stok çözeltisi elde etmek için T704'ü ( Malzeme Tablosuna bakınız) NF suyunda çözündürerek poloksamin 704 (T704) stok çözeltisi hazırlayın. Hazırlanan çözeltiyi 4 °C'de saklayın.
NOT: T704, dört zincir poli(propilen oksit) (PPO) blok ve poli(etilen oksit) (PEO) blok24'e bağlanmış bir etilendiamin merkezi grubundan yapılmış X şeklinde bir yapı içerir. T704'ün moleküler ağırlığı (Mw) 5500'dür. - Sentetik peptit (sPep, bakınız Malzeme Tablosu) stok çözeltisini, sPep'i (dizi: KETWWETWWTEWKKKKRRRKKKKGACSE) çözündürerek hazırlayın.
RSMNFCG) NF suyunda 2 mg/mL stok çözeltisi elde etmek ve 4 °C'de saklamak için. - IVT mRNA çözeltisini, IVT mRNA'yı (adım 1) buz üzerinde çözerek ve tüpü açmadan önce oda sıcaklığında 300 x g'de 3 s santrifüj ederek hazırlayın. IVT mRNA çözeltisini NF suyu ile 0,04 μg/μL'ye kadar seyreltin.
NOT: IVT mRNA ile mümkün olduğunca biyogüvenlik kabininde çalışılması önerilir. - T704 ve sPep karışım çözeltisini, sPep çözeltisini 0,555 μg/μL'ye ve T704 çözeltisini NF suyu ile 8 μg/μL'ye seyrelterek hazırlayın. Daha fazla kullanmadan önce karışık çözeltiyi oda sıcaklığında 15 dakika boyunca inkübe edin.
NOT: İstenilen N/P oranına göre gerekli sPep bileşenini hesaplayın. N / P oranı, sPep içindeki toplam azot kalıntısı sayısının (N) IVT mRNA içindeki negatif yüklü fosfat gruplarının (P) toplam sayısına oranıdır. T704 ve IVT mRNA arasındaki ağırlık/ağırlık (w/w) oranına göre gerekli T704'ü hesaplayın. N/P oranının 5, w/w oranının ise 100 olması gerekmektedir. - IVT mRNA/PP-sNp formülasyonunu aşağıdaki adımları izleyerek hazırlayın.
- IVT mRNA çözeltisini (adım 3) 1 mL'lik bir şırıngaya çekerek şırınga ucunda hava boşluğu veya kabarcık olmadığından emin olun. Şırıngayı kartuşun bir tarafına döner bloğun yanına yerleştirin.
- 1 mL'lik bir şırıngayı T704 ve sPep karışım çözeltisi ile doldurun (adım 4). Şırınga ucundaki kabarcıkları veya hava boşluklarını çıkarın ve şırıngayı pompanın diğer girişine yerleştirin (bkz.
- Pompayı 1:1 akış oranına ve toplam 4-10 mL/dak debiye ayarlayın.
NOT: Burada sunulan çalışmalarda toplam 6 mL/dak debi en uygunudur. - Karıştırma cihazının akış yolunun sonuna karışık IVT-mRNA/PP-sNp çözeltisini toplamak için 10 mL RNaz içermeyen bir konik tüp yerleştirin (bkz.
- Karıştırmayı başlatmak için pompayı çalıştırın ve parametrelerin doğru girildiğinden emin olun. Pompanın 6 sn boyunca çalışması bittikten sonra, IVT-mRNA / PP-sNp örneğini konik tüpten toplayın.
NOT: PP-sNp bir mikroakışkan karıştırıcı kullanılarak üretilmiştir (Ek Şekil 1). Cihaz sabit akışlı bir pompa, bağlantı cihazı, çip ve sabit cihazdan oluşur. Karıştırma işleminde, talaşa bağlı sabit akışlı pompa, önceden ayarlanmış akış hızına göre talaşa sıvı gönderir. Bağlı sabit akışlı pompa, çipin birden fazla giriş kanalına tek bir çıkış kanalı ile bağlanabilir. Çip de dahil olmak üzere cihazın bileşenleri ticari kaynaklardan elde edildi ve rasyonel olarak monte edildi (bkz. IVT mRNA çözeltisinin ve T704-sPep karışık çözeltisinin akış hızı ve hacmi gibi parametreler, farklı bir kurulum kullanılıyorsa mevcut protokolde görüntülenenlerden farklı olabilir ve buna göre optimize edilmelidir.
3. IVT-mRNA/PP-sNp'nin hidrodinamik çapının ve polidispersitesinin ölçülmesi
- 1 mL'lik bir son hacim elde etmek için IVT mRNA / PP-sNp çözeltisinin (adım 2) bir alikotunu NF-su ile seyreltin.
- Yarı mikro küvet25 kullanarak hidrodinamik boyutu ve polidispersite indeksini (PDI) ölçün. IVT mRNA/PP-sNp solüsyonunu küvete ekleyin ve partikül boyutu ölçere yerleştirin (bkz. Standart bir işletim prosedürü oluşturun ve veri toplamaya başlamak için Başlat'a tıklayın.
4. Transfeksiyon için hücrelerin hazırlanması
- Transfeksiyondan 24 saat önce 3.5 x 10 4 hücre / kuyu yoğunluğunda 96 kuyucuklu plakalarda plaka insan bronşiyal epitelhücreleri ( 16HBE) ve bir dendritik hücre hattı (DC2.4). Hücreleri% 10 ısıda inaktive edilmiş fetal sığır serumu ve% 1 penisilin / streptomisin ile desteklenmiş bir kültür ortamında büyütün.
NOT: Hücreler ticari bir kaynaktan elde edilmiştir (bkz. - Transfeksiyondan önce hücrelerin% 60-80 oranında eşit olmasını sağlamak için hücreleri24 saat boyunca bir inkübatörde (37 ° C ve% 5 CO 2 atmosferi) inkübe edin.
5. Kültürlenmiş hücrelerin transfeksiyonu
- Büyüme ortamını çıkardıktan sonra, kaplanmış hücreleri 0,2 mL / kuyucuk 1x PBS ile yıkayın.
- Kaplanmış hücre kültürlerini içeren her bir kuyucuğa 170 μL serumsuz kültür ortamı ekleyin.
- 0.4 μg MetLuc mRNA (2. adımda hazırlanan) içeren IVT mRNA / PP-sNp formülasyonunu, 30 μL / kuyucuk miktarında damla damla ekleyin.
- IVT mRNA/PP-sNp formülasyonu ile hücreleri 37 °C'de nemlendirilmiş %5 CO2 ile zenginleştirilmiş atmosferde 4 saat boyunca inkübe edin.
- Transfeksiyon ortamını% 10 ısı ile inaktive edilmiş fetal sığır serumu ve% 1 (v / v) penisilin / streptomisin ile desteklenmiş 0.2 mL taze kültür ortamı ile değiştirin.
NOT: Fetal sığır serumu, inaktivasyon için 30 dakika boyunca 56 ° C'de ısıtıldı. - Transfekte hücreleri 37 ° C'de ve% 5 CO2 ile zenginleştirilmiş bir atmosferde 24 saat boyunca inkübe edin ve her bir kuyucuktan tespit edilecek süpernatantları toplayın.
6. Metridia lusiferaz (MetLuc) testi kullanılarak hücre transfeksiyon etkinliğinin analizi
- Aşağıdaki adımları izleyerek coelenterazine substratı kullanarak MetLuc aktivitesi için her bir kuyucuktan süpernatantı test edin (Malzeme Tablosuna bakınız).
- Coelenterazine substratına 1x PBS ekleyerek yeni bir tahlil çözeltisi hazırlayın (coelenterazine konsantrasyonu 15 mM'dir).
- Vorteks coelenterazine çözeltisi 10 s için tam karıştırma için.
- 96 kuyucuklu bir plakaya 50 μL süpernatant (adım 5'te toplanan) ekleyin.
- Her bir kuyucuğa manuel olarak veya otomatik enjeksiyonla 30 μL coelenterazine çözeltisi (15 mM) eklemeden önce mikroplaka okuyucuyu ( Malzeme Tablosuna bakınız) 1.000 ms okuma süresiyle ayarlayın.
- Coelenterazine çözeltisini süpernatanta ekledikten hemen sonra lüminesans sinyalini ölçmek için Başlat'a tıklayın.
NOT: Lüminesans sinyali bir mikroplaka okuyucu kullanılarak ölçülür ve aktivitesi göreceli ışık birimleri cinsinden ifade edilir. PBS transfeksiyonlu kuyulardan elde edilen değerler boş kontrol olarak kullanılacaktır.
Sonuçlar
Rekombinant plazmid, doğrusallaştırılmış DNA şablonunu üretmek için sindirildi (Şekil 2A). Açıklanan protokolü kullanarak, T7 in vitro transkripsiyon kiti, 20 μL reaksiyon başına 80-120 μg'a kadar açılmamış MetLuc-mRNA ve 100 μL reaksiyon başına 50-60 μg kapaklı MetLuc-mRNA üretebilir. Elektroforez ile analiz edildiğinde, yüksek kalitede bozulmamış MetLuc-mRNA, Şekil 2B'de gösterildiği gibi tek ve net bir bant göstermelidir. DNA şablonundan reaksiyona sokulan kirleticiler, RNA bozulmasına ve daha düşük verime neden olabilir.
MetLuc-mRNA (MetLuc-mRNA/PP-sNp) içeren PP-sNp, mikroakışkan karıştırma yöntemi kullanılarak hazırlanmıştır (Şekil 1). Tablo 1 , MetLuc-mRNA/PP-sNp'nin fizikokimyasal karakterizasyonu ile ilgili verileri örnek olarak göstermektedir. MetLuc-mRNA / PP-sNp'nin hidrodinamik yarıçapı, yaklaşık 70-100 nm arasında değişiyorsa doğru kabul edilebilir. Ayrıca, PP-sNk'nin PDI'sı sabit olmalı ve tercihen 0.2'nin altında olmalıdır, ancak yaklaşık 0.3'e kadar PDI değerleri kabul edilir.
MetLuc-mRNA'yı PP-sNp'ye başarıyla dahil ettikten sonra, formülasyon 16HBE hücreleri ve bir dendritik hücre hattı (DC2.4) ile inkübe edilebilir ve MetLuc-mRNA'nın transfeksiyon verimliliği, transfeksiyon sonrası 24 saat hücre kültürü süpernatant içindeki lusiferaz aktivitesi ile gösterilebilir. Şekil 3 , MetLuc-mRNA/PP-sNp'nin başarılı transfeksiyonunun tipik bir örneğidir. 16HBE hücrelerinde MetLuc-mRNA / PP-sNp ile transfekte edilen hücrelerin, ticari olarak temin edilebilen lipit bazlı transfeksiyon regent (LP) ( bakınız Malzeme Tablosu), çıplak MetLuc-mRNA (negatif kontrol), PBS (boş kontrol) veya T704-sPep karışık çözeltisi (sahte kontrol) ile transfekte edilenlere kıyasla önemli ölçüde daha yüksek lusiferaz ekspresyonu gösterdiği açıkça görülebilir. MetLuc-mRNA / PP-sNp ayrıca LP'ye kıyasla daha yüksek lusiferaz ekspresyonu gösterdi. Veriler, PP-sNp dağıtım sisteminin MetLuc-mRNA'yı bozunmaya karşı korumak ve eksojen MetLuc-mRNA'nın transfeksiyon verimliliğini arttırmak için önemli olduğunu göstermektedir. Bu nedenle, PP-sNp gibi dağıtım sistemleri genellikle IVT mRNA transfeksiyon çalışmaları için gereklidir.
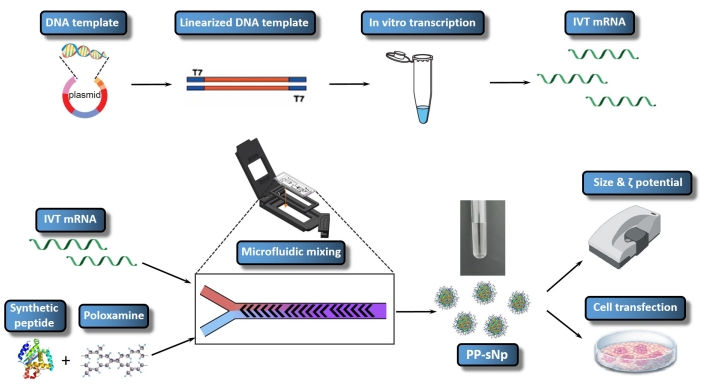
Şekil 1: IVT mRNA/PP-sNp'nin tüm iş akışının şematik gösterimi. DNA şablonu, rekombinant plazmid yapısı ile plazmid ile bağlantılıdır. Doğrusallaştırılmış DNA şablonu, kısıtlama enzimi sindirimi kullanılarak birleştirilir. In vitro transkribe edilmiş mRNA (IVT mRNA) sentezlenir ve doğrusallaştırılmış DNA şablonundan kapatılır. T704-sPep çözeltisi T704 ve sentetik peptit (sPep) içerirken, IVT mRNA çözeltisi MetLuc-mRNA içerir. IVT mRNA ve T704-sPep karışık çözeltileri, MetLuc-mRNA / PP-sNp'yi oluşturan bir mikroakışkan karıştırıcı kullanılarak karıştırılır. Daha sonra, bir Zetasizer kullanılarak parçacık boyutunu ve polidispersiteyi belirlemek için MetLuc-mRNA / PP-sNp'nin karakterizasyonu gerçekleştirilir. 16HBE hücreleri MetLuc-mRNA / PP-sN ile transfekte edilir ve transfeksiyon etkinliğini değerlendirmek için süpernatant içindeki lusiferaz aktivitesi ölçülür. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: MetLuc-mRNA'nın üretimi . (A) DNA şablonu bir T7 polimeraz promotörü, 5'inmemiş bir bölge (UTR), MetLuc'un açık okuma çerçevesi (ORF), bir 3'UTR ve poli (A) kuyrukları içerir. (B) Elektroforez tespiti. Beyaz ok rekombinant plazmidi gösterir. Sarı ok PUC57 vektörünü gösterir. Kırmızı ok, MetLuc-mRNA'nın in vitro transkripsiyonu için DNA şablonunu gösterir. Yeşil ok, açılmamış MetLuc-mRNA'yı gösterir. Mavi ok, kapaklı MetLuc-mRNA'yı gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: 16HBE ve DC2.4 hücrelerinde MetLuc-mRNA/PP-sNp'nin transfeksiyon etkinliği. MetLuc-mRNA, (A) 16HBE hücrelerinde PP-sNp ve (B) bir dendritik hücre hattında (DC2.4) transfekte edildi. MetLuc-mRNA'nın son konsantrasyonu 0.02 μg / μL, sPep'inki 0.139 μg / μL ve T704'ünki PP-sNp'de 2 μg / μL idi. Lusiferaz aktivitesi transfeksiyondan 24 saat sonra ölçüldü. PBS ile tedavi edilen örneklem boş bir kontrol olarak kabul edildi. T704-sPep karışık çözeltisi sahte bir kontrol olarak benimsendi. İstatistiksel farklılıklar öğrencinin t-testi ile analiz edildi (ns p ≥ 0.05, * p < 0.05). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| IVT mRNA | N/P (sPep) | w/w (T704) | Boyut (nm) | Pdı | Zeta |
| 17,5 ng/μL | 5 | 100 | 85,12 ± 9,40 | 0.20 ± 0.07 | -13.07 ± 0.47 |
Tablo 1: MetLuc-mRNA/PP-sNp'nin fizikokimyasal karakterizasyon verileri.
Ek Şekil 1: Mevcut çalışmada kullanılan kurum içi hazırlanmış mikroakışkan cihazın kurulumu. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 1: DNA şablonunun kodlama dizisi. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Burada açıklanan protokol sadece tanımlanmış özelliklere sahip IVT mRNA aşı formülasyonlarının uygun maliyetli ve hızlı üretimine izin vermekle kalmaz, aynı zamanda PP-sNp formülasyonunu gen terapisi gibi spesifik terapötik amaçlara göre özelleştirme imkanı da sunar. IVT mRNA/PP-sNp'nin başarılı bir şekilde üretilmesini sağlamak için, bazı kritik adımlara daha fazla dikkat edilmesi önerilir. mRNA ile çalışırken, süreç boyunca RNaz içermeyen koşulların korunması gerektiğini daima unutmayın, çünkü IVT mRNA, IVT mRNA kimyasal modifikasyonla hazırlanmış olsa bile, RNaz tarafından bozunma konusunda çok hassastır. Bu arada, formülasyonları depolarken RNase içermeyen bir ortam da sağlanmalıdır. IVT mRNA/PP-sNap'ın 2-8 °C'de 1 haftaya kadar saklanması önerilir. Sunulan sonuçlar, nükleaz içermeyen suyun, yüksek transfeksiyon verimliliğine sahip PP-sNk'nin başarılı bir şekilde oluşturulmasında etkili olduğunu göstermektedir. İstenirse PBS, salin, OptiMEM gibi diğer arabellekler kullanılabilir. Kültürlenmiş hücrelerin yaşayabilirliğini sağlamak için in vitro transfeksiyonların IVT mRNA / PP-sNp kullanılarak bir OptiMEM ortamında yapılması önerilir. Formülasyonun hazırlanması için nükleaz içermeyen su yerine başka bir tampon seçilirse, IVT mRNA'nın düşük konsantrasyonda (100 ng / mL'nin altında) kullanılması önemlidir; Aksi takdirde, nanopartiküller çökelme eğilimindedir, bu da geçersiz bir formülasyon oluşturur. Bu fenomenin nedeni, sentetik peptit içindeki katyonik moiety'dir. Ek olarak, nanopartikülün güçlü pozitif yük yoğunluğu hücre zarını dengesizleştirebilir, böylece önemli sitotoksisiteyi indükleyebilir. Bununla birlikte, önceki çalışmada, PP-sNp içindeki pozitif yükün, verimli IVT mRNA hücresel alımına, endozom kaçışına ve başarılı transfeksiyon23'e aracılık etmede zorunlu olduğu gösterilmiştir. Sonuç olarak, PP-sNp içindeki pozitif yükün, verimlilik ve toksisite açısından hassas bir denge kurması için ayarlanması önemlidir.
Sunulan protokol, bazı parametre değişiklikleri ile çeşitli PP-sNp tabanlı formülasyonlara uygulanabilir. IVT mRNA bazlı aşıların verilmesi için, partikül boyutu ve polidispersite indeksi gibi biyofiziksel özellikler, hazırlanan nanopartiküllerin transfeksiyon etkinliği ve immünojenisitesi için kritik öneme sahiptir26. IVT mRNA / PP-sNp'nin nanometre ölçeğindeki partikül boyutu, fizyolojik engeller arasında verimli bir transfer sağlar ve bu nedenle sonraki in vivo uygulamalar için önemlidir. 60-150 nm boyut aralığındaki LNP'lerin, insan olmayan primatlarda sağlam bağışıklık tepkileri ürettiği bildirilmiştir26. Öte yandan, büyük boyutlu nanopartiküller (örneğin, 400-1000 nm), pulmoner doğum için uygulandığında hava yolu mukus bariyerinin üstesinden gelemedi, çünkü önceki araştırmalarda ortaya çıktığı gibi, hava yolu mukus ağı gözeneklerinin ortalama 3 boyutlu ağ aralığı yaklaşık 60-300 nm27,28 arasında değişmektedir. İstenilen boyut veya transfeksiyon verimliliği elde edilmezse, sorun gidermeye başlamak için bazı ipuçları, kullanılan poloksamin veya sentetik peptit bileşenlerinin miktarını ayarlamayı içerir. Önceki çalışma, transfeksiyon için kullanılan IVT mRNA miktarı, kuluçka süresi ve kültürlenmiş hücrelerin tipleri ve hücre yoğunluğu gibi ek parametrelerin de transfeksiyon sonucunu önemli ölçüde etkileyebileceğini ortaya koymuştur23. Ayrıca, PP-sNp içindeki hedefleme moiety, kapsüllenmiş IVT mRNA'nın ilgili reseptörleri gösteren hücrelere spesifik olarak verilmesine izin verdiğinden, hedef hücreler hava yolu ile ilgili hücreler yerine diğer tiplerle transfekte edilirse, alternatif hedefleme ligandları ile değiştirilmesi gerekebilir. Genel olarak, protokol daha ayrıntılı bir içgörü ve daha fazla inceleme ile hala geliştirilebilir.
Orijinal IVT mRNA/PP-sNp'nin başlangıçta doğrudan manuel karıştırma ile hazırlandığı göz önüne alındığında, operatörün yetenekleri formülasyonun kalitesini kontrol etmede önemli bir rol oynamaktadır. IVT mRNA'yı PP-sNp'nin bileşenleri ile karıştırma sürecindeki değişiklikler, nano boyutlu parçacıklardan ziyade büyük mikro parçacıklarla sonuçlanabilir. En zor adım, kontrollü bir şekilde yapılması gereken mRNA ve sentetik peptidin karıştırılmasıdır. IVT mRNA/PP-sNp formülasyonunun farklı partileri arasındaki tekrarlanabilirliği artırmak için, düşük hacimli tarama, hızlı hız ve tekrarlanabilirlik, mikroakışkan yöntem29'un kullanılmasının önemli özellikleri olduğu için bir mikroakışkan karıştırıcı benimsenmiştir. Bu yöntem, partikül boyutu veya farklı partiler arasında gözlemlenen transfeksiyon verimliliği üzerinde önemli bir etkisi olmadan iyi bir tekrarlanabilirlik gösterdi. Bu durum IVT mRNA bazlı aşıların klinik uygulamalarda uygulanabilmesi için vazgeçilmez bir kriterdir. Özellikle, mikroakışkan karıştırıcı maksimum kullanıcı sayısını (üretici tarafından önerilen) aşmamalı ve farklı bileşimlere sahip formülasyonlar arasında değiştirilmelidir.
Bu protokolde açıklanan IVT mRNA transkripsiyonu protokolü, teorik olarak ilgilenilen herhangi bir muhabir proteini / antijenini hazırlamak için kullanılabilir. Metridia lusiferaz (MetLuc) bu çalışmada özel olarak uygulanmıştır çünkü benzersiz avantajlara sahiptir. MetLuc'un aktivite testinin yüksek hassasiyetle yapılması kolaydır, çünkü MetLuc yoğun bir biyolüminesan sinyal üretebilir ve doğrudan hücre ortamına salgılanabilir, böylece hücre lizsine ihtiyaç duyulmaz. Kültürlenmiş hücrelerdeki MetLuc ekspresyonunun, MetLuc-mRNA'nın kendisinin işlevselliği dışında birçok parametreden (örneğin, kuyu başına değişen hücre sayıları ve pipetleme hataları vb.) etkilenebileceğini belirtmek önemlidir.
Mevcut protokol IVT mRNA aşısının verilmesi için kurulmuş olmasına rağmen, plazmid DNA (pDNA) gibi diğer nükleik asit türlerine dayanan aşılar veya terapötikler için de uygulanabilir. Bu süreç, çeşitli klinik endikasyonlar için belirli PP-sNp geliştirmek için sentetik peptit, nükleik asit ve poloksamin bileşen değişikliklerine uyarlanabilir. Gerçekten de, ekzojen kistik fibrozis transmembran transdüksiyon regülatörü (CFTR) geninin, CFTR nakavt farelerinin solunum epitel dokusunda, PP-sNp23 tarafından verilen bir Uyuyan Güzel genetik modifikasyon aracının kullanılmasıyla genom entegrasyonu başarıyla sağlanmıştır. Terapötik uygulamalarla ilgili olarak, IVT mRNA / PP-sNp formülasyonları, α1-antitripsin eksikliği veya kistik fibroz30 gibi akciğer hastalıklarının tedavisi için spesifik nebülizasyon cihazları kullanılarak bir aerosol olarak kullanılabilir. Bununla birlikte, nebülizasyon için IVT mRNA / PP-sNp formülasyonlarının optimize edilmesi ve özelleştirilmesi gerektiğine dikkat etmek önemlidir, çünkü aerosolize IVT mRNA, nebülizör tarafından oluşturulan kesme kuvveti ve IVT mRNA30'un kırılgan doğası nedeniyle verimsiz olabilir. Dahası, protokol muhtemelen T-bağlantı karıştırma cihazları ve hatta sıkıştırma jetleri karıştırma pompaları31,32 gibi farklı mikroakışkan karıştırma cihazları kullanılarak daha büyük hacimlere ölçeklendirilebilir.
Özetle, burada ayrıntılı olarak açıklanan protokol, IVT mRNA'yı bir PP-sNp dağıtım sisteminde formüle etmek için tekrarlanabilir bir yöntem ve ayrıca kültürlenmiş hücrelerde daha sonra güvenilir transfeksiyon sunmaktadır. Açıklanan yöntem, mikroakışkan bir karıştırıcı kullanarak IVT mRNA / PP-sNp üretmek için erişilebilir ve kolay bir yaklaşımı garanti eder. Küçük partikül boyutlarına ve düşük polidispersite indeksine sahip hazırlanan formülasyonlar daha sonra transfekt kültürlü hücrelere güvenli ve verimli bir şekilde uygulanabilir. Bu protokol, PP-sNp tabanlı dağıtım sisteminin, belirtilen tüm dezavantajlardan kaçınırken, yeni IVT mRNA tabanlı aşılar veya terapötikler tasarlamak için akademik topluluğa sunulmasını sağlayacaktır. PP-sNp'nin esnek profilleriyle, çeşitli hastalıkları ele almak için farklı terapötikler üretmek için PP-sNp ile gelecekte çok sayıda uygulamanın gerçekleştirilmesi beklenmektedir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (NSFC, Hibe No. 82041045 ve 82173764), Çin Bilim ve Teknoloji Bakanlığı tarafından Patogenez ve Epidemik Önleme Teknoloji Sistemi Çalışması'nın (2021YFC2302500) ana projesi, Chongqing Yetenekleri: Olağanüstü Genç Yetenekler Projesi (CQYC202005027) ve Chongqing Doğa Bilimleri Vakfı (cstc2021jcyj-msxmX0136) tarafından desteklenmiştir. Yazarlar, hidrodinamik çapı (nm) ve polidispersite indeksini (PDI) ölçtüğü için Dr. Xiaoyan Ding'e minnettardır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BamHI | Takara | 1010 | |
| cap 1 capping system | Jinan | M082 | |
| Dendritic cell-line | Sigma | SCC142 | |
| DNA sequence | Genescript | ||
| Human bronchial epithelial cells | Sigma | SCC150 | |
| KpnI | Takara | 1068 | |
| LP | Beyotime | C0533 | |
| Lithium chloride | APEXBio | B6083 | |
| Malvern Zetasizer Nano ZS90 | Malvern | NB007605 | |
| Microfluidic chip | ZHONGXINQIHENG | Standard PDMS chip | |
| Microplate readers | ThermoFisher | Varioskan lux | |
| NanoDrop One | ThermoFisher | ND-ONE-W (A30221) | |
| Nuclease-free water | ThermoFisher | AM9932 | |
| OptiMEM | Gibco | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Pseudouridine | APE×Bio | B7972 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| Quanti-Luc | InvivoGen | Rep-qlc2 | |
| RiboRuler High Range RNA Ladder | ThermoFisher | SM1821 | |
| RNase-free conical tube | Biosharp | BS-100-M | |
| RPMI Medium 1640 | ThermoFisher | C11875500BT | |
| Syringe pump | Chemyx | Fusion 101 | |
| T7 transcription Kit | Jinan | E131 |
Referanslar
- Nature milestones in vaccines. Springer Nature Available from: https://www.nature.com/collections/hcajdiajij (2020)
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 40 (6), 840-854 (2022).
- Mulligan, M. J., et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586 (7830), 589-593 (2020).
- Tang, J., et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa. Nanomaterials. 12 (2), 226 (2022).
- Freyn, A. W., et al. A multi-targeting, nucleoside-modified mRNA influenza virus vaccine provides broad protection in mice. Molecular Therapy. 28 (7), 1569-1584 (2020).
- Wu, K., et al. Variant SARS-CoV-2 mRNA vaccines confer broad neutralization as primary or booster series in mice. Vaccine. 39 (51), 7394-7400 (2021).
- Chaudhary, N., Weissman, D., Whitehead, K. A. mRNA vaccines for infectious diseases: Principles, delivery and clinical translation. Nature Reviews Drug Discovery. 20, 817-838 (2021).
- Kormann, M. S. D., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature Biotechnology. 29 (2), 154-157 (2011).
- Tavernier, G., et al. mRNA as gene therapeutic: How to control protein expression. Journal of Controlled Release. 150 (3), 238-247 (2011).
- Walsh, E. E., et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. The New England Journal of Medicine. 383 (25), 2439-2450 (2020).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine. 384 (5), 403-416 (2021).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Sharova, L. V., et al. Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells. DNA Research. 16 (1), 45-58 (2009).
- Houseley, J., Tollervey, D. The many pathways of RNA degradation. Cell. 136 (4), 763-776 (2009).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13, 359-380 (2014).
- Hajj, K. A., Whitehead, K. A. Tools for translation: Non-viral materials for therapeutic mRNA delivery. Nature Reviews Materials. 2, 17056 (2017).
- Deering, R. P., Kommareddy, S., Ulmer, J. B., Brito, L. A., Geall, A. J. Nucleic acid vaccines: Prospects for non-viral delivery of mRNA vaccines. Expert Opinion on Drug Delivery. 11 (6), 885-899 (2014).
- Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C., Thakur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics. 12 (2), 102 (2020).
- Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nature Reviews Materials. 6 (12), 1078-1094 (2021).
- Sahin, U., et al. COVID-19 vaccine BNT162b1 elicits human antibody and T(H)1 T cell responses. Nature. 586 (7830), 594-599 (2020).
- Azzi, L., et al. Mucosal immune response in BNT162b2 COVID-19 vaccine recipients. EBioMedicine. 75, 103788 (2022).
- Guan, S., et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis. Nature Nanotechnology. 14 (3), 287-297 (2019).
- Pitard, B., et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Research. 32 (20), 159 (2004).
- Hiroi, T., Shibayama, M. Measurement of particle size distribution in turbid solutions by dynamic light scattering microscopy. Journal of Visualized Experiments. (119), e54885 (2017).
- Hassett, K. J., et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. Journal of Controlled Release. 335, 237-246 (2021).
- Suk, J. S., et al. The penetration of fresh undiluted sputum expectorated by cystic fibrosis patients by non-adhesive polymer nanoparticles. Biomaterials. 30 (13), 2591-2597 (2009).
- Kim, N., Duncan, G. A., Hanes, J., Suk, J. S. Barriers to inhaled gene therapy of obstructive lung diseases: A review. Journal of Controlled Release. 240, 465-488 (2016).
- Liu, Z., Fontana, F., Python, A., Hirvonen, J. T., Santos, H. A. Microfluidics for production of particles: Mechanism, methodology, and applications. Small. 16 (9), 1904673 (2020).
- Guan, S., Darmstädter, M., Xu, C., Rosenecker, J. In vitro investigations on optimizing and nebulization of IVT-mRNA formulations for potential pulmonary-based alpha-1-antitrypsin deficiency treatment. Pharmaceutics. 13 (8), 1281 (2021).
- Shepherd, S. J., Issadore, D., Mitchell, M. J. Microfluidic formulation of nanoparticles for biomedical applications. Biomaterials. 274, 120826 (2021).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır