Method Article
ペプチドポロキサミンナノ粒子を用いた培養細胞における in vitro 転写mRNAの効率的なトランスフェクション
* これらの著者は同等に貢献しました
要約
自己組織化ペプチドポロキサミンナノ粒子(PP-sNp)は、イン ビトロ転写 メッセンジャーRNAをカプセル化および送達するためにマイクロ流体混合装置を使用して開発される。記載されたmRNA/PP-sNpは、 インビトロで培養細胞を効率的にトランスフェクトすることができた。
要約
インビトロ転写 メッセンジャーRNA(mRNA)ワクチンは、コロナウイルス病2019(COVID-19)パンデミックとの戦いにおいて大きな可能性を示しています。mRNAの脆弱な特性のために、効率的で安全な送達システムをmRNAワクチンに含める必要があります。自己組織化ペプチドポロキサミンナノ粒子(PP-sNp)遺伝子送達システムは、核酸の肺送達のために特別に設計されており、成功したmRNAトランスフェクションを媒介する有望な能力を示す。ここでは、PP-sNpを調製するための改良された方法が記載されており、PP-sNpがメトリジアルシフェラーゼ(MetLuc)mRNAをカプセル化し、培養細胞をトランスフェクトする方法について詳述する。MetLuc-mRNAは、線状DNAテンプレートからの インビトロ 転写プロセスによって得られる。PP-sNpは、マイクロ流体ミキサーを用いて合成ペプチド/ポロキサミンとmRNA溶液を混合することにより製造され、PP-sNpの自己組織化を可能にする。PP−sNpの電荷は、その後、ゼータ電位を測定することによって評価される。一方、PP−sNpナノ粒子の多分散性および流体力学的サイズは、動的光散乱を用いて測定される。mRNA/PP-sNpナノ粒子を培養細胞にトランスフェクトし、培養細胞の上清をルシフェラーゼ活性についてアッセイする。代表的な結果は、 インビトロ トランスフェクションに対するそれらの能力を実証する。このプロトコルは、次世代mRNAワクチン送達システムの開発に光を当てる可能性があります。
概要
ワクチン接種は、感染症によって引き起こされる罹患率および死亡率を低下させるための最も効率的な医学的介入の1つとして予告されている1。ワクチンの重要性は、2019年のコロナウイルス病(COVID-19)の発生以来実証されています。不活化または弱毒化生病原体を注入するという従来の概念とは対照的に、核酸ベースのワクチンなどの最先端のワクチンアプローチは、従来の全微生物ウイルスまたは細菌ベースのワクチンに関連する潜在的な安全性の問題を回避しながら、標的病原体の免疫刺激特性を維持することに集中します。DNAおよびRNA(すなわち、 インビトロ転写 メッセンジャーRNA、IVT mRNA)ベースのワクチンは、感染症および癌を含む様々な疾患に対して予防的〜治療的可能性を示す2、3。原則として、核酸ベースのワクチンの可能性は、その生産、有効性、および安全性に関連しています4。これらのワクチンは、費用対効果が高く、スケーラブルで、迅速な生産を可能にするために、無細胞で製造することができます。
単一の核酸ベースのワクチンは、複数の抗原をコードすることができ、接種回数を減らして多数のウイルス変異体または細菌の標的を可能にし、弾力性病原体に対する免疫応答を強化する5,6。さらに、核酸ベースのワクチンは、ウイルスまたは細菌感染の自然な侵入プロセスを模倣し、B細胞およびT細胞媒介性免疫応答の両方をもたらす可能性がある。一部のウイルスまたはDNAベースのワクチンとは異なり、IVT mRNAベースのワクチンは安全性の面で大きな利点を提供します。それらは、細胞質ゾル中で所望の抗原を迅速に発現することができ、宿主ゲノムに組み込まれていないため、挿入突然変異誘発に関する懸念を排除する7。IVT-mRNAは翻訳が成功すると自動的に分解されるため、そのタンパク質発現動態は容易に制御できます8,9。重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)のパンデミックに触媒され、世界中の企業/機関からの努力により、多くの種類のワクチンが市場にリリースされました。IVT mRNAベースのワクチン技術は大きな可能性を示し、その迅速な設計と数ヶ月以内にあらゆる標的抗原に適応する柔軟な能力により、初めて以前に期待されていた成功を実証しました。臨床応用におけるCOVID-19に対するIVT mRNAワクチンの成功は、IVT mRNAワクチンの研究開発の新時代を開いただけでなく、感染症の発生に対処するための効果的なワクチンの迅速な開発のための貴重な経験を蓄積しました10,11。
IVT mRNAワクチンの有望な可能性にもかかわらず、作用部位(すなわち、細胞質)へのIVT mRNAの効率的な細胞内送達は、特に気道を介して投与されるものに対して、引き続き大きなハードル12を提起している4。IVT mRNAは本質的に非常に短い半減期(〜7時間)13を持つ不安定な分子であり、IVT mRNAはユビキタスRNase14によって分解されやすい。自然免疫系のリンパ球は、in vivo適用の場合に認識されたIVT mRNAを飲み込む傾向がある。さらに、IVT mRNAの高い負電荷密度および大きな分子量(1 x104−1 x106Da)は、細胞膜15のアニオン性脂質二重層全体にわたるその効果的な透過を損なう。したがって、IVT mRNA分子の分解を阻害し、細胞の取り込みを促進するために、特定の生体機能材料を含む送達系が必要である16。
裸のIVT mRNAがインビボ調査に直接利用されたいくつかの例外的なケースを除いて、IVT mRNAを治療的作用部位に運ぶために様々な送達系が使用される17,18。以前の研究は、送達系の助けなしに細胞質ゾルにおいて検出されるIVT mRNAがごくわずかであることが明らかにされている19。RNA送達を改善するために、プロタミン縮合から脂質封入まで、この分野での継続的な努力により、数多くの戦略が開発されています20。脂質ナノ粒子(LNP)は、臨床使用のために承認されたすべてのmRNA COVID-19ワクチンがLNPベースの送達システムを採用しているという事実によって証明されるように、mRNA送達ビヒクルの中で最も臨床的に進歩している21。しかしながら、LNPは、製剤が呼吸経路22を介して送達される場合、効果的なmRNAトランスフェクションを媒介することができず、粘膜免疫応答を誘導すること、または嚢胞性線維症またはα1-アンチトリプシン欠乏症などの肺関連疾患に対処する際のこれらの製剤の適用を著しく制限する。したがって、気道関連細胞におけるIVT mRNAの効率的な送達およびトランスフェクションを容易にする新規送達システムの開発は、この満たされていない必要性を解決するために必要とされる。
ペプチドポロキサミン自己組織化ナノ粒子(PP−sNp)送達系が、マウス23の気道における核酸の効率的なトランスフェクションを媒介し得ることが確認されている。PP-sNpは、多機能モジュラー設計アプローチを採用しており、異なる機能モジュールをナノ粒子に統合して迅速なスクリーニングと最適化を行うことができます23。PP−sNp内の合成ペプチドおよび電気的に中性な両親媒性ブロックコポリマー(ポロキサミン)は、IVT mRNAと自発的に相互作用して、コンパクトな構造および平滑な表面を有する均一に分布したナノ粒子を生成することができる23。PP-sNpは、マウス23の培養細胞および気道におけるIVT mRNA分子の遺伝子導入効果を向上させることができる。本研究は、メトリジア・ルシフェラーゼ(MetLuc−mRNA)をコードするIVT mRNAを含むPP−sNpを生成するためのプロトコールを記載する(図1)。千鳥ヘリンボーン混合設計を採用したマイクロ流体混合装置 を介した 制御された迅速な混合は、このプロトコルで利用されています。この手順は実行が簡単で、より均一なサイズのPP-sNpを生成できます。マイクロ流体ミキサーを使用したPP-sNp生産の一般的な目標は、mRNA複合体形成のためのPP-sNpを十分に制御された方法で作成し、 インビトロでの効率的で再現性のある細胞トランスフェクションを可能にすることです。本プロトコールは、MetLuc−mRNAを含むPP−sNpの調製、組み立て、および特性評価を記載する。
プロトコル
1. 化学修飾mRNAの インビトロ 転写
注:RNaseは実験室の溶液、器具の表面、髪、皮膚、ほこりなどの環境に遍在しているため、ヌクレアーゼフリーのチューブ、試薬、ガラス製品、ピペットチップなどを使用する必要があります。使用前にベンチの表面とピペットを徹底的に清掃し、RNase汚染を避けるために手袋を着用してください。
- DNAテンプレートの線形化を行います。
- T7ポリメラーゼプロモーター、5'非翻訳領域(UTR)、3'UTR、およびポリ(A)テールに挟まれたMetridia luciferase(MetLuc)のオープンリーディングフレーム(ORF)を合成し、細菌で発現されるPUC57ベクターにクローニングします( 材料表を参照)。
注:DNAテンプレートのコード配列は、 補足ファイル1に提供されています。 - 細菌を培養し、細菌を溶解し、対応するカラムによりプラスミドDNAを精製する( 材料表のプラスミドDNA抽出キットを参照のこと)。
- 2 μL の BamHI、2 μL の KpnI ( 材料表参照)、および 2 μg のプラスミド DNA を含む 50 μL の反応を 37 °C で 1 時間行い、DNA テンプレートの線形化を達成します。
- T7ポリメラーゼプロモーター、5'非翻訳領域(UTR)、3'UTR、およびポリ(A)テールに挟まれたMetridia luciferase(MetLuc)のオープンリーディングフレーム(ORF)を合成し、細菌で発現されるPUC57ベクターにクローニングします( 材料表を参照)。
- インビトロ転写を行い、キャップなし-IVT mRNAを生成します。
- T7転写キットとプソイドウリジン( 材料表参照)を用いて、10 μL (0.8-1 μg) の直鎖状化 DNA テンプレート、1.5 μL (150 mM) の ATP、擬似 UTP、GTP、および CTP の 2 μL、10 x 転写バッファー 2 μL、1 μL の T7 酵素、および 1 μL のヌクレアーゼフリー水 (NF-water) を使用して、1 μL の反応で mRNA 合成を行います。上記の成分を十分に混合し、37°Cで3時間インキュベートする。
- テンプレート DNA を削除します。
- 転写処理後にDNase(RNase非含有)を1 μL(1 U)加え、37°Cで15分間インキュベートする。
- 塩化リチウム沈殿を用いてキャップなし-IVT mRNA精製を行う。
- 10 mM の作業濃度で塩化リチウム( 材料表を参照)を使用して、キャップされていない IVT mRNA を精製します。50 μL の 10 mM 塩化リチウムを 20 μL のキャップなし IVT mRNA 溶液に加えます。
- 全量を十分に混合し、−20°Cで1時間冷やす。キャップなし IVT mRNA を 12,000 x g で 12 分間収集すると、各 20 μL 反応から 80 ~ 120 μg のキャップなし IVT mRNA が日常的に生成されます。
- IVT mRNAキャッピングを行う。
- キャップ1キャッピングシステムを使用してIVT mRNAキャッピングを実行します( 材料表を参照)。簡単に説明すると、65°Cで10分間加熱することによって50 μgの非キャップIVT mRNAの二次構造を除去し、次いで、2.5 μLのs-アデノシルメチオニン(SAM)(20 mM)および4 μLの2'-O-メチルトランスフェラーゼ(100 U)を用いてm7Gキャップ構造を修飾することによって調製されたキャップ1と、37°Cで30〜60分間100μLの反応で切断されたキャップ1と連結する。
- 250 μL の 10 mM 塩化リチウムを使用して 100 μL のキャップ付き IVT mRNA を精製し、50 μL の NF 水で希釈します。
- キャップ付きIVT mRNAの純度と分子サイズを決定します。
- キャップ付きIVT mRNAの濃度を紫外可視分光光度計で測定します。RNAマーカー( 材料表参照)を用いて、18%ホルムアルデヒドを含む1%ホルムアルデヒド変性アガロースゲル(電圧は120V)中のキャップ付きIVT mRNAの分子サイズを分析します。キャップなし IVT mRNA およびキャップ付き IVT mRNA が -80 °C で保存されていることを確認します。
注:IVT mRNAは、A 260/A280比が1.8-2.1、A260/A230比が2.0またはわずかに高い純度で良好であると考えられた。
- キャップ付きIVT mRNAの濃度を紫外可視分光光度計で測定します。RNAマーカー( 材料表参照)を用いて、18%ホルムアルデヒドを含む1%ホルムアルデヒド変性アガロースゲル(電圧は120V)中のキャップ付きIVT mRNAの分子サイズを分析します。キャップなし IVT mRNA およびキャップ付き IVT mRNA が -80 °C で保存されていることを確認します。
2. IVT mRNA/PP-sNp の生成
- T704( 材料表参照)をNF水に可溶化することによりポロキサミン704(T704)原液を調製し、10mg/mL原液を得た。調製した溶液を4°Cで保存する。
注:T704は、ポリ(プロピレンオキシド)(PPO)ブロックおよびポリ(エチレンオキシド)(PEO)ブロック24の4つの鎖に結合したエチレンジアミン中心基からなるX字型構造を含む。T704の分子量(Mw)は5500である。 - 合成ペプチド(sPep、 材料表参照)を可溶化することにより原液を調製し、sPepを可溶化することにより(配列:KETWWETWWTEWKKKRRRRRKKKACSE
RSMNFCG)をNF水中に投入し、4°Cで保存して2mg/mLの原液を得た。 - IVT mRNAを氷上で解凍し(ステップ1)、チューブを開く前に室温で300 x g で3秒間短時間遠心分離することにより、IVT mRNA溶液を調製する。IVT mRNA溶液をNF水で0.04 μg/μLに希釈します。
注:IVT mRNAを使用して、可能な限りバイオセーフティキャビネットで作業することをお勧めします。 - NF水でsPep溶液を0.555 μg/μLに、T704溶液を8 μg/μLに希釈して、T704とsPep混合溶液を調製します。さらに使用する前に、混合溶液を室温で15分間インキュベートする。
メモ: 必要な N/P 比に基づいて、必要な sPep 成分を計算します。N/P比は、IVT mRNA内の負に荷電したリン酸基(P)の総数に対するsPep内の窒素残基(N)の総数である。T704とIVT mRNAの間の重量/重量(w/w)比に基づいて、必要なT704を計算します。N/P比が5、w/w比が100であることが必要です。 - 以下の手順に従ってIVT mRNA/PP-sNp製剤を調製する。
- IVT mRNA溶液(ステップ3)を1mLシリンジに引き出し、シリンジ先端にエアギャップや気泡がないことを確認します。シリンジをカートリッジの片側の回転ブロックの隣にセットします。
- 1mLシリンジにT704とsPepミックス溶液を充填します(ステップ4)。シリンジ先端の気泡やエアギャップをすべて取り除き、シリンジをポンプのもう一方の入口に入れます( 材料表を参照)。
- ポンプの流量比は1:1、総流量は4~10mL/minに設定してください。
注:6mL/分の総流量は、ここで提示された研究において最適である。 - 10mLのRNaseフリー円錐管( 材料表参照)を置き、混合装置の流路の端部に混合IVT-mRNA/PP-sNp溶液を回収する。
- ポンプを実行してミキシングを開始し、パラメータが正しく入力されていることを確認します。ポンプが6秒間稼働し終わったら、円錐管からIVT-mRNA/PP-sNpサンプルを採取します。
注:PP-sNpは、マイクロ流体ミキサーを使用して生成しました(補足図1)。この装置は、定流量ポンプ、リンク装置、チップ、および固定装置を備える。混合プロセスでは、チップに接続された定流量ポンプが、予め設定された流量に従ってチップに液体を送達する。接続された定流量ポンプは、単一の出力チャネルでチップの複数の入力チャネルに接続することができます。チップを含むデバイスのコンポーネントは、市販のソースから入手し、合理的に組み立てられました( 材料表を参照)。IVT mRNA溶液およびT704-sPep混合溶液の流量および体積などのパラメータは、何らかの異なるセットアップが使用される場合、現在のプロトコルに表示されているものと異なる可能性があり、それに応じて最適化する必要があります。
3. IVT-mRNA/PP-sNpの流体力学的直径と多分散度の測定
- IVT mRNA/PP-sNp 溶液のアリコートを NF-水で希釈し (ステップ 2)、最終容量 1 mL を得ます。
- セミマイクロキュベット25を用いて流体力学的サイズおよび多分散度指数(PDI)を測定する。IVT mRNA/PP-sNp溶液をキュベットに加え、粒径計に入れます( 材料表を参照)。標準操作手順を設定し、[ 開始 ]をクリックしてデータ集録を開始します。
4. トランスフェクション用細胞の調製
- ヒト気管支上皮細胞(16HBE)および樹状細胞株(DC2.4)を、トランスフェクションの24時間前に3.5 x104 細胞/ウェルの密度で96ウェルプレートにプレートします。10%の熱不活化ウシ胎児血清と1%のペニシリン/ストレプトマイシンを添加した培養液で細胞を成長させる。
注:細胞は市販の供給源から入手した( 材料表を参照)。 - 細胞をインキュベーター(37°Cおよび5%CO2雰囲気)で24 時間インキュベートし、トランスフェクションの前に細胞が60%~80%コンフルエントであることを確認します。
5. 培養細胞のトランスフェクション
- 増殖培地を除去した後、播種した細胞を0.2mL/ウェル1x PBSで洗浄する。
- 播種した細胞培養物を含む各ウェルに無血清培養液を170 μL加える。
- 0.4 μg の MetLuc mRNA (ステップ 2 で調製) を含む IVT mRNA/PP-sNp 製剤を 30 μL/ウェルの量で滴下します。
- IVT mRNA/PP-sNp製剤と共に、加湿した5%CO2富化雰囲気中で37°Cで細胞を4時間インキュベートします。
- トランスフェクション培地を、10%の熱不活化ウシ胎児血清および1%(v/v)ペニシリン/ストレプトマイシンを添加した0.2mLの新鮮な培地と交換します。
注:ウシ胎児血清を不活性化のために56°Cで30分間加熱した。 - トランスフェクトした細胞を37°Cおよび5%CO2富化雰囲気中で24時間インキュベートし、各ウェルから検出される上清を回収する。
6. メトリジア・ルシフェラーゼ(MetLuc)アッセイを用いた細胞トランスフェクションの有効性の解析
- 以下のステップに従って、セレンテラジン基質(材料表を参照)を用いて、各ウェルからの上清 をMetLuc活性についてアッセイする。
- セレンテラジン基質に1x PBSを添加して新鮮なアッセイ溶液を調製する(セレンテラジンの濃度は15mMである)。
- 徹底的な混合のためにセレンテラジン溶液を10秒間ボルテックスする。
- 50 μLの上清(ステップ5で回収)を96ウェルプレートに加えます。
- マイクロプレートリーダー( 材料表を参照)を1,000 msの読み取り時間でセットアップしてから、30 μLのセレンテラジン溶液(15 mM)を手動または自動注射で各ウェルに添加します。
- 開始をクリックして、上清にセレンテラジン溶液を加えた直後に発光シグナルを測定します。
メモ:ルミネッセンス信号はマイクロプレートリーダーを使用して測定され、その活性は相対的な光単位で表されます。PBSトランスフェクトウェルから得られた値は、ブランクコントロールとして使用されます。
結果
組換えプラスミドを消化し、直鎖状DNA鋳型を作製した(図2A)。記載されたプロトコルを使用して、T7 in vitro 転写キットは、20 μL反応あたり最大80〜120μgのキャップなしMetLuc-mRNA、および100μL反応あたり50〜60μgのキャップ付きMetLuc-mRNAを製造することができる。電気泳動で分析した場合、高品質のインタクトなMetLuc-mRNAは、 図2Bに示すように、単一の明確なバンドを示すはずです。DNAテンプレートから反応に導入された汚染物質は、RNA分解およびより低い収率をもたらす可能性がある。
メトルーク-mRNA(メトラック-mRNA/PP-sNp)を含むPP-sNpは、マイクロ流体混合法を用いて調製した(図1)。 表1 に、例としてMetLuc-mRNA/PP-sNpの物理化学的特性評価に関するデータを示す。MetLuc-mRNA/PP-sNpの流体力学的半径は、約70-100nmの範囲であれば正しいと考えることができる。また、PP-sNpのPDIは一定でなければならず、好ましくは0.2未満でなければならないが、約0.3までのPDI値が受け入れられる。
PP-sNpにMetLuc-mRNAを正常に組み込んだ後、製剤を16HBE細胞および樹状細胞株(DC2.4)とインキュベートすることができ、MetLuc-mRNAのトランスフェクション効率は、トランスフェクション後24時間の細胞培養上清内のルシフェラーゼ活性によって示すことができる。 図3 は、MetLuc-mRNA/PP-sNpのトランスフェクションが成功した典型的な例です。16HBE細胞では、MetLuc-mRNA/PP-sNpをトランスフェクトした細胞は、市販の脂質ベースのトランスフェクションリージェント(LP)( 材料表参照)、裸のMetLuc-mRNA(ネガティブコントロール)、PBS(ブランクコントロール)、またはT704-sPep混合溶液(モックコントロール)でトランスフェクトしたものと比較して、ルシフェラーゼの発現が有意に高かったことが明確にわかります。MetLuc-mRNA/PP-sNpはまた、LPと比較してルシフェラーゼの発現が高かった。このデータは、PP-sNp送達系がMetLuc-mRNAを分解から保護し、外因性MetLuc-mRNAのトランスフェクション効率を促進するために重要であることを示唆している。したがって、PP-sNpなどの送達系は、一般にIVT mRNAトランスフェクション研究に不可欠である。
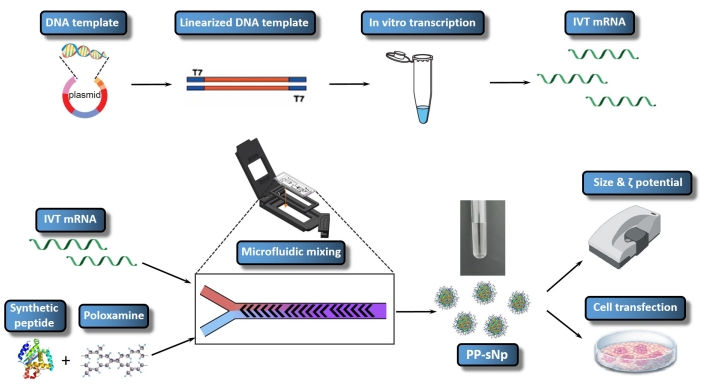
図1:IVT mRNA/PP-sNpのワークフロー全体の概略図。 DNA鋳型は、組換えプラスミド構築によってプラスミドに連結される。直鎖状DNAテンプレートは、制限酵素消化を用いて組み立てられる。 インビトロで 転写されたmRNA(IVT mRNA)が合成され、直鎖状DNA鋳型からキャップされる。T704-sPep溶液にはT704と合成ペプチド(sPep)が含まれ、IVT mRNA溶液にはMetLuc-mRNAが含まれています。IVT mRNAとT704-sPep混合溶液は、マイクロ流体ミキサーを使用して混合され、MetLuc-mRNA/PP-sNpを形成します。次に、ゼータサイザーを用いてMetLuc-mRNA/PP-sNpの特性評価を行い、粒子径と多分散度を決定します。16HBE細胞にMetLuc-mRNA/PP-sNpをトランスフェクトし、上清中のルシフェラーゼ活性を測定してトランスフェクション効率を評価します。 この図の拡大版を表示するには、ここをクリックしてください。

(A)DNAテンプレートには、T7ポリメラーゼプロモーター、5'非トラスレート領域(UTR)、MetLucのオープンリーディングフレーム(ORF)、3'UTR、およびポリ(A)テールが含まれています。(B)電気泳動検出。白矢印は組換えプラスミドを示す。黄色の矢印は PUC57 ベクトルを示します。赤い矢印は、MetLuc-mRNAのインビトロ転写のためのDNAテンプレートを示す。緑色の矢印は、キャップなしのMetLuc-mRNAを示す。青い矢印は、キャップされたMetLuc-mRNAを示す。この図の拡大版を表示するには、ここをクリックしてください。

図3:16HBEおよびDC2.4細胞におけるMetLuc-mRNA/PP-sNpのトランスフェクション効率。MetLuc-mRNAを、(A)16HBE細胞および(B)樹状細胞株(DC2.4)においてPP-sNpを用いてトランスフェクトした。PP-sNpでは、MetLuc-mRNAの最終濃度は0.02 μg/μL、sPepの終濃度は0.139 μg/μL、T704の終濃度は2 μg/μLであった。ルシフェラーゼ活性をトランスフェクション後24時間で測定した。PBS処理試料をブランクコントロールとして採用した。T704-sPep混合溶液をモックコントロールとして採用した。統計的差異は、スチューデントのt検定(ns p ≥ 0.05、* p < 0.05)で分析しました。この図の拡大版を表示するには、ここをクリックしてください。
| IVT mRNA | N/P (スペップ) | ワット/ワット (T704) | サイズ(nm) | ティッカー | ゼータ |
| 17.5 ng/μL | 5 | 100 | 85.12 ± 9.40 | 0.20 ± 0.07 | -13.07 ± 0.47 |
表1:MetLuc-mRNA/PP-sNpの物理化学的特性評価データ。
補足図1:現在の研究で使用された社内で準備されたマイクロ流体デバイスのセットアップ。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1:DNAテンプレートのコード配列。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで説明するプロトコルは、定義された特性を有するIVT mRNAワクチン製剤の費用対効果が高く迅速な製造を可能にするだけでなく、遺伝子治療などの特定の治療目的に応じてPP-sNp製剤をカスタマイズする可能性も提供する。IVT mRNA/PP-sNpの生成を確実に成功させるために、いくつかの重要なステップに特別な注意を払うことが推奨されます。mRNAを扱うときは、IVT mRNAが化学修飾で調製されていても、IVT mRNAはRNaseによる分解に関して非常に敏感であるため、RNaseを含まない条件をプロセス全体を通して維持する必要があることを常に覚えておいてください。一方、製剤を保存する際には、RNaseフリーの環境も確保する必要があります。IVT mRNA/PP-sNp を 2 ~ 8 °C で最大 1 週間保存することをお勧めします。提示された結果は、ヌクレアーゼフリーの水が高いトランスフェクション効率でPP-sNpを首尾よく形成するのに有効であることを実証する。他の緩衝液、例えばPBS、生理食塩水、OptiMEMなどは、必要に応じて使用され得る。培養細胞の生存率を確保するために、OptiMEM培地中でIVT mRNA/PP-sNpを用いてイン ビトロ トランスフェクションを行うことが推奨されます。製剤を調製するためにヌクレアーゼフリー水ではなく別の緩衝液を選択する場合は、低濃度(100ng/mL未満)のIVT mRNAを使用することが重要です。さもなければ、ナノ粒子は沈殿する傾向があり、それは今度は無効な製剤をレンダリングする。この現象の原因は、合成ペプチド内のカチオン性部分である。さらに、ナノ粒子の強い正電荷密度は細胞膜を不安定にし、したがって有意な細胞傷害性を誘導する可能性がある。しかし、PP-sNp内の正電荷は、効率的なIVT mRNA細胞取り込み、エンドソーム脱出、およびトランスフェクションの成功を媒介する上で不可欠であることが以前の研究で実証された23。そのため、PP-sNp内の正電荷を調整して、効率と毒性の微妙なバランスをとることが重要です。
提示されたプロトコルは、いくつかのパラメータ変更を伴う様々なPP−sNpベースの製剤に適用することができる。IVT mRNAベースのワクチンの送達のために、粒径および多分散度指数などの生物物理学的特性は、調製されたナノ粒子26のトランスフェクション効率および免疫原性にとって重要である。ナノメートルスケールのIVT mRNA/PP-sNpの粒径は、生理学的障壁を越えた効率的な移動を可能にし、それによって、その後のin vivoアプリケーションにとって重要である。60〜150nmのサイズ範囲のLNPが非ヒト霊長類において堅牢な免疫応答を生じることが報告されている26。一方、大型ナノ粒子(例えば、400〜1000nm)は、以前の調査によって明らかにされたように、気道粘液メッシュ孔の平均3次元メッシュ間隔が約60〜300nmの範囲であるため、肺送達に適用した場合、気道粘液障壁を克服することができなかった27,28。所望のサイズまたはトランスフェクション効率が達成されない場合、トラブルシューティングを開始するためのいくつかのヒントは、使用するポロキサミンまたは合成ペプチド成分の量を調整することを含む。以前の研究では、トランスフェクションに使用されるIVT mRNAの量、インキュベーション時間、培養細胞の種類と細胞密度などの追加のパラメータも、トランスフェクションの結果に大きく影響する可能性があることが明らかになりました23。さらに、PP-sNp内のターゲティング部分は、関連受容体を示す細胞への封入IVT mRNAの特異的送達を可能にするので、標的細胞が気道関連細胞ではなく他のタイプでトランスフェクトされる場合、代替ターゲティングリガンドとの置換が必要となり得る。全体として、プロトコルは、より詳細な洞察とさらなる検査によって改善される可能性があります。
オリジナルのIVT mRNA/PP-sNpが最初に直接手動混合によって調製されることを考慮すると、オペレータの能力は製剤の品質を制御する上で重要な役割を果たします。IVT mRNAをPP−sNpの成分と混合する過程における修飾は、ナノサイズの粒子ではなく大きな微粒子をもたらし得る。最もトリッキーなステップは、mRNAと合成ペプチドを混合することであり、これは制御された方法で行われなければならない。IVT mRNA/PP-sNp製剤の異なるバッチ間の再現性を向上させるために、マイクロ流体法29を使用する重要な特徴は、少量スクリーニング、高速、および再現性であるため、マイクロ流体ミキサーが採用された。この方法は良好な再現性を示し、異なるバッチ間で観察される粒径やトランスフェクション効率に有意な影響はなかった。これは、IVT mRNAベースのワクチンが臨床応用に適用されるために不可欠な基準です。特に、マイクロ流体ミキサーは、最大ユーザー数(製造業者が推奨)を超えてはならず、異なる組成の製剤間で変更する必要があります。
このプロトコルに記載されているIVT mRNA転写のプロトコルは、理論的には、目的の任意のレポータータンパク質/抗原を調製するために使用することができる。メトリジア・ルシフェラーゼ(MetLuc)は、独自の利点を有するため、この研究に特に適用された。MetLucの活性アッセイは、MetLucが集中的な生物発光シグナルを生成することができ、細胞培地に直接分泌される可能性があるため、高感度で簡単に実行できるため、細胞溶解の必要性を回避できます。培養細胞におけるMetLuc発現は、MetLuc-mRNA自体の機能性以外の多くのパラメータ(例えば、ウェルあたりの細胞数の変化およびピペッティングエラーなど)によって影響され得ることに注意することが重要です。
現在のプロトコルはIVT mRNAワクチンの送達のために確立されましたが、プラスミドDNA(pDNA)などの他のタイプの核酸に基づくワクチンまたは治療薬に対しても実施することができます。このプロセスは、様々な臨床適応症のための特定のPP−sNpを開発するための合成ペプチド、核酸、およびポロキサミン成分の変化に適応させることができる。実際、PP-sNp23によって送達される眠れる森の美女遺伝子改変ツールの利用によるCFTRノックアウトマウスの呼吸器上皮組織における外因性嚢胞性線維症膜貫通形質導入調節因子(CFTR)遺伝子のゲノム組み込みは首尾よく達成された。治療用途に関しては、IVT mRNA/PP-sNp製剤は、α1-アンチトリプシン欠乏症または嚢胞性線維症などの肺疾患の治癒のための特定の噴霧装置を用いたエアロゾルとして使用することができる30。しかし、エアロゾル化されたIVT mRNAは、ネブライザーによって生じる剪断力およびIVT mRNA30の脆弱な性質のために非効率的である可能性があるため、噴霧化のためのIVT mRNA/PP-sNp製剤を最適化し、カスタマイズする必要があることは注目に値します。さらに、このプロトコルは、T−接合混合装置およびさらには衝突ジェット混合ポンプ31、32などの異なるマイクロ流体混合装置を使用して、より大きな体積に拡張可能である可能性がある。
要約すると、ここで詳述するプロトコールは、PP-sNp送達系においてIVT mRNAを製剤化する再現可能な方法、ならびに培養細胞におけるその後の信頼できるトランスフェクションを導入する。記載された方法は、マイクロ流体ミキサーを使用してIVT mRNA/PP-sNpを製造するためのアクセス可能で簡単なアプローチを保証します。小さな粒径および低い多分散指数を有する調製製剤は、その後、安全かつ効率的にトランスフェクト培養細胞に適用することができる。このプロトコルにより、PP-sNpベースのデリバリーシステムは、前述のすべての欠点を回避しながら、新しいIVT mRNAベースのワクチンまたは治療薬を設計するために学術界に利用可能になります。PP-sNpの柔軟なプロファイルにより、PP-sNpを使用して、さまざまな疾患に対処するための明確な治療法を製造するための多数の将来のアプリケーションが達成されることが期待されています。
開示事項
著者らには開示するものは何もありません。
謝辞
この研究は、中国国家自然科学財団(NSFC、Grant No. 82041045 and 82173764)、中国科学技術部による病因形成および伝染病予防技術システムに関する研究(2021YFC2302500)、重慶才能:例外的な若い才能プロジェクト(CQYC202005027)、重慶自然科学財団(cstc2021jcyj-msxmX0136)の支援を受けた。著者らは、流体力学的直径(nm)と多分散度指数(PDI)を測定したXiaoyan Ding博士に感謝している。
資料
| Name | Company | Catalog Number | Comments |
| BamHI | Takara | 1010 | |
| cap 1 capping system | Jinan | M082 | |
| Dendritic cell-line | Sigma | SCC142 | |
| DNA sequence | Genescript | ||
| Human bronchial epithelial cells | Sigma | SCC150 | |
| KpnI | Takara | 1068 | |
| LP | Beyotime | C0533 | |
| Lithium chloride | APEXBio | B6083 | |
| Malvern Zetasizer Nano ZS90 | Malvern | NB007605 | |
| Microfluidic chip | ZHONGXINQIHENG | Standard PDMS chip | |
| Microplate readers | ThermoFisher | Varioskan lux | |
| NanoDrop One | ThermoFisher | ND-ONE-W (A30221) | |
| Nuclease-free water | ThermoFisher | AM9932 | |
| OptiMEM | Gibco | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Pseudouridine | APE×Bio | B7972 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| Quanti-Luc | InvivoGen | Rep-qlc2 | |
| RiboRuler High Range RNA Ladder | ThermoFisher | SM1821 | |
| RNase-free conical tube | Biosharp | BS-100-M | |
| RPMI Medium 1640 | ThermoFisher | C11875500BT | |
| Syringe pump | Chemyx | Fusion 101 | |
| T7 transcription Kit | Jinan | E131 |
参考文献
- Nature milestones in vaccines. Springer Nature Available from: https://www.nature.com/collections/hcajdiajij (2020)
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 40 (6), 840-854 (2022).
- Mulligan, M. J., et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586 (7830), 589-593 (2020).
- Tang, J., et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa. Nanomaterials. 12 (2), 226 (2022).
- Freyn, A. W., et al. A multi-targeting, nucleoside-modified mRNA influenza virus vaccine provides broad protection in mice. Molecular Therapy. 28 (7), 1569-1584 (2020).
- Wu, K., et al. Variant SARS-CoV-2 mRNA vaccines confer broad neutralization as primary or booster series in mice. Vaccine. 39 (51), 7394-7400 (2021).
- Chaudhary, N., Weissman, D., Whitehead, K. A. mRNA vaccines for infectious diseases: Principles, delivery and clinical translation. Nature Reviews Drug Discovery. 20, 817-838 (2021).
- Kormann, M. S. D., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature Biotechnology. 29 (2), 154-157 (2011).
- Tavernier, G., et al. mRNA as gene therapeutic: How to control protein expression. Journal of Controlled Release. 150 (3), 238-247 (2011).
- Walsh, E. E., et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. The New England Journal of Medicine. 383 (25), 2439-2450 (2020).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine. 384 (5), 403-416 (2021).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Sharova, L. V., et al. Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells. DNA Research. 16 (1), 45-58 (2009).
- Houseley, J., Tollervey, D. The many pathways of RNA degradation. Cell. 136 (4), 763-776 (2009).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13, 359-380 (2014).
- Hajj, K. A., Whitehead, K. A. Tools for translation: Non-viral materials for therapeutic mRNA delivery. Nature Reviews Materials. 2, 17056 (2017).
- Deering, R. P., Kommareddy, S., Ulmer, J. B., Brito, L. A., Geall, A. J. Nucleic acid vaccines: Prospects for non-viral delivery of mRNA vaccines. Expert Opinion on Drug Delivery. 11 (6), 885-899 (2014).
- Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C., Thakur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics. 12 (2), 102 (2020).
- Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nature Reviews Materials. 6 (12), 1078-1094 (2021).
- Sahin, U., et al. COVID-19 vaccine BNT162b1 elicits human antibody and T(H)1 T cell responses. Nature. 586 (7830), 594-599 (2020).
- Azzi, L., et al. Mucosal immune response in BNT162b2 COVID-19 vaccine recipients. EBioMedicine. 75, 103788 (2022).
- Guan, S., et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis. Nature Nanotechnology. 14 (3), 287-297 (2019).
- Pitard, B., et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Research. 32 (20), 159 (2004).
- Hiroi, T., Shibayama, M. Measurement of particle size distribution in turbid solutions by dynamic light scattering microscopy. Journal of Visualized Experiments. (119), e54885 (2017).
- Hassett, K. J., et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. Journal of Controlled Release. 335, 237-246 (2021).
- Suk, J. S., et al. The penetration of fresh undiluted sputum expectorated by cystic fibrosis patients by non-adhesive polymer nanoparticles. Biomaterials. 30 (13), 2591-2597 (2009).
- Kim, N., Duncan, G. A., Hanes, J., Suk, J. S. Barriers to inhaled gene therapy of obstructive lung diseases: A review. Journal of Controlled Release. 240, 465-488 (2016).
- Liu, Z., Fontana, F., Python, A., Hirvonen, J. T., Santos, H. A. Microfluidics for production of particles: Mechanism, methodology, and applications. Small. 16 (9), 1904673 (2020).
- Guan, S., Darmstädter, M., Xu, C., Rosenecker, J. In vitro investigations on optimizing and nebulization of IVT-mRNA formulations for potential pulmonary-based alpha-1-antitrypsin deficiency treatment. Pharmaceutics. 13 (8), 1281 (2021).
- Shepherd, S. J., Issadore, D., Mitchell, M. J. Microfluidic formulation of nanoparticles for biomedical applications. Biomaterials. 274, 120826 (2021).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved