Method Article
使用肽-泊洛沙明纳米颗粒在培养细胞中高效转染 体外 转录的mRNA
* 这些作者具有相同的贡献
摘要
使用微流体混合装置开发自组装肽 - 泊洛沙明纳米颗粒(PP-sNp)以封装和递送 体外 转录的信使RNA。所描述的mRNA / PP-sNp可以在 体外有效地转染培养的细胞。
摘要
体外 转录的信使RNA(mRNA)疫苗在抗击2019年冠状病毒病(COVID-19)大流行方面显示出巨大的潜力。由于mRNA的易碎特性,mRNA疫苗中必须包含高效和安全的递送系统。自组装的肽-泊洛沙明纳米颗粒(PP-sNp)基因递送系统专为核酸的肺递送而设计,在介导成功的mRNA转染方面显示出有希望的能力。这里描述了一种制备PP-sNp的改进方法,以详细说明PP-sNp如何包封荧光素酶(MetLuc)mRNA并成功转染培养的细胞。甲基强质-mRNA是通过从线性DNA模板 的体外 转录过程获得的。通过使用微流体混合器将合成肽/泊洛沙明与mRNA溶液混合来产生PP-sNp,从而允许PP-sNp的自组装。随后通过测量zeta电位来评估PP-sNp的电荷。同时,采用动态光散射法测量了PP-sNp纳米粒子的多分散度和流体动力学尺寸.将mRNA / PP-sNp纳米颗粒转染到培养的细胞中,并测定细胞培养物中的上清液的荧光素酶活性。代表性结果证明了其 体外 转染能力。该协议可能有助于开发下一代mRNA疫苗递送系统。
引言
疫苗接种被誉为降低传染病发病率和死亡率的最有效医疗干预措施之一1.自2019年新型冠状病毒肺炎(COVID-19)爆发以来,疫苗的重要性已经得到证明。与注射灭活或减毒活病原体的传统概念相反,最先进的疫苗方法,如基于核酸的疫苗,侧重于保持目标病原体的免疫刺激特性,同时避免与传统的全微生物病毒或基于细菌的疫苗相关的潜在安全问题。基于DNA和RNA(即 体外 转录的信使RNA,IVT mRNA)的疫苗都表现出对多种疾病的预防治疗潜力,包括传染病和癌症2,3。原则上,基于核酸的疫苗的潜力与其生产、功效和安全性有关4.这些疫苗可以以无细胞的方式生产,以实现具有成本效益,可扩展和快速的生产。
基于单一核酸的疫苗可以编码多种抗原,从而能够以较少的接种次数靶向多种病毒变异或细菌,并增强对弹性病原体的免疫反应5,6。此外,基于核酸的疫苗可以模仿病毒或细菌感染的自然侵袭过程,带来B细胞和T细胞介导的免疫反应。与一些基于病毒或基于DNA的疫苗不同,基于IVT mRNA的疫苗在安全性方面具有巨大的优势。它们可以在细胞质基质中快速表达所需的抗原,并且不会整合到宿主基因组中,从而消除了对插入诱变7的担忧。IVT-mRNA在成功翻译后自动降解,因此其蛋白表达动力学可以很容易地控制在8,9。在严重急性呼吸综合征冠状病毒2(SARS-CoV-2)大流行的催化下,全球公司/机构的努力使许多类型的疫苗能够投放市场。基于IVT mRNA的疫苗技术显示出巨大的潜力,并且由于其快速设计和灵活的能力,可以在几个月内适应任何靶抗原,因此首次显示出其先前预期的成功。IVT mRNA疫苗抗击COVID-19的成功应用,不仅开启了IVT mRNA疫苗研发的新时代,也为快速开发应对传染病暴发的有效疫苗积累了宝贵经验10,11.
尽管IVT mRNA疫苗具有广阔的潜力,但IVT mRNA在细胞内有效递送到作用部位(即细胞质)仍然是一个主要障碍12,特别是对于 通过 气道4施用的疫苗。IVT mRNA本质上是一种不稳定的分子,具有极短的半衰期(~7小时)13,这使得IVT mRNA极易被无处不在的RNase14降解。在 体内 应用的情况下,先天免疫系统的淋巴细胞倾向于吞噬公认的IVT mRNA。此外,IVT mRNA的高负电荷密度和大分子量(1 x 104-10 10 6 Da)损害了其在细胞膜阴离子脂质双层中的有效渗透15。因此,需要具有某些生物官能材料的递送系统来抑制IVT mRNA分子的降解并促进细胞摄取16。
除了一些直接用于体内研究的裸IVT mRNA的特殊情况 外 ,还使用各种递送系统将IVT mRNA携带到作用17,18的治疗位点。先前的研究表明,在没有递送系统19的帮助下,在细胞质基质中仅检测到少数IVT mRNA。通过在该领域的不断努力,已经开发了许多策略来改善RNA递送,从鱼精蛋白缩合到脂质包封20。脂质纳米颗粒(LNP)是mRNA递送载体中临床上最先进的,所有经批准的临床用途mRNA COVID-19疫苗都采用基于LNP的递送系统21这一事实证明了这一点。然而,当制剂 通过 呼吸途径22递送时,LNPs不能介导有效的mRNA转染,这显着限制了这些制剂在诱导粘膜免疫应答或解决肺部相关疾病(如囊性纤维化或α1-抗胰蛋白酶缺乏症)中的应用。因此,需要开发一种新型递送系统,以促进气道相关细胞中IVT mRNA的高效递送和转染,以解决这一未满足的需求。
已经证实,肽-泊洛沙明自组装纳米颗粒(PP-sNp)递送系统可以介导小鼠呼吸道中核酸23的有效转染。PP-sNp采用多功能模块化设计方法,可以将不同的功能模块集成到纳米颗粒中,以便快速筛选和优化23。PP-sNp内的合成肽和电中性两亲性嵌段共聚物(泊洛沙明)可以与IVT mRNA自发相互作用,生成结构紧凑、表面光滑均匀分布的纳米颗粒23。PP-sNp可以提高IVT mRNA分子在培养细胞和小鼠呼吸道中的基因转染作用23。本研究描述了一种用于生成含有IVT mRNA的PP-sNp的方案,该MRNA编码甲基化物胺酶(甲基葡糖-mRNA)(图1)。该方案 采用 交错式人字形混合设计的微流体混合装置进行受控和快速混合。该过程易于执行,并允许生成尺寸更均匀的PP-sNp。使用微流体混合器生产PP-sNp的总体目标是以良好控制的方式产生用于mRNA络合的PP-sNp,从而实现高效且可重复 的体外细胞转染。本实验方案描述了含有甲基葡聚糖-mRNA的PP-sNp的制备、组装和表征。
研究方案
1. 化学修饰的mRNA的 体外 转录
注意:需要使用无核酸酶的试管,试剂,玻璃器皿,移液器吸头等,因为RNA酶在环境中无处不在,例如实验室溶液,仪器表面,头发,皮肤,灰尘等。使用前彻底清洁工作台表面和移液器,并戴上手套以避免RNase污染。
- 对 DNA 模板进行线性化。
- 合成雌蕊花素酶(MetLuc)的开放阅读框(ORF),两侧是T7聚合酶启动子,5'未翻译区域(UTR),3'UTR和聚(A)尾部,并将其克隆到PUC57载体中,该载体在细菌中表达(参见 材料表)。
注意:DNA模板的编码序列在 补充文件1中提供。 - 培养细菌,裂解细菌,并通过相应的色谱柱纯化质粒DNA(参见 材料表中的质粒DNA提取试剂盒)。
- 在37°C下进行含有2μLBamHI,2μL KpnI(参见 材料表)和2μg质粒DNA的单次50μL反应,持续1小时,并实现DNA模板的线性化。
- 合成雌蕊花素酶(MetLuc)的开放阅读框(ORF),两侧是T7聚合酶启动子,5'未翻译区域(UTR),3'UTR和聚(A)尾部,并将其克隆到PUC57载体中,该载体在细菌中表达(参见 材料表)。
- 进行 体外 转录以生成无上限的IVT mRNA。
- 使用T7转录试剂盒和伪尿苷(参见 材料表)通过单个20μL反应进行mRNA合成:10μL(0.8-1μg)线性化DNA模板,1.5μL(150mM)ATP,假UTP,GTP和CTP,2μL10x转录缓冲液,1μLT7酶和1μL无核酸酶水(NF水)。充分混合上述组分,并在37°C下孵育3小时。
- 去除模板脱除基因。
- 转录过程后加入1μL(1U)DN酶(无RNase),并在37°C下孵育15分钟。
- 使用氯化锂沉淀进行无上限IVT mRNA纯化。
- 使用工作浓度为10mM的氯化锂(参见 材料表)纯化无上限的IVT mRNA。将50μL10 mM氯化锂加入20μL无上限IVT mRNA溶液中。
- 彻底混合整个体积,并在−20°C下冷却1小时。以12,000× g收集无上限的IVT mRNA12分钟,其通常从每个20μL反应中产生80-120μg无上限IVT mRNA。
- 进行静脉注射液酸封端。
- 使用瓶盖 1 封盖系统进行 IVT mRNA 封端(参见 材料表)。简而言之,通过在65°C下加热10分钟除去50μg无上限IVT mRNA的二级结构,然后将无上限IVT mRNA的5'末端与cap 1连接,其通过使用2.5μLs-腺苷甲硫氨酸(SAM)(20mM)和4μL 2'-O-甲基转移酶(100 U)在37°C下在100μL反应中30-60分钟来制备m7G帽结构。
- 使用250μL10mM氯化锂纯化100μL封顶IVT mRNA,并在50μLNF水中稀释。
- 确定封顶IVT mRNA的纯度和分子大小。
- 使用紫外可见分光光度计测量封顶 IVT mRNA 的浓度。使用RNA标记(参见 材料表),分析含有18%甲醛的1%甲醛变性琼脂糖凝胶中封顶IVT mRNA的分子大小(电压为120 V)。确保将无上限的IVT mRNA和封顶的IVT mRNA储存在-80°C。
注:IVT mRNA被认为具有良好的纯度,A260/A280 比率为1.8-2.1,A260/A230 比率为2.0或略高。
- 使用紫外可见分光光度计测量封顶 IVT mRNA 的浓度。使用RNA标记(参见 材料表),分析含有18%甲醛的1%甲醛变性琼脂糖凝胶中封顶IVT mRNA的分子大小(电压为120 V)。确保将无上限的IVT mRNA和封顶的IVT mRNA储存在-80°C。
2. 静脉输卵管癌的生成
- 通过将T704(参见 材料表)溶解在NF-水中来制备泊洛沙明704(T704)储备溶液,以获得10mg / mL储备溶液。将制备的溶液储存在4°C。
注意:T704包含由乙二胺中心基团制成的X形结构,该中心基团与四条聚环氧丙烷(PPO)嵌段和聚环氧乙烷(PEO)嵌段24链键合。T704的分子量(Mw)为5500。 - 通过增溶sPep来制备合成肽(sPep,参见 材料表)储备溶液(序列:KETWWETWWWW)
RSMNFCG)在NF水中获得2毫克/毫升储备溶液并储存在4°C。 - 通过在冰上解冻IVT mRNA(步骤1)并在室温下以300× g 离心短短3秒来制备IVT mRNA溶液,然后打开管。用NF水将IVT mRNA溶液稀释至0.04微克/微升。
注意:建议尽可能使用IVT mRNA在生物安全柜中工作。 - 通过将sPep溶液稀释至0.555μg/ μL并将T704溶液稀释至8μg/ μL来制备T704和sPep混合溶液。在进一步使用之前,将混合溶液在室温下孵育15分钟。
注:根据所需的净资产比率计算所需的 sPep 分量。N/P 比是 sPep 内氮残留物 (N) 的总数与 IVT mRNA 内带负电荷的磷酸基团 (P) 的总数之比。根据 T704 和 IVT mRNA 之间的重量/重量 (w/w) 比率计算所需的 T704。必须将 N/P 比设置为 5,w/w 比率为 100。 - 按照以下步骤制备IVT甲基核糖核酸/白蛋白-叔丁酸制剂。
- 将IVT mRNA溶液(步骤3)吸入1 mL注射器中,确保注射器尖端中没有气隙或气泡。将注射器装入注射器的一侧,靠近旋转块。
- 用T704和sPep混合溶液填充1 mL注射器(步骤4)。去除注射器尖端的任何气泡或气隙,并将注射器放入泵的另一个入口(参见 材料表)。
- 将泵的流量比设置为 1:1,总流速为 4-10 mL/min。
注意:在这里介绍的研究中,6 mL /min的总流速是最佳的。 - 放置10 mL无RNase锥形管(参见 材料表)以在混合装置流路的末端收集混合的IVT-mRNA / PP-sNp溶液。
- 运行泵以开始混合,确保参数输入正确。泵运行完6秒后,从锥形管中收集IVT-mRNA / PP-sNp样品。
注:PP-sNp是使用微流体混合器生成的(补充图1)。该装置包括恒流泵、连杆装置、芯片和固定装置。在混合过程中,连接到芯片的恒流泵根据预设的流速将液体输送到芯片。连接的恒流泵可以通过单个输出通道连接到芯片的多个输入通道。该器件的组件(包括芯片)是从商业来源获得并合理组装的(参见 材料表)。如果使用一些不同的设置,则IVT mRNA溶液和T704-sPep混合溶液的流速和体积等参数可能与当前方案中显示的参数不同,并且必须相应地进行优化。
3. IVT-mRNA/PP-sNp的流体动力学直径和多分散性的测量
- 用NF-水稀释等分试样的IVT mRNA / PP-sNp溶液(步骤2),以获得1mL的最终体积。
- 使用半微量比色皿测量流体动力学尺寸和多分散指数(PDI)25。将IVT mRNA / PP-sNp溶液加入比色皿中,并将其放入粒度计中(参见 材料表)。设置标准操作程序,然后单击" 开始 "开始数据采集。
4. 用于转染的细胞的制备
- 在转染前24小时,在96孔板中以3.5×10 4 个细胞/孔的密度将人支气管上皮细胞(16HBE)和树突状细胞系(DC2.4)板。在补充有10%热灭活胎牛血清和1%青霉素/链霉素的培养基中生长细胞。
注:电池是从商业来源获得的(见 材料表)。 - 将细胞在培养箱(37°C和5%CO2 气氛)中孵育24小时,以确保细胞在转染前为60%-80%汇合。
5. 培养细胞的转染
- 除去生长培养基后,用0.2 mL /孔1x PBS洗涤接种的细胞。
- 向含有接种细胞培养物的每个孔中加入170μL无血清培养基。
- 加入含有0.4微克甲基葡聚糖mRNA(在步骤2中制备)的IVT mRNA / PP-sNp制剂,量为30μL /孔。
- 将细胞与IVT mRNA / PP-sNp制剂在37°C下在加湿的5%CO2富集气氛中孵育4小时。
- 用0.2 mL新鲜培养基替换转染培养基,其中补充有10%热灭活胎牛血清和1%(v / v)青霉素/链霉素。
注意:将胎牛血清在56°C下加热30分钟以进行灭活。 - 将转染的细胞在37°C和5%富含CO2的气氛中孵育24小时,并收集要从每个孔中检测的上清液。
6. 使用甲基苄氨酰荧光素酶(MetLuc)测定法分析细胞转染功效
- 按照以下步骤,使用腔肠嗪底物(参见 材料表)从每个孔中测定MetLuc活性的上清液。
- 通过在腔肠嗪底物中加入1x PBS(腔肠嗪的浓度为15mM)来制备新鲜的测定溶液。
- 涡旋腔肠嗪溶液10秒,使其充分混合。
- 将50μL上清液(在步骤5中收集)加入96孔板中。
- 在手动或通过自动进样向每个孔中加入30μL腔肠拉嗪溶液(15mM)之前,将酶标仪(参见 材料表)设置为1,000ms读数时间。
- 单击 "开始" 以在将腔肠嗪溶液加入上清液后立即测量发光信号。
注意:发光信号是使用酶标仪测量的,其活性以相对光单位表示。从PBS转染孔中获得的值将用作空白对照。
结果
重组质粒被消化以产生线性化的DNA模板(图2A)。使用所述方案,T7 体外 转录试剂盒每20μL反应可产生高达80-120μg的无上限甲基氯化钾-mRNA,每100μL反应可产生50-60μg封顶的甲基氯化物-mRNA。当用电泳分析时,具有高质量的完整MetLuc-mRNA应显示单个清晰的条带,如图 2B所示。从DNA模板引入反应中的污染物可能导致RNA降解和产量降低。
使用微流体混合方法制备含有甲基葡糖核酸(甲基氯化物-mRNA / PP-sNp)的PP-sNp(图1)。 表1 显示了以甲基葡糖核酸/PP-sNp的物理化学表征数据为例。如果甲基葡聚糖-mRNA/PP-sNp的流体动力学半径范围约为70-100 nm,则可以认为它是正确的。此外,PP-sNp的PDI必须是恒定的,最好低于0.2,但PDI值高达约0.3是可以接受的。
在PP-sNp中成功掺入甲基卢克-mRNA后,该制剂可以与16HBE细胞和树突状细胞系(DC2.4)一起孵育,并且MetLuc-mRNA的转染效率可以通过转染后24小时细胞培养物中荧光素酶的活性来指示。 图3 是成功转染甲基葡聚糖核酸/PP-sNp的典型例子。可以清楚地看到,与使用市售脂质转染摄政(LP)(参见 材料表)、裸MetLuc-mRNA(阴性对照)、PBS(空白对照)或T704-sPep混合溶液(模拟对照)转染的细胞相比,用MetLuc-mRNA/PP-sNp转染的细胞显示出显着更高的荧光素酶表达。与LP相比,荧光素酶的表达也更高。数据表明,PP-sNp递送系统对于保护甲基强酸-mRNA免受降解和提高外源甲基葡聚糖-mRNA的转染效率非常重要。因此,PP-sNp等递送系统通常对于IVT mRNA转染研究至关重要。
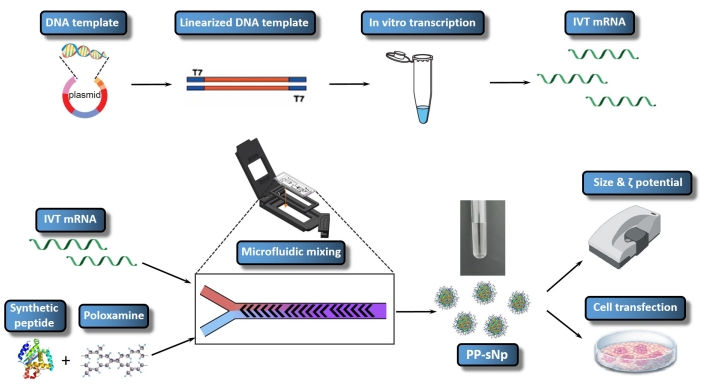
图 1:IVT 酶原酸/白血酸单纯化酶链的整个工作流程示意图。 DNA模板通过重组质粒构建与质粒连接。线性化的DNA模板使用限制性内切酶酶切组装。 体外 转录的mRNA(IVT mRNA)从线性化的DNA模板合成和封顶。T704-sPep 溶液含有 T704 和合成肽 (sPep),而 IVT mRNA 溶液含有甲基氯化物- mRNA。使用微流体混合器混合IVT mRNA和T704-sPep混合溶液,形成甲基氯化物-mRNA / PP-sNp。接下来,使用增氮剂对甲基氯化物-mRNA / PP-sNp进行表征以确定粒径和多分散性。用甲基葡聚糖-mRNA/PP-sNp转染16HBE细胞,并测量上清液中的荧光素酶活性以评估转染效率。 请点击此处查看此图的大图。

图 2:(A) DNA 模板包含一个 T7 聚合酶启动子、一个 5'未特拉射区域 (UTR)、一个 3'UTR 的开放阅读框 (ORF)、一个 3'UTR 和多 (A) 尾部。(B)电泳检测。白色箭头表示重组质粒。黄色箭头表示 PUC57 矢量。红色箭头表示用于甲基卢克-mRNA体外转录的DNA模板。绿色箭头表示无上限的甲基葡聚糖核酸-mRNA。蓝色箭头表示有上限的甲基葡糖-mRNA。请点击此处查看此图的大图。

图 3:甲基氯化钾/聚丙烯酸在 16HBE 和 DC2.4 细胞中的转染效率。 在(A)16HBE细胞和(B)树突状细胞系(DC2.4)中使用PP-sNp转染甲基葡聚糖mRNA。PP-sNp中甲基葡聚糖-mRNA终浓度为0.02 μg/μL,sPep终浓度为0.139 μg/μL,T704终浓度为2 μg/μL。转染后24小时测量荧光素酶活性。PBS处理的样品被采用为空白对照。采用T704-sPep混合溶液作为模拟对照。使用学生t检验(nsp ≥0.05,* p <0.05)分析统计差异。 请点击此处查看此图的大图。
| 断续器 | 不适用(sPep) | 不带 (T704) | 尺寸(纳米) | 断续器 | 截塔 |
| 17.5 纳克/微升 | 5 | 100 | 85.12 ± 9.40 | 0.20 ± 0.07 | -13.07 ± 0.47 |
表1:甲基葡聚糖-mRNA/PP-sNp的物理化学表征数据。
补充图1:当前研究中使用的内部制备的微流体装置的设置。请按此下载此档案。
补充文件1:DNA模板的编码序列。请按此下载此档案。
讨论
这里描述的方案不仅允许具有确定性质的IVT mRNA疫苗制剂的具有成本效益和快速生产,而且还提供了根据特定治疗目的(例如基因治疗)定制PP-sNp制剂的可能性。为了确保IVT mRNA/PP-sNp的成功生成,建议特别注意一些关键步骤。在使用mRNA时,请始终记住,应在整个过程中保持无RNase的条件,因为IVT mRNA对RNase的降解非常敏感,即使IVT mRNA是用化学修饰制备的。同时,在储存配方时,还必须确保无RNase的环境。建议在2-8°C下储存IVT mRNA / PP-sNp长达1周。结果表明,无核酸酶水可有效形成PP-sNp,转染效率高。如果需要,可以使用其他缓冲液,例如PBS,盐水,OptiMEM等。建议在OptiMEM培养基中使用IVT mRNA / PP-sNp进行 体外 转染,以确保培养细胞的活力。如果选择另一种缓冲液而不是无核酸酶的水来制备制剂,重要的是使用低浓度(低于100ng / mL)的IVT mRNA;否则,纳米颗粒往往会沉淀,这反过来又会使配方无效。这种现象的原因是合成肽内的阳离子部分。此外,纳米颗粒的强正电荷密度可能会破坏细胞膜的稳定性,从而诱导显着的细胞毒性。然而,在之前的研究中已经证明,PP-sNp内的正电荷对于介导有效的IVT mRNA细胞摄取,内体逃逸和成功转染23是必不可少的。因此,重要的是调整PP-sNp内的正电荷,以在效率和毒性方面取得微妙的平衡。
所提出的方案可以应用于各种基于PP-sNp的配方,但需要一些参数变化。对于基于IVT mRNA的疫苗的递送,生物物理特性(例如粒度和多分散性指数)对于制备的纳米颗粒26的转染效率和免疫原性至关重要。纳米级IVT mRNA /PP-sNp的粒径允许跨生理屏障的有效转移,因此对随后的 体内 应用非常重要。据报道,大小范围为60-150nm的LNP在非人灵长类动物26中产生强大的免疫反应。另一方面,当应用于肺部输送时,大尺寸纳米颗粒(例如,400-1000nm)无法克服气道粘液屏障,因为如先前的研究所揭示的那样,气道粘液网孔的平均三维网孔间距范围约为60-300纳米27,28。如果未达到所需的大小或转染效率,则开始故障排除的一些技巧包括调整泊洛沙明或合成肽组分的使用量。先前的研究表明,其他参数,例如用于转染的IVT mRNA量,孵育时间以及培养细胞的类型和细胞密度,也可能显着影响转染结果23。此外,由于PP-sNp内的靶向部分允许将封装的IVT mRNA特异性递送到显示相关受体的细胞中,因此如果靶细胞被其他类型的而不是气道相关细胞转染,则可能需要用替代靶向配体代替。总体而言,该协议仍可以通过更详细的见解和进一步检查来改进。
考虑到原始的IVT mRNA / PP-sNp最初是通过直接手动混合制备的,操作人员的能力在控制配方质量方面起着重要作用。在IVT mRNA与PP-sNp组分混合的过程中的修饰可能导致大的微粒而不是纳米级的颗粒。最棘手的步骤是混合mRNA和合成肽,这必须以受控的方式完成。为了提高IVT mRNA/PP-sNp制剂不同批次之间的重现性,采用微流控混合器,因为低体积筛选、快速和重现性是使用微流控方法29的重要特征。该方法具有良好的重现性,对粒径和不同批次间的转染效率均无显著影响。这是基于IVT mRNA的疫苗应用于临床应用的基本标准。特别是,微流体混合器不应超过最大用户数(制造商推荐),并且必须在具有不同组合物的配方之间进行更改。
该方案中描述的IVT mRNA转录方案理论上可用于制备任何感兴趣的报告蛋白/抗原。甲基化物色胺酶(MetLuc)专门用于这项研究,因为它具有独特的优势。MetLuc的活性测定易于以高灵敏度进行,因为MetLuc可以产生强烈的生物发光信号,并且可以直接分泌到细胞培养基中,因此避免了细胞裂解的需要。重要的是要注意,除了MetLuc-mRNA本身的功能外,培养细胞中的MetLuc表达可能受到许多参数(例如,每孔细胞数的变化和移液错误等)的影响。
虽然目前的方案是为IVT mRNA疫苗的递送而建立的,但它也可以用于基于其他类型的核酸的疫苗或治疗方法,如质粒DNA(pDNA)。该过程可以适应合成肽,核酸和泊洛沙明组分的变化,以开发用于各种临床适应症的特定PP-sNp。事实上,利用PP-sNp23提供的睡美人基因修饰工具,成功地实现了CFTR敲除小鼠呼吸上皮组织中外源性囊性纤维化跨膜转导调节因子(CFTR)基因的基因组整合。关于治疗应用,IVT mRNA / PP-sNp制剂可用作气溶胶,使用特定的雾化装置治愈肺部疾病,如α1-抗胰蛋白酶缺乏症或囊性纤维化30。然而,值得注意的是,用于雾化的IVT mRNA / PP-sNp制剂应进行优化和定制,因为雾化雾化IVT mRNA由于雾化器产生的剪切力和IVT mRNA30的脆弱性而可能效率低下。此外,该协议可以使用不同的微流体混合设备扩展到更大的体积,例如T型结混合设备甚至冲击射流混合泵31,32。
总之,这里详细介绍的方案介绍了一种在PP-sNp递送系统中配制IVT mRNA的可重复方法,以及随后在培养细胞中进行可靠的转染。所描述的方法保证了使用微流体混合器生产IVT mRNA / PP-sNp的可访问且简单的方法。制备的小粒径和低多分散指数的制剂随后可以应用于安全有效地转染培养的细胞。该协议将使基于PP-sNp的递送系统可供学术界用于设计基于IVT mRNA的新型疫苗或治疗方法,同时避免所有提到的缺点。凭借PP-sNp的灵活特性,PP-sNp有望实现许多未来的应用,以生产解决各种疾病的独特疗法。
披露声明
作者没有什么可透露的。
致谢
本研究由国家自然科学基金项目(国家自然科学基金委,批准号82041045和82173764)、国家科技部发病防疫技术体系研究重大专项(2021YFC2302500)、重庆市人才:优秀青年人才项目(CQYC202005027)和重庆市自然科学基金项目(cstc2021jcyj-msxmX0136)资助。作者感谢丁晓燕博士测量的流体动力直径(nm)和多分散指数(PDI)。
材料
| Name | Company | Catalog Number | Comments |
| BamHI | Takara | 1010 | |
| cap 1 capping system | Jinan | M082 | |
| Dendritic cell-line | Sigma | SCC142 | |
| DNA sequence | Genescript | ||
| Human bronchial epithelial cells | Sigma | SCC150 | |
| KpnI | Takara | 1068 | |
| LP | Beyotime | C0533 | |
| Lithium chloride | APEXBio | B6083 | |
| Malvern Zetasizer Nano ZS90 | Malvern | NB007605 | |
| Microfluidic chip | ZHONGXINQIHENG | Standard PDMS chip | |
| Microplate readers | ThermoFisher | Varioskan lux | |
| NanoDrop One | ThermoFisher | ND-ONE-W (A30221) | |
| Nuclease-free water | ThermoFisher | AM9932 | |
| OptiMEM | Gibco | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Pseudouridine | APE×Bio | B7972 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| Quanti-Luc | InvivoGen | Rep-qlc2 | |
| RiboRuler High Range RNA Ladder | ThermoFisher | SM1821 | |
| RNase-free conical tube | Biosharp | BS-100-M | |
| RPMI Medium 1640 | ThermoFisher | C11875500BT | |
| Syringe pump | Chemyx | Fusion 101 | |
| T7 transcription Kit | Jinan | E131 |
参考文献
- Nature milestones in vaccines. Springer Nature Available from: https://www.nature.com/collections/hcajdiajij (2020)
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 40 (6), 840-854 (2022).
- Mulligan, M. J., et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586 (7830), 589-593 (2020).
- Tang, J., et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa. Nanomaterials. 12 (2), 226 (2022).
- Freyn, A. W., et al. A multi-targeting, nucleoside-modified mRNA influenza virus vaccine provides broad protection in mice. Molecular Therapy. 28 (7), 1569-1584 (2020).
- Wu, K., et al. Variant SARS-CoV-2 mRNA vaccines confer broad neutralization as primary or booster series in mice. Vaccine. 39 (51), 7394-7400 (2021).
- Chaudhary, N., Weissman, D., Whitehead, K. A. mRNA vaccines for infectious diseases: Principles, delivery and clinical translation. Nature Reviews Drug Discovery. 20, 817-838 (2021).
- Kormann, M. S. D., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature Biotechnology. 29 (2), 154-157 (2011).
- Tavernier, G., et al. mRNA as gene therapeutic: How to control protein expression. Journal of Controlled Release. 150 (3), 238-247 (2011).
- Walsh, E. E., et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. The New England Journal of Medicine. 383 (25), 2439-2450 (2020).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine. 384 (5), 403-416 (2021).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Sharova, L. V., et al. Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells. DNA Research. 16 (1), 45-58 (2009).
- Houseley, J., Tollervey, D. The many pathways of RNA degradation. Cell. 136 (4), 763-776 (2009).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13, 359-380 (2014).
- Hajj, K. A., Whitehead, K. A. Tools for translation: Non-viral materials for therapeutic mRNA delivery. Nature Reviews Materials. 2, 17056 (2017).
- Deering, R. P., Kommareddy, S., Ulmer, J. B., Brito, L. A., Geall, A. J. Nucleic acid vaccines: Prospects for non-viral delivery of mRNA vaccines. Expert Opinion on Drug Delivery. 11 (6), 885-899 (2014).
- Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C., Thakur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics. 12 (2), 102 (2020).
- Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nature Reviews Materials. 6 (12), 1078-1094 (2021).
- Sahin, U., et al. COVID-19 vaccine BNT162b1 elicits human antibody and T(H)1 T cell responses. Nature. 586 (7830), 594-599 (2020).
- Azzi, L., et al. Mucosal immune response in BNT162b2 COVID-19 vaccine recipients. EBioMedicine. 75, 103788 (2022).
- Guan, S., et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis. Nature Nanotechnology. 14 (3), 287-297 (2019).
- Pitard, B., et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Research. 32 (20), 159 (2004).
- Hiroi, T., Shibayama, M. Measurement of particle size distribution in turbid solutions by dynamic light scattering microscopy. Journal of Visualized Experiments. (119), e54885 (2017).
- Hassett, K. J., et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. Journal of Controlled Release. 335, 237-246 (2021).
- Suk, J. S., et al. The penetration of fresh undiluted sputum expectorated by cystic fibrosis patients by non-adhesive polymer nanoparticles. Biomaterials. 30 (13), 2591-2597 (2009).
- Kim, N., Duncan, G. A., Hanes, J., Suk, J. S. Barriers to inhaled gene therapy of obstructive lung diseases: A review. Journal of Controlled Release. 240, 465-488 (2016).
- Liu, Z., Fontana, F., Python, A., Hirvonen, J. T., Santos, H. A. Microfluidics for production of particles: Mechanism, methodology, and applications. Small. 16 (9), 1904673 (2020).
- Guan, S., Darmstädter, M., Xu, C., Rosenecker, J. In vitro investigations on optimizing and nebulization of IVT-mRNA formulations for potential pulmonary-based alpha-1-antitrypsin deficiency treatment. Pharmaceutics. 13 (8), 1281 (2021).
- Shepherd, S. J., Issadore, D., Mitchell, M. J. Microfluidic formulation of nanoparticles for biomedical applications. Biomaterials. 274, 120826 (2021).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。