Method Article
Transfección eficiente del ARNm transcrito in vitro en células cultivadas utilizando nanopartículas de péptido-poloxamina
* Estos autores han contribuido por igual
En este artículo
Resumen
Se desarrolla una nanopartícula de péptido-poloxamina autoensamblada (PP-sNp) utilizando un dispositivo de mezcla microfluídica para encapsular y entregar ARN mensajero transcrito in vitro . El ARNm/PP-sNp descrito podría transfectar eficientemente células cultivadas in vitro.
Resumen
Las vacunas de ARN mensajero transcritas in vitro (ARNm) han mostrado un enorme potencial en la lucha contra la pandemia de la enfermedad por coronavirus 2019 (COVID-19). Los sistemas de administración eficientes y seguros deben incluirse en las vacunas de ARNm debido a las frágiles propiedades del ARNm. Un sistema de administración de genes de nanopartículas de péptido-poloxamina autoensamblado (PP-sNp) está diseñado específicamente para la administración pulmonar de ácidos nucleicos y muestra capacidades prometedoras para mediar la transfección exitosa de ARNm. Aquí, se describe un método mejorado para preparar PP-sNp para explicar cómo el PP-sNp encapsula el ARNm de Metridia luciferase (MetLuc) y transfecta con éxito las células cultivadas. El ARNm de MetLuc se obtiene mediante un proceso de transcripción in vitro a partir de una plantilla de ADN lineal. Un PP-sNp se produce mezclando péptido sintético / poloxamina con solución de ARNm utilizando un mezclador microfluídico, lo que permite el autoensamblaje de PP-sNp. La carga de PP-sNp se evalúa posteriormente midiendo el potencial zeta. Mientras tanto, la polidispersidad y el tamaño hidrodinámico de las nanopartículas de PP-sNp se miden utilizando dispersión dinámica de luz. Las nanopartículas de ARNm/PP-sNp se transfieren en células cultivadas, y los sobrenadantes del cultivo celular se analizan para determinar la actividad de la luciferasa. Los resultados representativos demuestran su capacidad de transfección in vitro. Este protocolo puede arrojar luz sobre el desarrollo de sistemas de administración de vacunas de ARNm de próxima generación.
Introducción
La vacunación ha sido anunciada como una de las intervenciones médicas más eficientes para reducir la morbilidad y mortalidad causadas por enfermedades infecciosas1. La importancia de las vacunas se ha demostrado desde el brote de la enfermedad por coronavirus 2019 (COVID-19). A diferencia del concepto tradicional de inyectar patógenos inactivados o vivos atenuados, los enfoques de vacunas de última generación, como las vacunas basadas en ácidos nucleicos, se concentran en preservar las propiedades inmunoestimulantes de los patógenos objetivo al tiempo que evitan los posibles problemas de seguridad asociados con el virus microbiano completo convencional o en las vacunas basadas en bacterias. Tanto las vacunas basadas en ADN como en ARN (es decir, ARN mensajero transcrito in vitro, ARNm IVT) exhiben potencial profiláctico a terapéutico contra una variedad de enfermedades, incluidas las enfermedades infecciosas y los cánceres 2,3. En principio, el potencial de las vacunas basadas en ácidos nucleicos se relaciona con su producción, eficacia y seguridad4. Estas vacunas se pueden fabricar de manera libre de células para permitir una producción rentable, escalable y rápida.
Una sola vacuna basada en ácidos nucleicos puede codificar múltiples antígenos, permitiendo el objetivo de numerosas variantes virales o bacterias con un número reducido de inoculaciones y fortaleciendo la respuesta inmune contra patógenos resilientes 5,6. Además, las vacunas basadas en ácidos nucleicos podrían imitar el proceso de invasión natural de la infección bacteriana o de virus, trayendo respuestas inmunes mediadas por células B y células T. A diferencia de algunas vacunas basadas en virus o en ADN, las vacunas basadas en ARNm IVT ofrecen una gran ventaja en términos de seguridad. Pueden expresar rápidamente el antígeno deseado en el citosol y no están integrados en el genoma del huésped, evitando las preocupaciones sobre la mutagénesis de inserción7. El ARNm de IVT se degrada automáticamente después de una traducción exitosa, por lo que su cinética de expresión de proteínas se puede controlar fácilmente 8,9. Catalizados por la pandemia del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2), los esfuerzos de empresas / instituciones de todo el mundo han permitido el lanzamiento al mercado de muchos tipos de vacunas. La tecnología de vacunas basada en ARNm IVT muestra un gran potencial y, por primera vez, ha demostrado su éxito previamente anticipado, debido a su diseño rápido y capacidad flexible para adaptarse a cualquier antígeno objetivo en varios meses. El éxito de las vacunas de ARNm IVT contra COVID-19 en aplicaciones clínicas no solo abrió una nueva era de investigación y desarrollo de vacunas de ARNm IVT, sino que también acumuló una valiosa experiencia para el rápido desarrollo de vacunas efectivas para tratar brotes de enfermedades infecciosas10,11.
A pesar del potencial prometedor de las vacunas de ARNm IVT, la entrega intracelular eficiente de ARNm IVT al sitio de acción (es decir, citoplasma) continúa planteando un obstáculo importante12, especialmente para aquellos administrados a través de las vías respiratorias4. El ARNm de IVT es inherentemente una molécula inestable con una vida media extremadamente corta (~ 7 h)13, lo que hace que el ARNm de IVT sea altamente propenso a la degradación por la ubicua RNasa14. Los linfocitos del sistema inmune innato tienden a engullir el ARNm IVT reconocido en casos de aplicación in vivo . Además, la alta densidad de carga negativa y el gran peso molecular (1 x 104-1 x 106 Da) del ARNm de IVT perjudican su permeación efectiva a través de la bicapa lipídica aniónica de las membranas celulares15. Por lo tanto, se requiere un sistema de administración con ciertos materiales biofuncionales para inhibir la degradación de las moléculas de ARNm de IVT y facilitar la absorción celular16.
Aparte de algunos casos excepcionales en los que el ARNm de la IVT desnuda fue utilizado directamente para investigaciones in vivo, se utilizan varios sistemas de administración para llevar el ARNm de la IVT al sitio terapéutico de acción17,18. Estudios previos han revelado que sólo unos pocos ARNm IVT son detectados en el citosol sin la ayuda de un sistema de administración19. Se han desarrollado numerosas estrategias para mejorar la entrega de ARN con esfuerzos continuos en el campo, que van desde la condensación de protamina hasta la encapsulación lipídica20. Las nanopartículas lipídicas (PNL) son las más avanzadas clínicamente entre los vehículos de administración de ARNm, como lo demuestra el hecho de que todas las vacunas COVID-19 de ARNm aprobadas para uso clínico emplean sistemas de administración basados en PNL21. Sin embargo, los LNP no pueden mediar la transfección efectiva del ARNm cuando las formulaciones se administran por vía respiratoria22, lo que limita notablemente la aplicación de estas formulaciones para inducir respuestas inmunes de la mucosa o abordar enfermedades relacionadas con la pulmón, como la fibrosis quística o la deficiencia de α1-antitripsina. Por lo tanto, se requiere desarrollar un nuevo sistema de administración para facilitar la administración y transfección eficientes del ARNm de IVT en células relacionadas con las vías respiratorias para resolver esta necesidad no satisfecha.
Se ha confirmado que el sistema de entrega de nanopartículas autoensambladas de péptido-poloxamina (PP-sNp) puede mediar la transfección eficiente de ácidos nucleicos en el tracto respiratorio de ratones23. El PP-sNp adopta un enfoque de diseño modular multifuncional, que puede integrar diferentes módulos funcionales en las nanopartículas para una rápida detección y optimización23. Los péptidos sintéticos y los copolímeros de bloque anfifílico eléctricamente neutros (poloxamina) dentro del PP-sNp pueden interactuar espontáneamente con el ARNm de IVT para generar nanopartículas distribuidas uniformemente con una estructura compacta y superficie lisa23. PP-sNp puede mejorar el efecto de transfección génica de las moléculas de ARNm de IVT en células cultivadas y el tracto respiratorio de ratones23. El presente estudio describe un protocolo para generar PP-sNp que contiene ARNm IVT que codifica Metridia luciferasa (MetLuc-mRNA) (Figura 1). En este protocolo se utiliza una mezcla controlada y rápida a través de un dispositivo de mezcla microfluídica, que emplea el diseño de mezcla escalonada en espiga. El procedimiento es fácil de ejecutar y permite la generación de PP-sNp con tamaños más uniformes. El objetivo general de la producción de PP-sNp utilizando el mezclador microfluídico es crear PP-sNp para la complejación de ARNm de una manera bien controlada, permitiendo así una transfección celular eficiente y reproducible in vitro. El presente protocolo describe la preparación, ensamblaje y caracterización de PP-sNp que contiene MetLuc-mRNA.
Protocolo
1. Transcripción in vitro de ARNm modificado químicamente
NOTA: Se requiere el uso de tubos libres de nucleasa, reactivos, cristalería, puntas de pipeta, etc., porque las RNasas son omnipresentes en el medio ambiente, como soluciones de laboratorio, superficies de instrumentos, cabello, piel, polvo, etc. Limpie bien las superficies y pipetas del banco antes de usarlas, y use guantes para evitar la contaminación por RNasa.
- Realizar la linealización de la plantilla de ADN.
- Sintetizar el marco de lectura abierto (ORF) de Metridia luciferasa (MetLuc) flanqueado por un promotor de polimerasa T7, colas de región no traducida (UTR) 5' (UTR), 3'UTR y poli (A) y clonarlo en el vector PUC57, que se expresa en bacterias (ver Tabla de materiales).
NOTA: La secuencia de codificación de la plantilla de ADN se proporciona en el Archivo complementario 1. - Cultive bacterias, lisar las bacterias y purificar el ADN plásmido por la columna correspondiente (consulte el kit de extracción de ADN plásmido en la Tabla de materiales).
- Realice una sola reacción de 50 μL que contenga 2 μL de BamHI, 2 μL de KpnI (consulte la Tabla de materiales) y 2 μg de ADN plásmido a 37 °C durante 1 h, y logre la linealización de la plantilla de ADN.
- Sintetizar el marco de lectura abierto (ORF) de Metridia luciferasa (MetLuc) flanqueado por un promotor de polimerasa T7, colas de región no traducida (UTR) 5' (UTR), 3'UTR y poli (A) y clonarlo en el vector PUC57, que se expresa en bacterias (ver Tabla de materiales).
- Realizar la transcripción in vitro para generar ARNm IVT sin tapa.
- Realizar la síntesis de ARNm mediante una sola reacción de 20 μL utilizando un kit de transcripción T7 y pseudouridina (ver Tabla de materiales): 10 μL (0.8-1 μg) de plantilla de ADN linealizado, 1.5 μL (150 mM) de ATP, pseudo-UTP, GTP y CTP, 2 μL de tampón de transcripción 10x, 1 μL de enzima T7 y 1 μL de agua libre de nucleasas (NF-agua). Mezclar bien los componentes mencionados anteriormente e incubar a 37 °C durante 3 h.
- Quite el ADN de la plantilla.
- Añadir 1 μL (1 U) de DNasa (libre de RNasa) después del proceso de transcripción e incubar a 37 °C durante 15 min.
- Realice la purificación de ARNm IVT sin tapa utilizando precipitación de cloruro de litio.
- Purificar el ARNm IVT sin tapa usando cloruro de litio (ver Tabla de materiales) con una concentración de trabajo de 10 mM. Añadir 50 μL de cloruro de litio de 10 mM a 20 μL de solución de ARNm IVT sin tapa.
- Mezclar bien todo el volumen y enfriar a -20 °C durante 1 h. Recoja el ARNm de IVT sin tapa durante 12 minutos a 12,000 x g, lo que produce rutinariamente 80-120 μg de ARNm de IVT sin tapa de cada reacción individual de 20 μL.
- Realizar el tapado de ARNm IVT.
- Realice el tapado de ARNm IVT utilizando el sistema de taponado cap 1 (consulte la Tabla de materiales). Brevemente, retire la estructura secundaria de 50 μg de ARNm IVT sin tapa calentando a 65 °C durante 10 min, luego vincule el extremo 5' del ARNm IVT sin tapa con la tapa 1, que se prepara modificando la estructura de la tapa m7G utilizando 2.5 μL de s-adenosilmetionina (SAM) (20 mM) y 4 μL de 2'-O-metiltransferasa (100 U) en una reacción de 100 μL a 37 °C durante 30-60 min.
- Purificar 100 μL del ARNm IVT tapado usando 250 μL de cloruro de litio 10 mM y diluir en 50 μL de agua NF.
- Determinar la pureza y el tamaño molecular del ARNm de IVT tapado.
- Mida la concentración de ARNm de IVT tapado con un espectrofotómetro UV-visible. Usando un marcador de ARN (consulte la Tabla de materiales), analice el tamaño molecular del ARNm de IVT tapado en un gel de agarosa desnaturalizante de formaldehído al 1% que contenga 18% de formaldehído (el voltaje es de 120 V). Asegúrese de que el ARNm de IVT sin tapa y el ARNm de IVT tapado se almacenen a -80 °C.
NOTA: Se consideró que el ARNm IVT tenía buena pureza en una relación A 260/A280 de 1.8-2.1 y una relación A260/A 230 de 2.0 o ligeramente superior.
- Mida la concentración de ARNm de IVT tapado con un espectrofotómetro UV-visible. Usando un marcador de ARN (consulte la Tabla de materiales), analice el tamaño molecular del ARNm de IVT tapado en un gel de agarosa desnaturalizante de formaldehído al 1% que contenga 18% de formaldehído (el voltaje es de 120 V). Asegúrese de que el ARNm de IVT sin tapa y el ARNm de IVT tapado se almacenen a -80 °C.
2. Generación de ARNm/PP-sNp de la TRI
- Preparar la solución madre de poloxamina 704 (T704) solubilizando la T704 (ver Tabla de materiales) en agua NF para obtener una solución madre de 10 mg/ml. Conservar la solución preparada a 4 °C.
NOTA: T704 contiene una estructura en forma de X hecha de un grupo central de etilendiamina unido a cuatro cadenas de bloques de poli(óxido de propileno) (PPO) y bloques de poli(óxido de etileno) (PEO)24. El peso molecular (Mw) de T704 es 5500. - Preparar la solución madre del péptido sintético (sPep, ver Tabla de materiales) solubilizando la sPep (secuencia: KETWWETWWTEWWWWKKKKRRRRRKKKKGACSE
RSMNFCG) en agua NF para obtener una solución madre de 2 mg/ml y almacenar a 4 °C. - Preparar la solución de ARNm IVT descongelando el ARNm IVT (paso 1) en hielo y centrifugando brevemente durante 3 s a 300 x g a temperatura ambiente antes de abrir el tubo. Diluir la solución de ARNm IVT a 0,04 μg/μL con agua NF.
NOTA: Se recomienda trabajar en un gabinete de bioseguridad siempre que sea posible con el ARNm de IVT. - Preparar la solución de mezcla de T704 y sPep diluyendo la solución de sPep a 0,555 μg/μL y la solución de T704 a 8 μg/μL con agua NF. Incubar la solución mezclada durante 15 minutos a temperatura ambiente antes de su uso posterior.
NOTA: Calcule el componente sPep requerido en función de la relación N/P deseada. La relación N/P es el número total de residuos de nitrógeno (N) dentro del sPep al número total de grupos fosfato (P) cargados negativamente dentro del ARNm IVT. Calcule el T704 requerido en función de la relación peso/peso (p/p) entre T704 y el ARNm de IVT. Es necesario que la relación N/P sea 5 y la relación p/p sea 100. - Prepare la formulación de ARNm/PP-sNp de IVT siguiendo los pasos a continuación.
- Extraiga la solución de ARNm IVT (paso 3) en una jeringa de 1 ml, asegurándose de que no haya espacios de aire ni burbujas en la punta de la jeringa. Cargue la jeringa en un lado del cartucho junto al bloque giratorio.
- Llene una jeringa de 1 ml con la solución de mezcla T704 y sPep (paso 4). Retire cualquier burbuja o espacio de aire en la punta de la jeringa y coloque la jeringa en la otra entrada de la bomba (consulte la Tabla de materiales).
- Ajuste la bomba con una relación de flujo de 1:1 y un caudal total de 4-10 mL/min.
NOTA: Un caudal total de 6 mL/min es óptimo en los estudios aquí presentados. - Coloque un tubo cónico libre de RNasa de 10 ml (consulte la Tabla de materiales) para recolectar la solución mixta IVT-mRNA/PP-sNp al final de la trayectoria de flujo del dispositivo mezclador.
- Haga funcionar la bomba para iniciar la mezcla, asegurándose de que los parámetros se ingresen correctamente. Después de que la bomba haya terminado de funcionar durante 6 s, recoja la muestra IVT-mRNA/PP-sNp del tubo cónico.
NOTA: El PP-sNp se generó utilizando un mezclador microfluídico (Figura complementaria 1). El dispositivo comprende una bomba de flujo constante, un dispositivo de enlace, un chip y un dispositivo fijo. En el proceso de mezcla, la bomba de flujo constante conectada al chip suministra líquido al chip de acuerdo con el caudal preestablecido. La bomba de flujo constante conectada se puede conectar a múltiples canales de entrada del chip con un solo canal de salida. Los componentes del dispositivo, incluido el chip, se obtuvieron de fuentes comerciales y se ensamblaron racionalmente (consulte la Tabla de materiales). Los parámetros, como el caudal y el volumen de la solución de ARNm IVT y la solución mixta T704-sPep, pueden diferir de los que se muestran en el protocolo actual si se utiliza una configuración diferente y deben optimizarse en consecuencia.
3. Medición del diámetro hidrodinámico y polidispersidad de IVT-mRNA/PP-sNp
- Diluir una alícuota de la solución IVT de ARNm/PP-sNp (paso 2) con agua NF para obtener un volumen final de 1 ml.
- Medir el tamaño hidrodinámico y el índice de polidispersidad (PDI) utilizando una semi-micro cubeta25. Agregue la solución IVT mRNA/PP-sNp en la cubeta y colóquela en el medidor de tamaño de partícula (consulte la Tabla de materiales). Configure un procedimiento operativo estándar y haga clic en Iniciar para comenzar la adquisición de datos.
4. Preparación de las células para la transfección
- Placas de células epiteliales bronquiales humanas (16HBE) y una línea celular dendrítica (DC2.4) en placas de 96 pocillos a una densidad de 3,5 x 104 células/pocillo 24 h antes de la transfección. Cultivar las células en un medio de cultivo suplementado con 10% de suero fetal bovino inactivado por calor y 1% de penicilina/estreptomicina.
NOTA: Las células se obtuvieron de una fuente comercial (ver Tabla de materiales). - Incubar las células en una incubadora (37 °C y 5% deCO2 atmósfera) durante 24 h para asegurarse de que las células son 60% -80% confluentes antes de la transfección.
5. Transfección de las células cultivadas
- Después de retirar el medio de crecimiento, lavar las células plateadas con 0,2 ml/pocillo 1x PBS.
- Añadir 170 μL de medio de cultivo sin suero a cada pocillo que contenga los cultivos celulares en placas.
- Añadir la formulación IVT mRNA/PP-sNp que contenga 0,4 μg de mRNA MetLuc (preparado en el paso 2) gota a gota con una cantidad de 30 μL/pocillo.
- Incubar las células con la formulación IVT mRNA/PP-sNp a 37 °C en una atmósfera humidificada enriquecida con CO2 al 5% durante 4 h.
- Reemplace el medio de transfección con 0,2 ml de medio de cultivo fresco suplementado con suero fetal bovino inactivado por calor al 10% y penicilina/estreptomicina al 1% (v/v).
NOTA: El suero fetal bovino se calentó a 56 °C durante 30 min para la inactivación. - Incubar las células transfectadas a 37 °C y en una atmósfera enriquecida conCO2 al 5% durante 24 h y recoger los sobrenadantes que se detectarán en cada pocillo.
6. Análisis de la eficacia de la transfección celular mediante el ensayo de Metridia luciferasa (MetLuc)
- Analizar el sobrenadante de cada pocillo para detectar la actividad de MetLuc utilizando sustrato de celenterazina (ver Tabla de materiales) siguiendo los pasos a continuación.
- Preparar una solución de ensayo fresca añadiendo 1x PBS al sustrato de celenterazina (la concentración de celenterazina es de 15 mM).
- Vortex la solución de celenterazina durante 10 s para mezclar bien.
- Añadir 50 μL de sobrenadante (recogido en el paso 5) a una placa de 96 pocillos.
- Configure el lector de microplacas (consulte la Tabla de materiales) con un tiempo de lectura de 1.000 ms antes de agregar 30 μL de solución de celenterazina (15 mM) a cada pocillo manualmente o mediante inyección automatizada.
- Haga clic en Inicio para medir la señal de luminiscencia inmediatamente después de agregar la solución de celenterazina al sobrenadante.
NOTA: La señal de luminiscencia se mide utilizando un lector de microplacas, y su actividad se expresa en unidades de luz relativa. Los valores obtenidos de los pozos transfectados por PBS se utilizarán como controles en blanco.
Resultados
El plásmido recombinante fue digerido para producir la plantilla de ADN linealizado (Figura 2A). Utilizando el protocolo descrito, el kit de transcripción in vitro T7 puede producir hasta 80-120 μg de ARNm MetLuc sin tapa por reacción de 20 μL y 50-60 μg de ARNm de MetLuc tapado por reacción de 100 μL. Cuando se analiza con electroforesis, el ARNm de MetLuc intacto con alta calidad debe mostrar una banda única y clara, como se muestra en la Figura 2B. Los contaminantes introducidos en la reacción de la plantilla de ADN podrían resultar en la degradación del ARN y un menor rendimiento.
Los PP-sNp que contienen el ARNm de MetLuc (MetLuc-mRNA/PP-sNp) se prepararon utilizando el método de mezcla microfluídica (Figura 1). La Tabla 1 muestra los datos sobre la caracterización fisicoquímica del MetLuc-mRNA/PP-sNp como ejemplos. El radio hidrodinámico del MetLuc-mRNA/PP-sNp podría considerarse correcto si oscila entre 70 y 100 nm. Además, el PDI del PP-sNp debe ser constante y preferiblemente estar por debajo de 0,2, pero se aceptan valores PDI de hasta aproximadamente 0,3.
Después de incorporar con éxito MetLuc-mRNA en el PP-sNp, la formulación puede incubarse con células 16HBE y una línea celular dendrítica (DC2.4), y la eficiencia de transfección de MetLuc-mRNA puede indicarse por la actividad luciferasa dentro del sobrenadante de cultivo celular 24 h después de la transfección. La figura 3 es un ejemplo típico de la transfección exitosa de MetLuc-mRNA/PP-sNp. Se puede ver claramente que las células transfectadas con MetLuc-mRNA/PP-sNp mostraron una expresión significativamente mayor de luciferasa en comparación con aquellas transfectadas con transfección regente (LP) a base de lípidos disponible comercialmente (ver Tabla de materiales), MetLuc-mRNA desnudo (control negativo), PBS (control en blanco) o solución mixta T704-sPep (control simulado) en células 16HBE. MetLuc-mRNA/PP-sNp también mostró una mayor expresión de luciferasa en comparación con LP. Los datos sugieren que el sistema de administración de PP-sNp es importante para proteger el ARNm de MetLuc contra la degradación y para promover la eficiencia de transfección del ARNm exógeno de MetLuc. Por lo tanto, los sistemas de administración como PP-sNp son generalmente esenciales para los estudios de transfección de ARNm IVT.
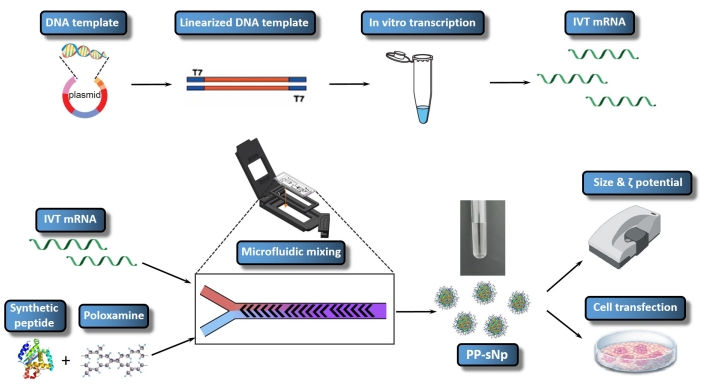
Figura 1: Representación esquemática de todo el flujo de trabajo de IVT mRNA/PP-sNp. La plantilla de ADN está vinculada al plásmido mediante la construcción de plásmidos recombinantes. La plantilla de ADN linealizado se ensambla utilizando la digestión de enzimas de restricción. El ARNm transcrito in vitro (ARNm IVT) se sintetiza y se tapa a partir de la plantilla de ADN lineal. La solución de T704-sPep contiene T704 y el péptido sintético (sPep), mientras que la solución de ARNm IVT contiene MetLuc-mRNA. Las soluciones mixtas de ARNm IVT y T704-sPep se mezclan utilizando un mezclador microfluídico, que forma MetLuc-mRNA/PP-sNp. A continuación, se realiza la caracterización de MetLuc-mRNA/PP-sNp para determinar el tamaño de partícula y la polidispersidad utilizando un Zetasizer. Las células 16HBE se transfectan con MetLuc-mRNA/PP-sNp, y la actividad luciferasa dentro del sobrenadante se mide para evaluar la eficiencia de la transfección. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: La producción de MetLuc-mRNA. (A) La plantilla de ADN contiene un promotor de polimerasa T7, una región 5'no trasvasada (UTR), un marco de lectura abierto (ORF) de MetLuc, un 3'UTR y colas poli (A). (B) Detección de electroforesis. La flecha blanca indica plásmido recombinante. La flecha amarilla indica el vector PUC57. La flecha roja indica la plantilla de ADN para la transcripción in vitro del ARNm de MetLuc. La flecha verde indica MetLuc-mRNA sin tapa. La flecha azul indica MetLuc-mRNA tapado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Eficiencia de transfección de MetLuc-mRNA/PP-sNp en células 16HBE y DC2.4. El ARNm de MetLuc se transfectó utilizando PP-sNp en (A) células 16HBE y (B) una línea celular dendrítica (DC2.4). La concentración final de MetLuc-mRNA fue de 0,02 μg/μL, la de sPep fue de 0,139 μg/μL y la de T704 fue de 2 μg/μL en PP-sNp. Se adoptó la transfección regente (LP) comercial basada en lípidos como control positivo. La actividad de la luciferasa se midió 24 h después de la transfección. La muestra tratada con PBS se adoptó como control en blanco. La solución mixta T704-sPep se adoptó como un control simulado. Las diferencias estadísticas fueron analizadas con una prueba t de Student (ns p ≥ 0,05, * p < 0,05). Haga clic aquí para ver una versión más grande de esta figura.
| ARNm de IVT | N/P (sPep) | con p/w (T704) | Tamaño (nm) | Pdi | Zeta |
| 17,5 ng/μL | 5 | 100 | 85,12 ± 9,40 | 0,20 ± 0,07 | -13,07 ± 0,47 |
Tabla 1: Datos de caracterización fisicoquímica del MetLuc-mRNA/PP-sNp.
Figura complementaria 1: La configuración del dispositivo microfluídico preparado internamente utilizado en el presente estudio. Haga clic aquí para descargar este archivo.
Archivo complementario 1: La secuencia codificante de la plantilla de ADN. Haga clic aquí para descargar este archivo.
Discusión
El protocolo descrito aquí no solo permite la producción rentable y rápida de formulaciones de vacunas de ARNm IVT con propiedades definidas, sino que también ofrece la posibilidad de personalizar la formulación de PP-sNp de acuerdo con fines terapéuticos específicos, como la terapia génica. Con el fin de garantizar la generación exitosa de ARNm / PP-sNp IVT, se sugiere prestar especial atención a algunos pasos críticos. Cuando trabaje con ARNm, recuerde siempre que las condiciones libres de RNasa deben mantenerse durante todo el proceso porque el ARNm IVT es muy sensible con respecto a la degradación por RNasa, incluso si el ARNm IVT se ha preparado con modificación química. Mientras tanto, también se debe garantizar un entorno libre de RNasa al almacenar las formulaciones. Se recomienda almacenar el ARNm/PP-sNp IVT a 2-8 °C durante un máximo de 1 semana. Los resultados presentados demuestran que el agua libre de nucleasas es eficaz para formar con éxito PP-sNp con alta eficiencia de transfección. Otros tampones, como PBS, solución salina, OptiMEM, etc., se pueden utilizar si se desea. Se recomienda realizar las transfecciones in vitro utilizando IVT mRNA/PP-sNp en un medio OptiMEM para asegurar la viabilidad de las células cultivadas. Si se elige otro tampón en lugar de agua libre de nucleasa para preparar la formulación, es importante utilizar ARNm IVT con una concentración baja (por debajo de 100 ng / ml); De lo contrario, las nanopartículas tienden a precipitarse, lo que, a su vez, hace que una formulación sea inválida. La causa de este fenómeno es la fracción catiónica dentro del péptido sintético. Además, la fuerte densidad de carga positiva de la nanopartícula puede desestabilizar la membrana celular, induciendo así una citotoxicidad significativa. Sin embargo, se demostró en el estudio anterior que la carga positiva dentro del PP-sNp es imperativa para mediar la captación celular eficiente del ARNm IVT, el escape endosómico y la transfección exitosa23. Como resultado, es importante ajustar la carga positiva dentro del PP-sNp para lograr un delicado equilibrio en términos de eficiencia y toxicidad.
El protocolo presentado se puede aplicar a varias formulaciones basadas en PP-sNp con algunos cambios de parámetros. Para la administración de vacunas basadas en ARNm IVT, las propiedades biofísicas como el tamaño de partícula y el índice de polidispersidad son críticas para la eficiencia de transfección y la inmunogenicidad de las nanopartículas preparadas26. El tamaño de partícula del ARNm/PP-sNp del IVT en la escala nanométrica permite una transferencia eficiente a través de barreras fisiológicas y, por lo tanto, es importante para las aplicaciones in vivo posteriores. Se ha reportado que las PNL en el rango de tamaño de 60-150 nm producen respuestas inmunes robustas en primates no humanos26. Por otro lado, las nanopartículas de gran tamaño (por ejemplo, 400-1000 nm) no pudieron superar la barrera mucosa de las vías respiratorias cuando se aplicaron para la administración pulmonar porque, como lo revelaron investigaciones anteriores, el espaciamiento promedio de la malla de malla de 3 dimensiones de los poros de la malla mucosa de las vías respiratorias varía de aproximadamente 60-300 nm27,28. Si no se logra el tamaño deseado o la eficiencia de transfección, algunos consejos para comenzar la solución de problemas comprenden ajustar la cantidad de poloxamina o componentes de péptidos sintéticos utilizados. El estudio anterior reveló que parámetros adicionales, como la cantidad de ARNm IVT utilizado para la transfección, el tiempo de incubación y los tipos y la densidad celular de las células cultivadas, también podrían influir significativamente en el resultado de la transfección23. Además, dado que la fracción objetivo dentro del PP-sNp permite la entrega específica del ARNm IVT encapsulado en células que muestran receptores relacionados, podría ser necesario reemplazar con ligandos dirigidos alternativos si las células diana se transectan con otros tipos en lugar de células relacionadas con las vías respiratorias. En general, el protocolo aún podría mejorarse con una visión más detallada y un examen más detallado.
Teniendo en cuenta que el ARNm/PP-sNp original de IVT se prepara inicialmente mediante mezcla manual directa, las habilidades del operador juegan un papel importante en el control de la calidad de la formulación. Las modificaciones en el proceso de mezcla del ARNm IVT con los componentes del PP-sNp pueden dar lugar a micropartículas grandes en lugar de partículas de tamaño nanométrico. El paso más complicado es mezclar el ARNm y el péptido sintético, que debe hacerse de manera controlada. Con el fin de mejorar la reproducibilidad entre diferentes lotes de formulación de ARNm/PP-sNp de IVT, se adoptó un mezclador microfluídico porque el cribado de bajo volumen, la velocidad rápida y la reproducibilidad son características importantes del uso del método microfluídico29. Este método mostró una buena reproducibilidad, sin impacto significativo en el tamaño de partícula ni en la eficiencia de transfección observada entre diferentes lotes. Este es un criterio esencial para que las vacunas basadas en ARNm IVT se apliquen en aplicaciones clínicas. En particular, el mezclador microfluídico no debe exceder el número máximo de usuarios (recomendado por el fabricante) y debe cambiarse entre formulaciones con diferentes composiciones.
El protocolo de transcripción del ARNm IVT descrito en este protocolo se puede utilizar teóricamente para preparar cualquier proteína/antígeno informador de interés. La Metridia luciferasa (MetLuc) se aplicó específicamente en este estudio porque tiene ventajas únicas. El ensayo de actividad de MetLuc es fácil de realizar con alta sensibilidad porque MetLuc puede producir una señal bioluminiscente intensiva y podría secretarse directamente en el medio celular, evitando así la necesidad de lisis celular. Es importante tener en cuenta que la expresión de MetLuc en las células cultivadas puede verse influenciada por muchos parámetros (por ejemplo, variando el número de células por pocillo y errores de pipeteo, etc.) distintos de la funcionalidad del propio ARNm de MetLuc.
Aunque el protocolo actual se estableció para la administración de la vacuna de ARNm IVT, también se puede implementar para vacunas o terapias que se basan en otros tipos de ácidos nucleicos, como el ADN plásmido (ADNp). Este proceso podría adaptarse a los cambios en los componentes de péptidos sintéticos, ácidos nucleicos y poloxamina para desarrollar PP-sNp particular para diversas indicaciones clínicas. De hecho, se logró con éxito la integración del genoma del gen regulador de transducción transmembrana de fibrosis quística exógena (CFTR) en el tejido epitelial respiratorio de ratones knockout CFTR con la utilización de una herramienta de modificación genética de la Bella Durmiente administrada por un PP-sNp23. En cuanto a las aplicaciones terapéuticas, las formulaciones IVT mRNA/PP-sNp podrían utilizarse como aerosol utilizando dispositivos de nebulización específicos para la curación de enfermedades pulmonares, como la deficiencia de α1-antitripsina o la fibrosis quística30. Sin embargo, vale la pena señalar que las formulaciones de ARNm / PP-sNp de IVT para la nebulización deben optimizarse y personalizarse, ya que el ARNm de IVT en aerosol podría ser ineficiente debido a la fuerza de cizallamiento creada por el nebulizador y la naturaleza frágil del ARNm de IVT30. Además, el protocolo es posiblemente escalable a volúmenes más grandes utilizando diferentes dispositivos de mezcla microfluídica, como dispositivos de mezcla de unión en T e incluso bombas mezcladoras de chorros de impacto31,32.
En resumen, el protocolo detallado aquí introduce un método reproducible para formular ARNm IVT en un sistema de administración de PP-sNp, así como la posterior transfección confiable en células cultivadas. El método descrito garantiza un enfoque accesible y fácil para producir ARNm / PP-sNp IVT utilizando un mezclador microfluídico. Las formulaciones preparadas con tamaños de partícula pequeños y bajo índice de polidispersidad se pueden aplicar posteriormente a células cultivadas transfectadas de manera segura y eficiente. Este protocolo permitirá que el sistema de administración basado en PP-sNp esté disponible para la comunidad académica para diseñar nuevas vacunas o terapias basadas en ARNm de IVT, evitando todos los inconvenientes mencionados. Con los perfiles flexibles de PP-sNp, se espera que se logren numerosas aplicaciones futuras con PP-sNp para producir terapias distintas para tratar diversas enfermedades.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (NSFC, Subvención No. 82041045 y 82173764), el principal proyecto de Estudio sobre el Sistema de Tecnología de Patogénesis y Prevención de Epidemias (2021YFC2302500) por el Ministerio de Ciencia y Tecnología de China, el Proyecto Chongqing Talents: Exceptional Young Talents (CQYC202005027) y la Fundación de Ciencias Naturales de Chongqing (cstc2021jcyj-msxmX0136). Los autores agradecen al Dr. Xiaoyan Ding por medir el diámetro hidrodinámico (nm) y el índice de polidispersidad (PDI).
Materiales
| Name | Company | Catalog Number | Comments |
| BamHI | Takara | 1010 | |
| cap 1 capping system | Jinan | M082 | |
| Dendritic cell-line | Sigma | SCC142 | |
| DNA sequence | Genescript | ||
| Human bronchial epithelial cells | Sigma | SCC150 | |
| KpnI | Takara | 1068 | |
| LP | Beyotime | C0533 | |
| Lithium chloride | APEXBio | B6083 | |
| Malvern Zetasizer Nano ZS90 | Malvern | NB007605 | |
| Microfluidic chip | ZHONGXINQIHENG | Standard PDMS chip | |
| Microplate readers | ThermoFisher | Varioskan lux | |
| NanoDrop One | ThermoFisher | ND-ONE-W (A30221) | |
| Nuclease-free water | ThermoFisher | AM9932 | |
| OptiMEM | Gibco | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Pseudouridine | APE×Bio | B7972 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| Quanti-Luc | InvivoGen | Rep-qlc2 | |
| RiboRuler High Range RNA Ladder | ThermoFisher | SM1821 | |
| RNase-free conical tube | Biosharp | BS-100-M | |
| RPMI Medium 1640 | ThermoFisher | C11875500BT | |
| Syringe pump | Chemyx | Fusion 101 | |
| T7 transcription Kit | Jinan | E131 |
Referencias
- Fehervari, Z., Minton, K., Duarte, J. H. Nature milestones in vaccines. Springer Nature. , Available from: https://www.nature.com/collections/hcajdiajij (2020).
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 40 (6), 840-854 (2022).
- Mulligan, M. J., et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586 (7830), 589-593 (2020).
- Tang, J., et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa. Nanomaterials. 12 (2), 226(2022).
- Freyn, A. W., et al. A multi-targeting, nucleoside-modified mRNA influenza virus vaccine provides broad protection in mice. Molecular Therapy. 28 (7), 1569-1584 (2020).
- Wu, K., et al. Variant SARS-CoV-2 mRNA vaccines confer broad neutralization as primary or booster series in mice. Vaccine. 39 (51), 7394-7400 (2021).
- Chaudhary, N., Weissman, D., Whitehead, K. A. mRNA vaccines for infectious diseases: Principles, delivery and clinical translation. Nature Reviews Drug Discovery. 20, 817-838 (2021).
- Kormann, M. S. D., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature Biotechnology. 29 (2), 154-157 (2011).
- Tavernier, G., et al. mRNA as gene therapeutic: How to control protein expression. Journal of Controlled Release. 150 (3), 238-247 (2011).
- Walsh, E. E., et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. The New England Journal of Medicine. 383 (25), 2439-2450 (2020).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine. 384 (5), 403-416 (2021).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Sharova, L. V., et al. Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells. DNA Research. 16 (1), 45-58 (2009).
- Houseley, J., Tollervey, D. The many pathways of RNA degradation. Cell. 136 (4), 763-776 (2009).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Sahin, U., Karikó, K., Türeci, Ö MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13, 359-380 (2014).
- Hajj, K. A., Whitehead, K. A. Tools for translation: Non-viral materials for therapeutic mRNA delivery. Nature Reviews Materials. 2, 17056(2017).
- Deering, R. P., Kommareddy, S., Ulmer, J. B., Brito, L. A., Geall, A. J. Nucleic acid vaccines: Prospects for non-viral delivery of mRNA vaccines. Expert Opinion on Drug Delivery. 11 (6), 885-899 (2014).
- Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C., Thakur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics. 12 (2), 102(2020).
- Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nature Reviews Materials. 6 (12), 1078-1094 (2021).
- Sahin, U., et al. COVID-19 vaccine BNT162b1 elicits human antibody and T(H)1 T cell responses. Nature. 586 (7830), 594-599 (2020).
- Azzi, L., et al. Mucosal immune response in BNT162b2 COVID-19 vaccine recipients. EBioMedicine. 75, 103788(2022).
- Guan, S., et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis. Nature Nanotechnology. 14 (3), 287-297 (2019).
- Pitard, B., et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Research. 32 (20), 159(2004).
- Hiroi, T., Shibayama, M. Measurement of particle size distribution in turbid solutions by dynamic light scattering microscopy. Journal of Visualized Experiments. (119), e54885(2017).
- Hassett, K. J., et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. Journal of Controlled Release. 335, 237-246 (2021).
- Suk, J. S., et al. The penetration of fresh undiluted sputum expectorated by cystic fibrosis patients by non-adhesive polymer nanoparticles. Biomaterials. 30 (13), 2591-2597 (2009).
- Kim, N., Duncan, G. A., Hanes, J., Suk, J. S. Barriers to inhaled gene therapy of obstructive lung diseases: A review. Journal of Controlled Release. 240, 465-488 (2016).
- Liu, Z., Fontana, F., Python, A., Hirvonen, J. T., Santos, H. A. Microfluidics for production of particles: Mechanism, methodology, and applications. Small. 16 (9), 1904673(2020).
- Guan, S., Darmstädter, M., Xu, C., Rosenecker, J. In vitro investigations on optimizing and nebulization of IVT-mRNA formulations for potential pulmonary-based alpha-1-antitrypsin deficiency treatment. Pharmaceutics. 13 (8), 1281(2021).
- Shepherd, S. J., Issadore, D., Mitchell, M. J. Microfluidic formulation of nanoparticles for biomedical applications. Biomaterials. 274, 120826(2021).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados