Method Article
Transfecção eficiente de mRNA transcrito in vitro em células cultivadas usando nanopartículas de peptídeo-poloxamina
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Uma nanopartícula de peptídeo-poloxamina auto-montada (PP-sNp) é desenvolvida usando um dispositivo de mistura microfluida para encapsular e fornecer RNA de mensageiro transcrito in vitro . O mRNA/PP-sNp descrito poderia transfetar eficientemente células cultivadas in vitro.
Resumo
As vacinas de RNA (mRNA) in vitro transcritas têm mostrado enorme potencial no combate à doença coronavírus 2019 (COVID-19). Sistemas de entrega eficientes e seguros devem ser incluídos nas vacinas mRNA devido às frágeis propriedades do mRNA. Um sistema de entrega de genes auto-montado peptídeo-poloxamina (PP-sNp) foi projetado especificamente para a entrega pulmonar de ácidos nucleicos e exibe capacidades promissoras na mediação da transfecção bem sucedida do mRNA. Aqui, um método aprimorado para preparar o PP-sNp é descrito para elaborar sobre como o PP-sNp encapsula o mRNA Metridia luciferase (MetLuc) e transfes com sucesso células cultivadas. MetLuc-mRNA é obtido por um processo de transcrição in vitro de um modelo de DNA linear. Um PP-sNp é produzido misturando peptídeo sintético/poloxamina com solução mRNA usando um misturador microfluido, permitindo a auto-montagem de PP-sNp. A carga de PP-sNp é posteriormente avaliada medindo o potencial zeta. Enquanto isso, a polidispersidade e o tamanho hidrodinâmico das nanopartículas PP-sNp são medidos usando dispersão dinâmica de luz. As nanopartículas mRNA/PP-sNp são transfectadas em células cultivadas, e os supernacantes da cultura celular são testados para a atividade da luciferase. Os resultados representativos demonstram sua capacidade de transfecção in vitro. Este protocolo pode lançar luz sobre o desenvolvimento de sistemas de entrega de vacinas mRNA de próxima geração.
Introdução
A vacinação tem sido anunciada como uma das intervenções médicas mais eficientes para a redução da morbidade e mortalidade causadas por doenças infecciosas1. A importância das vacinas vem sendo demonstrada desde o surto da doença coronavírus 2019 (COVID-19). Ao contrário do conceito tradicional de injetar patógenos inativados ou atenuados vivos, abordagens de vacinas de última geração, como vacinas à base de ácido nucleico, concentram-se na preservação das propriedades imuno-estimulantes dos patógenos alvo, evitando os potenciais problemas de segurança associados ao vírus microbiano convencional ou em vacinas baseadas em bactérias. Tanto o DNA quanto o RNA (ou seja, vacinas in vitro transcritas do mensageiro, IVT mRNA) exibem profilático ao potencial terapêutico contra uma variedade de doenças, incluindo doenças infecciosas e cânceres 2,3. Em princípio, o potencial das vacinas à base de ácido nucleico diz respeito à sua produção, eficácia e segurança4. Essas vacinas podem ser fabricadas de forma livre de células para permitir uma produção econômica, escalável e rápida.
Uma única vacina à base de ácido nucleico pode codificar vários antígenos, permitindo o alvo de inúmeras variantes virais ou bactérias com um número reduzido de inoculações e fortalecendo a resposta imune contra patógenos resistentes 5,6. Além disso, vacinas à base de ácido nucleico poderiam imitar o processo natural de invasão de vírus ou infecção bacteriana, trazendo respostas imunes mediadas por células B e T. Ao contrário de algumas vacinas baseadas em DNA, as vacinas baseadas em IC mRNA oferecem uma enorme vantagem em termos de segurança. Eles podem expressar rapidamente o antígeno desejado no citosol e não estão integrados ao genoma hospedeiro, evitando preocupações sobre mutagênese insercional7. O IVT-mRNA é automaticamente degradado após a tradução bem sucedida, de modo que sua cinética de expressão proteica pode ser facilmente controlada 8,9. Catalisados pela síndrome respiratória aguda grave coronavírus 2 (SARS-CoV-2), os esforços de empresas/instituições em todo o mundo permitiram a liberação para o mercado de muitos tipos de vacinas. A tecnologia de vacinas baseada em IG mRNA mostra grande potencial e, pela primeira vez, demonstrou seu sucesso anteriormente antecipado, devido ao seu rápido design e capacidade flexível de se adaptar a qualquer antígeno-alvo dentro de vários meses. O sucesso das vacinas IVT mRNA contra o COVID-19 em aplicações clínicas não só abriu uma nova era de pesquisa e desenvolvimento de vacinas IVT mRNA como também acumulou experiência valiosa para o rápido desenvolvimento de vacinas eficazes para lidar com surtos de doenças infecciosas10,11.
Apesar do potencial promissor das vacinas IVT mRNA, a eficiente entrega intracelular de IVT mRNA para o local de ação (ou seja, citoplasma) continua a representar um grande obstáculo12, especialmente para aqueles administrados via vias aéreas4. IVT mRNA é inerentemente uma molécula instável com uma meia-vida extremamente curta (~7 h)13, o que torna o IVT mRNA altamente propenso à degradação pelo onipresente RNase14. Os linfócitos do sistema imunológico inato tendem a engolir o reconhecido IVT mRNA em casos de aplicação in vivo . Além disso, a alta densidade de carga negativa e o grande peso molecular (1 x 104-1 x 106 Da) de IVT mRNA prejudicam sua efetiva permeação através da bicamada lipídica aniônica das membranas celulares15. Portanto, um sistema de entrega com certos materiais biofuncionais é necessário para inibir a degradação das moléculas de mRNA IVT e facilitar a absorção celular16.
Além de alguns casos excepcionais em que o MRNA IVT nu foi diretamente utilizado para investigações in vivo, vários sistemas de entrega são usados para transportar IVT mRNA para o local terapêutico da ação17,18. Estudos anteriores revelaram que apenas alguns mRNAs IVT são detectados em citosol sem a assistência de um sistema de entrega19. Inúmeras estratégias foram desenvolvidas para melhorar a entrega de RNA com esforços contínuos no campo, desde condensação de protamina até encapsulamento lipídicos20. As nanopartículas lipídicas (LNPs) são as mais clinicamente avançadas entre os veículos de entrega de mRNA, como comprovado pelo fato de que todas as vacinas aprovadas de mRNA COVID-19 para uso clínico empregam sistemas de entrega baseados em LNP21. No entanto, os LNPs não podem mediar a transfecção eficaz do mRNA quando as formulações são entregues através da rota respiratória22, o que limita notavelmente a aplicação dessas formulações na indução de respostas imunes mucosas ou no enfrentamento de doenças relacionadas com o pulmão, como fibrose cística ou deficiência de α1-antitripsina. Portanto, é necessário desenvolver um novo sistema de entrega para facilitar a entrega eficiente e transfecção de IVT mRNA em células relacionadas às vias aéreas para resolver essa necessidade não atendida.
Foi confirmado que o sistema de entrega de nanopartículas auto-montadas de peptídeo-poloxamina (PP-sNp) pode mediar a transfecção eficiente de ácidos nucleicos no trato respiratório dos camundongos23. O PP-sNp adota uma abordagem de design modular multifuncional, que pode integrar diferentes módulos funcionais nas nanopartículas para triagem rápida e otimização23. Os peptídeos sintéticos e copolímeros de blocos anfílicos eletricamente neutros (poloxamina) dentro do PP-sNp podem interagir espontaneamente com o IVT mRNA para gerar nanopartículas distribuídas uniformemente com uma estrutura compacta e superfície lisa23. PP-sNp pode melhorar o efeito de transfecção genética de moléculas de IVT mRNA em células cultivadas e o trato respiratório de camundongos23. O presente estudo descreve um protocolo para geração de PP-sNp contendo iGM que codifica a Luciferase Metridia (MetLuc-mRNA) (Figura 1). A mistura controlada e rápida através de um dispositivo de mistura microfluida, que emprega o design de mistura de herringbone escalonado, é utilizada neste protocolo. O procedimento é fácil de executar e permite a geração de PP-sNp com tamanhos mais uniformes. O objetivo geral da produção pp-sNp usando o misturador microfluido é criar PP-sNp para a complexação de mRNA de forma bem controlada, permitindo assim transfecção celular eficiente e reprodutível in vitro. O presente protocolo descreve a preparação, montagem e caracterização do PP-sNp contendo MetLuc-mRNA.
Protocolo
1. Transcrição in vitro de mRNA quimicamente modificado
NOTA: É necessário usar tubos sem nuclease, reagentes, vidros, pontas de pipeta, etc., porque as RNases são onipresentes no ambiente, como soluções de laboratório, superfícies de instrumentos, cabelo, pele, poeira, etc. Limpe as superfícies do banco e as pipetas completamente antes do uso, e use luvas para evitar a contaminação rnase.
- Realize a linearização do modelo de DNA.
- Sintetizar o quadro de leitura aberta (ORF) da Metridia luciferase (MetLuc) ladeado por um promotor de polimerase T7, região não traduzida (UTR), 3'UTR e caudas poli (A) e cloná-la no vetor PUC57, que é expresso em bactérias (ver Tabela de Materiais).
NOTA: A sequência de codificação do modelo de DNA é fornecida no Arquivo Suplementar 1. - Bactérias culturais, lisem as bactérias e purifiquem o DNA plasmídeo pela coluna correspondente (veja o kit de extração de DNA plasmídeo na Tabela de Materiais).
- Realize uma única reação de 50 μL que contenha 2 μL de BamHI, 2 μL de KpnI (ver Tabela de Materiais) e 2 μg de DNA plasmídeo a 37 °C por 1 h, e alcance a linearização do modelo de DNA.
- Sintetizar o quadro de leitura aberta (ORF) da Metridia luciferase (MetLuc) ladeado por um promotor de polimerase T7, região não traduzida (UTR), 3'UTR e caudas poli (A) e cloná-la no vetor PUC57, que é expresso em bactérias (ver Tabela de Materiais).
- Realize transcrição in vitro para gerar mRNA não tampado-IVT.
- Realize a síntese de mRNA por uma única reação de 20 μL usando um kit de transcrição T7 e pseudouridina (ver Tabela de Materiais): 10 μL (0,8-1 μg) de modelo de DNA linearizado, 1,5 μL (150 mM) de ATP, pseudo-UTP, GTP e CTP, 2 μL de tampão de transcrição de 10x, 1 μL de enzima T7 e 1 μL de água sem nuclease (NF-água). Misture bem os componentes acima mencionados e incubar a 37 °C por 3 h.
- Remova o DNA do modelo.
- Adicione 1 μL (1 U) de DNase (sem RNase) após o processo de transcrição e incubar a 37 °C por 15 min.
- Realize a purificação de mRNA sem tampa-IVT usando precipitação de cloreto de lítio.
- Purifique o mRNA uncapped-IVT usando cloreto de lítio (ver Tabela de Materiais) com uma concentração de trabalho de 10 mM. Adicione 50 μL de cloreto de lítio de 10 mM a 20 μL de solução mRNA não tampada-IVT.
- Misture bem o volume completo e esfrie a −20 °C por 1h. Colete o mRNA uncapped-IVT por 12 min a 12.000 x g, que produz rotineiramente 80-120 μg de mRNA uncapped-IVT de cada reação única de 20 μL.
- Realize o capping ivt mRNA.
- Realize o capping de mRNA IVT utilizando o sistema de tampa da tampa 1 (ver Tabela de Materiais). Brevemente, remova a estrutura secundária de 50 μg de mRNA uncapped-IVT por aquecimento a 65 °C por 10 min, em seguida, vincule a extremidade de 5' de mRNA uncapped-IVT com tampa 1, que é preparado modificando a estrutura da tampa m7G usando 2,5 μL de s-adenosylmethionine (SAM) (20 mM) e 4 μL de 2'-O-metiltransferase (100 U) em uma reação de 100 μL a 37 °C por 30-60 min.
- Purifique 100 μL do mRNA IVT tampado utilizando 250 μL de cloreto de lítio de 10 mM e diluir em 50 μL de NF-água.
- Determine a pureza e o tamanho molecular do mRNA capped-IVT.
- Meça a concentração de mRNA capped-IVT com um espectrofotômetro visível UV. Usando um marcador de RNA (ver Tabela de Materiais), analise o tamanho molecular de mRNA tampado-IVT em um gel de agarose de desnação de formaldeído de 1% contendo 18% de formaldeído (tensão é de 120 V). Certifique-se de que o mRNA sem tampa-IVT e o mRNA tampado-IVT sejam armazenados a −80 °C.
NOTA: Considerou-se que o IVT mRNA tinha boa pureza na proporção A260/A280 de 1,8-2,1 e uma razão A260/A230 de 2,0 ou ligeiramente superior.
- Meça a concentração de mRNA capped-IVT com um espectrofotômetro visível UV. Usando um marcador de RNA (ver Tabela de Materiais), analise o tamanho molecular de mRNA tampado-IVT em um gel de agarose de desnação de formaldeído de 1% contendo 18% de formaldeído (tensão é de 120 V). Certifique-se de que o mRNA sem tampa-IVT e o mRNA tampado-IVT sejam armazenados a −80 °C.
2. Geração de IVT mRNA/PP-sNp
- Prepare a solução de estoque poloxamine 704 (T704) solubilizando o T704 (ver Tabela de Materiais) em NF-água para obter uma solução de estoque de 10 mg/mL. Armazene a solução preparada a 4 °C.
NOTA: T704 contém uma estrutura em forma de X feita de um grupo central de etilenodiamina ligado a quatro cadeias de blocos de poli (óxido de propileno) (PPO) e blocos poli (óxido de etileno) (PEO)24. O peso molecular (Mw) de T704 é de 5500. - Prepare a solução de estoque de peptídeo sintético (sPep, ver Tabela de Materiais) solubilizando o sPep (sequência: KETWWETWWTEWWWKKRRRRRKKKKGACSE
RSMNFCG) em NF-água para obter uma solução de estoque de 2 mg/mL e armazenar a 4 °C. - Prepare a solução ivt mRNA descongelando o IVT mRNA (passo 1) no gelo e centrifugando logo para 3 s a 300 x g à temperatura ambiente antes de abrir o tubo. Diluir a solução ivt mRNA para 0,04 μg/μL com nf-água.
NOTA: Recomenda-se trabalhar em um armário de biossegurança sempre que possível com o mRNA IVT. - Prepare a solução de mix T704 e sPep diluindo a solução sPep para 0,555 μg/μL e a solução T704 para 8 μg/μL com NF-water. Incubar a solução mista por 15 minutos à temperatura ambiente antes de usar mais.
NOTA: Calcule o componente sPep necessário com base na relação N/P desejada. A razão N/P é o número total de resíduos de nitrogênio (N) dentro do sPep para o número total de grupos de fosfato carregados negativamente (P) dentro do IVT mRNA. Calcule o T704 necessário com base na relação peso/peso (w/w) entre T704 e IVT mRNA. É necessário que a razão N/P seja de 5 e a razão w/w seja de 100. - Prepare a formulação IVT mRNA/PP-sNp seguindo as etapas abaixo.
- Desenhe a solução IVT mRNA (passo 3) em uma seringa de 1 mL, garantindo que não haja aberturas de ar ou bolhas na ponta da seringa. Carregue a seringa em um lado do cartucho ao lado do bloco rotativo.
- Encha uma seringa de 1 mL com a solução de mix T704 e sPep (etapa 4). Remova quaisquer bolhas ou aberturas de ar na ponta da seringa e coloque a seringa na outra entrada da bomba (ver Tabela de Materiais).
- Defina a bomba com uma relação de fluxo de 1:1 e uma taxa de fluxo total de 4-10 mL/min.
NOTA: Uma vazão total de 6 mL/min é ótima nos estudos aqui apresentados. - Coloque um tubo cônico sem RNase de 10 mL (ver Tabela de Materiais) para coletar a solução mista IVT-mRNA/PP-sNp no final do caminho de fluxo do dispositivo de mistura.
- Execute a bomba para iniciar a mistura, garantindo que os parâmetros estejam inseridos corretamente. Depois que a bomba terminar de funcionar por 6 s, colete a amostra IVT-mRNA/PP-sNp do tubo cônico.
NOTA: O PP-sNp foi gerado por meio de um misturador microfluido (Figura Suplementar 1). O dispositivo compreende uma bomba de fluxo constante, dispositivo de link, chip e dispositivo fixo. No processo de mistura, a bomba de fluxo constante conectada ao chip entrega líquido ao chip de acordo com a taxa de fluxo predefinida. A bomba de fluxo constante conectada pode ser conectada a vários canais de entrada do chip com um único canal de saída. Os componentes do dispositivo, incluindo o chip, foram obtidos a partir de fontes comerciais e montados racionalmente (ver Tabela de Materiais). Os parâmetros, como taxa de fluxo e volume da solução IVT mRNA e solução mista T704-sPep, podem diferir daqueles exibidos no protocolo atual se alguma configuração diferente for usada e deve ser otimizada de acordo.
3. Medição do diâmetro hidrodinâmico e polidispersidade do IVT-mRNA/PP-sNp
- Diluir uma alíquota da solução IVT mRNA/PP-sNp (etapa 2) com nf-água para obter um volume final de 1 mL.
- Meça o tamanho hidrodinâmico e o índice de polidispersidade (IDP) utilizando um cuvette semi-micro25. Adicione a solução IVT mRNA/PP-sNp no cuvette e coloque-a no medidor de tamanho de partícula (ver Tabela de Materiais). Configure um procedimento operacional padrão e clique em Iniciar para iniciar a aquisição de dados.
4. Preparação das células para transfecção
- Placas de células epiteliais brônquicas humanas (16HBE) e uma linha celular dendrítica (DC2.4) em placas de 96 poços a uma densidade de 3,5 x 104 células/bem 24 h antes da transfecção. Cultivar as células em um meio de cultura suplementado com soro bovino fetal inativado 10% e 1% penicilina/estreptomicina.
NOTA: As células foram obtidas a partir de uma fonte comercial (ver Tabela de Materiais). - Incubar as células em uma incubadora (37 °C e 5% de co2 atmosfera) por 24 h para garantir que as células sejam 60%-80% confluentes antes da transfecção.
5. Transfecção das células cultivadas
- Depois de remover o meio de crescimento, lave as células banhadas com 0,2 mL/bem 1x PBS.
- Adicione 170 μL de meio de cultura livre de soro a cada poço contendo as culturas celulares banhadas.
- Adicione a formulação IVT mRNA/PP-sNp contendo 0,4 μg de MetLuc mRNA (preparado na etapa 2) em gota com uma quantidade de 30 μL/well.
- Incubar as células com a formulação IVT mRNA/PP-sNp a 37 °C em uma atmosfera umidificada de 5% de CO2 enriquecida por 4h.
- Substitua o meio de transfecção por 0,2 mL de cultura fresca complementada com soro bovino fetal inativado 10% e penicilina/estreptomicina 1% (v/v).
NOTA: O soro bovino fetal foi aquecido a 56 °C por 30 min para inativação. - Incubar as células transfeinadas a 37 °C e em uma atmosfera enriquecida com CO2 por 5% por 24 h e coletar os sobrenantes a serem detectados de cada poço.
6. Análise da eficácia da transfecção celular utilizando ensaio metridia luciferase (MetLuc)
- Teste o supernatante de cada poço para a atividade MetLuc usando substrato de coelenterazina (ver Tabela de Materiais) seguindo os passos abaixo.
- Prepare uma solução de ensaio fresco adicionando 1x PBS ao substrato de coelenterazina (a concentração de coelenterazina é de 15 mM).
- Vórtice a solução de coelenterazina para 10 s para mistura completa.
- Adicione 50 μL de supernascente (coletado na etapa 5) a uma placa de 96 poços.
- Configure o leitor de microplacas (ver Tabela de Materiais) com um tempo de leitura de 1.000 ms antes de adicionar 30 μL de solução de coelenterazina (15 mM) a cada poço manualmente ou por injeção automatizada.
- Clique em Iniciar para medir o sinal de luminescência imediatamente após adicionar a solução de coelenterazina ao supernatante.
NOTA: O sinal de luminescência é medido por meio de um leitor de microplaca, e sua atividade é expressa em unidades de luz relativas. Os valores obtidos dos poços transfectados pbs serão utilizados como controles em branco.
Resultados
O plasmídeo recombinante foi digerido para produzir o modelo de DNA linearizado (Figura 2A). Usando o protocolo descrito, o kit de transcrição in vitro T7 pode produzir até 80-120 μg de MetLuc-mRNA não tampado por reação de 20 μL e 50-60 μg de MetLuc-mRNA tampado por reação de 100 μL. Quando analisado com eletroforese, MetLuc-mRNA intacto com alta qualidade deve mostrar uma banda única e clara, como exibido na Figura 2B. Contaminantes introduzidos na reação do modelo de DNA podem resultar em degradação do RNA e um rendimento menor.
O PP-sNp contendo o MetLuc-mRNA (MetLuc-mRNA/PP-sNp) foi preparado utilizando o método de mistura microfluidica (Figura 1). A Tabela 1 mostra os dados sobre a caracterização físico-química do MetLuc-mRNA/PP-sNp como exemplos. O raio hidrodinâmico do MetLuc-mRNA/PP-sNp pode ser considerado correto se variar cerca de 70-100 nm. Além disso, o PDI do PP-sNp deve ser constante e preferencialmente estar abaixo de 0,2, mas valores de PDI até aproximadamente 0,3 são aceitos.
Depois de incorporar com sucesso o MetLuc-mRNA no PP-sNp, a formulação pode ser incubada com células 16HBE e uma linha celular dendrítica (DC2.4), e a eficiência de transfecção do MetLuc-mRNA pode ser indicada pela atividade luciferase dentro da cultura celular supernatante 24 h pós transfecção. A Figura 3 é um exemplo típico da transfecção bem sucedida do MetLuc-mRNA/PP-sNp. Pode-se ver claramente que as células transfeccionadas com MetLuc-mRNA/PP-sNp apresentaram expressão significativamente maior de luciferase em comparação com aquelas transfeccionadas com re regente de transfecção à base de lipídios (LP) (ver Tabela de Materiais), MetLuc-mRNA (controle negativo), PBS (controle em branco) ou solução mista T704-sPep (controle simulado) em células 16HBE. MetLuc-mRNA/PP-sNp também apresentou maior expressão de luciferase em relação ao LP. Os dados sugerem que o sistema de entrega PP-sNp é importante para proteger o MetLuc-mRNA contra a degradação e para promover a eficiência de transfecção do exógeno MetLuc-mRNA. Portanto, sistemas de entrega como o PP-sNp são geralmente essenciais para estudos de transfecção de IVT mRNA.
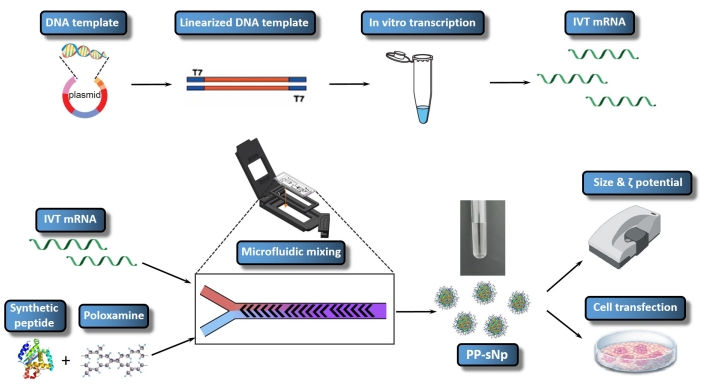
Figura 1: Representação esquemática de todo o fluxo de trabalho do IVT mRNA/PP-sNp. O modelo de DNA está ligado ao plasmídeo por construção plasmida recombinante. O modelo de DNA linearizado é montado usando a digestão da enzima de restrição. O mRNA transcrito in vitro (IVT mRNA) é sintetizado e tampado a partir do modelo de DNA linearizado. A solução T704-sPep contém T704 e o peptídeo sintético (sPep), enquanto a solução IVT mRNA contém MetLuc-mRNA. As soluções mistas IVT mRNA e T704-sPep são misturadas usando um misturador microfluido, que forma MetLuc-mRNA/PP-sNp. Em seguida, a caracterização do MetLuc-mRNA/PP-sNp é realizada para determinar o tamanho das partículas e a polidispersidade usando um Zetasizer. As células 16HBE são transfeccionadas com MetLuc-mRNA/PP-sNp, e a atividade de luciferase dentro do supernante é medida para avaliar a eficiência da transfecção. Clique aqui para ver uma versão maior desta figura.

Figura 2: A produção de MetLuc-mRNA. (A) O modelo de DNA contém um promotor de polimerase T7, uma região não traduzida (UTR), um quadro de leitura aberto (ORF) de MetLuc, uma cauda de 3'UTR e poli (A). (B) Detecção de eletroforese. A seta branca indica plasmídeo recombinante. A seta amarela indica o vetor PUC57. A seta vermelha indica o modelo de DNA para a transcrição in vitro de MetLuc-mRNA. O arqueiro verde indica MetLuc-mRNA sem tampa. A seta azul indica MetLuc-mRNA tampado. Clique aqui para ver uma versão maior desta figura.

Figura 3: Eficiência de transfecção de células MetLuc-mRNA/PP-sNp em células 16HBE e DC2.4. MetLuc-mRNA foi transfeinado usando PP-sNp em (A) células 16HBE e (B) uma linha celular dendrítica (DC2.4). A concentração final de MetLuc-mRNA foi de 0,02 μg/μL, a de sPep foi de 0,139 μg/μL, e a de T704 foi de 2 μg/μL em PP-sNp. O regente de transfecção baseado em lipídio comercial (LP) foi adotado como um controle positivo. A atividade da luciferase foi medida 24h após a transfecção. A amostra tratada pela PBS foi adotada como controle em branco. A solução mista T704-sPep foi adotada como um controle simulado. As diferenças estatísticas foram analisadas com o teste t do Aluno (nsp ≥ 0,05, * p < 0,05). Clique aqui para ver uma versão maior desta figura.
| IVT mRNA | N/P (sPep) | w/w (T704) | Tamanho (nm) | Pdi | Zeta |
| 17,5 ng/μL | 5 | 100 | 85.12 ± 9.40 | 0.20 ± 0.07 | -13.07 ± 0.47 |
Tabela 1: Dados de caracterização físico-química do MetLuc-mRNA/PP-sNp.
Figura suplementar 1: A configuração do dispositivo microfluido preparado internamente utilizado no presente estudo. Clique aqui para baixar este Arquivo.
Arquivo suplementar 1: A sequência de codificação do modelo de DNA. Clique aqui para baixar este Arquivo.
Discussão
O protocolo aqui descrito não só permite a produção econômica e rápida de formulações de vacinas IVT mRNA com propriedades definidas, mas também oferece a possibilidade de personalizar a formulação pp-sNp de acordo com propósitos terapêuticos específicos, como a terapia genética. Para garantir a geração bem sucedida de IVT mRNA/PP-sNp, sugere-se prestar atenção extra a algumas etapas críticas. Ao trabalhar com mRNA, lembre-se sempre que as condições livres de RNase devem ser mantidas durante todo o processo, pois o IVT mRNA é muito sensível no que diz respeito à degradação por parte da RNase, mesmo que o iCsm. Enquanto isso, um ambiente sem RNase também deve ser assegurado ao armazenar as formulações. Recomenda-se armazenar IVT mRNA/PP-sNp a 2-8 °C por até 1 semana. Os resultados apresentados demonstram que a água livre de nuclease é eficaz na formação com sucesso do PP-sNp com alta eficiência de transfecção. Outros buffers, como PBS, soro fisiológico, OptiMEM, etc., podem ser usados se desejarem. Recomenda-se realizar as transfecções in vitro usando IVT mRNA/PP-sNp em um meio OptiMEM, a fim de garantir a viabilidade das células cultivadas. Se outro buffer em vez de água sem nuclease for escolhido para preparar a formulação, é importante usar o IVT mRNA com baixa concentração (abaixo de 100 ng/mL); caso contrário, as nanopartículas tendem a ser precipitadas, o que, por sua vez, torna uma formulação inválida. A causa deste fenômeno é a moiety cationic dentro do peptídeo sintético. Além disso, a forte densidade de carga positiva da nanopartícula pode desestabilizar a membrana celular, induzindo assim citotoxicidade significativa. No entanto, foi demonstrado no estudo anterior que a carga positiva dentro do PP-sNp é imperativa na mediação eficiente da captação celular IVT mRNA, fuga endosome e transfecçãobem sucedida 23. Como resultado, é importante ajustar a carga positiva dentro do PP-sNp para atingir um equilíbrio delicado em termos de eficiência e toxicidade.
O protocolo apresentado pode ser aplicado a várias formulações baseadas em PP-sNp com algumas alterações de parâmetros. Para a entrega de vacinas baseadas em IVT mRNA, propriedades biofísicas como tamanho de partículas e índice de polidispersidade são fundamentais para a eficiência de transfecção e imunogenicidade das nanopartículaspreparadas 26. O tamanho das partículas do IVT mRNA/PP-sNp na escala de nanômetro permite uma transferência eficiente através de barreiras fisiológicas e é, portanto, importante para as aplicações in vivo subsequentes. Foi relatado que lNPs na faixa de tamanho de 60-150 nm produzem respostas imunes robustas em primatas não humanos26. Por outro lado, nanopartículas de grande porte (por exemplo, 400-1000 nm) não conseguiram superar a barreira do muco das vias aéreas quando solicitadas para o parto pulmonar porque, como revelado por investigações anteriores, o espaçamento médio de malha tridimensional de poros de malha de muco das vias aéreas varia de aproximadamente 60-300 nm27,28. Se o tamanho desejado ou a eficiência de transfecção não forem alcançados, algumas dicas para iniciar a solução de problemas incluem o ajuste da quantidade de componentes de poloxamina ou peptídeo sintético utilizados. O estudo anterior revelou que parâmetros adicionais, como a quantidade de IVT mRNA utilizado para transfecção, o tempo de incubação e os tipos e densidade celular das células cultivadas, também poderiam influenciar significativamente o resultado da transfecção23. Além disso, uma vez que a moiety de segmentação dentro do PP-sNp permite a entrega específica do mRNA IVT encapsulado em células que exibem receptores relacionados, a substituição por ligantes de alvo alternativos poderia ser necessária se as células-alvo forem transfeinadas com outros tipos em vez de células relacionadas às vias aéreas. No geral, o protocolo ainda pode ser melhorado com uma visão mais detalhada e um exame mais aprofundado.
Considerando que o IVT original mRNA/PP-sNp é preparado inicialmente por mixagem manual direta, as habilidades do operador desempenham um papel importante no controle da qualidade da formulação. Modificações no processo de mistura do iCmRNA com os componentes do PP-sNp podem resultar em grandes micropartículas em vez de partículas nano-dimensionadas. O passo mais complicado é misturar o mRNA e o peptídeo sintético, que deve ser feito de forma controlada. Para melhorar a reprodutibilidade entre diferentes lotes da formulação IVT mRNA/PP-sNp, foi adotado um misturador microfluido porque a triagem de baixo volume, a velocidade rápida e a reprodutibilidade são características importantes do uso do método microfluido29. Este método mostrou boa reprodutibilidade, sem impacto significativo no tamanho das partículas nem na eficiência de transfecção observada entre diferentes lotes. Este é um critério essencial para que as vacinas baseadas em IVT mRNA sejam aplicadas em aplicações clínicas. Particularmente, o misturador microfluido não deve exceder o número máximo de usuários (recomendado pelo fabricante) e deve ser alterado entre formulações com diferentes composições.
O protocolo de transcrição de IVT mRNA descrito neste protocolo pode teoricamente ser usado para preparar qualquer proteína/antígeno de interesse do repórter. A Luciferase Metridia (MetLuc) foi especificamente aplicada neste estudo por possuir vantagens únicas. O ensaio de atividade do MetLuc é fácil de realizar com alta sensibilidade porque o MetLuc pode produzir um sinal bioluminescente intensivo, podendo ser diretamente secretado no meio celular, evitando assim a necessidade de lise celular. É importante notar que a expressão MetLuc nas células cultivadas pode ser influenciada por muitos parâmetros (por exemplo, números de células variados por poço e erros de pipetação, etc.) além da funcionalidade do próprio MetLuc-mRNA.
Embora o protocolo atual tenha sido estabelecido para a entrega da vacina IVT mRNA, também pode ser implementado para vacinas ou terapêuticas baseadas em outros tipos de ácidos nucleicos, como o DNA plasmídeo (pDNA). Este processo poderia ser adaptado a peptídeos sintéticos, ácido nucleico e alterações de componentes de poloxamina para o desenvolvimento de pp-sNp particular para várias indicações clínicas. De fato, a integração genoma do gene regulador de transdução de fibrose cistiça exógena (CFTR) no tecido epitelial respiratório de camundongos eliminatórios cftr com a utilização de uma ferramenta de modificação genética da Bela Adormecida fornecida por um PP-sNp23 foi alcançada com sucesso. Quanto às aplicações terapêuticas, as formulações IVT mRNA/PP-sNp poderiam ser utilizadas como aerossol utilizando dispositivos específicos de nebulização para a cura de doenças pulmonares, como deficiência de α1-antitripsina ou fibrose cística30. No entanto, vale ressaltar que as formulações IVT mRNA/PP-sNp para nebulização devem ser otimizadas e personalizadas, pois o iMBânico IVT mRNA aerossolizado pode ser ineficiente devido à força de tesoura criada pelo nebulizador e à natureza frágil do IVT mRNA30. Além disso, o protocolo é possivelmente escalável para volumes maiores usando diferentes dispositivos de mistura microfluida, como dispositivos de mistura de junção T e até mesmo jatos de impacto misturando bombas31,32.
Em resumo, o protocolo aqui detalhado introduz um método reprodutível de formulação de iCmRNA em um sistema de entrega PP-sNp, bem como posterior transfecção confiável em células cultivadas. O método descrito garante uma abordagem acessível e fácil para produzir IVT mRNA/PP-sNp usando um misturador microfluido. As formulações preparadas com pequenos tamanhos de partículas e baixo índice de polidispersidade podem ser posteriormente aplicadas em células cultivadas com segurança e eficiência. Este protocolo permitirá que o sistema de entrega baseado em PP-sNp se torne disponível para a comunidade acadêmica para projetar novas vacinas ou terapêuticas baseadas em IVT mRNA, evitando todas as desvantagens mencionadas. Com os perfis flexíveis do PP-sNp, espera-se que inúmeras aplicações futuras sejam alcançadas com o PP-sNp para produzir terapêuticas distintas para enfrentar diversas doenças.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela National Natural Science Foundation of China (NSFC, Grant No. 82041045 e 82173764), o principal projeto de Estudo sobre Patogênese e Sistema de Tecnologia de Prevenção de Epidemias (2021YFC2302500) do Ministério da Ciência e Tecnologia da China, o Projeto De Talentos Jovens Excepcionais (CQYC202005027) e a Fundação de Ciência Natural de Chongqing (cstc2021jcyj-msxmX0136). Os autores são gratos ao Dr. Xiaoyan Ding por medir o diâmetro hidrodinâmico (nm) e índice de polidispersidade (PDI).
Materiais
| Name | Company | Catalog Number | Comments |
| BamHI | Takara | 1010 | |
| cap 1 capping system | Jinan | M082 | |
| Dendritic cell-line | Sigma | SCC142 | |
| DNA sequence | Genescript | ||
| Human bronchial epithelial cells | Sigma | SCC150 | |
| KpnI | Takara | 1068 | |
| LP | Beyotime | C0533 | |
| Lithium chloride | APEXBio | B6083 | |
| Malvern Zetasizer Nano ZS90 | Malvern | NB007605 | |
| Microfluidic chip | ZHONGXINQIHENG | Standard PDMS chip | |
| Microplate readers | ThermoFisher | Varioskan lux | |
| NanoDrop One | ThermoFisher | ND-ONE-W (A30221) | |
| Nuclease-free water | ThermoFisher | AM9932 | |
| OptiMEM | Gibco | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Pseudouridine | APE×Bio | B7972 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| Quanti-Luc | InvivoGen | Rep-qlc2 | |
| RiboRuler High Range RNA Ladder | ThermoFisher | SM1821 | |
| RNase-free conical tube | Biosharp | BS-100-M | |
| RPMI Medium 1640 | ThermoFisher | C11875500BT | |
| Syringe pump | Chemyx | Fusion 101 | |
| T7 transcription Kit | Jinan | E131 |
Referências
- Fehervari, Z., Minton, K., Duarte, J. H. Nature milestones in vaccines. Springer Nature. , Available from: https://www.nature.com/collections/hcajdiajij (2020).
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 40 (6), 840-854 (2022).
- Mulligan, M. J., et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586 (7830), 589-593 (2020).
- Tang, J., et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa. Nanomaterials. 12 (2), 226(2022).
- Freyn, A. W., et al. A multi-targeting, nucleoside-modified mRNA influenza virus vaccine provides broad protection in mice. Molecular Therapy. 28 (7), 1569-1584 (2020).
- Wu, K., et al. Variant SARS-CoV-2 mRNA vaccines confer broad neutralization as primary or booster series in mice. Vaccine. 39 (51), 7394-7400 (2021).
- Chaudhary, N., Weissman, D., Whitehead, K. A. mRNA vaccines for infectious diseases: Principles, delivery and clinical translation. Nature Reviews Drug Discovery. 20, 817-838 (2021).
- Kormann, M. S. D., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature Biotechnology. 29 (2), 154-157 (2011).
- Tavernier, G., et al. mRNA as gene therapeutic: How to control protein expression. Journal of Controlled Release. 150 (3), 238-247 (2011).
- Walsh, E. E., et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. The New England Journal of Medicine. 383 (25), 2439-2450 (2020).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine. 384 (5), 403-416 (2021).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Sharova, L. V., et al. Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells. DNA Research. 16 (1), 45-58 (2009).
- Houseley, J., Tollervey, D. The many pathways of RNA degradation. Cell. 136 (4), 763-776 (2009).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Sahin, U., Karikó, K., Türeci, Ö MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13, 359-380 (2014).
- Hajj, K. A., Whitehead, K. A. Tools for translation: Non-viral materials for therapeutic mRNA delivery. Nature Reviews Materials. 2, 17056(2017).
- Deering, R. P., Kommareddy, S., Ulmer, J. B., Brito, L. A., Geall, A. J. Nucleic acid vaccines: Prospects for non-viral delivery of mRNA vaccines. Expert Opinion on Drug Delivery. 11 (6), 885-899 (2014).
- Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C., Thakur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics. 12 (2), 102(2020).
- Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nature Reviews Materials. 6 (12), 1078-1094 (2021).
- Sahin, U., et al. COVID-19 vaccine BNT162b1 elicits human antibody and T(H)1 T cell responses. Nature. 586 (7830), 594-599 (2020).
- Azzi, L., et al. Mucosal immune response in BNT162b2 COVID-19 vaccine recipients. EBioMedicine. 75, 103788(2022).
- Guan, S., et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis. Nature Nanotechnology. 14 (3), 287-297 (2019).
- Pitard, B., et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Research. 32 (20), 159(2004).
- Hiroi, T., Shibayama, M. Measurement of particle size distribution in turbid solutions by dynamic light scattering microscopy. Journal of Visualized Experiments. (119), e54885(2017).
- Hassett, K. J., et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. Journal of Controlled Release. 335, 237-246 (2021).
- Suk, J. S., et al. The penetration of fresh undiluted sputum expectorated by cystic fibrosis patients by non-adhesive polymer nanoparticles. Biomaterials. 30 (13), 2591-2597 (2009).
- Kim, N., Duncan, G. A., Hanes, J., Suk, J. S. Barriers to inhaled gene therapy of obstructive lung diseases: A review. Journal of Controlled Release. 240, 465-488 (2016).
- Liu, Z., Fontana, F., Python, A., Hirvonen, J. T., Santos, H. A. Microfluidics for production of particles: Mechanism, methodology, and applications. Small. 16 (9), 1904673(2020).
- Guan, S., Darmstädter, M., Xu, C., Rosenecker, J. In vitro investigations on optimizing and nebulization of IVT-mRNA formulations for potential pulmonary-based alpha-1-antitrypsin deficiency treatment. Pharmaceutics. 13 (8), 1281(2021).
- Shepherd, S. J., Issadore, D., Mitchell, M. J. Microfluidic formulation of nanoparticles for biomedical applications. Biomaterials. 274, 120826(2021).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados