Method Article
Эффективная трансфекция транскрибированной мРНК in vitro в культивируемых клетках с использованием наночастиц пептид-полоксамин
* Эти авторы внесли равный вклад
В этой статье
Резюме
Самособранная пептидно-полоксаминовая наночастица (PP-sNp) разработана с использованием микрофлюидного смесительного устройства для инкапсулирования и доставки in vitro транскрибированной матричной РНК. Описанная мРНК/PP-sNp может эффективно трансфектировать культивируемые клетки in vitro.
Аннотация
Транскрибированные вакцины in vitro с матричной РНК (мРНК) продемонстрировали огромный потенциал в борьбе с пандемией коронавирусной болезни 2019 года (COVID-19). Эффективные и безопасные системы доставки должны быть включены в мРНК-вакцины из-за хрупких свойств мРНК. Самособранная система доставки генов пептидно-полоксаминовых наночастиц (PP-sNp) специально разработана для легочной доставки нуклеиновых кислот и демонстрирует многообещающие возможности в опосредовании успешной трансфекции мРНК. Здесь описан улучшенный метод получения PP-sNp, чтобы подробно рассказать о том, как PP-sNp инкапсулирует мРНК Metridia luciferase (MetLuc) и успешно трансфектирует культивируемые клетки. MetLuc-mRNA получают процессом транскрипции in vitro из линейного шаблона ДНК. PP-sNp получают путем смешивания синтетического пептида/ полокамина с раствором мРНК с использованием микрофлюидного миксера, что позволяет самостоятельно собирать PP-sNp. Заряд PP-sNp впоследствии оценивается путем измерения дзета-потенциала. Между тем, полидисперсность и гидродинамический размер наночастиц PP-sNp измеряют с помощью динамического рассеяния света. Наночастицы мРНК/PP-sNp трансфектируются в культивируемые клетки, а супернатанты из клеточной культуры анализируются на активность люциферазы. Репрезентативные результаты демонстрируют их способность к трансфекции in vitro. Этот протокол может пролить свет на разработку систем доставки мРНК-вакцин следующего поколения.
Введение
Вакцинация была объявлена одним из наиболее эффективных медицинских вмешательств для снижения заболеваемости и смертности, вызванных инфекционнымизаболеваниями1. Важность вакцин была продемонстрирована со времен вспышки коронавирусной болезни 2019 года (COVID-19). В отличие от традиционной концепции инъекции инактивированных или ослабленных живыми патогенов, современные подходы к вакцинам, такие как вакцины на основе нуклеиновых кислот, концентрируются на сохранении иммуностимулирующих свойств патогенов-мишеней, избегая при этом потенциальных проблем безопасности, связанных с обычным цельным микробным вирусом или в вакцинах на основе бактерий. Вакцины на основе ДНК и РНК (т.е. транскрибированной матричной РНК in vitro, мРНК IVT) демонстрируют профилактический терапевтический потенциал против различных заболеваний, включая инфекционные заболевания и рак 2,3. В принципе, потенциал вакцин на основе нуклеиновых кислот связан с их производством, эффективностью и безопасностью4. Эти вакцины могут быть изготовлены бесклеточным способом, чтобы обеспечить экономически эффективное, масштабируемое и быстрое производство.
Одна вакцина на основе нуклеиновых кислот может кодировать несколько антигенов, что позволяет нацеливаться на многочисленные вирусные варианты или бактерии с уменьшенным количеством прививок и усиливать иммунный ответ против устойчивых патогенов 5,6. Кроме того, вакцины на основе нуклеиновых кислот могут имитировать естественный процесс инвазии вирусной или бактериальной инфекции, вызывая иммунные реакции, опосредованные как В-клетками, так и Т-клетками. В отличие от некоторых вакцин на основе вирусов или ДНК, вакцины на основе мРНК IVT предлагают огромное преимущество с точки зрения безопасности. Они могут быстро экспрессировать желаемый антиген в цитозоле и не интегрированы в геном хозяина, устраняя опасения по поводу вставочного мутагенеза7. IVT-мРНК автоматически разлагается после успешной трансляции, поэтому кинетику экспрессии белка можно легко контролировать 8,9. Катализируемые пандемией коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2), усилия компаний / учреждений по всему миру позволили выпустить на рынок многие типы вакцин. Технология вакцин на основе мРНК IVT демонстрирует большой потенциал и впервые продемонстрировала свой ранее ожидаемый успех благодаря своей быстрой конструкции и гибкой способности адаптироваться к любым целевым антигенам в течение нескольких месяцев. Успех мРНК-вакцин IVT против COVID-19 в клиническом применении не только открыл новую эру исследований и разработок мРНК-вакцины IVT, но и накопил ценный опыт для быстрой разработки эффективных вакцин для борьбы со вспышками инфекционных заболеваний10,11.
Несмотря на многообещающий потенциал мРНК-вакцин IVT, эффективная внутриклеточная доставка мРНК IVT к месту действия (т.е. цитоплазме) продолжает представлять собой серьезное препятствие12, особенно для тех, которые вводятся через дыхательные пути4. МРНК IVT по своей природе является нестабильной молекулой с чрезвычайно коротким периодом полураспада (~ 7 ч)13, что делает мРНК IVT очень склонной к деградации вездесущейРНКазой 14. Лимфоциты врожденной иммунной системы имеют тенденцию поглощать признанную мРНК IVT в случаях применения in vivo . Кроме того, высокая отрицательная плотность заряда и большая молекулярная масса (1x 10 4-1 x 106 Da) мРНК IVT ухудшают ее эффективное проникновение через анионный липидный бислой клеточных мембран15. Поэтому система доставки с определенными биофункциональными материалами необходима для ингибирования деградации молекул мРНК IVT и облегчения клеточного поглощения16.
За исключением нескольких исключительных случаев, когда голая мРНК IVT непосредственно использовалась для исследований in vivo, различные системы доставки используются для переноса мРНК IVT к терапевтическому участку действия17,18. Предыдущие исследования показали, что только несколько мРНК IVT обнаруживаются в цитозоле без помощи системы доставки19. Были разработаны многочисленные стратегии для улучшения доставки РНК с непрерывными усилиями в этой области, начиная от конденсации протамина до инкапсуляции липидов20. Липидные наночастицы (LNP) являются наиболее клинически продвинутыми среди средств доставки мРНК, о чем свидетельствует тот факт, что все одобренные вакцины мРНК COVID-19 для клинического использования используют системы доставки на основе LNP21. Однако LNP не могут опосредовать эффективную трансфекцию мРНК, когда препараты доставляются дыхательным путем22, что удивительно ограничивает применение этих составов в индуцировании иммунных реакций слизистой оболочки или решении заболеваний, связанных с легочной, таких как муковисцидоз или дефицит α1-антитрипсина. Поэтому для решения этой неудовлетворенной потребности требуется разработка новой системы доставки для облегчения эффективной доставки и трансфекции мРНК IVT в клетках, связанных с дыхательными путями.
Подтверждено, что система доставки пептид-полоксаминовых самособранных наночастиц (PP-sNp) может опосредуть эффективную трансфекцию нуклеиновых кислот в дыхательных путях мышей23. PP-sNp использует многофункциональный модульный подход к проектированию, который может интегрировать различные функциональные модули в наночастицы для быстрого скрининга и оптимизации23. Синтетические пептиды и электрически нейтральные амфифильные блок-сополимеры (полоксамин) в PP-sNp могут спонтанно взаимодействовать с мРНК IVT с образованием равномерно распределенных наночастиц с компактной структурой и гладкой поверхностью23. PP-sNp может улучшить эффект трансфекции генов молекул мРНК IVT в культивируемых клетках и дыхательных путях мышей23. В настоящем исследовании описан протокол генерации PP-sNp, содержащий мРНК IVT, который кодирует metridia luciferase (MetLuc-mRNA) (рисунок 1). В этом протоколе используется контролируемое и быстрое смешивание с помощью микрофлюидного смесительного устройства, которое использует конструкцию смешивания елочки в шахматном порядке. Процедура проста в выполнении и позволяет генерировать PP-sNp с более однородными размерами. Общей целью производства PP-sNp с использованием микрофлюидного миксера является создание PP-sNp для комплексообразования мРНК хорошо контролируемым образом, что позволяет эффективно и воспроизводимо трансфекцию клеток in vitro. Настоящий протокол описывает получение, сборку и характеристику PP-sNp, содержащего MetLuc-мРНК.
протокол
1. Транскрипция in vitro химически модифицированной мРНК
ПРИМЕЧАНИЕ: Необходимо использовать безнуклеазные трубки, реагенты, стеклянную посуду, наконечники пипеток и т. Д., Потому что РНКазы повсеместно распространены в окружающей среде, такой как лабораторные растворы, поверхности инструментов, волосы, кожа, пыль и т. Д. Тщательно очистите поверхности скамейки и пипетки перед использованием и наденьте перчатки, чтобы избежать загрязнения RNase.
- Выполните линеаризацию шаблона ДНК.
- Синтезируют открытую рамку считывания (ORF) люциферазы Metridia (MetLuc), окруженную промотором полимеразы T7, 5' нетранслированной областью (UTR), 3'UTR и поли (A) хвостами и клонируют его в вектор PUC57, который экспрессируется в бактериях (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Кодирующая последовательность шаблона ДНК приведена в дополнительном файле 1. - Культивируйте бактерии, лизируйте бактерии и очищайте плазмидную ДНК соответствующей колонкой (см. набор для экстракции плазмидной ДНК в Таблице материалов).
- Выполняют одну реакцию 50 мкл, которая содержит 2 мкл BamHI, 2 мкл KpnI (см. Таблицу материалов) и 2 мкг плазмидной ДНК при 37 °C в течение 1 ч, и достигают линеаризации шаблона ДНК.
- Синтезируют открытую рамку считывания (ORF) люциферазы Metridia (MetLuc), окруженную промотором полимеразы T7, 5' нетранслированной областью (UTR), 3'UTR и поли (A) хвостами и клонируют его в вектор PUC57, который экспрессируется в бактериях (см. Таблицу материалов).
- Выполняйте транскрипцию in vitro для генерации неограниченной мРНК IVT.
- Выполняют синтез мРНК одной реакцией 20 мкл с использованием набора транскрипции Т7 и псевдоуридина (см. Таблицу материалов): 10 мкл (0,8-1 мкг) линеаризированного шаблона ДНК, 1,5 мкл (150 мМ) АТФ, псевдо-UTP, ГТФ и CTP, 2 мкл 10-кратного транскрипционного буфера, 1 мкл фермента Т7 и 1 мкл воды без нуклеазы (NF-воды). Тщательно перемешайте вышеупомянутые компоненты и инкубируйте при 37 °C в течение 3 ч.
- Удалите шаблон ДНК.
- Добавьте 1 мкл (1 ЕД) ДНКазы (без РНКазы) после процесса транскрипции и инкубируйте при 37 °C в течение 15 мин.
- Выполняют очистку мРНК без колпачка-IVT с использованием осаждения хлорида лития.
- Очищают мРНК без колпачка-IVT с помощью хлорида лития (см. Таблицу материалов) с рабочей концентрацией 10 мМ. Добавьте 50 мкл 10 мМ хлорида лития к 20 мкл раствора мРНК без колпачка IVT.
- Тщательно перемешайте весь объем и охладите при температуре −20 °C в течение 1 ч. Собирают мРНК без колпачка IVT в течение 12 мин при 12 000 х г, которая обычно производит 80-120 мкг мРНК без колпачка IVT из каждой отдельной реакции 20 мкл.
- Выполняют укупорку мРНК IVT.
- Выполните укупорку мРНК IVT с использованием системы укупорки колпачка 1 (см. Таблицу материалов). Вкратце удаляют вторичную структуру 50 мкг мРНК без колпачка IVT путем нагревания при 65 °C в течение 10 мин, затем связывают 5'-конец мРНК uncapped-IVT с колпачком 1, который получают путем модификации структуры колпачка m7G с использованием 2,5 мкл s-аденозилметионина (SAM) (20 мМ) и 4 мкл 2'-O-метилтрансферазы (100 ЕД) в реакции 100 мкл при 37 °C в течение 30-60 мин.
- Очистить 100 мкл закрытой мРНК IVT с использованием 250 мкл 10 мМ хлорида лития и разбавить в 50 мкл NF-воды.
- Определение чистоты и молекулярного размера мРНК с крышкой IVT.
- Измерьте концентрацию мРНК с крышкой IVT с помощью УФ-видимого спектрофотометра. Используя маркер РНК (см. Таблицу материалов), проанализируйте молекулярный размер мРНК capped-IVT в 1% формальдегидно-денатурирующем агарозном геле, содержащем 18% формальдегида (напряжение 120 В). Убедитесь, что мРНК без колпачка IVT и мРНК с крышкой IVT хранятся при температуре −80 °C.
ПРИМЕЧАНИЕ: Считалось, что мРНК IVT имеет хорошую чистоту в соотношении A260/A280 1,8-2,1 и соотношении A260/A230 2,0 или немного выше.
- Измерьте концентрацию мРНК с крышкой IVT с помощью УФ-видимого спектрофотометра. Используя маркер РНК (см. Таблицу материалов), проанализируйте молекулярный размер мРНК capped-IVT в 1% формальдегидно-денатурирующем агарозном геле, содержащем 18% формальдегида (напряжение 120 В). Убедитесь, что мРНК без колпачка IVT и мРНК с крышкой IVT хранятся при температуре −80 °C.
2. Генерация мРНК IVT/PP-sNp
- Готовят исходный раствор полоксомина 704 (Т704) путем солюбилизации Т704 (см. Таблицу материалов) в NF-воде для получения исходного раствора 10 мг/мл. Хранить приготовленный раствор при температуре 4 °C.
ПРИМЕЧАНИЕ: T704 содержит X-образную структуру, изготовленную из центральной группы этилендиамина, связанной с четырьмя цепями блоков поли(оксида пропилена) (PPO) и блоков поли(этиленоксида) (PEO)24. Молекулярная масса (Mw) T704 составляет 5500. - Приготовьте раствор синтетического пептида (sPep, см. Таблицу материалов) путем солюбилизации sPep (последовательность: KETWWETWWTEWWTEWKKKKRRRRRKKKKGACSE
RSMNFCG) в NF-воде для получения запасного раствора 2 мг/мл и хранения при 4 °C. - Готовят раствор мРНК IVT путем размораживания мРНК IVT (этап 1) на льду и центрифугирования в течение 3 с при 300 х г при комнатной температуре перед открытием трубки. Раствор мРНК IVT разбавляют до 0,04 мкг/мкл NF-водой.
ПРИМЕЧАНИЕ: Рекомендуется работать в шкафу биобезопасности, когда это возможно, с мРНК IVT. - Готовят смесь раствора T704 и sPep путем разбавления раствора sPep до 0,555 мкг/мкл и раствора T704 до 8 мкг/мкл с NF-водой. Инкубировать смешанный раствор в течение 15 мин при комнатной температуре перед дальнейшим применением.
ПРИМЕЧАНИЕ: Рассчитайте требуемый компонент sPep на основе желаемого соотношения N/P. Отношение N/P представляет собой общее число остатков азота (N) в пределах sPep к общему числу отрицательно заряженных фосфатных групп (P) в мРНК IVT. Рассчитайте требуемый T704 на основе соотношения масса/вес (w/w) между T704 и мРНК IVT. Необходимо, чтобы отношение N/P составляло 5, а отношение w/w составляло 100. - Подготовьте препарат IVT mRNA/PP-sNp, следуя приведенным ниже шагам.
- Втяните раствор мРНК IVT (шаг 3) в шприц объемом 1 мл, обеспечив отсутствие воздушных зазоров или пузырьков в наконечнике шприца. Загрузите шприц в одну сторону картриджа рядом с вращающимся блоком.
- Заполните шприц объемом 1 мл раствором смеси T704 и sPep (шаг 4). Удалите все пузырьки или воздушные зазоры на кончике шприца и поместите шприц в другое входное отверстие насоса (см. Таблицу материалов).
- Установите насос с коэффициентом расхода 1:1 и общим расходом 4-10 мл/мин.
ПРИМЕЧАНИЕ: Общий расход 6 мл/мин является оптимальным в исследованиях, представленных здесь. - Поместите коническую трубку без РНКазы объемом 10 мл (см. Таблицу материалов) для сбора смешанного раствора IVT-мРНК/PP-sNp в конце пути потока смесительного устройства.
- Запустите насос, чтобы начать смешивание, убедившись, что параметры введены правильно. После того, как насос закончит работу в течение 6 с, соберите образец IVT-mRNA/PP-sNp из конической трубки.
ПРИМЕЧАНИЕ: PP-sNp генерировали с помощью микрофлюидного смесителя (дополнительный рисунок 1). Устройство содержит насос постоянного потока, устройство связи, чип и неподвижное устройство. В процессе смешивания насос с постоянным потоком, подключенный к стружке, подает жидкость в стружку в соответствии с заданной скоростью потока. Подключенный насос постоянного потока может быть подключен к нескольким входным каналам микросхемы с одним выходным каналом. Компоненты устройства, включая чип, были получены из коммерческих источников и рационально собраны (см. Таблицу материалов). Параметры, такие как расход и объем раствора мРНК IVT и смешанного раствора T704-sPep, могут отличаться от параметров, отображаемых в текущем протоколе, если используется какая-то другая установка, и должны быть соответствующим образом оптимизированы.
3. Измерение гидродинамического диаметра и полидисперсности ИВТ-мРНК/ПП-sNp
- Разбавляют аликвоту раствора IVT мРНК/PP-sNp (стадия 2) NF-водой для получения конечного объема 1 мл.
- Измерьте гидродинамический размер и индекс полидисперсности (PDI) с помощью полумикрокуэты25. Добавьте раствор IVT mRNA/PP-sNp в кювету и поместите его в измеритель размера частиц (см. Таблицу материалов). Настройте стандартную операционную процедуру и нажмите кнопку Пуск , чтобы начать сбор данных.
4. Подготовка клеток к трансфекции
- Пластинчатые эпителиальные клетки бронхов человека (16HBE) и дендритная клеточная линия (DC2.4) в 96-луночных пластинах при плотности 3,5 х 104 клеток/лунка за 24 ч до трансфекции. Выращивайте клетки в культуральной среде, дополненной 10% инактивированной теплом фетальной бычьей сывороткой и 1% пенициллином/стрептомицином.
ПРИМЕЧАНИЕ: Ячейки были получены из коммерческого источника (см. Таблицу материалов). - Инкубируйте клетки в инкубаторе (37 °C и 5% CO2 атмосферы) в течение 24 ч, чтобы убедиться, что клетки на 60%-80% состоят из сливок перед трансфекцией.
5. Трансфекция культивируемых клеток
- После удаления питательной среды промыть покрытые клетки 0,2 мл/1x PBS.
- Добавьте 170 мкл безсывороточной питательной среды к каждой лунке, содержащей покрытые клеточные культуры.
- Добавьте препарат IVT mRNA/PP-sNp, содержащий 0,4 мкг мРНК MetLuc (полученный на стадии 2) по каплям с количеством 30 мкл/лунка.
- Инкубируют клетки с препаратом IVT mRNA/PP-sNp при 37 °C в увлажненной 5% обогащеннойCO2 атмосфере в течение 4 ч.
- Заменить трансфекционную среду 0,2 мл свежей питательной среды, дополненной 10% термоинактивированной фетальной бычьей сывороткой и 1% (v/v) пенициллином/стрептомицином.
ПРИМЕЧАНИЕ: Фетальную бычью сыворотку нагревали при 56 °C в течение 30 мин для инактивации. - Инкубируют трансфектированные клетки при 37 °C и в 5% обогащеннойCO2 атмосфере в течение 24 ч и собирают супернатанты для обнаружения из каждой скважины.
6. Анализ эффективности трансфекции клеток с использованием анализа Metridia luciferase (MetLuc)
- Проанализ супернатанта из каждой скважины на активность MetLuc с использованием субстрата целентеразина (см. Таблицу материалов), следуя приведенным ниже шагам.
- Готовят свежий пробирный раствор, добавляя 1x PBS к субстрату коэлентеразина (концентрация коэлентеразина составляет 15 мМ).
- Вихрь раствора целентеразина в течение 10 с для тщательного перемешивания.
- Добавьте 50 мкл надосадочного вещества (собранного на этапе 5) в 96-луночную пластину.
- Настройте считыватель микропластин (см. Таблицу материалов) со временем считывания 1000 мс перед добавлением 30 мкл раствора коэлентеразина (15 мМ) в каждую скважину вручную или путем автоматической закачки.
- Нажмите кнопку Начать , чтобы измерить сигнал люминесценции сразу после добавления раствора коэлентеразина к супернатанту.
ПРИМЕЧАНИЕ: Сигнал люминесценции измеряется с помощью считывателя микропластин, а его активность выражается в относительных световых единицах. Значения, полученные из PBS-трансфектированных скважин, будут использоваться в качестве пустых элементов управления.
Результаты
Рекомбинантную плазмиду переваривали с образованием линеаризованного шаблона ДНК (рисунок 2А). Используя описанный протокол, набор транскрипции T7 in vitro может производить до 80-120 мкг неограниченной MetLuc-мРНК на реакцию 20 мкл и 50-60 мкг закрытой MetLuc-мРНК на реакцию 100 мкл. При анализе с помощью электрофореза интактная MetLuc-мРНК с высоким качеством должна показывать единую и четкую полосу, как показано на рисунке 2B. Загрязняющие вещества, вводимые в реакцию из шаблона ДНК, могут привести к деградации РНК и снижению выхода.
PP-sNp, содержащие MetLuc-мРНК (MetLuc-mRNA/PP-sNp), получали с использованием метода микрофлюидного смешивания (рисунок 1). В таблице 1 приведены данные о физико-химической характеристике MetLuc-мРНК/PP-sNp в качестве примеров. Гидродинамический радиус MetLuc-mRNA/PP-sNp можно считать правильным, если он колеблется около 70-100 нм. Кроме того, PDI PP-sNp должен быть постоянным и предпочтительно ниже 0,2, но принимаются значения PDI примерно до 0,3.
После успешного включения MetLuc-мРНК в PP-sNp препарат может быть инкубирован с клетками 16HBE и дендритной клеточной линией (DC2.4), а эффективность трансфекции MetLuc-мРНК может быть обозначена активностью люциферазы в супернатанте клеточной культуры через 24 ч после трансфекции. Рисунок 3 является типичным примером успешной трансфекции MetLuc-мРНК/PP-sNp. Можно ясно видеть, что клетки, трансфектированные MetLuc-mRNA/PP-sNp, демонстрировали значительно более высокую экспрессию люциферазы по сравнению с клетками, трансфектированными коммерчески доступным трансфективным регентом на основе липидов (LP) (см. Таблицу материалов), голой MetLuc-мРНК (отрицательный контроль), PBS (пустой контроль) или смешанным раствором T704-sPep (имитация контроля) в клетках 16HBE. MetLuc-mRNA/PP-sNp также показали более высокую экспрессию люциферазы по сравнению с LP. Данные свидетельствуют о том, что система доставки PP-sNp важна для защиты MetLuc-мРНК от деградации и для повышения эффективности трансфекции экзогенной MetLuc-мРНК. Поэтому системы доставки, такие как PP-sNp, как правило, необходимы для исследований трансфекции мРНК IVT.
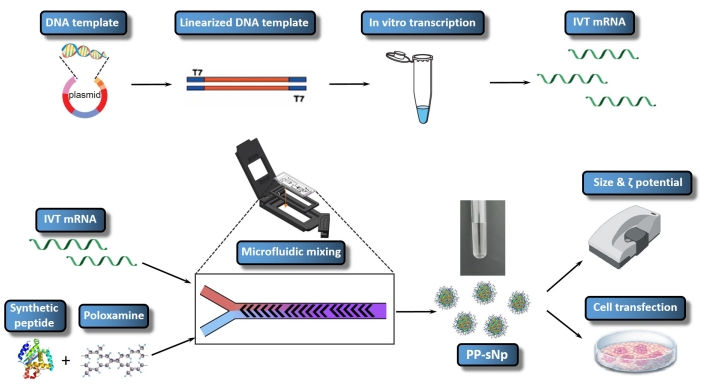
Рисунок 1: Схематическое представление всего рабочего процесса IVT mRNA/PP-sNp. Шаблон ДНК связан с плазмидой рекомбинантной плазмидной конструкцией. Линеаризованный шаблон ДНК собирается с помощью переваривания фермента рестрикции. Транскрибированная мРНК in vitro (мРНК IVT) синтезируется и закрывается из линеаризованного шаблона ДНК. Раствор T704-sPep содержит T704 и синтетический пептид (sPep), в то время как раствор мРНК IVT содержит MetLuc-мРНК. Смешанные растворы мРНК IVT и T704-sPep смешивают с использованием микрофлюидного миксера, который образует MetLuc-мРНК/PP-sNp. Далее проводится характеристика MetLuc-mRNA/PP-sNp для определения размера частиц и полидисперсности с помощью Zetasizer. Клетки 16HBE трансфектируются MetLuc-mRNA/PP-sNp, и активность люциферазы в супернатанте измеряется для оценки эффективности трансфекции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Производство MetLuc-мРНК. (A) Шаблон ДНК содержит промотор полимеразы T7, 5'нетраслабированную область (UTR), открытую рамку считывания (ORF) MetLuc, 3'UTR и поли (A) хвосты. (B) Обнаружение электрофореза. Белая стрелка указывает на рекомбинантную плазмиду. Желтая стрелка указывает на вектор PUC57. Красная стрелка указывает на шаблон ДНК для транскрипции MetLuc-mRNA in vitro . Зеленая стрелка указывает на неограниченную МетЛюк-мРНК. Синяя стрелка указывает на замкнутую МетЛюк-мРНК. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Эффективность трансфекции MetLuc-mRNA/PP-sNp в клетках 16HBE и DC2.4. MetLuc-мРНК трансфектировали с использованием PP-sNp в (A) клетках 16HBE и (B) дендритной клеточной линии (DC2.4). Конечная концентрация MetLuc-мРНК составляла 0,02 мкг/мкл, sPep - 0,139 мкг/мкл, а T704 - 2 мкг/мкл в PP-sNp. Коммерческий трансфекционный регент на основе липидов (LP) был принят в качестве положительного контроля. Активность люциферазы измеряли через 24 ч после трансфекции. Образец, обработанный PBS, был принят в качестве пустого элемента управления. Смешанное решение T704-sPep было принято в качестве имитации управления. Статистические различия анализировали с помощью T-теста Студента (nsp ≥ 0,05, * p < 0,05). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| МРНК ИВТ | Н/(sPep) | ж/д (T704) | Размер (нм) | ПдИ | Зета |
| 17,5 нг/мкл | 5 | 100 | 85.12 ± 9.40 | 0.20 ± 0.07 | -13.07 ± 0.47 |
Таблица 1: Данные физико-химической характеристики MetLuc-мРНК/PP-sNp.
Дополнительный рисунок 1: Установка собственного подготовленного микрофлюидного устройства, используемого в текущем исследовании. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: Кодирующая последовательность шаблона ДНК. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Протокол, описанный здесь, не только позволяет экономически эффективно и быстро производить составы вакцины мРНК IVT с определенными свойствами, но также предлагает возможность настройки состава PP-sNp в соответствии с конкретными терапевтическими целями, такими как генная терапия. Чтобы обеспечить успешную генерацию IVT mRNA/PP-sNp, предлагается уделить дополнительное внимание некоторым критическим шагам. При работе с мРНК всегда помните, что условия, свободные от РНКазы, должны поддерживаться на протяжении всего процесса, потому что мРНК IVT очень чувствительна в отношении деградации РНКазой, даже если мРНК IVT была получена с химической модификацией. Между тем, при хранении составов также должна быть обеспечена среда, свободная от РНКазы. Рекомендуется хранить IVT мРНК/PP-sNp при 2-8 °C до 1 недели. Представленные результаты показывают, что безнуклеазная вода эффективна при успешном формировании PP-sNp с высокой эффективностью трансфекции. При желании можно использовать другие буферы, такие как PBS, физиологический раствор, OptiMEM и т. Д. Рекомендуется выполнять трансфекции in vitro с использованием IVT mRNA/PP-sNp в среде OptiMEM для обеспечения жизнеспособности культивируемых клеток. Если для приготовления препарата выбрана другая буферная, а не безнуклеазная вода, важно использовать мРНК IVT с низкой концентрацией (ниже 100 нг/мл); в противном случае наночастицы имеют тенденцию выпадать в осадок, что, в свою очередь, делает недействительной формулировку. Причиной этого явления является катионный фрагмент внутри синтетического пептида. Кроме того, сильная положительная плотность заряда наночастицы может дестабилизировать клеточную мембрану, тем самым вызывая значительную цитотоксичность. Тем не менее, в предыдущем исследовании было продемонстрировано, что положительный заряд в PP-sNp необходим для опосредования эффективного поглощения клеток мРНК IVT, выхода эндосомы и успешной трансфекции23. В результате важно отрегулировать положительный заряд внутри PP-sNp, чтобы достичь тонкого баланса с точки зрения эффективности и токсичности.
Представленный протокол может быть применен к различным составам на основе PP-sNp с некоторыми изменениями параметров. Для доставки вакцин на основе мРНК IVT биофизические свойства, такие как размер частиц и индекс полидисперсности, имеют решающее значение для эффективности трансфекции и иммуногенности подготовленных наночастиц26. Размер частиц мРНК/PP-sNp IVT в нанометровой шкале обеспечивает эффективный перенос через физиологические барьеры и, таким образом, важен для последующих применений in vivo. Сообщалось, что LNP в диапазоне размеров 60-150 нм производят надежные иммунные реакции у нечеловеческих приматов26. С другой стороны, наночастицы большого размера (например, 400-1000 нм) не могли преодолеть барьер слизи дыхательных путей при применении для легочной доставки, поскольку, как показали предыдущие исследования, среднее расстояние между 3-мерными сетками пор сетки дыхательных путей колеблется примерно от 60-300 нм27,28. Если желаемый размер или эффективность трансфекции не достигнуты, некоторые советы по началу поиска и устранения неисправностей включают регулировку количества используемых компонентов полокамина или синтетических пептидов. Предыдущее исследование показало, что дополнительные параметры, такие как количество мРНК IVT, используемой для трансфекции, время инкубации, а также типы и плотность клеток культивируемых клеток, также могут значительно влиять на результат трансфекции23. Более того, поскольку целевой фрагмент в PP-sNp позволяет специфическую доставку инкапсулированной мРНК IVT в клетки, отображающие родственные рецепторы, замена альтернативными лигандами-мишенью может быть необходима, если клетки-мишени трансфектированы другими типами, а не клетками, связанными с дыхательными путями. В целом, протокол все еще может быть улучшен с более подробным пониманием и дальнейшим изучением.
Учитывая, что оригинальная IVT мРНК/PP-sNp получается первоначально путем прямого ручного перемешивания, способности оператора играют важную роль в контроле качества препарата. Модификации в процессе смешивания мРНК IVT с компонентами PP-sNp могут привести к образованию крупных микрочастиц, а не наноразмерных частиц. Самым сложным этапом является смешивание мРНК и синтетического пептида, что должно быть сделано контролируемым образом. Для улучшения воспроизводимости между различными партиями состава IVT mRNA/PP-sNp был принят микрофлюидный смеситель, поскольку малообъемный скрининг, высокая скорость и воспроизводимость являются важными особенностями использования микрофлюидного метода29. Этот метод показал хорошую воспроизводимость, без существенного влияния на размер частиц или эффективность трансфекции, наблюдаемую среди различных партий. Это важный критерий для применения вакцин на основе мРНК IVT в клинических приложениях. В частности, микрофлюидный смеситель не должен превышать максимальное количество пользователей (рекомендованное производителем) и должен меняться между составами с различными составами.
Протокол транскрипции мРНК IVT, описанный в этом протоколе, теоретически может быть использован для получения любого репортерного белка / антигена, представляющего интерес. Metridia luciferase (MetLuc) была специально применена в этом исследовании, потому что она обладает уникальными преимуществами. Анализ активности MetLuc легко выполнить с высокой чувствительностью, потому что MetLuc может производить интенсивный биолюминесцентный сигнал, и он может быть непосредственно секретирован в клеточную среду, что позволяет избежать необходимости лизиса клеток. Важно отметить, что на экспрессию MetLuc в культивируемых клетках могут влиять многие параметры (например, изменение числа клеток в лунке и ошибки дозирования и т. Д.), Отличные от функциональности самой MetLuc-мРНК.
Хотя текущий протокол был создан для доставки мРНК-вакцины IVT, он также может быть реализован для вакцин или терапевтических средств, основанных на других типах нуклеиновых кислот, таких как плазмидная ДНК (пДНК). Этот процесс может быть адаптирован к синтетическим пептидам, нуклеиновым кислотам и изменениям компонентов полокамина для разработки конкретного PP-sNp для различных клинических показаний. Действительно, интеграция генома экзогенного трансмембранного регулятора трансмембранной трансдукции муковисцидоза (CFTR) в дыхательную эпителиальную ткань нокаутирующих мышей CFTR с использованием инструмента генетической модификации Sleeping Beauty, доставленного PP-sNp23, была успешно достигнута. Что касается терапевтического применения, составы IVT mRNA/PP-sNp могут быть использованы в качестве аэрозоля с использованием специальных устройств распыления для лечения легочных заболеваний, таких как дефицит α1-антитрипсина или муковисцидоз30. Однако стоит отметить, что составы IVT mRNA/PP-sNp для распыления должны быть оптимизированы и настроены, так как аэрозольная мРНК IVT может быть неэффективной из-за силы сдвига, создаваемой небулайзером, и хрупкой природы IVT мРНК30. Кроме того, протокол, возможно, масштабируется на большие объемы с использованием различных микрофлюидных смесительных устройств, таких как устройства смешивания Т-образных переходов и даже смесительные насосы31,32.
Таким образом, протокол, подробно описанный здесь, вводит воспроизводимый метод формулирования мРНК IVT в системе доставки PP-sNp, а также последующую надежную трансфекцию в культивируемых клетках. Описанный способ гарантирует доступный и простой подход к получению IVT мРНК/PP-sNp с использованием микрофлюидного миксера. Приготовленные составы с малыми размерами частиц и низким полидисперсным индексом впоследствии могут быть применены к безопасной и эффективной трансфекции культивируемых клеток. Этот протокол позволит системе доставки на основе PP-sNp стать доступной для академического сообщества для разработки новых вакцин или терапевтических средств на основе мРНК IVT, избегая при этом всех упомянутых недостатков. Ожидается, что благодаря гибким профилям PP-sNp будут достигнуты многочисленные будущие применения PP-sNp для создания различных терапевтических средств для лечения различных заболеваний.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (NSFC, грант No 82041045 и 82173764), крупным проектом «Исследование системы технологий патогенеза и профилактики эпидемий» (2021YFC2302500) Министерства науки и технологий Китая, проектом «Чунцинские таланты: исключительные молодые таланты» (CQYC202005027) и Фондом естественных наук Чунцина (cstc2021jcyj-msxmX0136). Авторы благодарны доктору Сяоянь Дину за измерение гидродинамического диаметра (нм) и индекса полидисперсности (PDI).
Материалы
| Name | Company | Catalog Number | Comments |
| BamHI | Takara | 1010 | |
| cap 1 capping system | Jinan | M082 | |
| Dendritic cell-line | Sigma | SCC142 | |
| DNA sequence | Genescript | ||
| Human bronchial epithelial cells | Sigma | SCC150 | |
| KpnI | Takara | 1068 | |
| LP | Beyotime | C0533 | |
| Lithium chloride | APEXBio | B6083 | |
| Malvern Zetasizer Nano ZS90 | Malvern | NB007605 | |
| Microfluidic chip | ZHONGXINQIHENG | Standard PDMS chip | |
| Microplate readers | ThermoFisher | Varioskan lux | |
| NanoDrop One | ThermoFisher | ND-ONE-W (A30221) | |
| Nuclease-free water | ThermoFisher | AM9932 | |
| OptiMEM | Gibco | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Pseudouridine | APE×Bio | B7972 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| Quanti-Luc | InvivoGen | Rep-qlc2 | |
| RiboRuler High Range RNA Ladder | ThermoFisher | SM1821 | |
| RNase-free conical tube | Biosharp | BS-100-M | |
| RPMI Medium 1640 | ThermoFisher | C11875500BT | |
| Syringe pump | Chemyx | Fusion 101 | |
| T7 transcription Kit | Jinan | E131 |
Ссылки
- Nature milestones in vaccines. Springer Nature Available from: https://www.nature.com/collections/hcajdiajij (2020)
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 40 (6), 840-854 (2022).
- Mulligan, M. J., et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586 (7830), 589-593 (2020).
- Tang, J., et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa. Nanomaterials. 12 (2), 226 (2022).
- Freyn, A. W., et al. A multi-targeting, nucleoside-modified mRNA influenza virus vaccine provides broad protection in mice. Molecular Therapy. 28 (7), 1569-1584 (2020).
- Wu, K., et al. Variant SARS-CoV-2 mRNA vaccines confer broad neutralization as primary or booster series in mice. Vaccine. 39 (51), 7394-7400 (2021).
- Chaudhary, N., Weissman, D., Whitehead, K. A. mRNA vaccines for infectious diseases: Principles, delivery and clinical translation. Nature Reviews Drug Discovery. 20, 817-838 (2021).
- Kormann, M. S. D., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature Biotechnology. 29 (2), 154-157 (2011).
- Tavernier, G., et al. mRNA as gene therapeutic: How to control protein expression. Journal of Controlled Release. 150 (3), 238-247 (2011).
- Walsh, E. E., et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. The New England Journal of Medicine. 383 (25), 2439-2450 (2020).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine. 384 (5), 403-416 (2021).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Sharova, L. V., et al. Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells. DNA Research. 16 (1), 45-58 (2009).
- Houseley, J., Tollervey, D. The many pathways of RNA degradation. Cell. 136 (4), 763-776 (2009).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13, 359-380 (2014).
- Hajj, K. A., Whitehead, K. A. Tools for translation: Non-viral materials for therapeutic mRNA delivery. Nature Reviews Materials. 2, 17056 (2017).
- Deering, R. P., Kommareddy, S., Ulmer, J. B., Brito, L. A., Geall, A. J. Nucleic acid vaccines: Prospects for non-viral delivery of mRNA vaccines. Expert Opinion on Drug Delivery. 11 (6), 885-899 (2014).
- Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C., Thakur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics. 12 (2), 102 (2020).
- Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nature Reviews Materials. 6 (12), 1078-1094 (2021).
- Sahin, U., et al. COVID-19 vaccine BNT162b1 elicits human antibody and T(H)1 T cell responses. Nature. 586 (7830), 594-599 (2020).
- Azzi, L., et al. Mucosal immune response in BNT162b2 COVID-19 vaccine recipients. EBioMedicine. 75, 103788 (2022).
- Guan, S., et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis. Nature Nanotechnology. 14 (3), 287-297 (2019).
- Pitard, B., et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Research. 32 (20), 159 (2004).
- Hiroi, T., Shibayama, M. Measurement of particle size distribution in turbid solutions by dynamic light scattering microscopy. Journal of Visualized Experiments. (119), e54885 (2017).
- Hassett, K. J., et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. Journal of Controlled Release. 335, 237-246 (2021).
- Suk, J. S., et al. The penetration of fresh undiluted sputum expectorated by cystic fibrosis patients by non-adhesive polymer nanoparticles. Biomaterials. 30 (13), 2591-2597 (2009).
- Kim, N., Duncan, G. A., Hanes, J., Suk, J. S. Barriers to inhaled gene therapy of obstructive lung diseases: A review. Journal of Controlled Release. 240, 465-488 (2016).
- Liu, Z., Fontana, F., Python, A., Hirvonen, J. T., Santos, H. A. Microfluidics for production of particles: Mechanism, methodology, and applications. Small. 16 (9), 1904673 (2020).
- Guan, S., Darmstädter, M., Xu, C., Rosenecker, J. In vitro investigations on optimizing and nebulization of IVT-mRNA formulations for potential pulmonary-based alpha-1-antitrypsin deficiency treatment. Pharmaceutics. 13 (8), 1281 (2021).
- Shepherd, S. J., Issadore, D., Mitchell, M. J. Microfluidic formulation of nanoparticles for biomedical applications. Biomaterials. 274, 120826 (2021).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены