Method Article
טרנספקציה יעילה של mRNA מתועתק במבחנה בתאים בתרבית באמצעות ננו-חלקיקים פפטיד-פולוקסאמין
* These authors contributed equally
In This Article
Summary
ננו-חלקיק פפטיד-פולוקסאמין בהרכבה עצמית (PP-sNp) פותח באמצעות מכשיר ערבוב מיקרופלואידי כדי לתמצת ולהעביר רנ"א שליח מתועתק במבחנה . ה-mRNA/PP-sNp המתואר יכול להעביר ביעילות תאים בתרבית במבחנה.
Abstract
חיסוני RNA שליח מתועתקים במבחנה (mRNA) הציגו פוטנציאל עצום במאבק במגפת הקורונה 2019 (COVID-19). מערכות אספקה יעילות ובטוחות חייבות להיכלל בחיסוני ה-mRNA בשל התכונות השבריריות של mRNA. מערכת העברת גנים של ננו-חלקיקי פפטיד-פולוקסאמין (PP-sNp) בהרכבה עצמית תוכננה במיוחד להעברה ריאתית של חומצות גרעין ומציגה יכולות מבטיחות בתיווך העברה מוצלחת של mRNA. כאן מתוארת שיטה משופרת להכנת PP-sNp כדי לפרט כיצד ה-PP-sNp עוטף את ה-mRNA של Metridia luciferase (MetLuc) ומעביר בהצלחה תאים בתרבית. MetLuc-mRNA מתקבל על ידי תהליך שעתוק במבחנה מתבנית DNA ליניארית. PP-sNp מיוצר על ידי ערבוב פפטיד/פולוקסאמין סינתטי עם תמיסת mRNA באמצעות מערבל מיקרופלואידי, המאפשר הרכבה עצמית של PP-sNp. המטען של PP-sNp מוערך לאחר מכן על ידי מדידת פוטנציאל הזטה. בינתיים, הפולידיספריות והגודל ההידרודינמי של ננו-חלקיקי PP-sNp נמדדים באמצעות פיזור אור דינמי. הננו-חלקיקים mRNA/PP-sNp מועברים לתאים בתרבית, וסופרנאטנטים מתרבית התאים נבדקים לפעילות לוציפראז. התוצאות המייצגות מדגימות את יכולתן להעברה חוץ-גופית. פרוטוקול זה עשוי לשפוך אור על פיתוח מערכות אספקת חיסוני mRNA מהדור הבא.
Introduction
החיסון הוכרז כאחת ההתערבויות הרפואיות היעילות ביותר להפחתת התחלואה והתמותה הנגרמות ממחלות זיהומיות1. חשיבות החיסונים הוכחה מאז פרוץ מחלת הקורונה 2019 (COVID-19). בניגוד לתפיסה המסורתית של הזרקת פתוגנים מומתים או מוחלשים, גישות חיסונים מתקדמות, כגון חיסונים מבוססי חומצות גרעין, מתרכזות בשימור התכונות הממריצות את מערכת החיסון של פתוגני המטרה תוך הימנעות מבעיות הבטיחות הפוטנציאליות הקשורות לנגיף המיקרוביאלי השלם הקונבנציונלי - או בחיסונים מבוססי חיידקים. הן חיסונים מבוססי דנ"א והן רנ"א (כלומר, רנ"א שליח מתועתק במבחנה, IVT mRNA) מציגים פוטנציאל מניעתי עד טיפולי נגד מגוון מחלות, כולל מחלות זיהומיות וסרטן 2,3. באופן עקרוני, הפוטנציאל של חיסונים מבוססי חומצות גרעין קשור לייצורם, יעילותם ובטיחותם4. חיסונים אלה יכולים להיות מיוצרים באופן ללא תאים כדי לאפשר ייצור חסכוני, מדרגי ומהיר.
חיסון יחיד המבוסס על חומצות גרעין יכול לקודד אנטיגנים מרובים, מה שמאפשר מטרה לווריאנטים נגיפיים רבים או חיידקים עם מספר מופחת של חיסונים ולחזק את התגובה החיסונית נגד פתוגנים עמידים 5,6. חוץ מזה, חיסונים המבוססים על חומצות גרעין יכולים לחקות את תהליך הפלישה הטבעי של זיהום נגיפי או חיידקי, ולהביא הן לתגובות חיסוניות בתיווך תאי B והן בתאי T. בניגוד לחלק מהחיסונים מבוססי הנגיפים או הדנ"א, חיסונים מבוססי IVT mRNA מציעים יתרון עצום מבחינת בטיחות. הם יכולים לבטא במהירות את האנטיגן הרצוי בציטוזול ואינם משולבים בגנום המארח, מה שמייתר את החששות לגבי מוטגנזה החדרתית7. IVT-mRNA מתפרק באופן אוטומטי לאחר תרגום מוצלח, כך שניתן לשלוט בקלות בקינטיקה של ביטוי החלבון שלו 8,9. על ידי מגיפת נגיף הקורונה 2 (SARS-CoV-2) של תסמונת נשימתית חריפה חמורה, מאמצים של חברות/מוסדות ברחבי העולם אפשרו שחרור לשוק של סוגים רבים של חיסונים. טכנולוגיית חיסון מבוססת mRNA IVT מראה פוטנציאל גדול, ולראשונה, הוכיחה את הצלחתה הצפויה בעבר, הודות לתכנון המהיר שלה ויכולתה הגמישה להסתגל לכל אנטיגן מטרה תוך מספר חודשים. ההצלחה של חיסוני mRNA IVT נגד COVID-19 ביישומים קליניים לא רק פתחה עידן חדש של מחקר ופיתוח חיסוני mRNA IVT, אלא גם צברה ניסיון רב ערך לפיתוח מהיר של חיסונים יעילים להתמודדות עם התפרצויות של מחלות זיהומיות10,11.
למרות הפוטנציאל המבטיח של חיסוני mRNA IVT, ההעברה התוך-תאית היעילה של mRNA IVT לאתר הפעולה (כלומר, ציטופלסמה) ממשיכה להוות מכשול גדול12, במיוחד עבור אלה הניתנים דרך דרכי הנשימה4. IVT mRNA היא מטבעה מולקולה לא יציבה עם זמן מחצית חיים קצר ביותר (~7 שעות)13, מה שהופך את ה-IVT mRNA לנוטה מאוד להתפרקות על ידי RNase14 הנמצא בכל מקום. הלימפוציטים של מערכת החיסון המולדת נוטים לבלוע את ה- mRNA המוכר של IVT במקרים של יישום in vivo . יתר על כן, צפיפות המטען השלילי הגבוהה והמשקל המולקולרי הגדול (1 x 104-1 x 106 Da) של mRNA IVT פוגעים בחדירתו היעילה על פני דו-שכבת השומנים האניונית של קרומי התאים15. לכן, נדרשת מערכת אספקה עם חומרים ביו-פונקציונליים מסוימים כדי לעכב את הפירוק של מולקולות ה-mRNA של IVT ולהקל על ספיגת התאים16.
מלבד כמה מקרים חריגים שבהם נעשה שימוש ישיר ב-mRNA IVT עירום לחקירות in vivo, נעשה שימוש במערכות אספקה שונות כדי לשאת את ה-IVT mRNA לאתר הטיפולי של פעולה17,18. מחקרים קודמים גילו כי רק כמה mRNA IVT מזוהים בציטוזול ללא סיוע של מערכת אספקה19. אסטרטגיות רבות פותחו כדי לשפר את אספקת ה-RNA במאמצים מתמשכים בתחום, החל מעיבוי פרוטמין ועד אנקפסולציה של שומנים20. ננו-חלקיקי ליפידים (LNPs) הם המתקדמים ביותר מבחינה קלינית מבין כלי ההעברה של mRNA, כפי שמוכיחה העובדה שכל חיסוני ה-mRNA COVID-19 המאושרים לשימוש קליני משתמשים במערכות אספקה מבוססות LNP21. עם זאת, LNPs אינם יכולים לתווך טרנספקציה יעילה של mRNA כאשר הפורמולציות מועברות דרך נתיב הנשימה22, מה שמגביל באופן מדהים את היישום של פורמולציות אלה בגרימת תגובות חיסוניות של הרירית או בטיפול במחלות הקשורות לריאתיות כגון סיסטיק פיברוזיס או מחסור ב-α1-antitrypsin. לכן, פיתוח מערכת אספקה חדשנית כדי להקל על אספקה יעילה והעברה של mRNA IVT בתאים הקשורים לדרכי הנשימה נדרש כדי לפתור את הצורך הבלתי מסופק הזה.
אושר כי מערכת העברת הננו-חלקיקים בהרכבה עצמית של פפטיד-פולוקסאמין (PP-sNp) יכולה לתווך את ההעברה היעילה של חומצות גרעין בדרכי הנשימה של עכברים23. PP-sNp מאמצת גישת תכנון מודולרי רב-תכליתית, שיכולה לשלב מודולים פונקציונליים שונים בננו-חלקיקים לצורך סינון ואופטימיזציה מהירים23. הפפטידים הסינתטיים וקופולימרים של בלוקים אמפיפיליים ניטרליים חשמלית (פולוקסאמין) בתוך PP-sNp יכולים לקיים אינטראקציה ספונטנית עם mRNA IVT כדי ליצור ננו-חלקיקים המפוזרים באופן אחיד עם מבנה קומפקטי ומשטח חלק23. PP-sNp יכול לשפר את השפעת הטרנספקציה הגנטית של מולקולות mRNA IVT בתאים בתרבית ובדרכי הנשימה של עכברים23. המחקר הנוכחי מתאר פרוטוקול ליצירת PP-sNp המכיל mRNA IVT המקודד את Metridia luciferase (MetLuc-mRNA) (איור 1). בפרוטוקול זה נעשה שימוש בערבוב מבוקר ומהיר באמצעות מכשיר ערבוב מיקרופלואידי, המשתמש בעיצוב ערבוב עצמות הרינג המדשדש. ההליך קל לביצוע ומאפשר יצירת PP-sNp בגדלים אחידים יותר. המטרה הכללית של ייצור PP-sNp באמצעות מערבל מיקרופלואידי היא ליצור PP-sNp עבור קומפלקס mRNA באופן מבוקר היטב, ובכך לאפשר טרנספקציה יעילה וניתנת לשחזור של תאים במבחנה. הפרוטוקול הנוכחי מתאר את ההכנה, ההרכבה והאפיון של PP-sNp המכיל MetLuc-mRNA.
Protocol
1. שעתוק חוץ גופי של mRNA שעבר שינוי כימי
הערה: זה נדרש להשתמש צינורות ללא נוקלאז, ריאגנטים, כלי זכוכית, טיפים פיפטה, וכו ', כי RNases נמצאים בכל מקום בסביבה, כגון פתרונות מעבדה, משטחי מכשיר, שיער, עור, אבק, וכו ' נקו היטב את משטחי הספסל והפיפטות לפני השימוש, ולבשו כפפות כדי למנוע זיהום RNase.
- בצע ליניאריזציה של תבנית הדנ"א.
- סנתז את מסגרת הקריאה הפתוחה (ORF) של Metridia luciferase (MetLuc) שלצדה מקדם פולימראז T7, אזור לא מתורגם 5' (UTR), 3'UTR וזנבות פולי (A) ושכפל אותה לווקטור PUC57, המתבטא בחיידקים (ראו טבלת חומרים).
הערה: רצף הקידוד של תבנית הדנ"א מסופק בקובץ משלים 1. - תרבית חיידקים, lyse את החיידקים, ולטהר את הדנ"א פלסמיד על ידי העמודה המתאימה (ראה ערכת מיצוי DNA פלסמיד בטבלת החומרים).
- בצע תגובה יחידה של 50 μL המכילה 2 μL של BamHI, 2 μL של KpnI (ראה טבלת חומרים), ו-2 מיקרוגרם של דנ"א פלסמיד ב-37 °C למשך שעה אחת, והשג ליניאריזציה של תבנית הדנ"א.
- סנתז את מסגרת הקריאה הפתוחה (ORF) של Metridia luciferase (MetLuc) שלצדה מקדם פולימראז T7, אזור לא מתורגם 5' (UTR), 3'UTR וזנבות פולי (A) ושכפל אותה לווקטור PUC57, המתבטא בחיידקים (ראו טבלת חומרים).
- בצע שעתוק במבחנה כדי ליצור mRNA ללא כיסוי-IVT.
- בצע סינתזת mRNA על ידי תגובה יחידה של 20 μL באמצעות ערכת שעתוק T7 ופסאודורידין (ראה טבלת חומרים): 10 μL (0.8-1 מיקרוגרם) של תבנית DNA ליניארית, 1.5 μL (150 mM) של ATP, פסאודו-UTP, GTP ו- CTP, 2 μL של מאגר שעתוק 10x, 1 μL של אנזים T7, ו- 1 μL של מים נטולי נוקלאז (NF-water). מערבבים היטב את הרכיבים שהוזכרו לעיל ודוגרים בטמפרטורה של 37 מעלות צלזיוס למשך 3 שעות.
- הסר את הדנ"א של התבנית.
- יש להוסיף 1 μL (1 U) של DNase (ללא RNase) לאחר תהליך השעתוק ולדגירה בטמפרטורה של 37°C למשך 15 דקות.
- בצע טיהור mRNA ללא כיסוי-IVT באמצעות משקעי ליתיום כלוריד.
- טהר את ה-mRNA ללא כיסוי IVT באמצעות ליתיום כלוריד (ראו טבלת חומרים) בריכוז תקין של 10 mM. הוסף 50 μL של 10 mM ליתיום כלוריד ל 20 μL של תמיסת mRNA ללא כיסוי-IVT.
- מערבבים היטב את הנפח המלא ומצננים בטמפרטורה של −20°C למשך שעה אחת. אסוף את ה-mRNA ללא כיסוי-IVT למשך 12 דקות ב-12,000 x גרם, אשר מייצר באופן שגרתי 80-120 מיקרוגרם של mRNA ללא כיסוי-IVT מכל תגובה בודדת של 20 μL.
- בצע לכידת mRNA IVT.
- בצע את מכסה ה-mRNA של IVT באמצעות מערכת המכסה של מכסה 1 (ראה טבלת חומרים). בקצרה, הסר את המבנה המשני של 50 מיקרוגרם של mRNA uncapped-IVT על ידי חימום ב 65 °C למשך 10 דקות, ולאחר מכן קשר את הקצה 5' של mRNA uncapped-IVT עם מכסה 1, אשר מוכן על ידי שינוי מבנה מכסה m7G באמצעות 2.5 μL של s-אדנוזילמתיונין (SAM) (20 mM) ו 4 μL של 2'-O-מתיל-טרנספראז (100 U) בתגובה 100 μL ב 37 °C במשך 30-60 דקות.
- יש לטהר 100 μL של ה-IVT mRNA המכוסה באמצעות 250 μL של 10 mM ליתיום כלוריד ולדלל ב-50 μL של NF-מים.
- קבע את הטוהר והגודל המולקולרי של mRNA capped-IVT.
- מדוד את הריכוז של mRNA capped-IVT באמצעות ספקטרופוטומטר הנראה לעין UV. באמצעות סמן RNA (ראו טבלת חומרים), נתחו את הגודל המולקולרי של mRNA capped-IVT בג'ל אגרוז פורמלדהיד 1% המכיל 18% פורמלדהיד (המתח הוא 120 וולט). ודא שה-mRNA וה-mRNA של ה-capped-IVT מאוחסנים בטמפרטורה של −80 °C.
הערה: ה-mRNA של IVT נחשב לבעל טוהר טוב ביחס A260/A280 של 1.8-2.1 וביחס A260/A230 של 2.0 או מעט גבוה יותר.
- מדוד את הריכוז של mRNA capped-IVT באמצעות ספקטרופוטומטר הנראה לעין UV. באמצעות סמן RNA (ראו טבלת חומרים), נתחו את הגודל המולקולרי של mRNA capped-IVT בג'ל אגרוז פורמלדהיד 1% המכיל 18% פורמלדהיד (המתח הוא 120 וולט). ודא שה-mRNA וה-mRNA של ה-capped-IVT מאוחסנים בטמפרטורה של −80 °C.
2. יצירת mRNA/PP-sNp של IVT
- הכינו את תמיסת המלאי של פולוקסאמין 704 (T704) על ידי סילוק T704 (ראו טבלת חומרים) ב-NF-מים כדי לקבל תמיסת מלאי של 10 מ"ג/מ"ל. אחסן את התמיסה המוכנה בטמפרטורה של 4 מעלות צלזיוס.
הערה: T704 מכיל מבנה בצורת X העשוי מקבוצה מרכזית של אתילנדיאמין המחוברת לארבע שרשראות של בלוקים פולי(פרופילן אוקסיד) (PPO) ובלוקים פולי(אתילן אוקסיד) (PEO)24. המשקל המולקולרי (Mw) של T704 הוא 5500. - הכינו את תמיסת המניות של הפפטיד הסינתטי (sPep, ראו טבלת חומרים) על ידי הריסת ה-sPep (רצף: KETWWETWWTEWTEWTEWTEWKKRRRRRKKKKGACSE
RSMNFCG) ב-NF-water כדי לקבל תמיסת מלאי של 2 מ"ג/מ"ל ולאחסן בטמפרטורה של 4 מעלות צלזיוס. - הכן את תמיסת ה-mRNA של IVT על ידי הפשרת ה-mRNA של ה-IVT (שלב 1) על הקרח וצנטריפוגה תוך זמן קצר במשך 3 שניות ב-300 x גרם בטמפרטורת החדר לפני פתיחת הצינור. דלל את תמיסת ה-mRNA של IVT ל-0.04 מיקרוגרם/מיקרון עם NF-מים.
הערה: מומלץ לעבוד בארון בטיחות ביולוגית במידת האפשר עם ה-mRNA של IVT. - הכן תמיסת תערובת T704 ו- sPep על ידי דילול תמיסת sPep ל- 0.555 מיקרוגרם / μL ותמיסת T704 ל- 8 מיקרוגרם / μL עם NF-מים. יש לדגום את התמיסה המעורבת למשך 15 דקות בטמפרטורת החדר לפני שימוש נוסף.
הערה: חשב את רכיב sPep הנדרש בהתבסס על יחס N/P הרצוי. יחס N/P הוא המספר הכולל של שאריות חנקן (N) בתוך ה-sPep למספר הכולל של קבוצות פוספטים טעונות שלילית (P) בתוך ה-mRNA של IVT. חשב את T704 הנדרש בהתבסס על יחס המשקל/משקל (w/w) בין T704 ל-IVT mRNA. יש צורך שהיחס N/P הוא 5 והיחס w/w הוא 100. - הכן את נוסחת ה-MRNA/PP-SNp של IVT בהתאם לשלבים הבאים.
- משכו את תמיסת ה-mRNA של IVT (שלב 3) לתוך מזרק של 1 מ"ל, כדי להבטיח שלא יהיו מרווחי אוויר או בועות בקצה המזרק. טען את המזרק לצד אחד של המחסנית ליד הבלוק המסתובב.
- מלא מזרק של 1 מ"ל בתמיסת התערובת T704 ו- sPep (שלב 4). הסירו בועות או מרווחי אוויר בקצה המזרק והכניסו את המזרק לכניסה השנייה של המשאבה (ראו טבלת חומרים).
- הגדר את המשאבה ביחס זרימה של 1:1 וקצב זרימה כולל של 4-10 מ"ל/דקה.
הערה: קצב זרימה כולל של 6 מ"ל/דקה הוא אופטימלי במחקרים שהוצגו כאן. - הנח צינור חרוטי נטול RNase של 10 מ"ל (ראה טבלת חומרים) כדי לאסוף את התמיסה המעורבת IVT-mRNA/PP-sNp בסוף נתיב הזרימה של התקן הערבוב.
- הפעל את המשאבה כדי להתחיל את הערבוב, תוך הקפדה על קלט נכון של הפרמטרים. לאחר סיום פעולת המשאבה במשך 6 שניות, יש לאסוף את דגימת ה-IVT-mRNA/PP-sNp מהצינור החרוטי.
הערה: PP-sNp נוצרו באמצעות מערבל מיקרופלואידי (איור משלים 1). המכשיר כולל משאבת זרימה קבועה, התקן קישור, שבב ומכשיר קבוע. בתהליך הערבוב, משאבת הזרימה הקבועה המחוברת לשבב מספקת נוזלים לשבב בהתאם לקצב הזרימה שנקבע מראש. ניתן לחבר את משאבת הזרימה הקבועה המחוברת למספר ערוצי קלט של השבב עם ערוץ יציאה יחיד. רכיבי המכשיר, כולל השבב, התקבלו ממקורות מסחריים והורכבו באופן רציונלי (ראו טבלת חומרים). הפרמטרים, כגון קצב זרימה ונפח של פתרון ה-mRNA של IVT והתמיסה המעורבת T704-sEp, עשויים להיות שונים מאלה המוצגים בפרוטוקול הנוכחי אם נעשה שימוש בהגדרות שונות ויש למטב אותן בהתאם.
3. מדידת הקוטר ההידרודינמי והפולי-דיספרספריות של IVT-mRNA/PP-sNp
- יש לדלל אליקוט של תמיסת ה-IVT MRNA/PP-SNp (שלב 2) עם NF-water כדי לקבל נפח סופי של 1 מ"ל.
- מדוד את הגודל ההידרודינמי ואת מדד הפולי-פיזור (PDI) באמצעות חצי מיקרו-קובט25. הוסיפו את תמיסת ה-IVT mRNA/PP-sNp לתוך הקובט והכניסו אותה למטר גודל החלקיקים (ראו טבלת חומרים). הגדר נוהל הפעלה סטנדרטי ולחץ על התחל כדי להתחיל ברכישת הנתונים.
4. הכנת התאים להעברה
- צלחת תאי אפיתל הסימפונות האנושיים (16HBE) וקו תאים דנדריטיים (DC2.4) ב-96 לוחות באר בצפיפות של 3.5 x 104 תאים /באר 24 שעות לפני ההעברה. לגדל את התאים במדיום תרבית בתוספת 10% סרום בקר עוברי מומת בחום ו-1% פניצילין/סטרפטומיצין.
הערה: התאים התקבלו ממקור מסחרי (ראה טבלת חומרים). - דגירה של התאים באינקובטור (37 מעלות צלזיוס ו-5% CO2 באטמוספרה) למשך 24 שעות כדי להבטיח שהתאים יהיו מחוברים ב-60%-80% לפני הטרנספיקציה.
5. טרנספקציה של התאים בתרבית
- לאחר הסרת מדיום הצמיחה, לשטוף את התאים מצופים עם 0.2 מ"ל / טוב 1x PBS.
- הוסף 170 μL של מדיום תרבית ללא סרום לכל באר המכילה את תרביות התאים המצופות.
- הוסף את נוסחת ה-IVT mRNA/PP-sNp המכילה 0.4 מיקרוגרם של mRNA של MetLuc (מוכן בשלב 2) עם כמות של 30 μL/well.
- דגרו על התאים עם נוסחת ה-MRNA/PP-SNp של IVT בטמפרטורה של 37 מעלות צלזיוס באטמוספרה לחה המועשרת ב-5% CO2 למשך 4 שעות.
- החלף את מדיום הטרנספקציה ב-0.2 מ"ל של מדיום תרבית טרי בתוספת 10% סרום בקר עוברי מומת בחום ו-1% (v/v) פניצילין/סטרפטומיצין.
הערה: סרום בקר עוברי היה מחומם בטמפרטורה של 56 מעלות צלזיוס למשך 30 דקות לצורך השבתה. - לדגום את התאים הטרנספקטיביים בטמפרטורה של 37 מעלות צלזיוס ובאטמוספרה מועשרתב-5% CO במשך 24 שעות ולאסוף את הסופרנטנטים שיזוהו מכל באר.
6. ניתוח יעילות העברת תאים באמצעות בדיקת Metridia luciferase (MetLuc)
- בדוק את הסופר-נטנט מכל באר עבור פעילות MetLuc באמצעות מצע coelenterazine (ראה טבלת חומרים) בהתאם לשלבים הבאים.
- הכן תמיסת בדיקה חדשה על ידי הוספת 1x PBS למצע coelenterazine (ריכוז coelenterazine הוא 15 mM).
- וורטקס תמיסת coelenterazine במשך 10 שניות לערבוב יסודי.
- יש להוסיף 50 μL של סופרנטנט (שנאסף בשלב 5) לצלחת של 96 בארות.
- הגדר את קורא המיקרו-פלטות (ראה טבלת חומרים) עם זמן קריאה של 1,000 אלפיות השנייה לפני הוספת 30 μL של תמיסת coelenterazine (15 mM) לכל באר באופן ידני או על ידי הזרקה אוטומטית.
- לחץ על התחל כדי למדוד את אות הזוהר מיד לאחר הוספת תמיסת coelenterazine לסופרנטנט.
הערה: אות הזוהר נמדד באמצעות קורא מיקרו-לוחות, ופעילותו מתבטאת ביחידות אור יחסיות. הערכים המתקבלים מבארות PBS-transfected ישמשו כפקדים ריקים.
תוצאות
הפלסמיד הרקומביננטי עוכל כדי לייצר את תבנית הדנ"א הליניארית (איור 2A). באמצעות הפרוטוקול המתואר, ערכת השעתוק במבחנה T7 יכולה לייצר עד 80-120 מיקרוגרם של MetLuc-mRNA ללא כיסוי לכל תגובת 20 μL ו-50-60 מיקרוגרם של MetLuc-mRNA מכוסה לכל תגובת 100 μL. כאשר מנתחים אותו באמצעות אלקטרופורזה, MetLuc-mRNA שלם באיכות גבוהה אמור להראות פס יחיד וברור, כפי שמוצג באיור 2B. מזהמים שהוכנסו לתגובה מתבנית הדנ"א עלולים לגרום להתפרקות הרנ"א ולתפוקה נמוכה יותר.
PP-sNp המכיל את MetLuc-mRNA (MetLuc-mRNA/PP-sNp) הוכן בשיטת הערבוב המיקרופלואידי (איור 1). טבלה 1 מציגה את הנתונים על האפיון הפיסיקוכימי של MetLuc-mRNA/PP-sNp כדוגמאות. הרדיוס ההידרודינמי של MetLuc-mRNA/PP-sNp יכול להיחשב נכון אם הוא נע סביב 70-100 ננומטר. חוץ מזה, PDI של PP-sNp חייב להיות קבוע ועדיף להיות מתחת 0.2, אבל ערכי PDI עד כ 0.3 מתקבלים.
לאחר שילוב מוצלח של MetLuc-mRNA ב-PP-sNp, ניתן לדגור את הפורמולציה עם תאי 16HBE וקו תאים דנדריטיים (DC2.4), וניתן להצביע על יעילות הטרנספקציה של MetLuc-mRNA על ידי פעילות לוציפראז בתוך תרבית התאים 24 שעות לאחר הטרנספקציה. איור 3 הוא דוגמה טיפוסית להעברה מוצלחת של MetLuc-mRNA/PP-sNp. ניתן לראות בבירור כי תאים שעברו טרנספקציה עם MetLuc-mRNA/PP-sNp הציגו ביטוי גבוה יותר באופן משמעותי של לוציפראז בהשוואה לאלה שעברו טרנספקציה עם טרנספקציה מסחרית מבוססת שומנים (LP) (ראו טבלת חומרים), MetLuc-mRNA עירום (בקרה שלילית), PBS (בקרה ריקה) או T704-sPep תמיסה מעורבת (בקרה מדומה) בתאי 16HBE. MetLuc-mRNA/PP-sNp גם הראה ביטוי גבוה יותר של לוציפראז בהשוואה ל-LP. הנתונים מצביעים על כך שמערכת העברת PP-sNp חשובה להגנה על MetLuc-mRNA מפני השפלה ולקידום יעילות הטרנספקציה של MetLuc-mRNA אקסוגני. לכן, מערכות אספקה כגון PP-sNp חיוניות בדרך כלל למחקרי טרנספקציה של IVT mRNA.
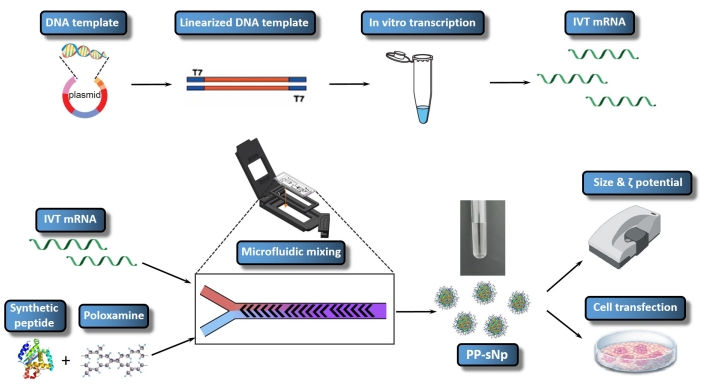
איור 1: ייצוג סכמטי של כל זרימת העבודה של IVT mRNA/PP-sNp. תבנית הדנ"א מקושרת לפלסמיד על ידי בניית פלסמיד רקומביננטי. תבנית הדנ"א הליניארית מורכבת באמצעות עיכול אנזים הגבלה. mRNA מתועתק במבחנה (IVT mRNA) מסונתז ומכוסה מתבנית הדנ"א הליניארי. תמיסת T704-sPep מכילה את T704 ואת הפפטיד הסינתטי (sPep), בעוד שתמיסת ה-mRNA של IVT מכילה את MetLuc-mRNA. תמיסות מעורבות של IVT mRNA ו-T704-sPep מעורבבות באמצעות מערבל מיקרופלואידי, היוצר MetLuc-mRNA/PP-sNp. לאחר מכן, האפיון של MetLuc-mRNA/PP-sNp מבוצע כדי לקבוע את גודל החלקיקים ואת הפולידיספריקציה באמצעות Zetasizer. תאי 16HBE עוברים טרנספקציה עם MetLuc-mRNA/PP-sNp, ופעילות הלוציפראז בתוך הסופר-נטנט נמדדת כדי להעריך את יעילות הטרנספקציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: הייצור של MetLuc-mRNA. (A) תבנית הדנ"א מכילה מקדם פולימראז T7, אזור 5'untraslated (UTR), מסגרת קריאה פתוחה (ORF) של זנבות MetLuc, 3'UTR ופולי (A). (B) זיהוי אלקטרופורזה. החץ הלבן מציין פלסמיד רקומביננטי. החץ הצהוב מציין את וקטור PUC57. החץ האדום מציין את תבנית הדנ"א עבור שעתוק במבחנה של MetLuc-mRNA. החץ הירוק מציין MetLuc-mRNA לא מכוסה. החץ הכחול מציין את ה-MetLuc-mRNA המכוסה במכסה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: יעילות טרנספקציה של MetLuc-mRNA/PP-sNp בתאי 16HBE ו-DC2.4. MetLuc-mRNA עבר טרנספקציה באמצעות PP-sNp בתאי (A) 16HBE ו-(B) קו תאים דנדריטיים (DC2.4). הריכוז הסופי של MetLuc-mRNA היה 0.02 מיקרוגרם/μL, זה של sPep היה 0.139 מיקרוגרם/מיקרול, וזה של T704 היה 2 מיקרוגרם/מיקרוL ב-PP-sNp. טרנספקציה מסחרית מבוססת שומנים (LP) אומצה כבקרה חיובית. פעילות הלוציפראז נמדדה 24 שעות לאחר הטרנספקציה. הדגימה שטופלה ב-PBS אומצה כבקרה ריקה. הפתרון המעורב T704-sPep אומץ כבקרה מדומה. הבדלים סטטיסטיים נותחו באמצעות מבחן t של סטודנט (ns p ≥ 0.05, * p < 0.05). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| IVT mRNA | N/P (sPep) | w/w (T704) | גודל (ננומטר) | PDI | זיטה |
| 17.5 ננוגרם/מיקרון | 5 | 100 | 85.12 ± 9.40 | 0.20 ± 0.07 | -13.07 ± 0.47 |
טבלה 1: נתוני אפיון פיסיקוכימיים של MetLuc-mRNA/PP-sNp.
איור משלים 1: ההתקנה של המכשיר המיקרופלואידי שהוכן בתוך הבית ששימש במחקר הנוכחי. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: רצף הקידוד של תבנית הדנ"א. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
הפרוטוקול המתואר כאן לא רק מאפשר ייצור חסכוני ומהיר של פורמולציות חיסון IVT mRNA עם תכונות מוגדרות, אלא הוא גם מציע את האפשרות להתאים אישית את נוסחת PP-sNp בהתאם למטרות טיפוליות ספציפיות, כגון ריפוי גנטי. על מנת להבטיח את הדור המוצלח של IVT mRNA/PP-sNp, מומלץ להקדיש תשומת לב נוספת לכמה שלבים קריטיים. כאשר עובדים עם mRNA, זכור תמיד כי תנאים ללא RNase צריך להישמר לאורך כל התהליך כי IVT mRNA הוא רגיש מאוד לגבי השפלה על ידי RNase, גם אם mRNA IVT הוכן עם שינוי כימי. בינתיים, יש להבטיח גם סביבה נטולת RNase בעת אחסון הפורמולציות. מומלץ לאחסן IVT mRNA/PP-sNp בטמפרטורה של 2-8 מעלות צלזיוס למשך עד שבוע. התוצאות שהוצגו מראות כי מים נטולי נוקלאז יעילים ביצירת PP-sNp בהצלחה עם יעילות העברה גבוהה. ניתן להשתמש במאגרים אחרים, כגון PBS, מלוחים, OptiMEM וכו ', במידת הצורך. מומלץ לבצע את הטרנספקציות במבחנה באמצעות IVT mRNA/PP-sNp במדיום OptiMEM על מנת להבטיח את הכדאיות של התאים בתרבית. אם נבחר חיץ אחר ולא מים נטולי נוקלאז כדי להכין את הפורמולה, חשוב להשתמש ב-mRNA IVT בריכוז נמוך (מתחת ל-100 ננוגרם/מ"ל); אחרת, הננו-חלקיקים נוטים להיות מואצים, אשר, בתורו, הופך ניסוח לא חוקי. הסיבה לתופעה זו היא המואטי הקטיוני בתוך הפפטיד הסינתטי. בנוסף, צפיפות המטען החיובי החזקה של הננו-חלקיק עלולה לערער את יציבות קרום התא, ובכך לגרום לציטוטוקסיות משמעותית. עם זאת, במחקר הקודם הוכח כי המטען החיובי בתוך PP-sNp הוא הכרחי בתיווך קליטה תאית יעילה של IVT mRNA, בריחת אנדוזום והעברה מוצלחת23. כתוצאה מכך, חשוב להתאים את המטען החיובי בתוך PP-sNp כדי להגיע לאיזון עדין במונחים של יעילות ורעילות.
ניתן להחיל את הפרוטוקול המוצג על ניסוחים שונים מבוססי PP-sNp עם כמה שינויים בפרמטרים. לצורך אספקת חיסונים מבוססי mRNA של IVT, תכונות ביופיזיות כגון גודל החלקיקים ומדד הפולידיספרספריות הן קריטיות ליעילות הטרנספקציה והאימונוגניות של הננו-חלקיקים המוכנים26. גודל החלקיקים של ה-IVT mRNA/PP-sNp בסולם הננומטר מאפשר העברה יעילה על פני מחסומים פיזיולוגיים, ולכן הוא חשוב ליישומי ה-in vivo הבאים. דווח כי LNPs בטווח הגודל של 60-150 ננומטר מייצרים תגובות חיסוניות חזקות בפרימטים שאינם בני אדם26. מצד שני, ננו-חלקיקים גדולים (למשל, 400-1000 ננומטר) לא יכלו להתגבר על מחסום ריר דרכי הנשימה כאשר הם מיושמים להעברה ריאתית מכיוון שכפי שנחשף בחקירות קודמות, מרווח הרשת התלת-ממדי הממוצע של נקבוביות רשת ריר דרכי הנשימה נע בין 60-300 ננומטר27,28. אם הגודל הרצוי או יעילות ההעברה אינם מושגים, כמה טיפים להתחלת פתרון בעיות כוללים התאמת כמות רכיבי הפולוקסאמין או הפפטיד הסינתטי המשמשים. המחקר הקודם גילה כי פרמטרים נוספים, כגון כמות ה-mRNA של IVT המשמשת לטרנספקציה, זמן הדגירה והסוגים וצפיפות התאים של תאים בתרבית, יכולים גם הם להשפיע באופן משמעותי על תוצאת הטרנספקציה23. יתר על כן, מאחר שה-Mooiety הממוקד בתוך ה-PP-sNp מאפשר העברה ספציפית של ה-IVT mRNA העטוף בתאים המציגים קולטנים קשורים, החלפה עם ליגנדות מיקוד חלופיות עשויה להיות נחוצה אם תאי המטרה מועברים לסוגים אחרים ולא לתאים הקשורים לדרכי הנשימה. בסך הכל, הפרוטוקול עדיין עשוי להשתפר עם תובנות מפורטות יותר ובדיקה נוספת.
בהתחשב בכך שה- IVT mRNA/PP-sNp המקורי מוכן בתחילה על ידי ערבוב ידני ישיר, יכולות המפעיל ממלאות תפקיד חשוב בשליטה על איכות הניסוח. שינויים בתהליך ערבוב ה-mRNA של IVT עם רכיבי ה-PP-sNp עשויים לגרום למיקרו-חלקיקים גדולים ולא לחלקיקים בגודל ננו. הצעד המסובך ביותר הוא ערבוב ה- mRNA והפפטיד הסינתטי, אשר חייב להיעשות בצורה מבוקרת. על מנת לשפר את יכולת השכפול בין קבוצות שונות של נוסחת IVT mRNA/PP-sNp, אומץ מערבל מיקרופלואידי מכיוון שסינון בנפח נמוך, מהירות מהירה ושכפול הם תכונות חשובות של שימוש בשיטה המיקרופלואידית29. שיטה זו הראתה יכולת שכפול טובה, ללא השפעה משמעותית על גודל החלקיקים או על יעילות ההעברה שנצפתה בין אצוות שונות. זהו קריטריון חיוני לחיסונים מבוססי IVT mRNA שייושמו ביישומים קליניים. במיוחד, מערבל microfluidic לא יעלה על המספר המרבי של משתמשים (מומלץ על ידי היצרן) ויש לשנות בין ניסוחים עם הרכבים שונים.
הפרוטוקול של שעתוק mRNA IVT המתואר בפרוטוקול זה יכול לשמש באופן תיאורטי להכנת כל חלבון/אנטיגן מדווח בעל עניין. ה- Metridia luciferase (MetLuc) יושם במיוחד במחקר זה מכיוון שהוא טומן בחובו יתרונות ייחודיים. בדיקת הפעילות של MetLuc קלה לביצוע ברגישות גבוהה מכיוון ש-MetLuc יכול לייצר אות ביולומינסנטי אינטנסיבי, והוא עלול להיות מופרש ישירות למדיום התא, ובכך להימנע מהצורך בהתזת תאים. חשוב לציין כי ביטוי MetLuc בתאים בתרבית יכול להיות מושפע מפרמטרים רבים (למשל, מספרי תאים משתנים לכל באר ושגיאות פיפטינג וכו') מלבד הפונקציונליות של MetLuc-mRNA עצמו.
למרות שהפרוטוקול הנוכחי נקבע לאספקת חיסון ה- mRNA IVT, ניתן ליישם אותו גם עבור חיסונים או טיפולים המבוססים על סוגים אחרים של חומצות גרעין, כגון DNA פלסמיד (pDNA). תהליך זה יכול להיות מותאם לשינויים סינתטיים בפפטידים, חומצות גרעין ורכיבי פולוקסאמין לפיתוח PP-sNp מסוים עבור אינדיקציות קליניות שונות. ואכן, שילוב הגנום של הגן האקסוגני סיסטיק פיברוזיס טרנסממברנה טרנסדוקציה (CFTR) ברקמת אפיתל נשימתית של עכברי נוקאאוט CFTR עם שימוש בכלי שינוי גנטי של היפהפייה הנרדמת המועבר על ידי PP-sNp23 הושג בהצלחה. לגבי יישומים טיפוליים, פורמולציות IVT mRNA/PP-sNp יכולות לשמש כתרסיס באמצעות מכשירי נבוליזציה ספציפיים לריפוי מחלות ריאה, כגון מחסור ב-α1-אנטיטריפסין או סיסטיק פיברוזיס30. עם זאת, ראוי לציין כי פורמולציות IVT mRNA/PP-sNp עבור נבוליזציה צריכות להיות אופטימליות ומותאמות אישית, שכן ה-mRNA האירוסולי של IVT עלול להיות לא יעיל בשל כוח הגזירה שנוצר על ידי הנבולייזר והאופי השברירי של IVT mRNA30. יתר על כן, הפרוטוקול עשוי להיות מדרגי לנפחים גדולים יותר באמצעות התקני ערבוב מיקרופלואידיים שונים, כגון התקני ערבוב צומת T ואפילו סילוני פגיעה משאבות ערבוב31,32.
לסיכום, הפרוטוקול המפורט כאן מציג שיטה הניתנת לשחזור של ניסוח IVT mRNA במערכת העברת PP-sNp, כמו גם טרנספקציה אמינה לאחר מכן בתאים בתרבית. השיטה המתוארת מבטיחה גישה נגישה וקלה לייצור IVT mRNA/PP-sNp באמצעות מערבל מיקרופלואידי. לאחר מכן ניתן ליישם את הפורמולציות המוכנות עם גדלי חלקיקים קטנים ומדד פולי-פיזור נמוך על תאים בתרבית בצורה בטוחה ויעילה. פרוטוקול זה יאפשר למערכת האספקה מבוססת PP-sNp להיות זמינה לקהילה האקדמית לתכנון חיסונים או טיפולים חדשניים מבוססי IVT mRNA תוך הימנעות מכל החסרונות שהוזכרו. עם הפרופילים הגמישים של PP-sNp, יישומים עתידיים רבים צפויים להיות מושגים עם PP-sNp כדי לייצר טיפולים נפרדים לטיפול במחלות שונות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (NSFC, מענק מס '82041045 ו- 82173764), הפרויקט הגדול של מחקר על פתוגנזה ומערכת טכנולוגיה למניעת מגיפות (2021YFC2302500) על ידי משרד המדע והטכנולוגיה של סין, פרויקט הכישרונות הצעירים יוצאי הדופן של צ'ונגצ'ינג: כישרונות צעירים יוצאי דופן (CQYC202005027), והקרן למדעי הטבע של צ'ונגצ'ינג (cstc2021jcyj-msxmX0136). המחברים מודים לד"ר שיאויאן דינג על מדידת הקוטר ההידרודינמי (nm) ומדד הפולידיספרסיה (PDI).
Materials
| Name | Company | Catalog Number | Comments |
| BamHI | Takara | 1010 | |
| cap 1 capping system | Jinan | M082 | |
| Dendritic cell-line | Sigma | SCC142 | |
| DNA sequence | Genescript | ||
| Human bronchial epithelial cells | Sigma | SCC150 | |
| KpnI | Takara | 1068 | |
| LP | Beyotime | C0533 | |
| Lithium chloride | APEXBio | B6083 | |
| Malvern Zetasizer Nano ZS90 | Malvern | NB007605 | |
| Microfluidic chip | ZHONGXINQIHENG | Standard PDMS chip | |
| Microplate readers | ThermoFisher | Varioskan lux | |
| NanoDrop One | ThermoFisher | ND-ONE-W (A30221) | |
| Nuclease-free water | ThermoFisher | AM9932 | |
| OptiMEM | Gibco | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Pseudouridine | APE×Bio | B7972 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| Quanti-Luc | InvivoGen | Rep-qlc2 | |
| RiboRuler High Range RNA Ladder | ThermoFisher | SM1821 | |
| RNase-free conical tube | Biosharp | BS-100-M | |
| RPMI Medium 1640 | ThermoFisher | C11875500BT | |
| Syringe pump | Chemyx | Fusion 101 | |
| T7 transcription Kit | Jinan | E131 |
References
- Nature milestones in vaccines. Springer Nature Available from: https://www.nature.com/collections/hcajdiajij (2020)
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 40 (6), 840-854 (2022).
- Mulligan, M. J., et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586 (7830), 589-593 (2020).
- Tang, J., et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa. Nanomaterials. 12 (2), 226 (2022).
- Freyn, A. W., et al. A multi-targeting, nucleoside-modified mRNA influenza virus vaccine provides broad protection in mice. Molecular Therapy. 28 (7), 1569-1584 (2020).
- Wu, K., et al. Variant SARS-CoV-2 mRNA vaccines confer broad neutralization as primary or booster series in mice. Vaccine. 39 (51), 7394-7400 (2021).
- Chaudhary, N., Weissman, D., Whitehead, K. A. mRNA vaccines for infectious diseases: Principles, delivery and clinical translation. Nature Reviews Drug Discovery. 20, 817-838 (2021).
- Kormann, M. S. D., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature Biotechnology. 29 (2), 154-157 (2011).
- Tavernier, G., et al. mRNA as gene therapeutic: How to control protein expression. Journal of Controlled Release. 150 (3), 238-247 (2011).
- Walsh, E. E., et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. The New England Journal of Medicine. 383 (25), 2439-2450 (2020).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine. 384 (5), 403-416 (2021).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Sharova, L. V., et al. Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells. DNA Research. 16 (1), 45-58 (2009).
- Houseley, J., Tollervey, D. The many pathways of RNA degradation. Cell. 136 (4), 763-776 (2009).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13, 359-380 (2014).
- Hajj, K. A., Whitehead, K. A. Tools for translation: Non-viral materials for therapeutic mRNA delivery. Nature Reviews Materials. 2, 17056 (2017).
- Deering, R. P., Kommareddy, S., Ulmer, J. B., Brito, L. A., Geall, A. J. Nucleic acid vaccines: Prospects for non-viral delivery of mRNA vaccines. Expert Opinion on Drug Delivery. 11 (6), 885-899 (2014).
- Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C., Thakur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics. 12 (2), 102 (2020).
- Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nature Reviews Materials. 6 (12), 1078-1094 (2021).
- Sahin, U., et al. COVID-19 vaccine BNT162b1 elicits human antibody and T(H)1 T cell responses. Nature. 586 (7830), 594-599 (2020).
- Azzi, L., et al. Mucosal immune response in BNT162b2 COVID-19 vaccine recipients. EBioMedicine. 75, 103788 (2022).
- Guan, S., et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis. Nature Nanotechnology. 14 (3), 287-297 (2019).
- Pitard, B., et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Research. 32 (20), 159 (2004).
- Hiroi, T., Shibayama, M. Measurement of particle size distribution in turbid solutions by dynamic light scattering microscopy. Journal of Visualized Experiments. (119), e54885 (2017).
- Hassett, K. J., et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. Journal of Controlled Release. 335, 237-246 (2021).
- Suk, J. S., et al. The penetration of fresh undiluted sputum expectorated by cystic fibrosis patients by non-adhesive polymer nanoparticles. Biomaterials. 30 (13), 2591-2597 (2009).
- Kim, N., Duncan, G. A., Hanes, J., Suk, J. S. Barriers to inhaled gene therapy of obstructive lung diseases: A review. Journal of Controlled Release. 240, 465-488 (2016).
- Liu, Z., Fontana, F., Python, A., Hirvonen, J. T., Santos, H. A. Microfluidics for production of particles: Mechanism, methodology, and applications. Small. 16 (9), 1904673 (2020).
- Guan, S., Darmstädter, M., Xu, C., Rosenecker, J. In vitro investigations on optimizing and nebulization of IVT-mRNA formulations for potential pulmonary-based alpha-1-antitrypsin deficiency treatment. Pharmaceutics. 13 (8), 1281 (2021).
- Shepherd, S. J., Issadore, D., Mitchell, M. J. Microfluidic formulation of nanoparticles for biomedical applications. Biomaterials. 274, 120826 (2021).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved