Method Article
Trasfezione efficiente di mRNA trascritto in vitro in cellule in coltura utilizzando nanoparticelle peptide-poloxamina
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Una nanoparticella peptide-poloxamina autoassemblata (PP-sNp) viene sviluppata utilizzando un dispositivo di miscelazione microfluidica per incapsulare e fornire RNA messaggero trascritto in vitro . L'mRNA/PP-sNp descritto potrebbe trasfettare efficacemente le cellule in coltura in vitro.
Abstract
I vaccini a RNA messaggero trascritto in vitro (mRNA) hanno mostrato un enorme potenziale nella lotta contro la pandemia di coronavirus 2019 (COVID-19). Sistemi di somministrazione efficienti e sicuri devono essere inclusi nei vaccini mRNA a causa delle fragili proprietà dell'mRNA. Un sistema di rilascio genico autoassemblato di nanoparticelle peptide-poloxamina (PP-sNp) è specificamente progettato per la consegna polmonare di acidi nucleici e mostra capacità promettenti nel mediare la trasfezione di mRNA di successo. Qui, viene descritto un metodo migliorato per preparare PP-sNp per elaborare come il PP-sNp incapsula l'mRNA della Metridia luciferasi (MetLuc) e trasfetta con successo le cellule in coltura. L'mRNA MetLuc è ottenuto mediante un processo di trascrizione in vitro da un modello lineare di DNA. Un PP-sNp viene prodotto mescolando peptide sintetico / poloxamina con soluzione di mRNA utilizzando un miscelatore microfluidico, consentendo l'auto-assemblaggio di PP-sNp. La carica di PP-sNp viene successivamente valutata misurando il potenziale zeta. Nel frattempo, la polidispersità e la dimensione idrodinamica delle nanoparticelle di PP-sNp vengono misurate utilizzando la diffusione dinamica della luce. Le nanoparticelle di mRNA/PP-sNp vengono trasfettate in cellule in coltura e i surnatanti della coltura cellulare vengono analizzati per l'attività della luciferasi. I risultati rappresentativi dimostrano la loro capacità di trasfezione in vitro. Questo protocollo potrebbe far luce sullo sviluppo di sistemi di rilascio del vaccino mRNA di prossima generazione.
Introduzione
La vaccinazione è stata annunciata come uno degli interventi medici più efficaci per ridurre la morbilità e la mortalità causate da malattie infettive1. L'importanza dei vaccini è stata dimostrata dallo scoppio della malattia da coronavirus 2019 (COVID-19). A differenza del concetto tradizionale di iniezione di agenti patogeni inattivati o vivi attenuati, gli approcci vaccinali all'avanguardia, come i vaccini a base di acidi nucleici, si concentrano sulla conservazione delle proprietà immunostimolatorie dei patogeni bersaglio, evitando i potenziali problemi di sicurezza associati ai vaccini convenzionali a base di virus interi o batteri. Sia i vaccini basati sul DNA che sull'RNA (cioè l'RNA messaggero trascritto in vitro, l'mRNA IVT) mostrano un potenziale profilattico terapeutico contro una varietà di malattie, comprese le malattie infettive e i tumori 2,3. In linea di principio, il potenziale dei vaccini a base di acidi nucleici si riferisce alla loro produzione, efficacia e sicurezza4. Questi vaccini possono essere prodotti in modo privo di cellule per consentire una produzione economica, scalabile e rapida.
Un singolo vaccino a base di acido nucleico può codificare più antigeni, consentendo il bersaglio di numerose varianti virali o batteri con un numero ridotto di inoculazioni e rafforzando la risposta immunitaria contro i patogeni resilienti 5,6. Inoltre, i vaccini a base di acidi nucleici potrebbero imitare il naturale processo di invasione del virus o dell'infezione batterica, portando risposte immunitarie mediate da cellule B e cellule T. A differenza di alcuni vaccini basati su virus o DNA, i vaccini basati su mRNA IVT offrono un enorme vantaggio in termini di sicurezza. Possono esprimere rapidamente l'antigene desiderato nel citosol e non sono integrati nel genoma ospite, ovviando alle preoccupazioni sulla mutagenesi inserzionale7. IVT-mRNA viene automaticamente degradato dopo una traduzione riuscita, quindi la sua cinetica di espressione proteica può essere facilmente controllata 8,9. Catalizzata dalla pandemia di sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2), gli sforzi di aziende / istituzioni di tutto il mondo hanno permesso il rilascio sul mercato di molti tipi di vaccini. La tecnologia dei vaccini basati su mRNA IVT mostra un grande potenziale e, per la prima volta, ha dimostrato il successo precedentemente previsto, grazie alla sua rapida progettazione e alla capacità flessibile di adattarsi a qualsiasi antigene bersaglio entro diversi mesi. Il successo dei vaccini mRNA IVT contro COVID-19 nelle applicazioni cliniche non solo ha aperto una nuova era di ricerca e sviluppo del vaccino mRNA IVT, ma ha anche accumulato una preziosa esperienza per il rapido sviluppo di vaccini efficaci per affrontare epidemie di malattie infettive10,11.
Nonostante il potenziale promettente dei vaccini mRNA IVT, l'efficiente consegna intracellulare di mRNA IVT al sito d'azione (cioè citoplasma) continua a rappresentare un ostacolo importante12, specialmente per quelli somministrati attraverso le vie aeree4. L'mRNA IVT è intrinsecamente una molecola instabile con un'emivita estremamente breve (~7 h)13, che rende l'mRNA IVT altamente incline alla degradazione da parte dell'ubiquitaria RNasi14. I linfociti del sistema immunitario innato tendono a fagocitare l'mRNA IVT riconosciuto nei casi di applicazione in vivo . Inoltre, l'elevata densità di carica negativa e il grande peso molecolare (1 x 104-1 x 106 Da) dell'mRNA IVT compromettono la sua permeazione efficace attraverso il doppio strato lipidico anionico delle membrane cellulari15. Pertanto, è necessario un sistema di rilascio con determinati materiali biofunzionali per inibire la degradazione delle molecole di mRNA IVT e facilitare l'assorbimento cellulare16.
A parte alcuni casi eccezionali in cui l'mRNA IVT nudo è stato utilizzato direttamente per indagini in vivo, vari sistemi di rilascio sono utilizzati per trasportare l'mRNA IVT al sito terapeutico di azione17,18. Studi precedenti hanno rivelato che solo pochi mRNA IVT sono rilevati nel citosol senza l'assistenza di un sistema di consegna19. Sono state sviluppate numerose strategie per migliorare il rilascio dell'RNA con continui sforzi sul campo, che vanno dalla condensazione della protamina all'incapsulamento lipidico20. Le nanoparticelle lipidiche (LNP) sono le più clinicamente avanzate tra i veicoli di rilascio di mRNA, come dimostrato dal fatto che tutti i vaccini mRNA COVID-19 approvati per uso clinico impiegano sistemi di rilascio basati su LNP21. Tuttavia, le LNP non possono mediare un'efficace trasfezione di mRNA quando le formulazioni vengono somministrate attraverso la via respiratoria22, il che limita notevolmente l'applicazione di queste formulazioni nell'indurre risposte immunitarie della mucosa o nell'affrontare malattie polmonari come la fibrosi cistica o il deficit di α1-antitripsina. Pertanto, è necessario sviluppare un nuovo sistema di consegna per facilitare la consegna efficiente e la trasfezione dell'mRNA IVT nelle cellule correlate alle vie aeree per risolvere questo bisogno insoddisfatto.
È stato confermato che il sistema di rilascio di nanoparticelle autoassemblate peptide-poloxamina (PP-sNp) può mediare l'efficiente trasfezione degli acidi nucleici nel tratto respiratorio dei topi23. Il PP-sNp adotta un approccio di progettazione modulare multifunzionale, che può integrare diversi moduli funzionali nelle nanoparticelle per uno screening e un'ottimizzazione rapidi23. I peptidi sintetici e i copolimeri a blocchi anfifilici elettricamente neutri (poloxamina) all'interno del PP-sNp possono interagire spontaneamente con l'mRNA IVT per generare nanoparticelle uniformemente distribuite con una struttura compatta e una superficie liscia23. PP-sNp può migliorare l'effetto di trasfezione genica delle molecole di mRNA IVT nelle cellule in coltura e nel tratto respiratorio dei topi23. Il presente studio descrive un protocollo per la generazione di PP-sNp contenente mRNA IVT che codifica per Metridia luciferasi (MetLuc-mRNA) (Figura 1). In questo protocollo viene utilizzata una miscelazione controllata e rapida tramite un dispositivo di miscelazione microfluidica, che impiega il design di miscelazione a spina di pesce sfalsata. La procedura è facile da eseguire e consente la generazione di PP-sNp con dimensioni più uniformi. L'obiettivo generale della produzione di PP-sNp utilizzando il miscelatore microfluidico è quello di creare PP-sNp per la complessazione dell'mRNA in modo ben controllato, consentendo così una trasfezione cellulare efficiente e riproducibile in vitro. Il presente protocollo descrive la preparazione, l'assemblaggio e la caratterizzazione di PP-sNp contenente MetLuc-mRNA.
Protocollo
1. Trascrizione in vitro di mRNA chimicamente modificato
NOTA: È necessario utilizzare tubi privi di nucleasi, reagenti, vetreria, punte per pipette, ecc., perché le RNasi sono onnipresenti nell'ambiente, come soluzioni di laboratorio, superfici di strumenti, capelli, pelle, polvere, ecc. Pulire accuratamente le superfici del banco e le pipette prima dell'uso e indossare guanti per evitare la contaminazione da RNasi.
- Eseguire la linearizzazione del modello di DNA.
- Sintetizzare il frame di lettura aperto (ORF) di Metridia luciferasi (MetLuc) affiancato da un promotore della polimerasi T7, 5' regione non tradotta (UTR), 3'UTR e code di poli (A) e clonarlo nel vettore PUC57, che è espresso nei batteri (vedi Tabella dei materiali).
NOTA: la sequenza di codifica del modello di DNA è fornita nel file supplementare 1. - Coltura batterica, lisare i batteri e purificare il DNA plasmidico mediante la colonna corrispondente (vedere il kit di estrazione del DNA plasmidico nella Tabella dei materiali).
- Eseguire una singola reazione da 50 μL che contenga 2 μL di BamHI, 2 μL di KpnI (vedi Tabella dei materiali) e 2 μg di DNA plasmidico a 37 °C per 1 ora e ottenere la linearizzazione del modello di DNA.
- Sintetizzare il frame di lettura aperto (ORF) di Metridia luciferasi (MetLuc) affiancato da un promotore della polimerasi T7, 5' regione non tradotta (UTR), 3'UTR e code di poli (A) e clonarlo nel vettore PUC57, che è espresso nei batteri (vedi Tabella dei materiali).
- Eseguire la trascrizione in vitro per generare mRNA IVT senza cappuccio.
- Eseguire la sintesi dell'mRNA mediante una singola reazione da 20 μL utilizzando un kit di trascrizione T7 e pseudouridina (vedere Tabella dei materiali): 10 μL (0,8-1 μg) di modello di DNA linearizzato, 1,5 μL (150 mM) di ATP, pseudo-UTP, GTP e CTP, 2 μL di tampone di trascrizione 10x, 1 μL di enzima T7 e 1 μL di acqua priva di nucleasi (NF-water). Mescolare accuratamente i suddetti componenti e incubare a 37 °C per 3 ore.
- Rimuovere il modello DNA.
- Aggiungere 1 μL (1 U) di DNasi (senza RNasi) dopo il processo di trascrizione e incubare a 37 °C per 15 minuti.
- Eseguire la purificazione dell'mRNA IVT senza cappuccio utilizzando la precipitazione del cloruro di litio.
- Purificare l'mRNA IVT senza cappuccio usando cloruro di litio (vedi Tabella dei materiali) con una concentrazione operativa di 10 mM. Aggiungere 50 μL di cloruro di litio 10 mM a 20 μL di soluzione di mRNA IVT senza cappuccio.
- Mescolare accuratamente l'intero volume e raffreddare a -20 °C per 1 ora. Raccogliere l'mRNA IVT senza cappuccio per 12 minuti a 12.000 x g, che produce abitualmente 80-120 μg di mRNA IVT senza cappuccio da ogni singola reazione di 20 μL.
- Eseguire il capping dell'mRNA IVT.
- Eseguire il capping dell'mRNA IVT utilizzando il sistema di tappatura cap 1 (vedere Tabella dei materiali). In breve, rimuovere la struttura secondaria di 50 μg di mRNA IVT senza cappuccio riscaldando a 65 °C per 10 minuti, quindi collegare l'estremità 5' dell'mRNA IVT senza cappuccio con il cappuccio 1, che viene preparato modificando la struttura del tappo m7G utilizzando 2,5 μL di s-adenosilmetionina (SAM) (20 mM) e 4 μL di 2'-O-metiltransferasi (100 U) in una reazione di 100 μL a 37 °C per 30-60 minuti.
- Purificare 100 μL dell'mRNA IVT rivestito utilizzando 250 μL di cloruro di litio 10 mM e diluire in 50 μL di acqua NF.
- Determinare la purezza e la dimensione molecolare dell'mRNA IVT con cappuccio.
- Misurare la concentrazione di mRNA IVT con cappuccio con uno spettrofotometro UV-visibile. Utilizzando un marcatore di RNA (vedi Tabella dei materiali), analizzare la dimensione molecolare dell'mRNA IVT con cappuccio in un gel di agarosio denaturante formaldeide all'1% contenente il 18% di formaldeide (la tensione è 120 V). Assicurarsi che l'mRNA IVT senza cappuccio e l'mRNA IVT con cappuccio siano conservati a -80 °C.
NOTA: L'mRNA IVT è stato considerato avere una buona purezza in un rapporto A 260/A280 di 1,8-2,1 e un rapporto A260/A230 di 2,0 o leggermente superiore.
- Misurare la concentrazione di mRNA IVT con cappuccio con uno spettrofotometro UV-visibile. Utilizzando un marcatore di RNA (vedi Tabella dei materiali), analizzare la dimensione molecolare dell'mRNA IVT con cappuccio in un gel di agarosio denaturante formaldeide all'1% contenente il 18% di formaldeide (la tensione è 120 V). Assicurarsi che l'mRNA IVT senza cappuccio e l'mRNA IVT con cappuccio siano conservati a -80 °C.
2. Generazione di mRNA/PP-sNp IVT
- Preparare la soluzione madre di poloxamina 704 (T704) solubilizzando il T704 (vedere la tabella dei materiali) in acqua NF per ottenere una soluzione madre da 10 mg/ml. Conservare la soluzione preparata a 4 °C.
NOTA: T704 contiene una struttura a forma di X costituita da un gruppo centrale etilendiammina legato a quattro catene di blocchi di poli (ossido di propilene) (PPO) e blocchi di poli (ossido di etilene) (PEO)24. Il peso molecolare (Mw) di T704 è 5500. - Preparare la soluzione madre di peptide sintetico (sPep, vedere Tabella dei materiali) solubilizzando il sPep (sequenza: KETWWETWWTEWWTEWKKKKRRRRRKKKKGACSE
RSMNFCG) in acqua NF per ottenere una soluzione madre di 2 mg/mL e conservare a 4 °C. - Preparare la soluzione di mRNA IVT scongelando l'mRNA IVT (fase 1) su ghiaccio e centrifugando brevemente per 3 s a 300 x g a temperatura ambiente prima di aprire il tubo. Diluire la soluzione di mRNA IVT a 0,04 μg/μL con acqua NF.
NOTA: Si raccomanda di lavorare in un armadio di biosicurezza quando possibile con l'mRNA IVT. - Preparare la soluzione di miscela T704 e sPep diluendo la soluzione di sPep a 0,555 μg/μL e la soluzione di T704 a 8 μg/μL con acqua NF. Incubare la soluzione miscelata per 15 minuti a temperatura ambiente prima di un ulteriore utilizzo.
NOTA: calcolare il componente sPep richiesto in base al rapporto N/P desiderato. Il rapporto N/P è il numero totale di residui di azoto (N) all'interno dello sPep rispetto al numero totale di gruppi fosfato (P) caricati negativamente all'interno dell'mRNA IVT. Calcolare il T704 richiesto in base al rapporto peso/peso (w/w) tra T704 e mRNA IVT. È necessario che il rapporto N/P sia 5 e il rapporto w/w sia 100. - Preparare la formulazione di mRNA/PP-sNp IVT seguendo i passaggi seguenti.
- Aspirare la soluzione di mRNA IVT (fase 3) in una siringa da 1 ml, assicurandosi che non vi siano vuoti d'aria o bolle nella punta della siringa. Caricare la siringa in un lato della cartuccia accanto al blocco rotante.
- Riempire una siringa da 1 mL con la soluzione di miscela T704 e sPep (fase 4). Rimuovere eventuali bolle o vuoti d'aria sulla punta della siringa e inserire la siringa nell'altro ingresso della pompa (vedere la tabella dei materiali).
- Impostare la pompa con un rapporto di flusso di 1:1 e una portata totale di 4-10 ml/min.
NOTA: Una portata totale di 6 ml/min è ottimale negli studi qui presentati. - Posizionare un tubo conico privo di RNasi da 10 mL (vedere Tabella dei materiali) per raccogliere la soluzione mista IVT-mRNA/PP-sNp alla fine del percorso di flusso del dispositivo di miscelazione.
- Far funzionare la pompa per avviare la miscelazione, assicurandosi che i parametri siano inseriti correttamente. Dopo che la pompa ha finito di funzionare per 6 s, raccogliere il campione IVT-mRNA/PP-sNp dal tubo conico.
NOTA: PP-sNp sono stati generati utilizzando un miscelatore microfluidico (Figura supplementare 1). Il dispositivo comprende una pompa a flusso costante, un dispositivo di collegamento, un chip e un dispositivo fisso. Nel processo di miscelazione, la pompa a flusso costante collegata al chip fornisce liquido al chip in base alla portata preimpostata. La pompa a flusso costante collegata può essere collegata a più canali di ingresso del chip con un singolo canale di uscita. I componenti del dispositivo, incluso il chip, sono stati ottenuti da fonti commerciali e assemblati razionalmente (vedi Tabella dei materiali). I parametri, come la portata e il volume della soluzione di mRNA IVT e della soluzione mista T704-sPep, possono differire da quelli visualizzati nel protocollo corrente se viene utilizzata una configurazione diversa e devono essere ottimizzati di conseguenza.
3. Misura del diametro idrodinamico e della polidispersione di IVT-mRNA/PP-sNp
- Diluire un'aliquota della soluzione di mRNA/PP-sNp IVT (fase 2) con acqua NF per ottenere un volume finale di 1 ml.
- Misurare la dimensione idrodinamica e l'indice di polidispersione (PDI) utilizzando una cuvetta semi-micro25. Aggiungere la soluzione di mRNA/PP-sNp IVT nella cuvetta e inserirla nel misuratore di dimensioni delle particelle (vedere Tabella dei materiali). Impostare una procedura operativa standard e cliccare su Start per iniziare l'acquisizione dei dati.
4. Preparazione delle cellule per la trasfezione
- Placcare cellule epiteliali bronchiali umane (16HBE) e una linea cellulare dendritica (DC2.4) in piastre a 96 pozzetti ad una densità di 3,5 x 104 cellule/pozzetto 24 ore prima della trasfezione. Coltivare le cellule in un terreno di coltura integrato con il 10% di siero fetale bovino inattivato dal calore e l'1% di penicillina / streptomicina.
NOTA: Le celle sono state ottenute da una fonte commerciale (vedi Tabella dei materiali). - Incubare le cellule in un incubatore (37 °C e 5% di CO2 atmosfera) per 24 ore per garantire che le cellule siano confluenti al 60%-80% prima della trasfezione.
5. Trasfezione delle cellule in coltura
- Dopo aver rimosso il terreno di coltura, lavare le cellule placcate con 0,2 ml / pozzetto 1x PBS.
- Aggiungere 170 μL di terreno di coltura privo di siero a ciascun pozzetto contenente le colture cellulari placcate.
- Aggiungere la formulazione IVT mRNA/PP-sNp contenente 0,4 μg di mRNA MetLuc (preparato al punto 2) goccia a goccia con una quantità di 30 μL/pozzetto.
- Incubare le cellule con la formulazione IVT mRNA/PP-sNp a 37 °C in atmosfera umidificata arricchita con CO2 al 5% per 4 ore.
- Sostituire il terreno di trasfezione con 0,2 ml di terreno di coltura fresco integrato con il 10% di siero fetale bovino inattivato dal calore e l'1% (v/v) di penicillina/streptomicina.
NOTA: Il siero fetale bovino è stato riscaldato a 56 °C per 30 minuti per l'inattivazione. - Incubare le cellule trasfettate a 37 °C e in atmosfera arricchita di CO2 al 5% per 24 ore e raccogliere i surnatanti da rilevare da ciascun pozzetto.
6. Analisi dell'efficacia della trasfezione cellulare mediante saggio Metridia luciferasi (MetLuc)
- Analizzare il surnatante da ciascun pozzetto per l'attività di MetLuc utilizzando il substrato di celenterazina (vedere la tabella dei materiali) seguendo i passaggi seguenti.
- Preparare una nuova soluzione di analisi aggiungendo 1x PBS al substrato di celenterazina (la concentrazione di celenteraszina è di 15 mM).
- Vortex la soluzione di celenterazina per 10 s per una miscelazione accurata.
- Aggiungere 50 μL di surnatante (raccolto al punto 5) in una piastra da 96 pozzetti.
- Impostare il lettore di micropiastre (vedere Tabella dei materiali) con un tempo di lettura di 1.000 ms prima di aggiungere 30 μL di soluzione di celenterazina (15 mM) a ciascun pozzetto manualmente o mediante iniezione automatica.
- Fare clic su Start per misurare il segnale di luminescenza immediatamente dopo aver aggiunto la soluzione di celenterazina al surnatante.
NOTA: Il segnale di luminescenza viene misurato utilizzando un lettore di micropiastre e la sua attività è espressa in unità di luce relative. I valori ottenuti dai pozzi trasfettati PBS saranno utilizzati come controlli in bianco.
Risultati
Il plasmide ricombinante è stato digerito per produrre il modello di DNA linearizzato (Figura 2A). Utilizzando il protocollo descritto, il kit di trascrizione in vitro T7 può produrre fino a 80-120 μg di MetLuc-mRNA senza cappuccio per reazione di 20 μL e 50-60 μg di MetLuc-mRNA limitato per 100 μL di reazione. Quando analizzato con elettroforesi, l'mRNA MetLuc intatto con alta qualità dovrebbe mostrare una banda singola e chiara, come mostrato in Figura 2B. I contaminanti introdotti nella reazione dal modello di DNA potrebbero causare la degradazione dell'RNA e una resa inferiore.
PP-sNp contenenti l'mRNA MetLuc (MetLuc-mRNA/PP-sNp) sono stati preparati utilizzando il metodo di miscelazione microfluidica (Figura 1). La Tabella 1 mostra i dati sulla caratterizzazione fisico-chimica del MetLuc-mRNA/PP-sNp come esempi. Il raggio idrodinamico del MetLuc-mRNA/PP-sNp potrebbe essere considerato corretto se varia intorno ai 70-100 nm. Inoltre, il PDI del PP-sNp deve essere costante e preferibilmente inferiore a 0,2, ma sono accettati valori PDI fino a circa 0,3.
Dopo aver incorporato con successo MetLuc-mRNA nel PP-sNp, la formulazione può essere incubata con cellule 16HBE e una linea cellulare dendritica (DC2.4), e l'efficienza di trasfezione di MetLuc-mRNA può essere indicata dall'attività luciferasica all'interno del surnatante di coltura cellulare 24 ore dopo la trasfezione. La Figura 3 è un tipico esempio della trasfezione riuscita di MetLuc-mRNA/PP-sNp. Si può vedere chiaramente che le cellule trasfettate con MetLuc-mRNA/PP-sNp hanno mostrato un'espressione significativamente più elevata di luciferasi rispetto a quelle trasfettate con reggente di trasfezione a base lipidica (LP) disponibile in commercio (vedi Tabella dei materiali), MetLuc-mRNA nudo (controllo negativo), PBS (controllo in bianco) o soluzione mista T704-sPep (controllo simulato) in cellule 16HBE. MetLuc-mRNA/PP-sNp ha anche mostrato una maggiore espressione di luciferasi rispetto alla LP. I dati suggeriscono che il sistema di rilascio di PP-sNp è importante per proteggere l'mRNA MetLuc dalla degradazione e per promuovere l'efficienza di trasfezione dell'mRNA esogeno MetLuc. Pertanto, i sistemi di rilascio come PP-sNp sono generalmente essenziali per gli studi di trasfezione dell'mRNA IVT.
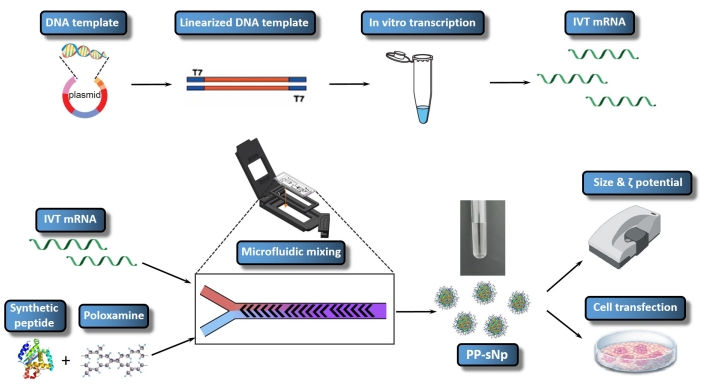
Figura 1: Rappresentazione schematica dell'intero flusso di lavoro di mRNA/PP-sNp IVT. Il modello di DNA è collegato al plasmide mediante costruzione plasmidica ricombinante. Il modello di DNA linearizzato è assemblato utilizzando la digestione enzimatica di restrizione. L'mRNA trascritto in vitro (IVT mRNA) viene sintetizzato e riassunto dal modello di DNA linearizzato. La soluzione di T704-sPep contiene T704 e il peptide sintetico (sPep), mentre la soluzione di mRNA IVT contiene MetLuc-mRNA. Le soluzioni miscelate di mRNA IVT e T704-sPep vengono miscelate utilizzando un miscelatore microfluidico, che forma MetLuc-mRNA/PP-sNp. Successivamente, la caratterizzazione di MetLuc-mRNA/PP-sNp viene eseguita per determinare la dimensione delle particelle e la polidispersività utilizzando uno Zetasizer. Le cellule 16HBE vengono trasfettate con MetLuc-mRNA/PP-sNp e l'attività della luciferasi all'interno del surnatante viene misurata per valutare l'efficienza della trasfezione. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: La produzione di MetLuc-mRNA. (A) Il modello di DNA contiene un promotore della polimerasi T7, una regione 5'non traslata (UTR), un frame di lettura aperto (ORF) di MetLuc, un 3'UTR e code di poli (A). (B) Rilevamento dell'elettroforesi. La freccia bianca indica plasmide ricombinante. La freccia gialla indica il vettore PUC57. La freccia rossa indica il modello di DNA per la trascrizione in vitro di MetLuc-mRNA. La freccia verde indica l'mRNA MetLuc senza cappuccio. La freccia blu indica l'mRNA MetLuc limitato. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Efficienza di trasfezione di MetLuc-mRNA/PP-sNp in cellule 16HBE e DC2.4. MetLuc-mRNA è stato trasfettato utilizzando PP-sNp in (A) cellule 16HBE e (B) una linea cellulare dendritica (DC2.4). La concentrazione finale di MetLuc-mRNA era di 0,02 μg/μL, quella di sPep era di 0,139 μg/μL e quella di T704 era di 2 μg/μL in PP-sNp. Il reggente commerciale della trasfezione a base lipidica (LP) è stato adottato come controllo positivo. L'attività della luciferasi è stata misurata 24 ore dopo la trasfezione. Il campione trattato con PBS è stato adottato come controllo in bianco. La soluzione mista T704-sPep è stata adottata come controllo simulato. Le differenze statistiche sono state analizzate con un t-test di Student (ns p ≥ 0,05, * p < 0,05). Fare clic qui per visualizzare una versione ingrandita di questa figura.
| MRNA IVT | N/P (sPep) | l/n (T704) | Dimensioni (nm) | PdI | Zeta |
| 17,5 ng/μL | 5 | 100 | 85.12 ± 9.40 | 0,20 ± 0,07 | -13,07 ± 0,47 |
Tabella 1: Dati di caratterizzazione fisico-chimica del MetLuc-mRNA/PP-sNp.
Figura supplementare 1: La configurazione del dispositivo microfluidico preparato internamente utilizzato nel presente studio. Clicca qui per scaricare questo file.
File supplementare 1: La sequenza di codifica del modello di DNA. Clicca qui per scaricare questo file.
Discussione
Il protocollo qui descritto non solo consente la produzione economica e rapida di formulazioni di vaccini mRNA IVT con proprietà definite, ma offre anche la possibilità di personalizzare la formulazione PP-sNp in base a specifici scopi terapeutici, come la terapia genica. Al fine di garantire il successo della generazione di mRNA / PP-sNp IVT, si suggerisce di prestare particolare attenzione ad alcuni passaggi critici. Quando si lavora con l'mRNA, ricordare sempre che le condizioni libere da RNasi devono essere mantenute durante tutto il processo perché l'mRNA IVT è molto sensibile per quanto riguarda la degradazione da parte della RNasi, anche se l'mRNA IVT è stato preparato con modificazioni chimiche. Nel frattempo, un ambiente privo di RNasi deve essere garantito anche durante la conservazione delle formulazioni. Si raccomanda di conservare l'mRNA/PP-sNp IVT a 2-8 °C per un massimo di 1 settimana. I risultati presentati dimostrano che l'acqua priva di nucleasi è efficace nel formare con successo PP-sNp con un'elevata efficienza di trasfezione. Altri buffer, come PBS, soluzione salina, OptiMEM, ecc., Possono essere utilizzati se lo si desidera. Si raccomanda di eseguire le trasfezioni in vitro utilizzando mRNA/PP-sNp IVT in un mezzo OptiMEM al fine di garantire la vitalità delle cellule in coltura. Se per preparare la formulazione viene scelto un altro tampone anziché acqua priva di nucleasi, è importante utilizzare mRNA IVT con una bassa concentrazione (inferiore a 100 ng/ml); Altrimenti, le nanoparticelle tendono ad essere precipitate, il che, a sua volta, rende una formulazione non valida. La causa di questo fenomeno è la porzione cationica all'interno del peptide sintetico. Inoltre, la forte densità di carica positiva della nanoparticella può destabilizzare la membrana cellulare, inducendo così una significativa citotossicità. Tuttavia, è stato dimostrato nello studio precedente che la carica positiva all'interno del PP-sNp è indispensabile nel mediare l'assorbimento efficiente dell'mRNA IVT, la fuga dell'endosoma e la trasfezione di successo23. Di conseguenza, è importante regolare la carica positiva all'interno del PP-sNp per raggiungere un delicato equilibrio in termini di efficienza e tossicità.
Il protocollo presentato può essere applicato a varie formulazioni basate su PP-sNp con alcune modifiche ai parametri. Per la somministrazione di vaccini basati su mRNA IVT, le proprietà biofisiche come la dimensione delle particelle e l'indice di polidispersità sono fondamentali per l'efficienza di trasfezione e l'immunogenicità delle nanoparticelle preparate26. La dimensione delle particelle dell'mRNA/PP-sNp IVT su scala nanometrica consente un trasferimento efficiente attraverso le barriere fisiologiche ed è, quindi, importante per le successive applicazioni in vivo. È stato riportato che gli LNP nella gamma di dimensioni di 60-150 nm producono robuste risposte immunitarie nei primati non umani26. D'altra parte, le nanoparticelle di grandi dimensioni (ad esempio, 400-1000 nm) non sono state in grado di superare la barriera del muco delle vie aeree quando applicate per la somministrazione polmonare perché, come rivelato da precedenti indagini, la spaziatura media delle maglie 3-dimensionali dei pori della maglia del muco delle vie aeree varia da circa 60-300 nm27,28. Se la dimensione desiderata o l'efficienza di trasfezione non vengono raggiunte, alcuni suggerimenti per iniziare la risoluzione dei problemi comprendono la regolazione della quantità di poloxamina o componenti peptidici sintetici utilizzati. Lo studio precedente ha rivelato che parametri aggiuntivi, come la quantità di mRNA IVT utilizzato per la trasfezione, il tempo di incubazione e i tipi e la densità cellulare delle cellule in coltura, potrebbero anche influenzare significativamente l'esito della trasfezione23. Inoltre, poiché la porzione di targeting all'interno del PP-sNp consente la consegna specifica dell'mRNA IVT incapsulato in cellule che mostrano recettori correlati, la sostituzione con ligandi bersaglio alternativi potrebbe essere necessaria se le cellule bersaglio sono trasfettate con altri tipi piuttosto che con cellule correlate alle vie aeree. Nel complesso, il protocollo potrebbe ancora essere migliorato con approfondimenti più dettagliati e ulteriori esami.
Considerando che l'originale mRNA/PP-sNp IVT viene preparato inizialmente mediante miscelazione manuale diretta, le capacità dell'operatore svolgono un ruolo importante nel controllo della qualità della formulazione. Le modifiche nel processo di miscelazione dell'mRNA IVT con i componenti del PP-sNp possono portare a microparticelle di grandi dimensioni piuttosto che a particelle di dimensioni nanometriche. Il passo più difficile è mescolare l'mRNA e il peptide sintetico, che deve essere fatto in modo controllato. Al fine di migliorare la riproducibilità tra diversi lotti di formulazione IVT mRNA/PP-sNp, è stato adottato un miscelatore microfluidico perché lo screening a basso volume, la velocità elevata e la riproducibilità sono caratteristiche importanti dell'utilizzo del metodo microfluidico29. Questo metodo ha mostrato una buona riproducibilità, senza alcun impatto significativo sulla dimensione delle particelle né sull'efficienza di trasfezione osservata tra i diversi lotti. Questo è un criterio essenziale per i vaccini basati su mRNA IVT da applicare in applicazioni cliniche. In particolare, il miscelatore microfluidico non deve superare il numero massimo di utenti (raccomandato dal produttore) e deve essere cambiato tra formulazioni con composizioni diverse.
Il protocollo di trascrizione dell'mRNA IVT descritto in questo protocollo può teoricamente essere utilizzato per preparare qualsiasi proteina/antigene reporter di interesse. La Metridia luciferasi (MetLuc) è stata specificamente applicata in questo studio perché contiene vantaggi unici. Il test di attività di MetLuc è facile da eseguire con alta sensibilità perché MetLuc può produrre un segnale bioluminescente intensivo e potrebbe essere secreto direttamente nel mezzo cellulare, evitando così la necessità di lisi cellulare. È importante notare che l'espressione di MetLuc nelle cellule in coltura può essere influenzata da molti parametri (ad esempio, numero variabile di cellule per pozzetto ed errori di pipettaggio, ecc.) diversi dalla funzionalità dell'mRNA MetLuc stesso.
Sebbene l'attuale protocollo sia stato stabilito per la consegna del vaccino mRNA IVT, può essere implementato anche per vaccini o terapie basati su altri tipi di acidi nucleici, come il DNA plasmidico (pDNA). Questo processo potrebbe essere adattato ai cambiamenti dei peptidi sintetici, degli acidi nucleici e dei componenti della poloxamina per lo sviluppo di particolari PP-sNp per varie indicazioni cliniche. Infatti, l'integrazione del genoma del gene CFTR (Transmembrane Transduction Regulator) della fibrosi cistica esogena nel tessuto epiteliale respiratorio di topi knockout CFTR con l'utilizzo di uno strumento di modificazione genetica della Bella Addormentata nel Bosco fornito da un PP-sNp23 è stata raggiunta con successo. Per quanto riguarda le applicazioni terapeutiche, le formulazioni di mRNA/PP-sNp IVT potrebbero essere utilizzate come aerosol utilizzando dispositivi di nebulizzazione specifici per la cura di malattie polmonari, come il deficit di α1-antitripsina o la fibrosi cistica30. Tuttavia, vale la pena notare che le formulazioni di mRNA / PP-sNp IVT per la nebulizzazione dovrebbero essere ottimizzate e personalizzate, poiché l'mRNA IVT aerosolizzato potrebbe essere inefficiente a causa della forza di taglio creata dal nebulizzatore e della natura fragile dell'mRNA IVT30. Inoltre, il protocollo è probabilmente scalabile a volumi maggiori utilizzando diversi dispositivi di miscelazione microfluidica, come i dispositivi di miscelazione a giunzione T e persino le pompe di miscelazione a getto di impatto31,32.
In sintesi, il protocollo qui descritto introduce un metodo riproducibile per formulare mRNA IVT in un sistema di consegna PP-sNp, nonché una successiva trasfezione affidabile in cellule in coltura. Il metodo descritto garantisce un approccio accessibile e semplice alla produzione di mRNA/PP-sNp IVT utilizzando un miscelatore microfluidico. Le formulazioni preparate con particelle di piccole dimensioni e basso indice di polidispersione possono essere successivamente applicate per trasfettare in modo sicuro ed efficiente le cellule coltivate. Questo protocollo consentirà al sistema di consegna basato su PP-sNp di diventare disponibile per la comunità accademica per la progettazione di nuovi vaccini o terapie basati su mRNA IVT, evitando tutti gli inconvenienti menzionati. Con i profili flessibili di PP-sNp, si prevede che numerose applicazioni future saranno raggiunte con PP-sNp per produrre terapie distinte per affrontare varie malattie.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (NSFC, Grant No. 82041045 and 82173764), dal grande progetto di Study on Pathogenesis and Epidemic Prevention Technology System (2021YFC2302500) del Ministero della Scienza e della Tecnologia della Cina, dal Chongqing Talents: Exceptional Young Talents Project (CQYC202005027) e dalla Natural Science Foundation di Chongqing (cstc2021jcyj-msxmX0136). Gli autori sono grati al Dr. Xiaoyan Ding per aver misurato il diametro idrodinamico (nm) e l'indice di polidispersità (PDI).
Materiali
| Name | Company | Catalog Number | Comments |
| BamHI | Takara | 1010 | |
| cap 1 capping system | Jinan | M082 | |
| Dendritic cell-line | Sigma | SCC142 | |
| DNA sequence | Genescript | ||
| Human bronchial epithelial cells | Sigma | SCC150 | |
| KpnI | Takara | 1068 | |
| LP | Beyotime | C0533 | |
| Lithium chloride | APEXBio | B6083 | |
| Malvern Zetasizer Nano ZS90 | Malvern | NB007605 | |
| Microfluidic chip | ZHONGXINQIHENG | Standard PDMS chip | |
| Microplate readers | ThermoFisher | Varioskan lux | |
| NanoDrop One | ThermoFisher | ND-ONE-W (A30221) | |
| Nuclease-free water | ThermoFisher | AM9932 | |
| OptiMEM | Gibco | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Pseudouridine | APE×Bio | B7972 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| Quanti-Luc | InvivoGen | Rep-qlc2 | |
| RiboRuler High Range RNA Ladder | ThermoFisher | SM1821 | |
| RNase-free conical tube | Biosharp | BS-100-M | |
| RPMI Medium 1640 | ThermoFisher | C11875500BT | |
| Syringe pump | Chemyx | Fusion 101 | |
| T7 transcription Kit | Jinan | E131 |
Riferimenti
- Fehervari, Z., Minton, K., Duarte, J. H. Nature milestones in vaccines. Springer Nature. , Available from: https://www.nature.com/collections/hcajdiajij (2020).
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 40 (6), 840-854 (2022).
- Mulligan, M. J., et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586 (7830), 589-593 (2020).
- Tang, J., et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa. Nanomaterials. 12 (2), 226(2022).
- Freyn, A. W., et al. A multi-targeting, nucleoside-modified mRNA influenza virus vaccine provides broad protection in mice. Molecular Therapy. 28 (7), 1569-1584 (2020).
- Wu, K., et al. Variant SARS-CoV-2 mRNA vaccines confer broad neutralization as primary or booster series in mice. Vaccine. 39 (51), 7394-7400 (2021).
- Chaudhary, N., Weissman, D., Whitehead, K. A. mRNA vaccines for infectious diseases: Principles, delivery and clinical translation. Nature Reviews Drug Discovery. 20, 817-838 (2021).
- Kormann, M. S. D., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature Biotechnology. 29 (2), 154-157 (2011).
- Tavernier, G., et al. mRNA as gene therapeutic: How to control protein expression. Journal of Controlled Release. 150 (3), 238-247 (2011).
- Walsh, E. E., et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. The New England Journal of Medicine. 383 (25), 2439-2450 (2020).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine. 384 (5), 403-416 (2021).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Sharova, L. V., et al. Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells. DNA Research. 16 (1), 45-58 (2009).
- Houseley, J., Tollervey, D. The many pathways of RNA degradation. Cell. 136 (4), 763-776 (2009).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Sahin, U., Karikó, K., Türeci, Ö MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13, 359-380 (2014).
- Hajj, K. A., Whitehead, K. A. Tools for translation: Non-viral materials for therapeutic mRNA delivery. Nature Reviews Materials. 2, 17056(2017).
- Deering, R. P., Kommareddy, S., Ulmer, J. B., Brito, L. A., Geall, A. J. Nucleic acid vaccines: Prospects for non-viral delivery of mRNA vaccines. Expert Opinion on Drug Delivery. 11 (6), 885-899 (2014).
- Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C., Thakur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics. 12 (2), 102(2020).
- Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nature Reviews Materials. 6 (12), 1078-1094 (2021).
- Sahin, U., et al. COVID-19 vaccine BNT162b1 elicits human antibody and T(H)1 T cell responses. Nature. 586 (7830), 594-599 (2020).
- Azzi, L., et al. Mucosal immune response in BNT162b2 COVID-19 vaccine recipients. EBioMedicine. 75, 103788(2022).
- Guan, S., et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis. Nature Nanotechnology. 14 (3), 287-297 (2019).
- Pitard, B., et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Research. 32 (20), 159(2004).
- Hiroi, T., Shibayama, M. Measurement of particle size distribution in turbid solutions by dynamic light scattering microscopy. Journal of Visualized Experiments. (119), e54885(2017).
- Hassett, K. J., et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. Journal of Controlled Release. 335, 237-246 (2021).
- Suk, J. S., et al. The penetration of fresh undiluted sputum expectorated by cystic fibrosis patients by non-adhesive polymer nanoparticles. Biomaterials. 30 (13), 2591-2597 (2009).
- Kim, N., Duncan, G. A., Hanes, J., Suk, J. S. Barriers to inhaled gene therapy of obstructive lung diseases: A review. Journal of Controlled Release. 240, 465-488 (2016).
- Liu, Z., Fontana, F., Python, A., Hirvonen, J. T., Santos, H. A. Microfluidics for production of particles: Mechanism, methodology, and applications. Small. 16 (9), 1904673(2020).
- Guan, S., Darmstädter, M., Xu, C., Rosenecker, J. In vitro investigations on optimizing and nebulization of IVT-mRNA formulations for potential pulmonary-based alpha-1-antitrypsin deficiency treatment. Pharmaceutics. 13 (8), 1281(2021).
- Shepherd, S. J., Issadore, D., Mitchell, M. J. Microfluidic formulation of nanoparticles for biomedical applications. Biomaterials. 274, 120826(2021).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon