Method Article
Effiziente Transfektion von in vitro transkribierter mRNA in kultivierten Zellen mit Peptid-Poloxamin-Nanopartikeln
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Ein selbstorganisiertes Peptid-Poloxamin-Nanopartikel (PP-sNp) wird unter Verwendung einer mikrofluidischen Mischvorrichtung entwickelt, um in vitro transkribierte Boten-RNA zu verkapseln und zu liefern. Die beschriebene mRNA/PP-sNp konnte kultivierte Zellen in vitro effizient transfizieren.
Zusammenfassung
In-vitro-transkribierte Boten-RNA (mRNA)-Impfstoffe haben ein enormes Potenzial im Kampf gegen die Coronavirus-Pandemie 2019 (COVID-19) gezeigt. Aufgrund der fragilen Eigenschaften der mRNA müssen effiziente und sichere Verabreichungssysteme in die mRNA-Impfstoffe aufgenommen werden. Ein selbstorganisierendes Peptid-Poloxamin-Nanopartikel (PP-sNp)-Genabgabesystem wurde speziell für die pulmonale Abgabe von Nukleinsäuren entwickelt und zeigt vielversprechende Fähigkeiten bei der Vermittlung einer erfolgreichen mRNA-Transfektion. Hier wird eine verbesserte Methode zur Herstellung von PP-sNp beschrieben, um zu erläutern, wie das PP-sNp Metridia luciferase (MetLuc) mRNA einkapselt und kultivierte Zellen erfolgreich transfiziert. MetLuc-mRNA wird durch einen in vitro Transkriptionsprozess aus einer linearen DNA-Vorlage gewonnen. Ein PP-sNp wird durch Mischen von synthetischem Peptid / Poloxamin mit mRNA-Lösung unter Verwendung eines mikrofluidischen Mischers hergestellt, was die Selbstorganisation von PP-sNp ermöglicht. Die Ladung von PP-sNp wird anschließend durch Messung des Zetapotentials bewertet. Gleichzeitig werden die Polydispersität und hydrodynamische Größe von PP-sNp-Nanopartikeln mittels dynamischer Lichtstreuung gemessen. Die mRNA/PP-sNp-Nanopartikel werden in kultivierte Zellen transfiziert, und Überstände aus der Zellkultur werden auf Luciferase-Aktivität untersucht. Die repräsentativen Ergebnisse belegen ihre Fähigkeit zur In-vitro-Transfektion . Dieses Protokoll könnte Aufschluss über die Entwicklung von mRNA-Impfstoffverabreichungssystemen der nächsten Generation geben.
Einleitung
Die Impfung gilt als eine der effizientesten medizinischen Maßnahmen zur Verringerung der Morbidität und Mortalität durch Infektionskrankheiten1. Die Bedeutung von Impfstoffen zeigt sich seit dem Ausbruch der Coronavirus-Krankheit 2019 (COVID-19). Im Gegensatz zum traditionellen Konzept der Injektion inaktivierter oder lebend attenuierter Krankheitserreger konzentrieren sich moderne Impfstoffansätze, wie z. B. Impfstoffe auf Nukleinsäurebasis, darauf, die immunstimulierenden Eigenschaften der Zielpathogene zu erhalten und gleichzeitig die potenziellen Sicherheitsprobleme zu vermeiden, die mit den herkömmlichen ganzmikrobiellen Virus- oder bakterienbasierten Impfstoffen verbunden sind. Sowohl DNA- als auch RNA-Impfstoffe (d. h. in vitro transkribierte Boten-RNA, IVT mRNA) weisen ein prophylaktisches bis therapeutisches Potenzial gegen eine Vielzahl von Krankheiten, einschließlich Infektionskrankheiten undKrebs, auf 2,3. Grundsätzlich bezieht sich das Potenzial von Impfstoffen auf Nukleinsäurebasis auf ihre Herstellung, Wirksamkeit und Sicherheit4. Diese Impfstoffe können zellfrei hergestellt werden, um eine kostengünstige, skalierbare und schnelle Produktion zu ermöglichen.
Ein einziger Impfstoff auf Nukleinsäurebasis kann mehrere Antigene kodieren, was das Ziel zahlreicher viraler Varianten oder Bakterien mit einer reduzierten Anzahl von Impfungen ermöglicht und die Immunantwort gegen resistente Krankheitserreger stärkt 5,6. Außerdem könnten Impfstoffe auf Nukleinsäurebasis den natürlichen Invasionsprozess von Virus- oder Bakterieninfektionen nachahmen und sowohl B-Zell- als auch T-Zell-vermittelte Immunantworten hervorrufen. Im Gegensatz zu einigen virus- oder DNA-basierten Impfstoffen bieten IVT-mRNA-basierte Impfstoffe einen großen Sicherheitsvorteil. Sie können das gewünschte Antigen schnell im Zytosol exprimieren und sind nicht in das Wirtsgenom integriert, was Bedenken hinsichtlich der Insertionsmutagenese beseitigt7. IVT-mRNA wird nach erfolgreicher Translation automatisch abgebaut, so dass ihre Proteinexpressionskinetik leicht kontrolliert werden kann 8,9. Katalysiert durch die Pandemie des schweren akuten respiratorischen Syndroms Coronavirus 2 (SARS-CoV-2) haben die Bemühungen von Unternehmen / Institutionen weltweit die Markteinführung vieler Arten von Impfstoffen ermöglicht. Die IVT-mRNA-basierte Impfstofftechnologie zeigt großes Potenzial und hat zum ersten Mal ihren zuvor erwarteten Erfolg gezeigt, da sie schnell entwickelt und flexibel in der Lage ist, sich innerhalb weniger Monate an beliebige Zielantigene anzupassen. Der Erfolg von IVT-mRNA-Impfstoffen gegen COVID-19 in klinischen Anwendungen eröffnete nicht nur eine neue Ära der Forschung und Entwicklung von IVT-mRNA-Impfstoffen, sondern sammelte auch wertvolle Erfahrungen für die schnelle Entwicklung wirksamer Impfstoffe zur Behandlung von Ausbrüchen von Infektionskrankheiten10,11.
Trotz des vielversprechenden Potenzials von IVT-mRNA-Impfstoffen stellt die effiziente intrazelluläre Abgabe von IVT-mRNA an den Wirkort (d. h. Zytoplasma) weiterhin eine große Hürdedar 12, insbesondere für diejenigen, die über die Atemwege verabreichtwerden 4. IVT mRNA ist von Natur aus ein instabiles Molekül mit einer extrem kurzen Halbwertszeit (~7 h)13, was IVT mRNA sehr anfällig für den Abbau durch die ubiquitäre RNase14 macht. Die Lymphozyten des angeborenen Immunsystems neigen dazu, die anerkannte IVT-mRNA in Fällen der in vivo-Anwendung zu verschlingen. Darüber hinaus beeinträchtigen die hohe negative Ladungsdichte und das große Molekulargewicht (1 x 104-1 x 106 Da) der IVT-mRNA ihre effektive Permeation über die anionische Lipiddoppelschicht von Zellmembranen15. Daher ist ein Abgabesystem mit bestimmten biofunktionellen Materialien erforderlich, um den Abbau der IVT-mRNA-Moleküle zu hemmen und die zelluläre Aufnahme zu erleichtern16.
Abgesehen von einigen Ausnahmefällen, in denen nackte IVT-mRNA direkt für in vivo Untersuchungen verwendet wurde, werden verschiedene Abgabesysteme verwendet, um IVT-mRNA zum therapeutischen Wirkortzu transportieren 17,18. Frühere Studien haben gezeigt, dass nur wenige IVT-mRNAs im Zytosol ohne die Hilfe eines Abgabesystems nachgewiesen werden19. Zahlreiche Strategien wurden entwickelt, um die RNA-Lieferung mit kontinuierlichen Bemühungen auf diesem Gebiet zu verbessern, die von der Protaminkondensation bis zur Lipidverkapselung reichen20. Lipid-Nanopartikel (LNPs) sind die klinisch am weitesten fortgeschrittenen mRNA-Verabreichungsvehikel, wie die Tatsache beweist, dass alle zugelassenen mRNA-COVID-19-Impfstoffe für den klinischen Gebrauch LNP-basierte Verabreichungssysteme verwenden21. LNPs können jedoch keine effektive mRNA-Transfektion vermitteln, wenn die Formulierungen über den respiratorischen Weg22 verabreicht werden, was die Anwendung dieser Formulierungen bei der Induktion von Schleimhautimmunantworten oder bei der Behandlung pulmonalbedingter Erkrankungen wie Mukoviszidose oder α1-Antitrypsin-Mangel bemerkenswert einschränkt. Daher ist die Entwicklung eines neuartigen Abgabesystems erforderlich, um die effiziente Abgabe und Transfektion von IVT-mRNA in atemwegsbezogenen Zellen zu erleichtern, um diesen ungedeckten Bedarf zu decken.
Es wurde bestätigt, dass das Peptid-Poloxamin-selbstorganisierende Nanopartikel-Abgabesystem (PP-sNp) die effiziente Transfektion von Nukleinsäuren in den Atemwegen von Mäusen vermitteln kann23. Das PP-sNp verfolgt einen multifunktionalen modularen Designansatz, der verschiedene Funktionsmodule in die Nanopartikel für ein schnelles Screening und Optimierung integrieren kann23. Die synthetischen Peptide und elektrisch neutralen amphiphilen Blockcopolymere (Poloxamin) innerhalb des PP-sNp können spontan mit IVT-mRNA interagieren, um gleichmäßig verteilte Nanopartikel mit kompakter Struktur und glatter Oberfläche zu erzeugen23. PP-sNp kann den Gentransfektionseffekt von IVT-mRNA-Molekülen in kultivierten Zellen und den Atemwegen von Mäusen verbessern23. Die vorliegende Studie beschreibt ein Protokoll zur Erzeugung von PP-sNp mit IVT-mRNA, das Metridia luciferase (MetLuc-mRNA) kodiert (Abbildung 1). In diesem Protokoll wird eine kontrollierte und schnelle Durchmischung über eine mikrofluidische Mischvorrichtung verwendet, die das versetzte Fischgrätenmischdesign verwendet. Das Verfahren ist einfach durchzuführen und ermöglicht die Erzeugung von PP-sNp mit einheitlicheren Größen. Das allgemeine Ziel der PP-sNp-Produktion mit dem mikrofluidischen Mischer ist es, PP-sNp für die mRNA-Komplexierung auf gut kontrollierte Weise zu erzeugen und so eine effiziente und reproduzierbare Zelltransfektion in vitro zu ermöglichen. Das vorliegende Protokoll beschreibt die Herstellung, Montage und Charakterisierung von PP-sNp enthaltender MetLuc-mRNA.
Protokoll
1. In-vitro-Transkription chemisch modifizierter mRNA
HINWEIS: Es ist erforderlich, nukleasefreie Röhrchen, Reagenzien, Glaswaren, Pipettenspitzen usw. zu verwenden, da RNasen in der Umwelt allgegenwärtig sind, wie Laborlösungen, Instrumentenoberflächen, Haare, Haut, Staub usw. Reinigen Sie die Tischoberflächen und Pipetten vor Gebrauch gründlich und tragen Sie Handschuhe, um eine RNase-Kontamination zu vermeiden.
- Führen Sie eine Linearisierung der DNA-Vorlage durch.
- Synthetisieren Sie den offenen Leserahmen (ORF) von Metridia luciferase (MetLuc), flankiert von einem T7-Polymerase-Promotor, 5' untranslatierten Region (UTR), 3'UTR und Poly (A) Schwänzen und klonen Sie ihn in den PUC57-Vektor, der in Bakterien exprimiert wird (siehe Materialtabelle).
HINWEIS: Die kodierende Sequenz der DNA-Vorlage ist in der Zusatzdatei 1 enthalten. - Bakterien kultivieren, die Bakterien lysieren und die Plasmid-DNA durch die entsprechende Spalte reinigen (siehe Plasmid-DNA-Extraktionskit in der Materialtabelle).
- Führen Sie eine einzelne 50-μL-Reaktion durch, die 2 μL BamHI, 2 μL KpnI (siehe Materialtabelle) und 2 μg Plasmid-DNA bei 37 °C für 1 h enthält, und erreichen Sie eine Linearisierung der DNA-Vorlage.
- Synthetisieren Sie den offenen Leserahmen (ORF) von Metridia luciferase (MetLuc), flankiert von einem T7-Polymerase-Promotor, 5' untranslatierten Region (UTR), 3'UTR und Poly (A) Schwänzen und klonen Sie ihn in den PUC57-Vektor, der in Bakterien exprimiert wird (siehe Materialtabelle).
- Führen Sie eine In-vitro-Transkription durch, um uncapped-IVT-mRNA zu erzeugen.
- Durchführung der mRNA-Synthese durch eine einzelne 20-μL-Reaktion unter Verwendung eines T7-Transkriptionskits und Pseudouridin (siehe Materialtabelle): 10 μL (0,8-1 μg) linearisierte DNA-Vorlage, 1,5 μL (150 mM) ATP, Pseudo-UTP, GTP und CTP, 2 μL 10x-Transkriptionspuffer, 1 μL T7-Enzym und 1 μL nukleasefreies Wasser (NF-Wasser). Die oben genannten Komponenten gründlich mischen und bei 37 °C 3 h inkubieren.
- Entfernen Sie die Vorlagen-DNA.
- Nach dem Transkriptionsprozess 1 μL (1 HE) DNase (RNase-frei) zugeben und 15 min bei 37 °C inkubieren.
- Führen Sie eine unverschlossene IVT-mRNA-Reinigung unter Verwendung von Lithiumchlorid-Fällung durch.
- Die unverschlossene IVT-mRNA wird mit Lithiumchlorid (siehe Materialtabelle) mit einer Arbeitskonzentration von 10 mM gereinigt. 50 μL 10 mM Lithiumchlorid zu 20 μL ungedeckelter IVT-mRNA-Lösung geben.
- Das gesamte Volumen gründlich mischen und bei −20 °C 1 h kalt stellen. Sammeln Sie die uncapped-IVT mRNA für 12 min bei 12.000 x g, die routinemäßig 80-120 μg uncapped-IVT mRNA aus jeder einzelnen 20 μL Reaktion produziert.
- Führen Sie ein IVT-mRNA-Capping durch.
- Führen Sie das IVT mRNA Capping mit dem Cap 1 Capping System durch (siehe Materialtabelle). Kurz die Sekundärstruktur von 50 μg uncapped-IVT mRNA durch Erhitzen bei 65 °C für 10 min entfernen, dann das 5'-Ende der uncapped-IVT mRNA mit cap 1 verbinden, das durch Modifizieren der m7G-Cap-Struktur unter Verwendung von 2,5 μL s-Adenosylmethionin (SAM) (20 mM) und 4 μL 2'-O-Methyltransferase (100 U) in einer 100 μL Reaktion bei 37 °C für 30-60 min hergestellt wird.
- 100 μL der verschlossenen IVT mRNA mit 250 μL 10 mM Lithiumchlorid reinigen und in 50 μL NF-Wasser verdünnen.
- Bestimmen Sie die Reinheit und Molekülgröße der capped-IVT mRNA.
- Messen Sie die Konzentration der Capped-IVT-mRNA mit einem UV-sichtbaren Spektralphotometer. Analysieren Sie unter Verwendung eines RNA-Markers (siehe Materialtabelle) die Molekülgröße von Capped-IVT-mRNA in einem 1% Formaldehyd-denaturierenden Agarosegel, das 18% Formaldehyd enthält (Spannung ist 120 V). Stellen Sie sicher, dass die uncapped-IVT-mRNA und die Capped-IVT-mRNA bei −80 °C gelagert werden.
ANMERKUNG: Die IVT-mRNA wurde als gut rein in einem A 260/A 280-Verhältnis von 1,8-2,1 und einem A260/A 230-Verhältnis von 2,0 oder etwas höher angesehen.
- Messen Sie die Konzentration der Capped-IVT-mRNA mit einem UV-sichtbaren Spektralphotometer. Analysieren Sie unter Verwendung eines RNA-Markers (siehe Materialtabelle) die Molekülgröße von Capped-IVT-mRNA in einem 1% Formaldehyd-denaturierenden Agarosegel, das 18% Formaldehyd enthält (Spannung ist 120 V). Stellen Sie sicher, dass die uncapped-IVT-mRNA und die Capped-IVT-mRNA bei −80 °C gelagert werden.
2. Erzeugung von IVT mRNA/PP-sNp
- Poloxamin 704 (T704) Stammlösung wird durch Solubilisieren des T704 (siehe Materialtabelle) in NF-Wasser hergestellt, um eine 10 mg/ml Stammlösung zu erhalten. Die vorbereitete Lösung bei 4 °C lagern.
HINWEIS: T704 enthält eine X-förmige Struktur aus einer zentralen Ethylendiamingruppe, die an vier Ketten von Polypropylenoxid (PPO)-Blöcken und Polyethylenoxid (PEO)-Blöcken24 gebunden ist. Das Molekulargewicht (Mw) von T704 beträgt 5500. - Die Stammlösung des synthetischen Peptids (sPep, siehe Tabelle der Materialien) wird durch Solubilisierung des sPep (Sequenz: KETWWETWWTEWWWTEWTEWKKKKKKRRRRRKKKKGACSE
RSMNFCG) in NF-Wasser, um eine 2 mg/ml Stammlösung zu erhalten und bei 4 °C zu lagern. - Die IVT-mRNA-Lösung wird hergestellt, indem die IVT-mRNA (Schritt 1) auf Eis aufgetaut und kurz für 3 s bei 300 x g bei Raumtemperatur zentrifugiert wird, bevor das Röhrchen geöffnet wird. Die IVT-mRNA-Lösung wird mit NF-Wasser auf 0,04 μg/μL verdünnt.
HINWEIS: Es wird empfohlen, wann immer möglich in einer Biosicherheitswerkbank mit der IVT-mRNA zu arbeiten. - Die T704- und sPep-Mischlösung wird durch Verdünnen der sPep-Lösung auf 0,555 μg/μL und der T704-Lösung auf 8 μg/μL mit NF-Wasser hergestellt. Die Mischlösung vor der weiteren Verwendung 15 min bei Raumtemperatur inkubieren.
HINWEIS: Berechnen Sie die erforderliche sPep-Komponente basierend auf dem gewünschten N/P-Verhältnis. Das N/P-Verhältnis ist die Gesamtzahl der Stickstoffreste (N) innerhalb des sPep zur Gesamtzahl der negativ geladenen Phosphatgruppen (P) innerhalb der IVT-mRNA. Berechnen Sie das erforderliche T704 basierend auf dem Gewichts-/Gewichtsverhältnis (w/w) zwischen T704 und IVT mRNA. Es ist notwendig, dass das N/P-Verhältnis 5 und das W/W-Verhältnis 100 beträgt. - Bereiten Sie die IVT-mRNA/PP-sNp-Formulierung gemäß den folgenden Schritten vor.
- Ziehen Sie die IVT-mRNA-Lösung (Schritt 3) in eine 1-ml-Spritze, um sicherzustellen, dass keine Luftspalte oder Blasen in der Spritzenspitze entstehen. Legen Sie die Spritze in eine Seite der Patrone neben dem rotierenden Block ein.
- Füllen Sie eine 1-ml-Spritze mit der T704- und sPep-Mischlösung (Schritt 4). Entfernen Sie alle Blasen oder Luftspalte an der Spritzenspitze und setzen Sie die Spritze in den anderen Einlass der Pumpe ein (siehe Materialtabelle).
- Stellen Sie die Pumpe auf ein Durchflussverhältnis von 1:1 und einen Gesamtdurchfluss von 4-10 ml/min ein.
HINWEIS: Eine Gesamtdurchflussrate von 6 ml / min ist in den hier vorgestellten Studien optimal. - Legen Sie ein 10 mL RNase-freies konisches Röhrchen (siehe Materialtabelle), um die gemischte IVT-mRNA/PP-sNp-Lösung am Ende des Fließwegs der Mischvorrichtung zu sammeln.
- Führen Sie die Pumpe aus, um das Mischen zu starten, und stellen Sie sicher, dass die Parameter korrekt eingegeben werden. Nachdem die Pumpe 6 s lang gelaufen ist, sammeln Sie die IVT-mRNA/PP-sNp-Probe aus dem konischen Röhrchen.
HINWEIS: PP-sNp wurden mit einem mikrofluidischen Mischer erzeugt (ergänzende Abbildung 1). Das Gerät besteht aus einer Konstantstrompumpe, einer Verbindungsvorrichtung, einem Chip und einer festen Vorrichtung. Beim Mischprozess fördert die mit dem Chip verbundene Konstantstrompumpe Flüssigkeit entsprechend der voreingestellten Durchflussrate an den Chip. Die angeschlossene Durchflusspumpe kann mit einem einzigen Ausgangskanal an mehrere Eingangskanäle des Chips angeschlossen werden. Die Komponenten des Geräts, einschließlich des Chips, wurden aus kommerziellen Quellen gewonnen und rationell zusammengesetzt (siehe Materialtabelle). Die Parameter, wie Flussrate und Volumen der IVT-mRNA-Lösung und der T704-sPep-Mischlösung, können von denen abweichen, die im aktuellen Protokoll angezeigt werden, wenn ein anderer Aufbau verwendet wird, und müssen entsprechend optimiert werden.
3. Messung des hydrodynamischen Durchmessers und der Polydispersität von IVT-mRNA/PP-sNp
- Ein Aliquot der IVT mRNA/PP-sNp Lösung (Schritt 2) wird mit NF-Wasser verdünnt, um ein Endvolumen von 1 ml zu erhalten.
- Messung der hydrodynamischen Größe und des Polydispersitätsindex (PDI) mit einer Semimikroküvette25. Die IVT mRNA/PP-sNp Lösung in die Küvette geben und in das Partikelgrößenmessgerät geben (siehe Materialtabelle). Richten Sie eine Standardarbeitsanweisung ein und klicken Sie auf Start , um mit der Datenerfassung zu beginnen.
4. Vorbereitung der Zellen für die Transfektion
- Platte humaner Bronchialepithelzellen (16HBE) und einer dendritischen Zelllinie (DC2.4) in 96-Well-Platten mit einer Dichte von 3,5 x 104 Zellen/Vertiefung 24 h vor der Transfektion. Züchten Sie die Zellen in einem Kulturmedium, das mit 10% hitzeinaktiviertem fetalem Rinderserum und 1% Penicillin / Streptomycin ergänzt wird.
HINWEIS: Die Zellen wurden aus einer kommerziellen Quelle gewonnen (siehe Materialtabelle). - Inkubieren Sie die Zellen in einem Inkubator (37 °C und 5% CO2 Atmosphäre) für 24 Stunden, um sicherzustellen, dass die Zellen vor der Transfektion 60%-80% konfluent sind.
5. Transfektion der kultivierten Zellen
- Nach dem Entfernen des Wachstumsmediums waschen Sie die plattierten Zellen mit 0,2 ml/well 1x PBS.
- In jede Vertiefung, die die plattierten Zellkulturen enthält, werden 170 μL serumfreies Kulturmedium zugegeben.
- Fügen Sie die IVT mRNA/PP-sNp Formulierung mit 0,4 μg MetLuc mRNA (hergestellt in Schritt 2) tropfenweise mit einer Menge von 30 μL/Well hinzu.
- Inkubieren Sie die Zellen mit der IVT mRNA/PP-sNp Formulierung bei 37 °C in einer befeuchteten 5% CO 2-angereicherten Atmosphäre für 4 h.
- Ersetzen Sie das Transfektionsmedium durch 0,2 ml frisches Kulturmedium, ergänzt mit 10% hitzeinaktiviertem fetalem Rinderserum und 1% (v / v) Penicillin / Streptomycin.
HINWEIS: Das fetale Rinderserum wurde zur Inaktivierung 30 min lang auf 56 °C erhitzt. - Inkubieren Sie die transfizierten Zellen bei 37 °C und in einer 5%CO2-angereicherten Atmosphäre für 24 h und sammeln Sie die nachzuweisenden Überstände aus jeder Vertiefung.
6. Analyse der Wirksamkeit der Zelltransfektion mit Metridia luciferase (MetLuc) Assay
- Untersuchen Sie den Überstand aus jedem Bohrloch auf MetLuc-Aktivität unter Verwendung von Coelenterazin-Substrat (siehe Tabelle der Materialien) gemäß den folgenden Schritten.
- Bereiten Sie eine frische Assaylösung vor, indem Sie 1x PBS zum Coelenterazinsubstrat geben (die Konzentration von Coelenterazin beträgt 15 mM).
- Vortex die Coelenterazin-Lösung für 10 s für gründliches Mischen.
- Fügen Sie 50 μL Überstand (gesammelt in Schritt 5) zu einer 96-Well-Platte hinzu.
- Stellen Sie den Mikrotiterplattenleser (siehe Materialtabelle) mit einer Lesezeit von 1.000 ms ein, bevor 30 μL Coelenterazin-Lösung (15 mM) manuell oder durch automatisierte Injektion in jede Vertiefung gegeben werden.
- Klicken Sie auf Start , um das Lumineszenzsignal unmittelbar nach Zugabe der Coelenterazin-Lösung zum Überstand zu messen.
HINWEIS: Das Lumineszenzsignal wird mit einem Mikrotiterplattenleser gemessen und seine Aktivität wird in relativen Lichteinheiten ausgedrückt. Die von PBS-transfizierten Bohrlöchern erhaltenen Werte werden als Blindkontrollen verwendet.
Ergebnisse
Das rekombinante Plasmid wurde verdaut, um die linearisierte DNA-Vorlage herzustellen (Abbildung 2A). Unter Verwendung des beschriebenen Protokolls kann das T7 in vitro Transkriptionskit bis zu 80-120 μg unverschlossene MetLuc-mRNA pro 20 μL Reaktion und 50-60 μg verschlossene MetLuc-mRNA pro 100 μL Reaktion erzeugen. Bei der Analyse mit Elektrophorese sollte intakte MetLuc-mRNA mit hoher Qualität eine einzige und klare Bande aufweisen, wie in Abbildung 2B dargestellt. Verunreinigungen, die aus der DNA-Vorlage in die Reaktion eingebracht werden, könnten zu einem RNA-Abbau und einer geringeren Ausbeute führen.
PP-sNp, die die MetLuc-mRNA (MetLuc-mRNA/PP-sNp) enthalten, wurden mit dem mikrofluidischen Mischverfahren hergestellt (Abbildung 1). Tabelle 1 zeigt die Daten zur physikochemischen Charakterisierung der MetLuc-mRNA/PP-sNp als Beispiele. Der hydrodynamische Radius der MetLuc-mRNA/PP-sNp könnte als korrekt angesehen werden, wenn er etwa 70-100 nm beträgt. Außerdem muss der PDI des PP-sNp konstant sein und vorzugsweise unter 0,2 liegen, PDI-Werte bis etwa 0,3 werden jedoch akzeptiert.
Nach erfolgreichem Einbau von MetLuc-mRNA in das PP-sNp kann die Formulierung mit 16HBE-Zellen und einer dendritischen Zelllinie (DC2.4) inkubiert werden, und die Transfektionseffizienz von MetLuc-mRNA kann durch die Luciferase-Aktivität innerhalb des Zellkulturüberstands 24 h nach der Transfektion angezeigt werden. Abbildung 3 ist ein typisches Beispiel für die erfolgreiche Transfektion von MetLuc-mRNA/PP-sNp. Es ist deutlich zu erkennen, dass Zellen, die mit MetLuc-mRNA/PP-sNp transfiziert wurden, eine signifikant höhere Expression von Luciferase aufwiesen als solche, die mit kommerziell erhältlichen lipidbasierten Transfektionsregenten (LP) (siehe Materialtabelle), nackter MetLuc-mRNA (Negativkontrolle), PBS (Blindkontrolle) oder T704-sPep-Mischlösung (Scheinkontrolle) in 16HBE-Zellen transfiziert wurden. MetLuc-mRNA/PP-sNp zeigte auch eine höhere Expression von Luciferase im Vergleich zu LP. Die Daten deuten darauf hin, dass das PP-sNp-Abgabesystem wichtig ist, um die MetLuc-mRNA vor Abbau zu schützen und die Transfektionseffizienz der exogenen MetLuc-mRNA zu fördern. Daher sind Abgabesysteme wie PP-sNp im Allgemeinen für IVT-mRNA-Transfektionsstudien unerlässlich.
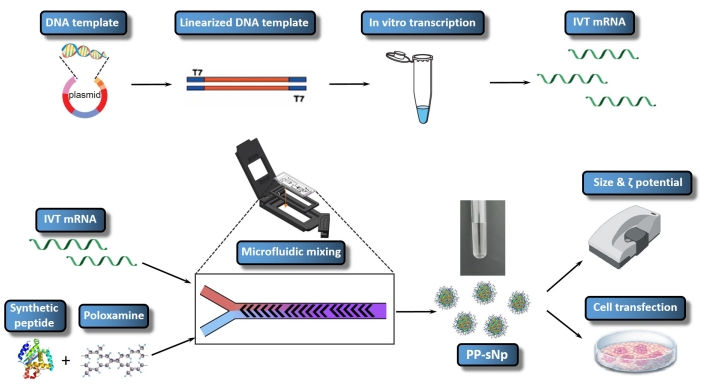
Abbildung 1: Schematische Darstellung des gesamten Workflows von IVT mRNA/PP-sNp. Die DNA-Vorlage ist durch rekombinante Plasmidkonstruktion mit dem Plasmid verknüpft. Die linearisierte DNA-Vorlage wird mittels Restriktionsenzymverdauung zusammengesetzt. In vitro transkribierte mRNA (IVT mRNA) wird synthetisiert und aus der linearisierten DNA-Vorlage verschlossen. Die T704-sPep-Lösung enthält T704 und das synthetische Peptid (sPep), während die IVT-mRNA-Lösung MetLuc-mRNA enthält. IVT mRNA und T704-sPep Mischlösungen werden unter Verwendung eines mikrofluidischen Mischers gemischt, der MetLuc-mRNA/PP-sNp bildet. Als nächstes wird die Charakterisierung von MetLuc-mRNA/PP-sNp durchgeführt, um die Partikelgröße und Polydispersität mit einem Zetasizer zu bestimmen. 16HBE-Zellen werden mit MetLuc-mRNA/PP-sNp transfiziert, und die Luciferase-Aktivität innerhalb des Überstands wird gemessen, um die Transfektionseffizienz zu bewerten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Die Produktion von MetLuc-mRNA. (A) Die DNA-Vorlage enthält einen T7-Polymerase-Promotor, eine 5'untraslated Region (UTR), einen offenen Leserahmen (ORF) von MetLuc, einen 3'UTR und Poly (A) Schwänze. (B) Elektrophorese-Detektion. Der weiße Pfeil zeigt rekombinantes Plasmid an. Der gelbe Pfeil zeigt den PUC57-Vektor an. Der rote Pfeil zeigt die DNA-Vorlage für die in vitro Transkription von MetLuc-mRNA an. Der grüne Pfeil zeigt uncapped MetLuc-mRNA an. Der blaue Pfeil zeigt die gekappte MetLuc-mRNA an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Transfektionseffizienz von MetLuc-mRNA/PP-sNp in 16HBE- und DC2.4-Zellen. MetLuc-mRNA wurde mit PP-sNp in (A) 16HBE-Zellen und (B) einer dendritischen Zelllinie (DC2.4) transfiziert. Die Endkonzentration von MetLuc-mRNA betrug 0,02 μg/μL, die von sPep 0,139 μg/μL und die von T704 2 μg/μL in PP-sNp. Kommerzieller lipidbasierter Transfektionsregent (LP) wurde als Positivkontrolle übernommen. Die Luciferase-Aktivität wurde 24 Stunden nach der Transfektion gemessen. Die PBS-behandelte Probe wurde als Blindkontrolle übernommen. Die T704-sPep-Mischlösung wurde als Mock-Control übernommen. Statistische Unterschiede wurden mit einem Student's t-Test (ns p ≥ 0,05, * p < 0,05) analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| IVT mRNA | N/P (sPep) | w/w (T704) | Größe (nm) | Pdi | Zeta |
| 17,5 ng/μL | 5 | 100 | 85,12 ± 9,40 | 0,20 ± 0,07 | -13,07 ± 0,47 |
Tabelle 1: Physikalisch-chemische Charakterisierungsdaten der MetLuc-mRNA/PP-sNp.
Ergänzende Abbildung 1: Der Aufbau des in der aktuellen Studie verwendeten selbst hergestellten mikrofluidischen Geräts. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Zusatzdatei 1: Die kodierende Sequenz der DNA-Vorlage. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das hier beschriebene Protokoll ermöglicht nicht nur die kostengünstige und schnelle Herstellung von IVT-mRNA-Impfstoffformulierungen mit definierten Eigenschaften, sondern bietet auch die Möglichkeit, die PP-sNp-Formulierung an spezifische therapeutische Zwecke, wie z.B. Gentherapie, anzupassen. Um die erfolgreiche Generierung von IVT mRNA/PP-sNp zu gewährleisten, wird empfohlen, einige kritische Schritte besonders zu beachten. Denken Sie bei der Arbeit mit mRNA immer daran, dass RNase-freie Bedingungen während des gesamten Prozesses aufrechterhalten werden sollten, da IVT-mRNA sehr empfindlich auf den Abbau durch RNase reagiert, auch wenn die IVT-mRNA mit chemischer Modifikation hergestellt wurde. Mittlerweile muss auch bei der Lagerung der Formulierungen auf eine RNase-freie Umgebung geachtet werden. Es wird empfohlen, IVT mRNA/PP-sNp bei 2-8 °C für bis zu 1 Woche zu lagern. Die vorgestellten Ergebnisse zeigen, dass nukleasefreies Wasser erfolgreich PP-sNp mit hoher Transfektionseffizienz bildet. Andere Puffer wie PBS, Kochsalzlösung, OptiMEM usw. können auf Wunsch verwendet werden. Es wird empfohlen, die In-vitro-Transfektionen mit IVT mRNA/PP-sNp in einem OptiMEM-Medium durchzuführen, um die Lebensfähigkeit der kultivierten Zellen sicherzustellen. Wenn zur Herstellung der Formulierung ein anderer Puffer anstelle von nukleasefreiem Wasser gewählt wird, ist es wichtig, IVT-mRNA mit einer niedrigen Konzentration (unter 100 ng / ml) zu verwenden. Andernfalls neigen die Nanopartikel dazu, ausgefällt zu werden, was wiederum zu einer ungültigen Formulierung führt. Die Ursache dieses Phänomens ist der kationische Anteil innerhalb des synthetischen Peptids. Darüber hinaus kann die starke positive Ladungsdichte des Nanopartikels die Zellmembran destabilisieren und so eine signifikante Zytotoxizität induzieren. In der vorherigen Studie wurde jedoch gezeigt, dass die positive Ladung innerhalb des PP-sNp für die Vermittlung einer effizienten IVT-mRNA-Zellaufnahme, der Endosomenflucht und der erfolgreichen Transfektion unerlässlich ist23. Daher ist es wichtig, die positive Ladung innerhalb des PP-sNp anzupassen, um ein empfindliches Gleichgewicht in Bezug auf Effizienz und Toxizität zu finden.
Das vorgestellte Protokoll kann mit einigen Parameteränderungen auf verschiedene PP-sNp-basierte Formulierungen angewendet werden. Für die Verabreichung von IVT-mRNA-basierten Impfstoffen sind biophysikalische Eigenschaften wie Partikelgröße und Polydispersitätsindex entscheidend für die Transfektionseffizienz und Immunogenität der hergestellten Nanopartikel26. Die Partikelgröße der IVT mRNA/PP-sNp im Nanometerbereich ermöglicht einen effizienten Transfer über physiologische Barrieren hinweg und ist damit wichtig für die nachfolgenden in vivo Anwendungen. Es wurde berichtet, dass LNPs im Größenbereich von 60-150 nm robuste Immunantworten bei nichtmenschlichen Primaten hervorrufen26. Auf der anderen Seite konnten großformatige Nanopartikel (z. B. 400-1000 nm) die Atemwegsschleimbarriere nicht überwinden, wenn sie für die pulmonale Verabreichung angewendet wurden, weil, wie frühere Untersuchungen ergaben, der durchschnittliche 3-dimensionale Netzabstand der Atemwegsschleimnetzporen von etwa 60-300 nm27,28 reicht. Wenn die gewünschte Größe oder Transfektionseffizienz nicht erreicht wird, umfassen einige Tipps für den Beginn der Fehlerbehebung die Anpassung der Menge an verwendeten Poloxamin- oder synthetischen Peptidkomponenten. Die vorherige Studie ergab, dass zusätzliche Parameter, wie die Menge der für die Transfektion verwendeten IVT-mRNA, die Inkubationszeit sowie die Typen und Zelldichte kultivierter Zellen, das Transfektionsergebnis ebenfalls signifikant beeinflussen könnten23. Da die Targeting-Einheit innerhalb des PP-sNp die spezifische Abgabe der verkapselten IVT-mRNA in Zellen mit verwandten Rezeptoren ermöglicht, könnte ein Ersatz durch alternative Zielliganden erforderlich sein, wenn die Zielzellen mit anderen Typen und nicht mit Atemwegszellen transfiziert werden. Insgesamt könnte das Protokoll mit detaillierteren Erkenntnissen und weiteren Untersuchungen noch verbessert werden.
Wenn man bedenkt, dass die ursprüngliche IVT mRNA/PP-sNp zunächst durch direktes manuelles Mischen hergestellt wird, spielen die Fähigkeiten des Bedieners eine wichtige Rolle bei der Kontrolle der Qualität der Formulierung. Modifikationen beim Mischen der IVT-mRNA mit den Komponenten des PP-sNp können eher zu großen Mikropartikeln als zu Partikeln in Nanogröße führen. Der schwierigste Schritt ist das Mischen der mRNA und des synthetischen Peptids, was kontrolliert erfolgen muss. Um die Reproduzierbarkeit zwischen verschiedenen Chargen der IVT mRNA/PP-sNp-Formulierung zu verbessern, wurde ein mikrofluidischer Mischer eingesetzt, da Screening mit geringem Volumen, schnelle Geschwindigkeit und Reproduzierbarkeit wichtige Merkmale der Verwendung der mikrofluidischen Methodesind 29. Diese Methode zeigte eine gute Reproduzierbarkeit, ohne signifikanten Einfluss auf die Partikelgröße oder die Transfektionseffizienz, die zwischen verschiedenen Chargen beobachtet wurde. Dies ist ein wesentliches Kriterium für IVT-mRNA-basierte Impfstoffe, die in klinischen Anwendungen eingesetzt werden können. Insbesondere sollte der mikrofluidische Mischer die vom Hersteller empfohlene maximale Anzahl von Anwendern nicht überschreiten und muss zwischen Formulierungen mit unterschiedlichen Zusammensetzungen gewechselt werden.
Das in diesem Protokoll beschriebene Protokoll der IVT-mRNA-Transkription kann theoretisch verwendet werden, um jedes Reporterprotein/Antigen von Interesse herzustellen. Die Metridia luciferase (MetLuc) wurde in dieser Studie speziell angewendet, da sie einzigartige Vorteile bietet. Der Aktivitätstest von MetLuc ist einfach mit hoher Empfindlichkeit durchzuführen, da MetLuc ein intensives biolumineszierendes Signal erzeugen kann, und es könnte direkt in das Zellmedium sezerniert werden, wodurch die Notwendigkeit einer Zelllyse vermieden wird. Es ist wichtig zu beachten, dass die MetLuc-Expression in den kultivierten Zellen durch viele andere Parameter (z. B. variierende Zellzahlen pro Vertiefung und Pipettierfehler usw.) beeinflusst werden kann, außer der Funktionalität der MetLuc-mRNA selbst.
Obwohl das aktuelle Protokoll für die Verabreichung des IVT-mRNA-Impfstoffs festgelegt wurde, kann es auch für Impfstoffe oder Therapeutika implementiert werden, die auf anderen Arten von Nukleinsäuren basieren, wie z. B. Plasmid-DNA (pDNA). Dieser Prozess könnte an synthetische Peptid-, Nukleinsäure- und Poloxaminkomponentenänderungen angepasst werden, um ein bestimmtes PP-sNp für verschiedene klinische Indikationen zu entwickeln. Tatsächlich wurde die Genomintegration des exogenen CFTR-Gens (Cystic Fibrosis Transmembrane Transduction Regulator) im respiratorischen Epithelgewebe von CFTR-Knockout-Mäusen unter Verwendung eines Dornröschen-Genmodifikationswerkzeugs eines PP-sNp23 erfolgreich erreicht. In Bezug auf therapeutische Anwendungen könnten IVT-mRNA/PP-sNp-Formulierungen als Aerosol unter Verwendung spezifischer Vernebelungsgeräte zur Heilung von Lungenerkrankungen wie α1-Antitrypsin-Mangel oder Mukoviszidose30 verwendet werden. Es ist jedoch erwähnenswert, dass IVT mRNA / PP-sNp Formulierungen für die Vernebelung optimiert und angepasst werden sollten, da die aerosolisierte IVT mRNA aufgrund der vom Vernebler erzeugten Scherkraft und der fragilen Natur der IVT mRNA30 ineffizient sein könnte. Darüber hinaus ist das Protokoll möglicherweise auf größere Volumina skalierbar, wobei verschiedene mikrofluidische Mischvorrichtungen, wie T-Junction-Mischvorrichtungen und sogar Impingement-Jet-Mischpumpen31,32, verwendet werden.
Zusammenfassend stellt das hier beschriebene Protokoll eine reproduzierbare Methode zur Formulierung von IVT-mRNA in einem PP-sNp-Abgabesystem sowie eine anschließende zuverlässige Transfektion in kultivierten Zellen vor. Das beschriebene Verfahren garantiert einen zugänglichen und einfachen Ansatz zur Herstellung von IVT mRNA/PP-sNp unter Verwendung eines mikrofluidischen Mischers. Die hergestellten Formulierungen mit kleinen Partikelgrößen und niedrigem Polydispersitätsindex können anschließend auf sicher und effizient transfizierte kultivierte Zellen aufgetragen werden. Dieses Protokoll wird es ermöglichen, dass das PP-sNp-basierte Verabreichungssystem der akademischen Gemeinschaft zur Verfügung steht, um neuartige IVT-mRNA-basierte Impfstoffe oder Therapeutika zu entwickeln und gleichzeitig alle genannten Nachteile zu vermeiden. Mit den flexiblen Profilen von PP-sNp werden voraussichtlich zahlreiche zukünftige Anwendungen mit PP-sNp erreicht, um unterschiedliche Therapeutika für verschiedene Krankheiten herzustellen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (NSFC, Grant No. 82041045 and 82173764), dem Großprojekt Study on Pathogenesis and Epidemic Prevention Technology System (2021YFC2302500) des chinesischen Ministeriums für Wissenschaft und Technologie, dem Chongqing Talents: Exceptional Young Talents Project (CQYC202005027) und der Natural Science Foundation of Chongqing (cstc2021jcyj-msxmX0136) unterstützt. Die Autoren danken Dr. Xiaoyan Ding für die Messung des hydrodynamischen Durchmessers (nm) und des Polydispersitätsindex (PDI).
Materialien
| Name | Company | Catalog Number | Comments |
| BamHI | Takara | 1010 | |
| cap 1 capping system | Jinan | M082 | |
| Dendritic cell-line | Sigma | SCC142 | |
| DNA sequence | Genescript | ||
| Human bronchial epithelial cells | Sigma | SCC150 | |
| KpnI | Takara | 1068 | |
| LP | Beyotime | C0533 | |
| Lithium chloride | APEXBio | B6083 | |
| Malvern Zetasizer Nano ZS90 | Malvern | NB007605 | |
| Microfluidic chip | ZHONGXINQIHENG | Standard PDMS chip | |
| Microplate readers | ThermoFisher | Varioskan lux | |
| NanoDrop One | ThermoFisher | ND-ONE-W (A30221) | |
| Nuclease-free water | ThermoFisher | AM9932 | |
| OptiMEM | Gibco | 31985070 | |
| Penicillin-streptomycin | Gibco | 15140122 | |
| Pseudouridine | APE×Bio | B7972 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27106 | |
| Quanti-Luc | InvivoGen | Rep-qlc2 | |
| RiboRuler High Range RNA Ladder | ThermoFisher | SM1821 | |
| RNase-free conical tube | Biosharp | BS-100-M | |
| RPMI Medium 1640 | ThermoFisher | C11875500BT | |
| Syringe pump | Chemyx | Fusion 101 | |
| T7 transcription Kit | Jinan | E131 |
Referenzen
- Nature milestones in vaccines. Springer Nature Available from: https://www.nature.com/collections/hcajdiajij (2020)
- Barbier, A. J., Jiang, A. Y., Zhang, P., Wooster, R., Anderson, D. G. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 40 (6), 840-854 (2022).
- Mulligan, M. J., et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature. 586 (7830), 589-593 (2020).
- Tang, J., et al. Nanotechnologies in delivery of DNA and mRNA vaccines to the nasal and pulmonary mucosa. Nanomaterials. 12 (2), 226 (2022).
- Freyn, A. W., et al. A multi-targeting, nucleoside-modified mRNA influenza virus vaccine provides broad protection in mice. Molecular Therapy. 28 (7), 1569-1584 (2020).
- Wu, K., et al. Variant SARS-CoV-2 mRNA vaccines confer broad neutralization as primary or booster series in mice. Vaccine. 39 (51), 7394-7400 (2021).
- Chaudhary, N., Weissman, D., Whitehead, K. A. mRNA vaccines for infectious diseases: Principles, delivery and clinical translation. Nature Reviews Drug Discovery. 20, 817-838 (2021).
- Kormann, M. S. D., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature Biotechnology. 29 (2), 154-157 (2011).
- Tavernier, G., et al. mRNA as gene therapeutic: How to control protein expression. Journal of Controlled Release. 150 (3), 238-247 (2011).
- Walsh, E. E., et al. Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. The New England Journal of Medicine. 383 (25), 2439-2450 (2020).
- Baden, L. R., et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. The New England Journal of Medicine. 384 (5), 403-416 (2021).
- Guan, S., Rosenecker, J. Nanotechnologies in delivery of mRNA therapeutics using nonviral vector-based delivery systems. Gene Therapy. 24 (3), 133-143 (2017).
- Sharova, L. V., et al. Database for mRNA half-life of 19 977 genes obtained by DNA microarray analysis of pluripotent and differentiating mouse embryonic stem cells. DNA Research. 16 (1), 45-58 (2009).
- Houseley, J., Tollervey, D. The many pathways of RNA degradation. Cell. 136 (4), 763-776 (2009).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Sahin, U., Karikó, K., Türeci, &. #. 2. 1. 4. ;. MRNA-based therapeutics-developing a new class of drugs. Nature Reviews Drug Discovery. 13, 359-380 (2014).
- Hajj, K. A., Whitehead, K. A. Tools for translation: Non-viral materials for therapeutic mRNA delivery. Nature Reviews Materials. 2, 17056 (2017).
- Deering, R. P., Kommareddy, S., Ulmer, J. B., Brito, L. A., Geall, A. J. Nucleic acid vaccines: Prospects for non-viral delivery of mRNA vaccines. Expert Opinion on Drug Delivery. 11 (6), 885-899 (2014).
- Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C., Thakur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics. 12 (2), 102 (2020).
- Hou, X., Zaks, T., Langer, R., Dong, Y. Lipid nanoparticles for mRNA delivery. Nature Reviews Materials. 6 (12), 1078-1094 (2021).
- Sahin, U., et al. COVID-19 vaccine BNT162b1 elicits human antibody and T(H)1 T cell responses. Nature. 586 (7830), 594-599 (2020).
- Azzi, L., et al. Mucosal immune response in BNT162b2 COVID-19 vaccine recipients. EBioMedicine. 75, 103788 (2022).
- Guan, S., et al. Self-assembled peptide-poloxamine nanoparticles enable in vitro and in vivo genome restoration for cystic fibrosis. Nature Nanotechnology. 14 (3), 287-297 (2019).
- Pitard, B., et al. Negatively charged self-assembling DNA/poloxamine nanospheres for in vivo gene transfer. Nucleic Acids Research. 32 (20), 159 (2004).
- Hiroi, T., Shibayama, M. Measurement of particle size distribution in turbid solutions by dynamic light scattering microscopy. Journal of Visualized Experiments. (119), e54885 (2017).
- Hassett, K. J., et al. Impact of lipid nanoparticle size on mRNA vaccine immunogenicity. Journal of Controlled Release. 335, 237-246 (2021).
- Suk, J. S., et al. The penetration of fresh undiluted sputum expectorated by cystic fibrosis patients by non-adhesive polymer nanoparticles. Biomaterials. 30 (13), 2591-2597 (2009).
- Kim, N., Duncan, G. A., Hanes, J., Suk, J. S. Barriers to inhaled gene therapy of obstructive lung diseases: A review. Journal of Controlled Release. 240, 465-488 (2016).
- Liu, Z., Fontana, F., Python, A., Hirvonen, J. T., Santos, H. A. Microfluidics for production of particles: Mechanism, methodology, and applications. Small. 16 (9), 1904673 (2020).
- Guan, S., Darmstädter, M., Xu, C., Rosenecker, J. In vitro investigations on optimizing and nebulization of IVT-mRNA formulations for potential pulmonary-based alpha-1-antitrypsin deficiency treatment. Pharmaceutics. 13 (8), 1281 (2021).
- Shepherd, S. J., Issadore, D., Mitchell, M. J. Microfluidic formulation of nanoparticles for biomedical applications. Biomaterials. 274, 120826 (2021).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten