Method Article
İn vitro Şok Dalga Tedavisi sonrası Eksozom İzolasyonu
Bu Makalede
Özet
Eksozomlar, şok dalgalarının in vitro uygulaması üzerine salınır. Burada, kültürlenmiş endotel hücrelerine şok dalgalarının nasıl uygulanacağını ve ardından daha fazla araştırma için eksozomların nasıl izole edileceğini açıklıyoruz.
Özet
Şok dalga tedavisi, lateral epikondilit (tenisçi dirseği) ve aşil tendiniti (topuk dikeni) gibi tendinopatilerin yanı sıra iyileşmeyen yara ve kemikleri içeren ortopedik endikasyonlarda rutin olarak uygulanmaktadır. Farklı patolojilere rağmen, şok dalgası tedavisinin anjiyojenik ve antienflamatuar etkisinin kombinasyonu yumuşak doku ve kemiklerde rejenerasyona yol açar. 30 yılı aşkın klinik uygulamada herhangi bir yan etki gözlenmemiştir. Ayrıca, temel araştırmalar iskemik miyokard üzerinde rejeneratif etkileri bile ortaya çıkardı.
Önceki bir çalışmada, kültürlenmiş hücrelerin mekanik uyaranının bir eksozom salınımı yoluyla biyolojik bir tepkiye çevrildiğini gösterebilirdik. Bununla birlikte, kesin mekanizma açıklığa kavuşturulmayı beklemektedir. Şok dalgası tedavisi uygulanırken mekanik bağlantı çok önemlidir, çünkü küçük hava kabarcıkları bile şok dalgalarını emebilir. Daha önce açıklanan su banyosu yöntemi, in vitro olarak yeterli ve tekrarlanabilir şok dalgası uygulamasını garanti etmek için geçerli bir yöntemdir.
Şok dalgası uygulamasından sonra kültürlenmiş hücrelerden eksozomları izole etmek için uygulanabilir ve tekrarlanabilir bir protokol geliştirebildik. Bu nedenle, mekanotransdüksiyonun altında yatan mekanizmaların yanı sıra şok dalgası salınan eksozomların rejeneratif ve anjiyojenik potansiyelini inceleme olasılığını gösteriyoruz.
Giriş
Şok dalgaları (SW), doğada kısa bir süre içinde yüksek miktarda enerji açığa çıktığında (örneğin, şimşek ile gök gürültüsü) ortaya çıkan ses basıncı dalgalarıdır. Klinik rutinde, 30 yılı aşkın bir süredir ilgili yan etkiler olmaksızın böbrek taşlarını parçalamak için litotripside şok dalgaları kullanılır 1,2. Tesadüfen, böbrek taşı parçalanmasından sonra X-ışınlarında iliak kemikte bir kalınlaşma gözlendi. Bu gözlem, kemik iyileşme bozuklukları üzerine yapılan araştırmalara temel oluşturmuş ve uzun kemik kaynamayanlarda tedaviye yol açmıştır 3,4,5.
Şok dalgası tedavisi için endikasyonlar genişletildi ve bugün yöntem, lateral epikondilit (tenisçi dirseği) ve Aşil tendiniti (topuk dikeni) gibi tendinopatiler dahil olmak üzere ortopedik endikasyonlarda rutin klinik kullanımda6,7. Ayrıca, temel araştırmalar, şok dalgası tedavisinin (SWT) yüksek anjiyojenik potansiyelini göstermiştir. Burada, bir çalışma, SWT üzerine VEGF (vasküler endotelyal büyüme faktörü), PIGF (plasental büyüme faktörü) ve FGF (vasküler endotelyal büyüme faktörü) gibi anjiyojenik büyüme faktörlerinde bir artış olduğunu ve ardından anjiyogenez8'i göstermiştir.
Şok dalgasına bağlı anjiyogenezin diğer patolojilerde olası yararlı rolünü araştırmak için, iskemik kalp hastalığınınbir hayvan modelinde SW tedavisi uyguladık 9,10. İskemik miyokardda rejeneratif bir etki gösterildikten sonra, doğuştan gelen immün reseptör TLR 3'ün (Toll benzeri reseptör 3) şok dalgası tedavisi11,12 üzerindeki vazgeçilmez rolünü belirleyebiliriz. Daha ileri çalışmalar, SW tedavisinin mekanik uyaranının eksozom salınımı yoluyla biyolojik bir sinyale çevrildiğini göstermiştir. Endotel hücrelerinden fizyolojik olarak salınan eksozomlarla karşılaştırıldığında, SWT üzerine salınan eksozomlar, artan bir anjiyojenik mikroRNA kargosu içerir. İskemik miyokard içine enjekte edilen SWT, eksozomları salgıladırejenerasyonu indükledi 13.
Hava SW'yi emdiğinden, aplikatör ve hücre kültürü şişeleri arasında mükemmel bir bağlantı çok önemlidir. Standartlaştırılmış bir su banyosu, SWT'yi in vitro olarak uygulamak için uygun bir yöntemi ve tekrarlanabilir bir deney düzeneğini temsil eder. Dalgaların yansımasını ve dolayısıyla girişimini önlemek için, kama şeklindeki bir emici, su banyosunun arkasına akan birincil dalgaları yok eder. Bu nedenle, sadece tarif edilen su banyosunu kullanarak in vitro şok dalgaları uygulamanızı öneririz.
Bu protokolde, anjiyojenik eksozomları süpernatan içine salmak için in vitro şok dalgalarının uygulanmasını tarif ediyoruz. Bu protokol, eksozomların mekanotransdüksiyondaki rolünü araştırma imkanı sağlar ve SWT üzerine eksozom salınımının daha fazla araştırılması için temel oluşturur.
Protokol
İnsan umbilikal ven endotel hücreleri Kadın Hastalıkları Bölümü'nde sezaryen ameliyatlarından elde edildi. Bu nedenle hastaların yazılı bilgilendirilmiş onamları alındı. Innsbruck Tıp Üniversitesi etik kurulundan izin verildi (no. UN4435).
NOT: Kontaminasyonu önlemek için steril bir laminer akış başlığı altında çalışın.
1. Deneyden 24 saat önce
- Gece boyunca 4 ° C'de ve 120.000 x g'da ultra santrifüj fetal sığır serumu (FCS) ile eksozom içermeyen endotelyal büyüme ortamı hazırlayın.
- 75 cm²'lik bir hücre kültürü şişesini %10 jelatin kullanarak kaplayın.
- Endotelyal büyüme ortamı kullanarak hücre kültürü şişesindeki insan endotel hücrelerini tohumlayın.
Deney günü:
NOT: 4 L ddH2O, eksozom içermeyen FCS, Endotel Hücre Büyümesi Bazal Ortam ve PBS'yi 37 ° C'ye kadar önceden ısıtın.
2. Şok dalgası tedavisi uygulamasını hazırlayın
- Ticari kitten (örneğin, Bullet Kit) takviyeler ekleyerek ve endotelyal büyüme ortamına ortak FCS yerine ultrasantrifüj eksozom içermeyen FCS ekleyerek eksozom içermeyen endotelyal büyüme ortamı hazırlayın.
- Bir su banyosunu yaklaşık 3,5 L 37 °C önceden ısıtılmış ddH2O ile doldurun.
- SW aplikatörünü su banyosuna bağlayın.
- SW cihazında tedavi parametrelerini (enerji akısı yoğunluğu, darbe frekansı) tanımlayın. 0,07 mJ/mm² enerji akısı yoğunluğunda ve 5 Hz frekansta 500 darbe öneriyoruz.
3. Şok dalgası uygulaması
- Toplam 100x büyütme kullanarak mikroskop aracılığıyla morfolojik görünüme ve endotel hücrelerinin yoğunluğuna göre hücre canlılığını araştırın. Yalnızca artan miktarda eksozom için yüksek birleşme özelliğine sahip şişeler kullanın.
- Şişeyi tamamen doldurmak ve kalan tüm havayı bastırmak için endotel hücre ortamını yaklaşık 250 mL PBS ile dikkatlice değiştirin.
- Şişeyi kapatmak için parafilm veya hava geçirmez kapaklar kullanın.
- Hücre kültürü şişesini, hücre kaplı tarafı SW cihazının karşısında olacak şekilde bir su banyosu içinde dikey konumda tutun. Şişenin aplikatöre olan mesafesinin belirtilen işaretle aynı hizada olduğundan emin olun. Orthowave 180c cihazı için 10 cm'lik bir mesafe kullanın.
- Hücre kültürü şişesinin alt yarısına 250 impuls SW tedavisi kullanın.
- Şişeyi 180° çevirin ve hücre kültürü şişesinin üst yarısına 250 darbe kullanın.
- Daha sonra şişe sızdırmazlığını çıkarın ve PBS'yi eksozom içermeyen FCS ile 15 mL endotelyal büyüme ortamı ile değiştirin.
- Kültürle tedavi edilen hücreler, deney düzeneği için uygun bir süre boyunca eksozom içermeyen bir ortamda kültürlenir. En yüksek eksozom miktarı SW tedavisinden 4 saat sonra toplanabilir (Şekil 1).
NOT: Sahte olarak ameliyat edilen grupta, hücre kültürü şişeleri SW tedavisi kullanılmadan aynı tedaviye (yukarıdaki bölüme bakınız) tabi tutulur.
4. Eksozomların izolasyonu
- Süpernatanı bir toplama tüpüne aktarın ve 4 ° C ve 300 x g'da 10 dakika boyunca santrifüjleyin. Bu adım, süpernatanttaki tüm hücreleri kaldırır.
- Hücre kalıntılarının giderilmesi için, süpernatanı yeni bir tüpe aktarın ve 20 dakika boyunca 4 ° C ve 3.000 x g'da santrifüjleyin.
- Apoptotik cisimleri çıkarmak için süpernatanı 200 nm'lik bir filtreden santrifüjlü bir tüpe süzün.
- 70 dakika boyunca 120.000 x g ile 4 ° C'de süpernatan filtrelenmiş santrifüj. Süpernatanı atın ve 300 μL PBS ile eksozom peletini yeniden süspanse edin.
- Eksozom peleti ultrasantrifüjlemeden sonra görünmediğinden, eksozom peletinin yeniden askıya alındığından emin olmak için ultrasantrifüj tüpünü 30 saniye boyunca vorteksleyin. Deneysel ihtiyaçlar ve diğer deneyler için PBS'nin ses seviyesini ayarlayın.
- Yeniden askıya alınmış eksozomları -80 °C'de saklayın.
NOT: Protokol, süpernatanı bir toplama tüpüne aktardıktan sonra veya süpernatanı -80 °C'de dondurarak ultrasantrifüjlemeden önce duraklatılabilir.
5. Tuzaklar
- SW aplikatörünün su banyosuna sıkıca bağlandığından emin olun. Eksik bir bağlantı, sızdıran bir su banyosuna neden olabilir.
- Farklı şişelere aynı miktarda enerji akısı yoğunluğunu kullanmak için şişeden aplikatöre doğru bir mesafe olduğundan emin olun.
- SW tedavisine tabi tutulan hücre kültürü şişelerini ve kontrol örnekleri olan hücre kültürü şişelerini işaretleyin.
- Kontaminasyonu önlemek için şişeleri tekrar kuluçka makinesine koymadan önce kurulayın.
Sonuçlar
Açıklanan protokolü kullanarak, insan endotel hücrelerini (HUVEC'ler) ve insan koroner arter endotel hücrelerini (CAEC'ler; PromoCell) şok dalgası tedavisine (örneğin, Orthowave 180c). Serbest bırakılan veziküller, nano izleme analizi (NTA) ile ölçüldü. Böylece, SW tedavisi üzerine mikro-parçacık salınımında bir artış gözlemleyebiliriz (Şekil 1A,B). Transmisyon elektron mikroskobu ile HUVEC'lerin salınan veziküllerinin görüntülenmesi, eksozomların karakteristik 100 nm boyutunun (Şekil 1C) yanı sıra tipik olarak tarif edilen fincan şeklindeki formu (Şekil 1D) ortaya çıkardı. Akış sitometresi analizi, eksozom protein belirteçleri CD9, CD81 ve CD63'ün varlığını ortaya çıkardığından, HUVEC'lerin salınan mikro-parçacıkların eksozom olduğuna şüphe yoktur (Şekil 1, E-G).
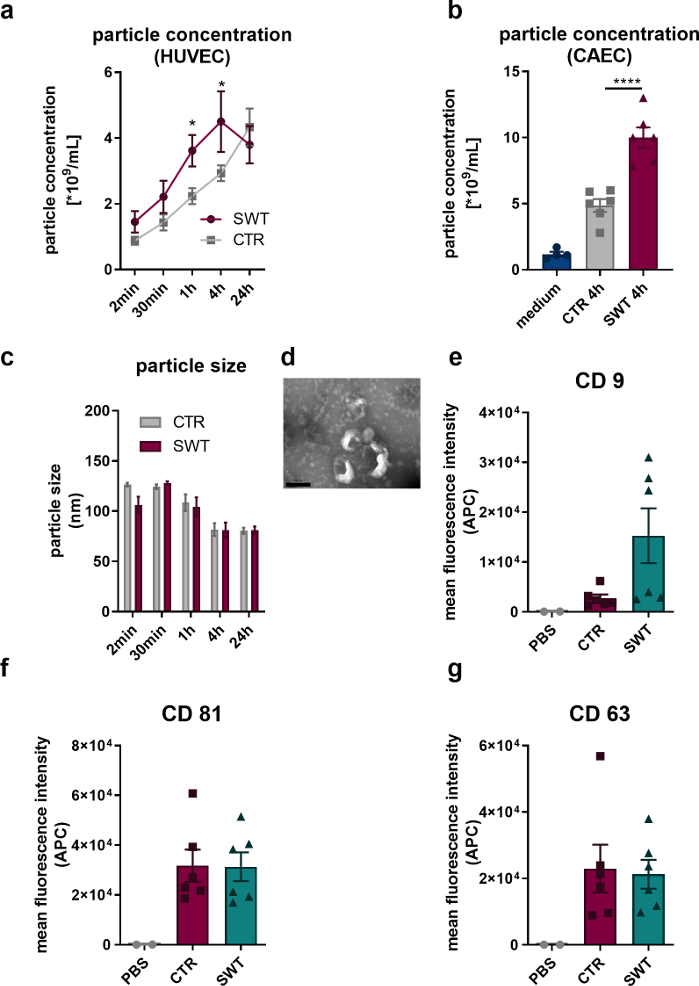
Şekil 1: İn vitro şok dalga tedavisi üzerine eksozom salınımı. (A) HUVEC'lerin saldığı mikro-parçacıklar, SW tedavisinden sonra bir zaman seyri şeklinde NTA ile ölçüldü. Veriler ortalama ± SEM olarak ifade edilir. *P<0.05. n=3–6 olur. (B) SW tedavisinden 4 saat sonra CAEC'lerin süpernatanında artmış mikro-parçacık seviyeleri bulundu. Veriler SEM ± ortalama olarak ifade edilir. ****P < 0.0001. n=4–6 olur. (C-D) NTA tipik boyutu ve transmisyon elektron mikroskobu tipik eksozom şeklini ortaya çıkardı. n=3–5 olur. Ölçek çubuğu = 200 nm. (E-G) Serbest bırakılan mikro-parçacıklar, CD 9, CD 63 ve CD 81 eksozom belirteçlerini eksprese eder. Veriler ortalama ± SEM olarak ifade edilmiştir. n=6. İki grup arasında istatistiksel karşılaştırmalar: Student t-testi, çoklu gruplar: tek yönlü varyans analizi ve Tukey post hoc analizi. Gollmann-Tepeköylü ve ark.13'ten değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Çok sayıda temel araştırma çalışmasında, şok dalga tedavisinin rejeneratif etkisi gösterilebilir ve ortopedik endikasyonlarda rutin olarak uygulanır 3,4,5. Çeşitli hayvan modellerinde, iskemik miyokard üzerindeki rejeneratif etki gösterilebilir ve CAST-HF çalışmasınınbaşlatılmasına yol açabilir 9,10. Bu randomize kontrollü çalışma, koroner arter baypas cerrahisi sırasında ek olarak uygulanan direkt kardiyak şok dalgası tedavisinin yararını değerlendirmeyi amaçlamaktadır14. Eksozomların şok dalga terapisindeki vazgeçilmez rolü daha önceki bir çalışmada gösterilebilir13. Bununla birlikte, eksozom salınımının kesin mekanizması ve salınan eksozomların tam kargosu belirsizliğini korumaktadır. Serbest bırakılan eksozomların salınımını ve rejeneratif etkisini incelemek için, şok dalgası tedavisi üzerine eksozomlar elde etmek için uygulanabilir ve standartlaştırılmış bir protokol oluşturduk.
Bildiğimiz kadarıyla, bu, şok dalgası terapisi üzerine eksozomları izole etmek için bir yöntemi tanımlayan ilk protokoldür. Protokolün yeterli SW uygulamasını garanti etmesi için mutlaka bir su banyosu gereklidir, çünkü hava emilimini önler15 . Böylece, bu protokol ile izole edilen tüm eksozomlar, aynı miktarda enerji akı yoğunluğu ile muamele edilen endotel hücrelerinden ortaya çıkar.
Sadece endotel hücrelerinden eksozom üretme konusunda deneyime sahip olduğumuzdan, diğer hücre dizileriyle yapılan deneyler için kesin bir deney kurulumu öneremeyiz. Bununla birlikte, SW tedavisi üzerine eksozomlar yoluyla mekanotransdüksiyonun diğer hücre tiplerinde de çok önemli bir rol oynadığına inanıyoruz. Ne olursa olsun, daha fazla araştırma bu teoriyi kanıtlamalıdır. Endotel hücrelerinin yanı sıra diğer hücre hatlarıyla çalışırken, bir pilot parkur öneririz. Endotel hücreleriyle çalışırken, hücreleri tohumlamadan önce şişeleri dikkatlice kaplamanın zorunlu olduğunu gördük. Aksi takdirde, SW tedavisi ile hücreler ayrılacaktır. Bunun diğer hücre hatları için de geçerli olduğuna inanıyoruz.
Ayrıca, aplikatör ile su banyosu arasında doğru bir bağlantı ve aplikatörden hücre kültürü şişesine olan tam mesafeyi bilmek, karşılaştırılabilir sonuçlar için önemlidir. Aplikatörün içinde bulunan kaynak (örneğin, bir elektro-hidrolik sistemdeki elektrot uçları) çeşitli SW aplikatörlerinde farklı şekilde konumlandırıldığından, aplikatör ile hücre kültürü şişeleri arasındaki mesafenin farklı SW cihazlarına göre farklılık gösterdiğini unutmayın. Ayrıca, sadece yapışık hücrelerin kullanılmasını öneririz, çünkü bir süspansiyon kültüründe aplikatör ile her hücre arasında sabit bir mesafe yoktur. Bu protokolün bir sınırlaması, bir ultrasantrifüj ihtiyacıdır. Ancak bu yöntem, eksozom izolasyon kitlerinin satın alınmasını önler.
Toplamda, bu protokol, şok dalgası tedavisi üzerinde hücre dışı vezikül salınımının rolünü incelemek için standart bir yöntem sağlar ve bu nedenle moleküler SW etkilerinin anlaşılması için çok önemli bir araç olabilir.
Açıklamalar
JH ve MG, kardiyak şok dalgası tedavisini (www.heart-regeneration.com) teşvik etmeyi amaçlayan bir Innsbruck Tıp Üniversitesi yan kuruluşu olan Heart Regeneration Technologies GmbH'nin hissedarlarıdır. Diğer tüm yazarların ifşa edecek hiçbir şeyi yoktur.
Teşekkürler
Bu çalışma, JH ve CGT'ye sınırsız bir AUVA araştırma hibesi ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
Referanslar
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076(2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır