Method Article
בידוד אקסוזום לאחר טיפול בגלי הלם במבחנה
In This Article
Summary
אקסוזומים משתחררים ביישום מבחנה של גלי הלם. כאן, אנו מתארים כיצד ליישם גלי הלם על תאי אנדותל מתורבתים ולאחר מכן לבודד אקסוזומים להמשך חקירה.
Abstract
טיפול בגלי הלם מיושם באופן שגרתי באינדיקציות אורטופדיות כולל גידים כגון אפיקונדיליטיס לרוחב (מרפק טניס) ודלקת בגיד אכילס (דורבן בעקב) וכן פצעים ועצמות שאינם מחלימים. למרות פתולוגיות שונות, השילוב של השפעה אנגיוגנית ואנטי דלקתית של טיפול בגלי הלם מוביל להתחדשות ברקמות רכות ובעצמות. במשך למעלה מ-30 שנות יישום קליני, לא נצפו תופעות לוואי. יתר על כן, מחקר בסיסי אף חשף השפעות רגנרטיביות על שריר הלב האיסכמי.
בעבודה קודמת יכולנו להראות שהגירוי המכני של תאים מתורבתים מתורגם באמצעות שחרור אקסוזום לתגובה ביולוגית. עם זאת, המנגנון המדויק עדיין לא ברור. צימוד מכני הוא חיוני בעת יישום טיפול בגלי הלם מכיוון שאפילו בועות אוויר קטנות יכולות לספוג גלי הלם. שיטת אמבט המים שתוארה קודם לכן היא שיטה תקפה להבטחת יישום גלי הלם הולם וניתן לשחזור במבחנה.
הצלחנו לפתח פרוטוקול אפשרי וניתן לשכפול לבידוד אקסוזומים מתאים מתורבתים לאחר יישום גלי הלם. בכך אנו מדגימים אפשרות לחקור את המנגנונים הבסיסיים של טרנסדוקציה מכנית כמו גם את הפוטנציאל ההתחדשות והאנגיוגני של אקסוזומים המשתחררים מגלי הלם.
Introduction
גלי הלם (SW) הם גלי לחץ קול המופיעים בטבע כאשר כמות גבוהה של אנרגיה משתחררת בפרק זמן קצר (למשל, רעם עם ברקים). בשגרה הקלינית, גלי הלם משמשים בליתוטריפסיה לפירוק אבנים בכליות ללא תופעות לוואי רלוונטיות במשך למעלה מ-30 שנה 1,2. במקרה, נצפה עיבוי של עצם הכסל בצילומי רנטגן לאחר התפוררות אבנים בכליות. תצפית זו סיפקה את הבסיס למחקר בהפרעות בריפוי עצמות והובילה לטיפול באי-איחודים של עצמות ארוכות 3,4,5.
ההתוויות לטיפול בגלי הלם הורחבו וכיום השיטה נמצאת בשימוש קליני שגרתי באינדיקציות אורטופדיות כולל גידים כגון אפיקונדיליטיס לרוחב (מרפק טניס) ודלקת בגיד אכילס (דורבן בעקב)6,7. יתר על כן, מחקר בסיסי הראה פוטנציאל אנגיוגני גבוה של טיפול בגלי הלם (SWT). שם, מחקר הראה עלייה בגורמי גדילה אנגיוגניים כגון VEGF (גורם גדילה אנדותל כלי דם), PIGF (גורם גדילת שליה) ו- FGF (גורם גדילה אנדותל כלי דם) על SWT ואחריו אנגיוגנזה8.
כדי לחקור תפקיד מועיל אפשרי של אנגיוגנזה הנגרמת על ידי גלי הלם בפתולוגיות אחרות, יישמנו טיפול SW במודל בעלי חיים של מחלת לב איסכמית 9,10. לאחר שניתן היה להדגים השפעה רגנרטיבית בשריר הלב האיסכמי, יכולנו לזהות את התפקיד החיוני של הקולטן החיסוני המולד TLR 3 (קולטן דמוי טול 3) בטיפול בגלי הלם11,12. מחקרים נוספים הראו כי הגירוי המכני של טיפול ב-SW מתורגם לאות ביולוגי באמצעות שחרור אקסוזום. בהשוואה לאקסוזומים המשתחררים פיזיולוגית מתאי אנדותל, אקסוזומים המשתחררים ב-SWT מכילים מטען מוגבר של מיקרו-RNA אנגיוגני. בהזרקה לשריר הלב האיסכמי, SWT שחרר אקסוזומים המושרה התחדשות13.
מכיוון שהאוויר סופג SW, צימוד מושלם בין המוליך לצלוחיות תרבית התאים הוא קריטי. אמבט מים סטנדרטי מייצג שיטה אפשרית ליישום SWT במבחנה ומערך ניסיוני הניתן לשחזור. על מנת למנוע השתקפות וכתוצאה מכך הפרעות של גלים, בולם בצורת טריז הורס את הגלים הראשוניים הזורמים לחלק האחורי של אמבט המים. מסיבה זו, אנו ממליצים ליישם גלי הלם במבחנה באמצעות אמבט המים המתואר בלבד.
בפרוטוקול זה אנו מתארים את היישום של גלי הלם במבחנה כדי לשחרר אקסוזומים אנגיוגניים לתוך הסופרנטנט. פרוטוקול זה מספק את האפשרות לחקור את תפקידם של אקסוזומים בטרנסדוקציה מכנית ומהווה בסיס לחקירה נוספת של שחרור אקסוזומים ב-SWT.
Protocol
תאי אנדותל של וריד הטבור האנושי התקבלו מניתוחים קיסריים במחלקה לגניקולוגיה. לכן הושגה הסכמה מדעת בכתב של המטופלים. האישור ניתן מוועדת האתיקה של האוניברסיטה הרפואית של אינסברוק (לא. UN4435).
הערה: עבדו מתחת למכסה זרימה למינרי סטרילי כדי למנוע זיהום.
1. 24 שעות לפני הניסוי
- הכן מדיום גידול אנדותל חופשי אקסוזום על ידי סרום בקר עוברי אולטרה-צנטריפוגה (FCS) ב-4 מעלות צלזיוס ו-120,000 x גרם למשך הלילה.
- יש לצפות בקבוק תרבית תאים בגודל 75 סמ"ר ב-10% ג'לטין.
- זרע תאי אנדותל אנושיים בבקבוק תרבית התאים באמצעות מדיום גידול אנדותל.
יום הניסוי:
הערה: יש לחמם מראש 4 ליטר של ddH2O, FCS נטול אקסוזומים, צמיחת תאי אנדותל מדיום בסיסי ו-PBS עד 37 מעלות צלזיוס.
2. הכן את יישום הטיפול בגלי הלם
- הכן מדיום גידול אנדותל חופשי מאקסוזומים על ידי הוספת תוספים מהערכה המסחרית (למשל, ערכת כדורים) והוספת FCS ללא אקסוזום אולטרה-צנטריפוגה במקום FCS נפוץ למצע גידול האנדותל.
- מלאו אמבט מים בכ-3.5 ליטר של 37 מעלות צלזיוס מחומם מראש ddH2O.
- חבר את מוליך ה-SW לאמבט המים.
- הגדר פרמטרי טיפול (צפיפות שטף אנרגיה, תדר דחף) במכשיר התוכנה. אנו ממליצים על 500 דחפים בצפיפות שטף אנרגיה של 0.07 mJ/mm² ותדר של 5 הרץ.
3. יישום גלי הלם
- סקר את כדאיות התאים לפי מראה מורפולוגי וצפיפות תאי האנדותל באמצעות מיקרוסקופ באמצעות הגדלה כוללת של פי 100. השתמש בצלוחיות עם מפגש גבוה לכמות מוגברת של אקסוזומים בלבד.
- החלף בזהירות את מדיום תאי האנדותל בכ-250 מ"ל PBS כדי למלא לחלוטין את הבקבוק ולדכא את כל האוויר שנותר.
- השתמש בפרפילם או במכסים אטומים כדי לאטום את הבקבוק.
- החזק את בקבוק תרבית התאים במצב אנכי בתוך אמבט מים כשהצד המכוסה בתא מול מכשיר ה- SW. ודא שמרחק הבקבוק למוליך תואם את הסימון המצוין. עבור מכשיר Orthowave 180c, השתמש במרחק של 10 ס"מ.
- השתמש ב-250 דחפים של טיפול ב-SW למחצית התחתונה של בקבוק תרבית התאים.
- סובב את הבקבוק ב-180 מעלות והשתמש ב-250 דחפים למחצית העליונה של בקבוק תרבית התאים.
- לאחר מכן הסר את איטום הבקבוק והחלף PBS ב-15 מ"ל של מדיום גידול אנדותל עם FCS ללא אקסוזום.
- תרבית תאים במדיום חופשי אקסוזום לזמן מתאים להגדרת הניסוי. ניתן לאסוף את הכמות הגבוהה ביותר של אקסוזומים 4 שעות לאחר טיפול בתוכנה (איור 1).
הערה: בקבוצה שנותחה בדמה, הכניסו צלוחיות תרבית תאים לאותו טיפול (ראה סעיף לעיל) ללא שימוש בטיפול SW.
4. בידוד אקסוזומים
- העבירו את הסופרנטנט לצינור איסוף וצנטריפוגה בטמפרטורה של 4 מעלות צלזיוס ו-300 x גרם למשך 10 דקות. שלב זה מסיר את כל התאים בסופרנטנט.
- להסרת פסולת תאים, העבירו את הסופרנטנט לצינור וצנטריפוגה חדשים בטמפרטורה של 4 מעלות צלזיוס ו-3,000 x גרם למשך 20 דקות.
- מסננים את הסופרנטנט דרך מסנן של 200 ננומטר לתוך צינור צנטריפוגלי כדי להסיר גופים אפופטוטיים.
- צנטריפוגה מסוננת בטמפרטורה של 4 מעלות צלזיוס עם 120,000 x גרם למשך 70 דקות. השליכו את הסופרנטנט והשעו מחדש את הגלולה האקסוזומית עם 300 מיקרוליטר PBS.
- מכיוון שגלולת האקסוזומים אינה נראית לאחר אולטרה-צנטריפוגה, מערבל את צינור האולטרה-צנטריפוגה למשך 30 שניות כדי לוודא שגלולת האקסוזום מושעה מחדש. התאם את עוצמת הקול של PBS לצרכי הניסוי ולניסויים נוספים.
- אחסן אקסוזומים תלויים בטמפרטורה של -80 מעלות צלזיוס.
הערה: ניתן להשהות את הפרוטוקול לאחר העברת הסופרנטנט לתוך צינור איסוף או לפני אולטרה-צנטריפוגה על ידי הקפאת הסופרנטנט ב-80 מעלות צלזיוס.
5. מלכודות
- ודא כי מוליך ה- SW מחובר היטב לאמבט המים. חיבור לא שלם יכול להוביל לאמבטיית מים דולפים.
- ודא שיש מרחק מדויק מהבקבוק למוליך כדי לנצל את אותה כמות של צפיפות שטף אנרגיה לצלוחיות שונות.
- סמן את צלוחיות תרבית התאים שהיו נתונים לטיפול SW ואת צלוחיות תרבית התאים שהיו דגימות הביקורת.
- יבש צלוחיות לפני שמחזירים אותן לחממה כדי למנוע זיהום.
תוצאות
באמצעות הפרוטוקול המתואר, חשפנו תאי אנדותל אנושיים (HUVECs) כמו גם תאי אנדותל של העורקים הכליליים האנושיים (CAECs; PromoCell) לטיפול בגלי הלם (למשל, Orthowave 180c). שלפוחיות ששוחררו כומתו באמצעות ניתוח מעקב ננו (NTA). לכן, יכולנו לראות עלייה בשחרור מיקרו-שלפוחית לאחר טיפול ב-SW (איור 1A,B). הדמיה של שלפוחיות ששוחררו באמצעות מיקרוסקופ אלקטרונים שידור חשפה את הגודל האופייני של 100 ננומטר של האקסוזומים (איור 1C) כמו גם את הצורה המתוארת בדרך כלל בצורת (איור 1D). מכיוון שניתוח ציטומטר זרימה חשף את נוכחותם של סמני חלבון אקסוזום CD9, CD81 ו-CD63, לא יכול להיות ספק שמיקרו-שלפוחיות משוחררות HUVECs הן אקסוזומים (איור 1, E-G).
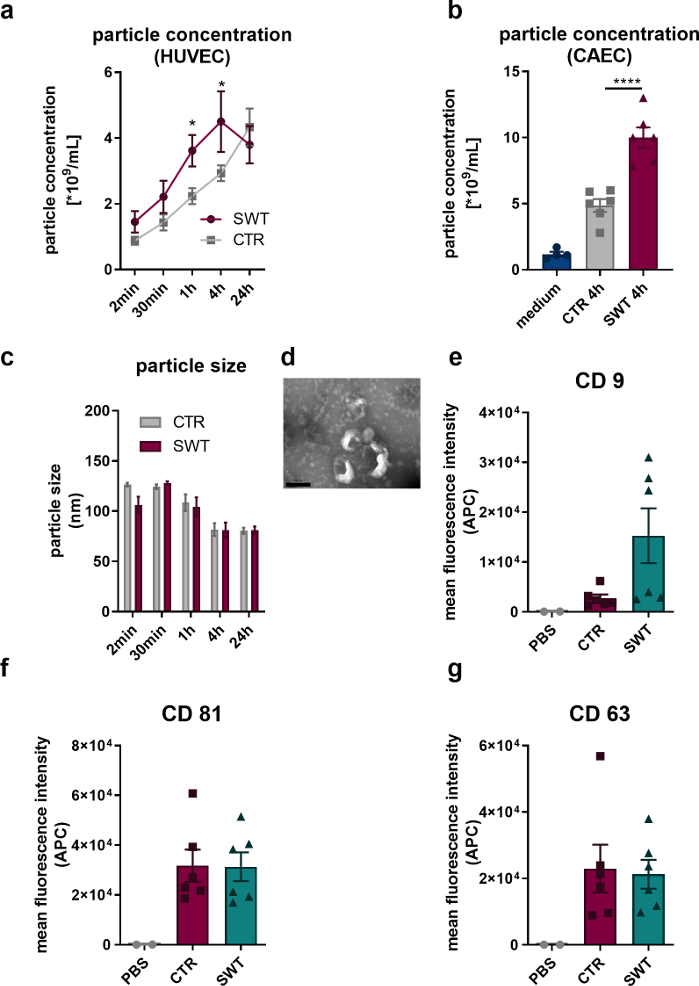
איור 1: שחרור אקסוזום בטיפול בגלי הלם במבחנה. (A) מיקרו-שלפוחיות ששוחררו על ידי HUVECs כומתו באמצעות NTA באופן מהלך זמן לאחר טיפול ב-SW. הנתונים מבוטאים כאמצעים ± SEM. *P<0.05. n=3–6. (B) רמות מוגברות של מיקרו-שלפוחיות נמצאו בסופרנטנט של CAECs 4 שעות לאחר הטיפול ב-SW. הנתונים מבוטאים כאמצעים ± SEM. ****P < 0.0001. n=4–6. (ג-ד) NTA חשפה גודל טיפוסי ומיקרוסקופ אלקטרונים שידור חשף צורת אקסוזום אופיינית. n=3–5. סרגל קנה מידה = 200 ננומטר. (א-ג) מיקרו-שלפוחיות ששוחררו מבטאות סמני אקסוזום CD 9, CD 63 ו-CD 81. הנתונים מבוטאים כאמצעים ± SEM. n=6. השוואות סטטיסטיות בין שתי קבוצות: מבחן t של סטודנט, מספר קבוצות: ANOVA חד כיווני עם ניתוח פוסט הוק של Tukey. שונה מ-Gollmann-Tepeköylü et al.13. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
במספר עבודות מחקר בסיסיות, ניתן היה להדגים את ההשפעה הרגנרטיבית של הטיפול בגלי הלם והיא מיושמת באופן שגרתי באינדיקציות אורטופדיות 3,4,5. במודלים מגוונים של בעלי חיים, ניתן היה להדגים את ההשפעה הרגנרטיבית על שריר הלב האיסכמי ולהוביל להתחלת ניסוי CAST-HF 9,10. ניסוי אקראי מבוקר זה נועד להעריך את התועלת של טיפול ישיר בגלי הלם לב המיושם בנוסף במהלך ניתוח מעקף עורקים כליליים14. ניתן היה להדגים את התפקיד החיוני של אקסוזומים בטיפול בגלי הלם בעבודה קודמת13. עם זאת, המנגנון המדויק של שחרור האקסוזומים כמו גם המטען המדויק של האקסוזומים המשוחררים נותר לא ברור. כדי לחקור את השחרור כמו גם את ההשפעה ההתחדשות של אקסוזומים משוחררים, קבענו פרוטוקול אפשרי וסטנדרטי להשגת אקסוזומים בטיפול בגלי הלם.
למיטב ידיעתנו, זהו הפרוטוקול הראשון המתאר שיטה לבידוד אקסוזומים בטיפול בגלי הלם. אמבט מים נחוץ בהכרח כדי שהפרוטוקול יבטיח יישום SW נאות, מכיוון שהוא נמנע מספיגת אוויר15 . לפיכך, כל האקסוזומים המבודדים בפרוטוקול זה נובעים מתאי אנדותל המטופלים באותה כמות של צפיפות שטף אנרגיה.
מכיוון שיש לנו ניסיון רק בייצור אקסוזומים מתאי אנדותל, איננו יכולים להמליץ על מערך ניסוי מדויק לניסויים עם קווי תאים אחרים. עם זאת, אנו משוכנעים כי טרנסדוקציה מכנית באמצעות אקסוזומים בטיפול ב-SW ממלאת תפקיד מכריע גם בסוגי תאים אחרים. כך או כך, חקירות נוספות חייבות להוכיח את התיאוריה הזו. כאשר עובדים עם קווי תאים אחרים מלבד תאי אנדותל, אנו ממליצים על מסלול פיילוט. בזמן שעבדנו עם תאי אנדותל, מצאנו שזה בהכרח לצפות את הצלוחיות בזהירות לפני זריעת התאים. אחרת, התאים יתנתקו בטיפול בתוכנה. אנו מאמינים שזה חל גם על קווי תאים אחרים.
יתרה מכך, חיבור מדויק בין המוליך לאמבט המים, כמו גם ידיעת המרחק המדויק מהמוליך לבקבוק תרבית התאים, חשוב לתוצאות דומות. מכיוון שהמקור (למשל, קצות אלקטרודות במערכת אלקטרו-הידראולית) הממוקם בתוך המוליך ממוקם בצורה שונה באפליקטורים SW מגוונים, שים לב שהמרחק בין המוליך לצלוחיות תרבית התאים שונה במכשירי SW שונים. כמו כן, אנו ממליצים להשתמש בתאים דבקים בלבד, שכן בתרבית תרחיף אין מרחק קבוע בין האפליקטור לכל תא. מגבלה של פרוטוקול זה היא הצורך באולטרה-צנטריפוגה. עם זאת, שיטה זו נמנעת מרכישת ערכות בידוד אקסוזומים.
בסך הכל, פרוטוקול זה מספק שיטה סטנדרטית לחקר התפקיד של שחרור שלפוחית חוץ-תאית בטיפול בגלי הלם ולכן עשוי להיות כלי מכריע להבנת השפעות SW מולקולריות.
Disclosures
JH ו-MG הם בעלי המניות של Heart Regeneration Technologies GmbH, ספין-אוף של האוניברסיטה הרפואית של אינסברוק שמטרתו לקדם טיפול בגלי הלם לב (www.heart-regeneration.com). לכל הסופרים האחרים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי מענק מחקר בלתי מוגבל של AUVA ל-JH ו-CGT.
Materials
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
References
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved