Method Article
Isolamento de exossomos após terapia por ondas de choque in vitro
Neste Artigo
Resumo
Os exossomos são liberados após a aplicação in vitro de ondas de choque. Aqui, descrevemos como aplicar ondas de choque em células endoteliais cultivadas e, posteriormente, isolar exossomos para investigação posterior.
Resumo
A terapia por ondas de choque é aplicada rotineiramente em indicações ortopédicas, incluindo tendinopatias, como epicondilite lateral (cotovelo de tenista) e tendinite de Aquiles (esporão do calcanhar), bem como feridas e ossos que não cicatrizam. Apesar das diferentes patologias, a combinação de um efeito angiogênico e antiinflamatório da terapia por ondas de choque leva à regeneração dos tecidos moles e dos ossos. Em mais de 30 anos de aplicação clínica, não foram observados efeitos colaterais. Além disso, a pesquisa básica revelou efeitos regenerativos no miocárdio isquêmico.
Em um trabalho anterior, pudemos mostrar que o estímulo mecânico de células cultivadas é traduzido por meio de uma liberação de exossomos em uma resposta biológica. No entanto, o mecanismo exato ainda precisa ser elucidado. O acoplamento mecânico é crucial ao aplicar a terapia por ondas de choque, pois mesmo pequenas bolhas de ar podem absorver as ondas de choque. O método do banho-maria descrito anteriormente é um método válido para garantir a aplicação adequada e reprodutível de ondas de choque in vitro.
Conseguimos desenvolver um protocolo viável e replicável para isolar exossomos de células cultivadas após aplicação de ondas de choque. Assim, demonstramos a possibilidade de estudar os mecanismos subjacentes da mecanotransdução, bem como o potencial regenerativo e angiogênico dos exossomos liberados por ondas de choque.
Introdução
As ondas de choque (SW) são ondas de pressão sonora que aparecem na natureza quando uma grande quantidade de energia é liberada em um curto período de tempo (por exemplo, trovões com raios). Na rotina clínica, as ondas de choque são utilizadas na litotripsia para desintegrar cálculos renais sem efeitos colaterais relevantes há mais de 30 anos 1,2. Por incidente, um espessamento do osso ilíaco foi observado em raios-X após a desintegração da pedra nos rins. Essa observação forneceu a base para pesquisas em distúrbios de cicatrização óssea e levou ao tratamento de não consolidação de ossos longos 3,4,5.
As indicações para a terapia por ondas de choque foram ampliadas e hoje o método está em uso clínico rotineiro em indicações ortopédicas, incluindo tendinopatias como epicondilite lateral (cotovelo de tenista) e tendinite de Aquiles (esporão de calcanhar)6,7. Além disso, a pesquisa básica demonstrou um alto potencial angiogênico da terapia por ondas de choque (SWT). Nele, um estudo mostrou um aumento nos fatores de crescimento angiogênicos, como VEGF (fator de crescimento endotelial vascular), PIGF (fator de crescimento placentário) e FGF (fator de crescimento endotelial vascular) sobre o SWT seguido de angiogênese8.
Para investigar um possível papel benéfico da angiogênese induzida por ondas de choque em outras patologias, aplicamos a terapia SW em um modelo animal de cardiopatia isquêmica 9,10. Após a demonstração de um efeito regenerativo no miocárdio isquêmico, pudemos identificar o papel indispensável do receptor imune inato TLR 3 (receptor Toll like 3) na terapia por ondas de choque11,12. Estudos posteriores mostraram que o estímulo mecânico da terapia SW é traduzido em um sinal biológico via liberação de exossomos. Em comparação com os exossomos liberados fisiologicamente das células endoteliais, os exossomos liberados após SWT contêm uma carga aumentada de microRNA angiogênico. Injetado no miocárdio isquêmico, o SWT liberou exossomos induzidos pela regeneração13.
Como o ar absorve SW, o acoplamento perfeito entre o aplicador e os frascos de cultura de células é crucial. Um banho-maria padronizado representa um método viável para aplicar SWT in vitro e uma configuração experimental reprodutível. Para evitar uma reflexão e consequentemente interferência das ondas, um absorvedor em forma de cunha destrói as ondas primárias que correm para a parte de trás do banho-maria. Por esse motivo, recomendamos a aplicação de ondas de choque in vitro usando apenas o banho-maria descrito.
Neste protocolo, descrevemos a aplicação de ondas de choque in vitro para liberar exossomos angiogênicos no sobrenadante. Este protocolo oferece a possibilidade de investigar o papel dos exossomos na mecanotransdução e é a base para uma investigação mais aprofundada da liberação de exossomos no SWT.
Protocolo
As células endoteliais da veia umbilical humana foram obtidas de cesarianas no Departamento de Ginecologia. Portanto, foi obtido o consentimento informado por escrito dos pacientes. A permissão foi dada pelo comitê de ética da Universidade Médica de Innsbruck (no. UN4435).
NOTA: Trabalhe sob uma capela de fluxo laminar estéril para evitar contaminação.
1. 24 h antes do experimento
- Prepare o meio de crescimento endotelial livre de exossomos por ultracentrifugação de soro fetal bovino (FCS) a 4 ° C e 120.000 x g durante a noite.
- Cubra um balão de cultura de células de 75 cm² com gelatina a 10%.
- Semear células endoteliais humanas no frasco de cultura celular usando meio de crescimento endotelial.
Dia do experimento:
NOTA: Pré-aqueça 4 L de ddH2O, FCS livre de exossomos, meio basal de crescimento de células endoteliais e PBS a 37 °C.
2. Prepare o aplicativo de terapia por ondas de choque
- Prepare o meio de crescimento endotelial livre de exossomos adicionando suplementos do kit comercial (por exemplo, Bullet Kit) e adicionando FCS livre de exossomos ultracentrifugados em vez do FCS comum ao meio de crescimento endotelial.
- Encha um banho-maria com aproximadamente 3,5 L de ddH2O pré-aquecido a 37 °C.
- Conecte o aplicador SW ao banho-maria.
- Defina os parâmetros de tratamento (densidade de fluxo de energia, frequência de impulso) no dispositivo SW. Recomendamos 500 impulsos com uma densidade de fluxo de energia de 0,07 mJ/mm² e uma frequência de 5 Hz.
3. Aplicação de ondas de choque
- Pesquise a viabilidade celular por aparência morfológica e a densidade das células endoteliais por meio de um microscópio usando uma ampliação total de 100x. Use frascos com alta confluência apenas para uma quantidade maior de exossomos.
- Substitua cuidadosamente o meio de células endoteliais por aproximadamente 250 mL de PBS para encher completamente o frasco e reprimir todo o ar residual.
- Utilizar parafilme ou cápsulas herméticas para selar o balão.
- Manter o balão de cultura de células na posição vertical dentro de um banho-maria com o lado coberto da célula oposto ao dispositivo SW. Certifique-se de que a distância do frasco ao aplicador esteja de acordo com a marcação indicada. Para o dispositivo Orthowave 180c, use uma distância de 10 cm.
- Utilize 250 impulsos de terapia SW na metade inferior do frasco de cultura de células.
- Rode o balão 180° e utilize 250 impulsos para a metade superior do balão de cultura de células.
- Em seguida, remova a vedação do frasco e substitua o PBS por 15 mL de meio de crescimento endotelial por FCS livre de exossomos.
- Cultura de células terapizadas em um meio livre de exossomos por um tempo apropriado para a configuração do experimento. A maior quantidade de exossomos pode ser coletada 4 h após a terapia SW (Figura 1).
NOTA: No grupo operado simulada, submeta os frascos de cultura de células ao mesmo tratamento (consulte a seção acima) sem utilizar a terapia SW.
4. Isolamento de exossomos
- Transferir o sobrenadante para um tubo de recolha e centrifugar a 4 °C e 300 x g durante 10 min. Esta etapa remove todas as células do sobrenadante.
- Para a remoção de detritos celulares, transfira o sobrenadante para um novo tubo e centrifugue a 4 °C e 3.000 x g por 20 min.
- Coar o sobrenadante através de um filtro de 200 nm para um tubo centrífugo para remover os corpos apoptóticos.
- Sobrenadante filtrado por centrífuga a 4 °C com 120.000 x g por 70 min. Rejeitar o sobrenadante e ressuspender o sedimento de exossoma com 300 μL de PBS.
- Como o sedimento de exossomos não é visível após a ultracentrifugação, faça um vórtice no tubo de ultracentrifugação por 30 segundos para garantir que o sedimento do exossomo seja ressuspenso. Ajuste o volume de PBS para as necessidades experimentais e experimentos posteriores.
- Armazenar os exossomas ressuspensos a -80 °C.
NOTA: O protocolo pode ser pausado após a transferência do sobrenadante para um tubo de coleta ou antes da ultracentrifugação, congelando o sobrenadante a -80 °C.
5. Armadilhas
- Certifique-se de que o aplicador SW esteja conectado firmemente ao banho-maria. Uma conexão incompleta pode levar a um banho-maria com vazamento.
- Certifique-se de que haja uma distância precisa do frasco ao aplicador para utilizar a mesma quantidade de densidade de fluxo de energia para diferentes frascos.
- Marque os frascos de cultura de células que foram submetidos à terapia SW e os frascos de cultura de células que foram as amostras de controle.
- Seque os frascos antes de colocá-los de volta na incubadora para evitar contaminação.
Resultados
Usando o protocolo descrito, submetemos células endoteliais humanas (HUVECs), bem como células endoteliais da artéria coronária humana (CAECs; PromoCell) à terapia por ondas de choque (por exemplo, Orthowave 180c). As vesículas liberadas foram quantificadas por meio de análise de rastreamento nano (NTA). Dessa forma, pudemos observar um aumento na liberação de microvesículas após a terapia SW (Figura 1A,B). A imagem das vesículas liberadas por HUVECs por microscopia eletrônica de transmissão revelou o tamanho característico de 100 nm dos exossomos (Figura 1C), bem como a forma em forma de copo tipicamente descrita (Figura 1D). Como a análise do citômetro de fluxo revelou a presença de marcadores de proteínas exossômicas CD9, CD81 e CD63, não pode haver dúvida de que as microvesículas liberadas pelos HUVECs são exossomos (Figura 1 EG).
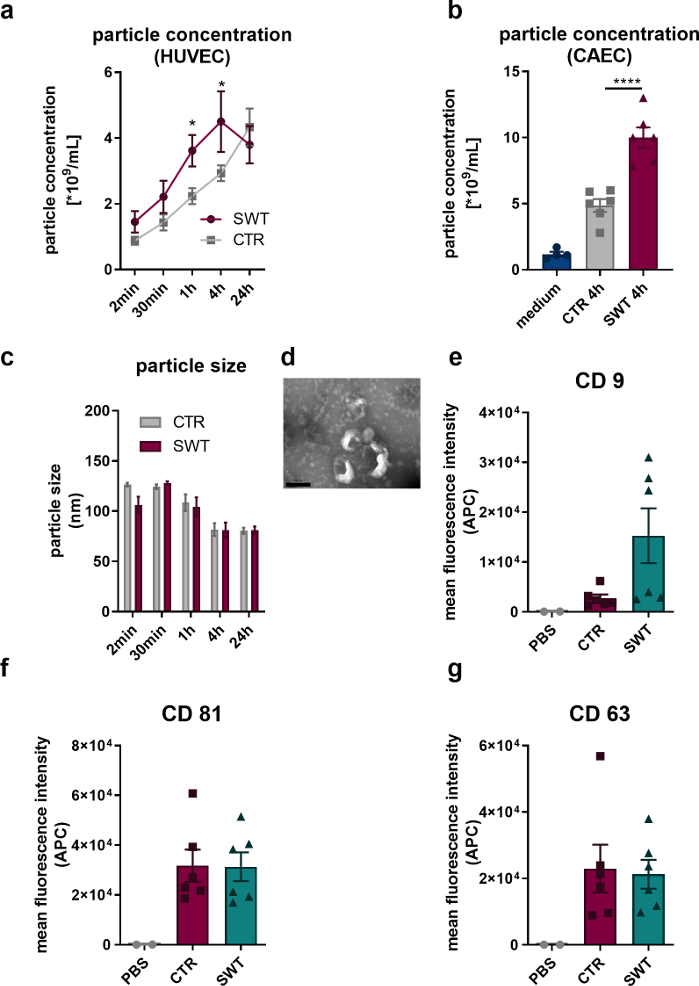
Figura 1: Liberação de exossomos após terapia por ondas de choque in vitro. (A) As microvesículas liberadas por HUVECs foram quantificadas via NTA de maneira contínua após a terapia com SW. Os dados são expressos como médias ± EPM. *P<0,05. n=3–6. (B) Níveis aumentados de microvesículas foram encontrados no sobrenadante de CAECs 4 horas após a terapia com SW. Os dados são expressos como médias ± EPM. **** P < 0,0001. n=4–6. (CD) A NTA revelou tamanho típico e a microscopia eletrônica de transmissão revelou a forma típica do exossomo. n=3–5. Barra de escala = 200 nm. (E-G) As microvesículas liberadas expressam os marcadores de exossomos CD 9, CD 63 e CD 81. Os dados são expressos como médias ± EPM. n=6. Comparações estatísticas entre dois grupos: teste t de Student, múltiplos grupos: ANOVA one-way com análise post hoc de Tukey. Modificado de Gollmann-Tepeköylü et al.13. Clique aqui para ver uma versão maior desta figura.
Discussão
Em vários trabalhos de pesquisa básica, o efeito regenerativo da terapia por ondas de choque pôde ser demonstrado e é aplicado rotineiramente em indicações ortopédicas 3,4,5. Em diversos modelos animais, o efeito regenerativo sobre o miocárdio isquêmico pôde ser demonstrado e levar ao início do estudo CAST-HF 9,10. Este estudo controlado randomizado tem como objetivo avaliar o benefício da terapia direta por ondas de choque cardíaco aplicada adicionalmente durante a cirurgia de revascularização do miocárdio14. O papel indispensável dos exossomos na terapia por ondas de choque poderia ser demonstrado em um trabalho anterior13. No entanto, o mecanismo exato de liberação de exossomos, bem como a carga exata de exossomos liberados, permanecem obscuros. Para estudar a liberação, bem como o efeito regenerativo dos exossomos liberados, estabelecemos um protocolo viável e padronizado para obter exossomos após terapia por ondas de choque.
Até onde sabemos, este é o primeiro protocolo que descreve um método para isolar exossomos após terapia por ondas de choque. O banho-maria é necessariamente necessário para que o protocolo garanta a aplicação adequada do SW, pois evita a absorção de ar15 . Assim, todos os exossomos isolados com este protocolo surgem de células endoteliais tratadas com a mesma quantidade de densidade de fluxo de energia.
Como só temos experiência na produção de exossomos de células endoteliais, não podemos recomendar uma configuração exata de experimento para experimentos com outras linhagens celulares. No entanto, estamos convencidos de que a mecanotransdução via exossomos após a terapia SW também desempenha um papel crucial em outros tipos de células. Independentemente disso, novas investigações devem provar essa teoria. Ao trabalhar com outras linhagens celulares além das células endoteliais, recomendamos uma trilha piloto. Ao trabalhar com células endoteliais, descobrimos que é necessário revestir os frascos cuidadosamente antes de semear as células. Caso contrário, as células se desprenderão após a terapia SW. Acreditamos que isso também se aplica a outras linhagens celulares.
Além disso, uma conexão precisa entre o aplicador e o banho-maria, bem como saber a distância exata do aplicador ao frasco de cultura de células, é importante para resultados comparáveis. Como a fonte (por exemplo, pontas de eletrodo em um sistema eletro-hidráulico) localizada dentro do aplicador é posicionada de forma diferente em diversos aplicadores de SW, esteja ciente de que a distância entre o aplicador e os frascos de cultura de células difere com diferentes dispositivos de SW. Além disso, recomendamos o uso apenas de células aderentes, pois em uma cultura em suspensão não há distância constante entre o aplicador e cada célula. Uma limitação deste protocolo é a necessidade de uma ultracentrífuga. No entanto, esse método evita a compra de kits de isolamento de exossomos.
Em conjunto, este protocolo fornece um método padronizado para estudar o papel da liberação de vesículas extracelulares na terapia por ondas de choque e pode, portanto, ser uma ferramenta crucial para a compreensão dos efeitos moleculares do SW.
Divulgações
A JH e a MG são acionistas da Heart Regeneration Technologies GmbH, uma spin-off da Universidade Médica de Innsbruck com o objetivo de promover a terapia por ondas de choque cardíaco (www.heart-regeneration.com). Todos os outros autores não têm nada a divulgar.
Agradecimentos
Este estudo foi apoiado por uma bolsa de pesquisa AUVA irrestrita para JH e CGT.
Materiais
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
Referências
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076(2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados