Method Article
in vitro Shock Wave Therapy 후 엑소좀 격리
요약
엑소좀은 충격파의 체외(in vitro) 적용에 따라 방출됩니다. 여기에서는 배양된 내피 세포에 충격파를 가한 후 추가 연구를 위해 엑소좀을 분리하는 방법을 설명합니다.
초록
충격파 요법은 외측 상과염(테니스 엘보우) 및 아킬레스 건염(발뒤꿈치 박차)과 같은 건병증과 치유되지 않는 상처 및 뼈를 포함한 정형외과적 적응증에 일상적으로 적용됩니다. 다양한 병리학에도 불구하고 충격파 요법의 혈관 신생 효과와 항염증 효과의 조합은 연조직과 뼈의 재생으로 이어집니다. 30년 이상의 임상 적용에서 부작용은 관찰되지 않았습니다. 또한, 기초 연구에서는 허혈성 심근에 대한 재생 효과도 밝혀졌습니다.
이전 연구에서는 배양된 세포의 기계적 자극이 엑소좀 방출을 통해 생물학적 반응으로 전환된다는 것을 보여줄 수 있었습니다. 그러나 정확한 메커니즘은 아직 밝혀지지 않았습니다. 충격파 요법을 적용할 때는 작은 기포라도 충격파를 흡수할 수 있으므로 기계적 결합이 중요합니다. 앞서 설명한 수조 방법은 적절하고 재현 가능한 충격파 in vitro 적용을 보장하는 유효한 방법입니다.
충격파 적용 후 배양된 세포에서 엑소좀을 분리할 수 있는 실현 가능하고 복제 가능한 프로토콜을 개발할 수 있었습니다. 이를 통해 우리는 기계전달의 기본 메커니즘과 충격파 방출 엑소좀의 재생 및 혈관신생 잠재력을 연구할 수 있는 가능성을 보여줍니다.
서문
충격파(SW)는 짧은 시간에 많은 양의 에너지가 방출될 때(예: 번개가 치는 천둥) 자연에서 나타나는 음압파입니다. 임상적 일상에서 충격파는 30년 이상 관련 부작용 없이 신장 결석을 분해하기 위해 쇄석술에 사용된다 1,2. 우연히도, 장골골이 두꺼워지는 것이 신장 결석 붕괴 후 X-선에서 관찰되었습니다. 이 관찰은 뼈 치유 장애에 대한 연구의 기초를 제공했으며 장골 유합 치료로 이어졌다 3,4,5.
충격파 요법에 대한 적응증이 확대되었으며 오늘날 이 방법은 외측 상과염(테니스 엘보) 및 아킬레스 건염(발뒤꿈치 박차)과 같은 건병증을 포함한 정형외과 적응증에서 일상적으로 임상적으로 사용되고 있습니다6,7. 또한, 기초 연구에서는 충격파 요법(SWT)의 높은 혈관신생 잠재력을 입증했습니다. 이와 관련하여, 한 연구에서는 SWT를 시행한 후 혈관형성 8을 실시한 후 VEGF(혈관내피 성장인자), PIPF(태반 성장인자), FGF(혈관내피 성장인자)와 같은 혈관신생 성장인자의 증가를 보였다.
다른 병리학에서 충격파 유도 혈관 신생의 유익한 역할을 조사하기 위해 허혈성 심장 질환의 동물 모델에 SW 요법을 적용했습니다 9,10. 허혈성 심근의 재생 효과가 입증 된 후, 충격파 요법에서 선천성 면역 수용체 TLR 3 (Toll like receptor 3)의 필수 역할을 확인할 수 있습니다11 , 12. 추가 연구에서는 SW 요법의 기계적 자극이 엑소좀 방출을 통해 생물학적 신호로 변환된다는 사실이 밝혀졌습니다. 내피 세포에서 생리학적으로 분비되는 엑소좀과 비교했을 때, SWT에서 분비되는 엑소좀은 혈관신생 microRNA의 화물을 증가시켜 줍니다. 허혈성 심근에 주입된 SWT는 재생을 유도하는 엑소좀을 방출했다13.
공기가 SW를 흡수하기 때문에 애플리케이터와 세포 배양 플라스크 사이의 완벽한 결합이 중요합니다. 표준화된 수조는 SWT를 in vitro에 적용할 수 있는 실현 가능한 방법과 재현 가능한 실험 설정을 나타냅니다. 반사와 그에 따른 파도의 간섭을 피하기 위해 쐐기 모양의 흡수 장치는 수조 뒤쪽으로 흐르는 1차 파도를 파괴합니다. 이러한 이유로 설명된 수조만 사용하여 시험관 내에서 충격파를 적용하는 것이 좋습니다.
이 프로토콜에서는 혈관형성 엑소좀을 상층액으로 방출하기 위해 시험관 내에서 충격파를 적용하는 방법을 설명합니다. 이 프로토콜은 기계전달에서 엑소좀의 역할을 조사할 수 있는 가능성을 제공하며, SWT 시 엑소좀 방출에 대한 추가 연구를 위한 기초가 됩니다.
프로토콜
인간 제대 정맥 내피 세포는 산부인과(Department of Gynecology)의 제왕절개에서 얻었습니다. 따라서 환자의 서면 동의서를 받았습니다. 인스브루크 의과대학 윤리위원회(no. UN4435)를 참조하십시오.
알림: 오염을 방지하기 위해 멸균 층류 후드 아래에서 작업하십시오.
1. 실험 24시간 전
- 초원심분리를 통해 4°C와 120,000 x g 에서 하룻밤 동안 소태아혈청(FCS)을 추출하여 엑소좀 유리 내피 생장 배지를 준비합니다.
- 75cm² 세포 배양 플라스크를 10% 젤라틴으로 코팅합니다.
- 내피 성장 배지를 사용하여 세포 배양 플라스크에 인간 내피 세포를 파종합니다.
실험일:
참고: ddH2O4L, 엑소좀 프리 FCS, 내피 세포 성장 기저 배지 및 PBS를 37°C로 예열합니다.
2. 충격파 치료 응용 프로그램을 준비하십시오.
- 시판 키트(예: Bullet Kit)의 보충제를 추가하고 내피 성장 배지에 일반 FCS 대신 초원심분리 엑소좀 무함유 FCS를 추가하여 엑소좀 유리 내피 성장 배지를 준비합니다.
- 약 3.5L의 37°C 예열 ddH2O를 수조에 채웁니다.
- SW 애플리케이터를 수조에 연결합니다.
- SW 장치에서 처리 매개변수(에너지, 플럭스, 밀도, 임펄스 주파수)를 정의합니다. 0.07mJ/mm²의 에너지 플럭스 밀도와 5Hz의 주파수에서 500개의 임펄스를 권장합니다.
3. 충격파 신청
- 형태학적 모양에 따른 세포 생존력과 내피 세포의 밀도를 100배 총 배율을 사용하여 현미경을 통해 조사합니다. 엑소좀의 양을 늘리기 위해서만 confluence가 높은 플라스크를 사용하십시오.
- 내피 세포 배지를 약 250mL의 PBS로 조심스럽게 교체하여 플라스크를 완전히 채우고 모든 잔류 공기를 억제합니다.
- 파라필름 또는 밀폐 캡을 사용하여 플라스크를 밀봉하십시오.
- 세포 배양 플라스크를 수조 내부의 수직 위치로 잡고 세포를 덮은 면이 SW 장치 반대편에 오도록 합니다. 플라스크에서 애플리케이터까지의 거리가 표시된 표시와 일치하는지 확인하십시오. Orthowave 180c 장치의 경우 10cm의 거리를 사용하십시오.
- 세포 배양 플라스크의 아래쪽 절반에 250개의 SW 요법 임펄스를 활용합니다.
- 플라스크를 180° 돌리고 세포 배양 플라스크의 위쪽 절반에 250개의 임펄스를 사용합니다.
- 그런 다음 플라스크 밀봉을 제거하고 PBS를 15mL의 내피 성장 배지로 엑소좀 프리 FCS로 교체합니다.
- 실험 설정을 위한 적절한 시간 동안 엑소좀이 없는 배지에서 세포를 배양했습니다. SW 요법 후 4시간 후에 가장 많은 엑소좀을 채취할 수 있습니다(그림 1).
참고: 가짜 수술 그룹에서는 SW 요법을 사용하지 않고 동일한 처리(위 섹션 참조)를 피험자 세포 배양 플라스크에 적용합니다.
4. 엑소좀의 분리
- 상층액을 수집 튜브에 넣고 4°C 및 300 x g 에서 10분 동안 원심분리합니다. 이 단계는 상층액의 모든 세포를 제거합니다.
- 세포 파편을 제거하기 위해 상층액을 새 튜브로 옮기고 4°C 및 3,000 x g 에서 20분 동안 원심분리합니다.
- 200nm 필터를 통해 상층액을 원심관에 걸러서 세포사멸체를 제거합니다.
- 4°C에서 120,000 x g 로 70분 동안 상층액을 여과한 원심분리기. 상층액을 버리고 엑소좀 펠릿을 300μL의 PBS로 재현탁합니다.
- 초원심분리 후에는 엑소좀 펠릿이 보이지 않기 때문에 초원심분리 튜브를 30초 동안 볼텍스하여 엑소좀 펠릿이 다시 부유하도록 합니다. 실험 요구 사항 및 추가 실험에 맞게 PBS의 부피를 조정합니다.
- 재현탁 엑소좀은 -80°C에서 보관합니다.
참고: 프로토콜은 상등액을 수집 튜브로 옮긴 후 또는 상등액을 -80°C에서 동결하여 초원심분리 전에 일시 중지할 수 있습니다.
5. 함정
- SW 애플리케이터가 수조에 단단히 연결되어 있는지 확인하십시오. 불완전한 연결로 인해 수조가 새게 될 수 있습니다.
- 다른 플라스크에 동일한 양의 에너지 플럭스 밀도를 활용하기 위해 플라스크에서 어플리케이터까지의 정확한 거리가 있는지 확인하십시오.
- SW 요법을 받은 세포 배양 플라스크와 대조군 샘플인 세포 배양 플라스크를 표시합니다.
- 오염을 방지하기 위해 인큐베이터에 다시 넣기 전에 플라스크를 건조시키십시오.
결과
설명된 프로토콜을 사용하여 인간 내피 세포(HUVEC)와 인간 관상 동맥 내피 세포(CAEC; PromoCell)에서 충격파 요법(예: Orthowave 180c)으로 변환할 수 있습니다. 방출된 소포는 나노 추적 분석(NTA)을 통해 정량화되었습니다. 이를 통해 SW 요법 시 미세소포 방출이 증가하는 것을 관찰할 수 있었습니다(그림 1A,B). 투과 전자 현미경을 통해 방출된 소포를 HUVEC의 이미징으로 확인하면 엑소좀의 특징적인 100nm 크기(그림 1C)와 일반적으로 설명되는 컵 모양의 형태(그림 1D)가 드러났습니다. 유세포분석기 분석을 통해 엑소좀 단백질 마커 CD9, CD81, CD63의 존재가 밝혀졌기 때문에 HUVEC에서 방출된 미세소포가 엑소좀이라는 것은 의심의 여지가 없습니다(그림 1, E-G).
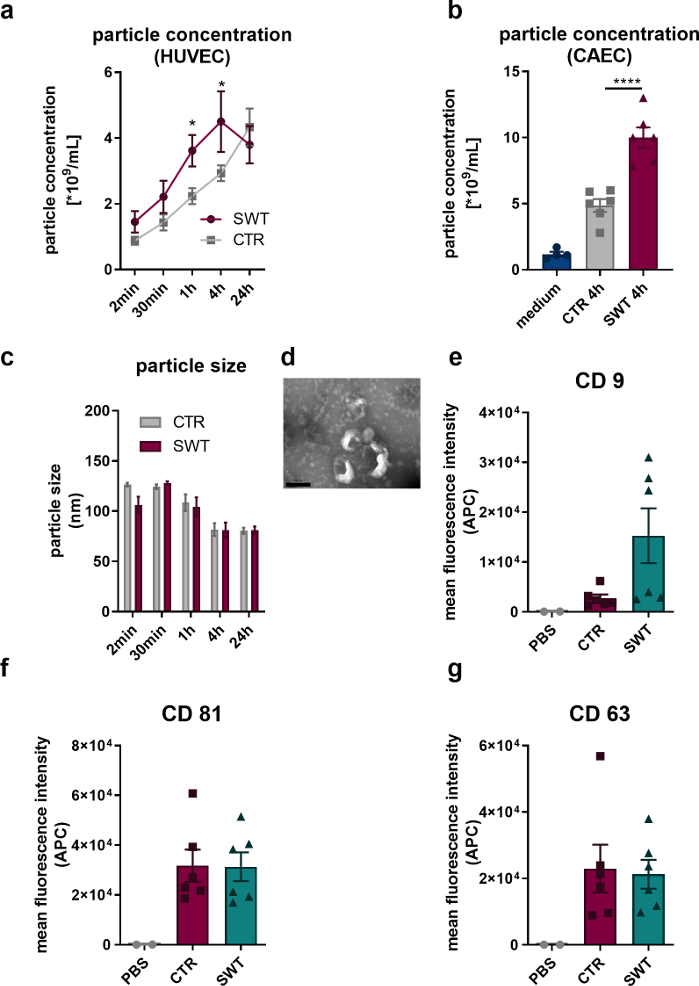
그림 1: 시험관 내 충격파 요법 시 엑소좀 방출. (A) 방출된 HUVEC은 SW 요법 후 시간 경과 방식으로 NTA를 통해 정량화되었습니다. 데이터는 SEM± 평균으로 표현됩니다. *P<0.05. n=3–6입니다. (B) SW 요법 4시간 후 CAEC의 상등액에서 증가된 미세소포 수치가 발견되었습니다. 데이터는 SEM± 평균으로 표현됩니다. ****P < 0.0001. n=4–6입니다. (C-D) NTA는 전형적인 크기와 투과 전자 현미경을 통해 전형적인 엑소좀 모양을 밝혔습니다. n=3–5입니다. 스케일 바 = 200nm. (예) 출시된 미세소포는 엑소좀 마커 CD 9, CD 63 및 CD 81을 발현합니다. 데이터는 SEM± 수단으로 표현됩니다. n=6. 두 그룹 간의 통계적 비교: 학생의 t-검정, 다중 그룹: Tukey 사후 분석을 사용한 단방향 ANOVA. Gollmann-Tepeköylü et al.13에서 수정됨. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여러 기초 연구 작업에서 충격파 요법의 재생 효과가 입증 될 수 있으며 정형 외과 적응증 3,4,5에 일상적으로 적용됩니다. 다양한 동물 모델에서 허혈성 심근에 대한 재생 효과가 입증될 수 있으며 CAST-HF 시험의 시작으로 이어질 수 있습니다 9,10. 본 무작위 대조 임상시험은 관상동맥 우회술 중에 추가로 적용되는 직접 심장 충격파 요법의 이점을 평가하는 것을 목표로 한다14. 충격파 요법에서 엑소좀의 필수적인 역할은 이전 연구에서 입증될 수 있습니다13. 그러나 엑소좀이 방출되는 정확한 메커니즘과 방출된 엑소좀의 정확한 화물은 아직 불분명합니다. 방출된 엑소좀의 재생 효과와 방출을 연구하기 위해 충격파 요법 시 엑소좀을 얻을 수 있는 실현 가능하고 표준화된 프로토콜을 수립했습니다.
우리가 아는 한, 이것은 충격파 요법 시 엑소좀을 분리하는 방법을 설명하는 최초의 프로토콜입니다. 수조는 공기 흡수를 피하기 때문에 적절한 SW 적용을 보장하기 위해 프로토콜에 반드시 필요합니다15 . 따라서 이 프로토콜로 분리된 모든 엑소좀은 동일한 양의 에너지 플럭스 밀도로 처리된 내피 세포에서 발생합니다.
내피 세포에서 엑소좀을 생산한 경험만 있기 때문에 다른 세포주를 이용한 실험에 대한 정확한 실험 설정을 권장할 수 없습니다. 그러나 SW 요법 시 엑소좀을 통한 기계전달이 다른 세포 유형에서도 중요한 역할을 한다고 확신합니다. 어쨌든, 추가 조사가 이 이론을 증명해야 합니다. 내피 세포 이외의 다른 세포주를 연구할 때는 파일럿 트레일을 권장합니다. 내피 세포를 대상으로 연구하는 동안, 우리는 세포를 파종하기 전에 플라스크를 조심스럽게 코팅해야 한다는 것을 알게 되었습니다. 그렇지 않으면 SW 요법 시 세포가 분리됩니다. 우리는 이것이 다른 세포주에도 적용된다고 생각합니다.
또한, 애플리케이터와 수조 사이의 정확한 연결과 애플리케이터에서 세포 배양 플라스크까지의 정확한 거리를 아는 것은 비교 가능한 결과를 위해 중요합니다. 어플리케이터 내부에 위치한 소스(예: 전기 유압 시스템의 전극 팁)는 다양한 SW 어플리케이터에서 다르게 배치되기 때문에 어플리케이터와 세포 배양 플라스크 사이의 거리는 SW 장치에 따라 다르다는 점에 유의해야 합니다. 또한, 현탁 배양에서는 어플리케이터와 각 세포 사이에 일정한 거리가 없기 때문에 부착 세포만 사용하는 것이 좋습니다. 이 프로토콜의 한계는 초원심분리기가 필요하다는 것입니다. 그러나 이 방법은 엑소좀 분리 키트를 구매하지 않아도 됩니다.
전체적으로 이 프로토콜은 충격파 치료 시 세포외 소포 방출의 역할을 연구하기 위한 표준화된 방법을 제공하므로 분자 SW 효과를 이해하는 데 중요한 도구가 될 수 있습니다.
공개
JH와 MG는 심장 충격파 요법(www.heart-regeneration.com)을 촉진하는 것을 목표로 하는 인스브루크 의과대학 분사인 Heart Regeneration Technologies GmbH의 주주입니다. 다른 모든 저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 JH 및 CGT에 대한 무제한 AUVA 연구 보조금의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
참고문헌
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유