Method Article
Exosomenisolierung nach in vitro Stoßwellentherapie
In diesem Artikel
Zusammenfassung
Exosomen werden bei der In-vitro-Anwendung von Stoßwellen freigesetzt. Hier beschreiben wir, wie man Stoßwellen auf kultivierte Endothelzellen aufbringt und anschließend Exosomen für weitere Untersuchungen isoliert.
Zusammenfassung
Die Stoßwellentherapie wird routinemäßig bei orthopädischen Indikationen wie Tendinopathien wie lateraler Epicondylitis (Tennisarm) und Achillessehnenentzündung (Fersensporn) sowie bei nicht heilenden Wunden und Knochen angewendet. Die Kombination aus einer angiogenen und einer entzündungshemmenden Wirkung der Stoßwellentherapie führt trotz unterschiedlicher Krankheitsbilder zu einer Regeneration im Weichgewebe und in den Knochen. In über 30 Jahren klinischer Anwendung wurden keine Nebenwirkungen beobachtet. Darüber hinaus zeigte die Grundlagenforschung sogar regenerative Effekte auf das ischämische Myokard.
In einer früheren Arbeit konnten wir zeigen, dass der mechanische Stimulus von kultivierten Zellen über eine Exosomenfreisetzung in eine biologische Reaktion übersetzt wird. Der genaue Mechanismus muss jedoch noch geklärt werden. Bei der Anwendung der Stoßwellentherapie ist die mechanische Kopplung von entscheidender Bedeutung, da selbst kleine Luftblasen Stoßwellen absorbieren können. Die zuvor beschriebene Wasserbadmethode ist eine valide Methode, um eine adäquate und reproduzierbare Stoßwellenapplikation in vitro zu gewährleisten.
Wir waren in der Lage, ein praktikables und replizierbares Protokoll zur Isolierung von Exosomen aus kultivierten Zellen nach Stoßwellenanwendung zu entwickeln. Dabei zeigen wir eine Möglichkeit, die zugrundeliegenden Mechanismen der Mechanotransduktion sowie das regenerative und angiogene Potenzial von Stoßwellen-freigesetzten Exosomen zu untersuchen.
Einleitung
Schockwellen (SW) sind Schalldruckwellen, die in der Natur auftreten, wenn in kurzer Zeit eine hohe Energiemenge freigesetzt wird (z.B. Donner mit Blitz). In der klinischen Routine werden Stoßwellen in der Lithotripsie seit über 30 Jahren eingesetzt, um Nierensteine ohne relevante Nebenwirkungen zu zersetzen 1,2. Zufällig wurde im Röntgenbild nach dem Zerfall des Nierensteins eine Verdickung des Beckenknochens beobachtet. Diese Beobachtung bildete die Grundlage für die Erforschung von Knochenheilungsstörungen und führte zur Behandlung von Pseudarthrosen an langen Knochen 3,4,5.
Die Indikationen für die Stoßwellentherapie wurden erweitert und heute ist die Methode in der klinischen Routine bei orthopädischen Indikationen wie Tendinopathien wie der lateralen Epicondylitis (Tennisarm) und der Achillessehnenentzündung (Fersensporn) im klinischen Einsatz6,7. Darüber hinaus konnte in der Grundlagenforschung ein hohes angiogenes Potenzial der Stoßwellentherapie (SWT) nachgewiesen werden. Darin zeigte eine Studie einen Anstieg der angiogenen Wachstumsfaktoren wie VEGF (vaskulärer endothelialer Wachstumsfaktor), PIGF (plazentarer Wachstumsfaktor) und FGF (vaskulärer endothelialer Wachstumsfaktor) nach SWT, gefolgt von Angiogenese8.
Um eine mögliche vorteilhafte Rolle der Stoßwellen-induzierten Angiogenese bei anderen Pathologien zu untersuchen, haben wir die SW-Therapie in einem Tiermodell der ischämischen Herzkrankheit angewendet 9,10. Nachdem ein regenerativer Effekt im ischämischen Myokard nachgewiesen werden konnte, konnten wir die unverzichtbare Rolle des angeborenen Immunrezeptors TLR 3 (Toll like receptor 3) bei der Stoßwellentherapie identifizieren11,12. Weitere Studien zeigten, dass der mechanische Stimulus der SW-Therapie über die Freisetzung von Exosomen in ein biologisches Signal übersetzt wird. Im Vergleich zu Exosomen, die physiologisch aus Endothelzellen freigesetzt werden, enthalten Exosomen, die bei SWT freigesetzt werden, eine erhöhte Ladung an angiogener microRNA. SWT wurde in das ischämische Myokard injiziert und setzte Exosomen frei, die eine Regeneration induzierten13.
Da Luft SW absorbiert, ist eine perfekte Kopplung zwischen dem Applikator und den Zellkulturflaschen entscheidend. Ein standardisiertes Wasserbad stellt eine praktikable Methode zur Anwendung von SWT in vitro und einen reproduzierbaren Versuchsaufbau dar. Um eine Reflexion und damit eine Interferenz von Wellen zu vermeiden, zerstört ein keilförmiger Absorber die in den hinteren Teil des Wasserbades verlaufenden Primärwellen. Aus diesem Grund empfehlen wir, Stoßwellen in vitro nur mit dem beschriebenen Wasserbad anzuwenden.
In diesem Protokoll beschreiben wir die Anwendung von Stoßwellen in vitro, um angiogene Exosomen in den Überstand freizusetzen. Dieses Protokoll bietet die Möglichkeit, die Rolle von Exosomen bei der Mechanotransduktion zu untersuchen und ist die Grundlage für weitere Untersuchungen der Exosomenfreisetzung nach SWT.
Protokoll
Humane Endothelzellen der Nabelschnurvene wurden aus einem Kaiserschnitt an der Klinik für Gynäkologie gewonnen. Daher wurde die schriftliche Einverständniserklärung der Patienten eingeholt. Die Genehmigung erfolgte durch die Ethikkommission der Medizinischen Universität Innsbruck (Nr. UN4435).
HINWEIS: Arbeiten Sie unter einer sterilen Laminar-Flow-Haube, um eine Kontamination zu vermeiden.
1. 24 h vor dem Experiment
- Bereiten Sie das exosomenfreie endotheliale Wachstumsmedium vor, indem Sie fötales Rinderserum (FCS) bei 4 °C und 120.000 x g über Nacht ultrazentrifugieren.
- Einen 75 cm² großen Zellkulturkolben mit 10 % Gelatine bestreichen.
- Humane Endothelzellen im Zellkulturkolben mit Endothelwachstumsmedium aussäen.
Experimentiertag:
HINWEIS: 4 l ddH2O, exosomenfreies FCS, Endothelial Cell Growth Basal Medium und PBS auf 37 °C vorwärmen.
2. Bereiten Sie die Anwendung der Stoßwellentherapie vor
- Bereiten Sie ein exosomenfreies endotheliales Wachstumsmedium vor, indem Sie Nahrungsergänzungsmittel aus dem handelsüblichen Kit (z. B. Bullet Kit) hinzufügen und ultrazentrifugiertes exosomfreies FCS anstelle von herkömmlichem FCS zum endothelialen Wachstumsmedium hinzufügen.
- Füllen Sie ein Wasserbad mit ca. 3,5 l 37 °C vorgewärmter ddH2O.
- Verbinden Sie den SW-Applikator mit dem Wasserbad.
- Definieren Sie die Behandlungsparameter (Energieflussdichte, Impulsfrequenz) am SW-Gerät. Wir empfehlen 500 Impulse bei einer Energieflussdichte von 0,07 mJ/mm² und einer Frequenz von 5 Hz.
3. Stoßwellen-Anwendung
- Untersuchen Sie die Lebensfähigkeit von Zellen anhand des morphologischen Aussehens und der Dichte von Endothelzellen über ein Mikroskop mit einer 100-fachen Gesamtvergrößerung. Verwenden Sie Kolben mit hoher Konfluenz nur für eine erhöhte Menge an Exosomen.
- Ersetzen Sie vorsichtig das Endothelzellmedium durch ca. 250 ml PBS, um den Kolben vollständig zu füllen und die gesamte Restluft zu unterdrücken.
- Verwenden Sie Parafilm oder luftdichte Kappen, um den Kolben zu verschließen.
- Halten Sie den Zellkulturkolben in vertikaler Position in ein Wasserbad, wobei die mit der Zelle bedeckte Seite dem SW-Gerät gegenüberliegt. Es ist darauf zu achten, dass der Abstand des Kolbens zum Applikator mit der angegebenen Markierung übereinstimmt. Verwenden Sie für das Orthowave 180c-Gerät einen Abstand von 10 cm.
- Verwenden Sie 250 Impulse der SW-Therapie auf die untere Hälfte des Zellkulturkolbens.
- Drehen Sie den Kolben um 180° und geben Sie 250 Impulse in die obere Hälfte des Zellkulturkolbens.
- Entfernen Sie anschließend die Kolbenversiegelung und ersetzen Sie PBS durch 15 mL endotheliales Wachstumsmedium mit exosomenfreiem FCS.
- Kultivieren Sie therapisierte Zellen in einem exosomenfreien Medium für eine angemessene Zeit für den Versuchsaufbau. Die höchste Menge an Exosomen kann 4 h nach der SW-Therapie entnommen werden (Abbildung 1).
HINWEIS: In der scheinoperierten Gruppe werden die Zellkulturflaschen der gleichen Behandlung unterzogen (siehe Abschnitt oben), ohne eine SW-Therapie anzuwenden.
4. Isolierung von Exosomen
- Den Überstand in ein Auffangröhrchen überführen und bei 4 °C und 300 x g 10 min zentrifugieren. In diesem Schritt werden alle Zellen im Überstand entfernt.
- Zur Entfernung von Zellresten den Überstand in ein neues Röhrchen umfüllen und bei 4 °C und 3.000 x g für 20 min zentrifugieren.
- Der Überstand wird durch einen 200-nm-Filter in ein Zentrifugalröhrchen abgeseiht, um apoptotische Körper zu entfernen.
- Zentrifugieren Sie den filtrierten Überstand bei 4 °C mit 120.000 x g für 70 min. Den Überstand verwerfen und das Exosomenpellet mit 300 μl PBS resuspendieren.
- Da das Exosomen-Pellet nach der Ultrazentrifugation nicht sichtbar ist, wirbeln Sie das Ultrazentrifugationsröhrchen 30 Sekunden lang ein, um sicherzustellen, dass das Exosomen-Pellet resuspendiert wird. Passen Sie die Lautstärke von PBS an die experimentellen Bedürfnisse und weitere Experimente an.
- Lagern Sie resuspendierte Exosomen bei -80 °C.
HINWEIS: Das Protokoll kann nach dem Transfer des Überstands in ein Sammelröhrchen oder vor der Ultrazentrifugation durch Einfrieren des Überstands bei -80 °C pausiert werden.
5. Fallstricke
- Stellen Sie sicher, dass der SW-Applikator fest mit dem Wasserbad verbunden ist. Eine unvollständige Verbindung kann zu einem undichten Wasserbad führen.
- Stellen Sie sicher, dass ein genauer Abstand zwischen dem Kolben und dem Applikator besteht, um die gleiche Menge an Energieflussdichte auf verschiedene Kolben auszunutzen.
- Markieren Sie die Zellkulturflaschen, die einer SW-Therapie unterzogen wurden, und die Zellkulturflaschen, die die Kontrollproben waren.
- Trocknen Sie die Kolben, bevor Sie sie wieder in den Inkubator legen, um eine Kontamination zu vermeiden.
Ergebnisse
Unter Verwendung des beschriebenen Protokolls haben wir sowohl humane Endothelzellen (HUVECs) als auch humane Endothelzellen der Koronararterien (CAECs; PromoCell) bis hin zur Stoßwellentherapie (z. B. Orthowave 180c). Die freigesetzten Vesikel wurden mittels Nano-Tracking-Analyse (NTA) quantifiziert. Dabei konnten wir eine Zunahme der Mikrovesikelfreisetzung unter SW-Therapie beobachten (Abbildung 1A,B). Die Bildgebung von HUVECs-freigesetzten Vesikeln mittels Transmissionselektronenmikroskopie zeigte die charakteristische 100-nm-Größe der Exosomen (Abbildung 1C) sowie die typischerweise beschriebene becherförmige Form (Abbildung 1D). Da die Analyse mit dem Durchflusszytometer das Vorhandensein der Exosomenproteinmarker CD9, CD81 und CD63 ergab, kann kein Zweifel daran bestehen, dass es sich bei den von HUVECs freigesetzten Mikrovesikel um Exosomen handelt (Abbildung 1 E-G).
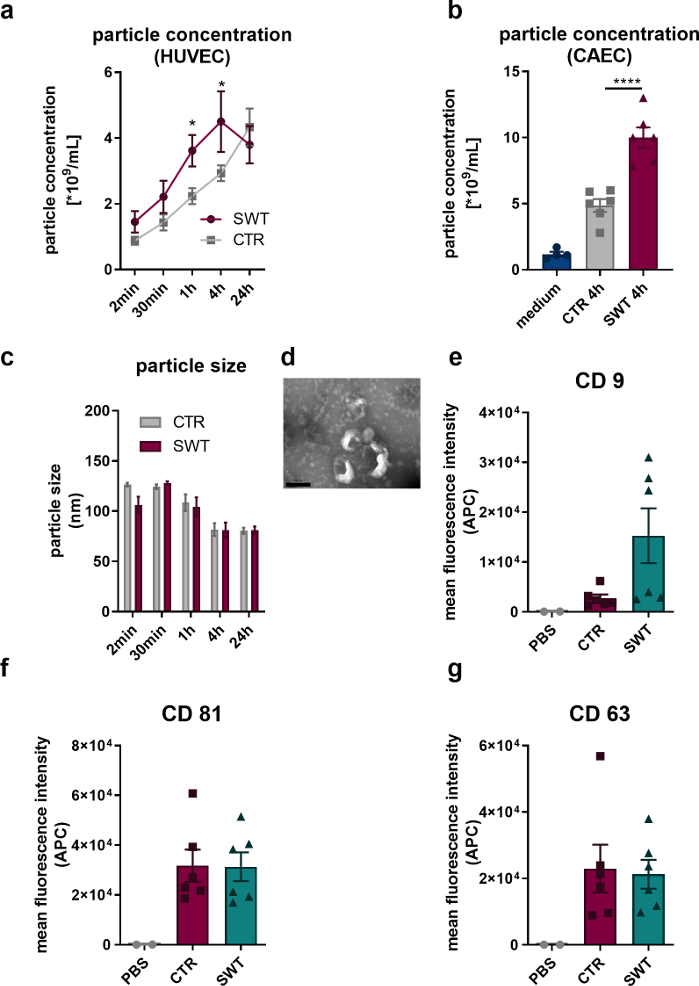
Abbildung 1: Freisetzung von Exosomen nach Stoßwellentherapie in vitro. (A) HUVECs, freigesetzte Mikrovesikel wurden über NTA im Zeitverlauf nach der SW-Therapie quantifiziert. Die Daten werden als Mittelwerte ± SEM ausgedrückt. *P<0,05. n=3–6. (B) Erhöhte Konzentrationen von Mikrovesikeln wurden im Überstand von CAECs 4 Stunden nach der SW-Therapie gefunden. Die Daten werden als Mittelwerte ± SEM ausgedrückt. ****P < 0,0001. n=4–6. (C-D) NTA zeigte eine typische Größe und die Transmissionselektronenmikroskopie eine typische Exosomenform. n=3–5. Maßstabsleiste = 200 nm. (E-G) Freigesetzte Mikrovesikel exprimieren die Exosomenmarker CD 9, CD 63 und CD 81. Die Daten werden als Mittelwerte ± SEM ausgedrückt. n=6. Statistische Vergleiche zwischen zwei Gruppen: Student's t-Test, mehrere Gruppen: unidirektionale ANOVA mit Tukey-Post-hoc-Analyse. Modifiziert von Gollmann-Tepeköylü et al.13. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In mehreren Grundlagenforschungsarbeiten konnte die regenerative Wirkung der Stoßwellentherapie nachgewiesen werden und wird routinemäßig in orthopädischen Indikationen angewendet 3,4,5. In verschiedenen Tiermodellen konnte die regenerative Wirkung auf das ischämische Myokard nachgewiesen werden und zur Initiierung der CAST-HF-Studie führen 9,10. Ziel dieser randomisierten kontrollierten Studie ist es, den Nutzen einer direkten kardialen Stoßwellentherapie zu evaluieren, die zusätzlich bei einer Bypass-Operation der Koronararterien angewendet wird14. Die unverzichtbare Rolle von Exosomen bei der Stoßwellentherapie konnte in einer früheren Arbeitgezeigt werden 13. Der genaue Mechanismus der Freisetzung von Exosomen sowie die genaue Fracht der freigesetzten Exosomen bleibt jedoch unklar. Um die Freisetzung sowie die regenerative Wirkung von freigesetzten Exosomen zu untersuchen, haben wir ein praktikables und standardisiertes Protokoll zur Gewinnung von Exosomen nach Stoßwellentherapie etabliert.
Unseres Wissens ist dies das erste Protokoll, das eine Methode zur Isolierung von Exosomen nach der Stoßwellentherapie beschreibt. Ein Wasserbad ist notwendigerweise erforderlich, damit das Protokoll eine angemessene SW-Anwendung gewährleistet, da es die Luftaufnahme15 vermeidet. Dabei stammen alle mit diesem Protokoll isolierten Exosomen aus Endothelzellen, die mit der gleichen Energieflussdichte behandelt wurden.
Da wir nur Erfahrung mit der Herstellung von Exosomen aus Endothelzellen haben, können wir für Experimente mit anderen Zelllinien keinen exakten Versuchsaufbau empfehlen. Wir sind jedoch davon überzeugt, dass die Mechanotransduktion über Exosomen nach SW-Therapie auch bei anderen Zelltypen eine entscheidende Rolle spielt. Unabhängig davon müssen weitere Untersuchungen diese Theorie beweisen. Bei der Arbeit mit anderen Zelllinien als Endothelzellen würden wir einen Pilotpfad empfehlen. Bei der Arbeit mit Endothelzellen stellten wir fest, dass es notwendig ist, die Kolben vor dem Aussäen der Zellen sorgfältig zu beschichten. Andernfalls lösen sich die Zellen bei der SW-Therapie ab. Wir glauben, dass dies auch für andere Zelllinien gilt.
Darüber hinaus ist eine genaue Verbindung zwischen dem Applikator und dem Wasserbad sowie die Kenntnis des genauen Abstands vom Applikator zum Zellkulturkolben wichtig für vergleichbare Ergebnisse. Da die Quelle (z. B. Elektrodenspitzen in einem elektrohydraulischen System), die sich im Inneren des Applikators befindet, bei verschiedenen SW-Applikatoren unterschiedlich positioniert ist, ist zu beachten, dass der Abstand zwischen dem Applikator und den Zellkulturflaschen bei verschiedenen SW-Geräten unterschiedlich ist. Darüber hinaus empfehlen wir, nur adhärente Zellen zu verwenden, da in einer Suspensionskultur kein konstanter Abstand zwischen dem Applikator und den einzelnen Zellen besteht. Eine Einschränkung dieses Protokolls ist die Notwendigkeit einer Ultrazentrifuge. Diese Methode vermeidet jedoch den Kauf von Exosomen-Isolationskits.
Insgesamt bietet dieses Protokoll eine standardisierte Methode zur Untersuchung der Rolle der extrazellulären Vesikelfreisetzung bei der Stoßwellentherapie und könnte daher ein entscheidendes Werkzeug für das Verständnis molekularer SW-Effekte sein.
Offenlegungen
JH und MG sind Gesellschafter der Heart Regeneration Technologies GmbH, einem Spin-off der Medizinischen Universität Innsbruck zur Förderung der kardialen Stoßwellentherapie (www.heart-regeneration.com). Alle anderen Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde durch ein uneingeschränktes AUVA-Forschungsstipendium an JH und CGT unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
Referenzen
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076(2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten