Method Article
Isolamento degli esosomi dopo terapia con onde d'urto in vitro
In questo articolo
Riepilogo
Gli esosomi vengono rilasciati dopo l'applicazione in vitro di onde d'urto. Qui, descriviamo come applicare le onde d'urto sulle cellule endoteliali in coltura e successivamente isolare gli esosomi per ulteriori indagini.
Abstract
La terapia con onde d'urto viene applicata di routine nelle indicazioni ortopediche, comprese le tendinopatie come l'epicondilite laterale (gomito del tennista) e la tendinite di Achille (sperone calcaneare), nonché le ferite e le ossa che non guariscono. Nonostante le diverse patologie, la combinazione di un effetto angiogenico e antinfiammatorio della terapia con onde d'urto porta alla rigenerazione dei tessuti molli e delle ossa. In oltre 30 anni di applicazione clinica, non sono stati osservati effetti collaterali. Inoltre, la ricerca di base ha anche rivelato effetti rigenerativi sul miocardio ischemico.
In un lavoro precedente abbiamo potuto dimostrare che lo stimolo meccanico delle cellule in coltura viene tradotto attraverso un rilascio di esosomi in una risposta biologica. Tuttavia, l'esatto meccanismo rimane da chiarire. L'accoppiamento meccanico è fondamentale quando si applica la terapia con onde d'urto, poiché anche piccole bolle d'aria possono assorbire le onde d'urto. Il metodo del bagno d'acqua precedentemente descritto è un metodo valido per garantire un'adeguata e riproducibile applicazione delle onde d'urto in vitro.
Siamo stati in grado di sviluppare un protocollo fattibile e replicabile per isolare gli esosomi dalle cellule in coltura dopo l'applicazione di onde d'urto. In questo modo dimostriamo la possibilità di studiare i meccanismi sottostanti alla meccanotrasduzione così come il potenziale rigenerativo e angiogenico degli esosomi rilasciati da onde d'urto.
Introduzione
Le onde d'urto (SW) sono onde di pressione sonora che compaiono in natura quando un'elevata quantità di energia viene rilasciata in un breve periodo di tempo (ad esempio, tuoni con fulmini). Nella routine clinica, le onde d'urto vengono utilizzate nella litotrissia per disintegrare i calcoli renali senza effetti collaterali rilevanti per oltre 30 anni 1,2. Per incidente, un ispessimento dell'osso iliaco è stato osservato nei raggi X dopo la disintegrazione dei calcoli renali. Questa osservazione ha fornito le basi per la ricerca sui disturbi della guarigione ossea e ha portato al trattamento nelle non unioni delle ossa lunghe 3,4,5.
Le indicazioni per la terapia con onde d'urto sono state ampliate e oggi il metodo è in uso clinico di routine in indicazioni ortopediche, comprese le tendinopatie come l'epicondilite laterale (gomito del tennista) e la tendinite di Achille (sperone calcaneare)6,7. Inoltre, la ricerca di base ha dimostrato un alto potenziale angiogenico della terapia con onde d'urto (SWT). In esso, uno studio ha mostrato un aumento dei fattori di crescita angiogenici come VEGF (fattore di crescita dell'endotelio vascolare), PIGF (fattore di crescita placentare) e FGF (fattore di crescita dell'endotelio vascolare) dopo SWT seguito da angiogenesi8.
Per studiare un possibile ruolo benefico dell'angiogenesi indotta da onde d'urto in altre patologie, abbiamo applicato la terapia SW in un modello animale di cardiopatia ischemica 9,10. Dopo che è stato dimostrato un effetto rigenerativo nel miocardio ischemico, abbiamo potuto identificare il ruolo indispensabile del recettore immunitario innato TLR 3 (Toll like receptor 3) nella terapia con onde d'urto11,12. Ulteriori studi hanno dimostrato che lo stimolo meccanico della terapia SW viene tradotto in un segnale biologico attraverso il rilascio di esosomi. Rispetto agli esosomi rilasciati fisiologicamente dalle cellule endoteliali, gli esosomi rilasciati dopo SWT contengono un maggiore carico di microRNA angiogenico. Iniettato nel miocardio ischemico, SWT ha rilasciato esosomi indotta dalla rigenerazione13.
Poiché l'aria assorbe il SW, è fondamentale un perfetto accoppiamento tra l'applicatore e i palloni per colture cellulari. Un bagno d'acqua standardizzato rappresenta un metodo fattibile per applicare SWT in vitro e un setup sperimentale riproducibile. Al fine di evitare una riflessione e di conseguenza l'interferenza delle onde, un assorbitore a forma di cuneo distrugge le onde primarie che corrono verso il retro del bagnomaria. Per questo motivo, si consiglia di applicare le onde d'urto in vitro utilizzando solo il bagnomaria descritto.
In questo protocollo descriviamo l'applicazione di onde d'urto in vitro per rilasciare esosomi angiogenici nel surnatante. Questo protocollo fornisce la possibilità di studiare il ruolo degli esosomi nella meccanotrasduzione ed è la base per ulteriori indagini sul rilascio di esosomi in seguito a SWT.
Protocollo
Le cellule endoteliali della vena ombelicale umana sono state ottenute da tagli cesarei presso il Dipartimento di Ginecologia. Pertanto, è stato ottenuto il consenso informato scritto dei pazienti. L'autorizzazione è stata data dal comitato etico dell'Università di Medicina di Innsbruck (n. UN4435).
NOTA: Lavorare sotto una cappa a flusso laminare sterile per evitare contaminazioni.
1. 24 ore prima dell'esperimento
- Preparare il terreno di crescita endoteliale libero da esosomi mediante ultracentrifugazione del siero fetale bovino (FCS) a 4 °C e 120.000 x g durante la notte.
- Rivestire un pallone di coltura cellulare da 75 cm² utilizzando il 10% di gelatina.
- Seminare cellule endoteliali umane nel pallone di coltura cellulare utilizzando il terreno di crescita endoteliale.
Giorno dell'esperimento:
NOTA: Preriscaldare 4 L di ddH2O, FCS senza esosomi, terreno basale di crescita delle cellule endoteliali e PBS a 37 °C.
2. Preparare l'applicazione della terapia con onde d'urto
- Preparare il terreno di crescita endoteliale libero da esosomi aggiungendo integratori dal kit commerciale (ad esempio, Bullet Kit) e aggiungendo FCS libero da esosomi ultracentrifugato invece del comune FCS al terreno di crescita endoteliale.
- Riempire un bagnomaria con circa 3,5 L di 37 °C preriscaldato ddH2O.
- Collegare l'applicatore SW al bagnomaria.
- Definire i parametri di trattamento (densità del flusso di energia, frequenza degli impulsi) sul dispositivo SW. Si consigliano 500 impulsi con una densità di flusso di energia di 0,07 mJ/mm² e una frequenza di 5 Hz.
3. Applicazione delle onde d'urto
- Esamina la vitalità cellulare in base all'aspetto morfologico e alla densità delle cellule endoteliali tramite un microscopio utilizzando un ingrandimento totale di 100x. Utilizzare palloni ad alta confluenza solo per una maggiore quantità di esosomi.
- Sostituire con cura il terreno di coltura endoteliale con circa 250 mL di PBS per riempire completamente il pallone e reprimere tutta l'aria residua.
- Utilizzare parafilm o tappi ermetici per sigillare il pallone.
- Tenere il pallone per coltura cellulare in posizione verticale all'interno di un bagno d'acqua con il lato coperto della cella opposto al dispositivo SW. Assicurarsi che la distanza del pallone dall'applicatore sia in linea con la marcatura indicata. Per il dispositivo Orthowave 180c, utilizzare una distanza di 10 cm.
- Utilizzare 250 impulsi di terapia SW nella metà inferiore del pallone di coltura cellulare.
- Ruotare il pallone di 180° e utilizzare 250 impulsi nella metà superiore del pallone per colture cellulari.
- Successivamente rimuovere il tappo del pallone e sostituire il PBS con 15 mL di terreno di crescita endoteliale con FCS privo di essomi.
- Coltura di cellule terapizzate in un terreno privo di esosomi per un tempo appropriato per la configurazione dell'esperimento. La quantità massima di esosomi può essere raccolta 4 ore dopo la terapia SW (Figura 1).
NOTA: Nel gruppo operato con sham, sottoporre i flaconi di coltura cellulare allo stesso trattamento (vedere la sezione precedente) senza utilizzare la terapia SW.
4. Isolamento degli esosomi
- Trasferire il surnatante in una provetta di raccolta e centrifugare a 4 °C e 300 x g per 10 minuti. Questo passaggio rimuove tutte le cellule nel surnatante.
- Per la rimozione dei detriti cellulari, trasferire il surnatante in una nuova provetta e centrifugare a 4 °C e 3.000 x g per 20 minuti.
- Filtrare il surnatante attraverso un filtro da 200 nm in una provetta centrifuga per rimuovere i corpi apoptotici.
- Centrifugare il surnatante filtrato a 4 °C con 120.000 x g per 70 min. Scartare il surnatante e risospendere il pellet di esosoma con 300 μl di PBS.
- Poiché il pellet di esosomi non è visibile dopo l'ultracentrifugazione, agitare la provetta di ultracentrifugazione per 30 secondi per assicurarsi che il pellet di esosoma sia risospeso. Regolare il volume di PBS in base alle esigenze sperimentali e agli ulteriori esperimenti.
- Conservare gli esosomi risospesi a -80 °C.
NOTA: Il protocollo può essere messo in pausa dopo il trasferimento del surnatante in una provetta di raccolta o prima dell'ultracentrifugazione congelando il surnatante a -80 °C.
5. Insidie
- Assicurarsi che l'applicatore SW sia collegato saldamente al bagnomaria. Un collegamento incompleto può portare a un bagno d'acqua che perde.
- Assicurarsi che vi sia una distanza precisa dal pallone all'applicatore per utilizzare la stessa quantità di densità di flusso di energia in flaconi diversi.
- Contrassegnare i flaconi di coltura cellulare che sono stati sottoposti a terapia SW e i flaconi di coltura cellulare che erano i campioni di controllo.
- Asciugare i palloni prima di rimetterli nell'incubatrice per evitare contaminazioni.
Risultati
Utilizzando il protocollo descritto, abbiamo sottoposto le cellule endoteliali umane (HUVEC) e le cellule endoteliali dell'arteria coronarica umana (CAEC; PromoCell) alla terapia con onde d'urto (ad es. Orthowave 180c). Le vescicole rilasciate sono state quantificate tramite analisi di nano tracciamento (NTA). In questo modo, abbiamo potuto osservare un aumento del rilascio di microvescicole durante la terapia SW (Figura 1A, B). L'imaging delle vescicole rilasciate da HUVEC tramite microscopia elettronica a trasmissione ha rivelato la caratteristica dimensione di 100 nm degli esosomi (Figura 1C) e la forma a forma di coppa tipicamente descritta (Figura 1D). Poiché l'analisi del citometro a flusso ha rivelato la presenza di marcatori proteici esosomici CD9, CD81 e CD63, non ci può essere dubbio che le microvescicole rilasciate da HUVEC siano esosomi (Figura 1 E-G).
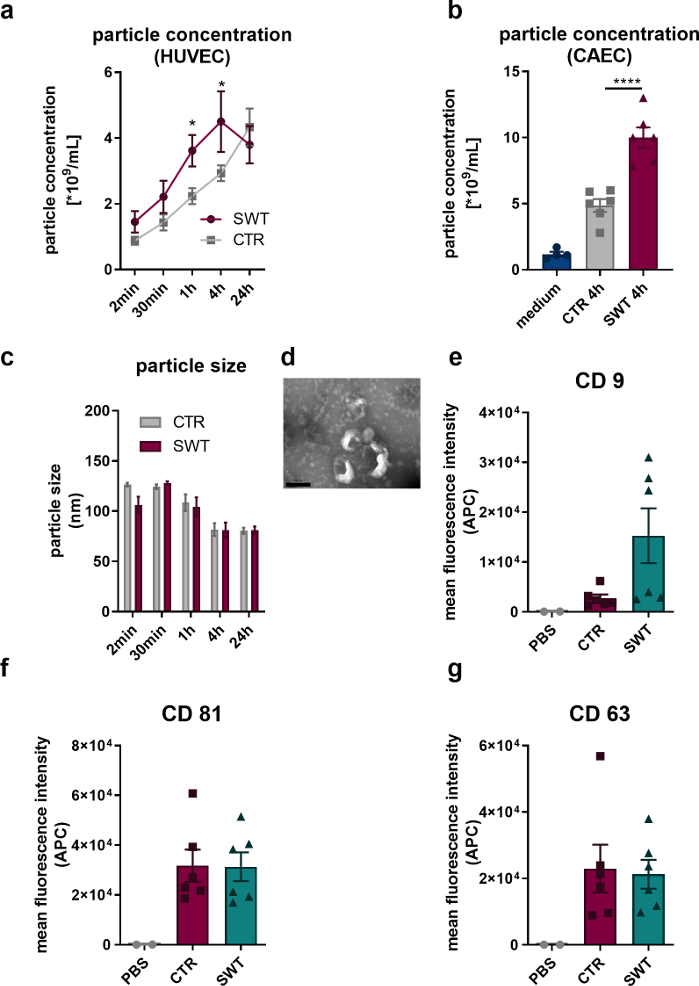
Figura 1: Rilascio di esosomi in terapia con onde d'urto in vitro. (A) Le microvescicole rilasciate da HUVEC sono state quantificate tramite NTA in un corso temporale dopo la terapia SW. I dati sono espressi come medie ± SEM. *P<0.05. n=3–6. (B) Livelli aumentati di microvescicole sono stati riscontrati nel surnatante delle CAEC 4 ore dopo la terapia SW. I dati sono espressi come medie ± SEM. ****P < 0,0001. n=4–6. (C-D) L'NTA ha rivelato dimensioni tipiche e la microscopia elettronica a trasmissione ha rivelato la tipica forma dell'esosoma. n=3–5. Barra della scala = 200 nm. (E-G) Le microvescicole rilasciate esprimono i marcatori esosomiali CD 9, CD 63 e CD 81. I dati sono espressi come medie ± SEM. n=6. Confronti statistici tra due gruppi: t-test di Student, gruppi multipli: ANOVA unidirezionale con analisi post hoc di Tukey. Modificato da Gollmann-Tepeköylü et al.13. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In molteplici lavori di ricerca di base, l'effetto rigenerativo della terapia con onde d'urto potrebbe essere dimostrato ed è applicato di routine nelle indicazioni ortopediche 3,4,5. In diversi modelli animali, l'effetto rigenerativo sul miocardio ischemico potrebbe essere dimostrato e portare all'inizio dello studio CAST-HF 9,10. Questo studio randomizzato controllato mira a valutare il beneficio della terapia con onde d'urto cardiache dirette applicata in aggiunta durante l'intervento di bypass aorto-coronarico14. Il ruolo indispensabile degli esosomi nella terapia con onde d'urto potrebbe essere dimostrato in un precedente lavoro13. Tuttavia, l'esatto meccanismo di rilascio degli esosomi e l'esatto carico di esosomi rilasciati rimangono poco chiari. Per studiare il rilascio e l'effetto rigenerativo degli esosomi rilasciati, abbiamo stabilito un protocollo fattibile e standardizzato per ottenere esosomi dopo la terapia con onde d'urto.
Per quanto ne sappiamo, questo è il primo protocollo che descrive un metodo per isolare gli esosomi durante la terapia con onde d'urto. Un bagno d'acqua è necessariamente necessario affinché il protocollo garantisca un'adeguata applicazione SW, in quanto evita l'assorbimento d'aria15 . In tal modo, tutti gli esosomi isolati con questo protocollo derivano da cellule endoteliali trattate con la stessa quantità di densità di flusso di energia.
Poiché abbiamo esperienza solo nella produzione di esosomi da cellule endoteliali, non possiamo raccomandare una configurazione esatta dell'esperimento per esperimenti con altre linee cellulari. Tuttavia, siamo convinti che la meccanotrasduzione attraverso gli esosomi in terapia SW svolga un ruolo cruciale anche in altri tipi di cellule. Indipendentemente da ciò, ulteriori indagini devono dimostrare questa teoria. Quando si lavora con altre linee cellulari oltre alle cellule endoteliali, si consiglia un percorso pilota. Mentre lavoravamo con le cellule endoteliali, abbiamo scoperto che era necessario rivestire accuratamente le fiasche prima di seminare le cellule. In caso contrario, le cellule si staccheranno durante la terapia SW. Riteniamo che questo valga anche per altre linee cellulari.
Inoltre, un collegamento accurato tra l'applicatore e il bagnomaria, oltre a conoscere l'esatta distanza tra l'applicatore e il pallone di coltura cellulare, è importante per ottenere risultati comparabili. Poiché la sorgente (ad esempio, le punte degli elettrodi in un sistema elettroidraulico) situata all'interno dell'applicatore è posizionata in modo diverso nei diversi applicatori SW, tenere presente che la distanza tra l'applicatore e i palloni di coltura cellulare differisce a seconda dei diversi dispositivi SW. Inoltre, si consiglia di utilizzare solo cellule aderenti, poiché in una coltura in sospensione non c'è una distanza costante tra l'applicatore e ciascuna cellula. Un limite di questo protocollo è la necessità di un'ultracentrifuga. Tuttavia, questo metodo evita l'acquisto di kit di isolamento degli esosomi.
Nel complesso, questo protocollo fornisce un metodo standardizzato per studiare il ruolo del rilascio di vescicole extracellulari sulla terapia con onde d'urto e potrebbe quindi essere uno strumento cruciale per la comprensione degli effetti molecolari del SW.
Divulgazioni
JH e MG sono azionisti di Heart Regeneration Technologies GmbH, uno spin-off dell'Università di Medicina di Innsbruck che mira a promuovere la terapia con onde d'urto cardiache (www.heart-regeneration.com). Tutti gli altri autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato supportato da una sovvenzione di ricerca AUVA illimitata a JH e CGT.
Materiali
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
Riferimenti
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon