Method Article
Aislamiento de exosomas después de la terapia de ondas de choque in vitro
En este artículo
Resumen
Los exosomas se liberan tras la aplicación in vitro de ondas de choque. Aquí, describimos cómo aplicar ondas de choque en células endoteliales cultivadas y posteriormente aislar exosomas para una mayor investigación.
Resumen
La terapia con ondas de choque se aplica de forma rutinaria en indicaciones ortopédicas, incluidas tendinopatías como la epicondilitis lateral (codo de tenista) y tendinitis de Aquiles (espolones calcáneos), así como heridas y huesos que no cicatrizan. A pesar de las diferentes patologías, la combinación de un efecto angiogénico y antiinflamatorio de la terapia con ondas de choque conduce a la regeneración de los tejidos blandos y los huesos. En más de 30 años de aplicación clínica, no se observaron efectos secundarios. Además, la investigación básica reveló incluso efectos regenerativos sobre el miocardio isquémico.
En un trabajo anterior pudimos demostrar que el estímulo mecánico de las células cultivadas se traduce a través de la liberación de un exosoma en una respuesta biológica. Sin embargo, el mecanismo exacto aún no se ha dilucidado. El acoplamiento mecánico es crucial cuando se aplica la terapia de ondas de choque, ya que incluso pequeñas burbujas de aire pueden absorber las ondas de choque. El método de baño de agua descrito anteriormente es un método válido para garantizar una aplicación adecuada y reproducible de ondas de choque in vitro.
Pudimos desarrollar un protocolo factible y replicable para aislar exosomas de células cultivadas después de la aplicación de ondas de choque. De este modo, demostramos la posibilidad de estudiar los mecanismos subyacentes de la mecanotransducción, así como el potencial regenerativo y angiogénico de los exosomas liberados por ondas de choque.
Introducción
Las ondas de choque (SW) son ondas de presión sonora que aparecen en la naturaleza cuando se libera una gran cantidad de energía en un corto período de tiempo (por ejemplo, truenos con relámpagos). En la rutina clínica, las ondas de choque se utilizan en la litotricia para desintegrar los cálculos renales sin efectos secundarios relevantes durante más de 30 años 1,2. Por incidente, se observó un engrosamiento del hueso ilíaco en las radiografías después de la desintegración de los cálculos renales. Esta observación proporcionó la base para la investigación de los trastornos de la cicatrización ósea y condujo al tratamiento en las pseudoartrosis de huesos largos 3,4,5.
Las indicaciones para la terapia con ondas de choque se ampliaron y hoy en día el método es de uso clínico rutinario en indicaciones ortopédicas que incluyen tendinopatías como la epicondilitis lateral (codo de tenista) y la tendinitis de Aquiles (espolones calcáneos)6,7. Además, la investigación básica demostró un alto potencial angiogénico de la terapia con ondas de choque (SWT). Allí, un estudio mostró un aumento de los factores de crecimiento angiogénico como el VEGF (factor de crecimiento endotelial vascular), el PIGF (factor de crecimiento placentario) y el FGF (factor de crecimiento endotelial vascular) tras el SWT seguido de angiogénesis8.
Para investigar un posible papel beneficioso de la angiogénesis inducida por ondas de choque en otras patologías, aplicamos la terapia SW en un modelo animal de cardiopatía isquémica 9,10. Una vez demostrado un efecto regenerativo en el miocardio isquémico, se pudo identificar el papel indispensable del receptor inmune innato TLR 3 (Toll like receptor 3) en la terapia con ondas de choque11,12. Estudios posteriores demostraron que el estímulo mecánico de la terapia SW se traduce en una señal biológica a través de la liberación de exosomas. En comparación con los exosomas liberados fisiológicamente por las células endoteliales, los exosomas liberados en SWT contienen una mayor carga de microARN angiogénico. Inyectado en el miocardio isquémico, los exosomas liberados por SWT indujeron la regeneración13.
Dado que el aire absorbe el SW, es crucial un acoplamiento perfecto entre el aplicador y los matraces de cultivo celular. Un baño de agua estandarizado representa un método factible para aplicar SWT in vitro y una configuración experimental reproducible. Para evitar la reflexión y, en consecuencia, la interferencia de las ondas, un absorbedor en forma de cuña destruye las ondas primarias que corren hacia la parte posterior del baño de agua. Por esta razón, recomendamos aplicar ondas de choque in vitro utilizando únicamente el baño de agua descrito.
En este protocolo describimos la aplicación de ondas de choque in vitro para liberar exosomas angiogénicos en el sobrenadante. Este protocolo ofrece la posibilidad de investigar el papel de los exosomas en la mecanotransducción y es la base para futuras investigaciones sobre la liberación de exosomas en el SWT.
Protocolo
Las células endoteliales de la vena umbilical humana se obtuvieron de cesáreas en el Departamento de Ginecología. Por lo tanto, se obtuvo el consentimiento informado por escrito de los pacientes. El comité de ética de la Universidad de Medicina de Innsbruck autorizó el trabajo (n. UN4435).
NOTA: Trabaje bajo una campana de flujo laminar estéril para evitar la contaminación.
1. 24 h antes del experimento
- Prepare el medio de crecimiento endotelial libre de exosomas mediante suero fetal bovino ultracentrífugo (FCS) a 4 °C y 120.000 x g durante la noche.
- Cubrir un matraz de cultivo celular de 75 cm² con gelatina al 10%.
- Siembre células endoteliales humanas en el matraz de cultivo celular utilizando un medio de crecimiento endotelial.
Día del experimento:
NOTA: Precalentar 4 L de ddH2O, FCS libre de exosomas, medio basal de crecimiento de células endoteliales y PBS a 37 °C.
2. Prepare la aplicación de la terapia con ondas de choque
- Prepare un medio de crecimiento endotelial libre de exosomas agregando suplementos del kit comercial (por ejemplo, Bullet Kit) y agregando FCS libre de exosomas ultracentrífugo en lugar de FCS comunes al medio de crecimiento endotelial.
- Llene un baño de agua con aproximadamente 3,5 L de ddH2O, precalentado a 37 °C.
- Conecte el aplicador SW al baño de agua.
- Defina los parámetros de tratamiento (energía, flujo de densidad, frecuencia de impulso) en el dispositivo SW. Recomendamos 500 impulsos a una densidad de flujo de energía de 0,07 mJ/mm² y una frecuencia de 5 Hz.
3. Aplicación de ondas de choque
- Estudie la viabilidad celular por el aspecto morfológico y la densidad de las células endoteliales a través de un microscopio utilizando un aumento total de 100x. Utilice matraces con alta confluencia solo para una mayor cantidad de exosomas.
- Reemplace cuidadosamente el medio de la célula endotelial con aproximadamente 250 mL de PBS para llenar completamente el matraz y reprimir todo el aire residual.
- Use parafilm o tapas herméticas para sellar el matraz.
- Sostenga el matraz de cultivo celular en posición vertical dentro de un baño de agua con el lado cubierto de la célula opuesto al dispositivo SW. Asegúrese de que la distancia del matraz al aplicador esté en línea con la marca indicada. Para el dispositivo Orthowave 180c, utilice una distancia de 10 cm.
- Utilice 250 impulsos de terapia SW en la mitad inferior del matraz de cultivo celular.
- Gire el matraz 180° y utilice 250 impulsos en la mitad superior del matraz de cultivo celular.
- A continuación, retire el sellado del matraz y sustituya el PBS por 15 mL de medio de crecimiento endotelial con FCS libre de exosomas.
- El cultivo de células terapeadas en un medio libre de exosomas durante un tiempo adecuado para la configuración del experimento. La mayor cantidad de exosomas se puede recolectar 4 h después de la terapia SW (Figura 1).
NOTA: En el grupo operado simuladamente, se sometieron los matraces de cultivo celular al mismo tratamiento (ver sección anterior) sin utilizar la terapia SW.
4. Aislamiento de exosomas
- Transfiera el sobrenadante a un tubo de recolección y centrifugue a 4 °C y 300 x g durante 10 min. Este paso elimina todas las células del sobrenadante.
- Para la eliminación de los restos celulares, transfiera el sobrenadante a un nuevo tubo y centrifugue a 4 °C y 3.000 x g durante 20 min.
- Cuele el sobrenadante a través de un filtro de 200 nm en un tubo centrífugo para eliminar los cuerpos apoptóticos.
- Sobrenadante filtrado por centrifugación a 4 °C con 120.000 x g durante 70 min. Deseche el sobrenadante y vuelva a suspender el pellet de exosoma con 300 μL de PBS.
- Dado que el gránulo de exosomas no es visible después de la ultracentrifugación, agite el tubo de ultracentrifugación durante 30 segundos para asegurarse de que el gránulo de exosoma se vuelva a suspender. Ajuste el volumen de PBS para las necesidades experimentales y otros experimentos.
- Almacene los exosomas resuspendidos a -80 °C.
NOTA: El protocolo puede ser pausado después de transferir el sobrenadante a un tubo de recolección o antes de la ultracentrifugación congelando el sobrenadante a -80 °C.
5. Trampas
- Asegúrese de que el aplicador SW esté bien conectado al baño de agua. Una conexión incompleta puede provocar un baño de agua con fugas.
- Asegúrese de que haya una distancia precisa desde el matraz hasta el aplicador para utilizar la misma cantidad de densidad de flujo de energía a diferentes matraces.
- Marque los matraces de cultivo celular que se sometieron a la terapia SW y los matraces de cultivo celular que fueron las muestras de control.
- Seque los matraces antes de volver a colocarlos en la incubadora para evitar la contaminación.
Resultados
Utilizando el protocolo descrito, sometimos células endoteliales humanas (HUVECs) así como células endoteliales de arterias coronarias humanas (CAECs; PromoCell) a la terapia con ondas de choque (por ejemplo, Orthowave 180c). Las vesículas liberadas se cuantificaron mediante análisis de nanoseguimiento (NTA). De este modo, pudimos observar un aumento en la liberación de microvesículas tras la terapia SW (Figura 1A,B). Las imágenes de las vesículas liberadas por HUVECs a través de microscopía electrónica de transmisión revelaron el tamaño característico de 100 nm de los exosomas (Figura 1C), así como la forma de copa típicamente descrita (Figura 1D). Dado que el análisis del citómetro de flujo reveló la presencia de los marcadores de proteínas de exosomas CD9, CD81 y CD63, no cabe duda de que las microvesículas liberadas por HUVEC son exosomas (Figura 1, E-G).
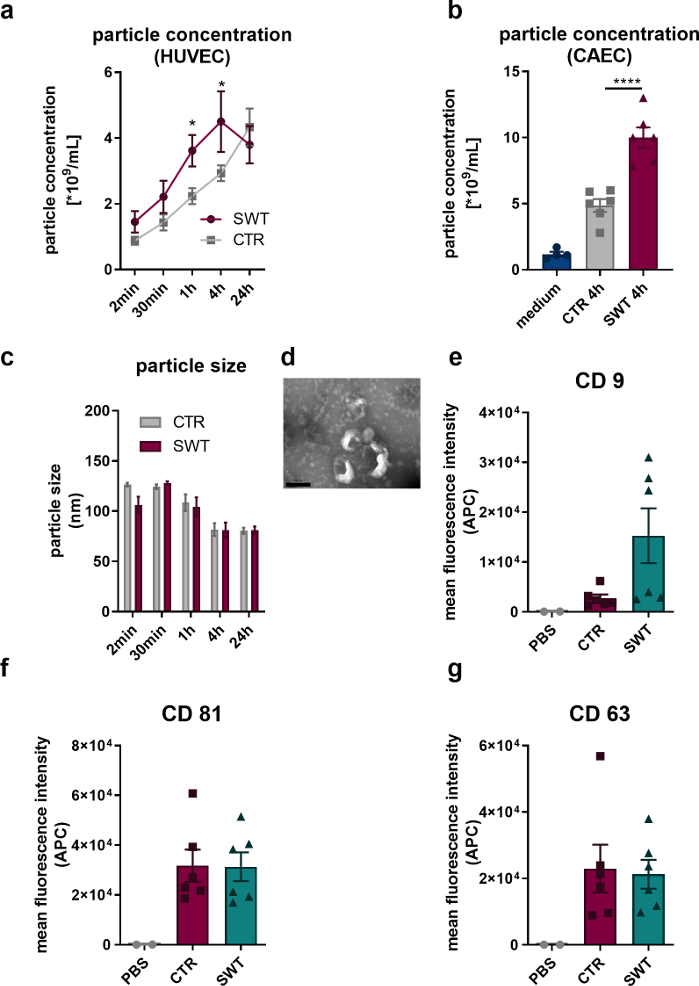
Figura 1: Liberación de exosomas tras la terapia con ondas de choque in vitro. (A) Las microvesículas liberadas por HUVECs se cuantificaron a través de NTA en un curso de tiempo después de la terapia con SW. Los datos se expresan como medios ± SEM. *P<0,05. n=3–6. (B) Se encontraron niveles aumentados de microvesículas en el sobrenadante de CAECs 4 horas después de la terapia con SW. Los datos se expresan como medias ± SEM. ****P < 0,0001. n=4–6. (C-D) La NTA reveló el tamaño típico y la microscopía electrónica de transmisión reveló la forma típica del exosoma. n=3–5. Barra de escala = 200 nm. (E-G) Las microvesículas liberadas expresan los marcadores de exosomas CD 9, CD 63 y CD 81. Los datos se expresan como medias ± SEM. n=6. Comparaciones estadísticas entre dos grupos: prueba t de Student, grupos múltiples: ANOVA de un factor con análisis post hoc de Tukey. Modificado de Gollmann-Tepeköylü et al.13. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En múltiples trabajos de investigación básica, se pudo demostrar el efecto regenerativo de la terapia con ondas de choque y se aplica de manera rutinaria en indicaciones ortopédicas 3,4,5. En diversos modelos animales, se pudo demostrar el efecto regenerativo sobre el miocardio isquémico y llevar al inicio del ensayo CAST-HF 9,10. Este ensayo controlado aleatorizado tiene como objetivo evaluar el beneficio de la terapia directa con ondas de choque cardíacas aplicada adicionalmente durante la cirugía de bypass coronario14. El papel indispensable de los exosomas en la terapia con ondas de choque pudo ser demostrado en un trabajo previo13. Sin embargo, el mecanismo exacto de liberación de exosomas, así como la carga exacta de exosomas liberados, sigue sin estar clara. Para estudiar la liberación, así como el efecto regenerativo de los exosomas liberados, establecimos un protocolo factible y estandarizado para obtener exosomas mediante terapia con ondas de choque.
Hasta donde sabemos, este es el primer protocolo que describe un método para aislar exosomas mediante terapia con ondas de choque. Es necesario un baño de agua para que el protocolo garantice una adecuada aplicación del SW, ya que evita la absorción de aire15 . De este modo, todos los exosomas aislados con este protocolo surgen de células endoteliales tratadas con la misma cantidad de densidad de flujo de energía.
Dado que solo tenemos experiencia en la producción de exosomas a partir de células endoteliales, no podemos recomendar una configuración de experimento exacta para experimentos con otras líneas celulares. Sin embargo, estamos convencidos de que la mecanotransducción a través de exosomas en la terapia SW también juega un papel crucial en otros tipos de células. De todos modos, investigaciones posteriores deben probar esta teoría. Cuando se trabaja con otras líneas celulares además de las células endoteliales, recomendamos un ensayo piloto. Al trabajar con células endoteliales, descubrimos que era necesario cubrir los matraces con cuidado antes de sembrar las células. De lo contrario, las células se desprenderán con la terapia SW. Creemos que esto también se aplica a otras líneas celulares.
Además, una conexión precisa entre el aplicador y el baño de agua, así como conocer la distancia exacta desde el aplicador hasta el matraz de cultivo celular, es importante para obtener resultados comparables. Dado que la fuente (por ejemplo, las puntas de los electrodos en un sistema electrohidráulico) ubicada dentro del aplicador está colocada de manera diferente en diversos aplicadores de SW, tenga en cuenta que la distancia entre el aplicador y los matraces de cultivo celular difiere con los diferentes dispositivos de SW. Además, se recomienda utilizar únicamente células adherentes, ya que en un cultivo en suspensión no hay una distancia constante entre el aplicador y cada célula. Una limitación de este protocolo es la necesidad de una ultracentrífuga. Sin embargo, este método evita la compra de kits de aislamiento de exosomas.
En conjunto, este protocolo proporciona un método estandarizado para estudiar el papel de la liberación de vesículas extracelulares en la terapia con ondas de choque y, por lo tanto, podría ser una herramienta crucial para la comprensión de los efectos moleculares de SW.
Divulgaciones
JH y MG son accionistas de Heart Regeneration Technologies GmbH, una empresa derivada de la Universidad de Medicina de Innsbruck cuyo objetivo es promover la terapia con ondas de choque cardíacas (www.heart-regeneration.com). Todos los demás autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado por una beca de investigación AUVA sin restricciones a JH y CGT.
Materiales
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
Referencias
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076(2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados