Method Article
Выделение экзосом после ударно-волновой терапии in vitro
В этой статье
Резюме
Экзосомы высвобождаются при воздействии ударных волн in vitro. В этой статье мы описываем, как применять ударные волны к культивируемым эндотелиальным клеткам и впоследствии выделять экзосомы для дальнейшего исследования.
Аннотация
Ударно-волновая терапия обычно применяется при ортопедических показаниях, включая тендинопатии, такие как латеральный эпикондилит (теннисный локоть) и тендинит ахиллова сухожилия (пяточная шпора), а также при незаживающих ранах и костях. Несмотря на разные патологии, сочетание ангиогенного и противовоспалительного эффекта ударно-волновой терапии приводит к регенерации в мягких тканях и костях. За более чем 30 лет клинического применения не наблюдалось никаких побочных эффектов. Более того, фундаментальные исследования даже выявили регенеративное воздействие на ишемизированный миокард.
В предыдущей работе мы смогли показать, что механический стимул культивируемых клеток транслируется через высвобождение экзосом в биологическую реакцию. Тем не менее, точный механизм еще предстоит выяснить. Механическая муфта имеет решающее значение при применении ударно-волновой терапии, так как даже небольшие пузырьки воздуха могут поглощать ударные волны. Ранее описанный метод водяной бани является действенным методом, гарантирующим адекватное и воспроизводимое применение ударной волны in vitro.
Нам удалось разработать осуществимый и воспроизводимый протокол для выделения экзосом из культивируемых клеток после применения ударной волны. Тем самым мы демонстрируем возможность изучения основных механизмов механотрансдукции, а также регенеративного и ангиогенного потенциала экзосом, высвобождаемых ударной волной.
Введение
Ударные волны (УВ) — это звуковые волны давления, которые появляются в природе при высвобождении большого количества энергии за короткий промежуток времени (например, гром с молнией). В клинической практике ударные волны используются в литотрипсии для разрушения камней в почках без соответствующих побочных эффектов в течение более 30лет. По происшествиям, на рентгенограммах наблюдалось утолщение подвздошной кости после распада камней в почках. Это наблюдение послужило основой для исследований нарушений заживления костей и привело к лечению несращения длинных костей 3,4,5.
Показания к проведению ударно-волновой терапии были расширены, и в настоящее время метод находится в рутинном клиническом применении при ортопедических показаниях, включая тендинопатии, такие как латеральный эпикондилит (локоть теннисиста) и тендинит ахиллова сухожилия (пяточная шпора)6,7. Кроме того, фундаментальные исследования продемонстрировали высокий ангиогенный потенциал ударно-волновой терапии (УВТ). В нем исследование показало увеличение ангиогенных факторов роста, таких как VEGF (фактор роста эндотелия сосудов), PIGF (фактор роста плаценты) и FGF (фактор роста эндотелия сосудов) при УВТ с последующим ангиогенезом8.
Для изучения возможной благоприятной роли ангиогенеза, индуцированного ударной волной, при других патологиях мы применили СР-терапию на животной модели ишемической болезни сердца 9,10. После того, как был продемонстрирован регенеративный эффект в ишемизированном миокарде, мы смогли определить незаменимую роль рецептора врожденного иммунитета TLR 3 (рецептор типа Toll 3) при ударно-волновой терапии11,12. Дальнейшие исследования показали, что механический стимул СР-терапии транслируется в биологический сигнал через высвобождение экзосом. По сравнению с экзосомами, физиологически высвобождаемыми из эндотелиальных клеток, экзосомы, высвобождаемые при УВТ, содержат повышенный груз ангиогенной микроРНК. При введении в ишемизированный миокард УВТ высвобождает экзосомы, индуцирующие регенерацию13.
Поскольку воздух поглощает ОУ, решающее значение имеет идеальное соединение между аппликатором и колбами для клеточных культур. Стандартизированная водяная баня представляет собой возможный метод применения УВТ in vitro и воспроизводимую экспериментальную установку. Чтобы избежать отражения и, как следствие, интерференции волн, клиновидный поглотитель разрушает первичные волны, идущие к задней части водяной бани. По этой причине мы рекомендуем применять ударные волны in vitro только с использованием описанной водяной бани.
В этом протоколе мы описываем применение ударных волн in vitro для высвобождения ангиогенных экзосом в надосадочную жидкость. Данный протокол дает возможность исследовать роль экзосом в механотрансдукции и является основой для дальнейших исследований высвобождения экзосом при УВТ.
протокол
Эндотелиальные клетки пупочной вены человека были получены путем кесарева сечения в отделении гинекологии. Таким образом, было получено письменное информированное согласие пациентов. Разрешение было дано комитетом по этике Медицинского университета Инсбрука (no. UN4435).
ПРИМЕЧАНИЕ: Работайте под стерильным ламинарным колпаком, чтобы избежать загрязнения.
1. За 24 ч до начала эксперимента
- Приготовьте свободную от экзосом эндотелиальную питательную среду путем ультрацентрифугирования фетальной бычьей сыворотки (FCS) при 4 °C и 120 000 x g в течение ночи.
- Покройте колбу для клеточных культур площадью 75 см² 10% желатином.
- Засейте эндотелиальные клетки человека в колбе для клеточных культур с использованием эндотелиальной питательной среды.
День эксперимента:
ПРИМЕЧАНИЕ: Предварительно нагрейте 4 л ddH2O, FCS без экзосом, базальную среду для роста эндотелиальных клеток и PBS до 37 °C.
2. Подготовьте приложение для ударно-волновой терапии
- Приготовьте эндотелиальную питательную среду без экзосом, добавив добавки из коммерческого набора (например, Bullet Kit) и добавив ультрацентрифугированную ФКС без экзосом вместо обычной ССК в эндотелиальную питательную среду.
- Наполните водяную баню примерно 3,5 л 37 °C предварительно подогретым ddH2O.
- Подключите SW-аппликатор к водяной бане.
- Определение параметров обработки (плотность потока энергии, частота импульсов) на программном устройстве. Мы рекомендуем 500 импульсов с плотностью потока энергии 0,07 мДж/мм² и частотой 5 Гц.
3. Применение ударной волны
- Исследование жизнеспособности клеток по морфологическому виду и плотности эндотелиальных клеток с помощью микроскопа с использованием 100-кратного общего увеличения. Используйте колбы с высокой конфлюенцией только для увеличенного количества экзосом.
- Осторожно замените среду эндотелиальных клеток примерно 250 мл PBS, чтобы полностью заполнить колбу и подавить весь остаточный воздух.
- Используйте парапленку или герметичные крышки, чтобы запечатать колбу.
- Держите колбу для клеточных культур в вертикальном положении внутри водяной бани стороной, закрытой клеткой, противоположной устройству SW. Убедитесь, что расстояние от колбы до аппликатора соответствует указанной маркировке. Для аппарата Orthowave 180c используйте расстояние от 10 см.
- Используйте 250 импульсов SW-терапии в нижней половине колбы с клеточными культурами.
- Поверните колбу на 180° и используйте 250 импульсов для верхней половины колбы для клеточных культур.
- Затем снимите пломбу колбы и замените PBS 15 мл эндотелиальной питательной среды на FCS, свободную от экзосом.
- Культивировали клетки в свободной от экзосом среде в течение времени, необходимого для проведения эксперимента. Наибольшее количество экзосом может быть собрано через 4 ч после СВ-терапии (рис. 1).
ПРИМЕЧАНИЕ: В группе, где проводилась фиктивная операция, флаконы с клеточными культурами подвергались той же обработке (см. раздел выше) без использования СР-терапии.
4. Выделение экзосом
- Переложите надосадочную жидкость в сборную пробирку и центрифугу при температуре 4 °C и 300 x g в течение 10 минут. На этом этапе удаляются все клетки надосадочной жидкости.
- Для удаления клеточного мусора перенесите надосадочную жидкость в новую пробирку и центрифугу при температуре 4 °C и 3 000 x g в течение 20 минут.
- Процедите надосадочную жидкость через фильтр 200 нм в центробежную трубку для удаления апоптотических тел.
- Центрифуга фильтрует надосадочную жидкость при 4 °C с 120 000 x g в течение 70 мин. Выбросьте надосадочную жидкость и ресуспендируйте гранулу экзосомы с 300 мкл PBS.
- Поскольку гранула экзосомы не видна после ультрацентрифугирования, поверните ультрацентрифужную трубку на 30 секунд, чтобы убедиться, что гранула экзосомы снова суспендирована. Отрегулируйте объем PBS в соответствии с потребностями эксперимента и дальнейшими экспериментами.
- Храните ресуспендированные экзосомы при температуре -80 °C.
ПРИМЕЧАНИЕ: Протокол можно приостановить после переноса надосадочной жидкости в сборную пробирку или перед ультрацентрифугированием путем замораживания надосадочной жидкости при температуре -80 °C.
5. Подводные камни
- Убедитесь, что SW-аппликатор плотно подключен к водяной бане. Неполное соединение может привести к негерметичности водяной бани.
- Убедитесь, что расстояние от колбы до аппликатора является точным, чтобы использовать одинаковое количество плотности потока энергии для разных колб.
- Отметьте колбы для клеточных культур, которые были подвергнуты SW-терапии, и колбы для клеточных культур, которые были контрольными образцами.
- Высушите колбы перед тем, как положить их обратно в инкубатор, чтобы избежать заражения.
Результаты
Используя описанный протокол, мы подвергали эндотелиальные клетки человека (HUVECs), а также эндотелиальные клетки коронарных артерий человека (CAEC; PromoCell) до ударно-волновой терапии (например, Orthowave 180c). Высвобожденные везикулы количественно оценивали с помощью анализа нанослежения (NTA). Таким образом, мы могли наблюдать увеличение высвобождения микровезикул при терапии SW (рис. 1A, B). Визуализация высвобождаемых везикул HUVEC с помощью просвечивающей электронной микроскопии выявила характерный размер экзосом в 100 нм (рисунок 1C), а также типично описанную чашеобразную форму (рисунок 1D). Поскольку анализ проточного цитометра выявил наличие маркеров экзосомных белков CD9, CD81 и CD63, не может быть никаких сомнений в том, что микровезикулы, высвобождаемые HUVECs, являются экзосомами (рис. 1, E-G).
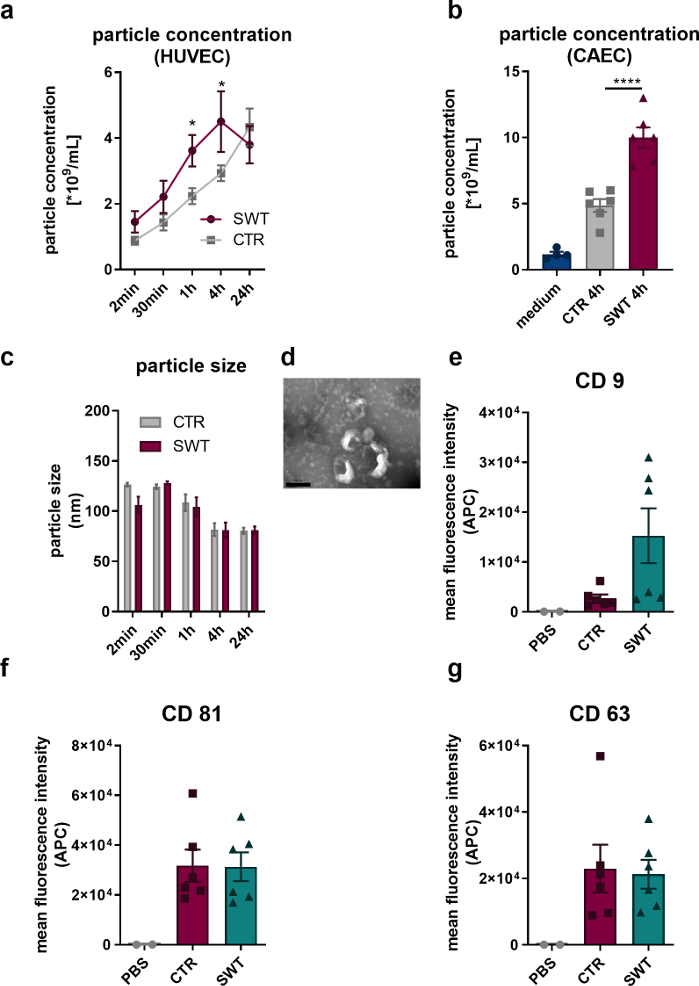
Рисунок 1: Высвобождение экзосом при ударно-волновой терапии in vitro. (A) Микровезикулы, высвобождаемые HUVECs, количественно оценивали с помощью NTA в течение определенного времени после терапии SW. Данные выражены в виде средних значений ± SEM. *P<0.05. n=3–6. (B) Повышенные уровни микровезикул были обнаружены в надосадочной жидкости CAECs через 4 часа после терапии SW. Данные выражаются в средних ± SEM. ****P < 0,0001. n=4–6. (К-Д) NTA выявила типичный размер, а просвечивающая электронная микроскопия выявила типичную форму экзосомы. n=3–5. Масштабная линейка = 200 нм. (Э-Г) Высвобождающиеся микровезикулы экспрессируют экзосомные маркеры CD 9, CD 63 и CD 81. Данные выражаются в виде средних ± СЕМ. n=6. Статистические сравнения между двумя группами: t-критерий Стьюдента, множественные группы: односторонняя ANOVA с апостериорным анализом Тьюки. Модифицировано из Gollmann-Tepeköylü et al.13. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В многочисленных фундаментальных исследованиях был продемонстрирован регенеративный эффект ударно-волновой терапии, которая регулярно применяется при ортопедических показаниях 3,4,5. На различных животных моделях было продемонстрировано регенеративное действие на ишемизированный миокард, что привело к началу исследования CAST-HF 9,10. Это рандомизированное контролируемое исследование направлено на оценку пользы прямой ударно-волновой терапии сердца, применяемой дополнительно во время операции аортокоронарного шунтирования14. Незаменимая роль экзосом в ударно-волновой терапии может быть продемонстрирована в предыдущей работе13. Тем не менее, точный механизм высвобождения экзосом, а также точный груз высвобождаемых экзосом остается неясным. Для изучения высвобождения, а также регенеративного эффекта высвобожденных экзосом мы разработали осуществимый и стандартизированный протокол получения экзосом с помощью ударно-волновой терапии.
Насколько нам известно, это первый протокол, описывающий метод выделения экзосом с помощью ударно-волновой терапии. Водяная баня обязательно необходима для того, чтобы протокол гарантировал адекватное применение ПО, так как она предотвращает поглощение воздуха15 . Таким образом, все экзосомы, выделенные по этому протоколу, возникают из эндотелиальных клеток, обработанных с одинаковой плотностью потока энергии.
Поскольку у нас есть опыт получения экзосом только из эндотелиальных клеток, мы не можем рекомендовать точную схему эксперимента для экспериментов с другими клеточными линиями. Тем не менее, мы убеждены, что механотрансдукция через экзосомы при SW-терапии играет решающую роль и в других типах клеток. В любом случае, дальнейшие исследования должны подтвердить эту теорию. При работе с другими клеточными линиями, помимо эндотелиальных клеток, мы бы рекомендовали пилотную трассу. Работая с эндотелиальными клетками, мы обнаружили необходимость тщательного покрытия колб перед посевом клеток. В противном случае клетки будут отделяться при SW-терапии. Мы полагаем, что это относится и к другим клеточным линиям.
Кроме того, для получения сопоставимых результатов важно точное соединение между аппликатором и водяной баней, а также точное расстояние от аппликатора до колбы с клеточными культурами. Поскольку источник (например, наконечники электродов в электрогидравлической системе), расположенный внутри аппликатора, расположен по-разному в различных SW-аппликаторах, следует учитывать, что расстояние между аппликатором и колбами для клеточных культур различается в разных SW-устройствах. Кроме того, мы рекомендуем использовать только адгезивные клетки, так как в суспензионной культуре нет постоянного расстояния между аппликатором и каждой клеткой. Ограничением этого протокола является необходимость использования ультрацентрифуги. Однако этот метод позволяет избежать покупки наборов для выделения экзосом.
В целом, этот протокол представляет собой стандартизированный метод изучения роли высвобождения внеклеточных везикул при ударно-волновой терапии и, следовательно, может быть важным инструментом для понимания молекулярных эффектов SW.
Раскрытие информации
JH и MG являются акционерами компании Heart Regeneration Technologies GmbH, дочерней компании Медицинского университета Инсбрука, целью которой является продвижение сердечной ударно-волновой терапии (www.heart-regeneration.com). Всем остальным авторам нечего раскрывать.
Благодарности
Это исследование было поддержано неограниченным исследовательским грантом AUVA для JH и CGT.
Материалы
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
Ссылки
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076(2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены