Method Article
Isolement des exosomes après une thérapie par ondes de choc in vitro
Dans cet article
Résumé
Les exosomes sont libérés lors de l’application in vitro d’ondes de choc. Ici, nous décrivons comment appliquer des ondes de choc sur des cellules endothéliales en culture et isoler ensuite des exosomes pour une étude plus approfondie.
Résumé
La thérapie par ondes de choc est couramment appliquée dans des indications orthopédiques, y compris les tendinopathies telles que l’épicondylite latérale (tennis elbow) et la tendinite d’Achille (épine calcanéenne), ainsi que les plaies et les os non cicatrisants. Malgré différentes pathologies, la combinaison d’un effet angiogénique et d’un effet anti-inflammatoire de la thérapie par ondes de choc conduit à une régénération des tissus mous et des os. En plus de 30 ans d’application clinique, aucun effet secondaire n’a été observé. De plus, la recherche fondamentale a même révélé des effets régénératifs sur le myocarde ischémique.
Dans un travail précédent, nous avons pu montrer que le stimulus mécanique des cellules cultivées est traduit par une libération d’exosomes en une réponse biologique. Cependant, le mécanisme exact reste à élucider. Le couplage mécanique est crucial lors de l’application de la thérapie par ondes de choc, car même de petites bulles d’air peuvent absorber les ondes de choc. La méthode du bain-marie décrite précédemment est une méthode valable pour garantir une application adéquate et reproductible des ondes de choc in vitro.
Nous avons été en mesure de développer un protocole réalisable et reproductible pour isoler les exosomes des cellules cultivées après l’application d’ondes de choc. Nous démontrons ainsi la possibilité d’étudier les mécanismes sous-jacents de la mécanotransduction ainsi que le potentiel régénérateur et angiogénique des exosomes libérés par ondes de choc.
Introduction
Les ondes de choc (SW) sont des ondes de pression sonore qui apparaissent dans la nature lorsqu’une grande quantité d’énergie est libérée dans un court laps de temps (par exemple, le tonnerre avec la foudre). En routine clinique, les ondes de choc sont utilisées dans la lithotripsie pour désintégrer les calculs rénaux sans effets secondaires pertinents depuis plus de 30 ans 1,2. Par incident, un épaississement de l’os iliaque a été observé sur les radiographies après la désintégration de calculs rénaux. Cette observation a servi de base à la recherche sur les troubles de la cicatrisation osseuse et a conduit au traitement des non-consolidation des os longs 3,4,5.
Les indications de la thérapie par ondes de choc ont été élargies et aujourd’hui, la méthode est utilisée en clinique de routine dans des indications orthopédiques, y compris les tendinopathies telles que l’épicondylite latérale (tennis elbow) et la tendinite d’Achille (épine calcanéenne)6,7. De plus, la recherche fondamentale a démontré un potentiel angiogénique élevé de la thérapie par ondes de choc (SWT). Dans cette étude, une étude a montré une augmentation des facteurs de croissance angiogéniques tels que le VEGF (facteur de croissance de l’endothélium vasculaire), le PIGF (facteur de croissance placentaire) et le FGF (facteur de croissance de l’endothélium vasculaire) lors de la SWT suivie de l’angiogenèse8.
Pour étudier un rôle bénéfique possible de l’angiogenèse induite par les ondes de choc dans d’autres pathologies, nous avons appliqué la thérapie SW dans un modèle animal de cardiopathie ischémique 9,10. Après la démonstration d’un effet régénérateur dans le myocarde ischémique, nous avons pu identifier le rôle indispensable du récepteur immunitaire inné TLR 3 (récepteur 3 de type Toll) lors de la thérapie par ondes de choc11,12. D’autres études ont montré que le stimulus mécanique de la thérapie SW est traduit en un signal biologique via la libération d’exosomes. Par rapport aux exosomes physiologiquement libérés par les cellules endothéliales, les exosomes libérés lors de la SWT contiennent une cargaison accrue de microARN angiogéniques. Injecté dans le myocarde ischémique, SWT libère des exosomes induisant la régénération13.
Étant donné que l’air absorbe le SW, un couplage parfait entre l’applicateur et les flacons de culture cellulaire est crucial. Un bain-marie standardisé représente une méthode réalisable pour appliquer le SWT in vitro et un dispositif expérimental reproductible. Afin d’éviter une réflexion et par conséquent une interférence des ondes, un absorbeur en forme de coin détruit les ondes primaires qui s’écoulent à l’arrière du bain d’eau. Pour cette raison, nous recommandons d’appliquer des ondes de choc in vitro en utilisant uniquement le bain-marie décrit.
Dans ce protocole, nous décrivons l’application d’ondes de choc in vitro pour libérer des exosomes angiogéniques dans le surnageant. Ce protocole offre la possibilité d’étudier le rôle des exosomes dans la mécanotransduction et constitue la base d’une étude plus approfondie de la libération d’exosomes lors de la SWT.
Protocole
Des cellules endothéliales de la veine ombilicale humaine ont été obtenues à partir de césariennes au Département de gynécologie. Par conséquent, le consentement éclairé écrit des patients a été obtenu. L’autorisation a été donnée par le comité d’éthique de l’Université de médecine d’Innsbruck (no. UN4435).
REMARQUE : Travaillez sous une hotte à flux laminaire stérile pour éviter toute contamination.
1. 24 h avant l’expérience
- Préparez un milieu de croissance endothéliale libre d’exosomes en ultra-centrifugeant du sérum fœtal bovin (SCF) à 4 °C et 120 000 x g pendant la nuit.
- Enduire une fiole de culture cellulaire de 75 cm² avec de la gélatine à 10 %.
- Ensemencez des cellules endothéliales humaines dans le ballon de culture cellulaire à l’aide d’un milieu de croissance endothéliale.
Journée d’expérimentation :
REMARQUE : Préchauffer 4 L de ddH2O, FCS libre d’exosome, milieu basal de croissance des cellules endothéliales et PBS à 37 °C.
2. Préparez l’application de la thérapie par ondes de choc
- Préparez un milieu de croissance endothéliale libre d’exosomes en ajoutant des suppléments du kit commercial (par exemple, Bullet Kit) et en ajoutant du FCS exempt d’exosomes ultracentrifugé au lieu d’un FCS commun au milieu de croissance endothéliale.
- Remplissez un bain-marie avec environ 3,5 L de ddH2O préchauffé à 37 °C.
- Connectez l’applicateur SW au bain-marie.
- Définissez les paramètres de traitement (densité de flux d’énergie, fréquence d’impulsion) sur l’appareil SW. Nous recommandons 500 impulsions à une densité de flux d’énergie de 0,07 mJ/mm² et une fréquence de 5 Hz.
3. Application d’ondes de choc
- Étudier la viabilité cellulaire par l’aspect morphologique et la densité des cellules endothéliales au microscope à l’aide d’un grossissement total de 100x. Utilisez des flacons à forte confluence pour une quantité accrue d’exosomes uniquement.
- Remplacez soigneusement le milieu de cellules endothéliales par environ 250 mL de PBS pour remplir complètement le ballon et réprimer tout l’air résiduel.
- Utilisez du parafilm ou des bouchons hermétiques pour sceller le flacon.
- Tenez le ballon de culture cellulaire en position verticale à l’intérieur d’un bain-marie, le côté recouvert de cellules étant opposé au dispositif SW. Assurez-vous que la distance entre le flacon et l’applicateur est alignée avec le marquage indiqué. Pour l’appareil Orthowave 180c, utilisez une distance de 10 cm.
- Utilisez 250 impulsions de thérapie SW vers la moitié inférieure du flacon de culture cellulaire.
- Tournez le ballon à 180° et utilisez 250 impulsions vers la moitié supérieure du ballon de culture cellulaire.
- Retirer ensuite le scellement du ballon et remplacer le PBS par 15 mL de milieu de croissance endothéliale avec du FCS sans exosome.
- Cultivez des cellules thérapeutiques dans un milieu exempt d’exosomes pendant un temps approprié pour la configuration de l’expérience. La plus grande quantité d’exosomes peut être recueillie 4 h après le traitement par SW (Figure 1).
REMARQUE : Dans le groupe opéré par placebo, soumettre des flacons de culture cellulaire au même traitement (voir la section ci-dessus) sans utiliser la thérapie SW.
4. Isolement des exosomes
- Transvaser le surnageant dans un tube de prélèvement et centrifuger à 4 °C et 300 x g pendant 10 min. Cette étape permet d’éliminer toutes les cellules du surnageant.
- Pour éliminer les débris cellulaires, transférez le surnageant dans un nouveau tube et centrifugez-le à 4 °C et 3 000 x g pendant 20 min.
- Filtrez le surnageant à travers un filtre de 200 nm dans un tube centrifuge pour éliminer les corps apoptotiques.
- Surnageant filtré par centrifugation à 4 °C avec 120 000 x g pendant 70 min. Jeter le surnageant et remettre en suspension la pastille d’exosome avec 300 μL de PBS.
- Étant donné que la pastille d’exosomes n’est pas visible après l’ultracentrifugation, faites tourbillonner le tube d’ultracentrifugation pendant 30 secondes pour vous assurer que la pastille d’exosome est remise en suspension. Ajustez le volume du PBS en fonction des besoins expérimentaux et des expériences ultérieures.
- Conserver les exosomes remis en suspension à -80 °C.
REMARQUE : Le protocole peut être interrompu après le transfert du surnageant dans un tube de prélèvement ou avant l’ultracentrifugation en congelant le surnageant à -80 °C.
5. Pièges
- Assurez-vous que l’applicateur SW est bien connecté au bain-marie. Une connexion incomplète peut entraîner une fuite du bain-marie.
- Assurez-vous qu’il y a une distance précise entre le ballon et l’applicateur afin d’utiliser la même quantité de densité de flux d’énergie vers différents flacons.
- Marquez les flacons de culture cellulaire qui ont été soumis à la thérapie SW et les flacons de culture cellulaire qui ont été les échantillons de contrôle.
- Faites sécher les flacons avant de les remettre dans l’incubateur pour éviter toute contamination.
Résultats
En utilisant le protocole décrit, nous avons soumis des cellules endothéliales humaines (HUVEC) ainsi que des cellules endothéliales de l’artère coronaire humaine (CAEC ; PromoCell) à la thérapie par ondes de choc (par exemple, Orthowave 180c). Les vésicules libérées ont été quantifiées par analyse de nano-suivi (NTA). Ainsi, nous avons pu observer une augmentation de la libération de microvésicules lors de la thérapie SW (Figure 1A, B). L’imagerie des vésicules libérées par microscopie électronique à transmission a révélé la taille caractéristique de 100 nm des exosomes (Figure 1C) ainsi que la forme en forme de coupe généralement décrite (Figure 1D). L’analyse par cytomètre en flux ayant révélé la présence de marqueurs protéiques d’exosomes CD9, CD81 et CD63, il ne fait aucun doute que les microvésicules libérées par les HUVECs sont des exosomes (Figure 1 E-G).
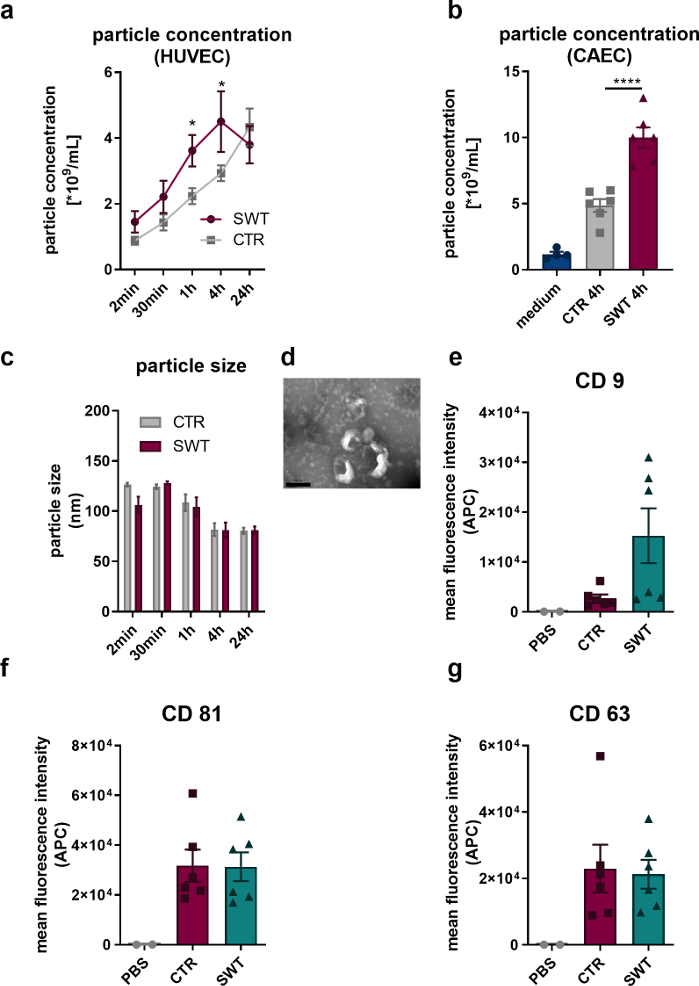
Figure 1 : Libération d’exosomes lors d’une thérapie par ondes de choc in vitro. (A) Les microvésicules libérées par les HUVECs ont été quantifiées par NTA dans le temps après le traitement SW. Les données sont exprimées en moyens ± MEB. *P<0,05. n = 3 à 6. (B) Des niveaux accrus de microvésicules ont été trouvés dans le surnageant des CAEC 4 heures après le traitement SW. Les données sont exprimées en moyens ± MEB. ****P < 0,0001. n = 4 à 6. (C-D) La NTA a révélé une taille typique et la microscopie électronique à transmission a révélé une forme typique de l’exosome. n = 3 à 5. Barre d’échelle = 200 nm. (E-G) Les microvésicules libérées expriment les marqueurs d’exosomes CD 9, CD 63 et CD 81. Les données sont exprimées en moyens ± SEM. n=6. Comparaisons statistiques entre deux groupes : test t de Student, groupes multiples : ANOVA à un facteur avec analyse post hoc de Tukey. Modifié d’après Gollmann-Tepeköylü et al.13. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans de multiples travaux de recherche fondamentale, l’effet régénérateur de la thérapie par ondes de choc a pu être démontré et est couramment appliqué dans des indications orthopédiques 3,4,5. Dans divers modèles animaux, l’effet régénérateur sur le myocarde ischémique a pu être démontré et conduire au lancement de l’essai CAST-HF 9,10. Cet essai contrôlé randomisé vise à évaluer le bénéfice de la thérapie directe par ondes de choc cardiaques appliquée en plus lors d’un pontage aorto-coronarien14. Le rôle indispensable des exosomes sur la thérapie par ondes de choc a pu être démontré dans un travail antérieur13. Cependant, le mécanisme exact de la libération des exosomes ainsi que la cargaison exacte des exosomes libérés restent incertains. Pour étudier la libération ainsi que l’effet régénérateur des exosomes libérés, nous avons établi un protocole réalisable et standardisé pour obtenir des exosomes lors de la thérapie par ondes de choc.
À notre connaissance, il s’agit du premier protocole décrivant une méthode d’isolement des exosomes lors d’une thérapie par ondes de choc. Un bain d’eau est nécessairement nécessaire pour que le protocole garantisse une application adéquate du SW, car il évite l’absorption d’air15 . Ainsi, tous les exosomes isolés avec ce protocole proviennent de cellules endothéliales traitées avec la même quantité de densité de flux d’énergie.
Comme nous n’avons d’expérience que dans la production d’exosomes à partir de cellules endothéliales, nous ne pouvons pas recommander une configuration d’expérience exacte pour des expériences avec d’autres lignées cellulaires. Cependant, nous sommes convaincus que la mécanotransduction via les exosomes lors de la thérapie SW joue également un rôle crucial dans d’autres types de cellules. Quoi qu’il en soit, des enquêtes plus approfondies doivent prouver cette théorie. Lorsque vous travaillez avec d’autres lignées cellulaires que les cellules endothéliales, nous recommandons un essai pilote. En travaillant avec des cellules endothéliales, nous avons constaté qu’il fallait nécessairement enrober soigneusement les flacons avant d’ensemencer les cellules. Sinon, les cellules se détacheront lors de la thérapie SW. Nous pensons que cela s’applique également à d’autres lignées cellulaires.
De plus, une connexion précise entre l’applicateur et le bain-marie, ainsi que la connaissance de la distance exacte entre l’applicateur et le ballon de culture cellulaire, sont importantes pour des résultats comparables. Étant donné que la source (p. ex., les pointes d’électrodes d’un système électrohydraulique) située à l’intérieur de l’applicateur est positionnée différemment dans divers applicateurs SW, sachez que la distance entre l’applicateur et les flacons de culture cellulaire diffère selon les dispositifs SW. De plus, nous recommandons d’utiliser uniquement des cellules adhérentes, car dans une culture en suspension, il n’y a pas de distance constante entre l’applicateur et chaque cellule. Une limitation de ce protocole est la nécessité d’une ultracentrifugeuse. Cependant, cette méthode permet d’éviter l’achat de kits d’isolement d’exosomes.
Dans l’ensemble, ce protocole fournit une méthode standardisée pour étudier le rôle de la libération de vésicules extracellulaires lors de la thérapie par ondes de choc et pourrait donc être un outil crucial pour la compréhension des effets moléculaires du SW.
Déclarations de divulgation
JH et MG sont actionnaires de Heart Regeneration Technologies GmbH, une spin-off de l’Université de médecine d’Innsbruck visant à promouvoir la thérapie par ondes de choc cardiaques (www.heart-regeneration.com). Tous les autres auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été soutenue par une subvention de recherche AUVA sans restriction à JH et CGT.
matériels
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
Références
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076(2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon