Method Article
in vitro衝撃波療法後のエクソソーム単離
要約
エクソソームは、衝撃波をin vitroで適用すると放出されます。ここでは、培養した内皮細胞に衝撃波を印加し、その後、さらなる研究のためにエクソソームを単離する方法について説明します。
要約
衝撃波療法は、外側上顆炎(テニス肘)やアキレス腱炎(踵骨棘)などの腱障害や、治癒しない創傷や骨などの整形外科の適応症に日常的に適用されています。異なる病状にもかかわらず、衝撃波療法の血管新生効果と抗炎症効果の組み合わせは、軟部組織および骨の再生をもたらす。30年以上の臨床応用において、副作用は観察されませんでした。さらに、基礎研究では、虚血性心筋に対する再生効果まで明らかになりました。
以前の研究では、培養細胞の機械的刺激がエキソソーム放出を介して生物学的応答に翻訳されることを示すことができました。しかし、その正確なメカニズムはまだ解明されていません。衝撃波治療を適用する際には、小さな気泡でも衝撃波を吸収できるため、メカニカルカップリングが重要です。前述のウォーターバス法は、in vitroでの適切で再現性のある衝撃波の適用を保証する有効な方法です。
私たちは、衝撃波適用後に培養細胞からエクソソームを単離するための実行可能で再現可能なプロトコルを開発することができました。これにより、メカノトランスダクションの根底にあるメカニズムと、衝撃波放出エクソソームの再生および血管新生の可能性を研究する可能性を示します。
概要
衝撃波(SW)は、短時間に大量のエネルギーが放出されるときに自然界に現れる音圧波です(例:雷と稲妻)。臨床ルーチンでは、衝撃波は砕石術で腎臓結石を崩壊させるために使用され、30年以上にわたって関連する副作用はありません1,2。偶然にも、腎臓結石崩壊後のX線で腸骨の肥厚が観察されました。この観察結果は、骨治癒障害の研究の基礎を提供し、長骨非癒合3,4,5の治療につながりました。
衝撃波療法の適応は拡大され、今日では、外側上顆炎(テニス肘)やアキレス腱炎(踵骨棘)などの腱鞘障害を含む整形外科の適応症で日常的に臨床使用されています6,7。さらに、基礎研究では、衝撃波療法(SWT)の高い血管新生能が示されました。その中で、SWTと血管新生8により、VEGF(血管内皮増殖因子)、PIGPF(胎盤成長因子)、FGF(血管内皮増殖因子)などの血管新生成長因子が増加することが示されました。
衝撃波誘発性血管新生が他の病態に有益な役割を果たす可能性を調査するために、虚血性心疾患の動物モデルにSW療法を適用しました9,10。虚血性心筋の再生効果が実証された後、自然免疫受容体TLR3(Toll like Receptor 3)が衝撃波治療に不可欠な役割を果たすことを明らかにした11,12。さらなる研究により、SW療法の機械的刺激は、エクソソーム放出を介して生物学的シグナルに変換されることが示されました。内皮細胞から生理学的に放出されるエクソソームと比較して、SWT時に放出されるエクソソームは、血管新生マイクロRNAのカーゴを増加させます。虚血性心筋に注射すると、SWTはエクソソームを放出して再生を誘導しました13。
空気はSWを吸収するため、アプリケーターと細胞培養フラスコとの完全な結合が重要です。標準化されたウォーターバスは、in vitroでSWTを適用するための実行可能な方法と、再現性のある実験セットアップを表しています。波の反射とそれに伴う干渉を避けるために、くさび形の吸収体は、ウォーターバスの後ろに走る一次波を破壊します。このため、記載されているウォーターバスのみを使用してin vitroで衝撃波を適用することをお勧めします。
このプロトコルでは、血管新生エキソソームを上清に放出するためのin vitroでの衝撃波の適用について説明します。このプロトコールは、メカノトランスダクションにおけるエキソソームの役割を調査する可能性を提供し、SWTによるエキソソーム放出のさらなる研究の基礎となります。
プロトコル
ヒト臍帯静脈内皮細胞は、婦人科の帝王切開から採取した。したがって、患者の書面によるインフォームドコンセントが得られました。インスブルック医科大学の倫理委員会から許可が与えられました(いいえ。UN4435)。
注:汚染を避けるために、滅菌された層流フードの下で作業してください。
1. 実験の24時間前
- ウシ胎児血清(FCS)を4°Cおよび120,000 x g で一晩超遠心分離することにより、エキソソーム遊離内皮増殖培地を調製します。
- 75 cm²の細胞培養フラスコに10%ゼラチンを使用してコーティングします。
- 内皮増殖培地を用いて、細胞培養フラスコにヒト内皮細胞を播種します。
実験日:
注:4 LのddH2O、エキソソーム遊離FCS、内皮細胞増殖基礎培地、PBSを37°Cに予温します。
2.衝撃波治療アプリケーションを準備します
- 市販のキット(Bullet Kitなど)のサプリメントを添加し、一般的なFCSの代わりに超遠心分離したエクソソーム遊離FCSを内皮増殖培地に添加することにより、エキソソーム遊離内皮増殖培地を調製します。
- 約3.5Lの37°C予温ddH2Oを水浴に充填します。
- SWアプリケーターをウォーターバスに接続します。
- SWデバイスでの処理パラメータ(エネルギー磁束密度、インパルス周波数)を定義します。エネルギー磁束密度0.07 mJ/mm²、周波数5 Hzで500インパルスを推奨します。
3.衝撃波アプリケーション
- 細胞の生存率を形態学的外観と内皮細胞の密度で顕微鏡で100倍に拡大して調査します。エクソソームの量を増やすためにのみ、高コンフルエンスを持つフラスコを使用してください。
- 内皮細胞培地を約250 mLのPBSと慎重に交換して、フラスコを完全に満たし、すべての残留空気を抑制します。
- パラフィルムまたは気密キャップを使用してフラスコを密封します。
- 細胞培養フラスコをウォーターバス内の垂直位置に保持し、細胞で覆われた側をSWデバイスの反対側に置きます。フラスコからアプリケーターまでの距離が、指定されたマーキングと一致していることを確認してください。Orthowave 180cデバイスの場合は、10cmからの距離を使用します。
- 細胞培養フラスコの下半分にSW療法の250インパルスを利用します。
- フラスコを180°回し、細胞培養フラスコの上半分に250インパルスを利用します。
- その後、フラスコシーリングを取り外し、PBSをエキソソームフリーFCSを含む15mLの内皮増殖培地と交換します。
- 治療した細胞をエキソソーム遊離培地で、実験セットアップに適切な時間培養します。最も多くのエキソソームは、SW療法の4時間後に収集できます(図1)。
注:偽手術群では、被験者の細胞培養フラスコを同じ治療(上記のセクションを参照)に使用し、SW療法を利用しません。
4. エクソソームの単離
- 上清を収集チューブに移し、4°Cおよび300 x g で10分間遠心分離します。この手順では、上清内のすべてのセルが除去されます。
- 細胞破片を除去するには、上清を新しいチューブに移し、4°Cおよび3,000 x g で20分間遠心分離します。
- 上清を200 nmフィルターで遠心チューブに濾し、アポトーシス体を除去します。
- ろ過した上清を4°Cで120,000 x g で70分間遠心分離します。上清を捨て、エキソソームペレットを300μLのPBSで再懸濁します。
- 超遠心分離後はエキソソームペレットが見えないため、超遠心チューブを30秒間ボルテックスして、エキソソームペレットが再懸濁していることを確認します。実験のニーズに合わせてPBSの量を調整し、さらに実験を行います。
- 再懸濁したエキソソームは-80°Cで保存してください。
注:プロトコールは、上清をコレクションチューブに移した後、または超遠心分離の前に上清を-80°Cで凍結することにより一時停止することができます。
5. 落とし穴
- SWアプリケーターがウォーターバスにしっかりと接続されていることを確認してください。接続が不完全な場合、ウォーターバスが漏れる可能性があります。
- フラスコからアプリケーターまでの距離が正確であることを確認して、異なるフラスコに同じ量のエネルギーフラックス密度を利用します。
- SW療法を受けた細胞培養フラスコと、コントロールサンプルであった細胞培養フラスコに印を付けます。
- 汚染を避けるために、フラスコをインキュベーターに戻す前にフラスコを乾かしてください。
結果
記載されたプロトコルを使用して、ヒト内皮細胞(HUVEC)およびヒト冠状動脈内皮細胞(CAEC;PromoCell)から衝撃波療法(オルソウェーブ180cなど)まで使用できます。放出されたベシクルは、ナノトラッキング分析(NTA)によって定量されました。これにより、SW療法時の微小胞放出の増加が観察されました(図1A、B)。透過型電子顕微鏡によるHUVECの放出小胞のイメージングにより、エクソソームの特徴的な100 nmサイズ(図1C)と、典型的に説明されるカップ形状(図1D)が明らかになりました。フローサイトメーターの分析により、エキソソームタンパク質マーカーCD9、CD81、CD63の存在が明らかになったため、HUVECが放出した微小胞がエキソソームであることは間違いありません(図1 E-G)。
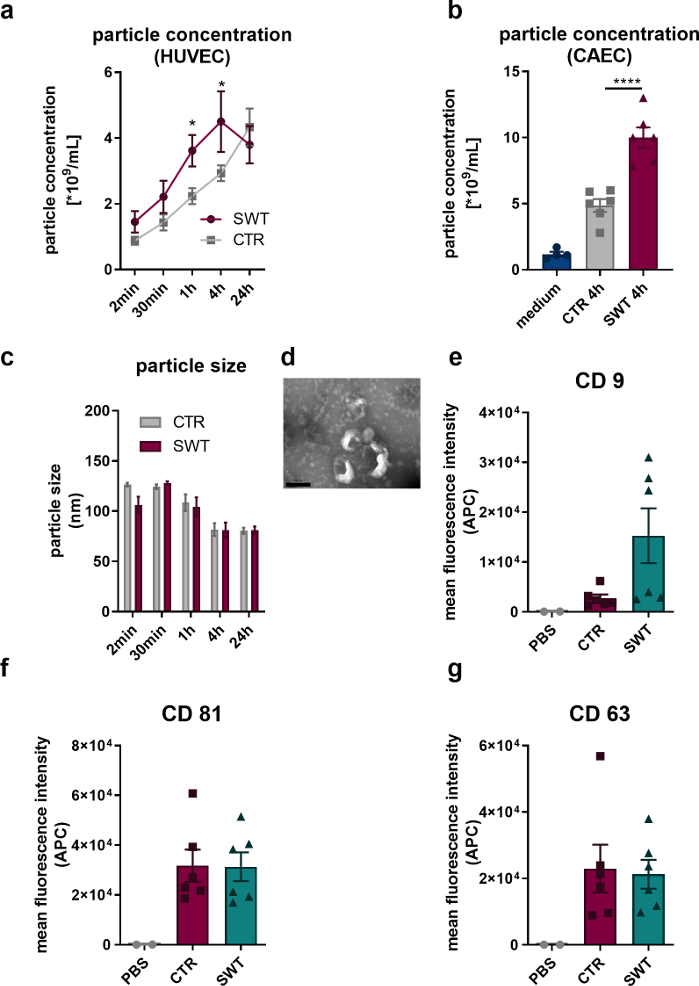
図1:in vitroでの衝撃波治療によるエクソソーム放出。 (A)放出されたHUVECは、SW療法後の経時的にNTAを介して定量されました。データはSEM±*P<0.05。n=3–6 です。(B)SW療法の4時間後にCAECの上清に微小胞のレベルの増加が見られた。データは SEM ±平均で表されます。 ****P < 0.0001。n=4–6 です。(C-D)NTAは典型的なサイズを明らかにし、透過型電子顕微鏡は典型的なエクソソーム形状を明らかにしました。n=3–5 です。スケールバー = 200 nm。(E-G)放出されたマイクロベシクルは、エクソソームマーカーCD9、CD63およびCD81を発現します。データは平均±SEMで表されます。 n=6。2つのグループ間の統計的比較:スチューデントのt検定、複数のグループ:テューキーの事後分析による一元配置ANOVA。Gollmann-Tepeköylü et al.13から変更。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
複数の基礎研究において、衝撃波療法の再生効果が実証され、整形外科の適応症3,4,5に日常的に適用されています。多様な動物モデルにおいて、虚血性心筋に対する再生効果が実証され、CAST-HF試験の開始につながる可能性がある9,10。このランダム化比較試験は、冠状動脈バイパス手術中に追加的に適用される直接心電波療法の利点を評価することを目的としています14。衝撃波治療におけるエクソソームの不可欠な役割は、以前の研究13で実証できた。しかし、エクソソーム放出の正確なメカニズムや放出されたエクソソームの正確な貨物は不明のままです。放出されたエクソソームの放出と再生効果を研究するために、衝撃波療法でエクソソームを取得するための実行可能で標準化されたプロトコルを確立しました。
私たちの知る限り、これは衝撃波療法でエクソソームを単離する方法を説明する最初のプロトコルです。プロトコルが適切なSWアプリケーションを保証するためには、水浴が必然的に必要であり、それは空気吸収15 を避けるからである。これにより、このプロトコルで単離されたすべてのエキソソームは、同量のエネルギーフラックス密度で処理された内皮細胞から生じる。
私たちは内皮細胞からエクソソームを作製した経験しかないため、他の細胞株を用いた実験には正確な実験セットアップを推奨することはできません。しかし、SW療法におけるエクソソームを介したメカノトランスダクションは、他の細胞種でも重要な役割を果たしていると確信しています。いずれにせよ、さらなる調査がこの理論を証明しなければならない。内皮細胞以外の細胞株を扱う場合は、パイロットトレイルをお勧めします。内皮細胞を扱う中で、細胞を播種する前にフラスコを慎重にコーティングする必要があることがわかりました。そうしないと、SW療法で細胞が剥離します。これは他の細胞株にも当てはまると考えています。
さらに、アプリケーターとウォーターバス間の正確な接続、およびアプリケーターから細胞培養フラスコまでの正確な距離を知ることは、同等の結果を得るために重要です。アプリケーター内部にあるソース(電気油圧システムの電極チップなど)は、さまざまなSWアプリケーターで異なる位置に配置されているため、アプリケーターと細胞培養フラスコの間の距離はSWデバイスによって異なることに注意してください。さらに、懸濁培養ではアプリケーターと各細胞との間に一定の距離がないため、接着細胞のみを使用することをお勧めします。このプロトコルの制限は、超遠心分離機の必要性です。ただし、この方法では、エキソソーム単離キットの購入を回避できます。
全体として、このプロトコルは、衝撃波治療における細胞外小胞放出の役割を研究するための標準化された方法を提供するため、分子SW効果を理解するための重要なツールになる可能性があります。
開示事項
JHとMGは、インスブルック医科大学のスピンオフ企業であるHeart Regeneration Technologies GmbHの株主であり、心臓衝撃波治療(www.heart-regeneration.com)の推進を目的としています。他のすべての著者は、開示するものは何もありません。
謝辞
この研究は、JHおよびCGTへの無制限のAUVA研究助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Cell culture flasks | Cellstar | 658170 | 75 cm2 |
| Collection tubes – Falcon Tube | Corning | 352070 | |
| Endothelial Cell Growth Medium-2 BulletKit | Lonza | CC-3162 | |
| Endothelial Cell Growth Basal Medium | Lonza | CC-3121 | |
| Fetal bovine serum | Sigma | F0804 | |
| Parafilm | Pechiney | PM996 | |
| Phosphat buffered saline | gibco | 14190-904 | |
| Shockwave applicator | MTS | Orthowave 180c |
参考文献
- Pearle, M. S., et al. Shock-wave lithotripsy for renal calculi. The New England Journal of Medicine. 367 (1), 50-57 (2012).
- Chaussy, C., Brendel, W., Schmiedt, E. Extracorporeally Induced Destruction of Kidney Stones By Shock Waves. Lancet. 316 (8207), 1265-1268 (1980).
- Valchanou, V. D., Michailov, P. High energy shock waves in the treatment of delayed and nonunion of fractures. International Orthopedics. 15 (3), 181-184 (1991).
- Haupt, G., Haupt, A., Ekkernkamp, A., Gerety, B., Chvapil, M. Influence of shock waves on fracture healing. Urology. 39 (6), 529-532 (1992).
- Moretti, B., et al. Bone healing induced by ESWT. Clinical Cases in Mineral and Bone Metabolism. 6 (2), 155-158 (2009).
- Romeo, P., Lavanga, V., Pagani, D., Sansone, V. Extracorporeal shock wave therapy in musculoskeletal disorders: A review. Medical Principles and Practice. 23 (1), 7-13 (2014).
- Schaden, W., et al. Shock Wave Therapy for Acute and Chronic Soft Tissue Wounds: A Feasibility Study. Journal of Surgical Research. 143 (1), 1-12 (2007).
- Holfeld, J., et al. Low energy shock wave therapy induces angiogenesis in acute hind-limb ischemia via VEGF receptor 2 phosphorylation. PLoS One. 9 (8), 1-7 (2014).
- Zimpfer, D., et al. Direct epicardial shock wave therapy improves ventricular function and induces angiogenesis in ischemic heart failure. Journal of Thoracic and Cardiovascular Surgery. 137 (4), 963-970 (2009).
- Holfeld, J., et al. Epicardial shock-wave therapy improves ventricular function in a porcine model of ischemic heart disease. Journal of Tissue Engineering and Regenerative Medicine. 10, 1057-1064 (2016).
- Holfeld, J., et al. Toll-like receptor 3 signaling mediates angiogenic response upon shock wave treatment of ischemic muscle. Cardiovascular Research. 109 (2), 331-343 (2016).
- Tepeköylü, C., et al. Shockwaves prevent from heart failure after acute myocardial ischemia via RNA/protein complexes. Journal of Cellular and Molecular Medicine. 21 (4), 791-801 (2017).
- Gollmann-Tepeköylü, C., et al. miR-19a-3p containing exosomes improve function of ischemic myocardium upon shock wave therapy. Cardiovascular Research. , (2019).
- Pölzl, L., et al. Safety and efficacy of direct Cardiac Shockwave Therapy in patients with ischemic cardiomyopathy undergoing coronary artery bypass grafting (the CAST-HF trial), Study protocol for a randomized controlled trial. Trials. 21 (1), 1-10 (2020).
- Holfeld, J., et al. Shock wave application to cell cultures. Journal of Visualized Experiments. (86), e51076 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved