Method Article
Costruzione di un modello di xenotrapianto di adenocarcinoma polmonare nei topi e valutazione dell'efficienza del decotto XY attraverso la via MAPK
In questo articolo
Riepilogo
Questo studio dimostra che il decotto XY esercita effetti terapeutici contro l'adenocarcinoma polmonare regolando la via MAPK.
Abstract
L'adenocarcinoma polmonare è in aumento in tutto il mondo, spingendo l'esplorazione e lo sviluppo di metodi di trattamento efficaci. Negli ultimi anni è stato sempre più riconosciuto il potenziale terapeutico della medicina tradizionale cinese per l'adenocarcinoma polmonare, come il decotto XiaoYi (XY). Il meccanismo d'azione della medicina tradizionale cinese nel trattamento dell'adenocarcinoma polmonare continua ad essere chiarito. In questo studio, sono stati utilizzati modelli animali per studiare gli effetti terapeutici del decotto XY nel trattamento dell'adenocarcinoma polmonare. I componenti chimici del decotto XY nei topi sono stati separati e analizzati in modalità ionica positiva e negativa utilizzando UHPLC-QE-MS. I risultati sono stati poi convalidati attraverso esperimenti in vivo , che hanno dimostrato una riduzione delle dimensioni del tumore, un miglioramento dei cambiamenti patologici e un aumento dell'apoptosi. Di conseguenza, sono stati identificati quindici componenti assorbiti nel sangue dopo la somministrazione di decotto XY: stachiosio, quercetina-3-O-beta-glucopiranosil-7-O-alfa-ramnopiranoside; Imperialino; Spinosina B; Peimine; Flavone base + 3O, 2MeO, O-Hex; Picropodofillotossina; (2S,3R,4S,5S,6R)-2-[(2R,3R,4S,5S,6R)-4,5-diidrossi-2 [[(3S,5R,8R,10R,12R,13R,14R,17S)-12-idrossi-17-(2-idrossi-6-metilepto-5-en-2-il) 4,4,8,10,14-pentametil-2,3,5,6,7,9,11,12,13,15,16,17-dodecaidro-1H ciclopenta[a]fenantre-3-il]ossi]-6-(idrossimetil)ossano-3-il]ossi-6-(idrossimetil)ossano-3,4,5-triolo; Tricin; Ginsenoside Rg1; (20R)-ginsenosidio Rh1; Giujuboside B; Aucubina; Ginsenoside Rg3; e acido beta-elemonico. Esperimenti sugli animali hanno dimostrato che il decotto XY inibiva la crescita tumorale, migliorava i cambiamenti patologici e promuoveva l'apoptosi delle cellule tumorali in modo dose-dipendente. I meccanismi coinvolti possono essere correlati all'upregolazione dell'espressione delle proteine p-JNK e p-P38 nella via MAPK e alla sottoregolazione dell'espressione della proteina p-ERK nella via MAPK. In conclusione, il decotto XY ha il potenziale per regolare la via MAPK ed esercitare effetti terapeutici contro l'adenocarcinoma polmonare.
Introduzione
L'incidenza del cancro ai polmoni è in aumento in tutto il mondo. Rappresenta il 18% di tutti i tumori maligni ed è responsabile di un numero significativo di decessi correlati al cancro 1,2. Il carcinoma polmonare non a piccole cellule (NSCLC) è una forma prevalente di cancro del polmone, con l'adenocarcinoma come principale tipo patologico3. A causa dei suoi sintomi insidiosi, il NSCLC viene spesso diagnosticato in uno stadio avanzato e ha un alto tasso di mortalità 4,5. I pazienti con NSCLC in stadio IV hanno un tasso di sopravvivenza a cinque anni di solo il 5%6, mentre anche il NSCLC in stadio iniziale resecabile chirurgicamente ha un tasso di sopravvivenza a cinque anni di appena il 50%7.
Attualmente, il trattamento dell'adenocarcinoma polmonare comprende chirurgia, radioterapia, chemioterapia, immunoterapia e terapia mirata. Inoltre, la medicina tradizionale cinese (MTC) per l'adenocarcinoma polmonare è sempre più riconosciuta e apprezzata8. La MTC ha una lunga storia ed è stata utilizzata nel trattamento di varie malattie oncologiche con risultati terapeutici efficaci 9,10. Considera il corpo umano come un'entità intera, con il principio terapeutico incentrato sul ripristino del movimento del Qi (Qi si riferisce all'energia vitale che promuove la circolazione del sangue e dei fluidi corporei, contribuendo a migliorare l'immunità e ridurre l'infiammazione nei pazienti con NSCLC) negli organi interni per ripristinare l'equilibrio generale e inibire la progressione del cancro.
La MTC non solo tratta le malattie oncologiche con bassa tossicità, bersagli multipli e alta efficienza11, ma facilita anche la riparazione dei danni causati dalla radioterapia e dalla chemioterapia, prolungando così la sopravvivenza12.
La tecnologia della cromatografia liquida-spettrometria di massa (LC-MS) integra la cromatografia liquida con la spettrometria di massa per ottenere la separazione e la rilevazione di componenti in miscele di composti complessi13. LC-MS offre un'alta risoluzione, un'elevata sensibilità e un'elevata specificità, consentendo la separazione e l'identificazione di vari componenti chimici nei decotti della medicina tradizionale cinese (MTC). Se combinata con la chimica farmaceutica del siero, che separa e rileva i componenti attivi che entrano nel sangue dopo somministrazione orale14,15, la LC-MS consente la previsione e l'analisi dei potenziali meccanismi d'azione dei farmaci. Questo approccio aiuta a comprendere la composizione chimica e i componenti farmacologici dei decotti MTC, fornendo dati essenziali per una ricerca approfondita sui loro effetti farmacologici e sulle applicazioni cliniche, rendendolo altamente applicabile nella ricerca sulla MTC16,17.
La via di segnalazione MAPK svolge un ruolo cruciale nella genesi, progressione, metastasi e invasione del cancro del polmone, con Erk, p38 e JNK come importanti sottofamiglie. È stato dimostrato che i decotti MTC influenzano l'espressione delle proteine nella via MAPK18. Il decotto XiaoYi (XY) è derivato dal decotto YiGuan ed è usato per trattare l'adenocarcinoma polmonare presso il Primo Ospedale Affiliato dell'Università di Medicina Cinese di Changchun (Figura 1), dimostrando una precisa efficacia clinica. Tuttavia, il suo meccanismo terapeutico rimane poco chiaro.
In questo studio, la cromatografia liquida ad altissime prestazioni abbinata alla spettrometria di massa Q-Exactive Orbitrap (UHPLC-QE-MS) è stata impiegata per chiarire il possibile meccanismo terapeutico del decotto XY contro l'adenocarcinoma polmonare e i suoi effetti sono stati convalidati attraverso studi in vivo .
Protocollo
Tutte le procedure sugli animali sono state approvate dal Comitato Etico Animale dell'Università di Medicina Tradizionale Cinese di Changchun (Etica n. 2024008). Topi maschi C57BL/6 di sei settimane (20 ± 2 g), allevati in condizioni specifiche prive di agenti patogeni (SPF), hanno mostrato modelli tipici di attività fisica in un ambiente controllato con temperatura e umidità costanti. Avevano accesso ad libitum a cibo e acqua e sono stati mantenuti sotto un ciclo luce/buio di 12 ore. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono forniti nella Tabella dei materiali.
1. Preparazione dell'estratto acquoso di decotto XY
- Mettere il Panax ginseng C.A. Mey (Renshen, 15 g), il Chinemys reevesii (Gray) (Guiban, 30 g) e il Trionyx sinensis Wiegmann (Biejia, 30 g) in un vaso per decotto. Aggiungere 1000 ml di acqua deionizzata e immergere per 30 minuti a temperatura ambiente.
- Lessare le tre erbe aromatiche del passaggio 1.1 per 1 ora. Contemporaneamente, immergere Rehmannia glutinosa Libosch (Dihuang, 30 g), Trichosanthes kirilowii Maxim. (Tianhuafen, 30 g), Coix lacryma-jobi L. var. mayuen (Romano.) Stapf (Yiyiren, 20 g), Paeonia lactiflora Pall. (Baishao, 30 g), Boswellia carterii Birdw. (Ruxiang, 7 g), Commiphora myrrha Engl. (Moyao, 7 g), Agrimonia pilosa Ledeb. (Xianhecao, 20 g), Alpinia oxyphylla Miq. (Yizhiren, 20 g), Ziziphus jujuba Mill. spinosa (Bunge) (Suanzaoren, 30 g), Melia toosendan Sieb. et Zucc. (Chuanlianzi, 5 g), Fritillaria thunbergii Miq. (Zhebeimu, 15 g), Anemarrhena asphodeloides Bge. (Zhimu, 10 g), Platycodon grandiflorum (Jacq.) (Jiegeng, 10 g), Polygala tenuifolia Willd. (Yuanzhi, 15 g), e Phragmites communis Trin. (Lugen, 30 g) in un altro contenitore per 30 min. Dopo l'ammollo, trasferiteli nella pentola del decotto dal passaggio 1.1.
- Lessare tutte le 18 erbe aromatiche dei passaggi 1.1 e 1.2 per 30 minuti. Versare il liquido a base di erbe, aggiungere 1000 ml di acqua deionizzata e far bollire per altri 30 minuti. Ripeti questo processo di ebollizione tre volte per ottenere tre porzioni di liquido a base di erbe, quindi uniscile e mescolale accuratamente.
- Filtrare il liquido a base di erbe miscelato attraverso un panno da 400 maglie. Concentrare il filtrato a pressione ridotta, quindi trasferire il liquido concentrato a base di erbe nell'apparecchiatura di raffreddamento per un'ulteriore lavorazione.
- Versare il liquido concentrato a base di erbe in una vaschetta di liofilizzazione e posizionarlo nella camera di pre-congelamento di un liofilizzatore sottovuoto. Una volta completata la pre-congelamento, trasferire il vassoio nella camera di essiccazione a sublimazione per rimuovere l'acqua.
- Rimuovere l'umidità residua ad alta temperatura. Polverizzare l'estratto di erbe liofilizzato utilizzando un polverizzatore per ottenere una polvere di decotto XY finemente liofilizzata (Figura 2).
2. Preparazione del siero contenente farmaci
- Assegnare in modo casuale topi maschi C57BL/6 di sei settimane (20 ± 2 g) al gruppo XiaoYi (XY) o al gruppo di controllo.
NOTA: La dose per topi è stata calcolata utilizzando il fattore di conversione da uomo a topo:
Dose sperimentale equivalente per topi (g/kg) = {Dose umana (g/kg) / Peso corporeo (70 kg)} x 9,1
Sulla base di questo calcolo, il dosaggio per i topi è stato determinato in 2,6 g/kg. - Pesare 0,9152 g di decotto XY liofilizzato in polvere e scioglierlo in 3,2 ml di acqua distillata per preparare la soluzione farmacologica.
NOTA: I topi sono stati digiunati per 12 ore prima della somministrazione orale. - Somministrare il decotto XY ai topi del gruppo XY tramite sonda gastrica, somministrando al gruppo di controllo un volume equivalente di acqua deionizzata.
- 2 ore dopo la somministrazione orale, anestetizzare i topi con pentobarbital sodico (seguendo protocolli istituzionalmente approvati). Enucleare i bulbi oculari usando una pinzetta per raccogliere campioni di sangue, quindi sopprimere i topi tramite asfissia da CO2 seguita da lussazione cervicale seguendo le linee guida etiche19.
- Lasciare stabilizzare i campioni di sangue a temperatura ambiente per 90 minuti. Centrifugare a 3450 x g (4 °C) per 15 minuti per raccogliere il surnatante.
3. Analisi UHPLC-QE-MS
- Aggiungere 100 mg di polvere liofilizzata per decotto XY a 500 μL di soluzione di estrazione (metanolo: acqua = 4:1). Mescolare accuratamente, sonicare e incubare in un bagno di acqua ghiacciata per 1 ora.
- Mantenere la miscela a -40 °C per 1 ora, quindi centrifugare a 13.800 x g (4 °C) per 15 minuti. Filtrare il surnatante attraverso una membrana filtrante da 0,22 μm, quindi combinare 100 μl di ciascun surnatante per creare campioni di controllo qualità (QC).
- Dopo aver scongelato i campioni di plasma, prelevare 400 μl del campione di plasma del gruppo di controllo e 400 μl dei campioni di plasma del gruppo XY. Aggiungere 40 μl di acido cloridrico (2 mol/L) a ciascun campione. Agitare per 1 minuto e lasciare riposare il composto a 4 °C per 15 minuti. Ripeti questo passaggio quattro volte.
- Aggiungere 1,6 mL di acetonitrile e agitare per 5 minuti. Centrifugare a 13.800 x g per 5 min a 4 °C. Sottoporre 1.800 μl del surnatante all'essiccazione con azoto.
- Ricostituire i campioni essiccati in 150 μL di metanolo all'80% contenente 10 μg/mL dello standard interno mediante vortice per 5 minuti. Centrifugare a 13.800 × g per 5 minuti a 4 °C, quindi trasferire 120 μl di surnatante in una fiala di vetro fresca per l'analisi LC-MS (Figura 3).
4. Colture cellulari e preparazione animale
- Seminare 1 mL di cellule di carcinoma polmonare di Lewis in un piatto di coltura contenente il Modified Eagle Medium (DMEM) di Dulbecco integrato con il 10% di siero fetale bovino e l'1% di penicillina/streptomicina. Incubare le cellule in condizioni controllate a 37 °C con CO2 al 5%.
- Quando le cellule raggiungono l'80% di confluenza, farle passare utilizzando lo 0,25% di tripsina. Continuare a passare fino a quando lo stato cellulare non si stabilizza, quindi regolare la concentrazione cellulare a 3 x 106 cellule/mL.
- Iniettare 0,1 mL della sospensione cellulare preparata per via sottocutanea nell'ascella destra di topi maschi C57BL/6 per stabilire il modello di adenocarcinoma polmonare.
NOTA: Il tessuto tumorale può essere palpato nell'ascella dei topi 5 giorni dopo l'inoculazione. - Dopo 5 giorni, dividere casualmente i topi in cinque gruppi (n = 6 per gruppo): Gruppo modello (M) - Nessun trattamento; decotto XY gruppo a basso dosaggio (XY-L) - 1,3 g/kg; decotto XY gruppo a dose media (XY-Z) - 2,6 g/kg; decotto XY gruppo ad alto dosaggio (XY-H) - 5,2 g/kg; Gruppo cisplatino (DDP) - Trattato con cisplatino20.
- Sciogliere il decotto di polvere XY in 200 μL di acqua distillata alla dose corrispondente e somministrarlo tramite gavage. I gruppi M e DDP ricevono un volume uguale di acqua distillata tramite gavage.
- Somministrare cisplatino al gruppo DDP tramite iniezione intraperitoneale (3 mg/kg) una volta ogni 3 giorni. Iniettare lo stesso volume di soluzione fisiologica negli altri gruppi.
5. Analisi patologica del tessuto tumorale
- Dopo 21 giorni, sopprimere tutti i topi utilizzando l'asfissia da CO2 seguita da lussazione cervicale (seguendo le linee guida etiche) e asportare il tessuto tumorale21. Misurare il volume e il peso del tumore (Figura 4).
- Fissare i tessuti tumorali asportati in paraformaldeide al 4% per 24 ore). Disidratare il tessuto utilizzando soluzioni di etanolo graduato.
- Eliminare i blocchi di tessuto disidratato utilizzando lo xilene, quindi incorporarli nella cera di paraffina fusa. Lascia che la cera si solidifichi in un blocco di paraffina. Sezionare il blocco di tessuto in fette spesse 5 μm utilizzando un microtomo.
- Decerare le sezioni di tessuto in xilene, quindi reidratare in soluzioni di etanolo graduate. Macchiare le sezioni con ematossilina per 5 minuti, quindi risciacquare con acqua deionizzata.
- Controcolorare le sezioni con una soluzione di eosina allo 0,5% per 1 minuto. Osservare le sezioni colorate al microscopio ottico e acquisire immagini per l'analisi.
6. Analisi immunoistochimica del tessuto tumorale
- Eseguire la deceratura e la reidratazione seguendo le procedure descritte nei passaggi 5.2-5.4.
- Incubare le sezioni in un bloccante endogeno della perossidasi a temperatura ambiente per 15 minuti. Bloccare il legame non specifico incubando le sezioni con siero di capra.
- Applicare gli anticorpi primari: Ki-67 (1:600) e Caspasi-3 (1:100). Incubare le sezioni per una notte a 4 °C. Lavare con tampone PBS), quindi applicare un anticorpo secondario per uso generico (1:500) e incubare a 37 °C per 30 minuti.
- Sviluppa la reazione cromatica aggiungendo la soluzione DAB. Controcolorare le sezioni con una soluzione di ematossilina.
- Eseguire la disidratazione, la pulizia e la sigillatura delle sezioni macchiate. Osserva l'espressione proteica al microscopio ottico e acquisisci immagini per l'analisi.
7. Analisi del Western blot
- Omogeneizzare i tessuti tumorali utilizzando un lizzatore tissutale. Estrarre la proteina totale e determinarne la concentrazione utilizzando un kit per il dosaggio dell'acido bicinconninico (BCA) (vedere la Tabella dei materiali).
- Eseguire la quantificazione delle proteine, seguita dall'elettroforesi SDS-PAGE e dal trasferimento delle proteine su una membrana.
- Incubare la membrana per una notte a 4 °C con gli anticorpi primari: P38 (1:2000), p-P38 (1:1000), ERK (1:20000), p-ERK (1:500), JNK (1:2000), p-JNK (1:5000), β-actina (1:200) (vedi Tabella dei materiali).
- Il giorno successivo, incubare la membrana con un anticorpo secondario coniugato con perossidasi di rafano (HRP) a temperatura ambiente per 1,5 ore. Rileva le bande proteiche utilizzando un sistema di chemiluminescenza potenziata (ECL).
NOTA: Le intensità delle bande proteiche sono state quantificate utilizzando il software ImageJ.
Risultati
I campioni di polvere XY e siero del gruppo di controllo e del gruppo XY sono stati analizzati utilizzando UHPLC-QE-MS, rivelando picchi ben separati. I diagrammi di ionizzazione totale per le modalità di ioni positivi e negativi sono mostrati nella Figura 3. La composizione del decotto XY è stata identificata in base al tempo di ritenzione, alla modalità di acquisizione e ai frammenti dello spettro di massa. Quindici componenti per l'ingresso nel sangue sono stati identificati confrontando il siero dei gruppi di somministrazione orale di decotto bianco e XY con i componenti della soluzione di polvere XY (Tabella 1).
Il grafico a linee del volume del tumore indica che dopo 21 giorni di sonda gastrica con decotto XY, il volume del tumore nei topi è diminuito rispetto al gruppo M e ha mostrato un effetto dose-dipendente (Figura 4). L'istopatologia tumorale è stata osservata utilizzando la colorazione H&E (Figura 5). Nel gruppo M, le cellule tumorali erano densamente disposte e mostravano una proliferazione attiva, con abbondante mitosi patologica. All'aumentare della dose di decotto XY, la disposizione delle cellule tumorali è diventata gradualmente rada e lo spazio intercellulare è aumentato. Vari gradi di necrosi sono stati osservati nei tessuti tumorali e la mitosi patologica era rara21.
Per verificare gli effetti del decotto XY sulla proliferazione e l'apoptosi dei tessuti tumorali nei topi, sono stati condotti esperimenti di immunoistochimica (IHC). Dopo la colorazione con anticorpi Ki-67 e Caspasi 3, sono state osservate particelle giallo-brunastre sparse nelle sezioni di tessuto tumorale. Rispetto al gruppo M, i livelli di Ki-67 nei tessuti tumorali dei gruppi XY e DDP sono diminuiti in sequenza, mentre i livelli di caspasi 3 sono aumentati (Figura 6).
Per determinare se il decotto XY esercita effetti terapeutici sull'adenocarcinoma polmonare attraverso la via MAPK, è stata eseguita l'analisi Western blot su tessuti tumorali di topi. Come mostrato nella Figura 7, il trattamento con decotto XY ha portato a una diminuzione dell'espressione di p-ERK, con il gruppo XY-H che ha mostrato una differenza significativa rispetto al gruppo M (p < 0,001). I livelli di p-JNK e p-P38 sono aumentati nel gruppo XY-H rispetto al gruppo M, con differenze statisticamente significative osservate nel gruppo XY-H (p < 0,01) e nel gruppo DDP (p < 0,05) rispetto al gruppo M. Inoltre, la differenza tra i gruppi DDP e XY-H era statisticamente significativa.

Figura 1: Componenti del decotto XY. Questa figura presenta i singoli farmaci contenuti nel decotto XY. Clicca qui per visualizzare una versione più grande di questa figura.
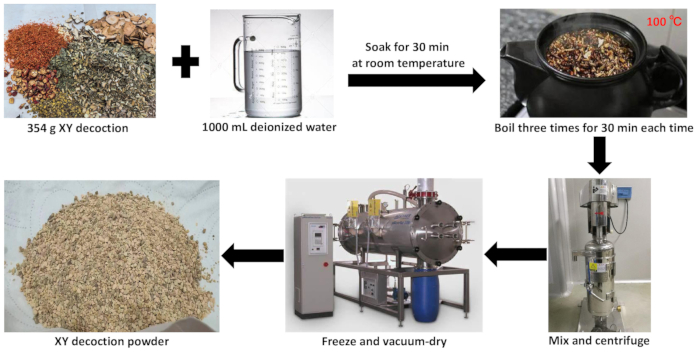
Figura 2: Preparazione dell'estratto acquoso di decotto XY. Questa figura illustra il processo di preparazione dell'estratto acquoso di decotto XY. Clicca qui per visualizzare una versione più grande di questa figura.
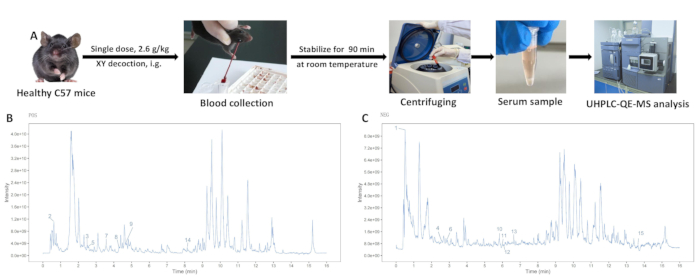
Figura 3: Analisi dell'estratto acquoso di decotto XY. (A) Il processo di estrazione del siero contenente farmaco. (B) Analisi di spettrometria di massa in modalità ioni positivi. (C) Analisi di spettrometria di massa in modalità ioni negativi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Effetti del decotto XY sul volume e sulla morfologia del tumore di topo. (A) Colture cellulari, impianto del tumore e procedure di campionamento. (B) Grafico a linee che rappresenta il volume del tumore nel tempo. (C) Morfologia del tumore dopo 21 giorni di trattamento con sonda gastrica. Clicca qui per visualizzare una versione più grande di questa figura.
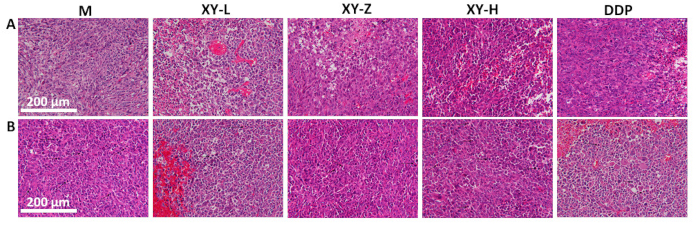
Figura 5: Analisi istologica dei tessuti tumorali di topo. (A) La disposizione del tessuto tumorale diventa più rada con l'aumentare delle dosi di decotto XY, con segni di necrosi in modo dose-dipendente. (B) Mitosi patologica nei tessuti tumorali, che mostra una diminuzione della mitosi patologica con l'aumentare delle dosi di decotto XY. Barre della scala: 200 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Livelli di espressione di Ki-67 e Caspasi-3. (A) Livelli di espressione del Ki-67. (B) Livelli di espressione della caspasi-3. Barre della scala: 400 μm. (C) Quantificazione delle aree Ki-67-positive, che mostrano una diminuzione con l'aumentare delle dosi di decotto XY. (D) Quantificazione delle aree Caspasi-3-positive, che mostrano un aumento con l'aumentare delle dosi di decotto XY. p < 0,001, ****p < 0,0001; ns, non significativo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Livelli di espressione proteica nella via MAPK. (A) Analisi Western blot dell'espressione proteica. (B) Livelli di espressione di ERK. (C) Livelli di espressione di p-ERK. (D) Livelli di espressione di JNK. (E) Livelli di espressione di p-JNK. (F) Livelli di espressione di P38. (G) Livelli di espressione di p-P38. Il decotto XY ha sovraregolato l'espressione delle proteine p-JNK e p-P38 mentre ha sottoregolato l'espressione di p-ERK. *p < 0,05, **p < 0,01, ***p < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.
| NO. | Composti identificati | Formula | m/z | RT (min) | Errore di massa (ppm) | Addotti | Fonte | ||
| 1 | Stachiosio | C24H42O21 | 665.21 | 0.49 | 1.2 | [M-H]- | Un | ||
| 2 | Quercetina-3-O-beta-glucopiranosil-7-O-alfa-ramnopiranoside | C4H9NO2 | 609.14 | 0.61 | 7.16 | [M+H]+ | A, C | ||
| 3 | Imperialino | C27H43NO3 | 430.33 | 2.5 | 0.13 | [M+H]+ | B | ||
| 4 | Spinosina B | C38H40O18 | 783.22 | 2.55 | 0.47 | [M-H]- | F | ||
| 5 | Peimine | C27H45NO3 | 432.35 | 2.62 | 1.19 | [M+H]+ | B | ||
| 6 | Flavone base + 3O, 2MeO, O-Hex | C23H24O12 | 491.12 | 2.86 | 0.27 | [M-H]- | G | ||
| 7 | Picropodofillotossina | C22H22Ø8 | 415.14 | 3.54 | 2.25 | [M+H]+ | B, E | ||
| 8 | (2S,3R,4S,5S,6R)-2-[(2R,3R,4S,5S,6R)-4,5-diidrossi-2-[[[(3S,5R,8R,10R,12R,13R,14R,17S)-12-idrossi-17-(2-idrossi-6-metilepto-5-en-2-il)-4,4,8,10,14-pentametil-2,3,5,6,7,9,11,12,13,15,16,17-dodecaidro-1H-ciclopenta[a]fenantre-3-il]ossi]-6-(idrossimetil)ossano-3-il]ossi-6-(idrossimetil)ossano-3,4,5-triolo | C42H72O13 | 785.5 | 4.26 | 8.49 | [M+H]+ | D | ||
| 9 | Tricina | C17H14O7 | 331.08 | 4.67 | 0.85 | [M+H]+ | G | ||
| 10 | Ginsenoside Rg1 | C42H72Ø14 | 845.49 | 5.83 | 2.16 | [M+FA]- | D | ||
| 11 | (20R)-Ginsenoside Rh1 | C36H62Ø9 | 683.44 | 5.98 | 1.35 | [M+FA]- | D | ||
| 12 | Jujuboside B | C52H84Ø21 | 1089.55 | 6.11 | 1.3 | [M+FA]- | F | ||
| 13 | Aucubina | C15H22O9 | 391.12 | 6.71 | 1.11 | [M+FA]- | Un | ||
| 14 | Ginsenoside Rg3 | C42H72O13 | 807.48 | 8.1 | 5.3 | [M+NA]+ | D | ||
| 15 | acido beta-elemonico | C30H46O3 | 453.34 | 13.74 | 0.42 | [M-H]- | E | ||
Tabella 1: Componenti assorbiti nel sangue dopo somministrazione di decotto XY. La tabella elenca i componenti attivi rilevati nel sangue dopo la somministrazione di decotto XY: A: Rehmannia glutinosa Libosch (Dihuang), B: Fritillaria thunbergii Miq. (Zhebeimu), C: Trichosanthes kirilowii Maxim. (Tianhuafen), D: Panax ginseng C.A. Mey (Renshen), E: Boswellia carterii Birdw. (Ruxiang), F: Ziziphus jujuba Mill. spinosa (Bunge) (Suanzaoren), G: Phragmites communis Trin. (Lugen).
Discussione
L'incidenza del cancro è in aumento ogni anno, attirando un notevole interesse clinico e di ricerca22,23. Recenti studi hanno dimostrato l'efficacia della medicina tradizionale cinese (MTC) nel trattamento del cancro del polmone 24,25,26. Ad esempio, è stato dimostrato che il decotto di Maimendong aumenta il numero e l'attività delle cellule NK, inibendo così le metastasi del cancro del polmone27. Allo stesso modo, il decotto di Mahuang Fuzi Xixin ha ottenuto effetti terapeutici sul cancro del polmone influenzando molteplici vie di segnalazione28. Questo studio utilizza l'analisi LC-MS e gli esperimenti in vivo per prevedere i possibili meccanismi attraverso i quali il decotto XY esercita effetti terapeutici sull'adenocarcinoma polmonare.
L'analisi LC-MS ha identificato 15 componenti dell'ingresso nel sangue. Tra questi, la tricina e la picropodofillotossina hanno dimostrato di inibire la resistenza ai farmaci e ridurre i livelli di espressione di p-PRKCA, SPHK1, SPHK2 e EGFR, sopprimendo così l'attività delle cellule tumorali del polmone29,30. Il ginsenosido Rg1 e il ginsenoside Rg3, componenti del Panax ginseng C.A. Meyer, possono bloccare la mitosi cellulare, inibire la segnalazione della via mTOR, esercitare effetti anti-angiogenici, migliorare la funzione immunitaria e, infine, inibire la crescita e le metastasi tumorali riducendo la resistenza ai farmaci 31,32,33,34. Lo stachiosio può indurre l'apoptosi nelle cellule tumorali intestinali modulando l'espressione delle proteine pro-apoptotiche35. L'imperialina, un alcaloide con proprietà antinfiammatorie e antiproliferative, ha un potenziale come agente antitumorale in fase iniziale36. La peimina può arrestare il ciclo cellulare inducendo l'apoptosi, inibire la migrazione cellulare attraverso lo stress del reticolo endoplasmatico e regolare l'espressione proteica correlata alla via NF-κB per sopprimere la crescita delle cellule tumorali della mammella e dello stomaco37,38. È stato riportato che l'aucubina e il jujuboside B promuovono l'autofagia e l'apoptosi nelle cellule tumorali inibendo l'angiogenesi, esercitando così effetti antitumorali 39,40,41.
La via MAPK è essenziale per vari processi biologici, tra cui l'attivazione cellulare, la proliferazione, l'autofagia e l'apoptosi. Diversi composti rilevati nei componenti ematici del decotto XY, come il ginsenosido Rg1, il ginsenosidio Rg3, la peimina e il jujuboside B, possono esercitare effetti antitumorali attraverso la via MAPK 42,43,44,45. La via MAPK coinvolge le cascate di segnalazione ERK, JNK e P38 ed è ampiamente studiata nella ricerca sul cancro grazie al suo ruolo nella regolazione dei processi fisiologici attraverso l'attivazione della cascata proteica di MAP3K-MAP2K-MAPK 46,47.
L'attivazione della via ERK stimola la proliferazione cellulare e inibisce l'apoptosi regolando l'attività e l'espressione di proteine pro-apoptotiche e anti-apoptotiche a livello trascrizionale e traduzionale48,49. Gli inibitori delle proteine che hanno come bersaglio la via ERK sono stati ampiamente studiati e sono utilizzati nel trattamento del cancro 50,51,52. È stato anche dimostrato che i monomeri e le formulazioni della medicina tradizionale cinese (MTC) esercitano effetti antitumorali modulando la via ERK. Ad esempio, la formula QYHJ inibisce la proliferazione e promuove l'apoptosi delle cellule di adenocarcinoma duttale pancreatico regolando l'espressione di p-P38 e p-ERK1/253. I derivati dell'acido ferulico sopprimono la proliferazione, arrestano il ciclo cellulare e inducono l'apoptosi nella linea cellulare di cancro del polmone umanoA549 54.
La via JNK/P38 svolge ruoli distinti regolando diverse proteine effettrici a valle attraverso la fosforilazione, influenzando così il ciclo cellulare, la proliferazione cellulare e l'apoptosi55,56. Gli studi hanno dimostrato che il triptolide modula l'espressione di p-P38 e p-JNK e inibisce la proliferazione delle cellule A549, esercitando effetti antitumorali57. Inoltre, la baicaleina induce l'apoptosi nelle cellule HeLa influenzando l'espressione di p-P38 e p-JNK58. Studi in vivo e in vitro hanno dimostrato che l'iniezione di Aidi influenza l'espressione di p-JNK e p-P38 nelle cellule HepG2 e nei modelli murini di carcinoma epatocellulare, inibendo così la proliferazione tumorale59.
Ki-67 e la caspasi 3 sono indicatori chiave della proliferazione tumorale e dell'apoptosi. Ki-67 è una proteina nucleare che è altamente espressa durante la proliferazione cellulare ed è assente nelle cellule quiescenti (fase G0)60. Poiché lo sviluppo tumorale è strettamente legato alla proliferazione cellulare, la ricerca sulla correlazione tra Ki-67 e tumorigenesi ha guadagnato un'attenzione significativa. L'espressione di Ki-67 è correlata positivamente con la malignità, l'aggressività e la prognosi del tumore61,62, rendendolo un biomarcatore ampiamente utilizzato per la proliferazione del cancro63. È stato ampiamente studiato nella patogenesi e nella prognosi dei tumori gastrointestinali, polmonari, mammari e cervicali 64,65,66,67.
La famiglia delle caspasi è costituita da enzimi proteolitici che regolano l'apoptosi e l'infiammazione. La caspasi 3, che si trova principalmente nel citoplasma, è un effettore chiave dell'apoptosi. Facilita la morte cellulare scindendo le proteine del citoscheletro, inattivando le proteine inibitorie dell'apoptosi e degradando gli enzimi di riparazione del DNA 68,69,70. Alterazioni nell'espressione della Caspasi 3 possono influenzare la sensibilità delle cellule tumorali alla chemioterapia, influenzando così l'invasione, le metastasi e la progressione di vari tumori 71,72,73,74.
Questo studio ha dimostrato che il decotto XY ha inibito la proliferazione tumorale nei topi portatori di tumore LLC in modo dose-dipendente. L'analisi patologica dei tessuti tumorali dei gruppi di trattamento XY e DDP ha rivelato arrangiamenti cellulari più sciolti rispetto al gruppo M, insieme a una ridotta mitosi patologica. Inoltre, sono state osservate necrosi ed emorragie nei tessuti tumorali dei gruppi di trattamento. I risultati dell'immunoistochimica (IHC) hanno inoltre confermato che il decotto XY inibisce la proliferazione delle cellule tumorali e promuove l'apoptosi in modo dose-dipendente. L'analisi Western blot dei tessuti tumorali ha indicato cambiamenti significativi nei livelli di espressione delle proteine chiave nella via MAPK. Nel complesso, i risultati patologici e IHC suggeriscono che il decotto XY esercita effetti terapeutici contro l'adenocarcinoma polmonare modulando l'espressione delle proteine nella via di segnalazione MAPK.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Piano di Sviluppo Scientifico e Tecnologico della Provincia di Jilin (YDZJ202301ZYTS459).
Materiali
| Name | Company | Catalog Number | Comments |
| Acetonitrile | CNW Technologies | 5/8/1975 | |
| 2-Chloro-L phenylalanine | Shanghai Hengbo Biotechnology Co., Ltd. | 103616-89-3 | |
| Ammonium Hydroxide Solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | #2028 | |
| Antibody-β-actin | Abcam | ab8228 | |
| Anti-Erk1 (pT202/pY204) + Erk2 (pT185/pY187) Antibody | Abcam | ab4819 | |
| Anti-ERK1/ERK2 Antibody | Abcam | ab184699 | |
| Anti-JNK1 (pY185) + JNK2 (pY185) + JNK3 (pY223) Antibody | Abcam | ab76572 | |
| Anti-JNK1/JNK2/JNK3 Antibody | Abcam | ab208035 | |
| Anti-Ki67 Antibody | Cell Signaling Technology | GB121141 | |
| Anti-p38 (phospho T180) Antibody | Abcam | ab178867 | |
| Anti-p38 alpha/MAPK14 Antibody | Abcam | ab170099 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine Serum Albumin (BSA) | DAKO | BIOFROXX | |
| Broad-spectrum phosphatase inhibitor (100x) | Boster Biological Technology | AR1183 | |
| C57bl/6 mice | Liaoning Changsheng Biotechnology Co., Ltd. | SCXK2021-0006 | |
| Chromatographic column | Waters | ACQUITY UPLC BEH C18 1.7 μm2.1*100 mm | |
| Cisplatin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 232120 | |
| Citrate (pH 6.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2010 | |
| Cover Slip | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 10212432C | |
| Cryogenic Stage | Wuhan Junjie Electronics Co., Ltd. | JB-L5 | |
| DAB Chromogenic Kit | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 2005289 | |
| Decolorization shaker | Beijing Liu Yi Instrument Factory | WD-9405A | |
| Dehydrator | Wuhan Junjie Electronics Co., Ltd. | JJ-12J | |
| Drying Oven | Shanghai Huitai Instrument Manufacturing Co., Ltd. | DHG-9140A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| EDTA (pH 8.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2001 | |
| EDTA (pH 9.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2002 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Eosin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 212954 | |
| Ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 493511 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Formic acid | SIGMA | 64-18-6 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| Hematoxylin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | H3136 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| High-Resolution Mass Spectrometry | Thermo Fisher Scientific | Q Exactive Focus | |
| HRP-conjugated Goat Anti-Mouse | SeraCare | 5220-0341 | |
| HRP-conjugated Goat Anti-Rabbit | SeraCare | 5220-0336 | |
| HRP-conjugated Goat Anti-Rabbit/Mouse Universal Secondary Antibody | DAKO | K5007 | |
| HRP-conjugated Goat Anti-Rat | SeraCare | 5220-0364 | |
| HRP-conjugated Rabbit Anti-Goat | SeraCare | 5220-0362 | |
| Hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | H9892 | |
| Hydrogen Peroxide | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | B12555 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| ImageJ software | National Institutes of Health | v1.8.0 | |
| Imaging System | Nikon (Japan) | NIKON DS-U3 | |
| Lewis lung carcinoma cells | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 90020104 | |
| Mesh cloth | Baijie | 100110779650 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Micropipette | Dlab Scientific Co., Ltd. | KE0003087/KA0056573 | |
| Microscope Slide | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 10212432C | |
| Microtome | Shanghai Leica Instruments Co., Ltd. | RM2016 | |
| Microwave Oven | Galanz Microwave Electrical Appliances Co., Ltd. | P70D20TL-P4 | |
| Neutral Balsam | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 10004160 | |
| Optical microscope | Nikon (Japan) | Nikon Eclipse CI | |
| Oven | Shanghai Huitai Instrument Manufacturing Co., Ltd. | DHG-9140A | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Paraformaldehyde | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 8.18715 | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5X) | Boster Biological Technology | AR1112 | |
| pulverizer | Shangzhiqiao Co., Ltd. | DFT-100A | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Tissue Flotation Workstation | Jinhua Kedi Instrument Equipment Co., Ltd., Zhejiang Province. | KD-P | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1x) | HyClone | J210045 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Upright Optical Microscope | Nikon (Japan) | Nikon Eclipse CI | |
| vacuum lyophilizer | Lanjing Co., Ltd. | HD-LG20D | |
| Vortex mixer | Kylin-Bell | XW-80A | |
| Xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 214736 |
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon