Method Article
Konstruktion eines Lungenadenokarzinom-Xenotransplantatmodells bei Mäusen und Bewertung der Effizienz der XY-Abkochung über den MAPK-Signalweg
In diesem Artikel
Zusammenfassung
Diese Studie zeigt, dass die XY-Abkochung therapeutische Wirkungen gegen das Lungenadenokarzinom ausübt, indem sie den MAPK-Signalweg reguliert.
Zusammenfassung
Das Lungenadenokarzinom nimmt weltweit zu, was die Erforschung und Entwicklung wirksamer Behandlungsmethoden erforderlich macht. In den letzten Jahren wurde zunehmend das therapeutische Potenzial der traditionellen chinesischen Medizin bei Lungenadenokarzinomen, wie z.B. dem XiaoYi (XY)-Sud, erkannt. Der Wirkmechanismus der traditionellen chinesischen Medizin bei der Behandlung des Lungenadenokarzinoms wird weiterhin aufgeklärt. In dieser Studie wurden Tiermodelle verwendet, um die therapeutische Wirkung der XY-Abkochung bei der Behandlung des Lungenadenokarzinoms zu untersuchen. Die chemischen Bestandteile der XY-Dekodierung bei Mäusen wurden getrennt und sowohl im positiven als auch im negativen Ionenmodus mittels UHPLC-QE-MS analysiert. Die Ergebnisse wurden dann durch In-vivo-Experimente validiert, die eine verringerte Tumorgröße, verbesserte pathologische Veränderungen und eine erhöhte Apoptose zeigten. Als Ergebnis wurden fünfzehn Komponenten identifiziert, die nach Verabreichung von XY-Abkochung in das Blut aufgenommen wurden: Stachyose, Quercetin-3-O-beta-glucopyranosyl-7-O-alpha-rhamnopyranosid; Imperialin; Spinosin B; Peimin; Flavon-Basis + 3O, 2MeO, O-Hex; Picropodophyllotoxin; (2S,3R,4S,5S,6R)-2-[(2R,3R,4S,5S,6R)-4,5-dihydroxy-2 [[(3S,5R,8R,10R,12R,13R,14R,17S)-12-hydroxy-17-(2-hydroxy-6-methylhept-5-en-2-yl) 4,4,8,10,14-pentamethyl-2,3,5,6,7,9,11,12,13,15,16,17-dodecahydro-1H cyclopenta[a]phenanthren-3-yl]oxy]-6-(hydroxymethyl)oxan-3-yl]oxy-6-(hydroxymethyl)oxan-3,4,5-triol; Tricin; Ginsenosid Rg1; (20R)-Ginsenosid Rh1; Jujubosid B; Aucubin; Ginsenosid Rg3; und Beta-Elemonsäure. Tierversuche zeigten, dass die XY-Abkochung das Tumorwachstum hemmte, pathologische Veränderungen verbesserte und die Apoptose der Tumorzellen dosisabhängig förderte. Die beteiligten Mechanismen könnten mit der Hochregulierung der p-JNK- und p-P38-Proteinexpression im MAPK-Signalweg und der Herunterregulierung der p-ERK-Proteinexpression im MAPK-Signalweg zusammenhängen. Zusammenfassend lässt sich sagen, dass die XY-Abkochung das Potenzial hat, den MAPK-Signalweg zu regulieren und therapeutische Wirkungen gegen das Lungenadenokarzinom auszuüben.
Einleitung
Die Inzidenz von Lungenkrebs steigt weltweit. Sie macht 18 % aller bösartigen Erkrankungen aus und ist für eine beträchtliche Anzahl krebsbedingter Todesfälle verantwortlich 1,2. Nicht-kleinzelliger Lungenkrebs (NSCLC) ist eine weit verbreitete Form von Lungenkrebs, wobei das Adenokarzinom der wichtigste pathologische Typ3 ist. Aufgrund seiner schleichenden Symptome wird NSCLC oft erst in einem fortgeschrittenen Stadium diagnostiziert und hat eine hohe Sterblichkeitsratevon 4,5. NSCLC-Patienten im Stadium IV haben eine Fünf-Jahres-Überlebensrate von nur 5 %6, während selbst chirurgisch resezierbare NSCLC-Patienten im Frühstadium eine Fünf-Jahres-Überlebensrate von nur 50 % aufweisen7.
Derzeit umfasst die Behandlung des Lungenadenokarzinoms Operationen, Strahlentherapien, Chemotherapien, Immuntherapien und gezielten Therapien. Darüber hinaus wird die Traditionelle Chinesische Medizin (TCM) bei Lungenadenokarzinomen zunehmend anerkannt und geschätzt8. Die TCM hat eine lange Geschichte und wurde bei der Behandlung verschiedener onkologischer Erkrankungen mit wirksamen therapeutischen Ergebnissen eingesetzt 9,10. Es betrachtet den menschlichen Körper als Ganzes, wobei sich das therapeutische Prinzip auf die Wiederherstellung der Bewegung des Qi (Qi bezieht sich auf die Lebensenergie, die die Zirkulation von Blut und Körperflüssigkeiten fördert und zu einer verbesserten Immunität und reduzierten Entzündungen bei NSCLC-Patienten beiträgt) in den inneren Organen konzentriert, um das allgemeine Gleichgewicht wiederherzustellen und das Fortschreiten der Krebserkrankung zu hemmen.
Die TCM behandelt nicht nur onkologische Erkrankungen mit geringer Toxizität, mehreren Angriffspunkten und hoher Effizienz11, sondern erleichtert auch die Reparatur von Schäden, die durch Strahlen- und Chemotherapie verursacht wurden, und verlängert dadurch das Überleben12.
Die Flüssigchromatographie-Massenspektrometrie-Technologie (LC-MS) integriert die Flüssigchromatographie mit der Massenspektrometrie, um die Trennung und Detektion von Komponenten in komplexen Verbindungsgemischenzu erreichen 13. LC-MS bietet eine hohe Auflösung, eine hohe Empfindlichkeit und eine hohe Spezifität und ermöglicht die Trennung und Identifizierung verschiedener chemischer Komponenten in Abkochungen der Traditionellen Chinesischen Medizin (TCM). In Kombination mit der medizinischen Serumchemie, die Wirkstoffe für den Bluteintritt nach oraler Verabreichung trennt und nachweist14,15, ermöglicht die LC-MS die Vorhersage und Analyse potenzieller Wirkstoffwirkmechanismen. Dieser Ansatz hilft beim Verständnis der chemischen Zusammensetzung und der pharmakologischen Komponenten von TCM-Abkochungen und liefert wesentliche Daten für eine eingehende Forschung über ihre pharmakologischen Wirkungen und klinischen Anwendungen, wodurch er in der TCM-Forschung sehr anwendbar ist16,17.
Der MAPK-Signalweg spielt eine entscheidende Rolle bei der Entstehung, Progression, Metastasierung und Invasion von Lungenkrebs, wobei Erk, p38 und JNK wichtige Unterfamilien sind. Es wurde gezeigt, dass TCM-Abkochungen die Expression von Proteinen im MAPK-Signalweg beeinflussen18. Die XiaoYi (XY)-Abkochung wird von der YiGuan-Abkochung abgeleitet und wird zur Behandlung des Lungenadenokarzinoms im First Affiliated Hospital der Changchun University of Chinese Medicine (Abbildung 1) eingesetzt, wobei eine präzise klinische Wirksamkeit nachgewiesen wird. Der therapeutische Mechanismus ist jedoch noch unklar.
In dieser Studie wurde die Ultrahochleistungsflüssigkeitschromatographie in Verbindung mit der Q-Exactive Orbitrap-Massenspektrometrie (UHPLC-QE-MS) eingesetzt, um den möglichen therapeutischen Mechanismus der XY-Abkochung gegen Lungenadenokarzinome aufzuklären, und seine Wirkungen wurden durch in vivo-Studien validiert.
Protokoll
Alle tierexperimentellen Verfahren wurden von der Tierethikkommission der Universität für Traditionelle Chinesische Medizin Changchun genehmigt (Ethik Nr. 2024008). Sechs Wochen alte männliche Mäuse des Typs C57BL/6 (20 ± 2 g), die unter spezifischen pathogenfreien (SPF) Bedingungen gezüchtet wurden, zeigten typische körperliche Aktivitätsmuster in einer kontrollierten Umgebung mit konstanter Temperatur und Luftfeuchtigkeit. Sie hatten ad libitum Zugang zu Nahrung und Wasser und wurden unter einem 12-stündigen Hell-Dunkel-Zyklus gehalten. Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle enthalten.
1. Zubereitung von wässrigem Extrakt aus XY-Abkochung
- Panax Ginseng C.A. Mey (Renshen, 15 g), Chinemys reevesii (Gray) (Guiban, 30 g) und Trionyx sinensis Wiegmann (Biejia, 30 g) in einen Abkochtopf geben. Fügen Sie 1000 mL entionisiertes Wasser hinzu und lassen Sie es 30 Minuten bei Raumtemperatur einweichen.
- Die drei Kräuter aus Schritt 1.1 1 h kochen. Gleichzeitig Rehmannia glutinosa Libosch (Dihuang, 30 g), Trichosanthes kirilowii Maxim. (Tianhuafen, 30 g), Coix lacryma-jobi L. var. mayuen (römisch.) Stapf (Yiyiren, 20 g), Paeonia lactiflora Pall. (Baishao, 30 g), Boswellia carterii Birdw. (Ruxiang, 7 g), Commiphora myrrha engl. (Moyao, 7 g), Agrimonia pilosa Ledeb. (Xianhecao, 20 g), Alpinia oxyphylla Miq. (Yizhiren, 20 g), Ziziphus jujuba Mühle. var. spinosa (Bunge) (Suanzaoren, 30 g), Melia toosendan Sieb. et Zucc. (Chuanlianzi, 5 g), Fritillaria thunbergii Miq. (Zhebeimu, 15 g), Anemarrhena asphodeloides Bge. (Zhimu, 10 g), Platycodon grandiflorum (Jacq.) (Jiegeng, 10 g), Polygala tenuifolia Willd. (Yuanzhi, 15 g) und Phragmites communis Trin. (Lugen, 30 g) in einem anderen Behälter für 30 min. Nach dem Einweichen in den Abkochtopf aus Schritt 1.1 umfüllen.
- Alle 18 Kräuter aus Schritt 1.1 und Schritt 1.2 30 min kochen. Gießen Sie die Kräuterflüssigkeit aus, fügen Sie 1000 ml deionisiertes Wasser hinzu und kochen Sie weitere 30 Minuten lang. Wiederholen Sie diesen Kochvorgang dreimal, um drei Portionen Kräuterflüssigkeit zu erhalten, und mischen Sie sie dann gründlich.
- Filtern Sie die gemischte Kräuterflüssigkeit durch ein 400-Mesh-Tuch. Konzentrieren Sie das Filtrat unter reduziertem Druck und überführen Sie dann die konzentrierte Kräuterflüssigkeit zur weiteren Verarbeitung in eine Kühlanlage.
- Gießen Sie die konzentrierte Kräuterflüssigkeit in eine Lyophilisationsschale und stellen Sie sie in die Vorgefrierkammer eines Vakuum-Lyophilisators. Sobald das Vorgefrieren abgeschlossen ist, stellen Sie das Tablett in die Sublimationstrockenkammer, um Wasser zu entfernen.
- Entfernen Sie die Restfeuchtigkeit bei hoher Temperatur. Pulverisieren Sie den gefriergetrockneten Kräuterextrakt mit einem Pulverisierer, um fein lyophilisiertes XY-Abkochpulver zu erhalten (Abbildung 2).
2. Arzneimittelhaltiges Serumpräparat
- Ordnen Sie sechs Wochen alte männliche C57BL/6-Mäuse (20 ± 2 g) nach dem Zufallsprinzip entweder der XiaoYi (XY)-Gruppe oder der Kontrollgruppe zu.
HINWEIS: Die Mausdosis wurde unter Verwendung des Umrechnungsfaktors von Mensch zu Maus berechnet:
Äquivalente experimentelle Dosis für Mäuse (g/kg) = {Dosis beim Menschen (g/kg) / Körpergewicht (70 kg)} x 9,1
Basierend auf dieser Berechnung wurde die Dosierung für Mäuse auf 2,6 g/kg festgelegt. - Wiegen Sie 0,9152 g lyophilisiertes XY-Abkochpulver und lösen Sie es in 3,2 ml destilliertem Wasser auf, um die Arzneimittellösung herzustellen.
HINWEIS: Mäuse wurden vor der oralen Verabreichung 12 Stunden lang nüchtern. - Verabreichen Sie den Mäusen in der XY-Gruppe den XY-Sud über eine Sonde, während Sie der Kontrollgruppe ein entsprechendes Volumen an deionisiertem Wasser verabreichten.
- 2 h nach der oralen Verabreichung die Mäuse mit Pentobarbital-Natrium anästhesieren (nach institutionell anerkannten Protokollen). Entkernen Sie die Augäpfel mit einer Pinzette, um Blutproben zu entnehmen, und euthanasieren Sie die Mäuse dann durch CO2 -Erstickung, gefolgt von einer Gebärmutterhalsluxation gemäß ethischen Richtlinien19.
- Lassen Sie die Blutproben 90 Minuten lang bei Raumtemperatur stabilisieren. Bei 3450 x g (4 °C) für 15 min zentrifugieren, um den Überstand aufzufangen.
3. UHPLC-QE-MS-Analyse
- 100 mg lyophilisiertes XY-Abkochpulver zu 500 μl Extraktionslösung (Methanol: Wasser = 4:1) geben. Gründlich mischen, beschallen und 1 h in einem Eiswasserbad inkubieren.
- Die Mischung 1 h lang bei -40 °C halten, dann 15 min lang bei 13.800 x g (4 °C) zentrifugieren. Filtrieren Sie den Überstand durch eine 0,22 μm große Filtermembran und kombinieren Sie dann 100 μl jedes Überstands, um Proben für die Qualitätskontrolle (QC) zu erstellen.
- Nach dem Auftauen der Plasmaproben werden 400 μl der Plasmaprobe der Kontrollgruppe und 400 μl der Plasmaproben der XY-Gruppe entnommen. Geben Sie 40 μl Salzsäure (2 mol/l) in jede Probe. 1 min vortexen und die Mischung 15 min bei 4 °C stehen lassen. Wiederholen Sie diesen Schritt viermal.
- 1,6 ml Acetonitril hinzufügen und 5 Minuten lang vortexen. Zentrifugieren bei 13.800 x g für 5 min bei 4 °C. 1.800 μL des Überstands werden einer Stickstofftrocknung unterzogen.
- Die getrockneten Proben werden in 150 μl 80 % Methanol mit einem Gehalt von 10 μg/ml des internen Standards rekonstituiert, indem sie 5 Minuten lang vortexen. Zentrifugieren Sie 5 Minuten lang bei 13.800 × g und 4 °C und überführen Sie dann 120 μl des Überstands für die LC-MS-Analyse in ein frisches Glasfläschchen (Abbildung 3).
4. Zellkultur und Tierpräparation
- Entkernen Sie 1 ml Lewis-Lungenkarzinomzellen in einer Kulturschale mit Dulbeccos modifiziertem Eagle Medium (DMEM), ergänzt mit 10 % fötalem Rinderserum und 1 % Penicillin/Streptomycin. Inkubieren Sie die Zellen unter kontrollierten Bedingungen bei 37 °C mit 5 % CO2.
- Wenn die Zellen eine Konfluenz von 80 % erreichen, passieren Sie sie mit 0,25 % Trypsin. Setzen Sie die Passage fort, bis sich der Zellzustand stabilisiert hat, und stellen Sie dann die Zellkonzentration auf 3 x 106 Zellen/ml ein.
- Injizieren Sie 0,1 ml der vorbereiteten Zellsuspension subkutan in die rechte Achselhöhle männlicher C57BL/6-Mäuse, um das Lungenadenokarzinommodell zu etablieren.
HINWEIS: Tumorgewebe kann 5 Tage nach der Inokulation in der Achselhöhle von Mäusen abgetastet werden. - Nach 5 Tagen teilen Sie die Mäuse nach dem Zufallsprinzip in fünf Gruppen ein (n = 6 pro Gruppe): Modellgruppe (M) - Keine Behandlung; XY-Abkochung Niedrigdosisgruppe (XY-L) - 1,3 g/kg; XY-Abkochung mittlerer Dosis (XY-Z) - 2,6 g/kg; XY-Abkochung Hochdosisgruppe (XY-H) - 5,2 g/kg; Cisplatin-Gruppe (DDP) - Behandelt mit Cisplatin20.
- Das XY-Abkochpulver wird in 200 μl destilliertem Wasser in der entsprechenden Dosis aufgelöst und über eine Sonde verabreicht. Die M- und DDP-Gruppen erhalten über die Sonde die gleiche Menge an destilliertem Wasser.
- Verabreichen Sie der DDP-Gruppe einmal alle 3 Tage Cisplatin durch intraperitoneale Injektion (3 mg/kg). Injizieren Sie das gleiche Volumen physiologischer Kochsalzlösung in die anderen Gruppen.
5. Pathologische Analyse des Tumorgewebes
- Nach 21 Tagen werden alle Mäuse mit CO2 -Erstickung und anschließender Zervixluxation (gemäß den ethischen Richtlinien) eingeschläfert und das Tumorgewebe entfernt21. Messen Sie das Tumorvolumen und -gewicht (Abbildung 4).
- Fixieren Sie das herausgeschnittene Tumorgewebe 24 h lang in 4% Paraformaldehyd). Dehydrieren Sie das Gewebe mit abgestuften Ethanollösungen.
- Reinigen Sie die dehydrierten Gewebeblöcke mit Xylol und betten Sie sie dann in geschmolzenes Paraffinwachs ein. Lassen Sie das Wachs zu einem Paraffinblock erstarren. Schneiden Sie den Gewebeblock mit einem Mikrotom in 5 μm dicke Scheiben.
- Entwachsen Sie die Gewebeabschnitte in Xylol, gefolgt von der Rehydratation in abgestuften Ethanollösungen. Färben Sie die Abschnitte 5 Minuten lang mit Hämatoxylin und spülen Sie sie dann mit entionisiertem Wasser ab.
- Die Abschnitte 1 min lang mit 0,5%iger Eosinlösung gegenfärben. Beobachten Sie die gefärbten Schnitte unter einem optischen Mikroskop und nehmen Sie Bilder für die Analyse auf.
6. Immunhistochemische Analyse von Tumorgewebe
- Führen Sie die Deparaffinierung und Rehydrierung gemäß den in den Schritten 5.2-5.4 beschriebenen Verfahren durch.
- Inkubieren Sie die Schnitte in einem endogenen Peroxidaseblocker bei Raumtemperatur für 15 min. Blockieren Sie die unspezifische Bindung, indem Sie die Abschnitte mit Ziegenserum inkubieren.
- Wenden Sie die primären Antikörper an: Ki-67 (1:600) und Caspase-3 (1:100). Die Schnitte werden über Nacht bei 4 °C inkubiert. Mit PBS-Puffer waschen), dann einen Allzweck-Sekundärantikörper (1:500) auftragen und 30 min bei 37 °C inkubieren.
- Entwickeln Sie die Farbreaktion durch Zugabe von DAB-Lösung. Färben Sie die Abschnitte mit Hämatoxylinlösung.
- Führen Sie die Dehydratisierung, Reinigung und Versiegelung der fleckigen Abschnitte durch. Beobachten Sie die Proteinexpression unter einem optischen Mikroskop und nehmen Sie Bilder für die Analyse auf.
7. Westliche Blot-Analyse
- Homogenisieren Sie das Tumorgewebe mit einem Gewebelyser. Extrahieren Sie das Gesamtprotein und bestimmen Sie seine Konzentration mit einem Bicinchoninsäure (BCA)-Assay-Kit (siehe Materialtabelle).
- Führen Sie eine Proteinquantifizierung durch, gefolgt von einer SDS-PAGE-Elektrophorese und einem Proteintransfer auf eine Membran.
- Inkubieren Sie die Membran über Nacht bei 4 °C mit den Primärantikörpern P38 (1:2000), p-P38 (1:1000), ERK (1:20000), p-ERK (1:500), JNK (1:2000), p-JNK (1:5000), β-Aktin (1:200) (siehe Materialtabelle).
- Am nächsten Tag inkubieren Sie die Membran mit Meerrettichperoxidase (HRP)-konjugierten Sekundärantikörpern bei Raumtemperatur für 1,5 h. Erkennen Sie Proteinbanden mit einem ECL-System (Enhanced Chemilumineszenz).
HINWEIS: Die Intensitäten der Proteinbanden wurden mit der ImageJ-Software quantifiziert.
Ergebnisse
XY-Pulverlösungs- und Serumproben aus der Kontrollgruppe und der XY-Gruppe wurden mittels UHPLC-QE-MS analysiert, wobei gut getrennte Peaks sichtbar wurden. Die Gesamtionisationsdiagramme für die positiven und negativen Ionenmoden sind in Abbildung 3 dargestellt. Die Zusammensetzung des XY-Suds wurde anhand der Retentionszeit, des Erfassungsmodus und der Massenspektrumfragmente identifiziert. Fünfzehn Bluteintrittskomponenten wurden durch den Vergleich des Serums der Blind- und der XY-Abkochungsgruppe mit den Komponenten der XY-Pulverlösung identifiziert (Tabelle 1).
Das Liniendiagramm des Tumorvolumens zeigt, dass nach 21 Tagen Sonde mit XY-Abkochung das Tumorvolumen bei Mäusen im Vergleich zur M-Gruppe abnahm und einen dosisabhängigen Effekt zeigte (Abbildung 4). Die Tumorhistopathologie wurde mittels H&E-Färbung beobachtet (Abbildung 5). In der M-Gruppe waren die Tumorzellen dicht angeordnet und zeigten eine aktive Proliferation mit reichlich pathologischer Mitose. Mit zunehmender XY-Abkochdosis wurde die Anordnung der Tumorzellen allmählich spärlich und der Interzellularraum nahm zu. In Tumorgeweben wurden verschiedene Grade der Nekrose beobachtet, und pathologische Mitose war selten21.
Um die Auswirkungen der XY-Abkochung auf die Proliferation und Apoptose von Tumorgeweben bei Mäusen zu verifizieren, wurden immunhistochemische (IHC) Experimente durchgeführt. Nach Färbung mit Ki-67 und Caspase 3 Antikörpern wurden vereinzelte bräunlich-gelbe Partikel in den Tumorgewebeschnitten beobachtet. Im Vergleich zur M-Gruppe nahmen die Ki-67-Spiegel in Tumorgeweben der XY- und DDP-Gruppe sequentiell ab, während die Caspase-3-Spiegel anstiegen (Abbildung 6).
Um festzustellen, ob die XY-Abkochung über den MAPK-Signalweg therapeutische Wirkungen auf das Lungenadenokarzinom ausübt, wurde eine Western-Blot-Analyse an Tumorgeweben von Mäusen durchgeführt. Wie in Abbildung 7 gezeigt, führte die Behandlung mit XY-Abkochung zu einer Abnahme der p-ERK-Expression, wobei die XY-H-Gruppe einen signifikanten Unterschied zur M-Gruppe aufwies (p < 0,001). Die Spiegel von p-JNK und p-P38 stiegen in der XY-H-Gruppe im Vergleich zur M-Gruppe an, wobei statistisch signifikante Unterschiede in der XY-H-Gruppe (p < 0,01) und der DDP-Gruppe (p < 0,05) im Vergleich zur M-Gruppe beobachtet wurden. Darüber hinaus war der Unterschied zwischen der DDP- und der XY-H-Gruppe statistisch signifikant.

Abbildung 1: Bestandteile der XY-Abkochung. Diese Abbildung zeigt die einzelnen Arzneimittel, die in der XY-Dekodierung enthalten sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
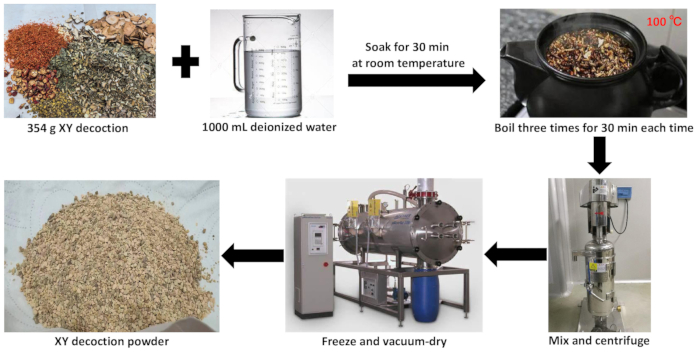
Abbildung 2: Herstellung von wässrigem Extrakt aus dem XY-Abkochverfahren. Diese Abbildung veranschaulicht den Herstellungsprozess des wässrigen Extrakts der XY-Abkochung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
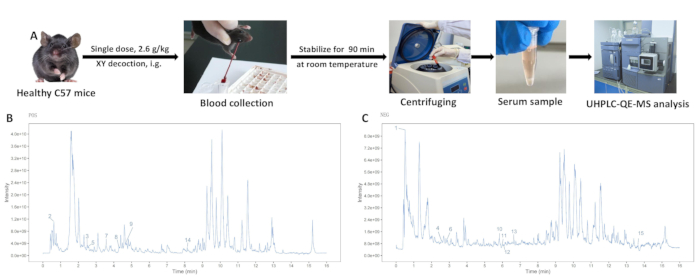
Abbildung 3: Analyse von wässrigem Extrakt aus XY-Abkochung. (A) Der Extraktionsprozess von arzneimittelhaltigem Serum. (B) Massenspektrometrische Analyse im positiven Ionenmodus. (C) Massenspektrometrische Analyse im Negativionenmodus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Auswirkungen der XY-Abkochung auf das Tumorvolumen und die Morphologie von Mausen. (A) Zellkultur, Tumorimplantation und Probenahmeverfahren. (B) Liniendiagramm, das das Tumorvolumen im Zeitverlauf darstellt. (C) Tumormorphologie nach 21-tägiger Sondenbehandlung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
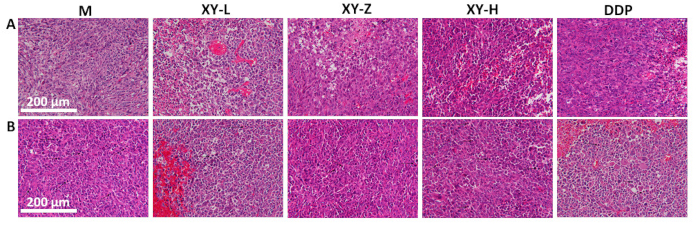
Abbildung 5: Histologische Analyse von Tumorgeweben der Maus. (A) Die Anordnung des Tumorgewebes wird mit zunehmender Dosis der XY-Abkochung spärlicher, mit Anzeichen von Nekrose in dosisabhängiger Weise. (B) Pathologische Mitose in Tumorgeweben, die eine Abnahme der pathologischen Mitose mit zunehmenden Dosen von XY-Abkochung zeigt. Maßstabsleisten: 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Ki-67- und Caspase-3-Expressionsniveaus. (A) Ki-67-Expressionsniveaus. (B) Caspase-3-Expressionsniveaus. Maßstabsbalken: 400 μm. (C) Quantifizierung der Ki-67-positiven Bereiche, die mit zunehmender Dosis der XY-Abkochung abnahmen. (D) Quantifizierung von Caspase-3-positiven Bereichen, die einen Anstieg mit zunehmender Dosis von XY-Abkochung zeigen. p < 0,001, ****p < 0,0001; ns, nicht signifikant. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Proteinexpressionsniveaus im MAPK-Signalweg. (A) Western-Blot-Analyse der Proteinexpression. (B) ERK-Expressionsniveaus. (C) p-ERK-Expressionsniveaus. (D) JNK-Expressionspegel. (E) p-JNK-Expressionspegel. (F) P38-Expressionsniveaus. (G) p-P38-Expressionsniveaus. Die XY-Abkochung regulierte die Expression von p-JNK- und p-P38-Proteinen hoch, während die p-ERK-Expression herunterreguliert wurde. *p < 0,05, **p < 0,01, ***p < 0,001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| NEIN. | Identifizierte Verbindungen | Formel | m/z | RT (min) | Massenfehler (ppm) | Addukte | Quelle | ||
| 1 | Stachyose | C24H42Ø21 | 665.21 | 0.49 | 1.2 | [M-H]- | Ein | ||
| 2 | Quercetin-3-O-beta-glucopyranosyl-7-O-alpha-rhamnopyranosid | C4H9NO2 | 609.14 | 0.61 | 7.16 | [M+H]+ | A, C | ||
| 3 | Imperialine | C27H43NO3 | 430.33 | 2.5 | 0.13 | [M+H]+ | B | ||
| 4 | Spinosin B | C38H40Ø18 | 783.22 | 2.55 | 0.47 | [M-H]- | F | ||
| 5 | Peimin | C27H45NO3 | 432.35 | 2.62 | 1.19 | [M+H]+ | B | ||
| 6 | Flavon-Basis + 3O, 2MeO, O-Hex | C23H24Ø12 | 491.12 | 2.86 | 0.27 | [M-H]- | G | ||
| 7 | Picropodophyllotoxin | C22H22Ø8 | 415.14 | 3.54 | 2.25 | [M+H]+ | B, E | ||
| 8 | (2S,3R,4S,5S,6R)-2-[(2R,3R,4S,5S,6R)-4,5-dihydroxy-2-[[(3S,5R,8R,10R,12R,13R,14R,17S)-12-hydroxy-17-(2-hydroxy-6-methylhept-5-en-2-yl)-4,4,8,10,14-pentamethyl-2,3,5,6,7,9,11,12,13,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-yl]oxy]-6-(hydroxymethyl)oxan-3-yl]oxy-6-(hydroxymethyl)oxan-3,4,5-triol | C42H72Ø13 | 785.5 | 4.26 | 8.49 | [M+H]+ | D | ||
| 9 | Tricin | C17H14Ø7 | 331.08 | 4.67 | 0.85 | [M+H]+ | G | ||
| 10 | Ginsenosid Rg1 | C42H72Ø14 | 845.49 | 5.83 | 2.16 | [M+FA]- | D | ||
| 11 | (20R)-Ginsenosid Rh1 | C36H62Ø9 | 683.44 | 5.98 | 1.35 | [M+FA]- | D | ||
| 12 | Jujubosid B | C52H84Ø21 | 1089.55 | 6.11 | 1.3 | [M+FA]- | F | ||
| 13 | Aucubin | C15H22Ø9 | 391.12 | 6.71 | 1.11 | [M+FA]- | Ein | ||
| 14 | Ginsenosid Rg3 | C42H72Ø13 | 807.48 | 8.1 | 5.3 | [M+NA]+ | D | ||
| 15 | Beta-Eletronsäure | C30H46Ω3 | 453.34 | 13.74 | 0.42 | [M-H]- | E | ||
Tabelle 1: Bestandteile, die nach Verabreichung von XY-Abkochung in das Blut aufgenommen werden. Die Tabelle listet die Wirkstoffe auf, die nach Verabreichung von XY-Abkochung im Blut nachgewiesen wurden: A: Rehmannia glutinosa Libosch (Dihuang), B: Fritillaria thunbergii Miq. (Zhebeimu), C: Trichosanthes kirilowii Maxim. (Tianhuafen), D: Panax ginseng C.A. Mey (Renshen), E: Boswellia carterii Birdw. (Ruxiang), F: Ziziphus jujuba Mühle. var. spinosa (Bunge) (Suanzaoren), G: Phragmites communis Trin. (Lugen).
Diskussion
Die Inzidenz von Krebs steigt jährlich und stößt auf erhebliches klinisches und Forschungsinteresse22,23. Neuere Studien haben die Wirksamkeit der Traditionellen Chinesischen Medizin (TCM) bei der Behandlung von Lungenkrebs nachgewiesen 24,25,26. Zum Beispiel hat sich gezeigt, dass die Abkochung von Maimendong die Anzahl und Aktivität von NK-Zellen erhöht und dadurch die Metastasierung von Lungenkrebs hemmt27. In ähnlicher Weise hat die Abkochung von Mahuang Fuzi Xixin therapeutische Wirkungen bei Lungenkrebs erzielt, indem sie mehrere Signalwege beeinflussthat 28. Diese Studie nutzt LC-MS-Analysen und in vivo-Experimente, um die möglichen Mechanismen vorherzusagen, durch die XY-Abkochung therapeutische Wirkungen auf das Lungenadenokarzinom ausübt.
Bei der LC-MS-Analyse wurden 15 Bluteintrittskomponenten identifiziert. Unter diesen wurde gezeigt, dass Tricin und Picropodophyllotoxin die Arzneimittelresistenz hemmen und die Expressionsniveaus von p-PRKCA, SPHK1, SPHK2 und EGFR reduzieren, wodurch die Aktivität von Lungenkrebszellen unterdrücktwird 29,30. Ginsenosid Rg1 und Ginsenosid Rg3, Bestandteile von Panax Ginseng C.A. Meyer, können die Zellmitose blockieren, die Signalübertragung des mTOR-Signalwegs hemmen, anti-angiogene Wirkungen ausüben, die Immunfunktion verbessern und letztendlich das Tumorwachstum und die Metastasierung hemmen, während sie die Arzneimittelresistenz reduzieren 31,32,33,34. Stachyose kann Apoptose in Darmkrebszellen induzieren, indem sie die Expression von pro-apoptotischen Proteinen moduliert35. Imperialin, ein Alkaloid mit entzündungshemmenden und antiproliferativen Eigenschaften, hat Potenzial als Antitumormittel im Frühstadium36. Peimin kann den Zellzyklus durch Induktion der Apoptose stoppen, die Zellmigration durch Stress des endoplasmatischen Retikulums hemmen und die Proteinexpression im Zusammenhang mit dem NF-κB-Signalweg regulieren, um das Wachstum von Brust- und Magenkrebszellen zu unterdrücken37,38. Es wurde berichtet, dass Aucubin und Jujubosid B die Autophagie und Apoptose in Tumorzellen fördern, während sie die Angiogenese hemmen und dadurch Antitumorwirkungen ausüben 39,40,41.
Der MAPK-Signalweg ist essentiell für verschiedene biologische Prozesse, einschließlich Zellaktivierung, Proliferation, Autophagie und Apoptose. Mehrere Verbindungen, die in den Bluteintrittskomponenten des XY-Suds nachgewiesen werden, wie Ginsenosid Rg1, Ginsenosid Rg3, Peimin und Jujubosid B, können über den MAPK-Signalweg 42,43,44,45 Antitumorwirkungen ausüben. Der MAPK-Signalweg umfasst die Signalkaskaden ERK, JNK und P38 und wird in der Krebsforschung aufgrund seiner Rolle bei der Regulierung physiologischer Prozesse durch die Aktivierung der Proteinkaskade von MAP3K-MAP2K-MAPK umfassend untersucht46,47.
Die Aktivierung des ERK-Signalwegs stimuliert die Zellproliferation und hemmt die Apoptose, indem sie die Aktivität und Expression von pro-apoptotischen und anti-apoptotischen Proteinen auf transkriptioneller und translationaler Ebene reguliert48,49. Proteininhibitoren, die auf den ERK-Signalweg abzielen, wurden ausgiebig untersucht und werden in der Krebsbehandlung eingesetzt 50,51,52. Es wurde ebenfalls gezeigt, dass Monomere und Formulierungen der Traditionellen Chinesischen Medizin (TCM) durch Modulation des ERK-Signalwegs eine Antitumorwirkung ausüben. Zum Beispiel hemmt die QYHJ-Formel die Proliferation und fördert die Apoptose von duktalen Adenokarzinomzellen der Bauchspeicheldrüse, indem sie die Expression von p-P38 und p-ERK1/2reguliert 53. Ferulasäurederivate unterdrücken die Proliferation, stoppen den Zellzyklus und induzieren die Apoptose in der menschlichen LungenkrebszelllinieA549 54.
Der JNK/P38-Signalweg spielt eine besondere Rolle, indem er verschiedene nachgeschaltete Effektorproteine durch Phosphorylierung reguliert und dadurch den Zellzyklus, die Zellproliferation und die Apoptose beeinflusst55,56. Studien haben gezeigt, dass Triptolid die Expression von p-P38 und p-JNK moduliert und die Proliferation von A549-Zellen hemmt, was eine Antitumorwirkung ausübt57. Zusätzlich induziert Baicalein die Apoptose in HeLa-Zellen, indem es die p-P38- und p-JNK-Expression beeinflusst58. In-vivo- und In-vitro-Studien haben gezeigt, dass die Injektion von Aidi die Expression von p-JNK und p-P38 in HepG2-Zellen und hepatozellulären Karzinom-Mausmodellen beeinflusst und dadurch die Tumorproliferation hemmt59.
Ki-67 und Caspase 3 sind Schlüsselindikatoren für die Tumorproliferation und Apoptose. Ki-67 ist ein nukleäres Protein, das während der Zellproliferation stark exprimiert wird und in ruhenden Zellen (G0-Phase) nicht vorhanden ist60. Da die Tumorentwicklung eng mit der Zellproliferation verbunden ist, hat die Erforschung des Zusammenhangs zwischen Ki-67 und Tumorgenese große Aufmerksamkeit erhalten. Die Ki-67-Expression ist positiv mit der Malignität, Aggressivität und Prognose des Tumors korreliert61,62, was es zu einem weit verbreiteten Biomarker für die Krebsproliferation macht63. Es wurde ausgiebig in der Pathogenese und Prognose von Magen-Darm-, Lungen-, Brust- und Gebärmutterhalskrebs untersucht 64,65,66,67.
Die Caspase-Familie besteht aus proteolytischen Enzymen, die Apoptose und Entzündungen regulieren. Caspase 3, die hauptsächlich im Zytoplasma vorkommt, ist ein wichtiger Effektor der Apoptose. Es erleichtert den Zelltod, indem es Zytoskelettproteine spaltet, Apoptose-hemmende Proteine inaktiviert und DNA-Reparaturenzyme abbaut 68,69,70. Veränderungen in der Caspase-3-Expression können die Empfindlichkeit der Tumorzellen gegenüber Chemotherapie beeinflussen und dadurch die Invasion, Metastasierung und das Fortschreiten verschiedener Krebsarten beeinflussen 71,72,73,74.
Diese Studie zeigte, dass die XY-Abkochung die Tumorproliferation bei LLC-Tumormäusen dosisabhängig hemmte. Die pathologische Analyse von Tumorgeweben aus der XY- und DDP-Behandlungsgruppe zeigte im Vergleich zur M-Gruppe lockerere Zellanordnungen sowie eine verminderte pathologische Mitose. Zusätzlich wurden Nekrosen und Blutungen in den Tumorgeweben der Behandlungsgruppen beobachtet. Die Ergebnisse der Immunhistochemie (IHC) bestätigten ferner, dass die XY-Abkochung die Proliferation der Tumorzellen hemmte und die Apoptose dosisabhängig förderte. Die Western-Blot-Analyse von Tumorgeweben zeigte signifikante Veränderungen in den Expressionsniveaus von Schlüsselproteinen im MAPK-Signalweg. Insgesamt deuten die pathologischen und IHC-Befunde darauf hin, dass die XY-Abkochung therapeutische Wirkungen gegen das Lungenadenokarzinom ausübt, indem sie die Expression von Proteinen im MAPK-Signalweg moduliert.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch den Wissenschafts- und Technologieentwicklungsplan der Provinz Jilin, Punkt (YDZJ202301ZYTS459) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetonitrile | CNW Technologies | 5/8/1975 | |
| 2-Chloro-L phenylalanine | Shanghai Hengbo Biotechnology Co., Ltd. | 103616-89-3 | |
| Ammonium Hydroxide Solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | #2028 | |
| Antibody-β-actin | Abcam | ab8228 | |
| Anti-Erk1 (pT202/pY204) + Erk2 (pT185/pY187) Antibody | Abcam | ab4819 | |
| Anti-ERK1/ERK2 Antibody | Abcam | ab184699 | |
| Anti-JNK1 (pY185) + JNK2 (pY185) + JNK3 (pY223) Antibody | Abcam | ab76572 | |
| Anti-JNK1/JNK2/JNK3 Antibody | Abcam | ab208035 | |
| Anti-Ki67 Antibody | Cell Signaling Technology | GB121141 | |
| Anti-p38 (phospho T180) Antibody | Abcam | ab178867 | |
| Anti-p38 alpha/MAPK14 Antibody | Abcam | ab170099 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine Serum Albumin (BSA) | DAKO | BIOFROXX | |
| Broad-spectrum phosphatase inhibitor (100x) | Boster Biological Technology | AR1183 | |
| C57bl/6 mice | Liaoning Changsheng Biotechnology Co., Ltd. | SCXK2021-0006 | |
| Chromatographic column | Waters | ACQUITY UPLC BEH C18 1.7 μm2.1*100 mm | |
| Cisplatin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 232120 | |
| Citrate (pH 6.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2010 | |
| Cover Slip | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 10212432C | |
| Cryogenic Stage | Wuhan Junjie Electronics Co., Ltd. | JB-L5 | |
| DAB Chromogenic Kit | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 2005289 | |
| Decolorization shaker | Beijing Liu Yi Instrument Factory | WD-9405A | |
| Dehydrator | Wuhan Junjie Electronics Co., Ltd. | JJ-12J | |
| Drying Oven | Shanghai Huitai Instrument Manufacturing Co., Ltd. | DHG-9140A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| EDTA (pH 8.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2001 | |
| EDTA (pH 9.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2002 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Eosin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 212954 | |
| Ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 493511 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Formic acid | SIGMA | 64-18-6 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| Hematoxylin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | H3136 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| High-Resolution Mass Spectrometry | Thermo Fisher Scientific | Q Exactive Focus | |
| HRP-conjugated Goat Anti-Mouse | SeraCare | 5220-0341 | |
| HRP-conjugated Goat Anti-Rabbit | SeraCare | 5220-0336 | |
| HRP-conjugated Goat Anti-Rabbit/Mouse Universal Secondary Antibody | DAKO | K5007 | |
| HRP-conjugated Goat Anti-Rat | SeraCare | 5220-0364 | |
| HRP-conjugated Rabbit Anti-Goat | SeraCare | 5220-0362 | |
| Hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | H9892 | |
| Hydrogen Peroxide | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | B12555 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| ImageJ software | National Institutes of Health | v1.8.0 | |
| Imaging System | Nikon (Japan) | NIKON DS-U3 | |
| Lewis lung carcinoma cells | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 90020104 | |
| Mesh cloth | Baijie | 100110779650 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Micropipette | Dlab Scientific Co., Ltd. | KE0003087/KA0056573 | |
| Microscope Slide | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 10212432C | |
| Microtome | Shanghai Leica Instruments Co., Ltd. | RM2016 | |
| Microwave Oven | Galanz Microwave Electrical Appliances Co., Ltd. | P70D20TL-P4 | |
| Neutral Balsam | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 10004160 | |
| Optical microscope | Nikon (Japan) | Nikon Eclipse CI | |
| Oven | Shanghai Huitai Instrument Manufacturing Co., Ltd. | DHG-9140A | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Paraformaldehyde | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 8.18715 | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5X) | Boster Biological Technology | AR1112 | |
| pulverizer | Shangzhiqiao Co., Ltd. | DFT-100A | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Tissue Flotation Workstation | Jinhua Kedi Instrument Equipment Co., Ltd., Zhejiang Province. | KD-P | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1x) | HyClone | J210045 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Upright Optical Microscope | Nikon (Japan) | Nikon Eclipse CI | |
| vacuum lyophilizer | Lanjing Co., Ltd. | HD-LG20D | |
| Vortex mixer | Kylin-Bell | XW-80A | |
| Xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 214736 |
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten