Method Article
Construction d’un modèle de xénogreffe d’adénocarcinome pulmonaire chez la souris et évaluation de l’efficacité de la décoction XY par la voie MAPK
Dans cet article
Résumé
Cette étude démontre que la décoction XY exerce des effets thérapeutiques contre l’adénocarcinome pulmonaire en régulant la voie MAPK.
Résumé
L’adénocarcinome pulmonaire augmente dans le monde entier, ce qui incite à l’exploration et au développement de méthodes de traitement efficaces. Ces dernières années, le potentiel thérapeutique de la médecine traditionnelle chinoise pour l’adénocarcinome pulmonaire, comme la décoction XiaoYi (XY), a été de plus en plus reconnu. Le mécanisme d’action de la médecine traditionnelle chinoise dans le traitement de l’adénocarcinome pulmonaire continue d’être élucidé. Dans cette étude, des modèles animaux ont été utilisés pour étudier les effets thérapeutiques de la décoction XY dans le traitement de l’adénocarcinome pulmonaire. Les composants chimiques d’entrée dans le sang de la décoction XY chez la souris ont été séparés et analysés en modes d’ions positifs et négatifs à l’aide de l’UHPLC-QE-MS. Les résultats ont ensuite été validés par des expériences in vivo , qui ont démontré une réduction de la taille de la tumeur, une amélioration des changements pathologiques et une augmentation de l’apoptose. En conséquence, quinze composants absorbés dans le sang après l’administration de décoction XY ont été identifiés : Stachyose, Quercétine-3-O-bêta-glucopyranosyl-7-O-alpha-rhamnopyranoside ; Imperialine ; Spinosine B ; Peimine ; Flavone base + 3O, 2MeO, O-Hex; Picropodophyllotoxine ; (2S,3R,4S,5S,6R)-2-[(2R,3R,4S,5S,6R)-4,5-dihydroxy-2 [[(3S,5R,8R,10R,12R,13R,14R,17S)-12-hydroxy-17-(2-hydroxy-6-méthylhept-5-en-2-yl) 4,4,8,10,14-pentaméthyl-2,3,5,6,7,9,11,12,13,15,16,17-dodécahydro-1H cyclopenta[a]phénanthrène-3-yl]oxy]-6-(hydroxyméthyl)oxan-3-yl]oxy-6-(hydroxyméthyl)oxane-3,4,5-triol ; Tricine ; Ginsénoside Rg1 ; (20R)-ginsénoside Rh1 ; Jujuboside B ; Aucubin ; Ginsénoside Rg3 ; et l’acide bêta-élemonique. Des expériences sur des animaux ont démontré que la décoction XY inhibait la croissance tumorale, améliorait les changements pathologiques et favorisait l’apoptose des cellules tumorales de manière dose-dépendante. Les mécanismes impliqués peuvent être liés à la régulation à la hausse de l’expression des protéines p-JNK et p-P38 dans la voie MAPK et à la régulation négative de l’expression de la protéine p-ERK dans la voie MAPK. En conclusion, la décoction XY a le potentiel de réguler la voie MAPK et d’exercer des effets thérapeutiques contre l’adénocarcinome pulmonaire.
Introduction
L’incidence du cancer du poumon augmente dans le monde entier. Il représente 18 % de toutes les tumeurs malignes et est responsable d’un nombre important de décès liés aucancer1,2. Le cancer du poumon non à petites cellules (CPNPC) est une forme prévalente de cancer du poumon, l’adénocarcinome étant la principale pathologie de type3. En raison de ses symptômes insidieux, le CPNPC est souvent diagnostiqué à un stade avancé et présente un taux de mortalité élevé 4,5. Les patients atteints d’un CPNPC de stade IV ont un taux de survie à cinq ans de seulement 5 %6, tandis que les patients atteints d’un CPNPC à un stade précoce, même résécable chirurgicalement, ont un taux de survie à cinq ans de seulement 50 %7.
Actuellement, le traitement de l’adénocarcinome pulmonaire comprend la chirurgie, la radiothérapie, la chimiothérapie, l’immunothérapie et la thérapie ciblée. De plus, la médecine traditionnelle chinoise (MTC) pour l’adénocarcinome pulmonaire est de plus en plus reconnue et valorisée8. La MTC a une longue histoire et a été utilisée dans le traitement de diverses maladies oncologiques avec des résultats thérapeutiques efficaces 9,10. Il considère le corps humain comme une entité entière, le principe thérapeutique étant axé sur la restauration du mouvement du Qi (le Qi fait référence à l’énergie vitale qui favorise la circulation du sang et des fluides corporels, contribuant à renforcer l’immunité et à réduire l’inflammation chez les patients atteints de CPNPC) dans les organes internes pour rétablir l’équilibre général et inhiber la progression du cancer.
La MTC traite non seulement les maladies oncologiques à faible toxicité, à cibles multiples et à haute efficacité11, mais elle facilite également la réparation des dommages causés par la radiothérapie et la chimiothérapie, prolongeant ainsi la survie12.
La technologie de chromatographie liquide couplée à la spectrométrie de masse (LC-MS) intègre la chromatographie liquide à la spectrométrie de masse pour réaliser la séparation et la détection de composants dans des mélanges de composés complexes13. La LC-MS offre une haute résolution, une sensibilité élevée et une spécificité élevée, permettant la séparation et l’identification de divers composants chimiques dans les décoctions de médecine traditionnelle chinoise (MTC). Lorsqu’elle est associée à la chimie médicinale sérique, qui sépare et détecte les composants actifs de l’entrée dans le sang après l’administration orale14,15, la LC-MS permet de prédire et d’analyser les mécanismes d’action potentiels des médicaments. Cette approche aide à comprendre la composition chimique et les composants pharmacologiques des décoctions de MTC, fournissant des données essentielles pour des recherches approfondies sur leurs effets pharmacologiques et leurs applications cliniques, ce qui la rend très applicable dans la recherche en MTC16,17.
La voie de signalisation MAPK joue un rôle crucial dans la genèse, la progression, les métastases et l’invasion du cancer du poumon, avec Erk, p38 et JNK comme sous-familles importantes. Il a été démontré que les décoctions de la MTC influencent l’expression des protéines dans la voie MAPK18. La décoction XiaoYi (XY) est dérivée de la décoction de YiGuan et est utilisée pour traiter l’adénocarcinome pulmonaire au premier hôpital affilié de l’Université de médecine chinoise de Changchun (Figure 1), démontrant une efficacité clinique précise. Cependant, son mécanisme thérapeutique reste incertain.
Dans cette étude, la chromatographie liquide à ultra-haute performance couplée à la spectrométrie de masse Q-Exactive Orbitrap (UHPLC-QE-MS) a été utilisée pour élucider le mécanisme thérapeutique possible de la décoction XY contre l’adénocarcinome pulmonaire, et ses effets ont été validés par des études in vivo .
Protocole
Toutes les procédures sur les animaux ont été approuvées par le Comité d’éthique animale de l’Université de médecine traditionnelle chinoise de Changchun (éthique n° 2024008). Des souris mâles C57BL/6 âgées de six semaines (20 ± 2 g), élevées dans des conditions spécifiques exemptes d’agents pathogènes (FPS), présentaient des schémas d’activité physique typiques dans un environnement contrôlé avec une température et une humidité constantes. Ils avaient un accès ad libitum à la nourriture et à l’eau et étaient maintenus sous un cycle lumière/obscurité de 12 heures. Des détails sur les réactifs et l’équipement utilisés dans cette étude sont fournis dans la table des matériaux.
1. Préparation de l’extrait aqueux de décoction XY
- Dans un pot de décoction, placez le Panax ginseng C.A. Mey (Renshen, 15 g), le Chinemys reevesii (Gray) (Guiban, 30 g) et le Trionyx sinensis Wiegmann (Biejia, 30 g). Ajouter 1000 mL d’eau déminéralisée et laisser tremper 30 min à température ambiante.
- Faites bouillir les trois herbes de l’étape 1.1 pendant 1 h. Simultanément, tremper Rehmannia glutinosa Libosch (Dihuang, 30 g), Trichosanthes kirilowii Maxim. (Tianhuafen, 30 g), Coix lacryma-jobi L. var. mayuen (Romain.) Stapf (Yiyiren, 20 g), Paeonia lactiflora Pall. (Baishao, 30 g), Boswellia carterii Birdw. (Ruxiang, 7 g), Commiphora myrrha Engl. (Moyao, 7 g), Agrimonia pilosa Ledeb. (Xianhecao, 20 g), Alpinia oxyphylla Miq. (Yizhiren, 20 g), Moulin à Ziziphus jujuba . var. spinosa (Bunge) (Suanzaoren, 30 g), Melia toosendan Sieb. et Zucc. (Chuanlianzi, 5 g), Fritillaria thunbergii Miq. (Zhebeimu, 15 g), Anemarrhena asphodeloides Bge. (Zhimu, 10 g), Platycodon grandiflorum (Jacq.) (Jiegeng, 10 g), Polygala tenuifolia Willd. (Yuanzhi, 15 g), et Phragmites communis Trin. (Lugen, 30 g) dans un autre récipient pendant 30 min. Après le trempage, transférez-les dans le pot de décoction à partir de l’étape 1.1.
- Faites bouillir les 18 herbes des étapes 1.1 et 1.2 pendant 30 min. Versez le liquide à base de plantes, ajoutez 1000 ml d’eau déminéralisée et faites bouillir pendant encore 30 minutes. Répétez ce processus d’ébullition trois fois pour obtenir trois portions de liquide à base de plantes, puis mélangez-les et mélangez-les soigneusement.
- Filtrez le liquide à base de plantes mélangé à travers un chiffon à mailles 400. Concentrez le filtrat sous pression réduite, puis transférez le liquide concentré à base de plantes dans un équipement de refroidissement pour un traitement ultérieur.
- Versez le liquide concentré à base de plantes dans un plateau de lyophilisation et placez-le dans la chambre de pré-congélation d’un lyophilisateur sous vide. Une fois la précongélation terminée, transférez le plateau dans la chambre de séchage par sublimation pour éliminer l’eau.
- Éliminez toute humidité résiduelle à haute température. Pulvérisez l’extrait de plantes lyophilisé à l’aide d’un pulvérisateur pour obtenir une fine poudre de décoction XY lyophilisée (Figure 2).
2. Préparation de sérum contenant du médicament
- Répartissez au hasard des souris mâles C57BL/6 âgées de six semaines (20 ± 2 g) dans le groupe XiaoYi (XY) ou dans le groupe témoin.
REMARQUE : La dose chez la souris a été calculée à l’aide du facteur de conversion humain-souris :
Dose expérimentale équivalente pour les souris (g/kg) = {Dose humaine (g/kg) / Poids corporel (70 kg)} x 9,1
Sur la base de ce calcul, la posologie pour les souris a été déterminée à 2,6 g/kg. - Peser 0,9152 g de poudre de décoction XY lyophilisée et la dissoudre dans 3,2 mL d’eau distillée pour préparer la solution médicamenteuse.
REMARQUE : Les souris ont été à jeun pendant 12 h avant l’administration orale. - Administrer la décoction XY aux souris du groupe XY par gavage, tout en administrant au groupe témoin un volume équivalent d’eau déminéralisée.
- 2 h après l’administration orale, anesthésier les souris avec du pentobarbital sodique (selon les protocoles approuvés par l’établissement). Énucléez les globes oculaires à l’aide d’une pince à épiler pour prélever des échantillons de sang, puis euthanasiez les souris par asphyxie au CO2 suivie d’une luxation cervicale conformément aux directives éthiques19.
- Laisser les échantillons de sang se stabiliser à température ambiante pendant 90 min. Centrifuger à 3450 x g (4 °C) pendant 15 min pour recueillir le surnageant.
3. Analyse UHPLC-QE-MS
- Ajouter 100 mg de poudre lyophilisée par décoction XY à 500 μL de solution d’extraction (méthanol : eau = 4:1). Mélangez soigneusement, sonicez et incubez dans un bain d’eau glacée pendant 1 h.
- Maintenir le mélange à -40 °C pendant 1 h, puis centrifuger à 13 800 x g (4 °C) pendant 15 min. Filtrez le surnageant à travers une membrane filtrante de 0,22 μm, puis combinez 100 μL de chaque surnageant pour créer des échantillons de contrôle de la qualité (CQ).
- Après la décongélation des échantillons de plasma, prélever 400 μL de l’échantillon de plasma du groupe témoin et 400 μL des échantillons de plasma du groupe XY. Ajouter 40 μL d’acide chlorhydrique (2 mol/L) à chaque échantillon. Agitez pendant 1 min et laissez reposer le mélange à 4 °C pendant 15 min. Répétez cette étape quatre fois.
- Ajouter 1,6 mL d’acétonitrile et agiter pendant 5 min. Centrifugeuse à 13 800 x g pendant 5 min à 4 °C. Soumettre 1 800 μL du surnageant à l’assèchement à l’azote.
- Reconstituer les échantillons séchés dans 150 μL de méthanol à 80 % contenant 10 μg/mL de l’étalon interne par vortex pendant 5 min. Centrifuger à 13 800 × g pendant 5 min à 4 °C, puis transférer 120 μL du surnageant dans un flacon en verre frais pour l’analyse LC-MS (figure 3).
4. Culture cellulaire et préparation des animaux
- Semez 1 mL de cellules de carcinome pulmonaire de Lewis dans une boîte de culture contenant du milieu Eagle modifié (DMEM) de Dulbecco complété par 10 % de sérum fœtal bovin et 1 % de pénicilline/streptomycine. Incuber les cellules dans des conditions contrôlées à 37 °C avec 5 % de CO2.
- Lorsque les cellules atteignent 80 % de confluence, faites-les passer en utilisant 0,25 % de trypsine. Continuez à passer jusqu’à ce que l’état cellulaire se stabilise, puis ajustez la concentration cellulaire à 3 x 106 cellules/mL.
- Injecter 0,1 mL de la suspension cellulaire préparée par voie sous-cutanée dans l’aisselle droite de souris mâles C57BL/6 pour établir le modèle d’adénocarcinome pulmonaire.
REMARQUE : Le tissu tumoral peut être palpé à l’aisselle des souris 5 jours après l’inoculation. - Après 5 jours, divisez au hasard les souris en cinq groupes (n = 6 par groupe) : Groupe modèle (M) - Aucun traitement ; décoction XY groupe à faible dose (XY-L) - 1,3 g/kg ; décoction XY groupe à dose moyenne (XY-Z) - 2,6 g/kg ; décoction XY groupe à forte dose (XY-H) - 5,2 g/kg ; Groupe cisplatine (DDP) - Traité avec du cisplatine20.
- Dissoudre la poudre de décoction XY dans 200 μL d’eau distillée à la dose correspondante et l’administrer par gavage. Les groupes M et DDP reçoivent un volume égal d’eau distillée par gavage.
- Administrer du cisplatine au groupe DDP par injection intrapéritonéale (3 mg/kg) une fois tous les 3 jours. Injectez le même volume de solution saline physiologique dans les autres groupes.
5. Analyse pathologique du tissu tumoral
- Après 21 jours, euthanasiez toutes les souris en utilisant l’asphyxie au CO2 suivie d’une luxation cervicale (conformément aux directives éthiques) et excisez le tissu tumoral21. Mesurez le volume et le poids de la tumeur (Figure 4).
- Fixer les tissus tumoraux excisés dans du paraformaldéhyde à 4 % pendant 24 h). Déshydratez le tissu à l’aide de solutions d’éthanol graduées.
- Éliminez les blocs de tissus déshydratés à l’aide de xylène, puis incorporez-les dans de la cire de paraffine fondue. Laissez la cire se solidifier en un bloc de paraffine. Coupez le bloc de tissu en tranches de 5 m d’épaisseur à l’aide d’un microtome.
- Déparaffiné les sections de tissu dans du xylène, suivi d’une réhydratation dans des solutions d’éthanol graduées. Teindre les sections avec de l’hématoxyline pendant 5 min, puis rincer à l’eau déminéralisée.
- Contre-colorez les sections avec une solution d’éosine à 0,5 % pendant 1 min. Observez les sections colorées au microscope optique et capturez des images pour analyse.
6. Analyse immunohistochimique du tissu tumoral
- Effectuez le déparaffinage et la réhydratation en suivant les procédures décrites aux étapes 5.2 à 5.4.
- Incuber les sections dans un bloqueur endogène de la peroxydase à température ambiante pendant 15 min. Bloquez la liaison non spécifique en incubant les sections avec du sérum de chèvre.
- Appliquez les anticorps primaires : Ki-67 (1:600) et Caspase-3 (1:100). Incuber les sections pendant la nuit à 4 °C. Laver avec un tampon PBS), puis appliquer un anticorps secondaire à usage général (1:500) et incuber à 37 °C pendant 30 min.
- Développez la réaction de couleur en ajoutant une solution DAB. Contre-colorez les sections avec une solution d’hématoxyline.
- Effectuez la déshydratation, le nettoyage et le scellement des sections tachées. Observez l’expression des protéines au microscope optique et capturez des images pour analyse.
7. Analyse par transfert Western
- Homogénéiser les tissus tumoraux à l’aide d’un lyseur de tissus. Extrayez la protéine totale et déterminez sa concentration à l’aide d’un kit de dosage de l’acide bicinchoninique (BCA) (voir le tableau des matériaux).
- Effectuer une quantification des protéines, suivie d’une électrophorèse SDS-PAGE et d’un transfert de protéines sur une membrane.
- Incuber la membrane pendant la nuit à 4 °C avec des anticorps primaires : P38 (1:2000), p-P38 (1:1000), ERK (1:20000), p-ERK (1:500), JNK (1:2000), p-JNK (1:5000), β-actine (1:200) (voir tableau des matériaux).
- Le lendemain, incubez la membrane avec l’anticorps secondaire conjugué à la peroxydase de raifort (HRP) à température ambiante pendant 1,5 h. Détectez les bandes de protéines à l’aide d’un système de chimiluminescence améliorée (ECL).
REMARQUE : Les intensités des bandes protéiques ont été quantifiées à l’aide du logiciel ImageJ.
Résultats
Des échantillons de solution de poudre XY et de sérum du groupe témoin et du groupe XY ont été analysés à l’aide de l’UHPLC-QE-MS, révélant des pics bien séparés. Les diagrammes d’ionisation totale pour les modes d’ions positifs et négatifs sont illustrés à la figure 3. La composition de la décoction XY a été déterminée sur la base du temps de rétention, du mode d’acquisition et des fragments de spectre de masse. Quinze composants sanguins ont été identifiés en comparant le sérum des groupes d’administration orale à blanc et XY avec les composants de la solution de poudre XY (tableau 1).
Le graphique linéaire du volume tumoral indique qu’après 21 jours de gavage avec décoction XY, le volume tumoral chez la souris a diminué par rapport au groupe M et a montré un effet dose-dépendant (Figure 4). L’histopathologie tumorale a été observée à l’aide de la coloration H&E (Figure 5). Dans le groupe M, les cellules tumorales étaient densément disposées et présentaient une prolifération active, avec une mitose pathologique abondante. Au fur et à mesure que la dose de décoction XY augmentait, la disposition des cellules tumorales devenait progressivement clairsemée et l’espace intercellulaire augmentait. Divers degrés de nécrose ont été observés dans les tissus tumoraux, et la mitose pathologique était rare21.
Pour vérifier les effets de la décoction XY sur la prolifération et l’apoptose des tissus tumoraux chez la souris, des expériences d’immunohistochimie (IHC) ont été menées. Après coloration avec des anticorps Ki-67 et Caspase 3, des particules jaune brunâtre dispersées ont été observées dans les coupes de tissu tumoral. Par rapport au groupe M, les niveaux de Ki-67 dans les tissus tumoraux des groupes XY et DDP ont diminué séquentiellement, tandis que les niveaux de caspase 3 ont augmenté (Figure 6).
Pour déterminer si la décoction XY exerce des effets thérapeutiques sur l’adénocarcinome pulmonaire par la voie MAPK, une analyse par transfert Western a été effectuée sur des tissus tumoraux de souris. Comme le montre la figure 7, le traitement par décoction XY a entraîné une diminution de l’expression de p-ERK, le groupe XY-H montrant une différence significative par rapport au groupe M (p < 0,001). Les niveaux de p-JNK et de p-P38 ont augmenté dans le groupe XY-H par rapport au groupe M, avec des différences statistiquement significatives observées dans le groupe XY-H (p < 0,01) et le groupe DDP (p < 0,05) par rapport au groupe M. De plus, la différence entre les groupes DDP et XY-H était statistiquement significative.

Figure 1 : Composantes de la décoction XY. Cette figure présente les différents médicaments contenus dans la décoction XY. Veuillez cliquer ici pour voir une version agrandie de cette figure.
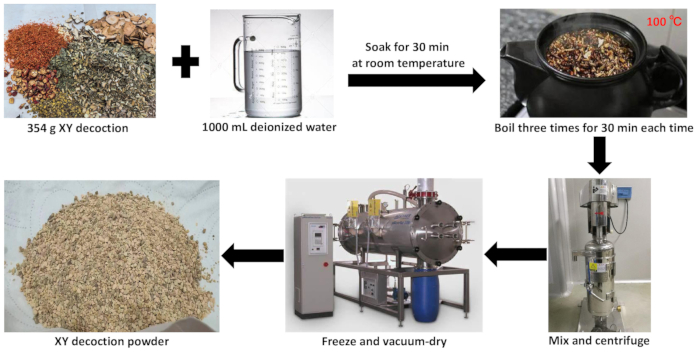
Figure 2 : Préparation de l’extrait aqueux de décoction XY. Cette figure illustre le processus de préparation de l’extrait aqueux de décoction XY. Veuillez cliquer ici pour voir une version agrandie de cette figure.
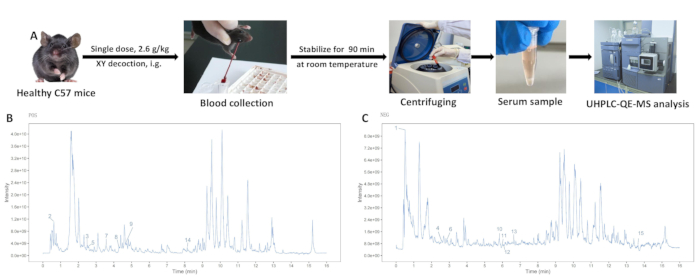
Figure 3 : Analyse de l’extrait aqueux de décoction XY. (A) Le processus d’extraction du sérum contenant du médicament. (B) Analyse par spectrométrie de masse en mode d’ions positifs. (C) Analyse par spectrométrie de masse en mode ions négatifs. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Effets de la décoction XY sur le volume et la morphologie de la tumeur de souris. (A) Culture cellulaire, implantation tumorale et procédures d’échantillonnage. (B) Graphique linéaire représentant le volume de la tumeur au fil du temps. (C) Morphologie de la tumeur après 21 jours de traitement par gavage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
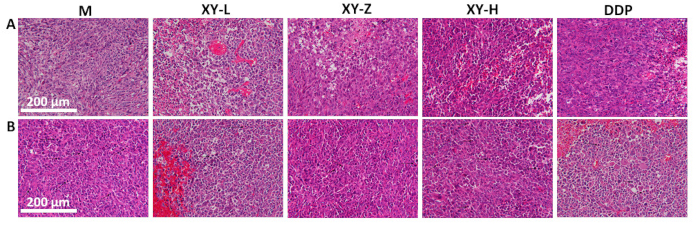
Figure 5 : Analyse histologique de tissus tumoraux de souris. (A) L’arrangement du tissu tumoral devient plus clairsemé avec l’augmentation des doses de décoction XY, avec des signes de nécrose de manière dose-dépendante. (B) Mitose pathologique dans les tissus tumoraux, montrant une diminution de la mitose pathologique avec des doses croissantes de décoction XY. Barres d’échelle : 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Niveaux d’expression du Ki-67 et de la Caspase-3. (A) Niveaux d’expression du Ki-67. (B) Niveaux d’expression de la caspase-3. Barres d’échelle : 400 μm. (C) Quantification des zones Ki-67-positives, montrant une diminution avec l’augmentation des doses de décoction XY. (D) Quantification des zones positives à la caspase-3, montrant une augmentation avec l’augmentation des doses de décoction XY. p < 0,001, ****p < 0,0001 ; ns, non significatif. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Niveaux d’expression des protéines dans la voie MAPK. (A) Analyse de l’expression des protéines par transfert de Western. (B) Niveaux d’expression ERK. (C) les niveaux d’expression de p-ERK. (D) Niveaux d’expression de JNK. (E) les niveaux d’expression de p-JNK. (F) Niveaux d’expression P38. (G) les niveaux d’expression de p-P38. La décoction XY régule à la hausse l’expression des protéines p-JNK et p-P38 tout en régulant à la baisse l’expression de p-ERK. *p < 0,05, **p < 0,01, ***p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| NON. | Composés identifiés | Formule | h/z | RT (min) | Erreur de masse (ppm) | Adduits | Source | ||
| 1 | Stachyose | C24H42O21 | 665.21 | 0.49 | 1.2 | [M-H]- | Un | ||
| 2 | Quercétine-3-O-bêta-glucopyranosyl-7-O-alpha-rhamnopyranoside | C4H9NON2 | 609.14 | 0.61 | 7.16 | [M+H]+ | A, C | ||
| 3 | Imperialine | C27H43NO3 | 430.33 | 2.5 | 0.13 | [M+H]+ | B | ||
| 4 | Spinosine B | C38H40O18 | 783.22 | 2.55 | 0.47 | [M-H]- | F | ||
| 5 | Peimine | C27H45NO3 | 432.35 | 2.62 | 1.19 | [M+H]+ | B | ||
| 6 | Base en flûte + 3O, 2MeO, O-Hex | C23H24O12 | 491.12 | 2.86 | 0.27 | [M-H]- | G | ||
| 7 | Picropodophyllotoxine | C22H22O8 | 415.14 | 3.54 | 2.25 | [M+H]+ | B, E | ||
| 8 | (2S,3R,4S,5S,6R)-2-[(2R,3R,4S,5S,6R)-4,5-dihydroxy-2-[[(3S,5R,8R,10R,12R,13R,14R,17S)-12-hydroxy-17-(2-hydroxy-6-méthylhept-5-en-2-yl)-4,4,8,10,14-pentaméthyl-2,3,5,6,7,9,11,12,13,15,16,17-dodécahydro-1H-cyclopenta[a]phenanthrren-3-yl]oxy]-6-(hydroxyméthyl)oxan-3-yl]oxy-6-(hydroxyméthyl)oxane-3,4,5-triol | C42H72O13 | 785.5 | 4.26 | 8.49 | [M+H]+ | D | ||
| 9 | Tricine | C17H14O7 | 331.08 | 4.67 | 0.85 | [M+H]+ | G | ||
| 10 | Ginsénoside Rg1 | C42H72O14 | 845.49 | 5.83 | 2.16 | [M+FA]- | D | ||
| 11 | (20R)-Ginsénoside Rh1 | C36H62O9 | 683.44 | 5.98 | 1.35 | [M+FA]- | D | ||
| 12 | Jujuboside B | C52H84O21 | 1089.55 | 6.11 | 1.3 | [M+FA]- | F | ||
| 13 | Aucubin | C15H22O9 | 391.12 | 6.71 | 1.11 | [M+FA]- | Un | ||
| 14 | Ginsénoside Rg3 | C42H72O13 | 807.48 | 8.1 | 5.3 | [M+NA]+ | D | ||
| 15 | Acide bêta-élemonique | C30H46O3 | 453.34 | 13.74 | 0.42 | [M-H]- | E | ||
Tableau 1 : Composants absorbés dans le sang après l’administration d’une décoction XY. Le tableau répertorie les composants actifs détectés dans le sang après l’administration de décoction XY : A : Rehmannia glutinosa Libosch (Dihuang), B : Fritillaria thunbergii Miq. (Zhebeimu), C : Trichosanthes kirilowii Maxim. (Tianhuafen), D : Panax ginseng C.A. Mey (Renshen), E : Boswellia carterii Birdw. (Ruxiang), A : Moulin Ziziphus jujuba . var. spinosa (Bunge) (Suanzaoren), G : Phragmites communis Trin. (Lugen).
Discussion
L’incidence du cancer augmente chaque année, suscitant un intérêt clinique et de recherche important22,23. Des études récentes ont démontré l’efficacité de la médecine traditionnelle chinoise (MTC) dans le traitement du cancer du poumon 24,25,26. Par exemple, il a été démontré que la décoction de Maimendong augmente le nombre et l’activité des cellules NK, inhibant ainsi les métastases du cancer du poumon27. De même, la décoction de Mahuang Fuzi Xixin a obtenu des effets thérapeutiques sur le cancer du poumon en influençant plusieurs voies de signalisation28. Cette étude utilise l’analyse LC-MS et des expériences in vivo pour prédire les mécanismes possibles par lesquels la décoction XY exerce des effets thérapeutiques sur l’adénocarcinome pulmonaire.
L’analyse LC-MS a permis d’identifier 15 composants d’entrée dans le sang. Parmi ceux-ci, il a été démontré que la tricine et la picropodophyllotoxine inhibent la résistance aux médicaments et réduisent les niveaux d’expression de p-PRKCA, SPHK1, SPHK2 et EGFR, supprimant ainsi l’activité des cellules cancéreuses du poumon29,30. Le ginsénoside Rg1 et le ginsénoside Rg3, composants du Panax ginseng C.A. Meyer, peuvent bloquer la mitose cellulaire, inhiber la signalisation de la voie mTOR, exercer des effets anti-angiogéniques, améliorer la fonction immunitaire et, en fin de compte, inhiber la croissance tumorale et les métastases tout en réduisant la résistance aux médicaments 31,32,33,34. Le stachyose peut induire l’apoptose dans les cellules cancéreuses intestinales en modulant l’expression des protéines pro-apoptotiques35. L’impérialeline, un alcaloïde aux propriétés anti-inflammatoires et anti-prolifératives, a un potentiel en tant qu’agent antitumoral à un stade précoce36. La peimine peut arrêter le cycle cellulaire en induisant l’apoptose, inhiber la migration cellulaire par le stress du réticulum endoplasmique et réguler l’expression des protéines liées à la voie NF-κB pour supprimer la croissance des cellules cancéreuses du sein et de l’estomac37,38. Il a été rapporté que l’aucubine et le jujuboside B favorisent l’autophagie et l’apoptose dans les cellules tumorales tout en inhibant l’angiogenèse, exerçant ainsi des effets antitumoraux 39,40,41.
La voie MAPK est essentielle à divers processus biologiques, notamment l’activation cellulaire, la prolifération, l’autophagie et l’apoptose. Plusieurs composés détectés dans les composants d’entrée dans le sang de la décoction XY, tels que le ginsenoside Rg1, le ginsenoside Rg3, la peimine et le jujuboside B, peuvent exercer des effets antitumoraux par la voie MAPK 42,43,44,45. La voie MAPK implique les cascades de signalisation ERK, JNK et P38 et est largement étudiée dans la recherche sur le cancer en raison de son rôle dans la régulation des processus physiologiques par l’activation de la cascade protéique de MAP3K-MAP2K-MAPK46,47.
L’activation de la voie ERK stimule la prolifération cellulaire et inhibe l’apoptose en régulant l’activité et l’expression des protéines pro-apoptotiques et anti-apoptotiques aux niveaux transcriptionnel et translationnel48,49. Les inhibiteurs de protéines ciblant la voie ERK ont été largement étudiés et sont utilisés dans le traitement du cancer 50,51,52. Il a également été démontré que les monomères et les formulations de la médecine traditionnelle chinoise (MTC) exercent des effets antitumoraux en modulant la voie ERK. Par exemple, la formule QYHJ inhibe la prolifération et favorise l’apoptose des cellules d’adénocarcinome canalaire pancréatique en régulant l’expression de p-P38 et p-ERK1/253. Les dérivés de l’acide férulique suppriment la prolifération, arrêtent le cycle cellulaire et induisent l’apoptose dans la lignée cellulaire A549 du cancer du poumon humain54.
La voie JNK/P38 joue des rôles distincts en régulant différentes protéines effectrices en aval par phosphorylation, influençant ainsi le cycle cellulaire, la prolifération cellulaire et l’apoptose55,56. Des études ont montré que le triptolide module l’expression de p-P38 et de p-JNK et inhibe la prolifération des cellules A549, exerçant des effets antitumoraux57. De plus, la baicaléine induit l’apoptose dans les cellules HeLa en affectant l’expression58 de p-P38 et p-JNK. Des études in vivo et in vitro ont démontré que l’injection d’Aidi influence l’expression de p-JNK et p-P38 dans les cellules HepG2 et les modèles murins de carcinome hépatocellulaire, inhibant ainsi la prolifération tumorale59.
Le Ki-67 et la caspase 3 sont des indicateurs clés de la prolifération tumorale et de l’apoptose. Ki-67 est une protéine nucléaire qui est fortement exprimée lors de la prolifération cellulaire et qui est absente dans les cellules quiescentes (phase G0)60. Étant donné que le développement tumoral est étroitement lié à la prolifération cellulaire, la recherche sur la corrélation entre Ki-67 et la tumorigenèse a suscité beaucoup d’attention. L’expression de Ki-67 est positivement corrélée avec la malignité, l’agressivité et le pronostic de la tumeur61,62, ce qui en fait un biomarqueur largement utilisé pour la prolifération du cancer63. Il a été largement étudié dans la pathogenèse et le pronostic des cancers gastro-intestinaux, du poumon, du sein et du col de l’utérus 64,65,66,67.
La famille des caspases est constituée d’enzymes protéolytiques qui régulent l’apoptose et l’inflammation. La caspase 3, principalement présente dans le cytoplasme, est un effecteur clé de l’apoptose. Il facilite la mort cellulaire en clivant les protéines du cytosquelette, en inactivant les protéines inhibitrices de l’apoptose et en dégradant les enzymes de réparation de l’ADN 68,69,70. Les altérations de l’expression de la caspase 3 peuvent influencer la sensibilité des cellules tumorales à la chimiothérapie, affectant ainsi l’invasion, les métastases et la progression de divers cancers 71,72,73,74.
Cette étude a démontré que la décoction XY inhibait la prolifération tumorale chez les souris porteuses de tumeurs LLC de manière dose-dépendante. L’analyse pathologique des tissus tumoraux des groupes de traitement XY et DDP a révélé des arrangements cellulaires plus lâches par rapport au groupe M, ainsi qu’une mitose pathologique réduite. De plus, une nécrose et une hémorragie ont été observées dans les tissus tumoraux des groupes de traitement. Les résultats de l’immunohistochimie (IHC) ont en outre confirmé que la décoction XY inhibait la prolifération des cellules tumorales et favorisait l’apoptose de manière dose-dépendante. L’analyse par Western blot des tissus tumoraux a indiqué des changements significatifs dans les niveaux d’expression des protéines clés de la voie MAPK. Dans l’ensemble, les résultats pathologiques et IHC suggèrent que la décoction XY exerce des effets thérapeutiques contre l’adénocarcinome pulmonaire en modulant l’expression des protéines dans la voie de signalisation MAPK.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le point (YDZJ202301ZYTS459) du plan de développement scientifique et technologique de la province de Jilin.
matériels
| Name | Company | Catalog Number | Comments |
| Acetonitrile | CNW Technologies | 5/8/1975 | |
| 2-Chloro-L phenylalanine | Shanghai Hengbo Biotechnology Co., Ltd. | 103616-89-3 | |
| Ammonium Hydroxide Solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | #2028 | |
| Antibody-β-actin | Abcam | ab8228 | |
| Anti-Erk1 (pT202/pY204) + Erk2 (pT185/pY187) Antibody | Abcam | ab4819 | |
| Anti-ERK1/ERK2 Antibody | Abcam | ab184699 | |
| Anti-JNK1 (pY185) + JNK2 (pY185) + JNK3 (pY223) Antibody | Abcam | ab76572 | |
| Anti-JNK1/JNK2/JNK3 Antibody | Abcam | ab208035 | |
| Anti-Ki67 Antibody | Cell Signaling Technology | GB121141 | |
| Anti-p38 (phospho T180) Antibody | Abcam | ab178867 | |
| Anti-p38 alpha/MAPK14 Antibody | Abcam | ab170099 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine Serum Albumin (BSA) | DAKO | BIOFROXX | |
| Broad-spectrum phosphatase inhibitor (100x) | Boster Biological Technology | AR1183 | |
| C57bl/6 mice | Liaoning Changsheng Biotechnology Co., Ltd. | SCXK2021-0006 | |
| Chromatographic column | Waters | ACQUITY UPLC BEH C18 1.7 μm2.1*100 mm | |
| Cisplatin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 232120 | |
| Citrate (pH 6.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2010 | |
| Cover Slip | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 10212432C | |
| Cryogenic Stage | Wuhan Junjie Electronics Co., Ltd. | JB-L5 | |
| DAB Chromogenic Kit | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 2005289 | |
| Decolorization shaker | Beijing Liu Yi Instrument Factory | WD-9405A | |
| Dehydrator | Wuhan Junjie Electronics Co., Ltd. | JJ-12J | |
| Drying Oven | Shanghai Huitai Instrument Manufacturing Co., Ltd. | DHG-9140A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| EDTA (pH 8.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2001 | |
| EDTA (pH 9.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2002 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Eosin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 212954 | |
| Ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 493511 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Formic acid | SIGMA | 64-18-6 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| Hematoxylin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | H3136 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| High-Resolution Mass Spectrometry | Thermo Fisher Scientific | Q Exactive Focus | |
| HRP-conjugated Goat Anti-Mouse | SeraCare | 5220-0341 | |
| HRP-conjugated Goat Anti-Rabbit | SeraCare | 5220-0336 | |
| HRP-conjugated Goat Anti-Rabbit/Mouse Universal Secondary Antibody | DAKO | K5007 | |
| HRP-conjugated Goat Anti-Rat | SeraCare | 5220-0364 | |
| HRP-conjugated Rabbit Anti-Goat | SeraCare | 5220-0362 | |
| Hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | H9892 | |
| Hydrogen Peroxide | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | B12555 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| ImageJ software | National Institutes of Health | v1.8.0 | |
| Imaging System | Nikon (Japan) | NIKON DS-U3 | |
| Lewis lung carcinoma cells | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 90020104 | |
| Mesh cloth | Baijie | 100110779650 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Micropipette | Dlab Scientific Co., Ltd. | KE0003087/KA0056573 | |
| Microscope Slide | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 10212432C | |
| Microtome | Shanghai Leica Instruments Co., Ltd. | RM2016 | |
| Microwave Oven | Galanz Microwave Electrical Appliances Co., Ltd. | P70D20TL-P4 | |
| Neutral Balsam | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 10004160 | |
| Optical microscope | Nikon (Japan) | Nikon Eclipse CI | |
| Oven | Shanghai Huitai Instrument Manufacturing Co., Ltd. | DHG-9140A | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Paraformaldehyde | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 8.18715 | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5X) | Boster Biological Technology | AR1112 | |
| pulverizer | Shangzhiqiao Co., Ltd. | DFT-100A | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Tissue Flotation Workstation | Jinhua Kedi Instrument Equipment Co., Ltd., Zhejiang Province. | KD-P | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1x) | HyClone | J210045 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Upright Optical Microscope | Nikon (Japan) | Nikon Eclipse CI | |
| vacuum lyophilizer | Lanjing Co., Ltd. | HD-LG20D | |
| Vortex mixer | Kylin-Bell | XW-80A | |
| Xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 214736 |
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon