Method Article
Construcción de un modelo de xenoinjerto de adenocarcinoma de pulmón en ratones y evaluación de la eficiencia de la decocción XY a través de la vía MAPK
En este artículo
Resumen
Este estudio demuestra que la decocción XY ejerce efectos terapéuticos contra el adenocarcinoma de pulmón mediante la regulación de la vía MAPK.
Resumen
El adenocarcinoma de pulmón está aumentando en todo el mundo, lo que impulsa la exploración y el desarrollo de métodos de tratamiento eficaces. En los últimos años, se ha reconocido cada vez más el potencial terapéutico de la medicina tradicional china para el adenocarcinoma de pulmón, como la decocción XiaoYi (XY). El mecanismo de acción de la medicina tradicional china en el tratamiento del adenocarcinoma de pulmón continúa siendo dilucidado. En este estudio, se utilizaron modelos animales para investigar los efectos terapéuticos de la decocción XY en el tratamiento del adenocarcinoma de pulmón. Los componentes químicos de entrada en sangre de la decocción XY en ratones se separaron y analizaron en modos de iones positivos y negativos utilizando UHPLC-QE-MS. Los hallazgos se validaron a través de experimentos in vivo , que demostraron una reducción del tamaño del tumor, una mejora de los cambios patológicos y un aumento de la apoptosis. Como resultado, se identificaron quince componentes absorbidos en la sangre después de la administración de la decocción XY: Stachyose, Quercetina-3-O-beta-glucopiranosil-7-O-alfa-ramnopiranósido; Imperialino; Espinosina B; Peiminado; Base de flavona + 3O, 2MeO, O-Hex; Picropodofilotoxina; (2S,3R,4S,5S,6R)-2-[(2R,3R,4S,5S,6R)-4,5-dihidroxi-2 [[(3S,5R,8R,10R,12R,13R,14R,17S)-12-hidroxi-17-(2-hidroxi-6-metilhept-5-en-2-il) 4,4,8,10,14-pentametil-2,3,5,6,7,9,11,12,13,15,16,17-dodecahidro-1H ciclopenta[a]fenantren-3-il]oxi]-6-(hidroximetil)oxano-3-il]oxi-6-(hidroximetil)oxano-3,4,5-triol; Tricina; Ginsenósido Rg1; (20R)-Ginsenósido Rh1; Jujuboside B; Aucubina; Ginsenósido Rg3; y ácido beta-elemonico. Los experimentos con animales demostraron que la decocción XY inhibía el crecimiento tumoral, mejoraba los cambios patológicos y promovía la apoptosis de las células tumorales de manera dependiente de la dosis. Los mecanismos implicados pueden estar relacionados con la regulación positiva de la expresión de las proteínas p-JNK y p-P38 en la vía MAPK y la regulación negativa de la expresión de la proteína p-ERK en la vía MAPK. En conclusión, la decocción XY tiene el potencial de regular la vía MAPK y ejercer efectos terapéuticos contra el adenocarcinoma de pulmón.
Introducción
La incidencia del cáncer de pulmón está aumentando en todo el mundo. Representa el 18% de todas las neoplasias malignas y es responsable de un número significativo de muertes relacionadas con el cáncer 1,2. El cáncer de pulmón de células no pequeñas (CPCNP) es una forma prevalente de cáncer de pulmón, con el adenocarcinoma como principal tipo patológico3. Debido a sus síntomas insidiosos, el CPNM a menudo se diagnostica en una etapa avanzada y tiene una alta tasa de mortalidad 4,5. Los pacientes con CPCNP en estadio IV tienen una tasa de supervivencia a cinco años de solo el 5%6, mientras que incluso el CPCNP en estadio temprano resecable quirúrgicamente tiene una tasa de supervivencia a cinco años de solo el 50%7.
Actualmente, el tratamiento del adenocarcinoma de pulmón incluye cirugía, radioterapia, quimioterapia, inmunoterapia y terapia dirigida. Además, la medicina tradicional china (MTC) para el adenocarcinoma de pulmón está siendo cada vez más reconocida y valorada8. La medicina tradicional china tiene una larga historia y se ha utilizado en el tratamiento de diversas enfermedades oncológicas con resultados terapéuticos efectivos 9,10. Considera el cuerpo humano como una entidad completa, con el principio terapéutico centrado en restaurar el movimiento del Qi (Qi se refiere a la energía vital que promueve la circulación de la sangre y los fluidos corporales, contribuyendo a mejorar la inmunidad y reducir la inflamación en pacientes con NSCLC) en los órganos internos para restaurar el equilibrio general e inhibir la progresión del cáncer.
La MTC no solo trata enfermedades oncológicas de baja toxicidad, múltiples dianas y alta eficiencia11, sino que también facilita la reparación del daño causado por la radioterapia y la quimioterapia, prolongando así la supervivencia12.
La tecnología de cromatografía líquida-espectrometría de masas (LC-MS) integra la cromatografía líquida con la espectrometría de masas para lograr la separación y detección de componentes en mezclas de compuestos complejos13. LC-MS ofrece alta resolución, alta sensibilidad y alta especificidad, lo que permite la separación e identificación de varios componentes químicos en las decocciones de la medicina tradicional china (MTC). Cuando se combina con la química medicinal sérica, que separa y detecta los componentes activos de entrada a la sangre después de la administración oral14,15, la LC-MS permite la predicción y el análisis de los posibles mecanismos de acción de los fármacos. Este enfoque ayuda a comprender la composición química y los componentes farmacológicos de las decocciones de la MTC, proporcionando datos esenciales para la investigación en profundidad sobre sus efectos farmacológicos y aplicaciones clínicas, lo que lo hace altamente aplicable en la investigación de la MTC16,17.
La vía de señalización MAPK desempeña un papel crucial en la génesis, progresión, metástasis e invasión del cáncer de pulmón, con Erk, p38 y JNK como subfamilias importantes. Se ha demostrado que las decocciones de la MTC influyen en la expresión de proteínas en la vía MAPK18. La decocción de XiaoYi (XY) se deriva de la decocción de YiGuan y se utiliza para tratar el adenocarcinoma de pulmón en el Primer Hospital Afiliado de la Universidad de Medicina China de Changchun (Figura 1), lo que demuestra una eficacia clínica precisa. Sin embargo, su mecanismo terapéutico sigue sin estar claro.
En este estudio, se empleó cromatografía líquida de ultra alta resolución junto con espectrometría de masas Q-Exactive Orbitrap (UHPLC-QE-MS) para dilucidar el posible mecanismo terapéutico de la decocción XY contra el adenocarcinoma de pulmón, y sus efectos se validaron mediante estudios in vivo .
Protocolo
Todos los procedimientos con animales fueron aprobados por el Comité de Ética Animal de la Universidad de Medicina Tradicional China de Changchun (Ética No. 2024008). Los ratones machos C57BL/6 de seis semanas de edad (20 ± 2 g), criados en condiciones específicas libres de patógenos (SPF), exhibieron patrones típicos de actividad física en un ambiente controlado con temperatura y humedad constantes. Tenían acceso ad libitum a alimentos y agua y se mantenían bajo un ciclo de luz/oscuridad de 12 horas. Los detalles de los reactivos y equipos utilizados en este estudio se proporcionan en la Tabla de Materiales.
1. Preparación del extracto acuoso de decocción XY
- Coloque Panax ginseng C.A. Mey (Renshen, 15 g), Chinemys reevesii (Gray) (Guiban, 30 g) y Trionyx sinensis Wiegmann (Biejia, 30 g) en una olla de decocción. Añadir 1000 mL de agua desionizada y remojar durante 30 min a temperatura ambiente.
- Hervir las tres hierbas del paso 1.1 durante 1 h. Al mismo tiempo, remojar Rehmannia glutinosa Libosch (Dihuang, 30 g), Trichosanthes kirilowii Maxim. (Tianhuafen, 30 g), Coix lacryma-jobi L. var. mayuen (Roman.) Stapf (Yiyiren, 20 g), Paeonia lactiflora Pall. (Baishao, 30 g), Boswellia carterii Birdw. (Ruxiang, 7 g), Commiphora myrrha Engl. (Moyao, 7 g), Agrimonia pilosa Ledeb. (Xianhecao, 20 g), Alpinia oxyphylla Miq. (Yizhiren, 20 g), Molino de Ziziphus jujuba . spinosa (Bunge) (Suanzaoren, 30 g), Meliá toosendan Sieb. et Zucc. (Chuanlianzi, 5 g), Fritillaria thunbergii Miq. (Zhebeimu, 15 g), Anemarrhena asphodeloides Bge. (Zhimu, 10 g), Platycodon grandiflorum (Jacq.) (Jiegeng, 10 g), Polygala tenuifolia Willd. (Yuanzhi, 15 g), y Phragmites communis Trin. (Lugen, 30 g) en otro envase durante 30 min. Después de remojar, transfiéralos a la maceta de decocción del paso 1.1.
- Hervir las 18 hierbas de los pasos 1.1 y 1.2 durante 30 min. Vierta el líquido de hierbas, agregue 1000 ml de agua desionizada y hierva durante otros 30 minutos. Repita este proceso de ebullición tres veces para obtener tres porciones de líquido de hierbas, luego combínelas y mézclelas bien.
- Filtre el líquido herbal mezclado a través de un paño de malla 400. Concentre el filtrado a presión reducida, luego transfiera el líquido herbal concentrado a un equipo de enfriamiento para su posterior procesamiento.
- Vierta el líquido herbal concentrado en una bandeja de liofilización y colóquelo en la cámara de precongelación de un liofilizador al vacío. Una vez finalizada la precongelación, transfiera la bandeja a la cámara de secado por sublimación para eliminar el agua.
- Elimine la humedad residual a alta temperatura. Pulverizar el extracto de hierbas liofilizado con un pulverizador para obtener polvo fino de decocción XY liofilizado (Figura 2).
2. Preparación de suero que contiene medicamentos
- Asigne aleatoriamente ratones machos C57BL/6 de seis semanas de edad (20 ± 2 g) al grupo XiaoYi (XY) o al grupo de control.
NOTA: La dosis en ratones se calculó utilizando el factor de conversión de humano a ratón:
Dosis experimental equivalente para ratones (g/kg) = {Dosis humana (g/kg) / Peso corporal (70 kg)} x 9,1
Sobre la base de este cálculo, se determinó que la dosis para ratones era de 2,6 g/kg. - Pesar 0,9152 g de polvo de decocción XY liofilizado y disolverlo en 3,2 mL de agua destilada para preparar la solución del fármaco.
NOTA: Los ratones se ayunaron durante 12 h antes de la administración oral. - Administrar la decocción XY a los ratones del grupo XY mediante sonda nasogástrica, mientras se administra al grupo de control un volumen equivalente de agua desionizada.
- 2 h después de la administración oral, anestesiar a los ratones con pentobarbital sódico (siguiendo los protocolos aprobados institucionalmente). Enuclear los globos oculares con pinzas para recolectar muestras de sangre, luego sacrificar a los ratones mediante asfixia por CO2 seguida de luxación cervical siguiendo las pautas éticas19.
- Deje que las muestras de sangre se estabilicen a temperatura ambiente durante 90 minutos. Centrifugar a 3450 x g (4 °C) durante 15 min para recoger el sobrenadante.
3. Análisis UHPLC-QE-MS
- Añadir 100 mg de polvo liofilizado de decocción XY a 500 μL de solución de extracción (metanol: agua = 4:1). Mezclar bien, sonicalar e incubar en un baño de agua helada durante 1 h.
- Mantenga la mezcla a -40 °C durante 1 h, luego centrifugue a 13,800 x g (4 °C) durante 15 min. Filtre el sobrenadante a través de una membrana filtrante de 0,22 μm, luego combine 100 μL de cada sobrenadante para crear muestras de control de calidad (QC).
- Después de descongelar las muestras de plasma, tome 400 μL de la muestra de plasma del grupo de control y 400 μL de las muestras de plasma del grupo XY. Añadir 40 μL de ácido clorhídrico (2 mol/L) a cada muestra. Vórtice durante 1 min y deje reposar la mezcla a 4 °C durante 15 min. Repita este paso cuatro veces.
- Añadir 1,6 mL de acetonitrilo y vórtice durante 5 min. Centrifugar a 13.800 x g durante 5 min a 4 °C. Someter 1.800 μL del sobrenadante a secado con nitrógeno.
- Reconstituya las muestras secas en 150 μL de metanol al 80% que contenga 10 μg/mL del patrón interno mediante vórtice durante 5 min. Centrifugar a 13.800 × g durante 5 min a 4 °C, luego transferir 120 μL del sobrenadante a un vial de vidrio fresco para el análisis de LC-MS (Figura 3).
4. Cultivo celular y preparación animal
- Siembre 1 mL de células de carcinoma de pulmón de Lewis en una placa de cultivo que contiene el medio Eagle Modificado de Dulbecco (DMEM) suplementado con un 10% de suero fetal bovino y un 1% de penicilina/estreptomicina. Incubar las células en condiciones controladas a 37 °C con 5% de CO2.
- Cuando las células alcancen el 80% de confluencia, hágalas pasar utilizando tripsina al 0,25%. Continúe el paso hasta que el estado de la célula se estabilice, luego ajuste la concentración de la célula a 3 x 106 células/mL.
- Inyecte 0,1 mL de la suspensión celular preparada por vía subcutánea en la axila derecha de ratones machos C57BL/6 para establecer el modelo de adenocarcinoma de pulmón.
NOTA: El tejido tumoral se puede palpar en la axila de los ratones 5 días después de la inoculación. - Después de 5 días, divida aleatoriamente los ratones en cinco grupos (n = 6 por grupo): Grupo modelo (M) - Sin tratamiento; Grupo de baja dosis de decocción XY (XY-L) - 1,3 g/kg; grupo de dosis media de decocción XY (XY-Z) - 2,6 g/kg; Grupo de alta dosis de decocción XY (XY-H) - 5,2 g/kg; Grupo del cisplatino (DDP) - Tratado con cisplatino20.
- Disolver el polvo de decocción XY en 200 μL de agua destilada a la dosis correspondiente y administrarlo por sonda nasogástrica. Los grupos M y DDP reciben un volumen igual de agua destilada a través de sonda nasogástrica.
- Administrar cisplatino al grupo DDP mediante inyección intraperitoneal (3 mg/kg) una vez cada 3 días. Inyectar el mismo volumen de solución salina fisiológica en los otros grupos.
5. Análisis anatomopatológico del tejido tumoral
- Después de 21 días, sacrificar a todos los ratones utilizando asfixia por CO2 seguida de luxación cervical (siguiendo las pautas éticas) y extirpar el tejido tumoral21. Medir el volumen y el peso del tumor (Figura 4).
- Fijar los tejidos tumorales extirpados en paraformaldehído al 4% durante 24 h). Deshidratar el tejido utilizando soluciones de etanol graduadas.
- Limpie los bloques de tejido deshidratado con xileno, luego insértelos en cera de parafina derretida. Deja que la cera se solidifique en un bloque de parafina. Divida el bloque de tejido en rodajas de 5 μm de grosor con un micrótomo.
- Desparafinar las secciones de tejido en xileno, seguido de rehidratación en soluciones de etanol graduadas. Tiñe las secciones con hematoxilina durante 5 minutos, luego enjuaga con agua desionizada.
- Contratiñir las secciones con una solución de eosina al 0,5% durante 1 min. Observe las secciones teñidas bajo un microscopio óptico y capture imágenes para su análisis.
6. Análisis inmunohistoquímico del tejido tumoral
- Realice el desparafinado y la rehidratación siguiendo los procedimientos descritos en los pasos 5.2-5.4.
- Incubar las secciones en un bloqueador de peroxidasa endógeno a temperatura ambiente durante 15 min. Bloquee la unión inespecífica incubando las secciones con suero de cabra.
- Aplicar los anticuerpos primarios: Ki-67 (1:600) y Caspasa-3 (1:100). Incubar las secciones durante la noche a 4 °C. Lavar con tampón PBS), luego aplicar un anticuerpo secundario de uso general (1:500) e incubar a 37 °C durante 30 min.
- Desarrolle la reacción de color agregando una solución DAB. Contratiñe las secciones con una solución de hematoxilina.
- Realizar la deshidratación, limpieza y sellado de las secciones manchadas. Observe la expresión de proteínas bajo un microscopio óptico y capture imágenes para su análisis.
7. Análisis de Western blot
- Homogeneizar los tejidos tumorales mediante un lisador de tejidos. Extraiga la proteína total y determine su concentración utilizando un kit de ensayo de ácido bicinconínico (BCA) (ver Tabla de Materiales).
- Realizar la cuantificación de proteínas, seguida de la electroforesis SDS-PAGE y la transferencia de proteínas a una membrana.
- Incubar la membrana durante la noche a 4 °C con anticuerpos primarios: P38 (1:2000), p-P38 (1:1000), ERK (1:20000), p-ERK (1:500), JNK (1:2000), p-JNK (1:5000), β-actina (1:200) (ver Tabla de Materiales).
- Al día siguiente, incubar la membrana con un anticuerpo secundario conjugado con peroxidasa de rábano picante (HRP) a temperatura ambiente durante 1,5 h. Detecte bandas de proteínas mediante un sistema de quimioluminiscencia mejorada (ECL).
NOTA: Las intensidades de las bandas de proteínas se cuantificaron utilizando el software ImageJ.
Resultados
Las muestras de solución y suero en polvo XY del grupo de control y del grupo XY se analizaron utilizando UHPLC-QE-MS, revelando picos bien separados. Los diagramas de ionización total para los modos de iones positivos y negativos se muestran en la Figura 3. La composición de la decocción XY se identificó en función del tiempo de retención, el modo de adquisición y los fragmentos del espectro de masas. Se identificaron quince componentes de entrada sanguínea comparando el suero de los grupos de administración oral de decocción en blanco y XY con los componentes de la solución de polvo XY (Tabla 1).
El gráfico de líneas de volumen tumoral indica que después de 21 días de sonda nasogástrica con decocción XY, el volumen tumoral en ratones disminuyó en comparación con el grupo M y mostró un efecto dependiente de la dosis (Figura 4). La histopatología tumoral se observó mediante tinción con H&E (Figura 5). En el grupo M, las células tumorales estaban densamente dispuestas y exhibían proliferación activa, con abundante mitosis patológica. A medida que aumentaba la dosis de decocción XY, la disposición de las células tumorales se escaseaba gradualmente y el espacio intercelular aumentaba. Se observaron diversos grados de necrosis en los tejidos tumorales y la mitosis patológica fue rara21.
Para verificar los efectos de la decocción XY en la proliferación y apoptosis de tejidos tumorales en ratones, se realizaron experimentos de inmunohistoquímica (IHC). Después de la tinción con anticuerpos Ki-67 y caspasa 3, se observaron partículas dispersas de color amarillo parduzco en las secciones de tejido tumoral. En comparación con el grupo M, los niveles de Ki-67 en los tejidos tumorales de los grupos XY y DDP disminuyeron secuencialmente, mientras que los niveles de caspasa 3 aumentaron (Figura 6).
Para determinar si la decocción XY ejerce efectos terapéuticos sobre el adenocarcinoma de pulmón a través de la vía MAPK, se realizó un análisis de Western blot en tejidos tumorales de ratones. Como se muestra en la Figura 7, el tratamiento con decocción XY condujo a una disminución en la expresión de p-ERK, con el grupo XY-H mostrando una diferencia significativa en comparación con el grupo M (p < 0,001). Los niveles de p-JNK y p-P38 aumentaron en el grupo XY-H en comparación con el grupo M, observándose diferencias estadísticamente significativas en el grupo XY-H (p < 0,01) y en el grupo DDP (p < 0,05) en comparación con el grupo M. Además, la diferencia entre los grupos DDP y XY-H fue estadísticamente significativa.

Figura 1: Componentes de la decocción XY. Esta figura presenta los medicamentos individuales contenidos en la decocción XY. Haga clic aquí para ver una versión más grande de esta figura.
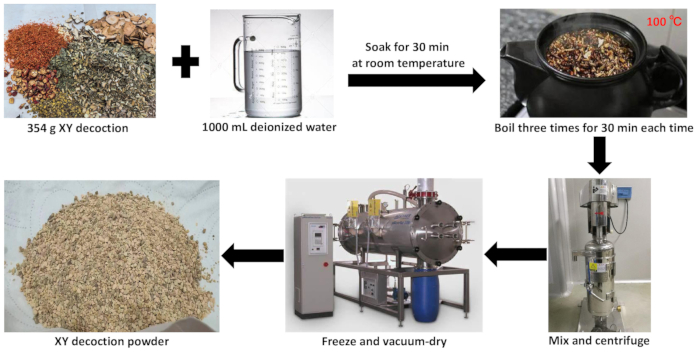
Figura 2: Preparación del extracto acuoso de decocción XY. Esta figura ilustra el proceso de preparación del extracto acuoso de la decocción XY. Haga clic aquí para ver una versión más grande de esta figura.
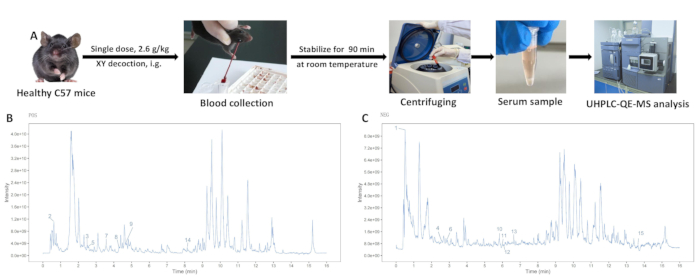
Figura 3: Análisis del extracto acuoso de decocción XY. (A) El proceso de extracción del suero que contiene drogas. (B) Análisis de espectrometría de masas en modo de iones positivos. (C) Análisis de espectrometría de masas en modo de iones negativos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Efectos de la decocción XY en el volumen y la morfología del tumor en ratón. (A) Cultivo celular, implantación tumoral y procedimientos de muestreo. (B) Gráfico de líneas que representa el volumen del tumor a lo largo del tiempo. (C) Morfología del tumor después de 21 días de tratamiento con sonda nasogástrica. Haga clic aquí para ver una versión más grande de esta figura.
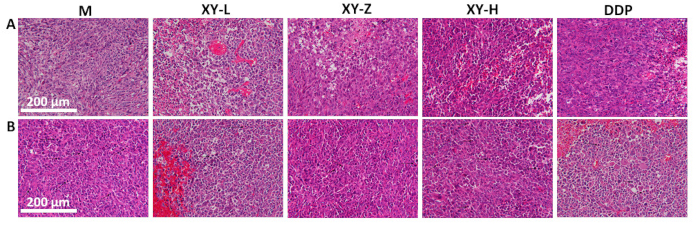
Figura 5: Análisis histológico de tejidos tumorales de ratón. (A) La disposición del tejido tumoral se vuelve más escasa con dosis crecientes de decocción XY, con signos de necrosis de manera dependiente de la dosis. (B) Mitosis patológica en los tejidos tumorales, mostrando una disminución de la mitosis patológica con dosis crecientes de decocción XY. Barras de escala: 200 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Niveles de expresión de Ki-67 y Caspasa-3. (A) Niveles de expresión de Ki-67. (B) Niveles de expresión de caspasa-3. Barras de escala: 400 μm. (C) Cuantificación de áreas positivas para Ki-67, mostrando una disminución con el aumento de las dosis de decocción XY. (D) Cuantificación de áreas positivas para caspasa-3, mostrando un aumento con dosis crecientes de decocción XY. p < 0,001, ****p < 0,0001; ns, no significativo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Niveles de expresión de proteínas en la vía MAPK. (A) Análisis de Western blot de la expresión de proteínas. (B) Niveles de expresión de ERK. (C) niveles de expresión de p-ERK. (D) Niveles de expresión de JNK. (E) niveles de expresión de p-JNK. (F) Niveles de expresión de P38. (G) Niveles de expresión de p-P38. La decocción XY reguló al alza la expresión de las proteínas p-JNK y p-P38 mientras regulaba a la baja la expresión de p-ERK. *p < 0,05, **p < 0,01, ***p < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
| NO. | Compuestos identificados | Fórmula | m/z | RT (min) | Error de masa (ppm) | Aductos | Fuente | ||
| 1 | Estaquiosa | C24H42O21 | 665.21 | 0.49 | 1.2 | [De lunes a viernes]- | Un | ||
| 2 | Quercetina-3-O-beta-glucopiranosil-7-O-alfa-ramnopiranósido | C4H9Nº2 | 609.14 | 0.61 | 7.16 | [M+H]+ | A, C | ||
| 3 | Imperialino | C27H43Nº3 | 430.33 | 2.5 | 0.13 | [M+H]+ | B | ||
| 4 | Espinosina B | C38H40O18 | 783.22 | 2.55 | 0.47 | [De lunes a viernes]- | F | ||
| 5 | Peimine | C27H45Nº3 | 432.35 | 2.62 | 1.19 | [M+H]+ | B | ||
| 6 | Base de flavona + 3O, 2MeO, O-Hex | C23H24O12 | 491.12 | 2.86 | 0.27 | [De lunes a viernes]- | G | ||
| 7 | Picropodofilotoxina | C22H22O8 | 415.14 | 3.54 | 2.25 | [M+H]+ | B, E | ||
| 8 | (2S,3R,4S,5S,6R)-2-[(2R,3R,4S,5S,6R)-4,5-dihidroxi-2-[[(3S,5R,8R,10R,12R,13R,14R,17S)-12-hidroxi-17-(2-hidroxi-6-metilhept-5-en-2-il)-4,4,8,10,14-pentametil-2,3,5,6,7,9,11,12,13,15,16,17-dodecahidro-1H-ciclopenta[a]fenantren-3-il]oxi]-6-(hidroximetil)oxano-3-il]oxi-6-(hidroximetil)oxano-3,4,5-triol | C42H72O13 | 785.5 | 4.26 | 8.49 | [M+H]+ | D | ||
| 9 | Tricina | C17H14O7 | 331.08 | 4.67 | 0.85 | [M+H]+ | G | ||
| 10 | Ginsenósido RG1 | C42H72O14 | 845.49 | 5.83 | 2.16 | [M+FA]- | D | ||
| 11 | (20R)-Ginsenósido Rh1 | C36H62O9 | 683.44 | 5.98 | 1.35 | [M+FA]- | D | ||
| 12 | Jujuboside B | C52H84O21 | 1089.55 | 6.11 | 1.3 | [M+FA]- | F | ||
| 13 | Aucubin | C15H22O9 | 391.12 | 6.71 | 1.11 | [M+FA]- | Un | ||
| 14 | Ginsenósido RG3 | C42H72O13 | 807.48 | 8.1 | 5.3 | [M+NA]+ | D | ||
| 15 | Ácido beta-elemonico | C30H46O3 | 453.34 | 13.74 | 0.42 | [De lunes a viernes]- | E | ||
Tabla 1: Componentes absorbidos en la sangre después de la administración de la decocción XY. La tabla enumera los componentes activos detectados en la sangre después de la administración de la decocción XY: A: Rehmannia glutinosa Libosch (Dihuang), B: Fritillaria thunbergii Miq. (Zhebeimu), C: Trichosanthes kirilowii Maxim. (Tianhuafen), D: Panax ginseng C.A. Mey (Renshen), E: Boswellia carterii Birdw. (Ruxiang), F: Molino de Ziziphus jujuba. spinosa (Bunge) (Suanzaoren), G: Phragmites communis Trin. (Lugen).
Discusión
La incidencia del cáncer aumenta cada año, atrayendo un importante interés clínico y de investigación22,23. Estudios recientes han demostrado la eficacia de la medicina tradicional china (MTC) en el tratamiento del cáncer de pulmón 24,25,26. Por ejemplo, se ha demostrado que la decocción de Maimendong aumenta el número y la actividad de las células NK, inhibiendo así la metástasis del cáncer de pulmón27. Del mismo modo, la decocción de Mahuang Fuzi Xixin ha logrado efectos terapéuticos sobre el cáncer de pulmón al influir en múltiples vías de señalización28. Este estudio utiliza el análisis de LC-MS y experimentos in vivo para predecir los posibles mecanismos por los cuales la decocción XY ejerce efectos terapéuticos sobre el adenocarcinoma de pulmón.
El análisis de LC-MS identificó 15 componentes de entrada en la sangre. Entre ellas, se ha demostrado que la tricina y la picropodofilotoxina inhiben la resistencia a los fármacos y reducen los niveles de expresión de p-PRKCA, SPHK1, SPHK2 y EGFR, suprimiendo así la actividad de las células de cáncer de pulmón29,30. El ginsenósido Rg1 y el ginsenósido Rg3, componentes del Panax ginseng C.A. Meyer, pueden bloquear la mitosis celular, inhibir la señalización de la vía mTOR, ejercer efectos antiangiogénicos, mejorar la función inmunitaria y, en última instancia, inhibir el crecimiento tumoral y la metástasis, al tiempo que reducen la resistencia a los medicamentos 31,32,33,34. Stachyose puede inducir la apoptosis en células de cáncer intestinal mediante la modulación de la expresión de proteínas proapoptóticas35. La imperialina, un alcaloide con propiedades antiinflamatorias y antiproliferativas, tiene potencial como agente antitumoral en etapa temprana36. La peimina puede detener el ciclo celular al inducir la apoptosis, inhibir la migración celular a través del estrés del retículo endoplásmico y regular la expresión de proteínas relacionadas con la vía NF-κB para suprimir el crecimiento de células de cáncer de mama y gástrico37,38. Se ha reportado que la aucubina y el jujubosido B promueven la autofagia y la apoptosis en las células tumorales mientras inhiben la angiogénesis, ejerciendo así efectos antitumorales 39,40,41.
La vía MAPK es esencial para varios procesos biológicos, incluida la activación celular, la proliferación, la autofagia y la apoptosis. Varios compuestos detectados en los componentes de entrada de sangre de la decocción XY, como el ginsenósido Rg1, el ginsenósido Rg3, la peimina y el jujubosido B, pueden ejercer efectos antitumorales a través de la vía MAPK 42,43,44,45. La vía MAPK involucra las cascadas de señalización ERK, JNK y P38 y es ampliamente estudiada en la investigación del cáncer debido a su papel en la regulación de los procesos fisiológicos a través de la activación en cascada de proteínas de MAP3K-MAP2K-MAPK46,47.
La activación de la vía ERK estimula la proliferación celular e inhibe la apoptosis mediante la regulación de la actividad y expresión de proteínas proapoptóticas y antiapoptóticas a nivel transcripcional y traduccional48,49. Los inhibidores de proteínas dirigidos a la vía ERK han sido ampliamente estudiados y se utilizan en el tratamiento del cáncer 50,51,52. También se ha demostrado que los monómeros y formulaciones de la medicina tradicional china (MTC) ejercen efectos antitumorales al modular la vía ERK. Por ejemplo, la fórmula QYHJ inhibe la proliferación y promueve la apoptosis de las células de adenocarcinoma ductal pancreático mediante la regulación de la expresión de p-P38 y p-ERK1/253. Los derivados del ácido ferúlico suprimen la proliferación, detienen el ciclo celular e inducen la apoptosis en la línea celular de cáncer de pulmón humano A54954.
La vía JNK/P38 desempeña distintas funciones al regular diferentes proteínas efectoras posteriores a través de la fosforilación, influyendo así en el ciclo celular, la proliferación celular y la apoptosis55,56. Los estudios han demostrado que el triptólido modula la expresión de p-P38 y p-JNK e inhibe la proliferación de las células A549, ejerciendo efectos antitumorales57. Además, la baicaleína induce la apoptosis en las células HeLa al afectar la expresión de p-P38 y p-JNK58. Estudios in vivo e in vitro han demostrado que la inyección de Aidi influye en la expresión de p-JNK y p-P38 en células HepG2 y modelos de ratón con carcinoma hepatocelular, inhibiendo así la proliferacióntumoral 59.
El Ki-67 y la caspasa 3 son indicadores clave de proliferación tumoral y apoptosis. El Ki-67 es una proteína nuclear que se expresa en gran medida durante la proliferación celular y está ausente en las células inactivas (fase G0)60. Dado que el desarrollo tumoral está estrechamente relacionado con la proliferación celular, la investigación sobre la correlación entre el Ki-67 y la tumorigénesis ha ganado mucha atención. La expresión de Ki-67 se correlaciona positivamente con la malignidad, la agresividad y el pronóstico del tumor61,62, lo que lo convierte en un biomarcador ampliamente utilizado para la proliferación del cáncer63. Ha sido ampliamente estudiado en la patogénesis y pronóstico de los cánceres gastrointestinal, de pulmón, de mama y de cuello uterino 64,65,66,67.
La familia de las caspasas está formada por enzimas proteolíticas que regulan la apoptosis y la inflamación. La caspasa 3, que se encuentra principalmente en el citoplasma, es un efector clave de la apoptosis. Facilita la muerte celular mediante la escisión de las proteínas del citoesqueleto, la inactivación de las proteínas inhibidoras de la apoptosis y la degradación de las enzimas de reparación del ADN 68,69,70. Las alteraciones en la expresión de la caspasa 3 pueden influir en la sensibilidad de las células tumorales a la quimioterapia, afectando así a la invasión, la metástasis y la progresión de diversos cánceres 71,72,73,74.
Este estudio demostró que la decocción XY inhibió la proliferación tumoral en ratones portadores de tumores LLC de una manera dependiente de la dosis. El análisis anatomopatológico de los tejidos tumorales de los grupos de tratamiento XY y DDP reveló una disposición celular más laxa en comparación con el grupo M, junto con una mitosis patológica reducida. Además, se observó necrosis y hemorragia en los tejidos tumorales de los grupos de tratamiento. Los resultados de la inmunohistoquímica (IHQ) confirmaron además que la decocción XY inhibió la proliferación de células tumorales y promovió la apoptosis de manera dependiente de la dosis. El análisis de Western blot de los tejidos tumorales indicó cambios significativos en los niveles de expresión de proteínas clave en la vía MAPK. En general, los hallazgos patológicos y de IHQ sugieren que la decocción XY ejerce efectos terapéuticos contra el adenocarcinoma de pulmón al modular la expresión de proteínas en la vía de señalización MAPK.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Plan de Desarrollo Científico y Tecnológico de la Provincia de Jilin (YDZJ202301ZYTS459).
Materiales
| Name | Company | Catalog Number | Comments |
| Acetonitrile | CNW Technologies | 5/8/1975 | |
| 2-Chloro-L phenylalanine | Shanghai Hengbo Biotechnology Co., Ltd. | 103616-89-3 | |
| Ammonium Hydroxide Solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | #2028 | |
| Antibody-β-actin | Abcam | ab8228 | |
| Anti-Erk1 (pT202/pY204) + Erk2 (pT185/pY187) Antibody | Abcam | ab4819 | |
| Anti-ERK1/ERK2 Antibody | Abcam | ab184699 | |
| Anti-JNK1 (pY185) + JNK2 (pY185) + JNK3 (pY223) Antibody | Abcam | ab76572 | |
| Anti-JNK1/JNK2/JNK3 Antibody | Abcam | ab208035 | |
| Anti-Ki67 Antibody | Cell Signaling Technology | GB121141 | |
| Anti-p38 (phospho T180) Antibody | Abcam | ab178867 | |
| Anti-p38 alpha/MAPK14 Antibody | Abcam | ab170099 | |
| BCA protein concentration assay kit | Boster Biological Technology | 17E17B46 | |
| Bovine Serum Albumin (BSA) | DAKO | BIOFROXX | |
| Broad-spectrum phosphatase inhibitor (100x) | Boster Biological Technology | AR1183 | |
| C57bl/6 mice | Liaoning Changsheng Biotechnology Co., Ltd. | SCXK2021-0006 | |
| Chromatographic column | Waters | ACQUITY UPLC BEH C18 1.7 μm2.1*100 mm | |
| Cisplatin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 232120 | |
| Citrate (pH 6.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2010 | |
| Cover Slip | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 10212432C | |
| Cryogenic Stage | Wuhan Junjie Electronics Co., Ltd. | JB-L5 | |
| DAB Chromogenic Kit | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 2005289 | |
| Decolorization shaker | Beijing Liu Yi Instrument Factory | WD-9405A | |
| Dehydrator | Wuhan Junjie Electronics Co., Ltd. | JJ-12J | |
| Drying Oven | Shanghai Huitai Instrument Manufacturing Co., Ltd. | DHG-9140A | |
| Dulbecco's modified eagle medium | Gibco | 8121587 | |
| EDTA (pH 8.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2001 | |
| EDTA (pH 9.0) Antigen Retrieval Solution | Wuhan Baiqiandu Biotechnology Co., Ltd. | B2002 | |
| Electrophoresis buffer | NCM Biotech | 20230801 | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd. | JB-P5 | |
| Eosin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 212954 | |
| Ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 493511 | |
| Fetal bovine serum | Gibco | 2166090RP | |
| Formic acid | SIGMA | 64-18-6 | |
| GraphPad Prism software | GraphPad software, LLC | Version 9.0.0 | |
| Hematoxylin | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | H3136 | |
| High performance liquid chromatography | Agilent | 1260 Infinity II Prime | |
| High speed refrigerated centrifuge | Thermo Fisher Scientific | Legend Micro 17R | |
| High-Resolution Mass Spectrometry | Thermo Fisher Scientific | Q Exactive Focus | |
| HRP-conjugated Goat Anti-Mouse | SeraCare | 5220-0341 | |
| HRP-conjugated Goat Anti-Rabbit | SeraCare | 5220-0336 | |
| HRP-conjugated Goat Anti-Rabbit/Mouse Universal Secondary Antibody | DAKO | K5007 | |
| HRP-conjugated Goat Anti-Rat | SeraCare | 5220-0364 | |
| HRP-conjugated Rabbit Anti-Goat | SeraCare | 5220-0362 | |
| Hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | H9892 | |
| Hydrogen Peroxide | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | B12555 | |
| Hypersensitive ECL chemiluminescence kit | NCM Biotech | P10300 | |
| ImageJ software | National Institutes of Health | v1.8.0 | |
| Imaging System | Nikon (Japan) | NIKON DS-U3 | |
| Lewis lung carcinoma cells | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 90020104 | |
| Mesh cloth | Baijie | 100110779650 | |
| Metal heating temperature control instrument | Baiwan Electronictechnology Co., Ltd. | HG221-X3 | |
| Methanol | Aladdin | M116118 | |
| Micropipette | Dlab Scientific Co., Ltd. | KE0003087/KA0056573 | |
| Microscope Slide | Jiangsu Shitai Laboratory Equipment Co., Ltd. | 10212432C | |
| Microtome | Shanghai Leica Instruments Co., Ltd. | RM2016 | |
| Microwave Oven | Galanz Microwave Electrical Appliances Co., Ltd. | P70D20TL-P4 | |
| Neutral Balsam | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 10004160 | |
| Optical microscope | Nikon (Japan) | Nikon Eclipse CI | |
| Oven | Shanghai Huitai Instrument Manufacturing Co., Ltd. | DHG-9140A | |
| PAGE gel rapid preparation kit | Biosharp | PL566B-5 | |
| Paraformaldehyde | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 8.18715 | |
| Phosphate buffered saline (1x) | Gibco | 8120485 | |
| Pre-stained color protein marker (10-180 kDa) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW176-02 | |
| Protein loading buffer (5X) | Boster Biological Technology | AR1112 | |
| pulverizer | Shangzhiqiao Co., Ltd. | DFT-100A | |
| PVDF (0.45 μm) | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW120-01 | |
| Rapid membrane transfer solution | Cywin Innovation (Beijing) Biotechnology Co., Ltd. | SW171-02 | |
| RIPA lysate | Boster Biological Technology Co., Ltd. | AR0105 | |
| TBS buffer | NCM Biotech | 23HA0102 | |
| Tissue Flotation Workstation | Jinhua Kedi Instrument Equipment Co., Ltd., Zhejiang Province. | KD-P | |
| Transmembrane buffer | NCM Biotech | 23CA2000 | |
| Trypsin (0.25%, 1x) | HyClone | J210045 | |
| Ultrasonic cell disruption apparatus | Ningbo Xinyi ultrasonic equipment Co., Ltd. | JY92-IIDN | |
| Upright Optical Microscope | Nikon (Japan) | Nikon Eclipse CI | |
| vacuum lyophilizer | Lanjing Co., Ltd. | HD-LG20D | |
| Vortex mixer | Kylin-Bell | XW-80A | |
| Xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd. | 214736 |
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados