Method Article
Kemirgenlerde Laminer Politrodlar ve Optogenetiğin Mikro Elektrokortikografi ile Entegre Edilmesi ile Kortikal İşlemenin Çok Ölçekli Araştırılması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, sıçanlarda ve farelerde yüksek yoğunluklu mikro-elektrokortikografi (μEcoG) kaydı için cerrahi, implantasyon ve kayıt yöntemleri dahil olmak üzere iki protokol sunuyoruz. μECoG kayıtları, sıçan işitsel korteksinde laminer politrod kaydı veya fare somatosensoriyel korteksindeki nöral aktivitenin optogenetik manipülasyonu ile kombinasyon halinde gerçekleştirilir.
Özet
Elektrokortikografi (ECoG), temel sinirbilim ile sağlık ve hastalıkta insan beyninin işlevini anlamak arasında metodolojik bir köprüdür. ECoG, nörofizyolojik sinyalleri doğrudan kortikal yüzeyden milisaniye zamansal çözünürlükte ve aynı anda kortikal dokunun geniş bölgeleri üzerinde sütunlu uzamsal çözünürlükte kaydeder ve hem yerel hem de dağıtılmış kortikal hesaplamaları incelemek için benzersiz bir konuma getirir. Burada, özel, yüksek yoğunluklu mikro-ECoG (μECoG) cihazların tasarımını ve bunların kullanımını iki prosedürde açıklıyoruz. Bu ızgaralar, elektrotlar arasında delikler bulunan berrak bir polimer substrat üzerinde imal edilmiş 200 μm aralıklı 128 düşük empedanslı elektrota sahiptir; bu özellikler, laminer politrode kayıtlar ve optogenetik manipülasyonlarla eşzamanlı μECoG kaydını mümkün kılar. İlk olarak, spesifik genetik olarak tanımlanmış kortikal hücre tiplerinin optogenetik manipülasyonu ile farelerin bıyık somatosensoriyel korteksi üzerinden kombine epidural μECoG kaydı için bir protokol sunuyoruz. Bu, farklı nöronal popülasyonların duyusal işlemeye farklı katkılarının nedensel diseksiyonuna izin verirken, aynı zamanda μECoG sinyallerindeki spesifik imzalarını da izler. İkinci olarak, μECoG ızgaraları ve laminer politrodlar kullanarak sıçan işitsel korteksinden nöral aktiviteyi kaydetmek için akut deneyler için bir protokol sunuyoruz. Bu, kortikal derinlik boyunca dağıtılan çoklu nöral birimlerden gelen kayıtlarla aynı anda kortikal yüzey boyunca duyusal olarak uyarılmış nöral tepkilerin ayrıntılı topografik haritalanmasına izin verir. Bu protokoller, dağıtılmış kortikal aktiviteyi karakterize eden deneyleri mümkün kılar ve çeşitli nörolojik bozukluklar için anlama ve nihai müdahalelere katkıda bulunabilir.
Giriş
Duyum, biliş ve eylemin altında yatan beyin işlevleri, tek nöronların sivri uçlarından kortikal bir sütundaki nöron popülasyonları tarafından üretilen elektrik alanlarına, beyin alanlarındaki sütunların topografik organizasyonuna (örneğin, somatosensoriyel kortekste somatotopi, birincil işitsel kortekste tonotopi) kadar geniş uzamsal ve zamansal ölçeklerde düzenlenir ve dağıtılır. Beyin fonksiyonlarını anlamak, bu uzamsal ölçeklerde elektrik sinyallerini algılamayı gerektirir1. Sinirbilim şu anda beynin aktivitesini izlemek için yaygın olarak kullanılan birçok yönteme sahiptir. Elektrofizyolojik olarak, laminer politrodlar (Nöropikseller gibi), tipik olarak bir avuç uzak aralıklı sütun içinde, yüksek (≥1 kHz) zamansal çözünürlüğe sahip, mütevazı sayıda (~ 300) tek nöronun izlenmesini sağlar. Ca2+ görüntüleme, daha düşük (~ 10 Hz) zamansal çözünürlükte ~ 1-2 mm uzamsal genişlik içinde mütevazı ila çok sayıda genetik ve anatomik olarak tanımlanmış tek nöronların izlenmesini sağlar2. fMRI, tüm beyindeki çok sayıda nöronun (36 mm3 hacimde ~1 M nöron) metabolik durumunun çok düşük (~0.2 Hz) zamansal çözünürlükte izlenmesini sağlar. EEG/MEG, tüm kortikal yüzeyden/beyinden gelen elektriksel aktivitenin mütevazı zamansal çözünürlükte (<100 Hz) ve çok düşük uzamsal çözünürlükte (santimetre)3 izlenmesini sağlar. Bu metodolojilerin her biri beyin fonksiyonuna temel, sinerjik içgörüler sağlamış olsa da, korteksin geniş uzamsal bölgeleri boyunca kesin anatomik konumlardan yüksek zamansal çözünürlükte elektrofizyolojik sinyallerin doğrudan algılanmasını sağlayan yöntemler yenidir. Geniş mekansal kapsama ihtiyacı, beyinde nöronal fonksiyonun derinliğe kıyasla yüzey boyunca çok daha dramatik bir şekilde değişmesi gerçeğiyle vurgulanmaktadır4.
Elektrokortikografi (ECoG), düşük empedanslı elektrot ızgaralarının beynin yüzeyine implante edildiği ve korteksinkaydedilmesine veya uyarılmasına izin verdiği bir yöntemdir 1,5. ECoG tipik olarak, farmakolojik olarak inatçı epilepsiyi tedavi etmek için klinik çalışmanın bir parçası olarak insan beyin cerrahisi ortamlarında kullanılır. Bununla birlikte, aynı zamanda insanlarda konuşma ve duyusal topografik haritalama gibi dağıtılmış kortikal işleme hakkında benzersiz bilgiler sağlar 6,7. Bu yetenekler, maymunlar, sıçanlar ve fareler dahil olmak üzere hayvan modellerinde kullanımını motive etmiştir 5,8,9,10,11. Kemirgenlerde, son zamanlarda mikro-ECoG'nin (μECoG), sütunlu uzamsal çözünürlük (~ 200 μm) ve geniş uzamsal kapsama alanı (birçok milimetre) ile nöronal popülasyonların yüksek zamansal çözünürlüklü (~ 100 Hz) doğrudan elektriksel izlenmesini sağladığı gösterilmiştir. μECoG, araştırmacıların hayvan modellerinde karmaşık duyusal işleme, bilişsel işlevler ve motor davranışlarla ilişkili dağıtılmış nöral dinamikleri araştırmalarını sağlar12,13. Son gelişmeler, μECoG'yi optogenetik ve laminer politrod kayıtları 14,15,16,17,18,19,20 ile entegre ederek kortikal ağların çok ölçekli araştırmalarına olanak tanımakta ve mikro ölçekli nöronal aktivite ile makro ölçekli kortikal dinamikler arasındaki boşluğu doldurmaktadır 21,22. Kritik olarak, μECoG sinyali insanlarda ve insan olmayan hayvan modellerinde çok benzer olduğu için, μECoG kullanımı, sonuçların ve bulguların hayvan modellerinden insanlara çok daha doğrudan çevrilmesini sağlar23. Bu nedenle, bütünleştirici yaklaşımlar, nöral devre anlayışımızı ilerletmek için çok önemlidir ve nörolojik bozukluklar için yeni terapötik müdahaleler geliştirmek için umut vaat etmektedir 5,24,25.
Sonuç olarak, kortikal işlemenin kapsamlı çok ölçekli araştırmalarını mümkün kılmak için yüksek yoğunluklu μECoG dizilerini laminer kayıtlar ve optogenetik araçlarla entegre eden protokollere yönelik ortaya çıkan bir ihtiyaç vardır 8,26. Bu boşluğu doldurmak için, elektrotlar arasında delikler bulunan esnek, şeffaf bir polimer substrat (parilen-C ve poliimid) üzerinde 40 μm elektrot çapına ve 20 μm elektrotlar arası mesafeye sahip 128 düşük empedanslı elektrot içeren özel olarak tasarlanmış μECoG cihazları geliştirdik ve optogenetik manipülasyonlarla eşzamanlı μECoG ve laminer politrod kayıtlarını mümkün kıldık13,22. Bu deneysel protokolün temel yönleri şunları içerir: (i) sütunlu uzamsal çözünürlük ve yüksek yoğunluklu μECoG dizileri aracılığıyla kortikal aktivitenin geniş ölçekli kapsamı; (ii) μECoG ızgarasından sokulan laminer politrodları kullanarak çoklu kortikal katmanlardan kayıt yapma yeteneği; ve (iii) belirli nöronal popülasyonları seçici olarak aktive etmek veya inhibe etmek için optogenetik tekniklerin dahil edilmesi, böylece nöral devrelerinnedensel diseksiyonunu mümkün kılar 27,28,29. Yüksek yoğunluklu konfigürasyon, yüksek uzamsal çözünürlüklü kayıtlara izin vererek, kortikal aktivitenin "sütunlu bir görünümünü" etkili bir şekilde sağlar, çünkü önceki çalışmalar μECoG sinyallerinin kemirgen kortikal kolonunun çapıyla (~ 20 μm) karşılaştırılabilir bir uzamsal ölçekte aktiviteyi çözebileceğini göstermiştir11. Bu entegre metodoloji, nöral aktivitenin eşzamanlı çok ölçekli izlenmesine ve manipüle edilmesine izin vererek, potansiyel olarak μECoG sinyallerinin nöronal kaynaklarını ve dağıtılmış kortikal işlemeyi belirlemek için nedensel deneylere olanak tanır. Bu hedeflere ulaşmak için bu el yazması, yüksek yoğunluklu μECoG dizilerinin iki kombinasyonda kullanımı için ayrıntılı protokoller sağlar.
İlk olarak, fare primer somatosensoriyel korteksindeki (S1) katman 5 (L5) piramidal hücrelerin manipülasyonu ile birlikte μECoG'yi tarif ediyoruz. Farede, μECoG dizisi epidural olarak yerleştirilir (farelerde durotominin cerrahi inatçılığı nedeniyle). Bir optik fiber, optogenetik ışığı kortikal yüzeyin küçük bir hedef alanına odaklamak için ızgara üzerine yerleştirilir veya bir lens ile birleştirilir. Optogenetik strateji, katman 5 uyarıcı nöronların inhibisyonu için burada açıklanmıştır, ancak karşılık gelen, popülasyona özgü, Cre eksprese eden fare hattı ile sağlanan herhangi bir nöron popülasyonuna kolayca uyarlanabilir. İkinci olarak, sıçan işitsel korteksinden (A1) kortikal katmanlar boyunca birden fazla nörondan kortikal yüzey elektrik potansiyellerini (CSEP'ler) ve tek birimli sivri aktivite kaydetmek için μECoG'nin silikon laminer politrodlarla birlikte kullanımını açıklıyoruz. Dizi, elektrotlar arasında deliklere sahiptir ve farklı kortikal katmanlar boyunca nöronal aktiviteyi kaydetmek için çok kanallı laminer politrodların ızgara boyunca yerleştirilmesini sağlar. Kraniotomi prosedürü sırasında, μECoG dizisi işitsel korteks üzerine subdural olarak yerleştirilir ve laminer politrod deliklerden sokulur. μECoG ve laminer probdan gelen nöral sinyaller, bir dijital sinyal işlemcisine optik olarak bağlı bir amplifikatör sistemi kullanılarak sırasıyla 6 kHz ve 24 kHz'de örneklenerek aynı anda kaydedilir.
Protokol
Her iki protokol de aynı temel adımları (anestezi, fiksasyon, kraniyotomi, μECoG kaydı) takip eder, ancak dikkate değer farklılıklara sahiptir. Aşağıdaki açıklamada, paylaşılan adımlar birleştirilirken, her protokolün özellikleri açıklanır. Aşağıdaki adımlar, optogenetik (Fare) ile μECoG kaydına veya laminer prob (Sıçan) ile μECoG kaydına karşılık gelir. Burada açıklanan tüm prosedürler yerel etik veya yasal otoritelere (IACUC veya Etik Kurullar) uygun olarak yürütülmüştür. Kullanılan ilaçlar onaylanmış etik protokole göre değişiklik gösterebilir.
1. Fare ve sıçan prosedürleri için hazırlık ve protokol
- Fare ve sıçan protokolleri arasındaki önemli farklar
- Elektrofizyolojik kayıtlara karşı cerrahi kurulumlar
- Bir sıçan için, hem ameliyat hem de elektrofizyolojik kayıtlar sırasında aynı kurulumu kullanın.
- Bir fare için, ilk kurulumda ameliyatı ve ikinci kurulumda elektrofizyolojik kayıtları gerçekleştirin.
- Kafa fiksasyonu
- Bir sıçan için, ameliyat ve elektrofizyolojik kayıt için aynı burun kelepçesini kullanın.
- Bir fare için, ameliyat için bir burun kelepçesi ve hafif izofluran anestezisi altında fiksasyona izin vermek için elektrofizyoloji kurulumunda harici bir metal başlık kullanın. Kafa çubuğunu kafatasına diş çimentosu ile implante edin.
- Kayıt kurulumu: İki tür için farklı edinme elektroniği, kayıt yazılımı ve duyusal stimülasyon yazılımı kullanın.
- Fare protokolü için, veri toplama için SpikeGadgets sistemini (https://spikegadgets.com) ve açık kaynaklı Trodes yazılımını (https://spikegadgets.com/trodes/) kullanın.
- Sıçan protokolü için, veri toplama için kayıt yazılımı Synapse - Neurophysiology Suite'i (https://www.tdt.com/component/synapse-software/) kullanın.
- Enjeksiyonla (Sıçan) veya inhalasyon (Fare) ile anesteziyi indükleyin.
- Kayıt konumu
- Bir fare için somatosensoriyel kortekste (S1) kayıtlar yapın.
- Bir sıçan için birincil işitsel kortekste (A1) kayıtlar yapın.
NOT: Anatomik lokalizasyondaki bu farklılık, her tür için farklı kraniyotomi bölgeleri gerektirir.
- Elektrofizyolojik kayıtlara karşı cerrahi kurulumlar
- Şebekenin hazırlanması ve test edilmesi
- Izgarayı (bağlantı kartı hariç) seyreltilmiş bir enzimatik deterjanda (%50 deterjan, %50 damıtılmış su) en az 1 saat bekletin.
- Saf damıtılmış su banyosuna aktarın ve güvenli, temiz bir yerde kurumaya bırakın.
- Her kayıt oturumundan önce değil, μECoG cihazının ilk hazırlığının bir parçası olarak platin siyahı elektrodepozisyon gerçekleştirin.
NOT: Bir kez biriktirildikten sonra, Platin Siyah kaplama, birden fazla kayıt için etkili kalan kararlı bir katman oluşturur, ancak performansı düzenli empedans testi ile izlenmelidir. Platin Siyahı elektrodepozisyon (1 kHz'de 10-20 kΩ hedef aralığı), nöral kayıtlarda elektrot empedansını azaltır ve sinyal-gürültü oranını iyileştirir. - Elektrodepozisyonu gerçekleştirmek için, biriktirme değiştirici olarak az miktarda kurşun asetat (yaklaşık% 1) içeren bir kloroplatinik asit çözeltisi (tipik olarak %3-2 Kloroplatinik asit [H0.005]) hazırlayın. μECoG elektrotlarını, üç elektrotlu bir elektrokimyasal hücrede çalışma elektrotu olarak görev yapacak şekilde bir platin karşı elektrot ve Ag/AgCl referans elektrotu ile bağlayın.
- Empedans değerlerini izlerken 10-30 s boyunca yaklaşık -0,5--2 mA/cm² sabit akım yoğunluğu uygulayın.
- Izgara elektrotlarının empedansını test edin ve kaydedin (örneğin, bir Nano-Z ile).
- Izgarayı bir ışık kaynağı üzerinden kontrol edin ve ızgarayı ameliyat sonrası kayıtta kullanmak üzere hazırlayın.
- Referans kablo lehimleme
- Bir fare için, kayıt sisteminin referans kablosuna bağlanmak için gümüş bir telin (10 mm uzunluğunda, 30 G) ucunu altın bir pime lehimleyin.
2. Ameliyat
- Materyallerin hazırlanması ve genel izleme (Hayvan bakımı ve kayıt altına alınması)
- Hazırlık: Cerrahi alanı uygun bir dezenfektan ile iyice temizleyin ve dezenfekte edin. Tüm cerrahi aletlerin tipik olarak bir otoklav kullanılarak sterilize edildiğinden emin olun.
- Cerrahi alet yerleştirme: Cerrahi aletleri steril cerrahi ped üzerine yerleştirin. Cerrahi alanı pamuk uçlu aplikatörler ve emici pamuklu cerrahi üçgenlerle doldurun. Biyolojik olarak tehlikeli atıkları özel bir bertaraf torbasına atın.
- Sıcaklık regülasyonu: Cerrahi ve elektrofizyolojik kayıt alanı içindeki ısıtma yastığını açın. Ameliyat ve kayıt boyunca ısıtma yastığının sıcaklığını kontrol edin.
- Cerrahi ped: Sıcaklık düzenleme yatağının üzerine mavi bir cerrahi ped veya battaniye yerleştirin.
NOT: Bu ped, yukarı bakması gereken yumuşak, pamuklu beyaz bir tabana sahip olmalıdır. - Mikroskop konumlandırma: Mikroskobu ve takılı aydınlatıcıyı (örn. LED halkası) cerrahi alanın bir tarafına hazırlayın. Düzgün çalışıp çalışmadığını kontrol edin.
- Cerrahi matkap: Kraniotomi prosedürü için cerrahi matkabı hazırlayın.
- Oksijen kaynağı: Oksijen tankı akış hızını 1.0 L/dk (Sıçan) veya 0.5 L/dk (Fare) olarak ayarlayın ve oksijen maskesini regülasyon pedinin yanına yerleştirin. Anesteziyi takiben hayvanın sürekli oksijene ihtiyacı olacaktır.
- Sıvı replasmanı: Ameliyat boyunca, hayvanın vücut ağırlığının en az% 1.5'inin (Fare) veya saatte 1 mL'nin (Sıçan) değiştirilmesini amaçlayan herhangi bir sıvı kaybını değiştirin. Buna göre izotonik çözeltiler hazırlayın.
- Hayvan: Hayvanı, onaylanmış prosedürlere göre hayvan tesisinden ameliyathaneye getirin. C57Bl6 arka planına sahip erkek veya dişi 8 ila 16 haftalık fareleri kullanın; aynı şekilde, Sprague Dawley suşunun 7 haftalık farelerini, erkeklerini kullanın.
- İlaçların hazırlanması: Hayvanı 0,1 g hassasiyetle bir ölçek kullanarak tartın. Gerekirse önceden seyreltilmiş solüsyonlar kullanarak ameliyat için yeterli ilaç miktarlarını hazırlayın.
- Anestezi indüksiyonu
- Bir fare için anestezi indüksiyonu
- Hayvanı izofluran indüksiyon odasına yerleştirin (0,5 L / dak O2'de% 3-5 İzofluran).
- Derin anestezi onaylandıktan sonra (kuyruk / ayak parmağı sıkışmasında refleks yok), hayvanı ameliyat ısıtma yastığına yerleştirin ve kafasını sabitleyin.
- Genel analjezi için deri altı ilaçlar enjekte edin: Meloksikam: 5 mg / kg ve Buprenorfin: 0.1 mg / kg.
- 2.2.1.5-2.2.1.6 adımlarını izleyerek farenin başlığını düzeltin.
- Burnu anestezi maskesine ve başı gevşek bir şekilde baş montajına yerleştirin. Fareyi ısırma çubuğuna yerleştirmek için önce dilin çubuk ile ağzın çatısı arasında değil, çubuğun altında olduğundan emin olun. Gerekirse dili hareket ettirmek için forseps kullanın.
- Hayvanın kesici dişlerini ısırma çubuğunun çubuğundaki deliğe yerleştirin. Sabitleme vidasını hafifçe sıkarak fare anestezi maskesini (0,5 L/dak O2'de% 1,5-2 İzofluran) sabitleyin. Ameliyat sırasında baş stabilizasyonu sadece ısırma çubuğu ile sağlanır.
- Ameliyat sırasında kurumayı önlemek için hayvanın gözlerini petrol bazlı bir göz merhemi veya kayganlaştırıcı ile koruyun.
- Maske boyunca sürekli bir izofluran akışı ile prosedür boyunca anesteziyi koruyun.
- Bir sıçan için anestezi indüksiyonu
- İndüksiyon anestezisinin enjeksiyonunu kolaylaştırmak için başlangıçta hayvanı sakinleştirmek için izofluran kullanın.
- Anestezi ve analjezi için ilaçları uygulayın:
Meloksikam: 5 mg / kg dozaj, konsantrasyon 10 mg / mL, 0.4 mL / kg
Ketamin: 90 mg / kg dozaj, konsantrasyon 100 mg / mL, 0.9 mL / kg
Ksilazin: 10 mg / kg dozaj, konsantrasyon 100 mg / mL, 0.1 mL / kg - Hayvanın kilosuna ve yaşına bağlı olarak 15-30 dakika içinde derin anesteziye ulaşmasına izin verin.
- Anestezi monitörizasyonu
- Prosedür boyunca hayvanın hayati değerlerini (solunum hızı) sürekli olarak izleyin. Solunum hızını, anestezi durumundaki erken değişikliklerin özellikle yararlı bir işareti olarak kontrol edin ve solunum hızı değişirse anestezi seviyesini ayarlayın.
- Pençe çekme refleksi, anestezi durumunun kritik bir işaretidir. Bu refleksi periyodik olarak test edin, çünkü toplam yokluğu ameliyat için yeterli anestezi seviyelerini sağlar.
- Bir fare için anestezi indüksiyonu
- Baş fiksasyonu ve yaşamsal belirtilerin izlenmesi
- Hayvan hayati değerlerinin izlenmesi
- Hayvanın yaşamsal belirtilerini bir deney kağıdına kontrol edin ve kaydedin. Hayvanın refleksleri (örneğin, pençe çekilmesi) tamamen sönmemişse, ek bir yarım doz ek ketamin (Sıçan) uygulayın veya izofluran konsantrasyonunu% 0,5'lik artışlarla artırın (Fare).
- Bir sıçan için kafa fiksasyonu
- Sıçan tamamen uyuşturulduktan sonra (pençe veya kuyruk refleksi yok), hayvanın kesici dişlerini kafa montajının çubuğundaki deliğe yerleştirin.
- Ameliyat sırasında başı sabitlemek için montaj kollarının uçlarını dikkatlice burun sırtına yerleştirin ve gözlerle temas etmediğinden emin olun.
- Hayvanın ağzının çatısı çubuğa sıkıca bastırılana kadar kolların açısını ayarlayın. Kafatasının basınç altında hareketsiz kaldığından emin olun.
- Vidaları altıgen bir anahtarla sıkarak montajın her iki kolunu da sabitleyin.
- Bir sıçan için oksijen kurulumu
- Oksijen tankındaki plastik boruyu hayvanın ağzına ve burnuna sabitleyin ve cerrahi bantla sabitleyin. Boruda hava akışını engelleyebilecek kırışıklıklardan kaçının. Oksijen tankını 1 L/dk'lık bir akış hızına ayarlayın.
NOT: Kalp atış hızı ve solunum hızı da dahil olmak üzere hayvansal hayati değerler, prosedür boyunca 15-30 dakikalık aralıklarla kontrol edilmelidir.
- Oksijen tankındaki plastik boruyu hayvanın ağzına ve burnuna sabitleyin ve cerrahi bantla sabitleyin. Boruda hava akışını engelleyebilecek kırışıklıklardan kaçının. Oksijen tankını 1 L/dk'lık bir akış hızına ayarlayın.
- Hayvan hayati değerlerinin izlenmesi
- Kafa derisi insizyonu
- Tıraş ve hazırlık
- Üst burundan başın arkasına kadar, bir gözden diğerine uzanan ve kulakların etrafındaki alanı tıraş edin. Kürkün büyük kısmını makas veya elektrikli kesme makinesi ile çıkarın ve ardından tüy dökücü krem uygulayın.
- Dezenfeksiyon
- Betadine batırılmış bir pamuklu çubuk kullanarak alanı dezenfekte edin, ardından %70 etanole batırılmış bir pamuklu çubukla durulayın. Bu işlemi üç kez tekrarlayın ve bölgenin steril olduğundan emin olmak için son bir Betadine uygulaması ile bitirin.
- Lokal anestezik enjeksiyon
- Lokal anestezik Lidokaini (% 1, fare için 0.1 mL / sıçan için kg başına 0.4 mL) deri altından hayvanın kafa derisinin orta hattına enjekte edin. Lidokaini yaymak için kafa derisine hafifçe masaj yapın ve anestezinin etkili olması için 5 dakika bekleyin.
- Kesi
- Bir fare için, cımbızla cilt üzerindeki bir noktayı kaldırın ve cerrahi makas kullanarak cildin küçük bir bölümünü (yaklaşık 1 cm çapında) rezeke edin.
- Bir sıçan için, kafa derisinin ön tarafında, burnun hemen üstünde, neşter kullanarak orta hatta hassas bir kesi yapın. Gözlerin arasından kafatasının tabanına doğru düz bir kesi oluşturarak cildi nazikçe geri çekin. Kafa derisini dikkatlice kaldırın, bağ dokusunu kesin ve kafatasını tamamen ortaya çıkarın.
- 2.4.4.4-2.4.4.5 adımlarını izleyerek kraniyotomi bölgesini ortaya çıkarın.
- Bir kazıyıcı ile kafatasının üst kısmındaki bağ dokusunu ve periosteuumu temizleyin. Tuzlu su yıkayın ve bölgeyi temizlemek için aspirasyon veya cerrahi sünger kullanın.
- Kraniotominin yapılacağı kafatası bölgesinin net bir şekilde ortaya çıkmasını kolaylaştırmak için cilt kenarlarında cerrahi klipsler kullanın.
- Tıraş ve hazırlık
- Kraniyotomi
- Genel delme prosedürü
- Deneyimli cerrahlar için cerrahi matkap hızını 5000 rpm veya 7000 rpm gibi düşük bir ayara ayarlayın. Mikroskopta görselleştirirken tüm delme işlemlerini yapın.
- Matkabı kafatasının yüzeyine paralel tutun ve yüzeye nazikçe yaslayın.
- Pedala hafifçe bastırarak tek bir yerde delmeye başlayın. Kemik rengindeki değişiklikleri sık sık kontrol ederek kısa aralıklarla (5-10 sn) delme işlemi yapın.
NOT: Kemik opak bir beyaza başlayacak ve delik derinleştikçe daha yarı saydam hale gelecek ve pembe bir renk tonu ortaya çıkacaktır. - Delme beyne yaklaştığında, yavaşlayın ve deliğe nem sızdığına dair işaretler arayın. Delik koyu pembe olduğunda ve hafif bir parlaklığa sahip olduğunda, delmeyi durdurun. 30 G'lik kısa bir iğne kullanarak, kalan kemik tabakasını nazikçe delin. Berrak sıvı yeni delikten iyi bir şekilde çıkmalıdır.
- Bir fare için delme prosedürü
- Fizyolojik kayıtlar için bir referans elektrot yerleştirmek için, kaydedilen alanın ipsilateralinde yarım kürenin ön kısmında bir çapak deliği açın.
- Çevresine sığ bir hendek açarak kraniyotominin konturunu tanımlayın. Medio-lateral eksende, referans olarak lateral kemik sırtından başlayın ve 4 mm'lik bir pencere çizin.
- Antero-arka eksende, arka kemik sırtının ~ 1 mm önünden başlayarak 3 mm'lik bir pencere açın. Son açık kraniotomi boyutu yaklaşık 4 x 3 mm'lik bir penceredir.
- Bir sıçan için delme prosedürü
- İki delik açın: biri sol arka kadranda, diğeri sağ ön kadranda.
- Masseter kasına ikinci bir doz lidokain (10 mg / mL'de 0.4 mL / kg) enjekte edin ve kesimin yapılacağı yere eşit olarak dağıtın.
- Kraniotomi alanını ortaya çıkarmak için gereken minimum kas setini rezeke edin.
- Yeni bir # 10 neşter bıçağı kullanarak, hayvanın çenesinin üzerindeki kas demetinde (sağ taraf) enine bir dorsal-ventral kesim oluşturun. Kesiğin arka kenarını kavrama forsepsleriyle tutun ve elmacık kemiğinin kemikli sırtı boyunca keserken kafatasından soyun. Bu sayede minimum kanama ile kas kemikten ayrılabilir.
- Kafatasındaki bir fissür çizgisi ortaya çıkana kadar ön kası benzer şekilde rezeke edin. Bu çizgi kraniyotomi penceresinin ön sınırı olacaktır.
- Yüksek derecede vaskülarize bölgeleri kesmekten kaçınmak için güçlü bir ışık kaynağı kullanarak neşter ve forseps ile arka sırtın etrafındaki kasları temizleyin.
- Matkabı kullanarak arka çıkıntıyı, kafatasının yüzeyinin üzerine artık kaldırılmayana kadar zımparalayın.
NOT: Bu adım, kortikal yüzeyle doğrudan temas sağlamak için μECoG ızgarasını ayarlamak için gereklidir. - Pencerenin sırt kenarını, rezeke edilen kasın bağlandığı sırtın hemen üzerinde delin. Arka kenarı ön kısımdan delinmiş arka çıkıntıya yerleştirin. Ön kenarı, göz yuvasının yakınına doğru uzanan fissür çizgisinin arkasına yerleştirin.
NOT: Ön kası temizlerken, gözden kaçınmak için özen gösterilmelidir.
- Genel delme prosedürü
- Kraniyotomi pencere sondajı
- Kraniyotomi penceresinin delinmesi (İpuçları)
- Delme sırasında, matkap ucunun kafatası yüzeyine paralel tutulduğundan emin olun. Amaçlanan kraniyotomi hattı boyunca kısa, tekrarlayan hareketler kullanırken matkabın kafatası ile hafif temas etmesine izin vererek matkabı bir fırça gibi kullanarak mümkün olduğunca az kuvvet uygulayın.
NOT: Sıçanlarda, pencerenin arka kenarı en kalın kemiğe sahiptir. Çok geriye doğru delinirse, kemik, delme işleminin ölçülmesini zorlaştıran lapa lapa, "gevrek" bir kalite sergileyebilir. Yanlış yerleştirilirse, bu kemik alanı beyne yakınlık konusunda yanlış bir izlenim veren damarlı kırmızı renklenme ortaya çıkarabilir. - Kraniyotomi penceresinin her iki tarafını, uzunluğu boyunca uzanan ince beyaz bir çatlak veya çatlak ile kemik soluk pembe görünene kadar delin. Hafif basınç uygulayın; Kemik, tamamen delindiğinde belirgin bir "kıpırdanma" üretmelidir. Çatlak ayrık görünüyorsa, sürekli bir çizgi elde edene kadar hafifçe delmeye devam edin.
- Delme sırasında, matkap ucunun kafatası yüzeyine paralel tutulduğundan emin olun. Amaçlanan kraniyotomi hattı boyunca kısa, tekrarlayan hareketler kullanırken matkabın kafatası ile hafif temas etmesine izin vererek matkabı bir fırça gibi kullanarak mümkün olduğunca az kuvvet uygulayın.
- Kraniyotomi penceresi içindeki incelmiş kafatasının çıkarılması
- Kafatası, aşırı hafif basınç tüm pencerenin gözle görülür şekilde kıpırdamasına neden olacak kadar inceldiğinde, inceltilmiş kafatasını çıkarın.
- Kraniyotomi bölgesini bir damla tuzlu su ile yıkayın ve en az 1 dakika bekleyin. Bu, incelmiş kemiği zayıflatır ve kemiğin duradan ayrılmasına yardımcı olur. Fazla tuzlu suyu emici bir pamuklu üçgen veya vakumla boşaltın.
- İnceltilmiş kafatasını forseps kullanarak dikkatlice kaldırın ve alttaki dokuya zarar vermekten kaçının.
- Beyni nemli tutmak için hemostatik bir sünger kullanın.
- Pencereyi dorsal ve ventral taraflardan dişli forseps ile sıkıca kavrayın ve doğrudan kafatasından çekin. Pencereyi sahadan çekmekte herhangi bir zorluk varsa, kemik yeterince zayıflayana kadar hafif delme işlemini durdurun ve devam ettirin.
- Fare μECoG kayıtları için dura'yı olduğu gibi bırakın.
- Kraniyotomi penceresinin delinmesi (İpuçları)
- Bir fare için çimento ve kafa direği implantı
- Referans kablosunu takın ve sabitleyin.
- Gümüş tel ucunu ~ 1 mm çapak deliğine, beynin yüzeyine temas edecek kadar ancak kanamaya neden olmayacak şekilde yerleştirin.
- İlk katı uygularken diş çimentosunu yerine uygulayın.
- Diş çimentosunun hazırlanması
- Diş çimentosu karışımını hazırlamak için soğutulmuş bir seramik karıştırma kabı kullanın. Bu çimento hızla kalınlaşır ve yeni bir karışımın düzenli olarak hazırlanmasını gerektirir. Yeni bir karışım hazırlamadan önce karıştırma kabını silerek temizleyin.
NOT: Çimento asla beyinle doğrudan temas halinde olmamalıdır.
- Diş çimentosu karışımını hazırlamak için soğutulmuş bir seramik karıştırma kabı kullanın. Bu çimento hızla kalınlaşır ve yeni bir karışımın düzenli olarak hazırlanmasını gerektirir. Yeni bir karışım hazırlamadan önce karıştırma kabını silerek temizleyin.
- İlk katın uygulanması
- Mikro aplikatörler kullanarak ilk çimento tabakasını kraniotominin etrafına ve tüm kafatasına uygulayın. Bu katman, kafatası ile metal başlık arasında elektriksel yalıtım görevi görür.
- Açık kraniyotomi ve μECoG ızgarası için yeterli koruma sağlamak için kraniyotomiyi yanal kaplama da dahil olmak üzere çimento ile tamamen çevreleyin.
- Metal başlığın konumlandırılması
- Kafa çubuğunun büyük bölümünü tam olarak sıkmadan tutucusuna takın.
- Kafa çubuğunu istediğiniz gibi konumlandırın, ince bölümü kafatası orta hattı boyunca çimento yüzeyiyle temas edecek şekilde yerleştirin.
- İmplantın sabitlenmesi
- Baş çubuğunu diş çimentosu ile örtün ve çimento yüzeyine bağlayın.
- Tutucunun çıkarılması
- Diş çimentosunun güçlenmesi için birkaç dakika bekleyin.
- Başlık tamamen sabitlendikten sonra, önce vidayı tutucudan çıkararak çıkarın. Ardından, kafa çubuğuna herhangi bir kuvvet uygulanmadığından emin olarak tutucuyu geriye doğru geri çekin.
- Referans kablosunu takın ve sabitleyin.
- Sıçan cerrahisi için durotomi
NOT: Bu zorlu bir cerrahi adımdır.- Dura'yı kaldırmak
- Beynin yüzeyine mümkün olduğunca paralel tutulan 5 numaralı forseps kullanarak, duranın küçük bir kısmını beyinden uzaklaştırın.
- Kaldırılan durayı dikkatlice yırtmak için 30 G'lik yeni bir iğne (mümkün olduğunca kısa) kullanın.
NOT: Dura mater, doğrudan beynin üzerinde bulunan ince, şeffaf bir doku tabakasıdır. Sıçanlarda μECoG kayıtları için çıkarılır. Durotominin beyin yüzeyindeki damar sistemini bozmadan yapılması çok önemlidir. Durotomiyi gerçekleştirmek için önerilen yöntemler arasında, durayı geri çekmeden önce delmek için forseps ve bir şırınga iğnesi kullanmak veya durayı dikkatlice geri çekmek için kafatasının yanına sabitlenmiş bir duratom aleti kullanmak yer alır.
- Dura rezeksiyonu
- Durayı forseps ile kavramaya ve beyinden kaldırmaya devam edin. Kaldırırken iğne ile çapraz bir yırtılma oluşturun.
- Durayı kraniyotomi penceresinin kenarlarına doğru dikkatlice soymak için forsepsleri kullanın ve beyin yüzeyinin bozulmamasını sağlayın.
- Dura'yı kaldırmak
- Farenin elektrofizyolojik kayıt için kuruluma aktarılması
- Burnunu ve kesici dişleri kesici çubuktan nazikçe kaldırarak ve ardından hayvanı geri çekerek hayvanı ameliyat kurulumundan çıkarın. Daha düşük bir İzofluran konsantrasyonu kullanılarak sürekli anestezinin sürdürülmesini sağlayan bir yatıştırıcı olan Klorprotiksen (1 mg / kg, intraperitoneal [IP]) enjekte edin.
- Fareyi elektrofizyolojik kayıt kurulumuna yerleştirin.
- Isıtma yastığının yerinde olduğundan ve düzgün çalıştığından emin olun.
- Elektrofizyolojik kurulumda tutucu üzerindeki baş çubuğunu kullanarak hayvanı sabitleyin.
- Hayvanın burnunu tamamen kaplayacak şekilde izofluran maskesini yaklaştırın.
- Anestezi ayarı
- Anestezi seviyelerini kademeli olarak% 0.7-1 Isoflurane'e düşürün (her 5 dakikada bir% 0.5'lik artışlarla).
- Hayvanın solunum hızını ve hareketlerini izleyin.
NOT: Solunum hızı cerrahi duruma göre biraz artmalı, ancak hayvan hareket etmemelidir. - Hayvan hareket ediyorsa,% 0,5'lik artışlarla yavaşça daha düşük bir seviyeye geri döndürmeden önce izofluran konsantrasyonunu% 2'ye yükseltin.
- Duyusal stimülasyon için bıyık yerleştirme
- Farenin titreşimini bıyık stimülasyon cihazına takın. Bu protokolde, titreşimin hızlı sapmasını sağlayan piezoelektrik aktüatörlere bağlı 10 μL'lik kısa pipet uçlarına dokuz titreşim yerleştirin.
3. Kayıt
- Şebekenin kurulması
- Ön adımlar
- Kayıt sistemini ve amplifikatörü açın.
- Hayvanın yaşamsal belirtilerini kontrol edin.
- Prosedür
- Hayvanı ve aletleri konumlandırmak için 3.1.2.2-3.1.2.4 adımlarını izleyin.
- Hayvanı kayıt kurulumuna yerleştirin ve düzenli olarak bir tuzlu su çözeltisi uygulayarak kraniyotominin nemli kalmasını sağlayın.
- Bir sıçan için, paraziti önlemek için mikromanipülatörü kraniyotomi bölgesinin hemen arkasında bulunan teçhizatın korkuluğuna yerleştirin.
- Bir fare için, mikromanipülatörü hayvanın yanındaki kraniyotomi bölgesine yanal olarak yerleştirin.
- Izgarayı bir fareye takmak ve yerleştirmek için 3.1.2.6-3.1.2.12 adımlarını izleyin.
- μECoG ızgarasını başlığa takıntage ZIF-klips konektörlerini (headstage konektörü) kullanarak. Headstage'in elektronik kartını bir mikromanipülatöre sabitlenmiş mekanik bir çubuk aracılığıyla yerinde tutun.
- Anteroposterior eksen boyunca kraniotomi üzerinde düz bir şekilde hizalamak için μECoG ızgarasını yatay olarak indirin.
NOT: Lateral-medial eksen boyunca, ızgaranın kenarı kraniyotominin medial sınırına yakın olmalıdır. - Izgara beynin yakınına yerleştirildiğinde, ancak onunla temas etmediğinde, ızgaranın referans telini implante edilmiş gümüş tel-altın pime takın. Gerekirse, elektriksel gürültüyü azaltmak için topraklama kablosunu hayvana (örn. üstü açık bir kas) takın.
- Ayrıca, beyinle temas etmek için ızgarayı indirin.
- Nemli dura yüzeyi üzerinde "kaymak" için ızgarayı yanal olarak hareket ettirin. Izgara mediolateral eksen boyunca ortalanana kadar ayarlamaya devam edin.
- Fazla tuzlu su solüsyonunu çıkarmak için kraniyotominin kenarlarında aspirasyon veya cerrahi sünger kullanın.
- Hazırlık biraz daha kuru olduğunda, ızgaranın duraya daha sıkı yapıştığından ve yüzeyi üzerinde kaymadığından emin olun. Daha kuru olduğunda, en yanal elektrotlarla teması sağlayarak esnek ızgaraya yanal ila medial hareket uygulayın. Şebekenin esnek kablosu, beynin konturuna uyacak şekilde doğal olarak bükülecektir.
- Izgarayı bir sıçan üzerine yerleştirmek için 3.1.2.14-3.1.2.18 adımlarını izleyin.
- Tutma çatalının gövdesini mikromanipülatöre sabitleyin ve ızgaranın konektör kartının indirildiğinde kraniyotomi penceresinin arka tarafına doğru durmasını sağlayın.
- Mikromanipülatörün korkuluk üzerindeki konumunu, ızgara kabaca kraniyotomi bölgesinin üzerinde olacak şekilde ayarlayın. Izgarayı beyin yüzeyinin üzerine yakın bir şekilde durana kadar indirin. Beyin yüzeyini küçük bir damla tuzlu su ile nemlendirin.
- Bu adımları mikroskobu kullanarak gerçekleştirin. Mikromanipülatörün kadranlarını kullanarak, ızgara konumunu kraniyotominin merkezindeki beyin yüzeyine düz bir şekilde oturana kadar ayarlayın.
- Izgaranın kendisine dokunmadan emici bir pamuklu üçgen kullanarak nemi dikkatlice uzaklaştırın. Izgaranın her sırasının beyin yüzeyi ile temas halinde olduğundan emin olun.
NOT: Nemin uzaklaştırılması, elektrik sinyalinin kortikal yüzey ile ızgara arasındaki sıvı yoluyla pasif yayılmasını önler, bu da elektrotta algılanan sinyali uzamsal olarak dağıtır. - 2 numaralı veya 5 numaralı forseps kullanarak, ızgara topraklama telini aynı çapak deliğine yerleştirin veya referans telini bir çapak deliğine ve topraklama telini yakındaki kas dokusuna yerleştirin.
NOT: Teller sadece ~ 1 mm yerleştirilmelidir, beyne temas edecek kadar, ancak beyinde kanama veya travmaya neden olmayacak kadar.
- Ön adımlar
- Şebekenin konumunu kontrol etme
- Elektrofizyolojik aktivitenin izlenmesi
- Kayıt yazılımını kullanarak elektrofizyolojik aktiviteyi gözlemleyin. Işık anestezisi altında, beyin sinyalleri değişkendir ve çeşitli desenler sergileyebilir.
- Şebekenin, referansın ve topraklama kablolarının uygun şekilde bağlanması, mV aralığında sinyal genlikleri ile yüksek bir sinyal-gürültü oranı sağlamalıdır. Trodes (örn. 100-6000 Hz) ile bant geçiren filtrelemeyi kullanarak yüksek frekans aralığındaki gürültüyü izleyin ve birkaç on mikrovoltu (μV) aşmadığından emin olun.
- Görünür olayla ilgili kortikal yüzey elektrik potansiyellerini (CSEP'ler) indüklemek için gürültüyü (örneğin, alkışlamak veya parmakları şıklatmak) kullanarak duyusal duyarlılığı değerlendirin.
NOT: Tek bir bıyık stimülasyonu, yalnızca birkaç kanalda (Fare) net, keskin bir olayla ilgili CSEP uyandırmalıdır. - Şebeke konumu doğrulaması
- Bir sıçan için, ızgaranın işitsel korteks üzerinde doğru şekilde konumlandırıldığını onaylayın. Kaydedilen ilk blok, şebekenin beyinden uygun bir yanıt kaydettiğini doğrulamak için tipik olarak 60 saniyelik bir beyaz gürültü uyaranı seti olmalıdır. Izgaranın doğru yerleştirilip yerleştirilmediğini ve bir sinyal yanıtı olup olmadığını belirlemeye yardımcı olmak için yalnızca politrode yerleştirmeden önce ızgara ile beyaz gürültü ve ton tanılama kayıtları yapın.
- Bir fare için, ızgara konumunu doğrulamak için, 350 ms aralıklı 20-30 yatay çizgi sapması ile hızlı bir eşleme oturumu gerçekleştirin. Trodes kullanarak yerel alan potansiyeli (LFP) bandındaki aktiviteyi kaydedin ve bıyıkla uyarılan aktivitenin uzamsal kapsamını görselleştirmek için özel bir MATLAB koduyla çevrimdışı olarak analiz edin.
- Yeni -den konumlandırma
- Izgara ayarlama gerektiriyorsa, kortikal yüzeyi ızgara üzerine tuzlu su damlaları ile nemlendirin.
- Izgarayı kaldırmaya çalışmadan önce tuzlu suyu 30 saniye ila 1 dakika arasında bırakın.
- Izgarayı dikkatlice ve yavaşça kaldırın.
- Adım 3.1'de açıklanan adımları kullanarak yeniden konumlandırın.
- Elektrofizyolojik aktivitenin izlenmesi
- Bir sıçan için laminer politrodlar
- Polytrode kurulumu
- İlk olarak, headstage adaptörünü polytrode'un arka tarafına bağlayın. Konektörü, adaptörün kartına takılan üçüncü kanal kümesine klipsleyin. Klips üzerindeki siyah işaretin, polytrode'un iş ucunun sağ tarafına baktığından emin olun.
- Politrode Yerleştirme
- En son (en üst) elektrotlar kortikal yüzeyin üzerinde görünene kadar politrodu beyne yerleştirin. Yavaş iniş (1 μm/s'ye kadar) sinyal kalitesini artırır. Beynin politrodun varlığına uyum sağlamasına izin vererek 15 dakika bekleyin.
- 15 dakika sonra, son elektrotların kortikal yüzeye girip girmediğini kontrol edin. Değilse, polytrodu biraz daha indirin ve devam etmeden önce 10 dakika daha bekleyin.
- Polytrode kurulumu
- Optogenetik ışık kaynağını bir fare üzerine yerleştirme
- Fiber optik tutucuyu monte etmek için mafsallı bir kol üzerine monte edilmiş üç boyutlu bir ince ayar vidası sistemi veya bir mikro manipülatör kullanın.
- Işık kaynağını yönlendirmek ve fiberin konumlandırılmasına yardımcı olmak için optogenetik ışığı düşük yoğunlukta açın. Optogenetik ışığı hedef alana doğru kaba bir şekilde konumlandırmak için mafsallı kolu kullanın.
- Bir mikromanipülatör veya ince ayar vidaları kullanarak fiberin konumuna odaklanın ve ince ayar yapın.
- Sinyallerin kaydedilmesi
- Hazırlık
- Elektriksel paraziti azaltmak için cerrahi teçhizattaki tüm gereksiz ışıkları, uzatma kablolarını ve aşırı gerilim koruyucuları çıkarın. Teçhizattaki tepe ışıklarını kapatın.
- Deneye başlamadan önce izole edilmiş kayıt alanının kapısını ve ameliyathanenin kapısını kapatın.
- Satın almaya başlama
- Bir sıçan için, kayıt platformunda/bilgisayarda Synapse'i başlatın ve sinyalleri önizleyerek ve kontrol ederek alımın işlevsel olduğunu onaylayın. Hayvanın yakınında uyaranlar sunarak, yani alkışlayarak μECoG sinyalinde büyük, keskin voltaj geçişleri ortaya çıkarın.
- Fare için, Trodes'ta Kayıt Oturumunu başlatın.
- Hidrasyon
- Dehidrasyonu önlemek için kayıt sırasında her 1-2 saatte bir sıçana veya fareye deri altına sırasıyla 1 mL veya 0.1 mL salin enjekte edin. Bir sıçan için, yeni bir kayıt bloğunu çalıştırmadan önce salin uyguladıktan sonra 5-10 dakika bekleyin.
- Uyaran setleri
- Bir sıçan için, kayıt yeri onaylandıktan sonra, gerekli uyaran setlerini kaydetmeye devam edin. Örnek bir küme şunları içerebilir
Beyaz Gürültü (60 sn)
Ton Teşhisi (5 dk)
Saf Ton (23 dk)
Dinamik Hareketli Dalgalanma
Ton 150 (15 dk)
TİMİT (38 dk) - Bir sıçan için, ızgara yeniden konumlandırıldığında beyaz gürültüyü ve ton teşhisini yeniden sunun.
- Bir fare için dokunsal uyaranlar: Her denemede her 350 ms'de bir rastgele bıyık sapmaları dizisi içeren bir deneme yapısında dokunsal uyaranlar sağlayın. Sağlanan örnekte, her deneme 4500 ms'nin üzerinde sunulan 14 sapma içerir.
- Bir fare için optogenetik uyaranlar: Bazı denemelerde, tüm deneme süresi (5 sn) boyunca bir optogenetik ışık kare darbesi uygulayın. Kullanılan opsine ve ışık penetrasyonu (https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php) tahminlerini kullanarak ulaşılacak doku derinliğine göre gerekli ışık seviyesini belirleyin
- Bir sıçan için, kayıt yeri onaylandıktan sonra, gerekli uyaran setlerini kaydetmeye devam edin. Örnek bir küme şunları içerebilir
- Hazırlık
- Temizleme
- Izgaranın kaldırılması ve temizlenmesi
- Kayıt bittiğinde, kayıt yazılımını kapatın ve teçhizattaki ışık kaynaklarını yeniden takın.
- Beyin kuruysa, bir şırınga kullanarak beyin yüzeyine küçük bir damla salin uygulayın. Izgarayı kaldırmaya çalışmadan önce tuzlu suyu 30 saniye ila 1 dakika arasında bırakın.
- Mikroskop altında çalışarak, mikromanipülatörler kullanarak ızgarayı beyin yüzeyinden nazikçe kaldırın.
- Izgarayı kaldırırken ek kuvvete ihtiyaç duyulursa, ızgarayı beyinden nazikçe kaldırmak için karbon uçlu forseps (kapalı) kullanın. Izgarayı beyin yüzeyinden nazikçe soymak için mikromanipülatörün hareketinin biraz önde olduğundan emin olun.
- Izgara tamamen çıkarıldıktan sonra, kavrama çatalından ayırın ve 3.6.1.6-3.6.1.7 adımlarını izleyerek temizleyin.
- Izgarayı (konektör kartı hariç) seyreltilmiş bir enzimatik deterjanda (%50 Enzol, %50 damıtılmış su) en az 1 saat bekletin. Daha sonra, saf damıtılmış su içeren ikinci bir banyoya aktarın ve güvenli, temiz bir yerde kurumaya bırakın.
- Izgaranın bazı bölgelerinde kan veya doku birikmişse, nazikçe silerek temizlemek için enzimatik solüsyona batırılmış pamuklu bir üçgen kullanın.
- Kuruduktan sonra ızgarayı kutusuna geri koyun.
- Hayvana ötenazi yapmak
- Bir fare için, hayvanı kafa fiksasyonundan çıkarın ve ötenazi odasına yerleştirin. 5 mL izofluran içeren bir gazlı bez ekleyin ve solunumun kesilmesinden sonra 60 saniye bekleyin. Geri çekilme refleksi eksikliğini doğrulayın ve keskin bir makas kullanarak kafasını kesin.
- Bir sıçan için 0.2 mL pentobarbital IP enjekte edin. Solunumun kesilmesinden sonra 60 saniye bekleyin, hayvanı sırt üstü yatırın ve çift torakotomi yapmak için # 11 bıçak kullanın.
- Ekipmanın temizlenmesi
- Tüm cerrahi aletleri laboratuvar lavabosuna götürün ve cerrahi bir havlu üzerine koyun. Aletlere% 10 çamaşır suyu solüsyonu püskürtün ve lavaboda iyice yıkayın. Daha kirli aletler için, yıkamadan önce bir çamaşır suyu çözeltisine batırılmalarına izin verin.
- Alternatif olarak, aletleri lavaboda bir fırça ile ovarak suyla bir toz deterjan (örneğin Contrex AP) kullanın.
- Aletler temizlendikten ve durulandıktan sonra, alkollü mendillerle silin ve saklama alanlarına geri koyun.
- Çalışma alanını sterilize etme
- Kullanılmış tüm iğneleri ve bıçakları keskin alet kabına atın.
- Kirlenmiş pamuklu çubukları, üçgenleri ve alkollü mendilleri biyolojik tehlike torbasına atın.
- Çalışma alanını kapatmadan önce teçhizat odasındaki tüm çalışma yüzeylerini alkolle silin ve tüm aletleri temizleyin.
- Izgaranın kaldırılması ve temizlenmesi
Sonuçlar
Optogenetik yöntemler ve laminer kayıtlarla birlikte elektrokortikografik sinyallerin kaydedilmesi için protokolleri tanımladık. Burada, farenin somatosensoriyel korteksinden (Şekil 1, Şekil 2 ve Şekil 3) ve sıçanların işitsel korteksinden duyusal stimülasyona yanıt olarak (Şekil 4, Şekil 5 ve Şekil 6) elde edilen tipik sinyaller sunulmaktadır.
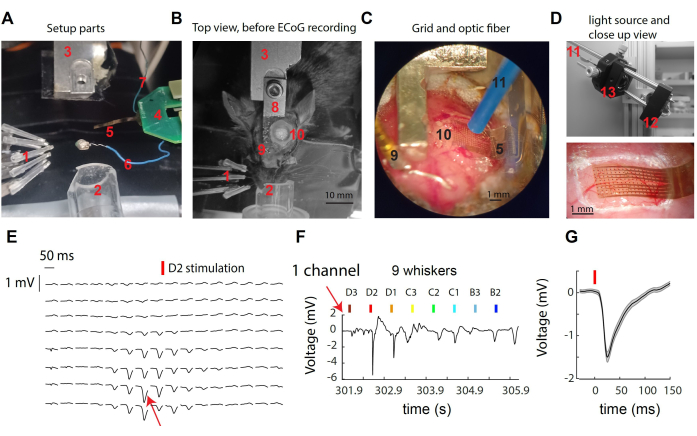
Şekil 1: μECoG sinyallerinin fare bıyık somatosensoriyel korteksi üzerinden kaydedilmesi. (A) Kurulumun bileşenleri. Metne bakın. (B) μECoG kaydından önce cerrahi kurulumun üstten görünümü, baş desteğinin yerleşimini ve kraniyotomi bölgesini gösterir. (C) Açıkta kalan korteks üzerine yerleştirilmiş μECoG ızgarasının ve optik fiberin ayrıntılı görünümü. (D) Üst: Işık kaynağı, kayıt kutusunun dışında bulunur. 473 nm'lik bir LED'den gelen ışık, bir lens tandemi aracılığıyla optik fiberde toplanır. Alt: Örnek bir kayıtta fare korteksi üzerindeki kortikal ızgaranın yakın çekimi. (E) Bıyık D2 stimülasyonuna deneme ortalaması yanıtlarını gösteren tüm 16x8 kanallardan temsili μECoG izleri. (F) Birden fazla bıyıkların tek sapmaları boyunca (E)'de gösterilen tek kanaldan gelen ham voltaj izi. Kanal, bıyık D2'nin uyarılması sırasında en güçlü tepkiyi sergiledi. (G) Bıyık stimülasyonunu takiben keskin bir voltaj sapması sergileyen tek kanaldaki (E, F) denemeler boyunca ortalama uyarılmış yanıt. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 1A-D, fare S1 korteksinde kayıt ve optogenetik manipülasyon için kullanılan sistemin çeşitli bileşenlerinin görüntülerini sağlar. Etiketli elemanlar şunları içerir: 1- 3 x 3 dizide dokuz bağımsız bıyık stimülatörü, izofluran anestezisi için 2- burun konisi, 3- baş direği tutucusu/muadili, 4- μECoG arka uç PCB, çift ZIF konektörlü headstage PCB'ye bağlı; 5- 8 mm'lik esnek bir kablonun ucundaki μECoG elektrot ızgarası; 6- referans teli; 7- topraklama kablosu; 8- Kafa direği implantı; 9- referans altın pim (diş çimentosu ile baş direğinden izole edilmiştir); 10- Sol hemisferde, S1 bıyık fıçı korteksi üzerinde kraniyotomi; 11- 1 mm çapında optogenetik lif (bir mikromanipülatör tarafından tutulur, gösterilmemiştir); 12- bir LED sürücüsü tarafından sürülen yıldız şeklinde bir LED (gösterilmemiştir); 13- Asferik lenslerden oluşan bir tandem aracılığıyla ışık toplama. Tek bir bıyık uyarılırken, az sayıda elektrotta yüzey potansiyelinde hızlı bir sapma gözlenir (Şekil 1E). Bu elektrot kümesi, uyarılmış bıyık30'un kortikal kolonunda zirve yapan yerel sinyali temsil eder. Tek bir elektroda baktığımızda, tercih edilen bıyıkların uyarılmasına en güçlü yanıtı ve daha uzaktaki bıyıkların uyarılmasına daha zayıf veya hiç yanıt vermediğini gözlemliyoruz (Şekil 1F). Bu örnekte, sapmanın başlangıcı, bıyık titreşiminden yaklaşık 10 ms sonra, ortalama 1 mV genlik ile gerçekleşir (Şekil 1G).
Şekil 2, optogenetik inhibisyon sırasında örnek kayıtları sunmaktadır. Işık, ızgaranın şeffaf substratı yoluyla kortikal dokuya ulaşabilir (Şekil 2A). Bununla birlikte, büyük çaplı bir fiber veya uzamsal olarak geniş herhangi bir ışık kaynağı kullanıldığında, fotonlar da elektrotlara çarparak bir opto-elektrik artefakt oluşturur (Şekil 2B). Bu inhibisyon protokolünde, 5 s uzunluğunda kare bir ışık darbesi kullandık. Ortaya çıkan opto-elektrik artefaktlar yalnızca ışığın başlangıcında ve ofsetinde bulunur. Opsin olmayan bir hayvanda, ışık açıkken sunulan bıyık stimülasyonu, ışık kapalıyken yapılan denemelerde sunulan bıyık stimülasyonundan farklı bir tepki uyandırmaz (Şekil 2C). Buna karşılık, uyarıcı nöronların bir alt popülasyonunda inhibitör opsinin ışıkla uyarılması, duyusal olarak uyarılan yanıtın genliğinde bir azalmaya yol açar (Şekil 2D)
Şekil 2C,D, zaman-frekans alanında optogenetik baskılama örneklerini sunar. μECoG verilerini analiz etmek için, önce elektrotlar arasında farklılaşmamış sinyalleri (örneğin nefes alma) çıkarmak için ortak bir ortalama referanslama (CAR) ve ardından zaman içinde aktif frekans bantlarını ortaya çıkaran bir Mors dalgacık dönüşümü uygularız. Frekans alanındaki sinirsel aktivite tipik olarak yaklaşık 1/f 2,3'lük bir güç yasası sergiler. Duyusal uyarılmış sinyali frekans alanı boyunca daha düzgün bir şekilde ortaya çıkarmak için, her frekans bandı için ayrı ayrı Z-puanlaması uyguluyoruz. Z-puanlaması, temel dönemler boyunca sinyalin istatistiklerine dayanır. Burada, deneme başlamadan önce -3000 ms ila -1000 ms arasında uyarandan önce bir zaman penceresi kullanıyoruz. Bu işlem, her frekans bandı için uyaranla uyarılan Z-skorunu verir (Şekil 2C,D).
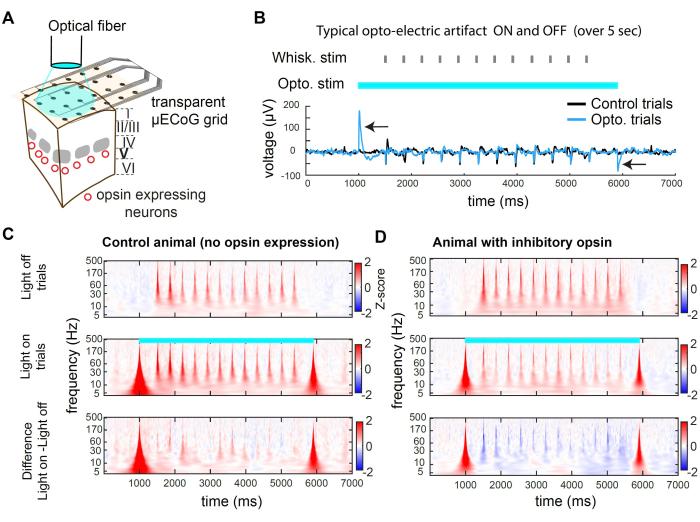
Şekil 2: Farelerde μECoG kaydı sırasında wS1'de optogenetik baskılanma. (A) Temsili bir optogenetik deneyin şeması. Bir optik fiber doğrudan beyne doğrultulur ve inhibitör bir opsin eksprese eden nöronal popülasyonun geçici inhibisyonuna izin verir. (B) Optogenetik stimülasyonun merkezindeki kanalda kaydedilen voltaj izi, denemeler boyunca ortalaması alınmıştır. Siyah ok, 473 nm ışığın başlangıcında ve ofsetinde opto-elektrik artefaktları gösterir. Denemenin ortasında bıyık sapmasına (rastgele bıyık kimliği) verilen yanıta dikkat edin. Artefakt geçicidir ve bir gecikmeden sonra duyusal olarak uyarılan aktivitenin kaydını etkilemez (burada 500 ms). (C) Işıktan kapalı denemelerde, ışıkta denemelerde bir örnek kanalın ortalama spektrogramı ve hiçbir opsin'in ifade edilmediği bir hayvanda ikisi arasındaki fark. Opto-elektrik etkinin geniş bantlı, geçici bir artefakt oluşturduğunu ve bıyıkla uyarılan tepkinin ışıktan etkilenmediğini unutmayın. (D) Işık kapalı denemeleri, ışık açık denemeleri ve st-GtACR2.0'ın katman 5'in uyarıcı nöronlarında ifade edildiği bir Rbp4-Cre faresinde32 ikisi arasındaki fark boyunca örnek deneme ortalamalı spektrogram. Spektrogramda bıyık uyarılmış yanıtının bastırıldığına dikkat edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3, hafif dağıtım sisteminde uygulanması kolay varyasyonları göstermektedir. Daha küçük bir fiber optik veya basit bir lens kullanarak, korteksin15 belirli bir bölgesini hedeflemek mümkündür. Elyaftan çıkan ışık hızla uzaklaşır ve hedeflenen alanın ötesindeki kortikal dokuya ulaşır. Fiber optik çıkışına asferik bir lens (f = 16 mm) ekleyerek, ışığı daha küçük bir yüzey alanına (Şekil 3A,C), kabaca tek bir kortikal sütunun çapına kadar odaklamak mümkündür (Şekil 3C). Işık ayrıca korteks içinde daha az uzaklaşır. İdeal olarak, bir lazer veya tandem lens seti ile güçlü bir ışık kaynağı kullanarak, kolimasyonlu bir ışık demeti ile tek bir kortikal sütunu hedeflemek mümkündür. Bununla birlikte, ışığın doku içinde dağılacağını ve bunun da komşu sütunları kısmen aydınlatabileceğini düşünmek önemlidir. μECoG verilerinde ölçülen ışık artefaktörü, ışığın kortikal yüzey üzerinde nereye iletildiğini ortaya çıkaracaktır; Şekil 3B ile Şekil 3D karşılaştırmasına bakın. Işık artefaktörü, ışık başlangıcından 65 ms sonra yüksek frekans aralığında (500-5 Hz) en yüksek güç olarak ölçülür.

Şekil 3: Korteksin odak noktalarına ışık iletimi. (A) 1 mm çapındaki optik fiberden gelen ışık beyin yüzeyine odaklanır. Bu basit ayarlama, ışığın beyin yüzeyinde ve doku içinde daha hassas bir şekilde hedeflenmesini sağlar. (B) Beyne iletilen ışığın uzamsal boyutu, opto-elektrik artefakttan ölçülür. (C,D) Ayar, 200 μm optik fibere sahip A,B panellerindeki gibidir, bu da kabaca bir kortikal kolon boyutu olan 250 μm çapında bir alanı doğrudan hedeflemesine izin verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sıçan μECoG ve Laminer Politrode kayıtları
Şekil 4A-D, sıçan birincil işitsel korteks kayıtları için kullanılan sistemin çeşitli bileşenlerinin görüntülerini sağlar. Spesifik olarak, etiketli elemanlar şunları içerir: (1) μECoG mikromanipülatör, (2) kemirgen stereotaksik teçhizat, (3) ZIF klipsli konektörlere sahip μECoG kablosu, (4) laminer politrod mikromanipülatör, (5) sıçan burun konisi ve kafa stabilizasyon aparatı, (6) uyaran sunumu için elektrostatik hoparlör, (7) ZIF klips adaptörlü laminer politrod kablo, (8) iki uçlu bir çatalla tutturulmuş μECoGZIF klipsi, (9) 32 kanallı politrode cihazı, (10) elektrostatik hoparlör, (11) cerrahi bölgeyi açık tutmak için timsah klipsleri, (12) biri sol arka kadran veya sağ ön kadrandaki çapak deliklerinden kortekse sokulan ve diğeri dokuya topraklanan topraklama telleri, (13) μECoG ızgarasının yakından görünümü, (14) yerleştirilen politrodun yakından görünümü. Şekil 4E, aynı frekans ve zayıflamaya sahip 50 ms ton piplerine yanıt olarak tek bir μECoG elektrodunun kaydedilen elektrik potansiyellerinden türetilen ortalama nöral spektrogramı göstermektedir (N = 20 deneme). Frekanslar arasında, uyarılan yanıt, uyaran başlangıcından sonra (sol gri noktalı çizgi) 25 ms ile 30 ms (kırmızı düz çizgilerle gösterilir) arasında keskin bir tepe gösterir. Uyaran başlangıcından önceki belirgin tepki (görünüşte nedensel), sabit-Q dönüşümünün daha düşük frekanslarındaki büyük bant genişliğinden kaynaklanır, bu da sinyali filtrelerden (nedensel, ancak bir faz ofsetini indükler) ziyade yumuşatır (nedensel, ancak faz ofseti yoktur). Bu nedenle, en yüksek tepkinin zamanı doğru kalır. Uyarılan tepe yanıtı sırasında, z-skorlu kortikal yüzey elektrik potansiyelinin (CSEP) frekanslar arasında multimodal olduğunu gözlemledik. Spesifik olarak, üç birincil harmonik olmayan tepe sergiledi: 40-180 Hz gama/yüksek gama (γ/Hγ) aralığında birincisi ve en büyüğü, ikincisi 200-450 Hz ultra yüksek gama (uHγ) aralığında ve çok birimli aktivite (MUA) ile ilişkili 500 Hz'nin üzerinde son bir tepe noktası (Şekil 4F)11. Bu uyaranla uyarılmış multimodal yapı, tüm ayarlanmış elektrotlarda sağlamdır. Burada, insan elektrokortikografi (ECoG) kayıtlarındaki yaygınlığı nedeniyle Hγ'ya odaklanıyoruz31. Şekil 4G'de, kortikal yüzey elektrik potansiyellerini (CSEP'ler) ve kortikal laminalar boyunca ani yükselme aktivitesini aynı anda ölçmek için bir silikon laminer politrod boyunca subdural olarak yerleştirilmiş bir μECoG dizisini gösteriyoruz. Özel olarak üretilmiş μECoG dizisi, 20 μm aralıklı ve 4 μm temas çapına sahip 8×16 elektrottan oluşuyordu ve 4 μm aralıklı ve 1 μm temas çapına sahip 2 × 16 kanal olarak yapılandırılmış 32 kanallı bir laminer politrode kullandık. μECoG dizisi, tüm sıçan birincil işitsel korteksini (A1) kaplayacak kadar büyüktü ve küçük 4 μm çapındaki elektrotları, işitsel akort türetmek için uygun yerel CSEP'lerin ölçülmesini sağladı. μECoG yüksek gama (Hγ) sinyalinin uzamsal çözünürlüğü ~20 μm'dir ve bir sıçan kortikal kolonunun yarıçapı ile karşılaştırılabilir. Böylece, μECoG, kortikal aktivitenin "sütunlu bir görünümünü" sağlar. μECoG ızgarasındaki delikler, laminer politrodun yüzey temasları arasında geçmesine izin vererek, kortikal laminalar boyunca nöronal aktivitenin doğrudan kaydedilmesini sağlar (Şekil 4H). μECoG ve laminer politrot elektrotlardan kaydedilen örnek voltaj izleri Şekil 4I'de gösterilmiştir.

Şekil 4: Sıçan primer işitsel korteksi (A1) üzerinden μECoG ve laminer politrod sinyallerinin kaydedilmesi. (A) μECoG ve laminer politrod kurulumunun bileşenleri. Metne bakın. (B) Baş desteğinin ve kraniyotomi bölgesinin yerleşimini gösteren μECoG ve laminer politrod kayıttan önce cerrahi kurulumun üstten görünümü. (C) Açıkta kalan işitsel korteks üzerinde μECoG ızgarasının ve laminer politrodun ayrıntılı görünümü. (D) Tek tek elektrotların boyutu (40 μm) ve elektrotlar arasındaki (200 μm) dahil olmak üzere korteks üzerindeki μECoG ızgara yerleşiminin yakından görünümü. (E) Tek bir frekans-zayıflama çiftine tek kanallı bir yanıtın ortalama z-skorlu dalgacık ayrışması. Dikey kırmızı çizgiler, F.(F) Kırmızı- Tek bir frekans-zayıflama çiftinin 20 sunumu boyunca ortalama tepe frekans yanıtında gösterilen tepe frekans yanıt periyodunu gösterir. Gri- Standart hata. Frekans ekseni bir log ölçeğindedir. Kanonik nöral frekans bantları üst kısımda belirtilmiştir. (G) Sıçan primer işitsel korteksinin (A1) yüzeyindeki 8 16 μECoG'luk bir ızgaranın fotomikrografı. Merkez μECoG penceresine 32 kanallı bir laminer politrod yerleştirilmiştir. (H) Kortikal aktivitenin 3D çok ölçekli kaydının şeması. (I) Üst: 50 ms saf ton piplerinin spektrogramı. Orta: Kırmızı renkte, 4 μECoG elektrotların ortalama kortikal yüzey elektrik potansiyeli (gri). Alt: 32 kanallı laminer politrot voltaj izleri kortikal derinliğe göre düzenlenmiştir Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5, bir laminer silikon politrod (Camb64) kullanılarak bir sivri uç aktivitesi ile aynı anda μECoG sinyallerinin kaydını göstermektedir. Bir yüzey elektrodundan kaydedilen μECoG sinyali, bir ham voltaj izi (Şekil 5A) ve dalgacık dönüşümü olarak gösterilir ve zaman içinde frekans ayrışmasını vurgular (Şekil 5B). Çok birimli aktivite, tek bir kanaldan (Şekil 5C) temsili bir ham voltaj izi ile gösterildiği gibi, politrot kullanılarak kaydedildi, burada bireysel aksiyon potansiyelleri (sivri uçlar) basit bir eşikleme yöntemi (-120 μV eşiğini geçen voltaj) kullanılarak tespit edildi. Bu kanaldan çıkarılan spike dalga formları, birden fazla nöron kaynağından kaynaklanabilmelerine rağmen, spikeların çoğu için iyi tanımlanmıştır (Şekil 5D, ek). Aynı penetrasyondaki birden fazla kanalda, ortalama ani yükselme dalga biçimleri, iyi tanımlanmış ani yükselme aktivitesi kayıtlarının tutarlılığını daha da doğrular (Şekil 5E). Bu nedenle, bu kayıt yöntemleri, ani sıralama analizi ve ani yükselme aralığı veya ateşleme oranları gibi kalite ölçümlerinin analizi ile tek birimli kaydı destekleyebilir (Şekil 5F). Özetle, laminer prob kayıtlarının kalitesi, tek kanallarda net dalga formu morfolojisi ile iyidir. Bu sonuçlar, bu yöntemin μECoG ve spiking aktivitesinin aynı anda elde edilmesini sağladığını göstermektedir.

Şekil 5: μECoG ve sütunlu spiking aktivitesinin eş zamanlı kayıtları. (A) Tek bir μECoG kanalından örnek ham voltaj izi. (B) Aynı μECoG kanalının zaman içinde frekans ayrışmasını gösteren dalgacık dönüşümü. (C) Basit bir voltaj eşiği kullanılarak tespit edilen aksiyon potansiyellerini (ani yükselmeler) gösteren tek bir politrot kanalından (akut 64 kanallı silikon prob camb64) örnek ham voltaj izi. (D) Voltaj genliğinin dağılımına bağlı olarak (C) hizalanmış ve renk kodlu politrot kanalından çıkarılan spike dalga biçimleri. 142 spike dalga formundan 7'si, spike genişliği ve genliği açısından ana kümeye olan uzaklıklarına bağlı olarak aykırı değerler olarak kabul edildikleri için gösterilmemiştir (bkz. (E) Aynı penetrasyonda 9 kanaldan çıkarılan ortalama çok birimli spike dalga biçimleri. (F) Farklı politrot kanalları (örneğin, Kanal 21, 27, 63 ve 61) için ani yükselme aralığı (ISI) histogramları, karşılık gelen ateşleme hızları (FR) Hz cinsinden gösterilir. ISI ihlalleri (5 ms<), tüm birimlerdeki ani artışların %5'inden daha azını temsil ediyordu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Özel olarak tasarlanmış μECoG dizisi ve laminer politrodu kullanarak eşzamanlı kayıt yapabilme özelliği sayesinde, μECoG sinyallerinin işitsel ayarlama açısından kortikal derinlik boyunca nöral birim kayıtlarına kıyasla nasıl olduğunu araştırdık. Şekil 6A , işitsel uyaran frekansı ve genliğinin bir fonksiyonu olarak yüksek gama (Hγ) tepkisini gösteren Frekans-Tepki Genliği (FRA) grafiklerini sunar. Üst panel, işitsel korteks üzerine yerleştirilmiş μECoG elektrotlarının 2 × 16 alt kümesinden FRA'ları gösterirken, alt panel, μECoG dizisinin deliklerinden (gri oklarla gösterilir) yerleştirilen 1×16 laminer politrot elektrot alt kümesinden FRA'ları görüntüler. Dikkat çekici bir şekilde, μECoG elektrotlarından elde edilen FRA'lar, laminer politrot kayıtlarından elde edilenlere çok benzer, bu da μECoG sinyallerinin kortikal katmanlar boyunca nöral birim aktivitesine benzer şekilde ayarlandığını düşündürür.
μECoG dizisinin yüksek uzamsal çözünürlüğünden yararlanarak, Hγ aktivitesi11'e dayalı olarak çoklu işitsel kortikal alanların yüksek çözünürlüklü bir tonotopik haritasını oluşturduk. Şekil 6B'de, her elektrotun en iyi frekansı renk kodludur ve kortikal yüzey boyunca tonotopik organizasyonu ortaya çıkarır. 8 × 16 μECoG dizisi, birincil işitsel korteks (A1), arka işitsel alan (PAF) ve ventral işitsel alan (VAF) dahil olmak üzere birkaç işitsel kortikal alanı kapsıyordu ve yaklaşık sınırları siyah çizgilerle sınırlıydı. Bu ayrıntılı haritalama, μECoG dizisinin kortikal aktivitenin "sütunlu bir görünümünü" sağlama yeteneğinin altını çizerek, bir sıçan kortikal kolonunun boyutlarıyla karşılaştırılabilir 20 μm'den daha az bir uzamsal çözünürlükle fonksiyonel organizasyonu yakalar. Bu bulgular, μECoG kayıtlarının yalnızca kortikal derinlik boyunca nöral birim kayıtlarında gözlemlenen akort özelliklerini yansıtmakla kalmayıp, aynı zamanda fonksiyonel kortikal organizasyonun yüksek çözünürlüklü haritalanmasını da mümkün kıldığını göstermektedir.
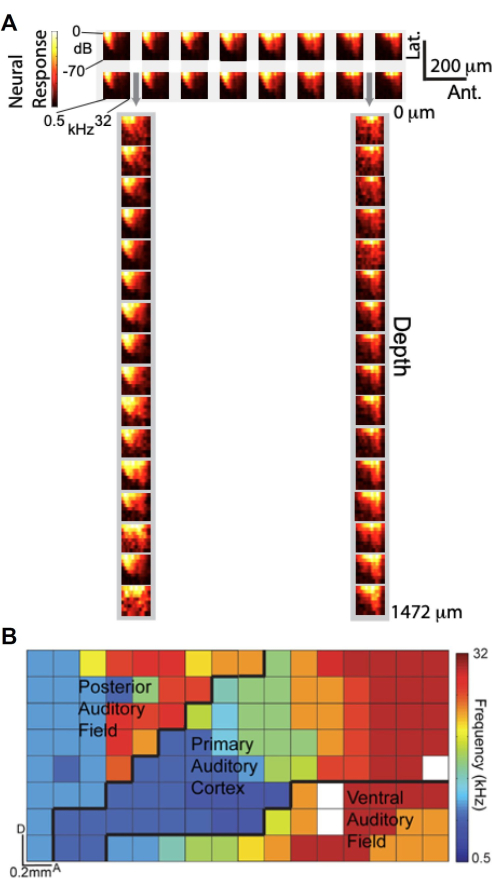
Şekil 6. μECoG sinyalleri, derinlik boyunca nöral birim spike kayıtlarına benzer şekilde ayarlanır ve işitsel korteksin tonotopik organizasyonunu ortaya çıkarır. (A) İşitsel uyaranın frekansının (x ekseni) ve genliğinin (y ekseni) bir fonksiyonu olarak yüksek gama tepkisini (renk çubuğu) gösteren Frekans-Tepki Genlik grafikleri (FRA'lar). (yukarıya) İşitsel korteks üzerindeki μECoG elektrotlarının 2 16 alt kümesinden FRA'lar; (altta) μECoG dizisindeki deliklerden sokulan laminer politrot elektrotların 1 16 alt kümesinden FRA'lar, gri oklarla gösterilir. (B) Yüksek gama aktivitesinden türetilen çoklu işitsel kortikal alanların yüksek çözünürlüklü tonotopik organizasyonu. Her piksel, o elektrotun en iyi frekansına göre renk kodludur. Burada görüntülenen 8x16 μECoG dizisi, birden fazla işitsel kortikal alanı (A1, PAF ve VAF) kapsar ve yaklaşık sınırlar sınırlandırılmıştır (siyah çizgiler). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan protokoller, yüksek yoğunluklu mikro-elektrokortikografi (μECoG) dizilerinin laminer problar ve optogenetik tekniklerle entegre edilmesini sağlar. Bu protokolün kemirgen modellerinde kullanım kolaylığı, onu kortikal dinamiklerin araştırılması için güçlü bir araç haline getirir ve denek sayısı kolayca artırılabilir. Yüksek yoğunluklu μECoG ızgarası, farelerde ve sıçanlarda birden fazla alanda kortikal topografyanın verimli, uzamsal olarak hassas bir şekilde haritalanmasına olanak tanır ve beyin organizasyonunda topografik temsillerin kritik rolünden yararlanır33. Laminer kaydın eklenmesi, çoklu uzamsal ve zamansal ölçeklerde kortikal dinamiklerin incelenmesine izin verir. Optogenetiğin dahil edilmesi, belirli nöral popülasyonlar arasındaki ilişkileri ve bunların kortikal yüzey uyarılmış potansiyellere (CSEP'ler) ve kortikal işlemeye katkılarını belirlemek için nedensel manipülasyonu mümkün kılar34.
Optogenetik, belirli nöronal popülasyonların seçici modülasyonuna izin vererek, kortikal aktivite paternleri oluşturmadaki nedensel rollerinin araştırılmasını sağlar ve imzaları μECoG ile algılanabilen hesaplamaya katılır. Örneğin, çalışmalarımız belirli bir hücre tipini hedeflemenin kortikal yüzey elektrik potansiyellerini (CSEP'ler) değiştirebileceğini göstermektedir. Bu yaklaşım, μECoG sinyallerinin nöral hücre tipi temelini incelemek için kullanılabilir ve hangi nöronal hücre tiplerinin, yüksek gama bandında gözlemlenenler gibi karakteristik duyusal uyarılmış aktivitelere katkıda bulunduğunu belirlememize olanak tanır. Farklı frekans bantlarındaki21 kortikal ritimler veya seyahat eden dalgalar35,36 dahil olmak üzere uzamsal olarak organize edilmiş aktivite gibi diğer büyük ölçekli fenomenler de benzer şekilde araştırılabilir. Ek olarak, belirli devre mekanizmalarını keşfetme fırsatları sağlayan bir dizi genetik olarak değiştirilmiş fare hattı ve opsin kolayca temin edilebilir. Optogenetik teknikler, çevre bastırma38 veya algısal bağlanma 39 gibi çeşitli duyusal hesaplamalarda çok önemli bir rol oynayan sütunlar37 arasındaki yatay bağlantıların işlevsel etkilerini incelemek için kullanılabilir. Özetle, optogenetik yoluyla nöronal aktiviteyi manipüle etme yeteneği, belirli nöronal popülasyonlar ile CSEP'lerin özellikleri arasındaki veya μECoG ile ölçülebilen popülasyon ve spesifik kortikal hesaplamalar arasındaki bağlantıların test edilmesini sağlar. Bu yaklaşım, lokal nöral yapılar ve global kortikal aktivite arasındaki ilişkileri etkili bir şekilde inceleyebilir.
Laminer politrod kayıtlar, küçük kortikal hacimlerde, yani tek bir kortikal kolon içinde birden fazla nörondan tek nöron aktivitesinin örneklenmesini sağlar. Bu kayıtlar çok önemlidir, çünkü bireysel nöronlar, Quiroga ve arkadaşları tarafından tanımlanan "Jennifer Aniston nöronları" gibi40 gibi uyaranların seçici kodlamasını kullanarak veya karışık seçicilik 41'de görüldüğü gibi daha yüksek boyutlu bir uzayda tamamlayıcı temsiller sağlayarak farklı bilgileri bağımsız olarak kodlayabilir. Geleneksel olarak, elektrofizyologlar nöral aktiviteyi basit, parametrik olarak tasarlanmış uyaranlar ve davranışlar bağlamında incelediler (örneğin, burada konuşlandırıldığı gibi tek bıyık sapması veya saf tonlar). Bu tür uyaranların temsili oldukça uzamsal olarak lokalize olma eğilimindedir (örneğin, tek tek sütunlar). Bununla birlikte, etolojik olarak ilgili birçok uyaran ve davranış daha karmaşıktır ve bu nedenle, bu tür paradigmalar sırasındaki tipik sinirsel aktivite kalıpları sıklıkla tek sütunların ötesine uzanır - hatta beynin her yerine42. Bu durumlarda μECoG, aynı anda birden fazla sütunda yüksek zamansal çözünürlüklü, sütunlu çözümlenmiş etkinliği yakalayan kapsamlı bir okuma sunar. Özetle, burada açıklanan protokol, tek tek kortikal sütunlar içindeki yerel işleme ile tüm kortikal alanda ve alanlar arasında birden fazla sütunda meydana gelen daha kapsamlı dinamikler arasındaki boşluğu etkili bir şekilde kapatır.
Genel rehberlik ve sorun giderme olarak birkaç öneri öneriyoruz. Konvansiyonel akut in vivo elektrofizyolojik protokoller tipik olarak, maruz kalan beynin sağlığını uzatmanın bir yolu olarak maruziyet sırasında beynin ıslak tutulmasını önerir. Bu, bazı durumlarda muhtemelen yararlı olsa da, deneyimlerimiz kemirgenlerde μECoG kayıtları için bunun tersinin geçerli olduğunu göstermektedir. Gerçekten de, μECoG dizileri hafif kuru bir kortikal yüzeye yerleştirildiğinde kayıt kalitesinin niteliksel olarak daha iyi olduğunu bulduk. Bunun, kortikal yüzey ile kayıt elektrotları arasında konumlandırılmış oldukça iletken bir iyonik çözelti olan salinin beyin tarafından üretilen elektrik sinyallerini homojenize etmesi nedeniyle ortaya çıktığına inanıyoruz. Etkili bir şekilde, salin elektrotları birlikte 'kısa devre' yapar. μECoG şebekeleri, nöron popülasyonları tarafından üretilen sürekli elektrik alanını izlediğinden, elektrofizyolojik sistemlerin iyi bir şekilde monte edilmesini ve gürültüden arındırılmasını sağlamak önemlidir. Kayıtlar sırasında, referans elektrodu ile bağlantı kritik öneme sahiptir. Kayıt sırasında iyileştirme yapılmadan, verilerin ön işlenmesi, hat gürültüsünü gidermek için 50 Hz veya 60 Hz'de bir çentik filtresi içerebilir. Bununla birlikte, bu sinyali önemli ölçüde değiştirecektir ve bu nedenle sonraki analizlerde hesaba katılmalıdır. Optogenetik ışık stimülasyonu göz önüne alındığında, opto-elektrik artefakt deneysel tasarımda en aza indirilmeli veya en azından hesaba katılmalıdır (örneğin, ışığın başlangıcını veya ofsetini takiben bir gecikme dahil edilerek). İdeal olarak, ışık, küçük bir fiber optik çap kullanılarak veya ışığı odaklayarak veya kolime ederek elektrotlar arasındaki alana iletilir. Bu artefakt tamamen önlenemezse (ancak şeffaf elektrotlar dahil olmak üzere farklı prob tasarımları 15,20,43 öneren çalışmalara bakınız), gerekli olan en az miktarda ışık kullanılarak azaltılabilir. Yeni nesil opsinler etkinlik için daha az ışığa ihtiyaç duyar44,45. Deneyden önce optogenetik ışık gücünü laminer problar kullanarak kalibre etmenizi öneririz. Artefakt şekli, ışık uyaranındaki keskin geçişlerden kaçınılarak da değiştirilebilir ve azaltılabilir (örneğin, kare darbe yerine hafif bir rampa kullanılarak). Her halükarda, opsin eksprese etmeyen hayvanları kullanan kontrol koşulları, nöral aktivitedeki gerçek değişiklikleri artefaktla ilgili sinyallerden ayırt etmek için tavsiye edilir. Son olarak, elektrodepozisyon işlemi, kayıtlar sırasında mekanik stabiliteyi korurken elektrot ve doku arasındaki yük transferini artıran, elektrot empedansını çıplak platine kıyasla 1-2 kat azaltan ve daha iyi nöral sinyal algılamayı sağlayan pürüzlü, yüksek yüzey alanlı bir kaplama oluşturur46.
Akut μECoG, deney düzeneklerinde esneklik ve daha az karmaşıklık sunarak, onlarca dakikalık kayıtlar boyunca nöral aktivitenin ayrıntılı bir şekilde haritalandırılmasına olanak tanır. Orta ölçekli bir yöntem olarak, sinyallerin kesin kaynakları belirsizliğini korusa da, kortikal aktivitenin alanlar arası ancak tüm beyin değil, izlenmesini sağlar 1,47. Gelecekte, multimodal çalışmalar sinyalin kökeninin daha iyi bir resmini sağlamalıdır. Akut μECoG, uzun vadeli nöral dinamikleri yakalamada sınırlıdır ve cerrahi iyileşme veya anestezi gibi geçici faktörlerden etkilenebilir48,49. Buna karşılık, kronik μECoG, nöral aktivitenin uzun süreli gözlemlenmesini sağlayarak öğrenme, plastisite ve hastalığın ilerlemesi gibi süreçler hakkında içgörüler sağlar10,13. Kronik μECoG ayrıca elektrot stabilitesi, potansiyel sinyal bozulması ve doku skarlaşması veya enfeksiyon dahil olmak üzere uzun süreli implantasyonla ilişkili riskler gibi zorluklar da sunar50,51. Bu zorluklar, penetran elektrotlarla karşılaştırıldığında daha az şiddetli olma eğilimindedir ve farelerde μECoG'nin epidural implantasyonu ile (daha düşük sinyal kalitesi pahasına) daha da azaldığı varsayılmaktadır52. Aynı μECoG ızgarasını aynı veya farklı hayvanlarda birçok seansta yeniden kullanmak, bir seansın sonunda ızgarayı çıkarmak ve bir sonraki seansta değiştirmek mümkündür. Bu subakut konfigürasyonda, beyin her zaman nemli tutulmalı ve seanslar arasında cam bir lamel ile korunmalıdır. μECoG ızgaralarının oldukça dayanıklı olduğunu gözlemledik; Tek bir ızgara, uygun kullanım ve temizlik ile ~ 20 kez yeniden kullanılabilir, bu da onları uygun maliyetli kayıt cihazları haline getirir. Izgaralar, çeşitli sayı ve elektrot yerleşimleri geometrileri ile tasarlanabilir. Buradaki sonuçlar, elektrot aralığının <200 μm'ye düşürülmesinin, altta yatan korteksteki nöral temsillerin tanecikliği nedeniyle fonksiyonel çözünürlükte yalnızca ihmal edilebilir iyileşmelere yol açtığını göstermektedir.
Açıklamalar
Yazarlar rekabet eden hiçbir mali çıkar beyan etmemektedir.
Teşekkürler
Bu çalışma, Lawrence Berkeley Ulusal Laboratuvarı LDRD Sinir Sistemleri ve Makine Öğrenimi Laboratuvarı (K.E.B.), NINDSR01 NS118648A (K.E.B. & D.E.F.) ve NINDS R01 NS092367 (D.E.F.) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 disposable #11 blade | Swann Morton | 303 | For surgical procedures |
| 2 disposable #10 blades | Swann Morton | 3901 | For surgical procedures |
| 30 mm cage bars | Thorlabs | ER | cage components |
| 30 mm cage plate | Thorlabs | CP33T | holding the lenses |
| 70% ethanol | Decon Labs | V1016 | Cleaning / Disinfectant (diluted to 70%) |
| Amalgambond PLUS Adjustable Precision Applicator Brush Teal 200/Bx | Henry Schein | 1869563 | precision applicator for the cement |
| Amalgambond PLUS Catalyst 0.7 mL Syringe Ea | Henry Schein | 1861119 | cement component |
| Amplifier (Tucker-Davis Technologies) | Tucker-Davis Technologies | PZ5M-512 | Used for auditory stimulus and recording software. |
| Articulated arm | Noga | DG60103 | for holding the fine adjustment screw system |
| Aspheric lenses for light collection (and one for focusing the light) | Thorlabs | ACL25416U-B | for collecting LED light |
| Auditory equipment | Tucker-Davis Technologies, Sony, Cortera | RP2.1 Enhanced Real-Time Processor/HB7 Headphone Drive | Used for auditory stimulus and recording software. |
| Buprenorphine | Sterile Products LLC | #42023017905 | General analgesia |
| C&B Metabond Base Cement Ea | Henry Schein | 1864477 | cement component |
| C&B Metabond L-Powder Cement Clear 3 g | Henry Schein | 1861068 | cement component |
| Chlorprothixene hydrochloride (mouse) | Sigma Aldrich | Cat. No. C1671 | For sedation, must be prepared the same day and kept at 4 |
| Custom-designed 128-channel micro-electrocorticography (μECoG) grids | Neuronexus | E128-200-8-40-HZ64 | For neurophysiology recordings. Placed onto the cortex. |
| Dengofoam gelatin sponges | Dengen dental | 600034 (SKU) | can be used dry or wet, saturated with sterile sodium chloride solution |
| Drill bit, size 5 to 9 (Mouse) | Fine Science Tools | 19007-XX | XX is the size of the drill bit e.g. 05 or 09. For mouse procedures |
| Drill bitSteel Round Bur (5.5 mm/7.5 mm) | LZQ Tools | Dental Bar Drill Bit Stainless Steel Bur | For rat procedures |
| Dumont No. 5 forceps | Fine Science Tools | 11251-10 | For surgical procedures |
| Dumont tweezers #5 bent 45° | World precision instruments | 14101 | for removing craniotomy window |
| DVD Player (Sony) | Sony | CDP-C345 | System used to accept and play back stimulus sets |
| Electrostatic Speaker | Sony | XS-162ES | Used for auditory stimulus and recording software. Located within the rig, plays sound to the sedated rodent |
| Enzymatic detergent (Enzol) | Advanced sterilization products | 2252 | Cleaning/Disinfectant |
| EverEdge 2.0 Scaler Sickle Double End H6/H7 #9 | Henry Schein | 6011862 | for scrubing the skull |
| Fine adjustment screw system in 3 dimension | Narishige | U-3C | for precise positioning of the optical fiber end |
| Gold pin | Harwin Inc | G125-1020005 | Used for contact reference in mouse Soldered to the silver wire |
| Gripping forceps | Fine Science Tools | 00632-11 | For surgical procedures |
| Isoflurane | Covetrus | 11695067772 | require a vaporizer |
| Ketamine (Hydrochloride Injection) (Rat) | Dechra | 17033-101-10 | Anesthesia/Analgesic |
| LED | New Energy | LED XLAMP XPE2 BLUE STARBOARD | Blue LED light source |
| LED driver | Thorlabs | LEDD1B | LED driver |
| Lidocaine | Covetrus | VINB-0024-6800 | to be diluted to 1% in saline |
| Meloxicam | Covetrus | 6451603845 | Anti-inflammatory used for general analgesia |
| Micromanipulator | Narishige (Stereotaxic Rig) | SR-6R + SR-10R-HT components | Used to manipulate ECoG and rodent with fine movements |
| No. 2 forceps | Fine Science Tools | 91117-10 | For surgical procedures |
| No. 55 forceps | Fine Science Tools | 1129551 | For surgical procedures |
| Ophtalmic lubricant (Artificial tears) | Akorn | 17478-062-35 | Used to protect eyes from dessication during surgical procedures |
| Optical fiber 200µm Core diameter | Thorlabs | M133L02 | FC/PC connector 2 m long |
| Pentobarbital (Rat) | Covetrus / Dechra | VINV-C0II-0008 | Anesthesia/Analgesic |
| Platinum Black | Sigma | 205915-250MG | For neurophysiology recordings (Used for electroplating the contacts on the μECoG grids). |
| Povidone Iodine 10% | Betadine | https://betadine.com/medical-professionals/betadine-solution/ | no catalog number ( not retail ) |
| Powder detergent (Contrex AP) | Decon Labs | 5204 | Cleaning / Disinfectant |
| Pre-cut tape for oxygen tube | ULINE (Various Providers) | S-14726 | Used to attach oxygen tube to the nose-cone of the rodent stereotaxic rig |
| Scalpel handle # 3 | World precision instruments | 500236-G | for blades # 10, #11 and #15 |
| Scraper | Fine Science Tools | 1007516 | For surgical procedures |
| Short 30 G needles | ExelInt | 26437 | For surgical procedures and injections |
| Silver Wire | Warner Instruments | 63-1319 | For neurophysiology recordings (Used for grounding and as a reference electrode). |
| Sterilized saline (0.9% sodium chloride for injection) | Hospira | 00409-7101-67 (NDC) | For dilution of injectable, and replacement of body fluids |
| Stoelting Hopkins Bulldog | Fine Science Tools | 10-000-481 | For surgical procedures |
| Surface disinfectant (Coverage Plus NDP Disinfectant) | Steris life science | 638708 | Cleaning/Disinfectant |
| TDT ZIF-clip connectors for acquisition. | Tucker-Davis Technologies | ZIF-Clip Analog Headstages | Connects ECoG with outside acquisition equipement |
| Two-pronged holding fork | Tucker-Davis Technologies | Z-ROD128 | Used to connect the TDT-clips with the micromanipulator |
| Xylazine (Rat) | Covetrus | 1XYL006 | Anesthesia/Analgesic |
Referanslar
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nunez, P. L., Srinivasan, R. . Electric Fields of the Brain: The Neurophysics of EEG. , (2006).
- Mountcastle, V. B., Powell, T. P. Central nervous mechanisms subserving position sense and kinesthesis. Bull Johns Hopkins Hosp. 105, 173-200 (1959).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci. 18 (2), 310-315 (2015).
- Lewis, C. M., Bosman, C. A., Womelsdorf, T., Fries, P. Stimulus-induced visual cortical networks are recapitulated by spontaneous local and interareal synchronization. Proc Natl Acad Sci U S A. 113 (5), E606-E615 (2016).
- Bouchard, K. E., Mesgarani, N., Johnson, K., Chang, E. F. Functional organization of human sensorimotor cortex for speech articulation. Nature. 495 (7441), 327-332 (2013).
- Ledochowitsch, P., et al. Fabrication and testing of a large area, high density, parylene MEMS µECoG array. , (2011).
- Bosman, C. A., et al. Attentional stimulus selection through selective synchronization between monkey visual areas. Neuron. 75 (5), 875-888 (2012).
- Rubehn, B., Bosman, C., Oostenveld, R., Fries, P., Stieglitz, T. A MEMS-based flexible multichannel ECoG-electrode array. J Neural Eng. 6 (3), 036003 (2009).
- Baratham, V. L., et al. Columnar localization and laminar origin of cortical surface electrical potentials. J Neurosci. 42 (18), 3733-3748 (2022).
- Kellis, S., et al. Decoding spoken words using local field potentials recorded from the cortical surface. J Neural Eng. 7 (5), 056007 (2010).
- Viventi, J., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci. 14 (12), 1599-1605 (2011).
- Ledochowitsch, P., Olivero, E., Blanche, T., Maharbiz, M. M. A transparent µECoG array for simultaneous recording and optogenetic stimulation. , (2011).
- Ledochowitsch, P., et al. Strategies for optical control and simultaneous electrical readout of extended cortical circuits. J Neurosci Methods. 256, 220-231 (2015).
- Dougherty, M. E., Nguyen, A. P. Q., Baratham, V. L., Bouchard, K. E. Laminar origin of evoked ECoG highgamma activity. Annu Int Conf IEEE Eng Med Biol Soc. 2019, 4391-4394 (2019).
- Tian, H., Xu, K., Zou, L., Fang, Y. Multimodal neural probes for combined optogenetics and electrophysiology. iScience. 25 (1), 103612 (2022).
- Gonzales, D. L., et al. A translaminar spacetime code supports touchevoked traveling waves. bioRxiv. , (2024).
- Leonard, M. K., et al. Largescale singleneuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Renz, A. F., et al. OptoEDura: a soft, stretchable ECoG array for multimodal, multiscale neuroscience. Adv Healthc Mater. 9 (17), 2000814 (2020).
- Buzsáki, G. . Rhythms of the brain. , (2006).
- Yang, W., et al. A fully transparent, flexible PEDOT:PSS-ITO-Ag-ITO based microelectrode array for ECoG recording. Lab Chip. 21 (6), 1096-1108 (2021).
- Buzsáki, G. Largescale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Schalk, G., et al. Realtime detection of eventrelated brain activity. Neuroimage. 43 (2), 245-249 (2008).
- Kellis, S., et al. Multiscale analysis of neural activity in humans: implications for microscale electrocorticography. Clin Neurophysiol. 127 (1), 591-601 (2016).
- Buzsáki, G., Schomburg, E. W. What does gamma coherence tell us about interregional neural communication. Nat Neurosci. 18 (4), 484-489 (2015).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecondtimescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Cardin, J. A., et al. Driving fastspiking cells induces gamma rhythm and controls sensory responses. Nature. 459 (7247), 663-667 (2009).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decisionrelated activity propagate in a cortical feedback loop during touch perception. Nat Neurosci. 19 (9), 1243-1249 (2016).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56 (2), 339-355 (2007).
- Crone, N. E., Sinai, A., Korzeniewska, A. Highfrequency gamma oscillations and human brain mapping with electrocorticography. Prog Brain Res. 159, 275-295 (2006).
- Gerfen, C. R., Paletzki, R., Heintz, N. GENSAT BAC crerecombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron. 80 (6), 1368-1383 (2013).
- Mountcastle, V. The columnar organization of the neocortex. Brain. 120 (4), 701-722 (1997).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Muller, L., Chavane, F., Reynolds, J., Sejnowski, T. J. Cortical travelling waves: mechanisms and computational principles. Nat Rev Neurosci. 19 (5), 255-268 (2018).
- Sato, T. K., Nauhaus, I., Carandini, M. Traveling waves in visual cortex. Neuron. 75 (2), 218-229 (2012).
- Gilbert, C. D., Wiesel, T. N. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortex. J Neurosci. 9 (7), 2432-2442 (1989).
- Angelucci, A., et al. Circuits and mechanisms for surround modulation in visual cortex. Annu Rev Neurosci. 40 (1), 425-451 (2017).
- Singer, W., Gray, C. M. Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci. 18, 555-586 (1995).
- Quiroga, R. Q., et al. Invariant visual representation by single neurons in the human brain. Nature. 435 (7045), 1102-1107 (2005).
- Fusi, S., Miller, E. K., Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr Opin Neurobiol. 37, 66-74 (2016).
- Stringer, C., et al. Spontaneous behaviors drive multidimensional, brainwide activity. Science. 364 (6437), eaav7893 (2019).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using celltypespecific expression of channelrhodopsin2. Nat Protoc. 5 (2), 247-254 (2010).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nat Neurosci. 21 (6), 881-893 (2018).
- Mahn, M., et al. Highefficiency optogenetic silencing with somatargeted anionconducting channelrhodopsins. Nat Commun. 9 (1), 4125 (2018).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating lowimpedance tetrodes by electroplating with additives. Sens Actuators A Phys. 156 (2), 388-393 (2009).
- Halnes, G., et al. . Electric Brain Signals: Foundations and Applications of Biophysical Modeling. , (2024).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nat Rev Neurosci. 9 (5), 370-386 (2008).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and anesthesia. Science. 322 (5903), 876-880 (2008).
- Schalk, G., Leuthardt, E. C. Braincomputer interfaces using electrocorticographic signals. IEEE Rev Biomed Eng. 4, 140-154 (2011).
- Chestek, C. A., et al. Longterm stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex. J Neural Eng. 8 (4), 045005 (2011).
- Branco, M. P., et al. Nine decades of electrocorticography: a comparison between epidural and subdural recordings. Eur J Neurosci. 57 (8), 1260-1288 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır