Method Article
Études multi-échelles du traitement cortical par intégration de polytrodes laminaires et d’optogénétique avec micro-électrocorticographie chez les rongeurs
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons deux protocoles d’enregistrement par micro-électrocorticographie à haute densité (μEcoG) chez le rat et la souris, y compris les méthodes chirurgicales, d’implantation et d’enregistrement. Les enregistrements μECoG sont effectués en combinaison avec l’enregistrement de polytrodes laminaires dans le cortex auditif du rat ou avec la manipulation optogénétique de l’activité neuronale dans le cortex somatosensoriel de la souris.
Résumé
L’électrocorticographie (ECoG) est un pont méthodologique entre les neurosciences fondamentales et la compréhension du fonctionnement du cerveau humain dans la santé et la maladie. ECoG enregistre les signaux neurophysiologiques directement à partir de la surface corticale à une résolution temporelle de l’ordre de la milliseconde et à une résolution spatiale en colonnes sur de grandes régions de tissu cortical simultanément, ce qui le rend particulièrement bien placé pour étudier les calculs corticaux locaux et distribués. Nous décrivons ici la conception de dispositifs micro-ECoG (μECoG) personnalisés à haute densité et leur utilisation dans deux procédures. Ces grilles sont dotées de 128 électrodes à faible impédance avec un espacement de 200 μm fabriquées sur un substrat polymère transparent avec des perforations entre les électrodes ; ces caractéristiques permettent l’enregistrement simultané μECoG avec des enregistrements de polytrodes laminaires et des manipulations optogénétiques. Tout d’abord, nous présentons un protocole pour l’enregistrement combiné de la durale μECoG sur le cortex somatosensoriel de souris avec manipulation optogénétique de types de cellules corticales spécifiques génétiquement définis. Cela permet une dissection causale des contributions distinctes de différentes populations neuronales au traitement sensoriel tout en surveillant leurs signatures spécifiques dans les signaux μECoG. Deuxièmement, nous présentons un protocole pour des expériences aiguës visant à enregistrer l’activité neuronale du cortex auditif du rat à l’aide de grilles μECoG et de polytrodes laminaires. Cela permet une cartographie topographique détaillée des réponses neuronales évoquées sensorielles à travers la surface corticale simultanément avec des enregistrements de plusieurs unités neuronales réparties dans toute la profondeur corticale. Ces protocoles permettent des expériences qui caractérisent l’activité corticale distribuée et peuvent contribuer à la compréhension et à d’éventuelles interventions pour divers troubles neurologiques.
Introduction
Les fonctions cérébrales sous-jacentes à la sensation, à la cognition et à l’action sont organisées et distribuées sur de vastes échelles spatiales et temporelles, allant des pointes de neurones uniques aux champs électriques générés par des populations de neurones dans une colonne corticale à l’organisation topographique des colonnes dans les zones du cerveau (par exemple, la somatotopie dans le cortex somatosensoriel, la tonotopie dans le cortex auditif primaire). Pour comprendre le fonctionnement du cerveau, il faut détecter des signaux électriques à travers ces échelles spatiales1. Les neurosciences disposent actuellement de nombreuses méthodes largement utilisées pour surveiller l’activité du cerveau. D’un point de vue électrophysiologique, les polytrodes laminaires (tels que les neuropixels) permettent de surveiller un nombre modeste (~300) de neurones uniques, généralement au sein d’une poignée de colonnes éloignées de distance, avec une résolution temporelle élevée (≥1 kHz). L’imagerie Ca2+ permet de surveiller un nombre modeste à grand de neurones uniques identifiés génétiquement et anatomiquement dans une étendue spatiale de ~1-2 mm à une résolution temporelle inférieure (~10 Hz)2. L’IRMf permet de surveiller l’état métabolique d’un grand nombre de neurones (~1 M de neurones dans un volume de 36 mm3 ) dans l’ensemble du cerveau à une résolution temporelle très faible (~0,2 Hz). L’EEG/MEG permet de surveiller l’activité électrique de l’ensemble de la surface corticale/du cerveau à une résolution temporelle modeste (<100 Hz) et à une très faible résolution spatiale (centimètres)3. Bien que chacune de ces méthodologies ait fourni des informations fondamentales et synergiques sur le fonctionnement du cerveau, les méthodes qui permettent la détection directe de signaux électrophysiologiques à haute résolution temporelle à partir de positions anatomiques précises dans de vastes régions spatiales du cortex sont naissantes. La nécessité d’une large couverture spatiale est soulignée par le fait que dans le cerveau, la fonction neuronale change beaucoup plus radicalement à la surface qu’à la profondeur4.
L’électrocorticographie (ECoG) est une méthode dans laquelle des grilles d’électrodes à faible impédance sont implantées à la surface du cerveau et permettent l’enregistrement ou la stimulation du cortex 1,5. L’ECoG est généralement déployé dans des contextes neurochirurgicaux humains dans le cadre du bilan clinique pour le traitement de l’épilepsie pharmacologiquement réfractaire. Cependant, il fournit également des informations uniques sur le traitement cortical distribué chez l’homme, comme la parole et la cartographie topographique sensorielle 6,7. Ces capacités ont motivé son utilisation dans des modèles animaux, notamment chez les singes, les rats et les souris 5,8,9,10,11. Chez les rongeurs, il a récemment été démontré que le micro-ECoG (μECoG) permet une surveillance électrique directe à haute résolution temporelle (~100 Hz) des populations neuronales avec une résolution spatiale en colonnes (~200 μm) et une large couverture spatiale (plusieurs millimètres). μECoG permet aux chercheurs d’étudier la dynamique neuronale distribuée associée au traitement sensoriel complexe, aux fonctions cognitives et aux comportements moteurs dans des modèles animaux12,13. Des progrès récents ont intégré μECoG à l’optogénétique et aux enregistrements de polytrodes laminaires 14,15,16,17,18,19,20, permettant des investigations multi-échelles des réseaux corticaux et comblant le fossé entre l’activité neuronale à l’échelle microscopique et la dynamique corticale à l’échelle macro 21,22. De manière critique, parce que le signal μECoG est très similaire chez les humains et les modèles animaux non humains, l’utilisation de μECoG rend la traduction des résultats et des découvertes des modèles animaux aux humains beaucoup plus directe23. En tant que telles, les approches intégratives sont cruciales pour faire progresser notre compréhension des circuits neuronaux et sont prometteuses pour le développement de nouvelles interventions thérapeutiques pour les troubles neurologiques 5,24,25.
Par conséquent, il existe un besoin émergent de protocoles qui intègrent des réseaux μECoG à haute densité avec des enregistrements laminaires et des outils optogénétiques pour permettre des investigations multi-échelles complètes du traitement cortical 8,26. Pour combler cette lacune, nous avons développé des dispositifs μECoG conçus sur mesure avec 128 électrodes à faible impédance avec un diamètre d’électrode de 40 μm et un espacement inter-électrode de 20 μm sur un substrat polymère flexible et transparent (parylène-C et polyimide) avec des perforations entre les électrodes, permettant des enregistrements simultanés de μECoG et de polytrode laminaire avec des manipulations optogénétiques13,22. Les principaux aspects de ce protocole expérimental comprennent : (i) la résolution spatiale en colonnes et la couverture à grande échelle de l’activité corticale par le biais de réseaux μECoG à haute densité ; (ii) la capacité d’enregistrer à partir de plusieurs couches corticales à l’aide de polytrodes laminaires insérés à travers la grille μECoG ; et (iii) l’incorporation de techniques optogénétiques pour activer ou inhiber sélectivement des populations neuronales spécifiques, permettant ainsi la dissection causale des circuits neuronaux 27,28,29. La configuration à haute densité permet des enregistrements à haute résolution spatiale, fournissant efficacement une « vue en colonne » de l’activité corticale, car des études antérieures ont montré que les signaux μECoG peuvent résoudre l’activité à une échelle spatiale comparable au diamètre de la colonne corticale du rongeur (~20 μm)11. Cette méthodologie intégrée permet une surveillance et une manipulation multi-échelles simultanées de l’activité neuronale, ce qui pourrait permettre des expériences causales pour déterminer les sources neuronales des signaux μECoG ainsi que le traitement cortical distribué. Pour atteindre ces objectifs, ce manuscrit fournit des protocoles détaillés pour l’utilisation de réseaux μECoG à haute densité en deux combinaisons.
Tout d’abord, nous décrivons μECoG combiné à la manipulation des cellules pyramidales de la couche 5 (L5) dans le cortex somatosensoriel primaire (S1) de la souris. Chez la souris, le réseau μECoG est placé par voie épidurale (en raison de l’intraitabilité chirurgicale de la durotomie chez la souris). Une fibre optique est positionnée sur la grille ou combinée à une lentille pour focaliser la lumière optogénétique sur une petite zone cible de la surface corticale. La stratégie optogénétique est décrite ici pour l’inhibition des neurones excitateurs de la couche 5, mais peut être facilement adaptée à n’importe quelle population de neurones pourvue de la lignée de souris exprimant Cre correspondante, spécifique à la population. Deuxièmement, nous décrivons l’utilisation combinée de μECoG avec des polytrodes laminaires en silicium pour enregistrer simultanément les potentiels électriques de surface corticale (CSEP) et l’activité de pointe unitaire de plusieurs neurones à travers les couches corticales du cortex auditif du rat (A1). Le réseau présente des perforations entre les électrodes, ce qui permet d’insérer des polytrodes laminaires multicanaux à travers la grille pour enregistrer l’activité neuronale à travers différentes couches corticales. Au cours de la procédure de craniotomie, le réseau μECoG est placé sous-duralement sur le cortex auditif et le polytrode laminaire est inséré à travers les perforations. Les signaux neuronaux de la sonde μECoG et de la sonde laminaire sont enregistrés simultanément, échantillonnés respectivement à 6 kHz et 24 kHz, à l’aide d’un système d’amplification connecté optiquement à un processeur de signal numérique.
Protocole
Les deux protocoles suivent les mêmes étapes clés (anesthésie, fixation, craniotomie, enregistrement μECoG) mais présentent des différences notables. Dans la description qui suit, les étapes partagées sont fusionnées, tandis que les spécificités de chaque protocole sont annotées. Les étapes ci-dessous correspondent à l’enregistrement μECoG avec l’optogénétique (souris) ou à l’enregistrement μECoG avec une sonde laminaire (Rat). Toutes les procédures décrites ici ont été menées dans le respect des autorités déontologiques ou juridiques locales (IACUC ou Comités d’éthique). Les médicaments utilisés peuvent varier selon le protocole éthique approuvé.
1. Préparation et protocole pour les procédures chez la souris et le rat
- Différences notables entre les protocoles de souris et de rat
- Configurations pour la chirurgie et enregistrements électrophysiologiques
- Pour un rat, utilisez la même configuration pendant la chirurgie et les enregistrements électrophysiologiques.
- Pour une souris, effectuez l’opération dans la première configuration et les enregistrements électrophysiologiques dans la deuxième configuration.
- Fixation de la tête
- Pour un rat, utilisez la même pince de museau pour la chirurgie et l’enregistrement électrophysiologique.
- Pour une souris, utilisez une pince de museau pour la chirurgie et une barre de tête métallique externe dans la configuration pour l’électrophysiologie afin de permettre la fixation sous anesthésie légère à l’isoflurane. Implantez la barre de tête avec du ciment dentaire sur le crâne.
- Configuration de l’enregistrement : Utilisez des appareils électroniques d’acquisition, des logiciels d’enregistrement et des logiciels de stimulation sensorielle distincts pour les deux espèces.
- Pour le protocole de souris, utilisez le système SpikeGadgets (https://spikegadgets.com) et le logiciel open source Trodes (https://spikegadgets.com/trodes/) pour l’acquisition de données.
- Pour le protocole chez le rat, utilisez le logiciel d’enregistrement Synapse - Neurophysiology Suite (https://www.tdt.com/component/synapse-software/) pour l’acquisition de données.
- Induire l’anesthésie par injection (Rat) ou inhalation (Souris).
- Lieu d’enregistrement
- Effectuer des enregistrements dans le cortex somatosensoriel (S1) pour une souris.
- Effectuer des enregistrements dans le cortex auditif primaire (A1) pour un rat.
REMARQUE : Cette différence de localisation anatomique nécessite des sites de craniotomie différents pour chaque espèce.
- Configurations pour la chirurgie et enregistrements électrophysiologiques
- Préparation et test du réseau
- Faites tremper la grille (à l’exclusion de la carte de connexion) dans un détergent enzymatique dilué (50 % de détergent, 50 % d’eau distillée) pendant au moins 1 h.
- Transférez-le dans un bain d’eau distillée pure et laissez-le sécher à l’air libre dans un endroit sûr et propre.
- Effectuez une électrodéposition de noir de platine dans le cadre de la préparation initiale de l’appareil μECoG, pas avant chaque session d’enregistrement.
REMARQUE : Une fois déposé, le revêtement Platinum Black forme une couche stable qui reste efficace pour plusieurs enregistrements, bien que ses performances doivent être surveillées par des tests d’impédance réguliers. L’électrodéposition noir de platine (plage cible de 10 à 20 kΩ à 1 kHz) diminue l’impédance de l’électrode et améliore le rapport signal/bruit dans les enregistrements neuronaux. - Pour effectuer l’électrodéposition, préparez une solution d’acide chloroplatinique (généralement de l’acide chloroplatinique à 1-3 % [H2PtCl6]) contenant une petite quantité d’acétate de plomb (environ 0,005 %) comme modificateur de dépôt. Connectez les électrodes μECoG pour qu’elles servent d’électrode de travail dans une cellule électrochimique à trois électrodes, avec une contre-électrode en platine et une électrode de référence Ag/AgCl.
- Appliquez une densité de courant constante d’environ -0,5--2 mA/cm² pendant 10 à 30 s tout en surveillant les valeurs d’impédance.
- Testez et enregistrez l’impédance des électrodes de la grille (par exemple, avec un Nano-Z).
- Vérifiez la grille au-dessus d’une source lumineuse et préparez-la pour l’utilisation dans l’enregistrement post-opératoire.
- Soudure de câble de référence
- Pour une souris, soudez l’extrémité d’un fil d’argent (10 mm de long, 30 G) à une broche en or pour la connexion au fil de référence du système d’enregistrement.
2. Chirurgie
- Préparation du matériel et suivi général (soins et enregistrement des animaux)
- Préparation : Nettoyez et désinfectez soigneusement la zone chirurgicale avec un désinfectant approprié. Assurez-vous que tous les instruments chirurgicaux sont stérilisés, généralement à l’aide d’un autoclave.
- Placement des outils chirurgicaux : Disposez les outils chirurgicaux sur le tampon chirurgical stérile. Remplissez la zone chirurgicale avec des applicateurs à embout de coton et des triangles chirurgicaux en coton absorbants. Jetez tous les déchets biologiques dangereux dans un sac d’élimination dédié.
- Régulation de la température : Allumez le coussin chauffant à l’intérieur du site d’enregistrement chirurgical et électrophysiologique. Contrôlez la température du coussin chauffant tout au long de la chirurgie et de l’enregistrement.
- Coussin chirurgical : Placez un coussin chirurgical bleu ou une couverture sur le lit de régulation de la température.
REMARQUE : Ce tampon doit comporter un fond blanc en coton doux, qui doit être orienté vers le haut. - Positionnement du microscope : Préparez le microscope et l’illuminateur attaché (par exemple, l’anneau LED) d’un côté de la zone chirurgicale. Vérifiez qu’il fonctionne correctement.
- Exercice chirurgical : Préparez l’exercice chirurgical pour l’intervention de craniotomie.
- Alimentation en oxygène : Réglez le débit de la bouteille d’oxygène sur 1,0 L/min (rat) ou 0,5 l/min (souris) et placez le masque à oxygène près du tampon de régulation. L’animal aura besoin d’oxygène en continu après l’anesthésie.
- Remplacement des fluides : Tout au long de la chirurgie, remplacez toute perte de liquide, en visant un remplacement d’au moins 1,5 % du poids corporel de l’animal (souris) ou 1 mL par h (rat). Préparez des solutions isotoniques en conséquence.
- Animal : Amenez l’animal de l’animalerie à la salle d’opération selon les procédures approuvées. Utiliser des souris âgées de 8 à 16 semaines, mâles ou femelles, de fond C57Bl6 ; de même, utilisez des rats âgés de 7 semaines, mâles, de la souche Sprague Dawley.
- Préparation des médicaments : Pesez l’animal à l’aide d’une balance d’une précision de 0,1 g. Préparez les quantités de médicament adéquates pour la chirurgie, en utilisant des solutions pré-diluées si nécessaire.
- Induction de l’anesthésie
- Induction de l’anesthésie chez la souris
- Placez l’animal dans la chambre d’induction de l’isoflurane (3-5 % d’isoflurane dans 0,5 L/minO2).
- Une fois l’anesthésie profonde confirmée (absence de réflexe dans le pincement de la queue/des orteils), placez l’animal sur le coussin chauffant chirurgical et fixez-le sur la tête.
- Injecter des médicaments sous-cutanés pour l’analgésie générale : méloxicam : 5 mg/kg et buprénorphine : 0,1 mg/kg.
- Fixez la souris en suivant les étapes 2.2.1.5-2.2.1.6.
- Placez le museau dans le masque d’anesthésie et la tête sans serrer dans le support de tête. Pour placer la souris dans la barre de morsure, assurez-vous d’abord que la langue se trouve sous la tige et non entre la tige et le toit de la bouche. Utilisez une pince pour déplacer la langue si nécessaire.
- Insérez les incisives de l’animal dans le trou de la tige de la barre de morsure. Fixez le masque d’anesthésie de souris (1,5-2 % d’isoflurane dans 0,5 L/min O2) en serrant doucement la vis de fixation. La stabilisation de la tête pendant l’opération est assurée uniquement par la barre d’occlusion.
- Protégez les yeux de l’animal avec une pommade ou un lubrifiant pour les yeux à base de pétrole pour éviter le dessèchement pendant la chirurgie.
- Maintenez l’anesthésie tout au long de la procédure avec un flux continu d’isoflurane à travers le masque.
- Induction de l’anesthésie chez le rat
- Utilisez initialement l’isoflurane pour calmer l’animal afin de faciliter l’injection d’anesthésie d’induction.
- Administrer les médicaments pour l’anesthésie et l’analgésie :
Méloxicam : Dosage de 5 mg/kg, concentration 10 mg/mL, 0,4 mL/kg
Kétamine : Dosage de 90 mg/kg, concentration de 100 mg/mL, 0,9 mL/kg
Xylazine : Dosage de 10 mg/kg, concentration 100 mg/mL, 0,1 mL/kg - Laissez l’animal atteindre l’anesthésie profonde dans les 15 à 30 minutes, selon le poids et l’âge.
- Surveillance de l’anesthésie
- Surveillez en permanence les signes vitaux de l’animal (fréquence respiratoire) tout au long de la procédure. Vérifiez la fréquence respiratoire comme un signe particulièrement utile de changements précoces de l’état anesthésique, et ajustez le niveau d’anesthésie si la fréquence respiratoire change.
- Le réflexe de retrait de la patte est un signe critique de l’état anesthésique. Testez périodiquement ce réflexe, car son absence totale garantit des niveaux d’anesthésie suffisants pour la chirurgie.
- Induction de l’anesthésie chez la souris
- Fixation de la tête et surveillance des signes vitaux
- Surveillance de l’état vital des animaux
- Vérifiez et consignez les signes vitaux de l’animal sur une feuille expérimentale. Si les réflexes de l’animal (p. ex., retrait de la patte) ne sont pas complètement éteints, administrer une demi-dose supplémentaire de kétamine supplémentaire (rat) ou augmenter la concentration d’isoflurane par tranches de 0,5 % (souris).
- Fixation de la tête d’un rat
- Une fois que le rat est complètement anesthésié (pas de réflexes de la patte ou de la queue), insérez les incisives de l’animal dans le trou de la tige du support de tête.
- Insérez soigneusement les pointes des bras de montage dans la crête du nez pour fixer la tête pendant l’opération, en veillant à ce qu’elle n’entre pas en contact avec les yeux.
- Ajustez l’angle des bras jusqu’à ce que le toit de la bouche de l’animal soit fermement appuyé contre la tige. Assurez-vous que le crâne reste immobile sous la pression.
- Fixez les deux bras du support en serrant les vis à l’aide d’une clé hexagonale.
- Configuration de l’oxygène pour un rat
- Fixez le tube en plastique de la bouteille d’oxygène sur le museau et le nez de l’animal, en le fixant avec du ruban chirurgical. Évitez les plis dans le tube qui pourraient obstruer la circulation de l’air. Réglez la bouteille d’oxygène sur un débit de 1 L/min.
REMARQUE : Les signes vitaux de l’animal, y compris la fréquence cardiaque et la fréquence respiratoire, doivent être vérifiés à des intervalles de 15 à 30 minutes tout au long de la procédure.
- Fixez le tube en plastique de la bouteille d’oxygène sur le museau et le nez de l’animal, en le fixant avec du ruban chirurgical. Évitez les plis dans le tube qui pourraient obstruer la circulation de l’air. Réglez la bouteille d’oxygène sur un débit de 1 L/min.
- Surveillance de l’état vital des animaux
- Incision du cuir chevelu
- Rasage et préparation
- Rasez la zone du haut du museau à l’arrière de la tête, en s’étendant d’un œil à l’autre et autour des oreilles. Retirez la majeure partie de la fourrure à l’aide de ciseaux ou d’une tondeuse électrique, puis appliquez une crème dépilatoire.
- Désinfection
- Désinfectez la zone à l’aide d’un coton-tige imbibé de bétadine, puis rincez avec un coton-tige imbibé d’éthanol à 70 %. Répétez ce processus trois fois et terminez par une application finale de bétadine pour vous assurer que la zone est stérile.
- Injection d’anesthésique local
- Injecter l’anesthésique local lidocaïne (1 %, 0,1 mL pour la souris/0,4 mL par kg pour le rat) par voie sous-cutanée dans la ligne médiane du cuir chevelu de l’animal. Massez doucement le cuir chevelu pour étaler la lidocaïne et attendez 5 min pour permettre à l’anesthésique de faire effet.
- Incision
- Pour une souris, soulevez un point sur la peau à l’aide d’une pince à épiler et séquez une petite section de peau (environ 1 cm de diamètre) à l’aide de ciseaux chirurgicaux.
- Pour un rat, faites une incision précise sur la face antérieure du cuir chevelu, juste au-dessus du nez, sur la ligne médiane à l’aide du scalpel. Tirez doucement la peau vers l’arrière, en créant une incision droite entre les yeux et la base du crâne. Soulevez soigneusement le cuir chevelu, coupez le tissu conjonctif et exposez complètement le crâne.
- Exposez le site de craniotomie en suivant les étapes 2.4.4.4-2.4.4.5.
- À l’aide d’un grattoir, enlevez le tissu conjonctif et le périoste sur le dessus du crâne. Rincez une solution saline et utilisez une éponge d’aspiration ou une éponge chirurgicale pour nettoyer le site.
- Utilisez des clips chirurgicaux sur les bords de la peau pour faciliter l’exposition claire de la région du crâne où la craniotomie sera effectuée.
- Rasage et préparation
- Craniotomie
- Procédure générale de forage
- Réglez la vitesse du foret chirurgical sur un réglage bas de 5000 tr/min ou 7000 tr/min pour les chirurgiens expérimentés. Effectuez tous les forages tout en visualisant au microscope.
- Tenez la perceuse parallèlement à la surface du crâne et posez-la doucement contre la surface.
- Avec une légère pression sur la pédale, commencez à percer à un seul endroit. Effectuez des forages à de courts intervalles (5 à 10 s) avec des contrôles fréquents pour détecter les changements de couleur des os.
REMARQUE : L’os commencera par un blanc opaque, et à mesure que le trou devient plus profond, il deviendra plus translucide, révélant une teinte rose. - Lorsque le forage s’est approché du cerveau, ralentissez et recherchez des signes d’humidité s’infiltrant dans le trou. Lorsque le trou est rose foncé et a une légère brillance, arrêtez de percer. À l’aide d’une aiguille courte de 30 g, percez doucement la couche d’os restante. Le liquide clair doit sortir du nouveau trou.
- Procédure de perçage pour une souris
- Pour placer une électrode de référence pour les enregistrements physiologiques, percez un trou de bavure dans la partie frontale de l’hémisphère ipsilatéral à la zone enregistrée.
- Définissez le contour de la craniotomie en perçant une tranchée peu profonde sur son périmètre. Dans l’axe médio-latéral, partez de la crête osseuse latérale comme référence, et tracez une fenêtre de 4 mm.
- Dans l’axe antéro-postérieur, percez une fenêtre de 3 mm commençant à ~ 1 mm en avant de la crête osseuse postérieure. La taille finale de la craniotomie ouverte est d’environ une fenêtre de 4 x 3 mm.
- Procédure de forage pour un rat
- Percez deux trous : l’un dans le quadrant postérieur gauche, l’autre dans le quadrant antérieur droit.
- Injectez dans le muscle masséter une deuxième dose de lidocaïne (0,4 mL/kg à 10 mg/mL) et répartissez uniformément l’endroit où la coupe doit être faite.
- Réséquez uniquement l’ensemble minimal de muscles nécessaires pour exposer la zone de craniotomie.
- À l’aide d’une lame de scalpel #10 fraîche, créez une coupe transversale dorsale-ventrale dans le faisceau de muscle au-dessus de la mâchoire de l’animal (côté droit). Tenez le bord postérieur de la coupure à l’aide d’une pince de préhension et décollez-le du crâne tout en coupant le long de la crête osseuse de la pommette. De cette façon, le muscle peut être détaché de l’os avec un saignement minimal.
- Réséquez le muscle antérieur de la même manière jusqu’à ce qu’une fissure dans le crâne soit révélée. Cette ligne sera la limite antérieure de la fenêtre de craniotomie.
- Dégagez le muscle autour de la crête postérieure à l’aide du scalpel et de la pince, en utilisant une source de lumière puissante pour éviter de couper dans des régions hautement vascularisées.
- Broyez la crête postérieure à l’aide de la perceuse jusqu’à ce qu’elle ne soit plus élevée au-dessus de la surface du crâne.
REMARQUE : Cette étape est essentielle pour poser la grille μECoG pour entrer en contact direct avec la surface corticale. - Percez le bord dorsal de la fenêtre juste au-dessus de la crête où le muscle réséqué était attaché. Placez le bord postérieur en avant de l’arête postérieure percée. Placez le bord antérieur postérieur à la ligne de fissure qui s’étend près de l’orbite.
REMARQUE : Lors du dégagement du muscle antérieur, des précautions doivent être prises pour éviter l’œil.
- Procédure générale de forage
- Perçage de fenêtre craniotomie
- Perçage de la fenêtre de craniotomie (Conseils)
- Lors du perçage, assurez-vous que le foret est maintenu parallèle à la surface du crâne. Appliquez le moins de force possible, en utilisant la perceuse comme une brosse en permettant à la perceuse d’entrer légèrement en contact avec le crâne tout en utilisant des mouvements courts et répétitifs le long de la ligne de craniotomie prévue.
REMARQUE : Chez les rats, le bord postérieur de la fenêtre a l’os le plus épais. Si vous percez trop loin vers l’arrière, l’os peut présenter une qualité feuilletée et « croquante » qui complique la progression du forage. Si elle est mal placée, cette zone osseuse peut révéler une coloration rouge veineuse qui donne une fausse impression de proximité avec le cerveau. - Percez chaque côté de la fenêtre de craniotomie jusqu’à ce que l’os apparaisse rose pâle avec une fine fissure blanche ou une fissure sur toute sa longueur. Appliquez une légère pression ; L’os doit produire un « mouvement » distinct lorsqu’il est complètement percé. Si la fissure semble disjointe, continuez à percer légèrement jusqu’à ce qu’elle obtienne une ligne continue.
- Lors du perçage, assurez-vous que le foret est maintenu parallèle à la surface du crâne. Appliquez le moins de force possible, en utilisant la perceuse comme une brosse en permettant à la perceuse d’entrer légèrement en contact avec le crâne tout en utilisant des mouvements courts et répétitifs le long de la ligne de craniotomie prévue.
- Retrait du crâne aminci à l’intérieur de la fenêtre de craniotomie
- Lorsque le crâne a été suffisamment aminci pour qu’une pression extrêmement légère fasse bouger visiblement toute la fenêtre, retirez le crâne aminci.
- Rincer le site de craniotomie avec une goutte de solution saline et attendre au moins 1 min. Cela affaiblit l’os aminci et aide l’os à se détacher de la dure-mère. Égouttez l’excès de solution saline à l’aide d’un triangle de coton absorbant ou sous vide.
- Soulevez délicatement le crâne aminci à l’aide d’une pince, en évitant d’endommager les tissus sous-jacents.
- Utilisez une éponge hémostatique pour garder le cerveau humide.
- Saisissez fermement la fenêtre sur les côtés dorsal et ventral à l’aide d’une pince dentée et tirez directement loin du crâne. S’il y a une difficulté à retirer la fenêtre du site, arrêtez et reprenez le forage léger jusqu’à ce que l’os soit suffisamment affaibli.
- Pour les enregistrements μECoG de souris, laissez la dure-mère intacte.
- Perçage de la fenêtre de craniotomie (Conseils)
- Ciment et implant de tête pour une souris
- Insérez et fixez le fil de référence.
- Insérez l’extrémité du fil d’argent ~1 mm dans le trou de la bavure, suffisamment pour entrer en contact avec la surface du cerveau mais sans provoquer de saignement.
- Appliquez le ciment dentaire en place tout en appliquant la première couche.
- Préparation du ciment dentaire
- Utilisez un plat de mélange en céramique refroidi pour préparer le mélange de ciment dentaire. Ce ciment s’épaissit rapidement et nécessite la préparation régulière d’un nouveau mélange. Essuyez le plat de mélange avant de préparer un nouveau mélange.
REMARQUE : Le ciment ne doit jamais être en contact direct avec le cerveau.
- Utilisez un plat de mélange en céramique refroidi pour préparer le mélange de ciment dentaire. Ce ciment s’épaissit rapidement et nécessite la préparation régulière d’un nouveau mélange. Essuyez le plat de mélange avant de préparer un nouveau mélange.
- Application de la première couche
- Appliquez la première couche de ciment autour de la craniotomie et sur l’ensemble du crâne à l’aide de micro-applicateurs. Cette couche agit comme une isolation électrique entre le crâne et la barre de tête métallique.
- Entourez complètement la craniotomie avec du ciment, y compris une couverture latérale, pour fournir une protection adéquate pour la craniotomie ouverte et la grille μECoG.
- Positionnement de la barre de tête métallique
- Fixez la grande partie du cintre à son support sans le serrer complètement.
- Positionnez la barre de tête comme vous le souhaitez, en posant la section mince le long de la ligne médiane du crâne en contact avec la surface du ciment.
- Fixation de l’implant
- Couvrez le guidon avec du ciment dentaire et connectez-le à la surface du ciment.
- Retrait du support
- Attendez quelques minutes pour que le ciment dentaire se renforce.
- Une fois le guidon entièrement fixé, retirez-le en retirant d’abord la vis du support. Ensuite, rétractez le support vers l’arrière, en vous assurant qu’aucune force n’est appliquée sur la barre de tête.
- Insérez et fixez le fil de référence.
- Durotomie pour la chirurgie du rat
REMARQUE : Il s’agit d’une étape chirurgicale difficile.- Lifting de la dure-mère
- À l’aide de la pince n° 5, maintenue aussi parallèle que possible à la surface du cerveau, soulevez une petite partie de la dure-mère loin du cerveau.
- À l’aide d’une aiguille fraîche de 30 g (aussi courte que possible), déchirez soigneusement la dure-mère soulevée.
REMARQUE : La dure-mère est une fine couche transparente de tissu qui se trouve directement sur le cerveau. Il est supprimé pour les enregistrements μECoG chez le rat. Il est essentiel d’effectuer la durotomie sans perturber le système vasculaire à la surface du cerveau. Les méthodes recommandées pour effectuer la durotomie comprennent l’utilisation d’une pince et d’une aiguille de seringue pour percer la dure-mère avant de la tirer vers l’arrière ou l’utilisation d’un outil de duratome ancré près du crâne pour rétracter la dure-mère avec soin.
- Résection de la dure-mère
- Continuez à saisir la dure-mère avec la pince et à la retirer du cerveau. Créez une déchirure diagonale avec l’aiguille tout en soulevant.
- À l’aide de la pince, décollez soigneusement la dure-mère vers les côtés de la fenêtre de craniotomie, en veillant à ce que la surface du cerveau ne soit pas dérangée.
- Lifting de la dure-mère
- Transfert de la souris dans la configuration pour l’enregistrement électrophysiologique
- Retirez l’animal de la configuration chirurgicale en soulevant doucement le museau et les incisives de la barre des incisives, puis en tirant l’animal vers l’arrière. Injecter du chlorprothixène (1 mg/kg, intrapéritonéale [IP]), un sédatif qui permet de maintenir une anesthésie continue en utilisant une concentration d’isoflurane plus faible.
- Placez la souris dans la configuration d’enregistrement électrophysiologique.
- Assurez-vous que le coussin chauffant est en place et qu’il fonctionne correctement.
- La tête fixe l’animal à l’aide de la barre de tête sur le support dans la configuration électrophysiologique.
- Approchez le masque à l’isoflurane pour couvrir complètement le museau de l’animal.
- Ajustement de l’anesthésie
- Réduire progressivement les niveaux d’anesthésie à 0,7-1 % d’isoflurane (par incréments de 0,5 % maximum toutes les 5 minutes).
- Surveillez la fréquence respiratoire et les mouvements de l’animal.
REMARQUE : La fréquence respiratoire doit augmenter légèrement par rapport à l’état chirurgical, mais l’animal ne doit pas bouger. - Si l’animal se déplace, augmentez immédiatement la concentration d’isoflurane à 2 % avant de la ramener lentement à un niveau inférieur par paliers de 0,5 %.
- Insertion de moustaches pour la stimulation sensorielle
- Fixez les vibrisses de la souris à l’appareil de stimulation des moustaches. Dans ce protocole, insérez neuf vibrisses dans de courtes pointes de pipette de 10 μL, qui sont connectées à des actionneurs piézoélectriques qui fournissent des déviations rapides des vibrisses.
3. Enregistrement
- Installation de la grille
- Étapes préliminaires
- Allumez le système d’enregistrement et l’amplificateur.
- Vérifiez les signes vitaux de l’animal.
- Procédure
- Pour positionner l’animal et les outils, suivez les étapes 3.1.2.2 à 3.1.2.4.
- Placez l’animal dans la configuration d’enregistrement et assurez-vous que la craniotomie reste humide en appliquant régulièrement une solution saline.
- Pour un rat, placez le micromanipulateur sur la balustrade de la plate-forme, située bien derrière le site de la craniotomie, pour éviter les interférences.
- Pour une souris, placez le micromanipulateur latéralement au site de craniotomie à côté de l’animal.
- Pour fixer et positionner la grille sur une souris, suivez les étapes 3.1.2.6 à 3.1.2.12.
- Fixez la grille μECoG au foulon à l’aide des connecteurs ZIF-clip (connecteur de pavillon). Maintenez la carte électronique de la scène en place via une barre mécanique fixée à un micromanipulateur.
- Abaissez la grille μECoG horizontalement pour l’aligner à plat sur la craniotomie le long de l’axe antéropostérieur.
REMARQUE : Le long de l’axe latéral-médial, le bord de la grille doit être près du bord médial de la craniotomie. - Une fois que la grille est positionnée près du cerveau mais pas en contact avec celui-ci, fixez le fil de référence de la grille à la broche en fil d’argent et en or implantée. Au besoin, fixez le fil de terre à l’animal (p. ex., à un muscle découvert) pour réduire le bruit électrique.
- De plus, abaissez la grille pour contacter le cerveau.
- Déplacez la grille latéralement pour « glisser » sur la surface humide de la dure-mère. Continuez à ajuster jusqu’à ce que la grille soit centrée le long de l’axe médiolatéral.
- Utilisez une éponge d’aspiration ou une éponge chirurgicale sur les bords de la craniotomie pour éliminer tout excès de solution saline.
- Une fois que la préparation est légèrement plus sèche, assurez-vous que la grille adhère plus fermement à la dure-mère et ne glisse pas sur sa surface. Lorsqu’il est plus sec, appliquez un mouvement latéral à médial sur la grille flexible, en assurant le contact avec les électrodes les plus latérales. Le câble flexible de la grille se pliera naturellement pour s’adapter au contour du cerveau.
- Pour positionner la grille sur un rat, suivez les étapes 3.1.2.14 à 3.1.2.18.
- Fixez la tige de la fourche de maintien dans le micromanipulateur, en vous assurant que la planche de connexion de la grille planera contre la face postérieure de la fenêtre de craniotomie lorsqu’elle sera abaissée.
- Ajustez la position du micromanipulateur sur la balustrade de manière à ce que la grille soit à peu près au-dessus du site de craniotomie. Abaissez la grille jusqu’à ce qu’elle plane au-dessus de la surface du cerveau. Humidifiez la surface du cerveau avec une petite goutte de solution saline.
- Effectuez ces étapes à l’aide du microscope. À l’aide des cadrans du micromanipulateur, ajustez la position de la grille jusqu’à ce qu’elle repose à plat contre la surface du cerveau au centre de la craniotomie.
- Évacuez soigneusement l’humidité à l’aide d’un triangle de coton absorbant sans toucher la grille elle-même. Assurez-vous que chaque rangée de la grille est en contact avec la surface du cerveau.
REMARQUE : L’élimination de l’humidité empêche la propagation passive du signal électrique à travers le fluide entre la surface corticale et la grille, qui diffuse spatialement le signal détecté à l’électrode. - À l’aide de la pince numéro 2 ou numéro 5, insérez le fil de mise à la terre de la grille dans le même trou de bavure ou insérez le fil de référence dans un trou de bavure et le fil de terre dans le tissu musculaire voisin.
REMARQUE : Les fils ne doivent être insérés que ~1 mm, suffisamment pour entrer en contact avec le cerveau mais pas pour provoquer de saignement ou de traumatisme au cerveau.
- Étapes préliminaires
- Vérification du positionnement de la grille
- Surveillance de l’activité électrophysiologique
- Observez l’activité électrophysiologique à l’aide du logiciel d’enregistrement. Sous anesthésie légère, les signaux cérébraux sont variables et peuvent présenter une variété de motifs.
- Une connexion correcte des fils du réseau, de référence et de terre doit permettre d’obtenir un rapport signal/bruit élevé, avec des amplitudes de signal de l’ordre du mV. Surveillez le bruit dans la gamme des hautes fréquences à l’aide d’un filtrage passe-bande avec Trodes (par exemple, 100-6000 Hz) et assurez-vous qu’il ne dépasse pas quelques dizaines de microvolts (μV).
- Évaluer la réactivité sensorielle à l’aide du bruit (p. ex., applaudir ou claquer des doigts) pour induire des potentiels électriques de surface corticale (CSEP) liés à des événements visibles.
REMARQUE : La stimulation d’une seule moustache doit provoquer une PESC claire et nette liée à un événement dans seulement quelques canaux (souris). - Vérification de la position sur la grille
- Pour un rat, vérifiez que la grille est correctement positionnée sur le cortex auditif. Le premier bloc enregistré devrait généralement être un stimulus de bruit blanc de 60 secondes défini pour vérifier que la grille enregistre une réponse appropriée du cerveau. Effectuez des enregistrements de diagnostic de bruit blanc et de tonalité avec la grille uniquement avant d’insérer polytrode pour aider à déterminer si la grille a été correctement placée et s’il y a une réponse du signal.
- Pour une souris, pour vérifier le positionnement de la grille, effectuez une session de cartographie rapide avec 20 à 30 déviations de moustaches espacées de 350 ms. Enregistrez l’activité dans la bande LFP (Local Field Potential) à l’aide de Trodes et analysez-la hors ligne avec un code MATLAB personnalisé pour visualiser l’étendue spatiale de l’activité évoquée par les moustaches.
- Repositionnement
- Si la grille doit être ajustée, humidifiez la surface corticale avec des gouttes de solution saline sur la grille.
- Laissez la solution saline pendant 30 s à 1 min avant d’essayer de soulever la grille.
- Soulevez délicatement et lentement la grille.
- Repositionnez-le en suivant les étapes décrites à l’étape 3.1.
- Surveillance de l’activité électrophysiologique
- Polytrodes laminaires pour un rat
- Configuration Polytrode
- Tout d’abord, connectez l’adaptateur de tête à l’arrière du polytrode. Fixez le connecteur au troisième ensemble de canaux sur la carte de l’adaptateur. Assurez-vous que la marque noire sur le clip fait face au côté droit de l’extrémité commerciale du polytrode.
- Polytrode Insertion
- Insérez le polytrode dans le cerveau jusqu’à ce que les toutes dernières électrodes (les plus hautes) soient visibles au-dessus de la surface corticale. Une descente lente (jusqu’à 1 μm/s) améliore la qualité du signal. Attendez 15 min, permettant au cerveau de s’adapter à la présence de la polytrode.
- Après 15 min, vérifiez si les dernières électrodes ont pénétré dans la surface corticale. Si ce n’est pas le cas, abaissez légèrement plus le polytrode et attendez 10 minutes supplémentaires avant de continuer.
- Configuration Polytrode
- Positionnement de la source lumineuse optogénétique sur une souris
- Utilisez soit un système de vis de réglage fin en trois dimensions, monté sur un bras articulé, soit un micromanipulateur pour monter le support de fibre optique.
- Pour guider la source lumineuse et aider à positionner la fibre, allumez la lumière optogénétique à faible intensité. À l’aide du bras articulé, positionnez grossièrement la lumière optogénétique vers la zone cible.
- Concentrez et ajustez la position de la fibre à l’aide d’un micromanipulateur ou de vis de réglage fin.
- Enregistrement des signaux
- Préparation
- Débranchez toutes les lumières, rallonges et parasurtenseurs inutiles dans le dispositif chirurgical pour réduire les interférences électriques. Éteignez les plafonniers de la plate-forme.
- Fermez la porte de l’espace d’enregistrement isolé et la porte de la salle d’opération avant de commencer l’expérience.
- Début de l’acquisition
- Pour un rat, démarrez Synapse sur la plate-forme d’enregistrement/l’ordinateur et confirmez que l’acquisition est fonctionnelle en prévisualisant et en vérifiant les signaux. Provoquer des transitoires de tension importants et nets dans le signal μECoG en présentant des stimuli près de l’animal, c’est-à-dire en applaudissant.
- Pour une souris, démarrez la session d’enregistrement dans Trodes.
- Hydratation
- Injecter par voie sous-cutanée au rat ou à la souris respectivement 1 mL ou 0,1 mL de solution saline toutes les 1 à 2 h pendant l’enregistrement pour prévenir la déshydratation. Pour un rat, attendez 5 à 10 minutes après l’administration d’une solution saline avant d’exécuter un nouveau bloc d’enregistrement.
- Ensembles de stimuli
- Pour un rat, une fois que le site d’enregistrement est confirmé, procédez à l’enregistrement des ensembles de stimulus requis. Un exemple d’ensemble peut inclure
Bruit blanc (60 s)
Diagnostic de tonalité (5 min)
Ton pur (23 min)
Ondulation mobile dynamique
Tonalité 150 (15 min)
TIMIT (38 min) - Pour un rat, ré-présentez le bruit blanc et les diagnostics de tonalité chaque fois que la grille est repositionnée.
- Stimuli tactiles pour une souris : Fournissez des stimuli tactiles dans une structure d’essai, chaque essai contenant un train de déviations aléatoires des moustaches toutes les 350 ms. Dans l’exemple fourni, chaque essai comprend 14 déviations présentées sur 4500 ms.
- Stimuli optogénétiques pour une souris : Dans certains essais, appliquez une impulsion carrée de lumière optogénétique pendant toute la durée de l’essai (5 s). Déterminer le niveau de lumière requis en fonction de l’opsine utilisée et de la profondeur des tissus à atteindre à l’aide d’estimations de la pénétrance lumineuse (https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php)
- Pour un rat, une fois que le site d’enregistrement est confirmé, procédez à l’enregistrement des ensembles de stimulus requis. Un exemple d’ensemble peut inclure
- Préparation
- Nettoyage
- Levage et nettoyage de la grille
- Une fois l’enregistrement terminé, fermez le logiciel d’enregistrement et rebranchez les sources lumineuses dans la plate-forme.
- Si le cerveau est sec, appliquez une petite goutte de solution saline sur la surface du cerveau à l’aide d’une seringue. Laissez la solution saline pendant 30 s à 1 min avant d’essayer de soulever la grille.
- En travaillant au microscope, soulevez doucement la grille de la surface du cerveau à l’aide de micromanipulateurs.
- Si une force supplémentaire est nécessaire lors du levage de la grille, utilisez une pince à pointe de carbone (fermée) pour soulever doucement la grille du cerveau. Assurez-vous que le mouvement du micromanipulateur est légèrement antérieur pour décoller doucement la grille de la surface du cerveau.
- Une fois la grille complètement retirée, détachez-la de la fourche de préhension et nettoyez-la en suivant les étapes 3.6.1.6-3.6.1.7.
- Faites tremper la grille (à l’exclusion de la carte de connexion) dans un détergent enzymatique dilué (50 % d’Enzol, 50 % d’eau distillée) pendant au moins 1 h. Ensuite, transférez-le dans un deuxième bain d’eau distillée pure et laissez-le sécher à l’air libre dans un endroit sûr et propre.
- Si des zones de la grille ont déposé du sang ou des tissus, utilisez un triangle de coton imbibé de solution enzymatique pour l’essuyer doucement.
- Une fois sèche, remettez la grille dans sa boîte.
- Euthanasie de l’animal
- Pour une souris, retirez l’animal de la fixation de la tête et placez-le dans la chambre d’euthanasie. Ajouter une gaze avec 5 mL d’isoflurane et attendre 60 s après l’arrêt de la respiration. Vérifiez l’absence de réflexe de retrait et décapitez à l’aide de ciseaux tranchants.
- Dans le cas d’un rat, injecter 0,2 mL de pentobarbital IP. Attendez 60 secondes après l’arrêt de la respiration, allongez l’animal sur le dos et utilisez une lame #11 pour effectuer une double thoracotomie.
- Nettoyage de l’équipement
- Apportez tous les outils chirurgicaux dans l’évier du laboratoire et posez-les sur une serviette chirurgicale. Vaporisez les outils avec une solution d’eau de Javel à 10 % et lavez-les soigneusement dans l’évier. Pour les outils plus sales, laissez-les tremper dans une solution d’eau de Javel avant de les laver.
- Vous pouvez également utiliser un détergent en poudre (p. ex., Contrex AP) avec de l’eau en frottant les instruments avec une brosse dans l’évier.
- Une fois les outils propres et rincés, essuyez-les avec des lingettes imbibées d’alcool et remettez-les dans leur espace de stockage.
- Désinfection de l’espace de travail
- Jetez toutes les aiguilles et lames usagées dans le contenant pour objets tranchants.
- Jetez les cotons-tiges, les triangles et les lingettes imbibées d’alcool contaminés dans le sac à risque biologique.
- Essuyez toutes les surfaces de travail de la salle de forage avec de l’alcool et nettoyez tous les instruments avant de fermer l’espace de travail.
- Levage et nettoyage de la grille
Résultats
Nous avons décrit les protocoles d’enregistrement des signaux électrocorticographiques combinés à des méthodes optogénétiques et à des enregistrements laminaires. Ici, des signaux typiques obtenus à partir du cortex somatosensoriel de la souris (Figure 1, Figure 2 et Figure 3) et dans le cortex auditif des rats en réponse à une stimulation sensorielle (Figure 4, Figure 5 et Figure 6) sont présentés.
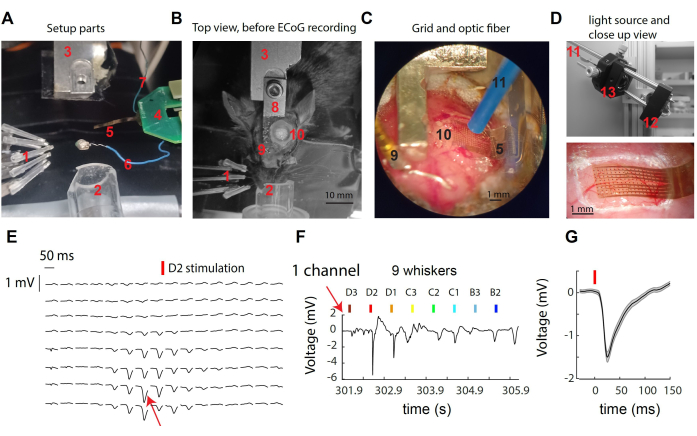
Figure 1 : Enregistrement des signaux μECoG sur le cortex somatosensoriel de la moustache de souris. (A) Composants du montage. Voir le texte. (B) Vue de dessus de l’installation chirurgicale avant l’enregistrement μECoG, montrant l’emplacement de l’appuie-tête et du site de craniotomie. (C) Vue détaillée de la grille μECoG et de la fibre optique positionnée sur le cortex exposé. (D) Haut : La source lumineuse est située à l’extérieur du boîtier d’enregistrement. La lumière d’une LED de 473 nm est collectée dans la fibre optique à travers un tandem de lentilles. En bas : gros plan de la grille corticale sur le cortex de la souris dans un exemple d’enregistrement. (E) Traces représentatives μECoG de tous les canaux 16x8 montrant les réponses moyennes de l’essai à la stimulation de la moustache D2. (F) Trace de tension brute à partir du canal unique indiqué en (E) à travers des déviations simples de plusieurs moustaches. Le canal a montré la réponse la plus forte lors de la stimulation de la moustache D2. (G) La réponse évoquée moyenne à travers les essais dans le canal unique (E, F), qui a montré une forte déviation de tension après stimulation des moustaches. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La figure 1A-D fournit des images de divers composants du système utilisés pour l’enregistrement et la manipulation optogénétique dans le cortex S1 de la souris. Les éléments étiquetés comprennent : 1- neuf stimulateurs de moustaches indépendants dans un réseau 3 x 3, 2- cône de nez pour l’anesthésie à l’isoflurane, 3- support/contrepartie de tige de tête, 4- circuit imprimé dorsal μECoG, connecté au circuit imprimé de tête avec un double connecteur ZIF ; 5- Grille d’électrodes μECoG à l’extrémité d’un câble flexible de 8 mm ; 6- fil de référence ; 7- fil de terre ; 8- implant de poteau de tête ; 9- Goupille dorée de référence (isolée du poteau de tête avec du ciment dentaire) ; 10- craniotomie sur l’hémisphère gauche, sur le cortex du baril de moustache S1 ; Fibre optogénétique de 11 à 1 mm de diamètre (tenue par un micromanipulateur, non illustrée) ; 12- une LED en forme d’étoile pilotée par un pilote de LED (non illustrée) ; 13- Collecte de la lumière grâce à un tandem de lentilles asphériques. Lors de la stimulation d’une seule moustache, une déviation rapide du potentiel de surface à un petit nombre d’électrodes (Figure 1E) est observée. Ce groupe d’électrodes représente le signal local qui atteint son pic dans la colonne corticale de la moustache stimulée30. En regardant une seule électrode, nous observons la réponse la plus forte à la stimulation de sa moustache préférée et la réponse la plus faible ou nulle à la stimulation des moustaches plus éloignées (Figure 1F). Dans cet exemple, le début de la déviation se produit environ 10 ms après la vibration de la moustache, avec une amplitude moyenne de 1 mV (Figure 1G).
La figure 2 présente des exemples d’enregistrements pendant l’inhibition optogénétique. La lumière peut atteindre le tissu cortical à travers le substrat transparent de la grille (Figure 2A). Cependant, lors de l’utilisation d’une fibre de grand diamètre ou de toute source de lumière spatialement large, les photons frappent également les électrodes, produisant un artefact opto-électrique (Figure 2B). Dans ce protocole d’inhibition, nous avons utilisé une impulsion de lumière carrée de 5 s de long. Les artefacts opto-électriques qui en résultent ne sont présents qu’au début et au décalage de la lumière. Chez un animal sans opsine, la stimulation des moustaches présentée pendant l’allumage de la lumière n’évoque pas une réponse différente de la stimulation des moustaches présentée dans les essais avec la lumière éteinte (Figure 2C). En revanche, la stimulation lumineuse de l’opsine inhibitrice dans une sous-population de neurones excitateurs entraîne une diminution de l’amplitude de la réponse sensorielle évoquée (Figure 2D)
Les figures 2C et D présentent des exemples de suppression optogénétique dans le domaine temps-fréquence. Pour analyser les données μECoG, nous appliquons d’abord un référencement de moyenne commune (CAR) pour supprimer les signaux indifférenciés entre les électrodes (par exemple, la respiration), suivi d’une transformée en ondelettes de Morse, qui révèle les bandes de fréquences actives au fil du temps. L’activité neuronale dans le domaine fréquentiel présente généralement une loi de puissance approximative de 1/f 2,3. Pour révéler le signal évoqué sensoriel de manière plus uniforme dans le domaine fréquentiel, nous appliquons le score Z séparément pour chaque bande de fréquence. Le score Z est basé sur les statistiques du signal au cours des époques de base. Ici, nous utilisons une fenêtre de temps qui précède le stimulus, de -3000 ms à -1000 ms avant le début de l’essai. Ce processus produit le score Z évoqué par stimulus pour chaque bande de fréquence (Figure 2C,D).
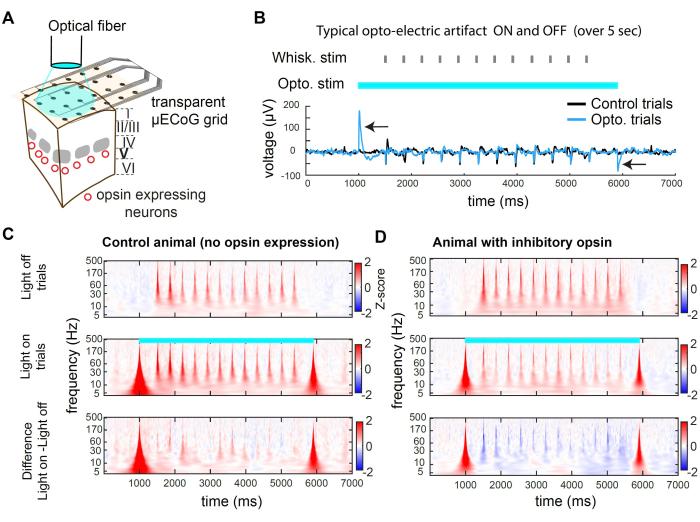
Figure 2 : Suppression optogénétique dans wS1 lors de l’enregistrement μECoG chez la souris. (A) Schéma d’une expérience optogénétique représentative. Une fibre optique est directement pointée vers le cerveau, permettant une inhibition transitoire de la population neuronale exprimant une opsine inhibitrice. (B) Trace de tension enregistrée dans le canal au centre de la stimulation optogénétique, moyennée sur l’ensemble des essais. La flèche noire indique la présence d’artefacts optoélectriques au début et au décalage de la lumière de 473 nm. Notez la réponse à la déviation des moustaches (identité aléatoire des moustaches) au milieu de l’essai. L’artefact est transitoire et n’affecte pas l’enregistrement de l’activité évoquée sensorielle après un délai (ici 500 ms). (C) Spectrogramme moyen d’un exemple de canal dans les essais à la lumière, les essais à la lumière, et la différence entre les deux, chez un animal où aucune opsine n’a été exprimée. Notez que l’effet opto-électrique induit un artefact transitoire à large bande, et que la réponse évoquée par les moustaches n’est pas affectée par la lumière. (D) Exemple de spectrogramme moyenné par essai à travers les essais de lumière, les essais de lumière, et la différence entre les deux chez une souris Rbp4-Cre32 dans laquelle st-GtACR2.0 a été exprimé dans les neurones excitateurs de la couche 5. Notez la suppression de la réponse évoquée de la moustache dans le spectrogramme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La figure 3 présente des variantes faciles à mettre en œuvre dans le système de distribution de lumière. À l’aide d’une fibre optique plus petite, ou d’une simple lentille, il est possible de cibler une zone spécifique du cortex15. La lumière sortant de la fibre diverge rapidement et atteint le tissu cortical au-delà de la zone ciblée. En incorporant une lentille asphérique (f = 16 mm) à la sortie de la fibre optique, il est possible de focaliser la lumière sur une surface plus petite (Figure 3A,C), jusqu’à peu près au diamètre d’une seule colonne corticale (Figure 3C). La lumière est également moins divergente au sein du cortex. Idéalement, à l’aide d’un laser ou d’une source de lumière puissante avec un ensemble de lentilles en tandem, il est possible de cibler une seule colonne corticale avec un faisceau de lumière collimaté. Cependant, il est important de considérer que la lumière se dispersera à l’intérieur du tissu, ce qui peut éclairer partiellement les colonnes voisines. L’artefact lumineux mesuré dans les données μECoG révélera où la lumière a été délivrée sur la surface corticale ; voir la comparaison de la figure 3B par rapport à la figure 3D. L’artefact lumineux est mesuré comme la puissance de crête dans une gamme de hautes fréquences (65-500 Hz) 5 ms après le début de la lumière.

Figure 3 : Diffusion de la lumière vers les points focaux du cortex. (A) La lumière de la fibre optique de 1 mm de diamètre est focalisée sur la surface du cerveau. Ce réglage simple permet de cibler plus précisément la lumière à la surface du cerveau et dans les tissus. (B) L’étendue spatiale de la lumière délivrée au cerveau est mesurée à partir de l’artefact opto-électrique. (C, D) Le réglage est comme dans les panneaux A,B avec une fibre optique de 200 μm, ce qui lui permet de cibler directement une zone de 250 μm de diamètre, à peu près la taille d’une colonne corticale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Enregistrements de rat μECoG et de polytrode laminaire
La figure 4A-D fournit des images de divers composants du système utilisé pour les enregistrements du cortex auditif primaire du rat. Plus précisément, les éléments étiquetés comprennent : (1) micromanipulateur μECoG, (2) plate-forme stéréotaxique pour rongeurs, (3) câble μECoG avec connecteurs ZIF-clip, (4) micromanipulateur polytrode laminaire, (5) appareil de stabilisation de cône et de tête de nez de rat, (6) haut-parleur électrostatique pour la présentation de stimulus, (7) câble polytrode laminaire avec adaptateur ZIF-clip, (8) clip μECoGZIF fixé par une fourche à deux branches, (9) dispositif polytrode à 32 canaux, (10) haut-parleur électrostatique, (11) pinces crocodiles pour maintenir le site chirurgical ouvert, (12) fils de mise à la terre, l’un inséré dans le cortex par les trous de bavure dans le quadrant postérieur gauche ou le quadrant antérieur droit et un autre est mis à la terre sur le tissu, (13) vue rapprochée de la grille μECoG, (14) vue rapprochée du polytrode inséré. La figure 4E montre le spectrogramme neuronal moyen dérivé des potentiels électriques enregistrés d’une seule électrode μECoG en réponse à des pips de tonalité de 50 ms de même fréquence et de même atténuation (N = 20 essais). À travers les fréquences, la réponse évoquée présente un pic brutal entre 25 ms et 30 ms (indiqué par des lignes continues rouges) après le début du stimulus (ligne pointillée grise à gauche). La réponse apparente précédant le début du stimulus (ostensiblement acausale) est due à la grande bande passante aux basses fréquences de la transformée Q constante, qui lisse (acausale, mais pas de décalage de phase) plutôt que de filtrer (causale, mais induit un décalage de phase) le signal. Par conséquent, l’heure de la réponse maximale reste précise. Au moment de la réponse évoquée de crête, nous avons observé que le potentiel électrique de surface corticale (CSEP) noté z était multimodal à travers les fréquences. Plus précisément, il a présenté trois pics primaires non harmoniques : le premier et le plus important dans la gamme 40-180 Hz gamma/high-gamma (γ/Hγ), le second dans la gamme 200-450 Hz ultra-haut gamma (uHγ) et un dernier pic au-dessus de 500 Hz associé à une activité multi-unités (MUA) (Figure 4F)11. Cette structure multimodale évoquée par stimulus est robuste sur toutes les électrodes accordées. Ici, nous nous concentrons sur Hγ en raison de sa prévalence dans les enregistrements d’électrocorticographie humaine (ECoG)31. Dans la figure 4G, nous montrons un réseau μECoG qui a été placé sous-duralement le long d’un polytrode laminaire de silicium pour mesurer simultanément les potentiels électriques de surface corticale (CSEP) et l’activité de pointe à travers les lames corticales. Le réseau μECoG fabriqué sur mesure se composait de 8×16 électrodes avec un pas de 20 μm et un diamètre de contact de 4 μm, et nous avons utilisé un polytrode laminaire à 32 canaux configuré en 2 × 16 canaux avec un pas de 4 μm et un diamètre de contact de 1 μm. Le réseau μECoG était suffisamment grand pour couvrir l’ensemble du cortex auditif primaire du rat (A1), et ses petites électrodes de 4 μm de diamètre permettaient de mesurer des CSEP locales adaptées à la dérivation d’un accord auditif. La résolution spatiale du signal μECoG high-gamma (Hγ) est de ~20 μm, comparable au rayon d’une colonne corticale de rat. Ainsi, μECoG fournit une « vue colonnaire » de l’activité corticale. Les perforations dans la grille μECoG ont permis au polytrode laminaire de passer entre les contacts de surface, permettant un enregistrement direct de l’activité neuronale à travers les lames corticales (Figure 4H). Des exemples de traces de tension enregistrées à partir d’électrodes μECoG et de polytrodes laminaires sont illustrés à la figure 4I.

Figure 4 : Enregistrement des signaux μECoG et polytrode laminaire sur le cortex auditif primaire du rat (A1). (A) Composants de la configuration μECoG et polytrode laminaire. Voir le texte. (B) Vue de dessus de l’installation chirurgicale avant l’enregistrement de la polytrode laminaire, montrant l’emplacement de l’appuie-tête et du site de craniotomie. (C) Vue détaillée de la grille μECoG et du polytrode laminaire sur le cortex auditif exposé. (D) Une vue rapprochée de l’emplacement de la grille μECoG sur le cortex, y compris la taille des électrodes individuelles (40 μm) et entre les électrodes (200 μm). (E) Décomposition en ondelettes moyenne notée z d’une réponse monocanal à une seule paire fréquence-atténuation. Les lignes rouges verticales indiquent la période de réponse en fréquence de crête indiquée dans F.(F) Rouge - Réponse en fréquence de crête moyenne sur 20 présentations d’une seule paire fréquence-atténuation. Gray- Erreur standard. L’axe des fréquences est sur une échelle logarithmique. Les bandes de fréquences neuronales canoniques sont indiquées en haut. (G) Photomicrographie d’une grille 8 16 μECoG à la surface du cortex auditif primaire du rat (A1). Un polytrode laminaire à 32 canaux a été inséré dans la fenêtre centrale μECoG. (H) Schéma d’enregistrement 3D multi-échelle de l’activité corticale. (I) En haut : Spectrogramme de 50 ms de points de tonalité pure. Au milieu : en rouge, le potentiel électrique moyen de la surface corticale de 4 électrodes μECoG (en gris). En bas : Les traces de tension polytrode laminaire à 32 canaux sont classées par profondeur corticale Veuillez cliquer ici pour voir une version plus grande de cette figure.
La figure 5 montre l’enregistrement de signaux μECoG simultanément avec une activité de dopage à l’aide d’un polytrode de silicium laminaire (Camb64). Le signal μECoG, enregistré à partir d’une électrode de surface, est représenté par une trace de tension brute (Figure 5A) et sa transformée en ondelettes, mettant en évidence la décomposition de la fréquence au fil du temps (Figure 5B). L’activité multi-unités a été enregistrée à l’aide de la polytrode, comme illustré par une trace de tension brute représentative d’un seul canal (Figure 5C), où des potentiels d’action individuels (pointes) ont été détectés à l’aide d’une méthode de seuillage simple (tension franchissant un seuil de -120 μV). Les formes d’onde de pointe extraites de ce canal sont bien définies pour la majorité des pointes, bien qu’elles puissent provenir de plusieurs sources de neurones (Figure 5D, encadré). Sur plusieurs canaux dans la même pénétration, les formes d’onde de pointe moyennes confirment davantage la cohérence d’enregistrements d’activité de pic bien définis (Figure 5E). Ainsi, ces méthodes d’enregistrement pourraient prendre en charge l’enregistrement unitaire avec une analyse de tri des pointes et l’analyse de paramètres de qualité tels que l’intervalle entre les pointes ou les taux de décharge (Figure 5F). En résumé, la qualité des enregistrements de la sonde laminaire est bonne, avec une morphologie de forme d’onde claire sur un seul canal. Ces résultats illustrent que cette méthode permet l’acquisition simultanée de l’activité μECoG et du dopation.

Figure 5 : Enregistrements simultanés de l’activité de l’ECoG et du pic en colonnes. (A) Exemple de trace de tension brute à partir d’un seul canal μECoG. (B) Transformée en ondelettes du même canal μECoG, montrant la décomposition en fréquence au fil du temps. (C) Exemple de trace de tension brute à partir d’un seul canal polytrode (sonde en silicium aiguë à 64 canaux camb64), montrant des potentiels d’action (pointes) détectés à l’aide d’un seuil de tension simple. (D) Formes d’onde de pointe extraites du canal polytrode en (C) alignées et codées par couleur en fonction de la distribution de l’amplitude de la tension. 7 des 142 formes d’onde de pointe ne sont pas représentées, car elles étaient considérées comme des valeurs aberrantes en fonction de leur distance par rapport à l’amas principal en termes de largeur et d’amplitude de pointe (voir encadré). (E) Formes d’onde de pointe multi-unités moyennes extraites de 9 canaux dans la même pénétration. (F) Histogrammes d’intervalle entre les pointes (ISI) pour différents canaux polytrodes (par exemple, canaux 21, 27, 63 et 61), avec les taux de décharge correspondants (FR) indiqués en Hz. Les violations ISI (< 5 ms) représentaient moins de 5 % des pointes dans toutes les unités. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Grâce à la possibilité d’effectuer des enregistrements simultanés à l’aide du réseau μECoG et du polytrode laminaire conçus sur mesure, nous avons étudié comment les signaux μECoG se comparent aux enregistrements d’unités neuronales à travers la profondeur corticale en termes de réglage auditif. La figure 6A présente des graphiques d’amplitude de réponse en fréquence (FRA), qui décrivent la réponse gamma élevée (Hγ) en fonction de la fréquence et de l’amplitude du stimulus auditif. Le panneau supérieur montre les FRA d’un sous-ensemble de 2 × 16 d’électrodes μECoG positionnées sur le cortex auditif, tandis que le panneau inférieur affiche les FRA d’un sous-ensemble 1×16 d’électrodes polytrodes laminaires insérées à travers les perforations du réseau μECoG (indiquées par des flèches grises). Remarquablement, les FRA obtenus à partir des électrodes μECoG ressemblent beaucoup à ceux des enregistrements de polytrodes laminaires, ce qui suggère que les signaux μECoG sont également accordés à l’activité des unités neuronales à travers les couches corticales.
En tirant parti de la haute résolution spatiale du réseau μECoG, nous avons généré une carte tonotopique à haute résolution de plusieurs champs corticaux auditifs basée sur l’activité Hγ11. Dans la figure 6B, la meilleure fréquence de chaque électrode est codée par couleur, révélant l’organisation tonotopique à travers la surface corticale. Le réseau 8 × 16 μECoG couvrait plusieurs champs corticaux auditifs, y compris le cortex auditif primaire (A1), le champ auditif postérieur (PAF) et le champ auditif ventral (VAF), avec des limites approximatives délimitées par des lignes noires. Cette cartographie détaillée souligne la capacité du réseau μECoG à fournir une « vue en colonne » de l’activité corticale, capturant l’organisation fonctionnelle avec une résolution spatiale inférieure à 20 μm, comparable aux dimensions d’une colonne corticale de rat. Ces résultats démontrent que les enregistrements μECoG reflètent non seulement les propriétés d’accord observées dans les enregistrements d’unités neuronales à travers la profondeur corticale, mais permettent également une cartographie à haute résolution de l’organisation corticale fonctionnelle.
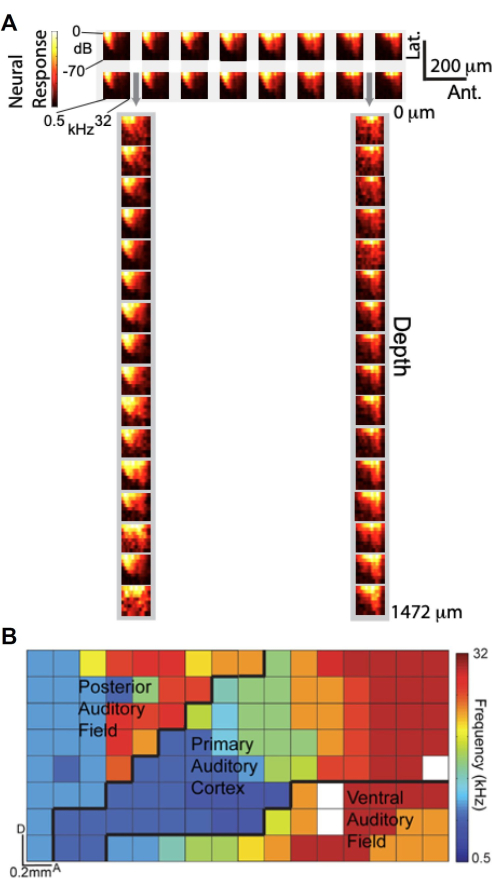
Graphique 6. Les signaux μECoG sont également accordés aux enregistrements de pointes d’unités neuronales à travers la profondeur et révèlent l’organisation tonotopique du cortex auditif. (A) Graphiques d’amplitude de réponse en fréquence (FRA), qui affichent la réponse gamma élevée (barre de couleur) en fonction de la fréquence (axe x) et de l’amplitude (axe y) du stimulus auditif. (haut) FRA de 2 à 16 sous-ensembles d’électrodes μECoG sur le cortex auditif ; (en bas) FRA de 1 16 sous-ensemble d’électrodes polytrodes laminaires insérées par des perforations dans le réseau μECoG, indiquées par des flèches grises. (B) Organisation tonotopique à haute résolution de plusieurs champs corticaux auditifs dérivés d’une activité gamma élevée. Chaque pixel est codé par couleur en fonction de la meilleure fréquence de cette électrode. Le réseau 8x16 μECoG présenté ici couvre plusieurs champs corticaux auditifs (A1, PAF et VAF), et les limites approximatives sont délimitées (lignes noires). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les protocoles décrits ici permettent d’intégrer des réseaux de micro-électrocorticographie à haute densité (μECoG) avec des sondes laminaires et des techniques optogénétiques. La facilité d’utilisation de ce protocole dans les modèles de rongeurs en fait un outil puissant pour l’investigation de la dynamique corticale, et le nombre de sujets peut être facilement augmenté. La grille μECoG à haute densité permet une cartographie efficace et spatialement précise de la topographie corticale sur plusieurs zones chez les souris et les rats, en tirant parti du rôle essentiel des représentations topographiques dans l’organisation du cerveau33. L’ajout de l’enregistrement laminaire permet d’examiner la dynamique corticale à plusieurs échelles spatiales et temporelles. L’inclusion de l’optogénétique permet une manipulation causale pour déterminer les relations entre des populations neuronales spécifiques et leurs contributions aux potentiels évoqués de surface corticale (CSEP) et au traitement cortical34.
L’optogénétique permet la modulation sélective de populations neuronales spécifiques, ce qui permet d’étudier leurs rôles causaux dans la génération de modèles d’activité corticale et de participer à des calculs dont les signatures peuvent être détectées avec μECoG. Par exemple, nos études démontrent que le ciblage d’un type de cellule spécifique peut modifier les potentiels électriques de surface corticale (CSEP). Cette approche pourrait être utilisée pour disséquer la base du type de cellule neurale des signaux μECoG, ce qui nous permettrait d’identifier quels types de cellules neuronales contribuent à des activités sensorielles caractéristiques, telles que celles observées dans la bande gamma élevée. D’autres phénomènes à grande échelle, tels que les rythmes corticaux dans différentes bandes de fréquences21, ou l’activité spatialement organisée, y compris les ondes progressives35,36, pourraient également être étudiés. De plus, une gamme de lignées de souris génétiquement modifiées et d’opsines est facilement disponible, ce qui permet d’explorer des mécanismes de circuit spécifiques. Des techniques optogénétiques pourraient être utilisées pour examiner les effets fonctionnels des connexions horizontales entre les colonnes37, qui jouent un rôle crucial dans divers calculs sensoriels, tels que la suppression du contour38 ou la liaison perceptuelle39. En résumé, la capacité de manipuler l’activité neuronale par l’optogénétique permet de tester les liens entre des populations neuronales spécifiques et les propriétés des CSEP ou entre la population et des calculs corticaux spécifiques mesurables avec μECoG. Cette approche pourrait disséquer efficacement les relations entre les structures neuronales locales et l’activité corticale globale.
Les enregistrements de polytrodes laminaires permettent d’échantillonner l’activité d’un seul neurone à partir de plusieurs neurones dans de petits volumes corticaux, c’est-à-dire au sein d’une colonne corticale individuelle. Ces enregistrements sont cruciaux parce que les neurones individuels peuvent coder indépendamment des informations distinctes, en utilisant un codage sélectif de stimuli - tels que les « neurones Jennifer Aniston » décrits par Quiroga et al.40 - ou en fournissant des représentations complémentaires dans un espace de dimension supérieure, comme on le voit dans la sélectivité mixte41. Traditionnellement, les électrophysiologistes étudiaient l’activité neuronale dans le contexte de stimuli et de comportements simples et paramétriques (par exemple, une déviation de moustache unique ou des tons purs, tels qu’ils sont déployés ici). La représentation de ces stimuli a tendance à être assez localisée dans l’espace (par exemple, des colonnes individuelles). Cependant, de nombreux stimuli et comportements pertinents sur le plan éthologique sont plus complexes et, en tant que tels, les modèles typiques de l’activité neuronale au cours de ces paradigmes s’étendent souvent au-delà de simples colonnes - même dans toutle cerveau. Dans ces cas, μECoG offre une lecture complète qui capture l’activité résolue en colonnes à haute résolution temporelle sur plusieurs colonnes simultanément. En résumé, le protocole décrit ici comble efficacement le fossé entre le traitement local au sein des colonnes corticales individuelles et les dynamiques plus étendues qui se produisent sur plusieurs colonnes dans une aire corticale entière et entre les aires.
À titre d’orientation générale et de dépannage, nous proposons quelques recommandations. Les protocoles électrophysiologiques aigus in vivo conventionnels conseillent généralement de garder le cerveau humide pendant l’exposition comme moyen de prolonger la santé du cerveau exposé. Bien que cela soit probablement utile dans certaines circonstances, notre expérience suggère que le contraire est vrai pour les enregistrements μECoG chez les rongeurs. En effet, nous avons constaté que la qualité d’enregistrement était qualitativement meilleure lorsque les réseaux μECoG étaient placés sur une surface corticale légèrement sèche. Nous pensons que cela se produit parce que le fait d’avoir une solution saline, une solution ionique hautement conductrice positionnée entre la surface corticale et les électrodes d’enregistrement, homogénéise les signaux électriques générés par le cerveau. En effet, la solution saline « court-circuite » les électrodes ensemble. Étant donné que les réseaux μECoG surveillent le champ électrique continu généré par les populations de neurones, il est important de s’assurer que les systèmes électrophysiologiques sont bien assemblés et débruités. Lors des enregistrements, la connexion avec l’électrode de référence est critique. Sans amélioration lors de l’enregistrement, le prétraitement des données peut intégrer un filtre coupe-bande à 50 Hz ou 60 Hz pour supprimer les bruits de ligne. Cependant, cela modifiera considérablement le signal et doit donc être pris en compte dans l’analyse ultérieure. En ce qui concerne la stimulation lumineuse optogénétique, l’artefact optoélectrique doit être minimisé ou au moins pris en compte dans la conception expérimentale (par exemple, en incluant un délai après l’apparition ou le décalage de la lumière). Idéalement, la lumière est délivrée dans la zone située entre les électrodes à l’aide d’une fibre optique de petit diamètre, ou en focalisant ou en collimatant la lumière. Si cet artefact ne peut pas être complètement évité (mais voir les études proposant différents modèles de sondes 15,20,43 y compris des électrodes transparentes), il peut être réduit en utilisant le moins de lumière nécessaire. Les opsines de nouvelle génération nécessitent moins de lumière pour être efficaces44,45. Nous suggérons d’étalonner la puissance lumineuse optogénétique avant l’expérience à l’aide de sondes laminaires. La forme de l’artefact peut également être modifiée et réduite en évitant les transitions brusques dans le stimulus lumineux (par exemple, en utilisant une rampe lumineuse au lieu d’une impulsion carrée). Dans tous les cas, des conditions de contrôle utilisant des animaux qui n’expriment pas d’opsines sont conseillées pour différencier les changements réels de l’activité neuronale des signaux liés aux artefacts. Enfin, le processus d’électrodéposition crée un revêtement rugueux et de grande surface qui améliore le transfert de charge entre l’électrode et le tissu tout en maintenant la stabilité mécanique pendant les enregistrements, réduisant l’impédance de l’électrode de 1 à 2 ordres de grandeur par rapport au platine nu et permettant une meilleure détection des signaux neuronaux46.
Acute μECoG offre une flexibilité et une complexité réduite dans les configurations expérimentales, permettant une cartographie détaillée de l’activité neuronale au cours de dizaines de minutes d’enregistrements. En tant que méthode à méso-échelle, elle permet un suivi inter-aire mais pas cérébral entier de l’activité corticale, bien que les sources exactes des signaux restent incertaines 1,47. À l’avenir, les études multimodales devraient permettre de mieux cerner l’origine du signal. La μECoG aiguë est limitée dans la capture de la dynamique neuronale à long terme et peut être influencée par des facteurs transitoires tels que la récupération chirurgicale ou l’anesthésie48,49. En revanche, le μECoG chronique permet une observation prolongée de l’activité neuronale, fournissant des informations sur des processus tels que l’apprentissage, la plasticité et la progression de la maladie10,13. La μECoG chronique présente également des défis tels que la stabilité des électrodes, la dégradation potentielle du signal et les risques associés à l’implantation à long terme, y compris la cicatrisation ou l’infection des tissus50,51. Ces défis ont tendance à être moins graves par rapport aux électrodes pénétrantes et sont censés être encore réduits avec l’implantation péridurale du μECoG chez la souris (au prix d’une qualité de signal inférieure)52. Il est possible de réutiliser la même grille μECoG sur plusieurs sessions chez le même animal ou chez des animaux différents, en supprimant la grille à la fin d’une session et en la remplaçant lors de la session suivante. Dans cette configuration subaiguë, le cerveau doit être maintenu humide en tout temps et protégé par une lamelle en verre entre les séances. Nous avons observé que les réseaux μECoG sont assez durables ; Une grille individuelle peut être réutilisée ~20 fois avec une manipulation et un nettoyage appropriés, ce qui en fait des appareils d’enregistrement rentables. Les grilles peuvent être conçues avec différents nombres et géométries de dispositions d’électrodes. Les résultats suggèrent que la réduction du pas de l’électrode à <200 μm n’entraîne que des améliorations négligeables de la résolution fonctionnelle en raison de la granularité des représentations neuronales dans le cortex sous-jacent.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Ce travail a été soutenu par le Lawrence Berkeley National Laboratory LDRD pour le Neural Systems and Machine Learning Lab (K.E.B.), NINDSR01 NS118648A (K.E.B.& D.E.F.) et NINDS R01 NS092367 (D.E.F.).
matériels
| Name | Company | Catalog Number | Comments |
| 1 disposable #11 blade | Swann Morton | 303 | For surgical procedures |
| 2 disposable #10 blades | Swann Morton | 3901 | For surgical procedures |
| 30 mm cage bars | Thorlabs | ER | cage components |
| 30 mm cage plate | Thorlabs | CP33T | holding the lenses |
| 70% ethanol | Decon Labs | V1016 | Cleaning / Disinfectant (diluted to 70%) |
| Amalgambond PLUS Adjustable Precision Applicator Brush Teal 200/Bx | Henry Schein | 1869563 | precision applicator for the cement |
| Amalgambond PLUS Catalyst 0.7 mL Syringe Ea | Henry Schein | 1861119 | cement component |
| Amplifier (Tucker-Davis Technologies) | Tucker-Davis Technologies | PZ5M-512 | Used for auditory stimulus and recording software. |
| Articulated arm | Noga | DG60103 | for holding the fine adjustment screw system |
| Aspheric lenses for light collection (and one for focusing the light) | Thorlabs | ACL25416U-B | for collecting LED light |
| Auditory equipment | Tucker-Davis Technologies, Sony, Cortera | RP2.1 Enhanced Real-Time Processor/HB7 Headphone Drive | Used for auditory stimulus and recording software. |
| Buprenorphine | Sterile Products LLC | #42023017905 | General analgesia |
| C&B Metabond Base Cement Ea | Henry Schein | 1864477 | cement component |
| C&B Metabond L-Powder Cement Clear 3 g | Henry Schein | 1861068 | cement component |
| Chlorprothixene hydrochloride (mouse) | Sigma Aldrich | Cat. No. C1671 | For sedation, must be prepared the same day and kept at 4 |
| Custom-designed 128-channel micro-electrocorticography (μECoG) grids | Neuronexus | E128-200-8-40-HZ64 | For neurophysiology recordings. Placed onto the cortex. |
| Dengofoam gelatin sponges | Dengen dental | 600034 (SKU) | can be used dry or wet, saturated with sterile sodium chloride solution |
| Drill bit, size 5 to 9 (Mouse) | Fine Science Tools | 19007-XX | XX is the size of the drill bit e.g. 05 or 09. For mouse procedures |
| Drill bitSteel Round Bur (5.5 mm/7.5 mm) | LZQ Tools | Dental Bar Drill Bit Stainless Steel Bur | For rat procedures |
| Dumont No. 5 forceps | Fine Science Tools | 11251-10 | For surgical procedures |
| Dumont tweezers #5 bent 45° | World precision instruments | 14101 | for removing craniotomy window |
| DVD Player (Sony) | Sony | CDP-C345 | System used to accept and play back stimulus sets |
| Electrostatic Speaker | Sony | XS-162ES | Used for auditory stimulus and recording software. Located within the rig, plays sound to the sedated rodent |
| Enzymatic detergent (Enzol) | Advanced sterilization products | 2252 | Cleaning/Disinfectant |
| EverEdge 2.0 Scaler Sickle Double End H6/H7 #9 | Henry Schein | 6011862 | for scrubing the skull |
| Fine adjustment screw system in 3 dimension | Narishige | U-3C | for precise positioning of the optical fiber end |
| Gold pin | Harwin Inc | G125-1020005 | Used for contact reference in mouse Soldered to the silver wire |
| Gripping forceps | Fine Science Tools | 00632-11 | For surgical procedures |
| Isoflurane | Covetrus | 11695067772 | require a vaporizer |
| Ketamine (Hydrochloride Injection) (Rat) | Dechra | 17033-101-10 | Anesthesia/Analgesic |
| LED | New Energy | LED XLAMP XPE2 BLUE STARBOARD | Blue LED light source |
| LED driver | Thorlabs | LEDD1B | LED driver |
| Lidocaine | Covetrus | VINB-0024-6800 | to be diluted to 1% in saline |
| Meloxicam | Covetrus | 6451603845 | Anti-inflammatory used for general analgesia |
| Micromanipulator | Narishige (Stereotaxic Rig) | SR-6R + SR-10R-HT components | Used to manipulate ECoG and rodent with fine movements |
| No. 2 forceps | Fine Science Tools | 91117-10 | For surgical procedures |
| No. 55 forceps | Fine Science Tools | 1129551 | For surgical procedures |
| Ophtalmic lubricant (Artificial tears) | Akorn | 17478-062-35 | Used to protect eyes from dessication during surgical procedures |
| Optical fiber 200µm Core diameter | Thorlabs | M133L02 | FC/PC connector 2 m long |
| Pentobarbital (Rat) | Covetrus / Dechra | VINV-C0II-0008 | Anesthesia/Analgesic |
| Platinum Black | Sigma | 205915-250MG | For neurophysiology recordings (Used for electroplating the contacts on the μECoG grids). |
| Povidone Iodine 10% | Betadine | https://betadine.com/medical-professionals/betadine-solution/ | no catalog number ( not retail ) |
| Powder detergent (Contrex AP) | Decon Labs | 5204 | Cleaning / Disinfectant |
| Pre-cut tape for oxygen tube | ULINE (Various Providers) | S-14726 | Used to attach oxygen tube to the nose-cone of the rodent stereotaxic rig |
| Scalpel handle # 3 | World precision instruments | 500236-G | for blades # 10, #11 and #15 |
| Scraper | Fine Science Tools | 1007516 | For surgical procedures |
| Short 30 G needles | ExelInt | 26437 | For surgical procedures and injections |
| Silver Wire | Warner Instruments | 63-1319 | For neurophysiology recordings (Used for grounding and as a reference electrode). |
| Sterilized saline (0.9% sodium chloride for injection) | Hospira | 00409-7101-67 (NDC) | For dilution of injectable, and replacement of body fluids |
| Stoelting Hopkins Bulldog | Fine Science Tools | 10-000-481 | For surgical procedures |
| Surface disinfectant (Coverage Plus NDP Disinfectant) | Steris life science | 638708 | Cleaning/Disinfectant |
| TDT ZIF-clip connectors for acquisition. | Tucker-Davis Technologies | ZIF-Clip Analog Headstages | Connects ECoG with outside acquisition equipement |
| Two-pronged holding fork | Tucker-Davis Technologies | Z-ROD128 | Used to connect the TDT-clips with the micromanipulator |
| Xylazine (Rat) | Covetrus | 1XYL006 | Anesthesia/Analgesic |
Références
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nunez, P. L., Srinivasan, R. Electric Fields of the Brain: The Neurophysics of EEG. , Oxford University Press, USA. (2006).
- Mountcastle, V. B., Powell, T. P. Central nervous mechanisms subserving position sense and kinesthesis. Bull Johns Hopkins Hosp. 105, 173-200 (1959).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci. 18 (2), 310-315 (2015).
- Lewis, C. M., Bosman, C. A., Womelsdorf, T., Fries, P. Stimulus-induced visual cortical networks are recapitulated by spontaneous local and interareal synchronization. Proc Natl Acad Sci U S A. 113 (5), E606-E615 (2016).
- Bouchard, K. E., Mesgarani, N., Johnson, K., Chang, E. F. Functional organization of human sensorimotor cortex for speech articulation. Nature. 495 (7441), 327-332 (2013).
- Fabrication and testing of a large area, high density, parylene MEMS µECoG array. Ledochowitsch, P., et al. 2011 IEEE 24th International Conference on Micro Electro Mechanical Systems, Cancun, Mexico, , (2011).
- Bosman, C. A., et al. Attentional stimulus selection through selective synchronization between monkey visual areas. Neuron. 75 (5), 875-888 (2012).
- Rubehn, B., Bosman, C., Oostenveld, R., Fries, P., Stieglitz, T. A MEMS-based flexible multichannel ECoG-electrode array. J Neural Eng. 6 (3), 036003(2009).
- Baratham, V. L., et al. Columnar localization and laminar origin of cortical surface electrical potentials. J Neurosci. 42 (18), 3733-3748 (2022).
- Kellis, S., et al. Decoding spoken words using local field potentials recorded from the cortical surface. J Neural Eng. 7 (5), 056007(2010).
- Viventi, J., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci. 14 (12), 1599-1605 (2011).
- A transparent µECoG array for simultaneous recording and optogenetic stimulation. Ledochowitsch, P., Olivero, E., Blanche, T., Maharbiz, M. M. 2011 Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Boston, MA, USA, , (2011).
- Ledochowitsch, P., et al. Strategies for optical control and simultaneous electrical readout of extended cortical circuits. J Neurosci Methods. 256, 220-231 (2015).
- Laminar origin of evoked ECoG highgamma activity. Annu Int Conf IEEE Eng Med Biol Soc. Dougherty, M. E., Nguyen, A. P. Q., Baratham, V. L., Bouchard, K. E. 2019, 4391-4394 (2019).
- Tian, H., Xu, K., Zou, L., Fang, Y. Multimodal neural probes for combined optogenetics and electrophysiology. iScience. 25 (1), 103612(2022).
- Gonzales, D. L., et al. A translaminar spacetime code supports touchevoked traveling waves. bioRxiv. , (2024).
- Leonard, M. K., et al. Largescale singleneuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Renz, A. F., et al. OptoEDura: a soft, stretchable ECoG array for multimodal, multiscale neuroscience. Adv Healthc Mater. 9 (17), 2000814(2020).
- Buzsáki, G. Rhythms of the brain. , Oxford University Press, USA. (2006).
- Yang, W., et al. A fully transparent, flexible PEDOT:PSS-ITO-Ag-ITO based microelectrode array for ECoG recording. Lab Chip. 21 (6), 1096-1108 (2021).
- Buzsáki, G. Largescale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Schalk, G., et al. Realtime detection of eventrelated brain activity. Neuroimage. 43 (2), 245-249 (2008).
- Kellis, S., et al. Multiscale analysis of neural activity in humans: implications for microscale electrocorticography. Clin Neurophysiol. 127 (1), 591-601 (2016).
- Buzsáki, G., Schomburg, E. W. What does gamma coherence tell us about interregional neural communication. Nat Neurosci. 18 (4), 484-489 (2015).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecondtimescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Cardin, J. A., et al. Driving fastspiking cells induces gamma rhythm and controls sensory responses. Nature. 459 (7247), 663-667 (2009).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decisionrelated activity propagate in a cortical feedback loop during touch perception. Nat Neurosci. 19 (9), 1243-1249 (2016).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56 (2), 339-355 (2007).
- Crone, N. E., Sinai, A., Korzeniewska, A. Highfrequency gamma oscillations and human brain mapping with electrocorticography. Prog Brain Res. 159, 275-295 (2006).
- Gerfen, C. R., Paletzki, R., Heintz, N. GENSAT BAC crerecombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron. 80 (6), 1368-1383 (2013).
- Mountcastle, V. The columnar organization of the neocortex. Brain. 120 (4), 701-722 (1997).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Muller, L., Chavane, F., Reynolds, J., Sejnowski, T. J. Cortical travelling waves: mechanisms and computational principles. Nat Rev Neurosci. 19 (5), 255-268 (2018).
- Sato, T. K., Nauhaus, I., Carandini, M. Traveling waves in visual cortex. Neuron. 75 (2), 218-229 (2012).
- Gilbert, C. D., Wiesel, T. N. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortex. J Neurosci. 9 (7), 2432-2442 (1989).
- Angelucci, A., et al. Circuits and mechanisms for surround modulation in visual cortex. Annu Rev Neurosci. 40 (1), 425-451 (2017).
- Singer, W., Gray, C. M. Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci. 18, 555-586 (1995).
- Quiroga, R. Q., et al. Invariant visual representation by single neurons in the human brain. Nature. 435 (7045), 1102-1107 (2005).
- Fusi, S., Miller, E. K., Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr Opin Neurobiol. 37, 66-74 (2016).
- Stringer, C., et al. Spontaneous behaviors drive multidimensional, brainwide activity. Science. 364 (6437), eaav7893(2019).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using celltypespecific expression of channelrhodopsin2. Nat Protoc. 5 (2), 247-254 (2010).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nat Neurosci. 21 (6), 881-893 (2018).
- Mahn, M., et al. Highefficiency optogenetic silencing with somatargeted anionconducting channelrhodopsins. Nat Commun. 9 (1), 4125(2018).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating lowimpedance tetrodes by electroplating with additives. Sens Actuators A Phys. 156 (2), 388-393 (2009).
- Halnes, G., et al. Electric Brain Signals: Foundations and Applications of Biophysical Modeling. , Cambridge University Press. (2024).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nat Rev Neurosci. 9 (5), 370-386 (2008).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and anesthesia. Science. 322 (5903), 876-880 (2008).
- Schalk, G., Leuthardt, E. C. Braincomputer interfaces using electrocorticographic signals. IEEE Rev Biomed Eng. 4, 140-154 (2011).
- Chestek, C. A., et al. Longterm stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex. J Neural Eng. 8 (4), 045005(2011).
- Branco, M. P., et al. Nine decades of electrocorticography: a comparison between epidural and subdural recordings. Eur J Neurosci. 57 (8), 1260-1288 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon