Method Article
Investigaciones multiescala del procesamiento cortical mediante la integración de politrodos laminares y optogenética con microelectrocorticografía en roedores
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos dos protocolos para el registro de microelectrocorticografía de alta densidad (μEcoG) en ratas y ratones, incluidos los métodos quirúrgicos, de implantación y de registro. Los registros de μECoG se realizan en combinación con el registro de politrodos laminares en la corteza auditiva de la rata o con la manipulación optogenética de la actividad neuronal en la corteza somatosensorial del ratón.
Resumen
La electrocorticografía (ECoG) es un puente metodológico entre la neurociencia básica y la comprensión de la función del cerebro humano en la salud y la enfermedad. ECoG registra señales neurofisiológicas directamente desde la superficie cortical con una resolución temporal de milisegundos y una resolución espacial columnar en grandes regiones de tejido cortical simultáneamente, lo que lo coloca en una posición única para estudiar cálculos corticales locales y distribuidos. Aquí, describimos el diseño de dispositivos micro-ECoG (μECoG) personalizados y su uso en dos procedimientos. Estas rejillas tienen 128 electrodos de baja impedancia con un espaciado de 200 μm fabricados sobre un sustrato de polímero transparente con perforaciones entre electrodos; estas características permiten el registro simultáneo de μECoG con registros de politrodos laminares y manipulaciones optogenéticas. En primer lugar, presentamos un protocolo para el registro epidural combinado de μECoG sobre la corteza somatosensorial de los bigotes de ratones con manipulación optogenética de tipos específicos de células corticales genéticamente definidas. Esto permite la disección causal de las distintas contribuciones de diferentes poblaciones neuronales al procesamiento sensorial, al tiempo que monitorea sus firmas específicas en las señales μECoG. En segundo lugar, presentamos un protocolo para experimentos agudos para registrar la actividad neuronal de la corteza auditiva de ratas utilizando rejillas μECoG y politrodos laminares. Esto permite un mapeo topográfico detallado de las respuestas neuronales evocadas sensorialmente a través de la superficie cortical simultáneamente con grabaciones de múltiples unidades neuronales distribuidas a través de la profundidad cortical. Estos protocolos permiten realizar experimentos que caracterizan la actividad cortical distribuida y pueden contribuir a la comprensión y a las eventuales intervenciones para diversos trastornos neurológicos.
Introducción
Las funciones cerebrales que subyacen a la sensación, la cognición y la acción están organizadas y distribuidas a través de vastas escalas espaciales y temporales, que van desde los picos de neuronas individuales hasta los campos eléctricos generados por las poblaciones de neuronas en una columna cortical y la organización topográfica de las columnas en las áreas del cerebro (por ejemplo, somatotopía en la corteza somatosensorial, tonotopía en la corteza auditiva primaria). La comprensión de la función cerebral requiere la detección de señales eléctricas a través de estas escalas espaciales1. En la actualidad, la neurociencia cuenta con muchos métodos ampliamente utilizados para monitorizar la actividad del cerebro. Desde el punto de vista electrofisiológico, los politrodos laminares (como los neuropíxeles) permiten la monitorización de un número modesto (~300) de neuronas individuales, normalmente dentro de un puñado de columnas espaciadas a distancia, con una resolución temporal alta (≥1 kHz). Las imágenes de Ca2+ permiten el monitoreo de un número modesto a grande de neuronas individuales identificadas genética y anatómicamente dentro de una extensión espacial de ~ 1-2 mm a una resolución temporal más baja (~ 10 Hz)2. La resonancia magnética funcional permite monitorizar el estado metabólico de un gran número de neuronas (~1 M de neuronas en un volumen de 36mm3) en todo el cerebro a una resolución temporal muy baja (~0,2 Hz). El EEG/MEG permite monitorizar la actividad eléctrica de toda la superficie cortical/cerebro con una resolución temporal modesta (<100 Hz) y una resolución espacial muy baja (centímetros)3. Si bien cada una de estas metodologías ha proporcionado información fundamental y sinérgica sobre la función cerebral, los métodos que permiten la detección directa de señales electrofisiológicas a alta resolución temporal desde ubicaciones anatómicas precisas en amplias regiones espaciales de la corteza son incipientes. La necesidad de una amplia cobertura espacial se enfatiza por el hecho de que en el cerebro, la función neuronal cambia mucho más dramáticamente a través de la superficie en comparación conla profundidad.
La electrocorticografía (ECoG) es un método en el que se implantan rejillas de electrodos de baja impedancia en la superficie del cerebro y permiten el registro o la estimulación de la corteza 1,5. Por lo general, la ECoG se implementa en entornos neuroquirúrgicos humanos como parte de los estudios clínicos para el tratamiento de la epilepsia farmacológicamente intratable. Sin embargo, también proporciona información única sobre el procesamiento cortical distribuido en los seres humanos, como el habla y el mapeo topográfico sensorial 6,7. Estas capacidades han motivado su uso en modelos animales, incluyendo monos, ratas y ratones 5,8,9,10,11. En roedores, se ha demostrado recientemente que el micro-ECoG (μECoG) permite la monitorización eléctrica directa de poblaciones neuronales de alta resolución temporal (~100 Hz) con resolución espacial columnar (~200 μm) y amplia cobertura espacial (muchos milímetros). μECoG permite a los investigadores investigar la dinámica neuronal distribuida asociada con el procesamiento sensorial complejo, las funciones cognitivas y los comportamientos motores en modelos animales12,13. Los avances recientes han integrado μECoG con la optogenética y los registros de politrodos laminares 14,15,16,17,18,19,20, lo que permite investigaciones multiescala de redes corticales y cierra la brecha entre la actividad neuronal a microescala y la dinámica cortical a macroescala 21,22. De manera crítica, debido a que la señal μECoG es muy similar en humanos y modelos animales no humanos, el uso de μECoG hace que la traducción de los resultados y hallazgos de modelos animales a humanos sea mucho más directa23. Como tal, los enfoques integradores son cruciales para avanzar en nuestra comprensión de los circuitos neuronales y son prometedores para el desarrollo de nuevas intervenciones terapéuticas para los trastornos neurológicos 5,24,25.
En consecuencia, existe una necesidad emergente de protocolos que integren matrices de μECoG de alta densidad con registros laminares y herramientas optogenéticas para permitir investigaciones multiescala exhaustivas del procesamiento cortical 8,26. Para abordar esta brecha, hemos desarrollado dispositivos μECoG diseñados a medida con 128 electrodos de baja impedancia con un diámetro de electrodo de 40 μm y un espaciamiento entre electrodos de 20 μm en un sustrato polimérico flexible y transparente (parileno-C y poliimida) con perforaciones entre electrodos, lo que permite registros simultáneos de μECoG y politrodo laminar con manipulaciones optogenéticas13,22. Los aspectos clave de este protocolo experimental incluyen: (i) resolución espacial columnar y cobertura a gran escala de la actividad cortical a través de matrices μECoG de alta densidad; (ii) la capacidad de registrar desde múltiples capas corticales utilizando politrodos laminares insertados a través de la rejilla μECoG; y (iii) la incorporación de técnicas optogenéticas para activar o inhibir selectivamente poblaciones neuronales específicas, permitiendo así la disección causal de circuitos neuronales 27,28,29. La configuración de alta densidad permite registros de alta resolución espacial, proporcionando efectivamente una "vista en columna" de la actividad cortical, ya que estudios previos han demostrado que las señales μECoG pueden resolver la actividad a una escala espacial comparable al diámetro de la columna cortical de roedores (~20 μm)11. Esta metodología integrada permite el monitoreo y la manipulación simultáneos a múltiples escalas de la actividad neuronal, lo que podría permitir experimentos causales para determinar las fuentes neuronales de las señales μECoG, así como el procesamiento cortical distribuido. Para lograr estos objetivos, este manuscrito proporciona protocolos detallados para el uso de matrices μECoG de alta densidad en dos combinaciones.
En primer lugar, describimos μECoG combinado con la manipulación de células piramidales de capa 5 (L5) en la corteza somatosensorial primaria (S1) del ratón. En el ratón, la matriz μECoG se coloca por vía epidural (debido a la intratabilidad quirúrgica de la durotomía en ratones). Una fibra óptica se coloca sobre la rejilla o se combina con una lente para enfocar la luz optogenética sobre una pequeña área objetivo de la superficie cortical. La estrategia optogenética se describe aquí para la inhibición de las neuronas excitadoras de la capa 5, pero se puede adaptar fácilmente a cualquier población de neuronas provistas de la línea de ratón correspondiente, específica de la población, que expresa Cre. En segundo lugar, describimos el uso combinado de μECoG con politrodos laminares de silicio para registrar simultáneamente los potenciales eléctricos de superficie cortical (CSEP) y la actividad de pico de una sola unidad de múltiples neuronas a través de las capas corticales de la corteza auditiva de rata (A1). La matriz tiene perforaciones entre electrodos, lo que permite la inserción de politrodos laminares multicanal a través de la rejilla para registrar la actividad neuronal en diferentes capas corticales. Durante el procedimiento de craneotomía, la matriz μECoG se coloca subduralmente sobre la corteza auditiva y el polítrodo laminar se inserta a través de las perforaciones. Las señales neuronales de la sonda μECoG y laminar se registran simultáneamente, muestreadas a 6 kHz y 24 kHz, respectivamente, utilizando un sistema amplificador conectado ópticamente a un procesador de señal digital.
Protocolo
Ambos protocolos siguen los mismos pasos clave (anestesia, fijación, craneotomía, registro de μECoG) pero tienen diferencias notables. En la siguiente descripción, se combinan los pasos compartidos, mientras que se anotan las especificidades de cada protocolo. Estos pasos a continuación corresponden al registro de μECoG con optogenética (ratón) o al registro de μECoG con una sonda laminar (rata). Todos los procedimientos descritos aquí se llevaron a cabo de conformidad con las autoridades éticas o legales locales (IACUC o Comités de Ética). Los medicamentos utilizados pueden variar de acuerdo con el protocolo ético aprobado.
1. Preparación y protocolo para los procedimientos con ratones y ratas
- Diferencias notables entre los protocolos de ratón y rata
- Configuraciones para la cirugía frente a registros electrofisiológicos
- En el caso de una rata, utilice la misma configuración tanto durante la cirugía como durante los registros electrofisiológicos.
- En el caso de un ratón, realice la cirugía en la primera configuración y los registros electrofisiológicos en la segunda configuración.
- Fijación de la cabeza
- En el caso de una rata, utilice la misma pinza para el hocico para la cirugía y el registro electrofisiológico.
- En el caso de un ratón, utilice una pinza para el hocico para la cirugía y una barra de cabeza metálica externa en la configuración para la electrofisiología para permitir la fijación bajo anestesia ligera con isoflurano. Implante la barra de cabeza con cemento dental en el cráneo.
- Configuración de la grabación: Utilice una electrónica de adquisición, un software de grabación y un software de estimulación sensorial distintos para las dos especies.
- Para el protocolo del ratón, utilice el sistema SpikeGadgets (https://spikegadgets.com) y el software de código abierto Trodes (https://spikegadgets.com/trodes/) para la adquisición de datos.
- Para el protocolo rata, utilice el software de grabación Synapse - Neurophysiology Suite (https://www.tdt.com/component/synapse-software/) para la adquisición de datos.
- Inducir la anestesia por inyección (rata) o inhalación (ratón).
- Lugar de grabación
- Realizar grabaciones en la corteza somatosensorial (S1) de un ratón.
- Realizar grabaciones en la corteza auditiva primaria (A1) de una rata.
NOTA: Esta diferencia en la localización anatómica requiere diferentes sitios de craneotomía para cada especie.
- Configuraciones para la cirugía frente a registros electrofisiológicos
- Preparación y prueba de la red
- Remoje la rejilla (excluyendo la placa de conectores) en un detergente enzimático diluido (50% de detergente, 50% de agua destilada) durante al menos 1 h.
- Transfiéralo a un baño de agua destilada pura y deje que se seque al aire en un lugar seguro y limpio.
- Realice la electrodeposición de negro de platino como parte de la preparación inicial del dispositivo μECoG, no antes de cada sesión de grabación.
NOTA: Una vez depositado, el recubrimiento de Platinum Black forma una capa estable que sigue siendo efectiva para múltiples grabaciones, aunque su rendimiento debe controlarse mediante pruebas de impedancia periódicas. La electrodeposición de negro de platino (rango objetivo de 10-20 kΩ a 1 kHz) disminuye la impedancia del electrodo y mejora la relación señal-ruido en las grabaciones neuronales. - Para realizar la electrodeposición, prepare una solución de ácido cloroplatínico (generalmente ácido cloroplatínico al 1-3% [H2PtCl6]) que contenga una pequeña cantidad de acetato de plomo (alrededor del 0,005%) como modificador de la deposición. Conecte los electrodos μECoG para que sirvan como electrodo de trabajo en una celda electroquímica de tres electrodos, con un contraelectrodo de platino y un electrodo de referencia Ag/AgCl.
- Aplique una densidad de corriente constante de aproximadamente -0,5--2 mA/cm² durante 10-30 s mientras monitorea los valores de impedancia.
- Pruebe y registre la impedancia de los electrodos de rejilla (por ejemplo, con un Nano-Z).
- Revise la rejilla sobre una fuente de luz y prepare la rejilla para su uso en el registro posterior a la cirugía.
- Soldadura de cable de referencia
- En el caso de un ratón, suelde el extremo de un cable de plata (10 mm de largo, 30 G) a un pin de oro para conectarlo al cable de referencia del sistema de grabación.
2. Cirugía
- Preparación de materiales y seguimiento general (Cuidado y registro de animales)
- Preparación: Limpiar y desinfectar a fondo la zona quirúrgica con un desinfectante adecuado. Asegúrese de que todos los instrumentos quirúrgicos estén esterilizados, por lo general utilizando un autoclave.
- Colocación de herramientas quirúrgicas: Coloque las herramientas quirúrgicas en la almohadilla quirúrgica estéril. Llene el área quirúrgica con aplicadores de punta de algodón y triángulos quirúrgicos de algodón absorbentes. Deseche cualquier residuo biopeligroso en una bolsa de eliminación específica.
- Regulación de la temperatura: Encienda la almohadilla térmica dentro del sitio de registro quirúrgico y electrofisiológico. Controle la temperatura de la almohadilla térmica durante toda la cirugía y el registro.
- Almohadilla quirúrgica: Coloque una almohadilla quirúrgica o manta azul sobre la cama de regulación de temperatura.
NOTA: Esta almohadilla debe tener un fondo blanco de algodón suave, que debe mirar hacia arriba. - Posicionamiento del microscopio: Prepare el microscopio y el iluminador adjunto (por ejemplo, anillo LED) a un lado del área quirúrgica. Compruebe que funciona correctamente.
- Fresa quirúrgica: Prepare la fresa quirúrgica para el procedimiento de craneotomía.
- Suministro de oxígeno: Ajuste el caudal del tanque de oxígeno a 1,0 L/min (rata) o 0,5 l/min (ratón) y coloque la máscara de oxígeno cerca de la almohadilla de regulación. El animal necesitará oxígeno continuo después de la anestesia.
- Reemplazo de líquidos: A lo largo de la cirugía, reemplace cualquier pérdida de líquidos, con el objetivo de reemplazar al menos el 1,5% del peso corporal del animal (ratón) o 1 ml por hora (rata). Prepare las soluciones isotónicas en consecuencia.
- Animal: Lleve al animal de la instalación de animales a la sala de cirugía de acuerdo con los procedimientos aprobados. Utilice ratones de 8 a 16 semanas de edad, ya sea machos o hembras, de fondo C57Bl6; asimismo, utilizar ratas de 7 semanas de edad, machos, de la cepa Sprague Dawley.
- Preparación de medicamentos: Pesar al animal utilizando una báscula con una precisión de 0,1 g. Prepare las cantidades adecuadas de fármaco para la cirugía, utilizando soluciones prediluidas si es necesario.
- Inducción de la anestesia
- Inducción de anestesia para un ratón
- Colocar el animal en la cámara de inducción de isoflurano (3-5% de isoflurano en 0,5 L/min Ø2).
- Una vez que se confirme la anestesia profunda (ausencia de reflejo en el pinzamiento de la cola / dedo del pie), coloque al animal en la almohadilla térmica de cirugía y fíjelo en la cabeza.
- Inyectar fármacos subcutáneos para la analgesia general: Meloxicam: 5 mg/kg y Buprenorfina: 0,1 mg/kg.
- Fije la cabeza del mouse siguiendo los pasos 2.2.1.5-2.2.1.6.
- Coloque el hocico en la máscara de anestesia y la cabeza sin apretar en el soporte para la cabeza. Para colocar el ratón en la barra de mordida, primero, asegúrese de que la lengua esté debajo de la varilla y no entre la varilla y el paladar. Use fórceps para mover la lengua si es necesario.
- Inserte los incisivos del animal en el orificio de la varilla de la barra de mordida. Asegure la máscara de anestesia del ratón (1,5-2% de isoflurano en 0,5 L/min Ø2) apretando suavemente el tornillo de fijación. La estabilización de la cabeza durante la cirugía está garantizada únicamente por la barra de mordida.
- Proteja los ojos del animal con un ungüento o lubricante para los ojos a base de petróleo para evitar que se seque durante la cirugía.
- Mantenga la anestesia durante todo el procedimiento con un flujo continuo de isoflurano a través de la mascarilla.
- Inducción de la anestesia para una rata
- Utilice isoflurano inicialmente para sedar al animal y facilitar la inyección de anestesia de inducción.
- Administrar los fármacos para la anestesia y la analgesia:
Meloxicam: Dosis de 5 mg/kg, concentración 10 mg/mL, 0,4 mL/kg
Ketamina: Dosis de 90 mg/kg, concentración 100 mg/mL, 0,9 mL/kg
Xilacina: Dosis de 10 mg/kg, concentración 100 mg/mL, 0,1 mL/kg - Permita que el animal alcance la anestesia profunda en 15-30 minutos, dependiendo del peso y la edad.
- Monitorización de la anestesia
- Monitoree continuamente los signos vitales del animal (frecuencia respiratoria) durante todo el procedimiento. Verifique la frecuencia respiratoria como un signo particularmente útil de cambios tempranos en el estado anestésico, y ajuste el nivel de anestesia si la frecuencia respiratoria cambia.
- El reflejo de retirada de la pata es un signo crítico del estado anestésico. Pruebe este reflejo periódicamente, ya que su ausencia total asegura niveles suficientes de anestesia para la cirugía.
- Inducción de anestesia para un ratón
- Fijación de la cabeza y monitorización de las constantes vitales
- Monitoreo de los signos vitales de los animales
- Revise y registre los signos vitales del animal en una hoja experimental. Si los reflejos del animal (por ejemplo, la retirada de las patas) no se han extinguido por completo, administre media dosis adicional de ketamina suplementaria (rata) o aumente la concentración de isoflurano en incrementos del 0,5% (ratón).
- Fijación de la cabeza de una rata
- Una vez que la rata esté completamente anestesiada (sin reflejos de pata o cola), inserte los incisivos del animal en el orificio de la varilla de la montura de la cabeza.
- Inserte con cuidado las puntas de los brazos de montaje en la cresta de la nariz para fijar la cabeza durante la cirugía, asegurándose de que no entre en contacto con los ojos.
- Ajuste el ángulo de los brazos hasta que el paladar del animal esté firmemente presionado contra la varilla. Asegúrese de que el cráneo permanezca inmóvil bajo presión.
- Asegure ambos brazos del soporte apretando los tornillos con una llave hexagonal.
- Configuración de oxígeno para una rata
- Asegure el tubo de plástico del tanque de oxígeno sobre el hocico y la nariz del animal, sujetándolo con cinta quirúrgica. Evite las arrugas en el tubo que puedan obstruir el flujo de aire. Ajuste el tanque de oxígeno a un caudal de 1 L/min.
NOTA: Los signos vitales de los animales, incluida la frecuencia cardíaca y la frecuencia respiratoria, deben controlarse a intervalos de 15 a 30 minutos durante todo el procedimiento.
- Asegure el tubo de plástico del tanque de oxígeno sobre el hocico y la nariz del animal, sujetándolo con cinta quirúrgica. Evite las arrugas en el tubo que puedan obstruir el flujo de aire. Ajuste el tanque de oxígeno a un caudal de 1 L/min.
- Monitoreo de los signos vitales de los animales
- Incisión en el cuero cabelludo
- Afeitado y preparación
- Afeita el área desde la parte superior del hocico hasta la parte posterior de la cabeza, extendiéndose de un ojo al otro y alrededor de las orejas. Retire la mayor parte del pelaje con unas tijeras o una maquinilla eléctrica y luego aplique crema depilatoria.
- Desinfección
- Desinfecte el área con un hisopo de algodón empapado en Betadine, luego enjuague con un hisopo de algodón empapado en etanol al 70%. Repita este proceso tres veces y termine con una aplicación final de Betadine para asegurarse de que el área esté estéril.
- Inyección de anestésico local
- Inyectar el anestésico local lidocaína (1%, 0,1 mL para ratón/0,4 mL por kg para rata) por vía subcutánea en la línea media del cuero cabelludo del animal. Masajee suavemente el cuero cabelludo para esparcir la lidocaína y espere 5 minutos para que el anestésico haga efecto.
- Incisión
- En el caso de un ratón, levante un punto de la piel con unas pinzas y reseque una pequeña sección de piel (de aproximadamente 1 cm de diámetro) con unas tijeras quirúrgicas.
- En el caso de una rata, haz una incisión precisa en la parte anterior del cuero cabelludo, justo encima de la nariz, en la línea media con el bisturí. Tira suavemente de la piel hacia atrás, creando una incisión recta desde entre los ojos hasta la base del cráneo. Levante con cuidado el cuero cabelludo, corte el tejido conectivo y exponga el cráneo por completo.
- Exponga el sitio de la craneotomía siguiendo los pasos 2.4.4.4-2.4.4.5.
- Con un raspador, limpie el tejido conectivo y el periostio de la parte superior del cráneo. Enjuague la solución salina y use aspiración o una esponja quirúrgica para limpiar el sitio.
- Use clips quirúrgicos en los márgenes de la piel para facilitar la exposición clara de la región del cráneo donde se realizará la craneotomía.
- Afeitado y preparación
- Craneotomía
- Procedimiento general de perforación
- Ajuste la velocidad del taladro quirúrgico a un ajuste bajo de 5000 rpm o 7000 rpm para cirujanos experimentados. Realice todas las perforaciones mientras visualiza a través del microscopio.
- Sostenga el taladro paralelo a la superficie del cráneo y descanse suavemente contra la superficie.
- Con una ligera presión sobre el pedal, comience a perforar en un solo lugar. Realice la perforación en intervalos cortos (5-10 s) con controles frecuentes para detectar cambios en el color del hueso.
NOTA: El hueso comenzará de un blanco opaco y, a medida que el agujero se hace más profundo, se volverá más translúcido, revelando un tinte rosado. - Cuando la perforación se haya acercado al cerebro, reduzca la velocidad y busque signos de humedad que se filtre en el agujero. Cuando el agujero sea de color rosa oscuro y tenga un ligero brillo, deje de perforar. Con una aguja corta de 30 G, perfore suavemente la capa restante de hueso. El líquido transparente debe salir del nuevo orificio.
- Procedimiento de perforación para un ratón
- Para colocar un electrodo de referencia para registros fisiológicos, perfore un orificio de rebaba en la parte frontal del hemisferio ipsilateral al área registrada.
- Defina el contorno de la craneotomía perforando una zanja poco profunda en su perímetro. En el eje medio-lateral, se parte de la cresta ósea lateral como referencia y se traza una ventana de 4 mm.
- En el eje antero-posterior, perfore una ventana de 3 mm comenzando ~ 1 mm anterior de la cresta ósea posterior. El tamaño final de la craneotomía abierta es de aproximadamente una ventana de 4 x 3 mm.
- Procedimiento de perforación para una rata
- Taladre dos orificios: uno en el cuadrante posterior izquierdo, el otro en el cuadrante anterior derecho.
- Inyecte el músculo masetero con una segunda dosis de lidocaína (0,4 mL/kg a 10 mg/mL) y distribúyalo uniformemente en el lugar donde se va a realizar el corte.
- Resecar solo el conjunto mínimo de músculos necesarios para exponer el área de la craneotomía.
- Con una hoja de bisturí #10 nueva, cree un corte transversal dorsal-ventral en el haz de músculo por encima de la mandíbula del animal (lado derecho). Sostenga el borde posterior del corte con pinzas de agarre y despegue el cráneo mientras corta a lo largo de la cresta ósea del pómulo. De esta manera, el músculo se puede separar del hueso con un sangrado mínimo.
- Reseca el músculo anterior de manera similar hasta que se revele una línea de fisura en el cráneo. Esta línea será el límite anterior de la ventana de la craneotomía.
- Limpie el músculo alrededor de la cresta posterior con el bisturí y las pinzas, utilizando una fuente de luz fuerte para evitar cortar en regiones muy vascularizadas.
- Muele la cresta posterior con el taladro hasta que ya no se eleve por encima de la superficie del cráneo.
NOTA: Este paso es esencial para establecer la rejilla μECoG para que entre en contacto directo con la superficie cortical. - Taladra el borde dorsal de la ventana, justo por encima de la cresta donde se unió el músculo resecado. Coloque el borde posterior anterior a la cresta posterior perforada. Coloque el borde anterior posterior a la línea de fisura que se extiende hacia abajo cerca de la cuenca del ojo.
NOTA: Al limpiar el músculo anterior, se debe tener cuidado de evitar el ojo.
- Procedimiento general de perforación
- Perforación de ventana craneotomía
- Perforación de la ventana de craneotomía (Consejos)
- Al perforar, asegúrese de que la broca se mantenga paralela a la superficie del cráneo. Aplique la menor cantidad de fuerza posible, usando el taladro como un cepillo permitiendo que el taladro haga un ligero contacto con el cráneo mientras usa movimientos cortos y repetitivos a lo largo de la línea de craneotomía prevista.
NOTA: En las ratas, el borde posterior de la ventana tiene el hueso más grueso. Si se perfora demasiado atrás, el hueso puede exhibir una calidad escamosa y "crujiente" que complica la medición del progreso de la perforación. Si se coloca incorrectamente, esta área ósea puede revelar una coloración roja venosa que da una falsa impresión de proximidad al cerebro. - Perfore cada lado de la ventana de la craneotomía hasta que el hueso se vea de color rosa pálido con una fisura o grieta blanca delgada a lo largo de su longitud. Aplique una ligera presión; El hueso debe producir un "movimiento" distintivo cuando se perfora por completo. Si la grieta parece inconexa, continúe perforando ligeramente hasta lograr una línea continua.
- Al perforar, asegúrese de que la broca se mantenga paralela a la superficie del cráneo. Aplique la menor cantidad de fuerza posible, usando el taladro como un cepillo permitiendo que el taladro haga un ligero contacto con el cráneo mientras usa movimientos cortos y repetitivos a lo largo de la línea de craneotomía prevista.
- Extirpación del cráneo adelgazado dentro de la ventana de la craneotomía
- Cuando el cráneo se haya adelgazado lo suficiente como para que una presión extremadamente ligera haga que toda la ventana se mueva visiblemente, retire el cráneo adelgazado.
- Enjuague el sitio de la craneotomía con una gota de solución salina y espere al menos 1 minuto. Esto debilita el hueso adelgazado y ayuda a que el hueso se desprenda de la duramadre. Drene el exceso de solución salina con un triángulo de algodón absorbente o una aspiradora.
- Levante con cuidado el cráneo adelgazado con fórceps, evitando dañar el tejido subyacente.
- Use una esponja hemostática para mantener el cerebro húmedo.
- Sujete firmemente la ventana en los lados dorsal y ventral con pinzas dentadas y tire directamente hacia afuera del cráneo. Si hay alguna dificultad para sacar la ventana del sitio, deténgase y reanude la perforación ligera hasta que el hueso esté lo suficientemente debilitado.
- Para las grabaciones de μECoG del ratón, deje la duramadre intacta.
- Perforación de la ventana de craneotomía (Consejos)
- Implante de cemento y poste de cabeza para un ratón
- Inserte y asegure el cable de referencia.
- Inserte el extremo del alambre de plata ~ 1 mm en el orificio de la rebaba, lo suficiente como para entrar en contacto con la superficie del cerebro pero sin causar sangrado.
- Aplique el cemento dental en su lugar mientras aplica la primera capa.
- Preparación de cemento dental
- Use un plato mezclador de cerámica enfriado para preparar la mezcla de cemento dental. Este cemento se espesa rápidamente y requiere la preparación regular de una nueva mezcla. Limpie el plato mezclador antes de preparar una nueva mezcla.
NOTA: El cemento nunca debe estar en contacto directo con el cerebro.
- Use un plato mezclador de cerámica enfriado para preparar la mezcla de cemento dental. Este cemento se espesa rápidamente y requiere la preparación regular de una nueva mezcla. Limpie el plato mezclador antes de preparar una nueva mezcla.
- Aplicación de la primera capa
- Aplique la primera capa de cemento alrededor de la craneotomía y en todo el cráneo con microaplicadores. Esta capa actúa como aislamiento eléctrico entre el cráneo y la barra de cabeza de metal.
- Rodear completamente la craneotomía con cemento, incluida la cobertura lateral, para proporcionar una protección adecuada para la craneotomía abierta y la rejilla μECoG.
- Colocación de la barra de cabecera metálica
- Fije la sección grande de la barra principal a su soporte sin apretarlo completamente.
- Coloque la barra de cabeza como desee, colocando la sección delgada a lo largo de la línea media del cráneo en contacto con la superficie de cemento.
- Fijación del implante
- Cubra la barra de cabecera con cemento dental y conéctela a la superficie de cemento.
- Extracción del soporte
- Espere unos minutos para que el cemento dental se fortalezca.
- Una vez que la barra de dirección esté completamente asegurada, retírela quitando primero el tornillo del soporte. Luego, retraiga el soporte hacia atrás, asegurándose de que no se aplique fuerza a la barra principal.
- Inserte y asegure el cable de referencia.
- Durotomía para cirugía de ratas
NOTA: Este es un paso quirúrgico desafiante.- Levantamiento de la duramadre
- Usando pinzas No. 5, sostenidas lo más paralelas posible a la superficie del cerebro, levante una pequeña porción de la duramadre del cerebro.
- Utilice una aguja nueva de 30 g (lo más corta posible) para rasgar con cuidado la duramadre levantada.
NOTA: La duramadre es una capa delgada y transparente de tejido que se encuentra directamente sobre el cerebro. Se retira para los registros de μECoG en ratas. Es fundamental realizar la durotomía sin alterar la vasculatura de la superficie del cerebro. Los métodos recomendados para realizar la duratomía incluyen el uso de fórceps y una aguja de jeringa para perforar la duramadre antes de tirar de ella hacia atrás, o el uso de una herramienta de duratome anclada cerca del cráneo para retraer la duramadre con cuidado.
- Resección de la duramadre
- Continúe agarrando la duramadre con las pinzas y levantándola lejos del cerebro. Crea un desgarro diagonal con la aguja mientras levantas.
- Use las pinzas para pelar cuidadosamente la duramadre hacia los lados de la ventana de la craneotomía, asegurándose de que la superficie del cerebro permanezca intacta.
- Levantamiento de la duramadre
- Transferencia del ratón a la configuración para el registro electrofisiológico
- Retire al animal de la instalación de la cirugía levantando suavemente el hocico y los incisivos de la barra de incisivos y luego tirando del animal hacia atrás. Inyectar Clorprotixeno (1 mg/kg, intraperitoneal [IP]), un sedante que permite mantener la anestesia continua utilizando una concentración más baja de Isoflurano.
- Coloque el ratón en la configuración de grabación electrofisiológica.
- Asegúrese de que la almohadilla térmica esté en su lugar y funcione correctamente.
- Fije la cabeza del animal usando la barra de cabeza en el soporte en la configuración electrofisiológica.
- Acerque la mascarilla de isoflurano para cubrir completamente el hocico del animal.
- Ajuste de la anestesia
- Reducir gradualmente los niveles de anestesia a 0,7-1% de isoflurano (en incrementos de 0,5% como máximo cada 5 min).
- Controlar la frecuencia respiratoria y los movimientos del animal.
NOTA: La frecuencia respiratoria debe aumentar ligeramente en comparación con el estado quirúrgico, pero el animal no debe moverse. - Si el animal está en movimiento, aumente inmediatamente la concentración de isoflurano al 2% antes de devolverla lentamente a un nivel más bajo en incrementos del 0,5%.
- Inserción de bigotes para la estimulación sensorial
- Conecte las vibrisas del ratón al dispositivo de estimulación de bigotes. En este protocolo, inserte nueve vibrisas en puntas de pipeta cortas de 10 μL, que están conectadas a actuadores piezoeléctricos que proporcionan desviaciones rápidas de las vibrisas.
3. Grabación
- Instalación de la red
- Pasos preliminares
- Encienda el sistema de grabación y el amplificador.
- Revisa los signos vitales del animal.
- Procedimiento
- Para colocar el animal y las herramientas, siga los pasos 3.1.2.2-3.1.2.4.
- Coloque al animal en la configuración de grabación y asegúrese de que la craneotomía permanezca húmeda aplicando regularmente una solución salina.
- En el caso de una rata, coloque el micromanipulador en la barandilla del equipo, ubicada muy detrás del sitio de la craneotomía, para evitar interferencias.
- En el caso de un ratón, coloque el micromanipulador lateralmente al sitio de la craneotomía junto al animal.
- Para adjuntar y colocar la cuadrícula en un ratón, siga los pasos 3.1.2.6-3.1.2.12.
- Fije la rejilla μECoG a la etapa principal mediante los conectores ZIF-clip (conector de etapa principal). Sostenga la placa electrónica del escenario en su lugar a través de una barra mecánica fijada a un micromanipulador.
- Baje la rejilla μECoG horizontalmente para alinearla plana sobre la craneotomía a lo largo del eje anteroposterior.
NOTA: A lo largo del eje lateral-medial, el borde de la rejilla debe estar cerca del borde medial de la craneotomía. - Una vez que la rejilla esté colocada cerca del cerebro pero no en contacto con él, conecte el cable de referencia de la rejilla al pin de alambre de plata y oro implantado. Si es necesario, conecte el cable de tierra al animal (por ejemplo, a un músculo descubierto) para reducir el ruido eléctrico.
- Además, baje la rejilla para entrar en contacto con el cerebro.
- Mueva la rejilla lateralmente para "deslizarse" sobre la superficie dura húmeda. Continúe ajustando hasta que la rejilla esté centrada a lo largo del eje mediolateral.
- Use aspiración o una esponja quirúrgica alrededor de los bordes de la craneotomía para eliminar cualquier exceso de solución salina.
- Una vez que la preparación esté un poco más seca, asegúrese de que la rejilla se adhiera más firmemente a la duramadre y no se deslice sobre su superficie. Cuando esté más seco, aplique un movimiento lateral a medial a la rejilla flexible, asegurando el contacto con los electrodos más laterales. El cable flexible de la rejilla se doblará naturalmente para adaptarse al contorno del cerebro.
- Para colocar la cuadrícula en una rata, siga los pasos 3.1.2.14-3.1.2.18.
- Asegure el vástago de la horquilla de sujeción en el micromanipulador, asegurándose de que la placa de conexión de la rejilla se desplace sobre el lado posterior de la ventana de craneotomía cuando se baje.
- Ajuste la posición del micromanipulador en la barandilla para que la rejilla quede aproximadamente por encima del sitio de la craneotomía. Baje la rejilla hasta que quede cerca de la superficie del cerebro. Humedece la superficie del cerebro con una pequeña gota de solución salina.
- Realice estos pasos con el microscopio. Usando los diales del micromanipulador, ajuste la posición de la rejilla hasta que quede plana contra la superficie del cerebro en el centro de la craneotomía.
- Absorbe la humedad con cuidado con un triángulo de algodón absorbente sin tocar la rejilla. Asegúrese de que cada fila de la rejilla esté en contacto con la superficie del cerebro.
NOTA: La eliminación de la humedad evita la propagación pasiva de la señal eléctrica a través del fluido entre la superficie cortical y la rejilla, que difunde espacialmente la señal detectada en el electrodo. - Con las pinzas número 2 o número 5, inserte el cable de conexión a tierra de la rejilla en el mismo orificio de rebaba o inserte el cable de referencia en un orificio de rebaba y el cable de tierra en el tejido muscular cercano.
NOTA: Los cables deben insertarse solo ~ 1 mm, lo suficiente para entrar en contacto con el cerebro pero no para causar sangrado o trauma en el cerebro.
- Pasos preliminares
- Comprobación de la posición de la rejilla
- Monitorización de la actividad electrofisiológica
- Observar la actividad electrofisiológica mediante el software de registro. Bajo anestesia ligera, las señales cerebrales son variables y pueden exhibir una variedad de patrones.
- La conexión adecuada de los cables de red, de referencia y de tierra debe producir una alta relación señal-ruido, con amplitudes de señal en el rango de mV. Monitoree el ruido en el rango de alta frecuencia utilizando el filtrado de paso de banda con Trodes (por ejemplo, 100-6000 Hz) y asegúrese de que no exceda unas pocas decenas de microvoltios (μV).
- Evaluar la capacidad de respuesta sensorial utilizando ruido (por ejemplo, aplausos o chasquidos de dedos) para inducir potenciales eléctricos de superficie cortical (CSEP) visibles relacionados con eventos.
NOTA: La estimulación de un solo bigote debe evocar un CSEP claro y nítido relacionado con el evento en solo unos pocos canales (mouse). - Verificación de la posición de la red
- En el caso de una rata, confirme que la rejilla está colocada correctamente sobre la corteza auditiva. Por lo general, el primer bloque registrado debe ser un estímulo de ruido blanco de 60 segundos para verificar que la red registra una respuesta adecuada del cerebro. Realice grabaciones de diagnóstico de tono y ruido blanco con la rejilla solo antes de insertar el polytrode para ayudar a determinar si la rejilla se colocó correctamente y si hay una respuesta de señal.
- Para un mouse, para verificar la posición de la cuadrícula, realice una sesión de mapeo rápida con 20-30 deflexiones de bigotes espaciadas por 350 ms. Registre la actividad en la banda de potencial de campo local (LFP) mediante Trodes y analícela sin conexión con un código de MATLAB personalizado para visualizar la extensión espacial de la actividad evocada por los bigotes.
- Reposicionamiento
- Si la rejilla requiere ajuste, humedezca la superficie cortical con gotas de solución salina sobre la rejilla.
- Deje la solución salina durante 30 s a 1 min antes de intentar levantar la rejilla.
- Levante la rejilla con cuidado y lentamente.
- Vuelva a colocarlo siguiendo los pasos descritos en el paso 3.1.
- Monitorización de la actividad electrofisiológica
- Politros laminares para una rata
- Configuración de Polytrode
- En primer lugar, conecte el adaptador de la etapa principal a la parte posterior del polytrode. Sujete el conector al tercer conjunto de canales en la placa del adaptador. Asegúrese de que la marca negra en el clip mire hacia el lado derecho del extremo comercial del polytrode.
- Inserción de politrodo
- Inserte el politrodo en el cerebro hasta que los últimos electrodos (los más altos) sean visibles por encima de la superficie cortical. Un descenso lento (hasta 1 μm/s) mejora la calidad de la señal. Espere 15 minutos, permitiendo que el cerebro se adapte a la presencia del polítrodo.
- Después de 15 minutos, compruebe si los últimos electrodos han entrado en la superficie cortical. De lo contrario, baje el polytrode un poco más y espere 10 minutos más antes de continuar.
- Configuración de Polytrode
- Posicionamiento de la fuente de luz optogenética en un ratón
- Utilice un sistema de tornillo de ajuste fino en tres dimensiones, montado en un brazo articulado, o un micromanipulador para montar el soporte de fibra óptica.
- Para guiar la fuente de luz y ayudar a posicionar la fibra, encienda la luz optogenética a baja intensidad. Utilice el brazo articulado para posicionar la luz optogenética de forma aproximada hacia el área objetivo.
- Enfoque y ajuste la posición de la fibra con un micromanipulador o tornillos de ajuste fino.
- Registro de las señales
- Preparación
- Desconecte todas las luces, cables de extensión y protectores contra sobretensiones innecesarios en el equipo quirúrgico para reducir la interferencia eléctrica. Apague las luces del techo de la plataforma.
- Cierre la puerta del espacio de grabación aislado y la puerta de la sala de cirugía antes de comenzar el experimento.
- Inicio de la adquisición
- En el caso de una rata, inicie Synapse en la plataforma/computadora de grabación y confirme que la adquisición funciona mediante una vista previa y la verificación de señales. Provoca transitorios de voltaje grandes y agudos en la señal μECoG mediante la presentación de estímulos cerca del animal, es decir, aplausos.
- Para un mouse, inicie la sesión de grabación en Trodes.
- Hidratación
- Inyecte a la rata o al ratón por vía subcutánea 1 ml o 0,1 ml de solución salina cada 1-2 h durante el registro para prevenir la deshidratación. En el caso de una rata, espere de 5 a 10 minutos después de administrar solución salina antes de ejecutar un nuevo bloque de grabación.
- Conjuntos de estímulos
- En el caso de una rata, una vez confirmado el lugar de registro, se procede a registrar los conjuntos de estímulos necesarios. Un conjunto de ejemplos podría incluir
Ruido blanco (60 s)
Diagnóstico de tono (5 min)
Tono puro (23 min)
Ondulación móvil dinámica
Tono 150 (15 min)
TIMIT (38 min) - En el caso de una rata, vuelva a presentar el ruido blanco y los diagnósticos de tono cada vez que se reposicione la rejilla.
- Estímulos táctiles para un ratón: Proporciona estímulos táctiles en una estructura de prueba, con cada prueba conteniendo una serie de desviaciones aleatorias de bigotes cada 350 ms. En el ejemplo proporcionado, cada ensayo incluye 14 deflexiones presentadas a lo largo de 4500 ms.
- Estímulos optogenéticos para un ratón: En algunos ensayos, aplique un pulso cuadrado de luz optogenética durante toda la duración del ensayo (5 s). Determine el nivel de luz requerido en función de la opsina utilizada y de la profundidad del tejido que se alcanzará utilizando estimaciones de la penetrancia de la luz (https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php)
- En el caso de una rata, una vez confirmado el lugar de registro, se procede a registrar los conjuntos de estímulos necesarios. Un conjunto de ejemplos podría incluir
- Preparación
- Limpieza
- Elevación y limpieza de la rejilla
- Una vez finalizada la grabación, cierre el software de grabación y vuelva a enchufar las fuentes de luz del equipo.
- Si el cerebro está seco, aplique una pequeña gota de solución salina sobre la superficie del cerebro con una jeringa. Deje la solución salina durante 30 s a 1 min antes de intentar levantar la rejilla.
- Trabajando bajo el microscopio, levante suavemente la rejilla de la superficie del cerebro usando micromanipuladores.
- Si se necesita fuerza adicional mientras se levanta la rejilla, use pinzas con punta de carbono (cerradas) para levantar suavemente la rejilla del cerebro. Asegúrese de que el movimiento del micromanipulador sea ligeramente anterior para despegar suavemente la rejilla de la superficie del cerebro.
- Una vez que la rejilla se haya retirado por completo, sepárela de la horquilla de agarre y límpiela siguiendo los pasos 3.6.1.6-3.6.1.7.
- Remoje la rejilla (excluyendo la placa de conexión) en un detergente enzimático diluido (50% Enzol, 50% agua destilada) durante al menos 1 h. Luego, transfiéralo a un segundo baño de agua destilada pura y deje que se seque al aire en un lugar seguro y limpio.
- Si áreas de la rejilla han depositado sangre o tejido, use un triángulo de algodón empapado en una solución enzimática para limpiarlo suavemente.
- Una vez seco, regrese la rejilla a su caja.
- Eutanasia del animal
- En el caso de un ratón, retire al animal de la fijación de la cabeza y colóquelo en la cámara de eutanasia. Añadir una gasa con 5 mL de isoflurano y esperar 60 s después del cese de la respiración. Verifica la falta de reflejo de retirada y decapita con tijeras afiladas.
- En el caso de una rata, inyecte 0,2 ml de pentobarbital IP. Espere 60 segundos después del cese de la respiración, acueste al animal boca arriba y use una cuchilla # 11 para realizar una toracotomía doble.
- Limpieza del equipo
- Lleve todas las herramientas quirúrgicas al lavabo del laboratorio y colóquelas sobre una toalla quirúrgica. Rocíe las herramientas con una solución de lejía al 10% y lávelas bien en el fregadero. En el caso de las herramientas más sucias, déjelas remojar en una solución de lejía antes de lavarlas.
- Alternativamente, use un detergente en polvo (por ejemplo, Contrex AP) con agua frotando los instrumentos con un cepillo en el fregadero.
- Una vez que las herramientas estén limpias y enjuagadas, límpielas con toallitas con alcohol y devuélvalas a su espacio de almacenamiento.
- Higienización del espacio de trabajo
- Deseche todas las agujas y cuchillas usadas en el recipiente para objetos punzocortantes.
- Deseche los hisopos de algodón, los triángulos y las toallitas con alcohol contaminados en la bolsa de riesgo biológico.
- Limpie todas las superficies de trabajo de la sala de perforación con alcohol y limpie todos los instrumentos antes de cerrar el espacio de trabajo.
- Elevación y limpieza de la rejilla
Resultados
Hemos descrito los protocolos de registro de señales electrocorticográficas combinados con métodos optogenéticos y registros laminares. Aquí, se presentan señales típicas obtenidas de la corteza somatosensorial del ratón (Figura 1, Figura 2 y Figura 3) y dentro de la corteza auditiva de ratas en respuesta a la estimulación sensorial (Figura 4, Figura 5 y Figura 6).
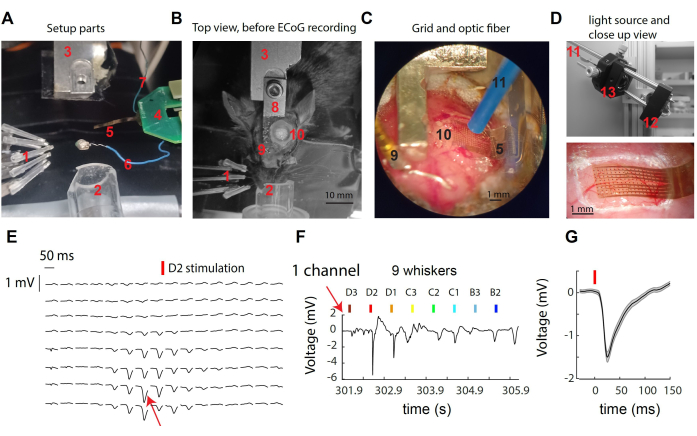
Figura 1: Registro de señales μECoG a través de la corteza somatosensorial del bigote del ratón. (A) Componentes de la configuración. Ver texto. (B) Vista superior de la configuración quirúrgica antes del registro de μECoG, que muestra la ubicación del reposacabezas y el sitio de la craneotomía. (C) Vista detallada de la cuadrícula μECoG y la fibra óptica colocada en la corteza expuesta. (D) Arriba: La fuente de luz se encuentra fuera de la caja de grabación. La luz de un LED de 473 nm se recoge en la fibra óptica a través de un tándem de lentes. Abajo: primer plano de la rejilla cortical sobre la corteza del ratón en una grabación de ejemplo. (E) Trazas representativas de μECoG de todos los canales de 16x8 que muestran respuestas promediadas de prueba a la estimulación de Bigotes D2. (F) Traza de voltaje bruto desde el canal único indicado en (E) a través de deflexiones individuales de bigotes múltiples. El canal mostró la respuesta más fuerte durante la estimulación del bigote D2. (G) La respuesta evocada promedio a través de los ensayos en el canal único (E,F), que exhibió una deflexión de voltaje brusca después de la estimulación de bigotes. Haga clic aquí para ver una versión más grande de esta figura.
La Figura 1A-D proporciona imágenes de varios componentes del sistema utilizados para el registro y la manipulación optogenética en la corteza S1 del ratón. Los elementos etiquetados incluyen: 1- nueve estimuladores de bigotes independientes en una matriz de 3 x 3, 2- cono de nariz para anestesia con isoflurano, 3- soporte/contraparte de poste de cabeza, 4- PCB de respaldo μECoG, conectado a la PCB de la etapa principal con un conector ZIF doble; 5- Rejilla de electrodos μECoG en la punta de un cable flexible de 8 mm; 6- Alambre de referencia; 7- cable de tierra; 8- Implante de poste de cabeza; 9- alfiler de oro de referencia (aislado del poste de la cabeza con cemento dental); 10- craneotomía en el hemisferio izquierdo, sobre la corteza del barril de bigotes S1; Fibra optogenética de 11 mm de diámetro (sostenida por un micromanipulador, no mostrada); 12- un LED en forma de estrella accionado por un controlador LED (no se muestra); 13- Recogida de luz a través de un tándem de lentes asféricas. Al estimular un solo bigote, se observa una rápida deflexión del potencial superficial en un pequeño número de electrodos (Figura 1E). Este grupo de electrodos representa la señal local que alcanza su punto máximo en la columna cortical del bigote30 estimulado. Al observar un solo electrodo, observamos la respuesta más fuerte a la estimulación de su bigote preferido y la respuesta más débil o nula a la estimulación de bigotes más distantes (Figura 1F). En este ejemplo, el inicio de la deflexión ocurre alrededor de 10 ms después de la vibración del bigote, con una amplitud promedio de 1 mV (Figura 1G).
En la Figura 2 se presentan ejemplos de grabaciones durante la inhibición optogenética. La luz puede llegar al tejido cortical a través del sustrato transparente de la rejilla (Figura 2A). Sin embargo, cuando se utiliza una fibra de gran diámetro o cualquier fuente de luz espacialmente amplia, los fotones también golpean los electrodos, produciendo un artefacto optoeléctrico (Figura 2B). En este protocolo de inhibición, utilizamos un pulso de luz cuadrado de 5 s de largo. Los artefactos optoeléctricos resultantes solo están presentes al inicio y al desplazamiento de la luz. En un animal sin opsina, la estimulación de los bigotes presentada durante el encendido de la luz no evoca una respuesta diferente de la estimulación de los bigotes presentada en los ensayos con la luz apagada (Figura 2C). Por el contrario, la estimulación lumínica de la opsina inhibidora en una subpoblación de neuronas excitadoras conduce a una disminución de la amplitud de la respuesta evocada sensorialmente (Figura 2D)
La figura 2C, D presenta ejemplos de supresión optogenética en el dominio tiempo-frecuencia. Para analizar los datos de μECoG, primero aplicamos una referencia de promedio común (CAR) para eliminar las señales que no están diferenciadas a través de los electrodos (por ejemplo, la respiración) seguida de una transformada de ondículas Morse, que revela las bandas de frecuencia activas a lo largo del tiempo. La actividad neuronal en el dominio de la frecuencia suele exhibir una ley de potencia aproximada de 1/f 2,3. Para revelar la señal evocada sensorialmente de manera más uniforme en todo el dominio de la frecuencia, aplicamos la puntuación Z por separado para cada banda de frecuencia. La puntuación Z se basa en las estadísticas de la señal durante las épocas de referencia. Aquí, usamos una ventana de tiempo que precede al estímulo, de -3000 ms a -1000 ms antes del inicio del ensayo. Este proceso produce la puntuación Z evocada por el estímulo para cada banda de frecuencia (Figura 2C, D).
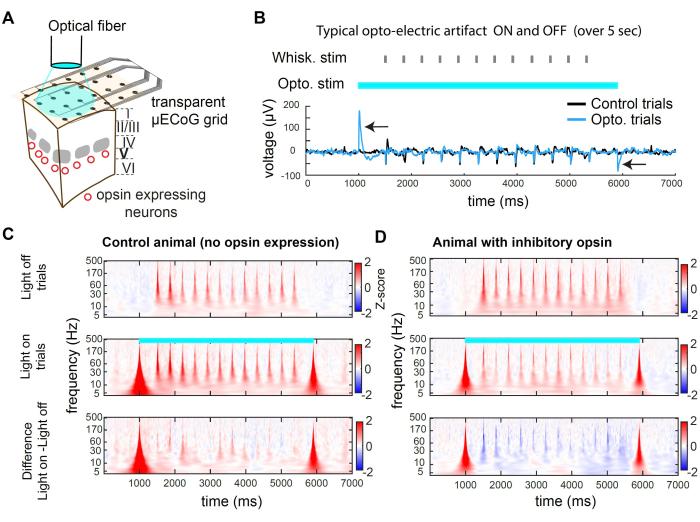
Figura 2: Supresión optogenética en wS1 durante el registro de μECoG en ratones. (A) Esquema de un experimento optogenético representativo. Una fibra óptica apunta directamente al cerebro, lo que permite la inhibición transitoria de la población neuronal que expresa una opsina inhibitoria. (B) Traza de voltaje registrada en el canal en el centro de la estimulación optogenética, promediada a través de los ensayos. La flecha negra indica artefactos optoeléctricos al inicio y desplazamiento de la luz de 473 nm. Observe la respuesta a la deflexión de los bigotes (identidad aleatoria de los bigotes) en medio de la prueba. El artefacto es transitorio y no afecta al registro de la actividad sensorial evocada después de un retraso (en este caso, 500 ms). (C) Espectrograma promedio de un canal de ejemplo en ensayos de luz apagada, ensayos de luz encendida, y la diferencia entre los dos, en un animal donde no se expresó opsina. Obsérvese que el efecto optoeléctrico induce un artefacto transitorio de banda ancha, y la respuesta evocada por los bigotes no se ve afectada por la luz. (D) Ejemplo de espectrograma promediado de ensayo a través de ensayos de luz apagada, ensayos de luz encendida y la diferencia entre los dos en un ratón Rbp4-Cre32 en el que st-GtACR2.0 se expresó en neuronas excitadoras de la capa 5. Obsérvese la supresión de la respuesta evocada por los bigotes en el espectrograma. Haga clic aquí para ver una versión más grande de esta figura.
La Figura 3 presenta variaciones fáciles de implementar en el sistema de suministro de luz. Usando una fibra óptica más pequeña, o una lente simple, es posible apuntar a un área específica de la corteza15. La luz que sale de la fibra diverge rápidamente y llega al tejido cortical más allá del área objetivo. Al incorporar una lente asférica (f = 16 mm) en la salida de fibra óptica, es posible enfocar la luz a un área de superficie más pequeña (Figura 3A, C), hasta aproximadamente el diámetro de una sola columna cortical (Figura 3C). La luz también es menos divergente dentro de la corteza. Idealmente, utilizando un láser o una fuente de luz potente con un conjunto de lentes en tándem, es posible apuntar a una sola columna cortical con un haz de luz colimado. Sin embargo, es importante tener en cuenta que la luz se dispersará dentro del tejido, lo que puede iluminar parcialmente las columnas vecinas. El artefacto de luz medido en los datos de μECoG revelará dónde se ha entregado la luz sobre la superficie cortical; vea la comparación de la Figura 3B con la Figura 3D. El artefacto de luz se mide como la potencia máxima en un rango de alta frecuencia (65-500 Hz) 5 ms después del inicio de la luz.

Figura 3: Entrega de luz a los puntos focales de la corteza. (A) La luz de la fibra óptica de 1 mm de diámetro se enfoca en la superficie del cerebro. Este simple ajuste permite una orientación más precisa de la luz en la superficie del cerebro y dentro del tejido. (B) La extensión espacial de la luz entregada al cerebro se mide a partir del artefacto optoeléctrico. (C,D) La configuración es como en los paneles A, B con una fibra óptica de 200 μm, lo que le permite apuntar directamente a un área de 250 μm de diámetro, aproximadamente del tamaño de una columna cortical. Haga clic aquí para ver una versión más grande de esta figura.
Grabaciones de rata μECoG y politrodo laminar
La Figura 4A-D proporciona imágenes de varios componentes del sistema utilizado para los registros de la corteza auditiva primaria de ratas. Específicamente, los elementos etiquetados incluyen: (1) micromanipulador μECoG, (2) plataforma estereotáxica para roedores, (3) cable μECoG con conectores ZIF-clip, (4) micromanipulador de politrodo laminar, (5) aparato de estabilización de cabeza y cono de nariz de rata, (6) altavoz electrostático para la presentación de estímulos, (7) cable de politrodo laminar con adaptador ZIF-clip, (8) clip μECoGZIF unido por una horquilla de dos puntas, (9) dispositivo de politrodo de 32 canales, (10) altavoz electrostático, (11) pinzas de cocodrilo para mantener abierto el sitio quirúrgico, (12) cables de conexión a tierra, uno insertado en la corteza a través de los orificios de rebaba en el cuadrante posterior izquierdo o el cuadrante anterior derecho y otro conectado a tierra al tejido, (13) vista de cerca de la rejilla μECoG, (14) vista de cerca del polítrodo insertado. La Figura 4E muestra el espectrograma neuronal promedio derivado de los potenciales eléctricos registrados de un solo electrodo μECoG en respuesta a pips de tono de 50 ms de la misma frecuencia y atenuación (N = 20 ensayos). En todas las frecuencias, la respuesta evocada exhibe un pico agudo entre 25 ms y 30 ms (indicado por líneas continuas rojas) después del inicio del estímulo (línea punteada gris izquierda). La respuesta aparente que precede al inicio del estímulo (ostensiblemente acausal) se debe al gran ancho de banda a frecuencias más bajas de la transformada Q constante, que suaviza (acausal, pero sin desplazamiento de fase) en lugar de filtrar (causal, pero induce un desplazamiento de fase) la señal. Por lo tanto, el tiempo de la respuesta máxima sigue siendo preciso. En el momento de la respuesta evocada máxima, observamos que el potencial eléctrico de superficie cortical (CSEP) con puntuación z era multimodal en todas las frecuencias. Específicamente, exhibió tres picos primarios no armónicos: el primero y el más grande en el rango de 40-180 Hz gamma/alta gamma (γ/Hγ), el segundo en el rango de 200-450 Hz ultra alta gamma (uHγ) y un pico final por encima de 500 Hz asociado con la actividad de múltiples unidades (MUA) (Figura 4F)11. Esta estructura multimodal evocada por estímulos es robusta en todos los electrodos sintonizados. Aquí, nos centramos en el Hγ debido a su prevalencia en los registros de electrocorticografía humana (ECoG)31. En la Figura 4G, mostramos una matriz μECoG que se colocó subduralmente junto a un politrodo laminar de silicio para medir simultáneamente los potenciales eléctricos de la superficie cortical (CSEP) y la actividad de picos a través de las láminas corticales. La matriz μECoG fabricada a medida constó de 8×16 electrodos con un paso de 20 μm y un diámetro de contacto de 4 μm, y utilizamos un politrodo laminar de 32 canales configurado como 2 × 16 canales con un paso de 4 μm y un diámetro de contacto de 1 μm. La matriz μECoG era lo suficientemente grande como para cubrir toda la corteza auditiva primaria de la rata (A1), y sus pequeños electrodos de 4 μm de diámetro permitieron la medición de CSEPs locales adecuados para derivar el ajuste auditivo. La resolución espacial de la señal μECoG de alta gamma (Hγ) es de ~20 μm, comparable al radio de una columna cortical de rata. Por lo tanto, μECoG proporciona una "vista en columna" de la actividad cortical. Las perforaciones en la rejilla μECoG permitieron que el politrodo laminar pasara entre los contactos de la superficie, lo que permitió el registro directo de la actividad neuronal a través de las láminas corticales (Figura 4H). En la Figura 4I se muestran ejemplos de trazas de voltaje registradas por μECoG y electrodos de politrodo laminar.

Figura 4: Registro de señales de μECoG y politrodo laminar sobre la corteza auditiva primaria de rata (A1). (A) Componentes de la configuración de μECoG y politrodo laminar. Ver texto. (B) Vista superior de la configuración quirúrgica antes del registro de μECoG y politrodo laminar, que muestra la ubicación del reposacabezas y el sitio de la craneotomía. (C) Vista detallada de la rejilla μECoG y el politrodo laminar en la corteza auditiva expuesta. (D) Una vista de cerca de la ubicación de la rejilla μECoG en la corteza, incluido el tamaño de los electrodos individuales (40 μm) y entre electrodos (200 μm). (E) Descomposición media de ondículas con puntuación z de una respuesta de un solo canal a un solo par de atenuación de frecuencia. Las líneas rojas verticales indican el período de respuesta de frecuencia máxima que se muestra en F.(F) Rojo: respuesta media de frecuencia máxima en 20 presentaciones de un solo par de atenuación de frecuencia. Gris: error estándar. El eje de frecuencia está en una escala logarítmica. Las bandas de frecuencia neuronal canónicas se indican en la parte superior. (G) Fotomicrografía de una rejilla de 8 16 μECoG en la superficie de la corteza auditiva primaria de rata (A1). Se ha insertado un polytrodo laminar de 32 canales en la ventana central de μECoG. (H) Esquema de registro 3D multiescala de la actividad cortical. (I) Arriba: Espectrograma de 50 ms de pips de tono puro. Centro: En rojo, el potencial eléctrico medio de la superficie cortical de 4 electrodos μECoG (gris). Abajo: Las trazas de voltaje de politrodo laminar de 32 canales están ordenadas por profundidad cortical Haga clic aquí para ver una versión más grande de esta figura.
La Figura 5 muestra el registro de señales μECoG simultáneamente con una actividad de aumento utilizando un politrodo laminar de silicio (Camb64). La señal μECoG, registrada desde un electrodo de superficie, se muestra como una traza de voltaje bruto (Figura 5A) y su transformada de ondículas, destacando la descomposición de la frecuencia a lo largo del tiempo (Figura 5B). La actividad de varias unidades se registró utilizando el politrodo, como se ilustra mediante una traza representativa de voltaje bruto de un solo canal (Figura 5C), donde los potenciales de acción individuales (picos) se detectaron utilizando un método de umbral simple (voltaje que cruza un umbral de -120 μV). Las formas de onda de los picos extraídos de este canal están bien definidas para la mayoría de los picos, aunque podrían originarse en múltiples fuentes de neuronas (Figura 5D, recuadro). A través de múltiples canales en la misma penetración, las formas de onda de pico promedio confirman aún más la consistencia de los registros de actividad de pico bien definidos (Figura 5E). Por lo tanto, estos métodos de registro podrían admitir el registro de una sola unidad con análisis de clasificación de picos y análisis de métricas de calidad como el intervalo entre picos o las tasas de disparo (Figura 5F). En resumen, la calidad de las grabaciones de la sonda laminar es buena, con una morfología clara de la forma de onda en canales individuales. Estos resultados ilustran que este método permite la adquisición simultánea de μECoG y la actividad de spiking.

Figura 5: Registros simultáneos de μECoG y actividad de picos columnares. (A) Ejemplo de traza de voltaje bruto de un solo canal μECoG. (B) Transformada wavelet del mismo canal μECoG, que muestra la descomposición de la frecuencia a lo largo del tiempo. (C) Ejemplo de traza de voltaje bruto de un solo canal de politrodo (sonda de silicio aguda de 64 canales camb64), que muestra potenciales de acción (picos) detectados utilizando un umbral de voltaje simple. (D) Formas de onda de pico extraídas del canal de politrodo en (C) alineadas y codificadas por colores según la distribución de la amplitud de voltaje. No se muestran 7 de las 142 formas de onda de pico, ya que se consideraron valores atípicos en función de su distancia al grupo principal en ancho y amplitud de pico (ver recuadro). (E) Formas de onda de pico multiunidad promedio extraídas de 9 canales en la misma penetración. (F) Histogramas de intervalo entre picos (ISI) para diferentes canales de politrodo (por ejemplo, canales 21, 27, 63 y 61), con las correspondientes velocidades de disparo (FR) indicadas en Hz. Las violaciones de ISI (< 5 ms) representaron menos del 5% de los picos en todas las unidades. Haga clic aquí para ver una versión más grande de esta figura.
Con la capacidad de realizar grabaciones simultáneas utilizando la matriz μECoG diseñada a medida y el politrodo laminar, investigamos cómo se comparan las señales μECoG con las grabaciones de unidades neuronales a través de la profundidad cortical en términos de sintonía auditiva. La Figura 6A presenta gráficos de amplitud de respuesta en frecuencia (FRA), que representan la respuesta de alta gamma (Hγ) en función de la frecuencia y amplitud del estímulo auditivo. El panel superior muestra los FRA de un subconjunto de 2 × 16 de electrodos μECoG colocados en la corteza auditiva, mientras que el panel inferior muestra los FRA de un subconjunto de 1×16 de electrodos de politrodo laminar insertados a través de las perforaciones de la matriz de μECoG (indicados por flechas grises). Sorprendentemente, los FRA obtenidos de los electrodos μECoG se parecen mucho a los de los registros de politrodo laminar, lo que sugiere que las señales de μECoG están sintonizadas de manera similar con la actividad de la unidad neuronal a través de las capas corticales.
Aprovechando la alta resolución espacial de la matriz μECoG, generamos un mapa tonotópico de alta resolución de múltiples campos corticales auditivos basado en la actividad Hγ11. En la Figura 6B, la mejor frecuencia de cada electrodo está codificada por colores, revelando la organización tonotópica a través de la superficie cortical. La matriz de 8 × 16 μECoG cubrió varios campos corticales auditivos, incluida la corteza auditiva primaria (A1), el campo auditivo posterior (PAF) y el campo auditivo ventral (VAF), con límites aproximados demarcados por líneas negras. Este mapeo detallado subraya la capacidad de la matriz μECoG para proporcionar una "vista en columna" de la actividad cortical, capturando la organización funcional con una resolución espacial de menos de 20 μm, comparable a las dimensiones de una columna cortical de rata. Estos hallazgos demuestran que las grabaciones de μECoG no solo reflejan las propiedades de ajuste observadas en las grabaciones de unidades neuronales a través de la profundidad cortical, sino que también permiten el mapeo de alta resolución de la organización cortical funcional.
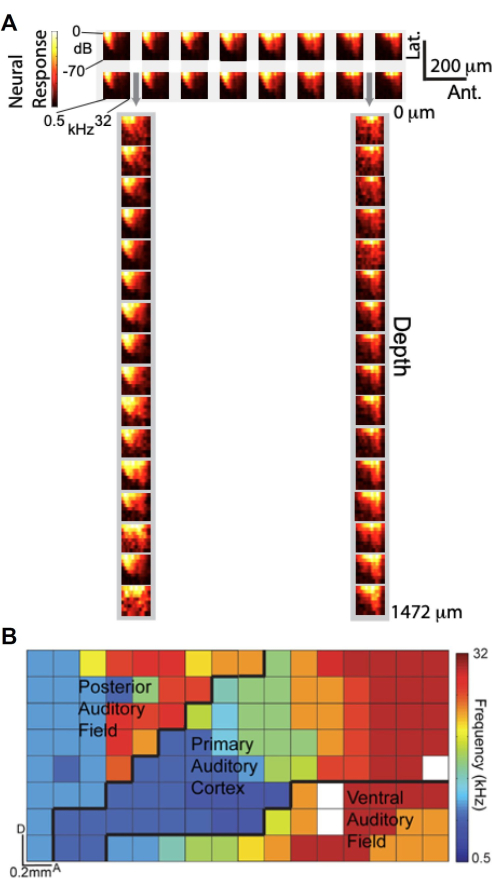
Figura 6. Las señales μECoG se sintonizan de manera similar con las grabaciones de picos de las unidades neuronales a través de la profundidad y revelan la organización tonotópica de la corteza auditiva. (A) Gráficos de amplitud de respuesta en frecuencia (FRA), que muestran la respuesta gamma alta (barra de color) en función de la frecuencia (eje x) y la amplitud (eje y) del estímulo auditivo. (arriba) FRA de 2 16 subconjuntos de electrodos μECoG en la corteza auditiva; (abajo) FRA de 1 16 subconjunto de electrodos de politrodo laminar insertados a través de perforaciones en la matriz μECoG, indicados por flechas grises. (B) Organización tonotópica de alta resolución de múltiples campos corticales auditivos derivados de la actividad gamma alta. Cada píxel está codificado por colores de acuerdo con la mejor frecuencia de ese electrodo. La matriz de 8x16 μECoG que se muestra aquí cubre múltiples campos corticales auditivos (A1, PAF y VAF) y los límites aproximados están demarcados (líneas negras). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los protocolos aquí descritos permiten integrar matrices de microelectrocorticografía de alta densidad (μECoG) con sondas laminares y técnicas optogenéticas. La facilidad de uso de este protocolo en modelos de roedores lo convierte en una poderosa herramienta para la investigación de la dinámica cortical, y el número de sujetos se puede aumentar fácilmente. La cuadrícula μECoG de alta densidad permite un mapeo eficiente y espacialmente preciso de la topografía cortical en múltiples áreas en ratones y ratas, aprovechando el papel crítico de las representaciones topográficas en la organización del cerebro33. La adición del registro laminar permite el examen de la dinámica cortical a través de múltiples escalas espaciales y temporales. La inclusión de la optogenética permite la manipulación causal para determinar las relaciones entre poblaciones neuronales específicas y sus contribuciones a los potenciales evocados de superficie cortical (CSEP) y al procesamiento cortical34.
La optogenética permite la modulación selectiva de poblaciones neuronales específicas, lo que permite investigar sus roles causales en la generación de patrones de actividad cortical y participar en cálculos cuyas firmas se pueden detectar con μECoG. Por ejemplo, nuestros estudios demuestran que dirigirse a un tipo específico de célula puede alterar los potenciales eléctricos de la superficie cortical (CSEP). Este enfoque podría utilizarse para diseccionar la base del tipo de células neuronales de las señales μECoG, lo que nos permite identificar qué tipos de células neuronales contribuyen a las actividades evocadas sensoriales características, como las observadas en la banda gamma alta. Otros fenómenos a gran escala, como los ritmos corticales en diferentes bandas de frecuencia21, o la actividad organizada espacialmente, incluidas las ondas viajeras35,36, podrían investigarse de manera similar. Además, hay una gama de líneas de ratones modificados genéticamente y opsinas disponibles, lo que brinda oportunidades para explorar mecanismos de circuitos específicos. Las técnicas optogenéticas podrían emplearse para examinar los efectos funcionales de las conexiones horizontales entre las columnas37, que desempeñan un papel crucial en varios cálculos sensoriales, como la supresión del entorno38 o la unión perceptiva39. En resumen, la capacidad de manipular la actividad neuronal a través de la optogenética permite probar los vínculos entre poblaciones neuronales específicas y las propiedades de los CSEP o entre la población y los cálculos corticales específicos medibles con μECoG. Este enfoque podría diseccionar eficazmente las relaciones entre las estructuras neuronales locales y la actividad cortical global.
Los registros de politrodos laminares permiten el muestreo de la actividad de una sola neurona de múltiples neuronas dentro de pequeños volúmenes corticales, es decir, dentro de una columna cortical individual. Estos registros son cruciales porque las neuronas individuales pueden codificar de forma independiente información distinta, empleando la codificación selectiva de estímulos, como las "neuronas de Jennifer Aniston" descritas por Quiroga et al.40, o proporcionando representaciones complementarias en un espacio de mayor dimensión, como se ve en la selectividad mixta41. Tradicionalmente, los electrofisiólogos estudiaban la actividad neuronal en el contexto de estímulos y comportamientos simples y paramétricamente diseñados (por ejemplo, la deflexión de un solo bigote o los tonos puros, como se despliega aquí). La representación de tales estímulos tiende a estar bastante localizada espacialmente (por ejemplo, columnas individuales). Sin embargo, muchos estímulos y comportamientos etológicamente relevantes son más complejos y, como tales, los patrones típicos de actividad neuronal durante tales paradigmas con frecuencia se extienden más allá de columnas individuales, incluso en todoel cerebro. En estos casos, μECoG ofrece una lectura completa que captura la actividad resuelta en columnas de alta resolución temporal en varias columnas simultáneamente. En resumen, el protocolo descrito aquí cierra efectivamente la brecha entre el procesamiento local dentro de las columnas corticales individuales y la dinámica más extensa que ocurre a través de múltiples columnas en un área cortical completa y entre áreas.
Como orientación general y solución de problemas, proponemos algunas recomendaciones. Los protocolos electrofisiológicos agudos in vivo convencionales suelen aconsejar mantener el cerebro húmedo durante la exposición como medio para prolongar la salud del cerebro expuesto. Si bien esto es probablemente útil en algunas circunstancias, nuestra experiencia sugiere que lo contrario es cierto para las grabaciones de μECoG en roedores. De hecho, descubrimos que la calidad de grabación era cualitativamente mejor cuando las matrices de μECoG se colocaban sobre una superficie cortical ligeramente seca. Creemos que esto se debe a que tener solución salina, una solución iónica altamente conductora colocada entre la superficie cortical y los electrodos de registro, homogeneiza las señales eléctricas generadas por el cerebro. Efectivamente, la solución salina está "cortocircuitando" los electrodos juntos. Debido a que las rejillas μECoG monitorean el campo eléctrico continuo generado por las poblaciones de neuronas, es importante garantizar que los sistemas electrofisiológicos estén bien ensamblados y sin ruido. Durante las grabaciones, la conexión con el electrodo de referencia es fundamental. Sin mejora durante la grabación, el preprocesamiento de los datos puede incorporar un filtro de muesca a 50 Hz o 60 Hz para eliminar el ruido de línea. Sin embargo, esto alterará drásticamente la señal y, por lo tanto, debe tenerse en cuenta en el análisis posterior. Teniendo en cuenta la estimulación optogenética de la luz, el artefacto optoeléctrico debe minimizarse o al menos tenerse en cuenta en el diseño experimental (por ejemplo, incluyendo un retraso después del inicio o el desplazamiento de la luz). Idealmente, la luz se entrega en el área entre los electrodos utilizando un diámetro de fibra óptica pequeño, o enfocando o colimando la luz. Si este artefacto no se puede evitar por completo (pero véanse los estudios que proponen diferentes diseños de sondas 15,20,43 incluyendo electrodos transparentes), se puede reducir utilizando la menor cantidad de luz necesaria. Las opsinas de nueva generación requieren menos luz para ser efectivas44,45. Sugerimos calibrar la potencia de la luz optogenética antes del experimento utilizando sondas laminares. La forma del artefacto también puede modificarse y reducirse evitando las transiciones bruscas en el estímulo luminoso (por ejemplo, utilizando una rampa de luz en lugar de un pulso cuadrado). En cualquier caso, las condiciones de control con animales que no expresan opsinas son aconsejables para diferenciar los cambios genuinos en la actividad neuronal de las señales relacionadas con los artefactos. Finalmente, el proceso de electrodeposición crea un recubrimiento rugoso de alta área superficial que mejora la transferencia de carga entre el electrodo y el tejido, al tiempo que mantiene la estabilidad mecánica durante las grabaciones, reduciendo la impedancia del electrodo en 1-2 órdenes de magnitud en comparación con el platino desnudo y permitiendo una mejor detección de señales neuronales46.
Acute μECoG ofrece flexibilidad y complejidad reducida en las configuraciones experimentales, lo que permite un mapeo detallado de la actividad neuronal en el transcurso de decenas de minutos de grabaciones. Como método de mesoescala, permite un seguimiento interaéreo, pero no de todo el cerebro, de la actividad cortical, aunque las fuentes exactas de las señales siguen siendo inciertas. En el futuro, los estudios multimodales deberían proporcionar una mejor imagen del origen de la señal. La μECoG aguda es limitada en la captura de la dinámica neuronal a largo plazo y puede estar influenciada por factores transitorios como la recuperación quirúrgica o la anestesia48,49. Por el contrario, la μECoG crónica permite la observación prolongada de la actividad neuronal, proporcionando información sobre procesos como el aprendizaje, la plasticidad y la progresión de la enfermedad10,13. La μECoG crónica también presenta desafíos como la estabilidad de los electrodos, la posible degradación de la señal y los riesgos asociados con la implantación a largo plazo, incluida la cicatrización del tejido o la infección50,51. Estos desafíos tienden a ser menos severos en comparación con los electrodos penetrantes y supuestamente se reducen aún más con la implantación epidural del μECoG en ratones (a costa de una menor calidad de la señal)52. Es posible reutilizar la misma cuadrícula μECoG en muchas sesiones en el mismo animal o en animales diferentes, eliminando la cuadrícula al final de una sesión y reemplazándola en la siguiente sesión. En esta configuración subaguda, el cerebro debe mantenerse húmedo en todo momento y protegerse con un cubreobjetos de vidrio entre sesiones. Hemos observado que las rejillas μECoG son bastante duraderas; Una cuadrícula individual se puede reutilizar ~ 20 veces con el manejo y la limpieza adecuados, lo que los convierte en dispositivos de grabación rentables. Las rejillas se pueden diseñar con diversos números y geometrías de diseños de electrodos. Los resultados aquí sugieren que la reducción del paso del electrodo a <200 μm da como resultado solo mejoras insignificantes en la resolución funcional debido a la granularidad de las representaciones neuronales en la corteza subyacente.
Divulgaciones
Los autores declaran no tener intereses financieros contrapuestos.
Agradecimientos
Este trabajo fue apoyado por el Laboratorio Nacional Lawrence Berkeley LDRD para el Laboratorio de Sistemas Neuronales y Aprendizaje Automático (K.E.B.), NINDSR01 NS118648A (K.E.B.& D.E.F.) y NINDS R01 NS092367 (D.E.F.).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 disposable #11 blade | Swann Morton | 303 | For surgical procedures |
| 2 disposable #10 blades | Swann Morton | 3901 | For surgical procedures |
| 30 mm cage bars | Thorlabs | ER | cage components |
| 30 mm cage plate | Thorlabs | CP33T | holding the lenses |
| 70% ethanol | Decon Labs | V1016 | Cleaning / Disinfectant (diluted to 70%) |
| Amalgambond PLUS Adjustable Precision Applicator Brush Teal 200/Bx | Henry Schein | 1869563 | precision applicator for the cement |
| Amalgambond PLUS Catalyst 0.7 mL Syringe Ea | Henry Schein | 1861119 | cement component |
| Amplifier (Tucker-Davis Technologies) | Tucker-Davis Technologies | PZ5M-512 | Used for auditory stimulus and recording software. |
| Articulated arm | Noga | DG60103 | for holding the fine adjustment screw system |
| Aspheric lenses for light collection (and one for focusing the light) | Thorlabs | ACL25416U-B | for collecting LED light |
| Auditory equipment | Tucker-Davis Technologies, Sony, Cortera | RP2.1 Enhanced Real-Time Processor/HB7 Headphone Drive | Used for auditory stimulus and recording software. |
| Buprenorphine | Sterile Products LLC | #42023017905 | General analgesia |
| C&B Metabond Base Cement Ea | Henry Schein | 1864477 | cement component |
| C&B Metabond L-Powder Cement Clear 3 g | Henry Schein | 1861068 | cement component |
| Chlorprothixene hydrochloride (mouse) | Sigma Aldrich | Cat. No. C1671 | For sedation, must be prepared the same day and kept at 4 |
| Custom-designed 128-channel micro-electrocorticography (μECoG) grids | Neuronexus | E128-200-8-40-HZ64 | For neurophysiology recordings. Placed onto the cortex. |
| Dengofoam gelatin sponges | Dengen dental | 600034 (SKU) | can be used dry or wet, saturated with sterile sodium chloride solution |
| Drill bit, size 5 to 9 (Mouse) | Fine Science Tools | 19007-XX | XX is the size of the drill bit e.g. 05 or 09. For mouse procedures |
| Drill bitSteel Round Bur (5.5 mm/7.5 mm) | LZQ Tools | Dental Bar Drill Bit Stainless Steel Bur | For rat procedures |
| Dumont No. 5 forceps | Fine Science Tools | 11251-10 | For surgical procedures |
| Dumont tweezers #5 bent 45° | World precision instruments | 14101 | for removing craniotomy window |
| DVD Player (Sony) | Sony | CDP-C345 | System used to accept and play back stimulus sets |
| Electrostatic Speaker | Sony | XS-162ES | Used for auditory stimulus and recording software. Located within the rig, plays sound to the sedated rodent |
| Enzymatic detergent (Enzol) | Advanced sterilization products | 2252 | Cleaning/Disinfectant |
| EverEdge 2.0 Scaler Sickle Double End H6/H7 #9 | Henry Schein | 6011862 | for scrubing the skull |
| Fine adjustment screw system in 3 dimension | Narishige | U-3C | for precise positioning of the optical fiber end |
| Gold pin | Harwin Inc | G125-1020005 | Used for contact reference in mouse Soldered to the silver wire |
| Gripping forceps | Fine Science Tools | 00632-11 | For surgical procedures |
| Isoflurane | Covetrus | 11695067772 | require a vaporizer |
| Ketamine (Hydrochloride Injection) (Rat) | Dechra | 17033-101-10 | Anesthesia/Analgesic |
| LED | New Energy | LED XLAMP XPE2 BLUE STARBOARD | Blue LED light source |
| LED driver | Thorlabs | LEDD1B | LED driver |
| Lidocaine | Covetrus | VINB-0024-6800 | to be diluted to 1% in saline |
| Meloxicam | Covetrus | 6451603845 | Anti-inflammatory used for general analgesia |
| Micromanipulator | Narishige (Stereotaxic Rig) | SR-6R + SR-10R-HT components | Used to manipulate ECoG and rodent with fine movements |
| No. 2 forceps | Fine Science Tools | 91117-10 | For surgical procedures |
| No. 55 forceps | Fine Science Tools | 1129551 | For surgical procedures |
| Ophtalmic lubricant (Artificial tears) | Akorn | 17478-062-35 | Used to protect eyes from dessication during surgical procedures |
| Optical fiber 200µm Core diameter | Thorlabs | M133L02 | FC/PC connector 2 m long |
| Pentobarbital (Rat) | Covetrus / Dechra | VINV-C0II-0008 | Anesthesia/Analgesic |
| Platinum Black | Sigma | 205915-250MG | For neurophysiology recordings (Used for electroplating the contacts on the μECoG grids). |
| Povidone Iodine 10% | Betadine | https://betadine.com/medical-professionals/betadine-solution/ | no catalog number ( not retail ) |
| Powder detergent (Contrex AP) | Decon Labs | 5204 | Cleaning / Disinfectant |
| Pre-cut tape for oxygen tube | ULINE (Various Providers) | S-14726 | Used to attach oxygen tube to the nose-cone of the rodent stereotaxic rig |
| Scalpel handle # 3 | World precision instruments | 500236-G | for blades # 10, #11 and #15 |
| Scraper | Fine Science Tools | 1007516 | For surgical procedures |
| Short 30 G needles | ExelInt | 26437 | For surgical procedures and injections |
| Silver Wire | Warner Instruments | 63-1319 | For neurophysiology recordings (Used for grounding and as a reference electrode). |
| Sterilized saline (0.9% sodium chloride for injection) | Hospira | 00409-7101-67 (NDC) | For dilution of injectable, and replacement of body fluids |
| Stoelting Hopkins Bulldog | Fine Science Tools | 10-000-481 | For surgical procedures |
| Surface disinfectant (Coverage Plus NDP Disinfectant) | Steris life science | 638708 | Cleaning/Disinfectant |
| TDT ZIF-clip connectors for acquisition. | Tucker-Davis Technologies | ZIF-Clip Analog Headstages | Connects ECoG with outside acquisition equipement |
| Two-pronged holding fork | Tucker-Davis Technologies | Z-ROD128 | Used to connect the TDT-clips with the micromanipulator |
| Xylazine (Rat) | Covetrus | 1XYL006 | Anesthesia/Analgesic |
Referencias
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nunez, P. L., Srinivasan, R. . Electric Fields of the Brain: The Neurophysics of EEG. , (2006).
- Mountcastle, V. B., Powell, T. P. Central nervous mechanisms subserving position sense and kinesthesis. Bull Johns Hopkins Hosp. 105, 173-200 (1959).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci. 18 (2), 310-315 (2015).
- Lewis, C. M., Bosman, C. A., Womelsdorf, T., Fries, P. Stimulus-induced visual cortical networks are recapitulated by spontaneous local and interareal synchronization. Proc Natl Acad Sci U S A. 113 (5), E606-E615 (2016).
- Bouchard, K. E., Mesgarani, N., Johnson, K., Chang, E. F. Functional organization of human sensorimotor cortex for speech articulation. Nature. 495 (7441), 327-332 (2013).
- Ledochowitsch, P., et al. Fabrication and testing of a large area, high density, parylene MEMS µECoG array. , (2011).
- Bosman, C. A., et al. Attentional stimulus selection through selective synchronization between monkey visual areas. Neuron. 75 (5), 875-888 (2012).
- Rubehn, B., Bosman, C., Oostenveld, R., Fries, P., Stieglitz, T. A MEMS-based flexible multichannel ECoG-electrode array. J Neural Eng. 6 (3), 036003 (2009).
- Baratham, V. L., et al. Columnar localization and laminar origin of cortical surface electrical potentials. J Neurosci. 42 (18), 3733-3748 (2022).
- Kellis, S., et al. Decoding spoken words using local field potentials recorded from the cortical surface. J Neural Eng. 7 (5), 056007 (2010).
- Viventi, J., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci. 14 (12), 1599-1605 (2011).
- Ledochowitsch, P., Olivero, E., Blanche, T., Maharbiz, M. M. A transparent µECoG array for simultaneous recording and optogenetic stimulation. , (2011).
- Ledochowitsch, P., et al. Strategies for optical control and simultaneous electrical readout of extended cortical circuits. J Neurosci Methods. 256, 220-231 (2015).
- Dougherty, M. E., Nguyen, A. P. Q., Baratham, V. L., Bouchard, K. E. Laminar origin of evoked ECoG highgamma activity. Annu Int Conf IEEE Eng Med Biol Soc. 2019, 4391-4394 (2019).
- Tian, H., Xu, K., Zou, L., Fang, Y. Multimodal neural probes for combined optogenetics and electrophysiology. iScience. 25 (1), 103612 (2022).
- Gonzales, D. L., et al. A translaminar spacetime code supports touchevoked traveling waves. bioRxiv. , (2024).
- Leonard, M. K., et al. Largescale singleneuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Renz, A. F., et al. OptoEDura: a soft, stretchable ECoG array for multimodal, multiscale neuroscience. Adv Healthc Mater. 9 (17), 2000814 (2020).
- Buzsáki, G. . Rhythms of the brain. , (2006).
- Yang, W., et al. A fully transparent, flexible PEDOT:PSS-ITO-Ag-ITO based microelectrode array for ECoG recording. Lab Chip. 21 (6), 1096-1108 (2021).
- Buzsáki, G. Largescale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Schalk, G., et al. Realtime detection of eventrelated brain activity. Neuroimage. 43 (2), 245-249 (2008).
- Kellis, S., et al. Multiscale analysis of neural activity in humans: implications for microscale electrocorticography. Clin Neurophysiol. 127 (1), 591-601 (2016).
- Buzsáki, G., Schomburg, E. W. What does gamma coherence tell us about interregional neural communication. Nat Neurosci. 18 (4), 484-489 (2015).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecondtimescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Cardin, J. A., et al. Driving fastspiking cells induces gamma rhythm and controls sensory responses. Nature. 459 (7247), 663-667 (2009).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decisionrelated activity propagate in a cortical feedback loop during touch perception. Nat Neurosci. 19 (9), 1243-1249 (2016).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56 (2), 339-355 (2007).
- Crone, N. E., Sinai, A., Korzeniewska, A. Highfrequency gamma oscillations and human brain mapping with electrocorticography. Prog Brain Res. 159, 275-295 (2006).
- Gerfen, C. R., Paletzki, R., Heintz, N. GENSAT BAC crerecombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron. 80 (6), 1368-1383 (2013).
- Mountcastle, V. The columnar organization of the neocortex. Brain. 120 (4), 701-722 (1997).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Muller, L., Chavane, F., Reynolds, J., Sejnowski, T. J. Cortical travelling waves: mechanisms and computational principles. Nat Rev Neurosci. 19 (5), 255-268 (2018).
- Sato, T. K., Nauhaus, I., Carandini, M. Traveling waves in visual cortex. Neuron. 75 (2), 218-229 (2012).
- Gilbert, C. D., Wiesel, T. N. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortex. J Neurosci. 9 (7), 2432-2442 (1989).
- Angelucci, A., et al. Circuits and mechanisms for surround modulation in visual cortex. Annu Rev Neurosci. 40 (1), 425-451 (2017).
- Singer, W., Gray, C. M. Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci. 18, 555-586 (1995).
- Quiroga, R. Q., et al. Invariant visual representation by single neurons in the human brain. Nature. 435 (7045), 1102-1107 (2005).
- Fusi, S., Miller, E. K., Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr Opin Neurobiol. 37, 66-74 (2016).
- Stringer, C., et al. Spontaneous behaviors drive multidimensional, brainwide activity. Science. 364 (6437), eaav7893 (2019).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using celltypespecific expression of channelrhodopsin2. Nat Protoc. 5 (2), 247-254 (2010).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nat Neurosci. 21 (6), 881-893 (2018).
- Mahn, M., et al. Highefficiency optogenetic silencing with somatargeted anionconducting channelrhodopsins. Nat Commun. 9 (1), 4125 (2018).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating lowimpedance tetrodes by electroplating with additives. Sens Actuators A Phys. 156 (2), 388-393 (2009).
- Halnes, G., et al. . Electric Brain Signals: Foundations and Applications of Biophysical Modeling. , (2024).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nat Rev Neurosci. 9 (5), 370-386 (2008).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and anesthesia. Science. 322 (5903), 876-880 (2008).
- Schalk, G., Leuthardt, E. C. Braincomputer interfaces using electrocorticographic signals. IEEE Rev Biomed Eng. 4, 140-154 (2011).
- Chestek, C. A., et al. Longterm stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex. J Neural Eng. 8 (4), 045005 (2011).
- Branco, M. P., et al. Nine decades of electrocorticography: a comparison between epidural and subdural recordings. Eur J Neurosci. 57 (8), 1260-1288 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados