Method Article
Indagini multiscala sull'elaborazione corticale integrando politrodi laminari e optogenetica con la microcorticografia nei roditori
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo due protocolli per la registrazione della micro-elettrocorticografia ad alta densità (μEcoG) in ratti e topi, inclusi metodi chirurgici, di impianto e di registrazione. Le registrazioni μECoG vengono eseguite in combinazione con la registrazione di politrodi laminari nella corteccia uditiva del ratto o con la manipolazione optogenetica dell'attività neurale nella corteccia somatosensoriale del topo.
Abstract
L'elettrocorticografia (ECoG) è un ponte metodologico tra le neuroscienze di base e la comprensione della funzione cerebrale umana in salute e malattia. ECoG registra i segnali neurofisiologici direttamente dalla superficie corticale con risoluzione temporale al millisecondo e risoluzione spaziale colonnare su ampie regioni di tessuto corticale contemporaneamente, rendendolo in una posizione unica per studiare calcoli corticali sia locali che distribuiti. In questo articolo, descriviamo la progettazione di dispositivi micro-ECoG (μECoG) personalizzati ad alta densità e il loro utilizzo in due procedure. Queste griglie hanno 128 elettrodi a bassa impedenza con spaziatura di 200 μm fabbricati su un substrato polimerico trasparente con perforazioni tra gli elettrodi; queste caratteristiche consentono la registrazione simultanea di μECoG con registrazioni di politrodi laminari e manipolazioni optogenetiche. In primo luogo, presentiamo un protocollo per la registrazione combinata di μECoG epidurale sulla corteccia somatosensoriale dei baffi di topi con manipolazione optogenetica di specifici tipi di cellule corticali geneticamente definite. Ciò consente la dissezione causale dei contributi distinti di diverse popolazioni neuronali all'elaborazione sensoriale, monitorando anche le loro firme specifiche nei segnali μECoG. In secondo luogo, presentiamo un protocollo per esperimenti acuti per registrare l'attività neurale dalla corteccia uditiva del ratto utilizzando griglie μECoG e politrodi laminari. Ciò consente una mappatura topografica dettagliata delle risposte neurali evocate sensorialmente attraverso la superficie corticale contemporaneamente con registrazioni da più unità neurali distribuite in tutta la profondità corticale. Questi protocolli consentono esperimenti che caratterizzano l'attività corticale distribuita e possono contribuire alla comprensione e agli eventuali interventi per diversi disturbi neurologici.
Introduzione
Le funzioni cerebrali alla base della sensazione, della cognizione e dell'azione sono organizzate e distribuite su vaste scale spaziali e temporali, che vanno dai picchi di singoli neuroni ai campi elettrici generati da popolazioni di neuroni in una colonna corticale all'organizzazione topografica delle colonne attraverso le aree cerebrali (ad esempio, la somatotopia nella corteccia somatosensoriale, la tonotopia nella corteccia uditiva primaria). La comprensione della funzione cerebrale richiede il rilevamento di segnali elettrici su queste scale spaziali1. Le neuroscienze hanno attualmente molti metodi ampiamente utilizzati per monitorare l'attività del cervello. Elettrofisiologicamente, i politrodi laminari (come i neuropixel) consentono il monitoraggio di un numero modesto (~300) di singoli neuroni, tipicamente all'interno di una manciata di colonne distanti tra loro, con un'alta risoluzione temporale (≥1 kHz). L'imaging Ca2+ consente il monitoraggio di un numero da modesto a elevato di singoli neuroni identificati geneticamente e anatomicamente entro un'estensione spaziale di ~1-2 mm a una risoluzione temporale inferiore (~10 Hz)2. La fMRI consente di monitorare lo stato metabolico di un gran numero di neuroni (~1 M di neuroni in un volume di 36 mm3 ) in tutto il cervello a una risoluzione temporale molto bassa (~0,2 Hz). L'EEG/MEG consente il monitoraggio dell'attività elettrica dell'intera superficie corticale/cervello a una risoluzione temporale modesta (<100 Hz) e a una risoluzione spaziale molto bassa (centimetri)3. Mentre ognuna di queste metodologie ha fornito intuizioni fondamentali e sinergiche sulla funzione cerebrale, sono nascenti metodi che consentono il rilevamento diretto di segnali elettrofisiologici ad alta risoluzione temporale da precise posizioni anatomiche in ampie regioni spaziali della corteccia. La necessità di un'ampia copertura spaziale è enfatizzata dal fatto che nel cervello, la funzione neuronale cambia molto più drasticamente sulla superficie rispetto alla profondità4.
L'elettrocorticografia (ECoG) è un metodo in cui griglie di elettrodi a bassa impedenza vengono impiantate sulla superficie del cervello e consentono la registrazione o la stimolazione della corteccia 1,5. L'ECoG è tipicamente impiegata in contesti neurochirurgici umani come parte del work-up clinico per il trattamento dell'epilessia farmacologicamente intrattabile. Tuttavia, fornisce anche informazioni uniche sull'elaborazione corticale distribuita negli esseri umani, come la mappatura topografica vocale e sensoriale 6,7. Queste capacità ne hanno motivato l'uso in modelli animali, tra cui scimmie, ratti e topi 5,8,9,10,11. Nei roditori, è stato recentemente dimostrato che la micro-ECoG (μECoG) consente un monitoraggio elettrico diretto ad alta risoluzione temporale (~100 Hz) di popolazioni neuronali con risoluzione spaziale colonnare (~200 μm) e ampia copertura spaziale (molti millimetri). μECoG consente ai ricercatori di studiare le dinamiche neurali distribuite associate a complesse elaborazioni sensoriali, funzioni cognitive e comportamenti motori in modelli animali12,13. Recenti progressi hanno integrato μECoG con l'optogenetica e le registrazioni di politrodi laminari 14,15,16,17,18,19,20, consentendo indagini multiscala delle reti corticali e colmando il divario tra l'attività neuronale su microscala e la dinamica corticale su macroscala 21,22. Criticamente, poiché il segnale μECoG è molto simile negli esseri umani e nei modelli animali non umani, l'uso di μECoG rende la traduzione dei risultati e dei risultati dai modelli animali all'uomo molto più diretta23. Pertanto, gli approcci integrativi sono fondamentali per far progredire la nostra comprensione dei circuiti neurali e sono promettenti per lo sviluppo di nuovi interventi terapeutici per i disturbi neurologici 5,24,25.
Di conseguenza, vi è una necessità emergente di protocolli che integrino array di μECoG ad alta densità con registrazioni laminari e strumenti optogenetici per consentire indagini multiscala complete dell'elaborazione corticale 8,26. Per colmare questa lacuna, abbiamo sviluppato dispositivi μECoG progettati su misura con 128 elettrodi a bassa impedenza con diametro dell'elettrodo di 40 μm e spaziatura tra gli elettrodi di 20 μm su un substrato polimerico flessibile e trasparente (parylene-C e poliimmide) con perforazioni tra gli elettrodi, consentendo registrazioni simultanee di μECoG e politrodi laminari con manipolazioni optogenetiche13,22. Gli aspetti chiave di questo protocollo sperimentale includono: (i) risoluzione spaziale colonnare e copertura su larga scala dell'attività corticale attraverso array μECoG ad alta densità; (ii) la capacità di registrare da più strati corticali utilizzando politrodi laminari inseriti attraverso la griglia μECoG; e (iii) l'incorporazione di tecniche optogenetiche per attivare o inibire selettivamente specifiche popolazioni neuronali, consentendo così la dissezione causale dei circuiti neurali 27,28,29. La configurazione ad alta densità consente registrazioni ad alta risoluzione spaziale, fornendo efficacemente una "vista colonnare" dell'attività corticale, poiché studi precedenti hanno dimostrato che i segnali μECoG possono risolvere l'attività su una scala spaziale paragonabile al diametro della colonna corticale del roditore (~20 μm)11. Questa metodologia integrata consente il monitoraggio e la manipolazione simultanea su più scale dell'attività neurale, consentendo potenzialmente esperimenti causali per determinare le fonti neuronali dei segnali μECoG e l'elaborazione corticale distribuita. Per raggiungere questi obiettivi, questo manoscritto fornisce protocolli dettagliati per l'uso di array μECoG ad alta densità in due combinazioni.
In primo luogo, descriviamo la μECoG combinata con la manipolazione delle cellule piramidali dello strato 5 (L5) nella corteccia somatosensoriale primaria del topo (S1). Nel topo, l'array μECoG viene posizionato per via epidurale (a causa dell'intrattabilità chirurgica della durotomia nei topi). Una fibra ottica è posizionata sopra la griglia o combinata con una lente per focalizzare la luce optogenetica su una piccola area target della superficie corticale. La strategia optogenetica è qui descritta per l'inibizione dei neuroni eccitatori dello strato 5, ma può essere facilmente adattata a qualsiasi popolazione di neuroni dotati della corrispondente linea murina che esprime Cre. In secondo luogo, descriviamo l'uso combinato di μECoG con politrodi laminari di silicio per registrare simultaneamente i potenziali elettrici di superficie corticale (CSEP) e l'attività di picco di una singola unità da più neuroni attraverso gli strati corticali dalla corteccia uditiva di ratto (A1). L'array è dotato di perforazioni tra gli elettrodi, che consentono l'inserimento di politrodi laminari multicanale attraverso la griglia per registrare l'attività neuronale attraverso diversi strati corticali. Durante la procedura di craniotomia, l'array μECoG viene posizionato subduralmente sopra la corteccia uditiva e il politrodo laminare viene inserito attraverso le perforazioni. I segnali neurali provenienti dal μECoG e dalla sonda laminare vengono registrati simultaneamente, campionati rispettivamente a 6 kHz e 24 kHz, utilizzando un sistema di amplificazione collegato otticamente a un processore di segnale digitale.
Protocollo
Entrambi i protocolli seguono gli stessi passaggi chiave (anestesia, fissazione, craniotomia, registrazione μECoG) ma presentano notevoli differenze. Nella descrizione seguente, i passaggi condivisi sono uniti, mentre le specificità di ciascun protocollo sono annotate. Questi passaggi seguenti corrispondono alla registrazione μECoG con optogenetica (topo) o alla registrazione μECoG con una sonda laminare (ratto). Tutte le procedure qui descritte sono state condotte in conformità con le autorità etiche o legali locali (IACUC o Comitati Etici). I farmaci utilizzati possono variare in base al protocollo etico approvato.
1. Preparazione e protocollo per le procedure su topi e ratti
- Notevoli differenze tra i protocolli per topi e ratti
- Configurazioni per la chirurgia rispetto alle registrazioni elettrofisiologiche
- Per un ratto, utilizzare la stessa configurazione sia durante l'intervento chirurgico che durante le registrazioni elettrofisiologiche.
- Per un topo, eseguire l'intervento chirurgico nella prima configurazione e le registrazioni elettrofisiologiche nella seconda configurazione.
- Fissaggio della testa
- Per un ratto, utilizzare lo stesso morsetto per muso per la chirurgia e la registrazione elettrofisiologica.
- Per un topo, utilizzare un morsetto per muso per la chirurgia e una headbar metallica esterna nella configurazione per l'elettrofisiologia per consentire il fissaggio in anestesia con isoflurano leggero. Impiantare la headbar con cemento dentale sul cranio.
- Configurazione della registrazione: utilizzare elettronica di acquisizione, software di registrazione e software di stimolazione sensoriale distinti per le due specie.
- Per il protocollo del mouse, utilizzare il sistema SpikeGadgets (https://spikegadgets.com) e il software open source Trodes (https://spikegadgets.com/trodes/) per l'acquisizione dei dati.
- Per il protocollo ratto, utilizzare il software di registrazione Synapse - Neurophysiology Suite (https://www.tdt.com/component/synapse-software/) per l'acquisizione dei dati.
- Indurre l'anestesia per iniezione (ratto) o inalazione (topo).
- Luogo di registrazione
- Condurre registrazioni nella corteccia somatosensoriale (S1) per un topo.
- Condurre registrazioni nella corteccia uditiva primaria (A1) per un ratto.
NOTA: Questa differenza nella localizzazione anatomica richiede siti di craniotomia diversi per ogni specie.
- Configurazioni per la chirurgia rispetto alle registrazioni elettrofisiologiche
- Preparazione e collaudo della rete
- Immergere la griglia (esclusa la scheda di connessione) in un detergente enzimatico diluito (50% detergente, 50% acqua distillata) per almeno 1 ora.
- Trasferiscilo in un bagno di acqua distillata pura e lascialo asciugare all'aria in un luogo sicuro e pulito.
- Eseguire l'elettrodeposizione di nero platino come parte della preparazione iniziale del dispositivo μECoG, non prima di ogni sessione di registrazione.
NOTA: Una volta depositato, il rivestimento Platinum Black forma uno strato stabile che rimane efficace per più registrazioni, anche se le sue prestazioni devono essere monitorate attraverso regolari test di impedenza. L'elettrodeposizione di nero di platino (intervallo target di 10-20 kΩ a 1 kHz) riduce l'impedenza dell'elettrodo e migliora il rapporto segnale/rumore nelle registrazioni neurali. - Per eseguire l'elettrodeposizione, preparare una soluzione di acido cloroplatinico (tipicamente acido cloroplatinico all'1-3% [H2PtCl6]) contenente una piccola quantità di acetato di piombo (circa lo 0,005%) come modificatore di deposizione. Collegare gli elettrodi μECoG in modo che fungano da elettrodo di lavoro in una cella elettrochimica a tre elettrodi, con un controelettrodo in platino e un elettrodo di riferimento Ag/AgCl.
- Applicare una densità di corrente costante di circa -0,5--2 mA/cm² per 10-30 s monitorando i valori di impedenza.
- Testare e registrare l'impedenza degli elettrodi a griglia (ad esempio, con un Nano-Z).
- Controllare la griglia su una fonte di luce e preparare la griglia per l'uso nella registrazione post-operatoria.
- Saldatura del cavo di riferimento
- Per un mouse, saldare l'estremità di un filo d'argento (10 mm di lunghezza, 30 G) a un pin d'oro per il collegamento al cavo di riferimento del sistema di registrazione.
2. Chirurgia
- Preparazione dei materiali e monitoraggio generale (cura degli animali e registrazione)
- Preparazione: Pulire e disinfettare accuratamente l'area chirurgica con un disinfettante appropriato. Assicurarsi che tutti gli strumenti chirurgici siano sterilizzati, in genere utilizzando un'autoclave.
- Posizionamento degli strumenti chirurgici: disporre gli strumenti chirurgici sul cuscinetto chirurgico sterile. Rifornisci l'area chirurgica con applicatori a punta di cotone e triangoli chirurgici in cotone assorbente. Smaltire i rifiuti a rischio biologico in un apposito sacchetto per lo smaltimento.
- Regolazione della temperatura: Accendere il termoforo all'interno del sito di registrazione chirurgica ed elettrofisiologica. Controlla la temperatura del termoforo durante l'intervento chirurgico e la registrazione.
- Cuscinetto chirurgico: posizionare un cuscinetto chirurgico blu o una coperta sopra il letto di regolazione della temperatura.
NOTA: Questo tappetino deve essere dotato di un fondo bianco in morbido cotone, che deve essere rivolto verso l'alto. - Posizionamento del microscopio: Preparare il microscopio e l'illuminatore collegato (ad es. anello LED) su un lato dell'area chirurgica. Verificare che funzioni correttamente.
- Trapano chirurgico: Preparare il trapano chirurgico per la procedura di craniotomia.
- Fornitura di ossigeno: Impostare la portata della bombola di ossigeno su 1,0 L/min (Ratto) o 0,5 L/min (Mouse) e posizionare la maschera di ossigeno vicino al cuscinetto di regolazione. L'animale avrà bisogno di ossigeno continuo dopo l'anestesia.
- Sostituzione dei liquidi: durante l'intervento, sostituire qualsiasi perdita di liquidi con l'obiettivo di sostituire almeno l'1,5% del peso corporeo dell'animale (topo) o 1 ml all'ora (ratto). Preparare le soluzioni isotoniche di conseguenza.
- Animale: Portare l'animale dalla struttura per animali alla sala operatoria secondo le procedure approvate. Utilizzare topi di età compresa tra 8 e 16 settimane, maschi o femmine, di origine C57Bl6; allo stesso modo, utilizzare ratti di 7 settimane, maschi, del ceppo Sprague Dawley.
- Preparazione dei farmaci: Pesare l'animale utilizzando una bilancia con una precisione di 0,1 g. Preparare le quantità adeguate di farmaco per l'intervento chirurgico, utilizzando soluzioni pre-diluite se necessario.
- Induzione dell'anestesia
- Induzione dell'anestesia per un topo
- Posizionare l'animale nella camera di induzione dell'isoflurano (3-5% di isoflurano in 0,5 L/min O2).
- Una volta confermata l'anestesia profonda (assenza di riflesso nel pizzico della coda/punta), posizionare l'animale sul termoforo chirurgico e fissarlo con la testa.
- Iniettare farmaci sottocutanei per analgesia generale: Meloxicam: 5 mg/kg e Buprenorfina: 0,1 mg/kg.
- Correggi il mouse seguendo i passaggi 2.2.1.5-2.2.1.6.
- Posizionare il muso nella maschera per anestesia e la testa senza stringere nel supporto per la testa. Per posizionare il mouse nella barra del morso, per prima cosa, assicurati che la lingua sia sotto l'asta e non tra l'asta e il palato. Usa una pinza per muovere la lingua, se necessario.
- Inserire gli incisivi dell'animale nel foro sull'asta della barra del morso. Fissare la maschera per anestesia del topo (1,5-2% di isoflurano in 0,5 L/min O2) serrando delicatamente la vite di fissaggio. La stabilizzazione della testa durante l'intervento chirurgico è assicurata esclusivamente dalla barra del morso.
- Proteggi gli occhi dell'animale con un unguento o un lubrificante per gli occhi a base di petrolio per prevenire l'essiccazione durante l'intervento chirurgico.
- Mantenere l'anestesia durante tutta la procedura con un flusso continuo di isoflurano attraverso la maschera.
- Induzione dell'anestesia per un ratto
- Utilizzare inizialmente l'isoflurano per sedare l'animale per facilitare l'iniezione dell'anestesia di induzione.
- Somministrare i farmaci per l'anestesia e l'analgesia:
Meloxicam: Dosaggio di 5 mg/kg, concentrazione 10 mg/mL, 0,4 mL/kg
Ketamina: Dosaggio di 90 mg/kg, concentrazione 100 mg/mL, 0,9 mL/kg
Xilazina: Dosaggio di 10 mg/kg, concentrazione 100 mg/mL, 0,1 mL/kg - Lasciare che l'animale raggiunga l'anestesia profonda entro 15-30 minuti, a seconda del peso e dell'età.
- Monitoraggio dell'anestesia
- Monitorare continuamente i parametri vitali dell'animale (frequenza respiratoria) durante tutta la procedura. Controllare la frequenza respiratoria come segno particolarmente utile di cambiamenti precoci nello stato anestetico e regolare il livello di anestetico se la frequenza respiratoria cambia.
- Il riflesso di ritiro della zampa è un segno critico dello stato anestetico. Testare periodicamente questo riflesso, poiché la sua totale assenza garantisce livelli sufficienti di anestesia per l'intervento chirurgico.
- Induzione dell'anestesia per un topo
- Fissazione della testa e monitoraggio dei parametri vitali
- Monitoraggio dei parametri vitali degli animali
- Controllare e registrare i segni vitali dell'animale su un foglio sperimentale. Se i riflessi dell'animale (ad esempio, l'astinenza della zampa) non sono completamente estinti, somministrare un'ulteriore mezza dose di ketamina supplementare (ratto) o aumentare la concentrazione di isoflurano con incrementi dello 0,5% (topo).
- Fissazione della testa per un ratto
- Una volta che il ratto è completamente anestetizzato (senza riflessi della zampa o della coda), inserire gli incisivi dell'animale nel foro sull'asta del supporto per la testa.
- Inserire con cautela le punte dei bracci di montaggio nella cresta del naso per fissare la testa durante l'intervento chirurgico, assicurandosi che non entri in contatto con gli occhi.
- Regolare l'angolazione delle braccia fino a quando il palato dell'animale non è saldamente premuto contro l'asta. Assicurarsi che il cranio rimanga immobile sotto pressione.
- Fissare entrambi i bracci del supporto serrando le viti con una chiave esagonale.
- Configurazione dell'ossigeno per un ratto
- Fissare il tubo di plastica dalla bombola di ossigeno sul muso e sul naso dell'animale, fissandolo con del nastro chirurgico. Evitare pieghe nel tubo che potrebbero ostruire il flusso d'aria. Impostare la bombola di ossigeno su una portata di 1 L/min.
NOTA: I parametri vitali degli animali, tra cui la frequenza cardiaca e la frequenza respiratoria, devono essere controllati a intervalli di 15-30 minuti durante la procedura.
- Fissare il tubo di plastica dalla bombola di ossigeno sul muso e sul naso dell'animale, fissandolo con del nastro chirurgico. Evitare pieghe nel tubo che potrebbero ostruire il flusso d'aria. Impostare la bombola di ossigeno su una portata di 1 L/min.
- Monitoraggio dei parametri vitali degli animali
- Incisione del cuoio capelluto
- Rasatura e preparazione
- Radere l'area dalla parte superiore del muso alla parte posteriore della testa, estendendosi da un occhio all'altro e intorno alle orecchie. Rimuovere la maggior parte del pelo con le forbici o un tagliacapelli elettrico, quindi applicare la crema depilatoria.
- Disinfezione
- Disinfettare l'area con un batuffolo di cotone imbevuto di Betadine, quindi risciacquare con un batuffolo di cotone imbevuto di etanolo al 70%. Ripeti questo processo tre volte e termina con un'ultima applicazione di Betadine per assicurarti che l'area sia sterile.
- Iniezione di anestetico locale
- Iniettare l'anestetico locale lidocaina (1%, 0,1 ml per il topo/0,4 ml per kg per il ratto) per via sottocutanea nella linea mediana del cuoio capelluto dell'animale. Massaggiare delicatamente il cuoio capelluto per diffondere la lidocaina e attendere 5 minuti per consentire all'anestetico di fare effetto.
- Incisione
- Per un topo, sollevare un punto sulla pelle con una pinzetta e resecare una piccola sezione di pelle (circa 1 cm di diametro) usando le forbici chirurgiche.
- Per un ratto, praticare un'incisione precisa sul lato anteriore del cuoio capelluto, appena sopra il naso, sulla linea mediana usando il bisturi. Tirare delicatamente indietro la pelle, creando un'incisione diritta tra gli occhi fino alla base del cranio. Sollevare con cautela il cuoio capelluto, tagliare il tessuto connettivo ed esporre completamente il cranio.
- Esporre il sito della craniotomia seguendo i passaggi 2.4.4.4-2.4.4.5.
- Con un raschietto, elimina il tessuto connettivo e il periostio sulla parte superiore del cranio. Sciacquare la soluzione salina e utilizzare l'aspirazione o una spugna chirurgica per pulire il sito.
- Utilizzare clip chirurgiche sui margini cutanei per facilitare l'esposizione chiara della regione del cranio in cui verrà eseguita la craniotomia.
- Rasatura e preparazione
- Craniotomia
- Procedura generale di foratura
- Impostare la velocità della fresa chirurgica su un'impostazione bassa di 5000 giri/min o 7000 giri/min per i chirurghi esperti. Esegui tutte le perforazioni mentre visualizzi attraverso il microscopio.
- Tenere il trapano parallelo alla superficie del cranio e appoggiarlo delicatamente contro la superficie.
- Con una leggera pressione sul pedale, iniziare a forare in un'unica posizione. Eseguire la perforazione a brevi intervalli (5-10 s) con controlli frequenti per verificare la presenza di cambiamenti nel colore dell'osso.
NOTA: L'osso inizierà di un bianco opaco e, man mano che il foro diventa più profondo, diventerà più traslucido, rivelando una tinta rosa. - Quando la perforazione si è avvicinata al cervello, rallenta e cerca segni di umidità che penetrano nel foro. Quando il foro è rosa scuro e ha una leggera lucentezza, smetti di forare. Utilizzando un ago corto da 30 G, perforare delicatamente lo strato di osso rimanente. Il liquido limpido dovrebbe fuoriuscire dal nuovo foro.
- Procedura di perforazione per un mouse
- Per posizionare un elettrodo di riferimento per le registrazioni fisiologiche, praticare un foro di fresatura nella parte frontale dell'emisfero omolaterale all'area registrata.
- Definisci il contorno della craniotomia praticando una trincea poco profonda sul suo perimetro. Nell'asse medio-laterale, partire dalla cresta ossea laterale come riferimento, e tracciare una finestra di 4 mm.
- Nell'asse antero-posteriore, praticare una finestra di 3 mm a partire da ~ 1 mm anteriormente alla cresta ossea posteriore. La dimensione finale della craniotomia aperta è di circa una finestra di 4 x 3 mm.
- Procedura di perforazione per un ratto
- Praticare due fori: uno nel quadrante posteriore sinistro, l'altro nel quadrante anteriore destro.
- Iniettare il muscolo massetere con una seconda dose di lidocaina (0,4 ml/kg a 10 mg/ml) e distribuire uniformemente nel punto in cui deve essere effettuato il taglio.
- Resecare solo l'insieme minimo di muscoli necessari per esporre l'area della craniotomia.
- Usando una nuova lama di bisturi #10, crea un taglio trasversale dorso-ventrale nel fascio di muscoli sopra la mascella dell'animale (lato destro). Tenere il bordo posteriore del taglio con una pinza di presa e staccarlo dal cranio mentre si taglia lungo la cresta ossea dello zigomo. In questo modo, il muscolo può essere staccato dall'osso con un sanguinamento minimo.
- Resecare il muscolo anteriore in modo simile fino a quando non viene rivelata una linea di fessura nel cranio. Questa linea sarà il confine anteriore della finestra craniotomica.
- Eliminare il muscolo intorno alla cresta posteriore con il bisturi e la pinza, utilizzando una forte fonte di luce per evitare di tagliare in regioni altamente vascolarizzate.
- Macinare la cresta posteriore usando il trapano fino a quando non è più sollevata sopra la superficie del cranio.
NOTA: Questo passaggio è essenziale per impostare la griglia μECoG in modo che entri in contatto diretto con la superficie corticale. - Forare il bordo dorsale della finestra appena sopra la cresta dove era attaccato il muscolo resecato. Posizionare il bordo posteriore anteriormente alla cresta posteriore perforata. Posizionare il bordo anteriore posteriormente alla linea della fessura che si estende verso il basso vicino all'orbita dell'occhio.
NOTA: Quando si libera il muscolo anteriore, è necessario prestare attenzione per evitare l'occhio.
- Procedura generale di foratura
- Perforazione della finestra per craniotomia
- Perforazione della finestra per craniotomia (Suggerimenti)
- Durante la perforazione, assicurarsi che la punta del trapano sia mantenuta parallela alla superficie del cranio. Applicare la minor forza possibile, usando il trapano come un pennello consentendo al trapano di entrare in contatto leggero con il cranio mentre si utilizzano movimenti brevi e ripetitivi lungo la linea di craniotomia prevista.
NOTA: Nei ratti, il bordo posteriore della finestra ha l'osso più spesso. Se si perfora troppo indietro, l'osso può mostrare una qualità squamosa e "croccante" che complica la misurazione dell'avanzamento della perforazione. Se posizionata in modo errato, questa zona ossea può rivelare una colorazione rossa venosa che dà una falsa impressione di vicinanza al cervello. - Perforare ogni lato della finestra craniotomica fino a quando l'osso appare rosa pallido con una sottile fessura bianca o crepa che corre lungo la sua lunghezza. Applicare una leggera pressione; L'osso dovrebbe produrre una distinta "oscillazione" quando è completamente perforato. Se la fessura appare disgiunta, continuare a forare leggermente fino a raggiungere una linea continua.
- Durante la perforazione, assicurarsi che la punta del trapano sia mantenuta parallela alla superficie del cranio. Applicare la minor forza possibile, usando il trapano come un pennello consentendo al trapano di entrare in contatto leggero con il cranio mentre si utilizzano movimenti brevi e ripetitivi lungo la linea di craniotomia prevista.
- Rimozione del cranio assottigliato all'interno della finestra di craniotomia
- Quando il cranio è stato assottigliato abbastanza da causare una pressione estremamente leggera che fa oscillare visibilmente l'intera finestra, rimuovere il cranio assottigliato.
- Sciacquare il sito della craniotomia con una goccia di soluzione fisiologica e attendere almeno 1 minuto. Questo indebolisce l'osso assottigliato e aiuta l'osso a staccarsi dalla dura dura. Scolare la soluzione salina in eccesso con un triangolo di cotone assorbente o aspirare.
- Sollevare con cautela il cranio assottigliato usando una pinza, evitando di danneggiare il tessuto sottostante.
- Usa una spugna emostatica per mantenere umido il cervello.
- Afferrare saldamente la finestra sui lati dorsale e ventrale con una pinza dentata e tirare direttamente lontano dal cranio. In caso di difficoltà nell'estrarre la finestra dal sito, fermarsi e riprendere la perforazione leggera fino a quando l'osso non è sufficientemente indebolito.
- Per le registrazioni μECoG nel topo, lasciare intatta la dura madre.
- Perforazione della finestra per craniotomia (Suggerimenti)
- Impianto di cemento e palo per un topo
- Inserire e fissare il filo di riferimento.
- Inserire l'estremità del filo d'argento ~1 mm nel foro della fresa, abbastanza da entrare in contatto con la superficie del cervello ma non causare sanguinamento.
- Applicare il cemento dentale in posizione mentre si applica il primo strato.
- Preparazione del cemento dentale
- Utilizzare un piatto di miscelazione in ceramica raffreddato per preparare la miscela di cemento dentale. Questo cemento si addensa rapidamente e richiede la preparazione regolare di una nuova miscela. Pulire la pirofila prima di preparare una nuova miscela.
NOTA: Il cemento non deve mai essere a diretto contatto con il cervello.
- Utilizzare un piatto di miscelazione in ceramica raffreddato per preparare la miscela di cemento dentale. Questo cemento si addensa rapidamente e richiede la preparazione regolare di una nuova miscela. Pulire la pirofila prima di preparare una nuova miscela.
- Applicazione del primo strato
- Applicare il primo strato di cemento intorno alla craniotomia e su tutto il cranio utilizzando micro applicatori. Questo strato funge da isolamento elettrico tra il cranio e la testata metallica.
- Circondare completamente la craniotomia con cemento, compresa la copertura laterale, per fornire una protezione adeguata per la craniotomia aperta e la griglia μECoG.
- Posizionamento della barra di testa in metallo
- Fissare la sezione grande della barra portatestina al suo supporto senza serrarla completamente.
- Posizionare la headbar come desiderato, posando la sezione sottile lungo la linea mediana del cranio a contatto con la superficie del cemento.
- Fissaggio dell'impianto
- Coprire la testata con cemento dentale e collegarla alla superficie del cemento.
- Rimozione del supporto
- Attendere qualche minuto affinché il cemento dentale si rafforzi.
- Una volta che la barra della testa è completamente fissata, rimuoverla rimuovendo prima la vite dal supporto. Quindi, ritrarre il supporto all'indietro, assicurandosi che non venga applicata alcuna forza alla barra portatestina.
- Inserire e fissare il filo di riferimento.
- Durotomia per chirurgia dei ratti
NOTA: Questo è un passaggio chirurgico impegnativo.- Sollevamento della dura madre
- Usando una pinza n. 5, tenuta il più parallela possibile alla superficie del cervello, sollevare una piccola parte della dura madre lontano dal cervello.
- Utilizzare un ago nuovo da 30 g (il più corto possibile) per strappare con cura la dura madre sollevata.
NOTA: La dura madre è uno strato sottile e trasparente di tessuto che si trova direttamente sopra il cervello. Viene rimosso per le registrazioni μECoG nei ratti. È fondamentale eseguire la durotomia senza disturbare la vascolarizzazione sulla superficie del cervello. I metodi consigliati per eseguire la durotomia includono l'uso di una pinza e di un ago da siringa per perforare la dura madre prima di tirarla indietro o l'uso di uno strumento duratome ancorato vicino al cranio per ritrarre con cura la dura dura.
- Resezione della dura madre
- Continua ad afferrare la dura madre con la pinza e sollevala dal cervello. Creare uno strappo diagonale con l'ago durante il sollevamento.
- Usa la pinza per staccare con cura la dura madre verso i lati della finestra craniotomica, assicurandoti che la superficie del cervello rimanga indisturbata.
- Sollevamento della dura madre
- Trasferimento del mouse alla configurazione per la registrazione elettrofisiologica
- Rimuovere l'animale dalla struttura chirurgica sollevando delicatamente il muso e gli incisivi dalla barra degli incisivi e quindi tirando indietro l'animale. Iniettare clorprotixene (1 mg/kg, intraperitoneale [IP]), un sedativo che consente di mantenere l'anestesia continua utilizzando una concentrazione inferiore di isoflurano.
- Posizionare il mouse nella configurazione di registrazione elettrofisiologica.
- Assicurarsi che il termoforo sia in posizione e funzioni correttamente.
- Testa fissare l'animale utilizzando la barra sulla testa sul supporto nella configurazione elettrofisiologica.
- Avvicinare la maschera all'isoflurano per coprire completamente il muso dell'animale.
- Regolazione dell'anestesia
- Ridurre gradualmente i livelli di anestesia allo 0,7-1% di isoflurano (con incrementi dello 0,5% al massimo ogni 5 minuti).
- Monitorare la frequenza respiratoria e i movimenti dell'animale.
NOTA: La frequenza respiratoria dovrebbe aumentare leggermente rispetto allo stato chirurgico, ma l'animale non dovrebbe muoversi. - Se l'animale è in movimento, aumentare immediatamente la concentrazione di isoflurano al 2% prima di riportarla lentamente a un livello più basso con incrementi dello 0,5%.
- Inserimento di baffi per stimolazione sensoriale
- Attacca le vibrisse del mouse al dispositivo di stimolazione dei baffi. In questo protocollo, inserire nove vibrisse in puntali corti per pipette da 10 μL, che sono collegati ad attuatori piezoelettrici che forniscono rapide deflessioni delle vibrisse.
3. Registrazione
- Installazione della rete
- Passaggi preliminari
- Accendere il sistema di registrazione e l'amplificatore.
- Controlla i segni vitali dell'animale.
- Procedimento
- Per posizionare l'animale e gli attrezzi, seguire i passaggi 3.1.2.2-3.1.2.4.
- Posiziona l'animale nella configurazione di registrazione e assicurati che la craniotomia rimanga umida applicando regolarmente una soluzione salina.
- Per un ratto, posizionare il micromanipolatore sulla ringhiera del rig, situata ben dietro il sito della craniotomia, per evitare interferenze.
- Per un topo, posizionare il micromanipolatore lateralmente al sito della craniotomia accanto all'animale.
- Per collegare e posizionare la griglia con il mouse, seguire i passaggi 3.1.2.6-3.1.2.12.
- Fissare la griglia μECoG all'headstage utilizzando i connettori ZIF-clip (connettore headstage). Tenere in posizione la scheda elettronica dell'headstage tramite una barra meccanica fissata a un micromanipolatore.
- Abbassare la griglia μECoG orizzontalmente per allinearla in piano sopra la craniotomia lungo l'asse anteroposteriore.
NOTA: Lungo l'asse laterale-mediale, il bordo della griglia dovrebbe essere vicino al bordo mediale della craniotomia. - Una volta che la griglia è posizionata vicino al cervello ma non a contatto con esso, collegare il filo di riferimento della griglia al perno d'argento impiantato-filo d'oro. Se necessario, collegare il filo di terra all'animale (ad es. a un muscolo scoperto) per ridurre il rumore elettrico.
- Inoltre, abbassa la griglia per contattare il cervello.
- Spostare la griglia lateralmente per "scivolare" sulla superficie umida della dura dura. Continuare la regolazione fino a quando la griglia non è centrata lungo l'asse mediolaterale.
- Utilizzare l'aspirazione o una spugna chirurgica attorno ai bordi della craniotomia per rimuovere la soluzione salina in eccesso.
- Una volta che la preparazione è leggermente più asciutta, assicurarsi che la griglia aderisca più saldamente alla dura madre e non scivoli sulla sua superficie. Quando è più asciutto, applicare un movimento laterale a mediale alla griglia flessibile, assicurando il contatto con la maggior parte degli elettrodi laterali. Il cavo flessibile della griglia si piegherà naturalmente per adattarsi al contorno del cervello.
- Per posizionare la griglia su un ratto, segui i passaggi 3.1.2.14-3.1.2.18.
- Fissare lo stelo della forcella di supporto nel micromanipolatore, assicurandosi che la scheda del connettore della griglia si sollevi contro il lato posteriore della finestra di craniotomia quando viene abbassata.
- Regolare la posizione del micromanipolatore sulla ringhiera in modo che la griglia si trovi all'incirca sopra il sito della craniotomia. Abbassa la griglia fino a quando non si libra vicino alla superficie del cervello. Inumidire la superficie del cervello con una piccola goccia di soluzione fisiologica.
- Eseguire questi passaggi utilizzando il microscopio. Utilizzando i quadranti del micromanipolatore, regolare la posizione della griglia fino a quando non si trova piatta contro la superficie del cervello al centro della craniotomia.
- Allontana l'umidità con cura utilizzando un triangolo di cotone assorbente senza toccare la griglia stessa. Assicurati che ogni riga della griglia sia a contatto con la superficie del cervello.
NOTA: La rimozione dell'umidità impedisce la diffusione passiva del segnale elettrico attraverso il fluido tra la superficie corticale e la griglia, che diffonde spazialmente il segnale rilevato all'elettrodo. - Utilizzando una pinza numero 2 o numero 5, inserire il filo di messa a terra della griglia nello stesso foro della fresa o inserire il filo di riferimento in un foro della fresa e il filo di terra nel tessuto muscolare vicino.
NOTA: I fili devono essere inseriti solo ~1 mm, abbastanza da entrare in contatto con il cervello ma non causare sanguinamento o traumi al cervello.
- Passaggi preliminari
- Controllo del posizionamento della griglia
- Monitoraggio dell'attività elettrofisiologica
- Osservare l'attività elettrofisiologica utilizzando il software di registrazione. In anestesia leggera, i segnali cerebrali sono variabili e possono mostrare una varietà di modelli.
- Il corretto collegamento dei cavi di rete, di riferimento e di terra dovrebbe produrre un elevato rapporto segnale/rumore, con ampiezze del segnale nell'intervallo di mV. Monitora il rumore nella gamma delle alte frequenze utilizzando il filtro passa-banda con Trodes (ad esempio, 100-6000 Hz) e assicurati che non superi alcune decine di microvolt (μV).
- Valutare la reattività sensoriale utilizzando il rumore (ad esempio, battito di mani o schiocco delle dita) per indurre potenziali elettrici di superficie corticale (CSEP) visibili correlati agli eventi.
NOTA: La stimolazione di un singolo baffo dovrebbe evocare un CSEP chiaro e nitido correlato all'evento solo in pochi canali (Mouse). - Verifica della posizione in griglia
- Per un ratto, verificare che la griglia sia posizionata correttamente sopra la corteccia uditiva. Il primo blocco registrato dovrebbe in genere essere uno stimolo di rumore bianco a 60 secondi impostato per verificare che la griglia registri una risposta corretta dal cervello. Eseguire registrazioni diagnostiche del rumore bianco e del tono con la griglia solo prima di inserire il politrodo per determinare se la griglia è stata posizionata correttamente e se c'è una risposta del segnale.
- Per un mouse, per verificare il posizionamento della griglia, eseguire una sessione di mappatura rapida con deflessioni di 20-30 baffi distanziate di 350 ms. Registra l'attività nella banda del potenziale di campo locale (LFP) utilizzando Trodes e analizzala offline con un codice MATLAB personalizzato per visualizzare l'estensione spaziale dell'attività evocata dai baffi.
- Riposizionamento
- Se la griglia richiede una regolazione, inumidire la superficie corticale con gocce di soluzione fisiologica sopra la griglia.
- Lasciare la soluzione salina per 30 s a 1 min prima di tentare di sollevare la griglia.
- Sollevare con cautela e lentamente la griglia.
- Riposizionarlo utilizzando i passaggi descritti nel passaggio 3.1.
- Monitoraggio dell'attività elettrofisiologica
- Politrodi laminari per un ratto
- Configurazione del politrodo
- Innanzitutto, collegare l'adattatore per headstage al lato posteriore del politrodo. Agganciare il connettore al terzo set di canali sulla scheda dell'adattatore. Assicurarsi che il segno nero sulla clip sia rivolto verso il lato destro dell'estremità commerciale del politrodo.
- Inserimento di politrodi
- Inserire il politrodo nel cervello fino a quando gli ultimi elettrodi (più in alto) sono visibili sopra la superficie corticale. Una discesa lenta (fino a 1 μm/s) migliora la qualità del segnale. Attendi 15 minuti, permettendo al cervello di adattarsi alla presenza del politrodo.
- Dopo 15 minuti, controllare se gli ultimi elettrodi sono entrati nella superficie corticale. In caso contrario, abbassare leggermente di più il politrodo e attendere altri 10 minuti prima di procedere.
- Configurazione del politrodo
- Posizionamento della sorgente di luce optogenetica su un mouse
- Utilizzare un sistema di viti di regolazione di precisione in tre dimensioni, montato su un braccio articolato, o un micromanipolatore per montare il supporto della fibra ottica.
- Per guidare la sorgente luminosa e facilitare il posizionamento della fibra, accendere la luce optogenetica a bassa intensità. Utilizzare il braccio articolato per posizionare grossolanamente la luce optogenetica verso l'area target.
- Metti a fuoco e regola la posizione della fibra utilizzando un micromanipolatore o viti di regolazione fine.
- Registrazione dei segnali
- Preparazione
- Scollegare tutte le luci, le prolunghe e i dispositivi di protezione da sovratensione non necessari nel banco chirurgico per ridurre le interferenze elettriche. Spegni le luci a soffitto nel rig.
- Chiudere la porta dello spazio di registrazione isolato e la porta della sala operatoria prima di iniziare l'esperimento.
- Avvio dell'acquisizione
- Per un ratto, avviare Synapse sulla piattaforma di registrazione/computer e confermare che l'acquisizione è funzionante visualizzando in anteprima e controllando i segnali. Suscita transitori di tensione grandi e taglienti nel segnale μECoG presentando stimoli vicino all'animale, ad esempio applaudendo.
- Per un mouse, avviare la sessione di registrazione in Trodes.
- Idratazione
- Iniettare nel ratto o nel topo per via sottocutanea rispettivamente 1 mL o 0,1 mL di soluzione fisiologica ogni 1-2 ore durante la registrazione per prevenire la disidratazione. Per un ratto, attendere 5-10 minuti dopo la somministrazione di soluzione salina prima di eseguire un nuovo blocco di registrazione.
- Set di stimoli
- Per un ratto, una volta confermato il sito di registrazione, procedere con la registrazione dei set di stimoli richiesti. Un set di esempio potrebbe includere
Rumore bianco (60 s)
Diagnostica del tono (5 min)
Tono puro (23 min)
Ondulazione dinamica in movimento
Tono 150 (15 min)
TIMIT (38 min) - Per un ratto, ripresentare la diagnostica del rumore bianco e del tono ogni volta che la griglia viene riposizionata.
- Stimoli tattili per un topo: fornisce stimoli tattili in una struttura di prova, con ogni prova contenente un treno di deflessioni casuali dei baffi ogni 350 ms. Nell'esempio fornito, ogni prova include 14 deflessioni presentate in 4500 ms.
- Stimoli optogenetici per un topo: in alcune prove, applicare un impulso quadrato di luce optogenetica per l'intera durata della prova (5 s). Determinare il livello di luce richiesto in base all'opsina utilizzata e alla profondità del tessuto da raggiungere utilizzando stime della penetranza luminosa (https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php)
- Per un ratto, una volta confermato il sito di registrazione, procedere con la registrazione dei set di stimoli richiesti. Un set di esempio potrebbe includere
- Preparazione
- Pulizia
- Sollevamento e pulizia della griglia
- Una volta terminata la registrazione, chiudere il software di registrazione e ricollegare le sorgenti luminose al rig.
- Se il cervello è asciutto, applicare una piccola goccia di soluzione salina sulla superficie del cervello usando una siringa. Lasciare la soluzione salina per 30 s a 1 min prima di tentare di sollevare la griglia.
- Lavorando al microscopio, sollevare delicatamente la griglia dalla superficie del cervello utilizzando micromanipolatori.
- Se è necessaria una forza aggiuntiva durante il sollevamento della griglia, utilizzare una pinza con punta in carbonio (chiusa) per sollevare delicatamente la griglia dal cervello. Assicurarsi che il movimento del micromanipolatore sia leggermente anteriore per staccare delicatamente la griglia dalla superficie del cervello.
- Una volta rimossa completamente la griglia, staccarla dalla forcella di presa e pulirla seguendo i passaggi 3.6.1.6-3.6.1.7.
- Immergere la griglia (esclusa la scheda di connessione) in un detergente enzimatico diluito (50% Enzolo, 50% acqua distillata) per almeno 1 ora. Successivamente, trasferiscilo in un secondo bagno di acqua distillata pura e lascialo asciugare all'aria in un luogo sicuro e pulito.
- Se alcune aree della griglia hanno depositato sangue o tessuto, utilizzare un triangolo di cotone imbevuto di soluzione enzimatica per pulirlo delicatamente.
- Una volta asciutta, rimettere la griglia nella sua scatola.
- Soppressione dell'animale
- Per un topo, rimuovere l'animale dal fissaggio della testa e metterlo nella camera di eutanasia. Aggiungere una garza con 5 ml di isoflurano e attendere 60 s dopo la cessazione della respirazione. Verificare la mancanza di riflesso di astinenza e decapitare usando forbici affilate.
- Per un ratto, iniettare 0,2 mL di pentobarbital IP. Attendi 60 secondi dopo la cessazione della respirazione, sdraia l'animale sulla schiena e usa una lama #11 per eseguire una doppia toracotomia.
- Pulizia dell'attrezzatura
- Portare tutti gli strumenti chirurgici nel lavandino del laboratorio e adagiarli su un asciugamano chirurgico. Spruzzare gli strumenti con una soluzione di candeggina al 10% e lavare accuratamente nel lavandino. Per gli strumenti più sporchi, lasciarli in ammollo in una soluzione di candeggina prima del lavaggio.
- In alternativa, utilizzare un detersivo in polvere (ad es. Contrex AP) con acqua strofinando gli strumenti con una spazzola nel lavandino.
- Una volta che gli strumenti sono puliti e risciacquati, puliscili con salviettine imbevute di alcol e riponili nel loro spazio di archiviazione.
- Sanificazione dell'area di lavoro
- Smaltire tutti gli aghi e le lame usati nel contenitore per oggetti taglienti.
- Smaltire i tamponi di cotone, i triangoli e le salviettine imbevute di alcol contaminati nel sacchetto per il rischio biologico.
- Pulire tutte le superfici di lavoro della sala di perforazione con alcool e pulire tutti gli strumenti prima di chiudere l'area di lavoro.
- Sollevamento e pulizia della griglia
Risultati
Abbiamo descritto i protocolli per la registrazione dei segnali elettrocorticografici combinati con metodi optogenetici e registrazioni laminari. Qui vengono presentati i segnali tipici ottenuti dalla corteccia somatosensoriale del topo (Figura 1, Figura 2 e Figura 3) e all'interno della corteccia uditiva dei ratti in risposta alla stimolazione sensoriale (Figura 4, Figura 5 e Figura 6).
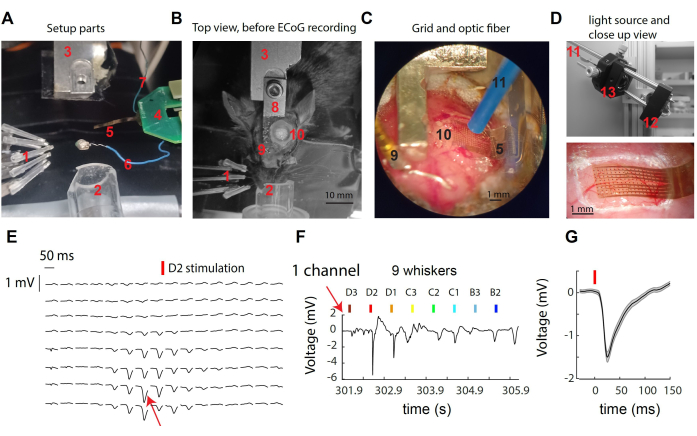
Figura 1: Registrazione di segnali μECoG sulla corteccia somatosensoriale del baffo del topo. (A) Componenti della configurazione. Vedi testo. (B) Vista dall'alto del setup chirurgico prima della registrazione μECoG, che mostra il posizionamento del poggiatesta e del sito della craniotomia. (C) Vista dettagliata della griglia μECoG e della fibra ottica posizionata sulla corteccia esposta. (D) In alto: la sorgente luminosa si trova all'esterno della scatola di registrazione. La luce di un LED da 473 nm viene raccolta nella fibra ottica attraverso un tandem di lenti. In basso: primo piano della griglia corticale sopra la corteccia del topo in un esempio di registrazione. (E) Tracce μECoG rappresentative da tutti i canali 16x8 che mostrano risposte medie di prova alla stimolazione D2 dei baffi. (F) Traccia di tensione grezza dal singolo canale indicato in (E) attraverso singole deflessioni di più baffi. Il canale ha mostrato la risposta più forte durante la stimolazione del baffo D2. (G) La risposta evocata media nelle prove nel singolo canale (E,F), che ha mostrato una forte deflessione di tensione dopo la stimolazione dei baffi. Clicca qui per visualizzare una versione più grande di questa figura.
La Figura 1A-D fornisce immagini di vari componenti del sistema utilizzato per la registrazione e per la manipolazione optogenetica nella corteccia S1 del topo. Gli elementi etichettati includono: 1- nove stimolatori di baffi indipendenti in un array 3 x 3, 2- cono nasale per anestesia con isoflurano, 3- supporto/controparte del perno della testa, PCB back-end da 4 μECoG, collegato al PCB dell'headstage con un doppio connettore ZIF; Griglia di elettrodi da 5 μECoG sulla punta di un cavo flessibile da 8 mm; 6- filo di riferimento; 7- filo di terra; 8- impianto del palo della testa; 9- perno d'oro di riferimento (isolato dal palo della testata con cemento dentale); 10- craniotomia sull'emisfero sinistro, sopra la corteccia del barilotto dei baffi S1; 11- fibra optogenetica di 1 mm di diametro (trattenuta da un micromanipolatore, non mostrata); 12- un LED a forma di stella pilotato da un driver LED (non raffigurato); 13- Raccolta della luce attraverso un tandem di lenti asferiche. Quando si stimola un singolo baffo, si osserva una rapida deflessione del potenziale superficiale in un piccolo numero di elettrodi (Figura 1E). Questo gruppo di elettrodi rappresenta il segnale locale che raggiunge il picco nella colonna corticale del baffostimolato 30. Osservando un singolo elettrodo, osserviamo la risposta più forte alla stimolazione dei suoi baffi preferiti e la risposta più debole o assente alla stimolazione dei baffi più distanti (Figura 1F). In questo esempio, l'inizio della deflessione si verifica circa 10 ms dopo la vibrazione dei baffi, con un'ampiezza media di 1 mV (Figura 1G).
La Figura 2 presenta esempi di registrazioni durante l'inibizione optogenetica. La luce può raggiungere il tessuto corticale attraverso il substrato trasparente della griglia (Figura 2A). Tuttavia, quando si utilizza una fibra di grande diametro o qualsiasi fonte di luce spazialmente ampia, i fotoni colpiscono anche gli elettrodi, producendo un artefatto optoelettrico (Figura 2B). In questo protocollo di inibizione, abbiamo utilizzato un impulso di luce quadrato lungo 5 s. Gli artefatti optoelettrici risultanti sono presenti solo all'inizio e all'offset della luce. In un animale senza opsina, la stimolazione dei baffi presentata durante la luce accesa non evoca una risposta diversa dalla stimolazione dei baffi presentata nelle prove con la luce spenta (Figura 2C). Al contrario, la stimolazione luminosa dell'opsina inibitoria in una sottopopolazione di neuroni eccitatori porta a una diminuzione dell'ampiezza della risposta evocata sensorialmente (Figura 2D)
Le figure 2C, D presentano esempi di soppressione optogenetica nel dominio tempo-frequenza. Per analizzare i dati μECoG, applichiamo prima un riferimento medio comune (CAR) per rimuovere i segnali che sono indifferenziati tra gli elettrodi (ad esempio, la respirazione) seguito da una trasformata wavelet Morse, che rivela bande di frequenza attive nel tempo. L'attività neurale nel dominio della frequenza mostra tipicamente una legge di potenza approssimata di 1/f 2,3. Per rivelare il segnale evocato sensoriale in modo più uniforme nel dominio della frequenza, applichiamo lo Z-scoring separatamente per ciascuna banda di frequenza. Lo Z-scoring si basa sulle statistiche del segnale durante le epoche di base. In questo caso, utilizziamo una finestra temporale che precede lo stimolo, da -3000 ms a -1000 ms prima dell'inizio della prova. Questo processo produce lo Z-score evocato dallo stimolo per ciascuna banda di frequenza (Figura 2C, D).
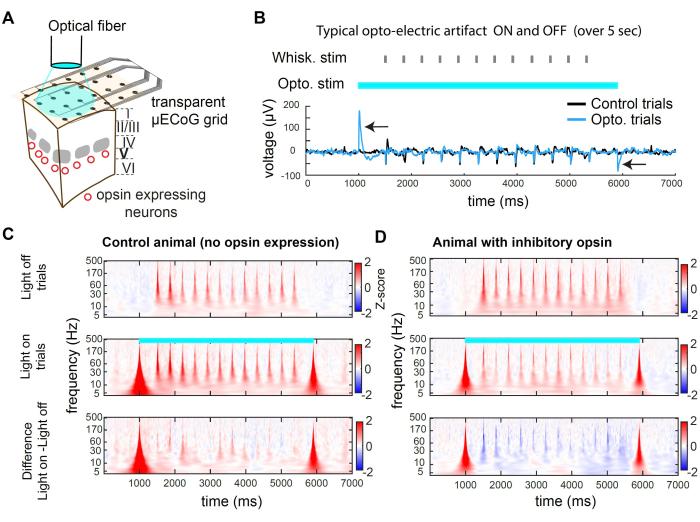
Figura 2: Soppressione optogenetica in wS1 durante la registrazione μECoG nei topi. (A) Schema di un esperimento optogenetico rappresentativo. Una fibra ottica è puntata direttamente verso il cervello, consentendo l'inibizione transitoria della popolazione neuronale che esprime un'opsina inibitoria. (B) Traccia di tensione registrata nel canale al centro della stimolazione optogenetica, mediata tra le prove. La freccia nera indica gli artefatti optoelettrici all'inizio e all'offset della luce a 473 nm. Si noti la risposta alla deflessione dei baffi (identità casuale dei baffi) nel mezzo del processo. L'artefatto è transitorio e non influisce sulla registrazione dell'attività evocata sensorialmente dopo un ritardo (qui 500 ms). (C) Spettrogramma medio di un canale di esempio in prove di luce spenta, prove di luce accesa e la differenza tra i due, in un animale in cui non è stata espressa opsina. Si noti che l'effetto optoelettrico induce un artefatto transitorio a banda larga e la risposta evocata dai baffi non è influenzata dalla luce. (D) Esempio di spettrogramma mediato in prove light-off, prove light-on e la differenza tra i due in un topo Rbp4-Cre32 in cui st-GtACR2.0 era espresso nei neuroni eccitatori dello strato 5. Si noti la soppressione della risposta evocata dai baffi nello spettrogramma. Clicca qui per visualizzare una versione più grande di questa figura.
La Figura 3 mostra le variazioni facili da implementare nel sistema di erogazione della luce. Utilizzando una fibra ottica più piccola, o una semplice lente, è possibile mirare un'area specifica della corteccia15. La luce che esce dalla fibra diverge rapidamente e raggiunge il tessuto corticale oltre l'area mirata. Incorporando una lente asferica (f = 16 mm) all'uscita della fibra ottica, è possibile focalizzare la luce su una superficie più piccola (Figura 3A, C), fino a circa il diametro di una singola colonna corticale (Figura 3C). La luce è anche meno divergente all'interno della corteccia. Idealmente, utilizzando un laser o una potente fonte di luce con un set tandem di lenti, è possibile puntare una singola colonna corticale con un raggio di luce collimato. Tuttavia, è importante considerare che la luce si disperderà all'interno del tessuto, il che potrebbe illuminare parzialmente le colonne vicine. L'artefatto luminoso misurato nei dati μECoG rivelerà dove la luce è stata erogata sulla superficie corticale; vedere il confronto tra la Figura 3B e la Figura 3D. L'artefatto luminoso viene misurato come potenza di picco in una gamma di alte frequenze (65-500 Hz) 5 ms dopo l'inizio della luce.

Figura 3: Erogazione di luce ai punti focali della corteccia. (A) La luce proveniente dalla fibra ottica di 1 mm di diametro è focalizzata sulla superficie del cervello. Questa semplice regolazione consente un targeting più preciso della luce sulla superficie cerebrale e all'interno del tessuto. (B) L'estensione spaziale della luce fornita al cervello è misurata dall'artefatto optoelettrico. (C, D) L'impostazione è come nei pannelli A,B con una fibra ottica da 200 μm, che gli consente di mirare direttamente a un'area di 250 μm di diametro, all'incirca delle dimensioni di una colonna corticale. Clicca qui per visualizzare una versione più grande di questa figura.
Registrazioni di μECoG di ratto e politrodo laminare
La Figura 4A-D fornisce immagini di vari componenti del sistema utilizzato per le registrazioni della corteccia uditiva primaria di ratto. In particolare, gli elementi etichettati includono: (1) micromanipolatore μECoG, (2) rig stereotassico per roditori, (3) cavo μECoG con connettori ZIF-clip, (4) micromanipolatore in politrodo laminare, (5) cono del naso di ratto e apparecchio per la stabilizzazione della testa, (6) altoparlante elettrostatico per la presentazione dello stimolo, (7) cavo in politrodo laminare con adattatore ZIF-clip, (8) clip μECoGZIF fissata da una forchetta a due punte, (9) dispositivo in politrodo a 32 canali, (10) altoparlante elettrostatico, (11) clip a coccodrillo per tenere aperto il sito chirurgico, (12) fili di messa a terra, uno inserito nella corteccia attraverso i fori di bava nel quadrante posteriore sinistro o nel quadrante anteriore destro e un altro è collegato a terra al tessuto, (13) vista ravvicinata della griglia μECoG, (14) vista ravvicinata del politrodo inserito. La Figura 4E mostra lo spettrogramma neurale medio derivato dai potenziali elettrici registrati di un singolo elettrodo μECoG in risposta a 50 ms di pip di tono della stessa frequenza e attenuazione (N = 20 prove). Attraverso le frequenze, la risposta evocata mostra un picco acuto tra 25 ms e 30 ms (indicato da linee continue rosse) dopo l'inizio dello stimolo (linea tratteggiata grigia sinistra). La risposta apparente che precede l'insorgenza dello stimolo (apparentemente acausale) è dovuta all'ampia larghezza di banda alle frequenze più basse della trasformata Q costante, che attenua (acausale, ma non l'offset di fase) piuttosto che filtra (causale, ma induce un offset di fase) il segnale. Pertanto, il tempo della risposta di picco rimane accurato. Al momento della risposta evocata di picco, abbiamo osservato che il potenziale elettrico della superficie corticale (CSEP) con punteggio z era multimodale attraverso le frequenze. In particolare, ha mostrato tre picchi primari non armonici: il primo e il più grande nell'intervallo 40-180 Hz gamma/high-gamma (γ/Hγ), il secondo nell'intervallo 200-450 Hz ultrahigh-gamma (uHγ) e un picco finale superiore a 500 Hz associato all'attività multi-unità (MUA) (Figura 4F)11. Questa struttura multimodale evocata dallo stimolo è robusta su tutti gli elettrodi sintonizzati. Qui, ci concentriamo sull'Hγ a causa della sua prevalenza nelle registrazioni dell'elettrocorticografia umana (ECoG)31. Nella Figura 4G, mostriamo un array di μECoG che è stato posizionato subduralmente accanto a un politrodo laminare di silicio per misurare simultaneamente i potenziali elettrici della superficie corticale (CSEP) e l'attività di picco attraverso le lamine corticali. L'array μECoG fabbricato su misura consisteva in 8×16 elettrodi con un passo di 20 μm e un diametro di contatto di 4 μm, e abbiamo utilizzato un politrodo laminare a 32 canali configurato come 2 × 16 canali con un passo di 4 μm e un diametro di contatto di 1 μm. L'array μECoG era sufficientemente grande da coprire l'intera corteccia uditiva primaria del ratto (A1) e i suoi piccoli elettrodi di diametro di 4 μm consentivano la misurazione di CSEP locali adatti per derivare la sintonizzazione uditiva. La risoluzione spaziale del segnale μECoG ad alta gamma (Hγ) è di ~20 μm, paragonabile al raggio di una colonna corticale di ratto. Pertanto, μECoG fornisce una "visione colonnare" dell'attività corticale. Le perforazioni nella griglia μECoG hanno permesso al politrodo laminare di passare tra i contatti superficiali, consentendo la registrazione diretta dell'attività neuronale attraverso le lamine corticali (Figura 4H). Esempi di tracce di tensione registrate da μECoG e da elettrodi laminari in politrodo sono mostrate nella Figura 4I.

Figura 4: Registrazione di segnali μECoG e politrodi laminari sulla corteccia uditiva primaria del ratto (A1). (A) Componenti del μECoG e della configurazione del politrodo laminare. Vedi testo. (B) Vista dall'alto del setup chirurgico prima della registrazione del μECoG e del politrodo laminare, che mostra il posizionamento del poggiatesta e del sito della craniotomia. (C) Vista dettagliata della griglia μECoG e del politrodo laminare sulla corteccia uditiva esposta. (D) Una vista ravvicinata del posizionamento della griglia μECoG sulla corteccia, comprese le dimensioni dei singoli elettrodi (40 μm) e tra gli elettrodi (200 μm). (E) Decomposizione wavelet media z-scored di una risposta a canale singolo a una singola coppia di attenuazione di frequenza. Le linee rosse verticali indicano il periodo di risposta in frequenza di picco mostrato in F.(F) Rosso- Risposta in frequenza di picco media in 20 presentazioni di una singola coppia di attenuazione in frequenza. Grigio: errore standard. L'asse delle frequenze è su una scala logaritmica. Le bande di frequenza neurale canoniche sono indicate nella parte superiore. (G) Microfotografia di una griglia di 8 μECoG sulla superficie della corteccia uditiva primaria di ratto (A1). Un politrodo laminare a 32 canali è stato inserito nella finestra centrale μECoG. (H) Schema della registrazione 3D multiscala dell'attività corticale. (I) In alto: Spettrogramma di 50 ms di pip di tono puro. Al centro: in rosso, il potenziale elettrico medio della superficie corticale di 4 μECoG di elettrodi (grigio). In basso: le tracce di tensione in politrodo laminare a 32 canali sono disposte in base alla profondità corticale Fare clic qui per visualizzare una versione più grande di questa figura.
La Figura 5 mostra la registrazione di segnali μECoG simultaneamente a un'attività di spiking utilizzando un politrodo di silicio laminare (Camb64). Il segnale μECoG, registrato da un elettrodo di superficie, viene mostrato come una traccia di tensione grezza (Figura 5A) e la sua trasformata wavelet, evidenziando la decomposizione della frequenza nel tempo (Figura 5B). L'attività multi-unità è stata registrata utilizzando il politrodo, come illustrato da una traccia di tensione grezza rappresentativa da un singolo canale (Figura 5C), dove i potenziali d'azione individuali (picchi) sono stati rilevati utilizzando un semplice metodo di soglia (tensione che attraversa una soglia di -120 μV). Le forme d'onda spike estratte da questo canale sono ben definite per la maggior parte dei picchi, sebbene possano provenire da più fonti di neuroni (Figura 5D, riquadro). Su più canali nella stessa penetrazione, le forme d'onda medie dei picchi confermano ulteriormente la coerenza delle registrazioni dell'attività di picco ben definite (Figura 5E). Pertanto, questi metodi di registrazione potrebbero supportare la registrazione di singole unità con l'analisi dell'ordinamento dei picchi e l'analisi di metriche di qualità come l'intervallo tra i picchi o i tassi di attivazione (Figura 5F). In sintesi, la qualità delle registrazioni della sonda laminare è buona, con una chiara morfologia della forma d'onda sui singoli canali. Questi risultati illustrano che questo metodo consente l'acquisizione simultanea di μECoG e attività di spiking.

Figura 5: Registrazioni simultanee di μECoG e attività di spiking colonnare. (A) Esempio di traccia di tensione grezza da un singolo canale μECoG. (B) Trasformata wavelet dello stesso canale μECoG, che mostra la decomposizione della frequenza nel tempo. (C) Esempio di traccia di tensione grezza da un singolo canale politrodico (sonda acuta al silicio a 64 canali camb64), che mostra i potenziali d'azione (picchi) rilevati utilizzando una semplice soglia di tensione. (D) Forme d'onda spike estratte dal canale politrodico in (C) allineate e codificate a colori in base alla distribuzione dell'ampiezza della tensione. 7 delle 142 forme d'onda dei picchi non sono mostrate, poiché sono state considerate valori anomali in base alla loro distanza dal cluster principale in larghezza e ampiezza dei picchi (vedi riquadro). (E) Forme d'onda di picco medie multi-unità estratte da 9 canali nella stessa penetrazione. (F) Istogrammi dell'intervallo tra i picchi (ISI) per diversi canali politrodici (ad esempio, canali 21, 27, 63 e 61), con corrispondenti velocità di sparo (FR) indicate in Hz. Le violazioni ISI (< 5 ms) rappresentavano meno del 5% dei picchi in tutte le unità. Clicca qui per visualizzare una versione più grande di questa figura.
Con la capacità di eseguire registrazioni simultanee utilizzando l'array μECoG progettato su misura e il politrodo laminare, abbiamo studiato il confronto tra i segnali μECoG e le registrazioni di unità neurali in profondità corticale in termini di sintonizzazione uditiva. La Figura 6A presenta i grafici dell'ampiezza frequenza-risposta (FRA), che descrivono la risposta ad alta gamma (Hγ) in funzione della frequenza e dell'ampiezza dello stimolo uditivo. Il pannello superiore mostra i FRA da un sottoinsieme di 2 × 16 di elettrodi μECoG posizionati sulla corteccia uditiva, mentre il pannello inferiore mostra i FRA da un sottoinsieme di 1×16 di elettrodi politrodi laminari inseriti attraverso le perforazioni dell'array μECoG (indicati da frecce grigie). Sorprendentemente, i FRA ottenuti dagli elettrodi μECoG assomigliano molto a quelli delle registrazioni dei politrodi laminari, suggerendo che i segnali μECoG sono sintonizzati in modo simile all'attività dell'unità neurale attraverso gli strati corticali.
Sfruttando l'elevata risoluzione spaziale dell'array μECoG, abbiamo generato una mappa tonotopica ad alta risoluzione di più campi corticali uditivi basata sull'attività Hγ11. Nella Figura 6B, la frequenza migliore di ciascun elettrodo è codificata a colori, rivelando l'organizzazione tonotopica sulla superficie corticale. L'array da 8 × 16 μECoG copriva diversi campi corticali uditivi, tra cui la corteccia uditiva primaria (A1), il campo uditivo posteriore (PAF) e il campo uditivo ventrale (VAF), con confini approssimativi delimitati da linee nere. Questa mappatura dettagliata sottolinea la capacità dell'array μECoG di fornire una "vista colonnare" dell'attività corticale, catturando l'organizzazione funzionale con una risoluzione spaziale inferiore a 20 μm, paragonabile alle dimensioni di una colonna corticale di ratto. Questi risultati dimostrano che le registrazioni μECoG non solo riflettono le proprietà di regolazione osservate nelle registrazioni di unità neurali in profondità corticale, ma consentono anche una mappatura ad alta risoluzione dell'organizzazione corticale funzionale.
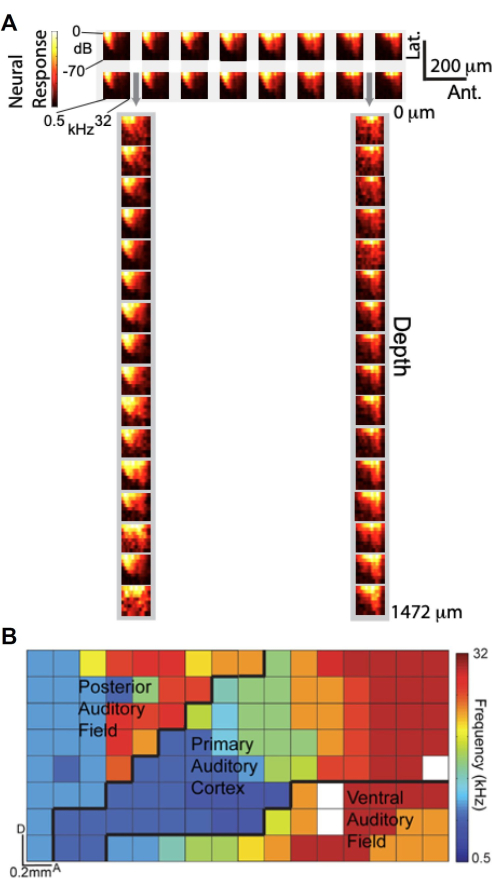
Figura 6. I segnali μECoG sono sintonizzati in modo simile alle registrazioni dei picchi delle unità neurali in profondità e rivelano l'organizzazione tonotopica della corteccia uditiva. (A) Grafici di ampiezza frequenza-risposta (FRA), che mostrano la risposta ad alta gamma (barra di colore) in funzione della frequenza (asse x) e dell'ampiezza (asse y) dello stimolo uditivo. (inizio) FRA da 2 16 sottogruppi di elettrodi μECoG sulla corteccia uditiva; (in basso) FRA da 1 16 sottoinsieme di elettrodi laminari in politrodo inseriti attraverso perforazioni nell'array μECoG, indicati da frecce grigie. (B) Organizzazione tonotopica ad alta risoluzione di più campi corticali uditivi derivati da attività ad alta gamma. Ogni pixel è codificato a colori in base alla migliore frequenza di quell'elettrodo. L'array 8x16 μECoG qui visualizzato copre più campi corticali uditivi (A1, PAF e VAF) e i confini approssimativi sono delimitati (linee nere). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
I protocolli qui descritti consentono l'integrazione di array di micro-elettrocorticografia ad alta densità (μECoG) con sonde laminari e tecniche optogenetiche. La facilità d'uso di questo protocollo nei modelli di roditori lo rende un potente strumento per l'indagine della dinamica corticale e il numero di soggetti può essere facilmente aumentato. La griglia μECoG ad alta densità consente una mappatura efficiente e spazialmente precisa della topografia corticale in più aree in topi e ratti, sfruttando il ruolo critico delle rappresentazioni topografiche nell'organizzazione del cervello33. L'aggiunta della registrazione laminare consente l'esame delle dinamiche corticali su più scale spaziali e temporali. L'inclusione dell'optogenetica consente la manipolazione causale per determinare le relazioni tra specifiche popolazioni neurali e i loro contributi ai potenziali evocati di superficie corticale (CSEP) e all'elaborazione corticale34.
L'optogenetica consente la modulazione selettiva di specifiche popolazioni neuronali, consentendo lo studio dei loro ruoli causali nella generazione di modelli di attività corticale e partecipando al calcolo le cui firme possono essere rilevate con μECoG. Ad esempio, i nostri studi dimostrano che il targeting di un tipo specifico di cellula può alterare i potenziali elettrici della superficie corticale (CSEP). Questo approccio potrebbe essere utilizzato per sezionare la base del tipo di cellula neurale dei segnali μECoG, permettendoci di identificare quali tipi di cellule neuronali contribuiscono alle caratteristiche attività evocate sensorialmente, come quelle osservate nella banda ad alta gamma. Altri fenomeni su larga scala, come i ritmi corticali in diverse bande di frequenza21, o l'attività spazialmente organizzata, comprese le onde viaggianti35,36, potrebbero essere studiati in modo simile. Inoltre, è prontamente disponibile una gamma di linee di topi e opsine geneticamente modificati, che offrono l'opportunità di esplorare specifici meccanismi circuitali. Le tecniche optogenetiche potrebbero essere impiegate per esaminare gli effetti funzionali delle connessioni orizzontali tra le colonne37, che svolgono un ruolo cruciale in vari calcoli sensoriali, come la soppressione del surround38 o il legame percettivo39. In sintesi, la capacità di manipolare l'attività neuronale attraverso l'optogenetica consente di testare i legami tra specifiche popolazioni neuronali e le proprietà dei CSEP o tra la popolazione e specifici calcoli corticali misurabili con μECoG. Questo approccio potrebbe analizzare efficacemente le relazioni tra le strutture neurali locali e l'attività corticale globale.
Le registrazioni di politrodi laminari consentono il campionamento dell'attività di un singolo neurone da più neuroni all'interno di piccoli volumi corticali, cioè all'interno di una singola colonna corticale. Queste registrazioni sono cruciali perché i singoli neuroni possono codificare in modo indipendente informazioni distinte, impiegando la codifica selettiva di stimoli - come i "neuroni di Jennifer Aniston" descritti da Quiroga et al.40 - o fornendo rappresentazioni complementari in uno spazio dimensionale superiore, come si vede nella selettività mista41. Tradizionalmente, gli elettrofisiologi hanno studiato l'attività neurale nel contesto di stimoli e comportamenti semplici e progettati parametricamente (ad esempio, la deflessione di un singolo baffo o toni puri, come illustrato qui). La rappresentazione di tali stimoli tende ad essere abbastanza localizzata spazialmente (ad esempio, singole colonne). Tuttavia, molti stimoli e comportamenti etologicamente rilevanti sono più complessi e, come tali, i modelli tipici di attività neurale durante tali paradigmi spesso si estendono oltre le singole colonne, anche in tutto il cervello42. In questi casi, μECoG offre una lettura completa che cattura l'attività risolta colonnare ad alta risoluzione temporale su più colonne contemporaneamente. In sintesi, il protocollo qui descritto colma efficacemente il divario tra l'elaborazione locale all'interno delle singole colonne corticali e le dinamiche più estese che si verificano su più colonne in un'intera area corticale e tra aree.
Come guida generale e risoluzione dei problemi, proponiamo alcune raccomandazioni. I protocolli elettrofisiologici acuti in vivo convenzionali in genere consigliano di mantenere il cervello umido durante l'esposizione come mezzo per prolungare la salute del cervello esposto. Mentre questo è probabilmente utile in alcune circostanze, la nostra esperienza suggerisce che il contrario è vero per le registrazioni μECoG nei roditori. In effetti, abbiamo scoperto che la qualità della registrazione era qualitativamente migliore quando gli array μECoG erano posizionati su una superficie corticale leggermente asciutta. Riteniamo che ciò derivi dal fatto che la presenza di soluzione salina, una soluzione ionica altamente conduttiva posizionata tra la superficie corticale e gli elettrodi di registrazione, omogeneizza i segnali elettrici generati dal cervello. In effetti, la soluzione salina "cortocircuita" gli elettrodi insieme. Poiché le griglie μECoG monitorano il campo elettrico continuo generato dalle popolazioni di neuroni, è importante garantire che i sistemi elettrofisiologici siano ben assemblati e privi di rumore. Durante le registrazioni, il collegamento con l'elettrodo di riferimento è fondamentale. Senza miglioramenti durante la registrazione, la pre-elaborazione dei dati può incorporare un filtro notch a 50 Hz o 60 Hz per rimuovere il rumore di linea. Tuttavia, questo modificherà drasticamente il segnale e quindi deve essere preso in considerazione nelle analisi successive. Considerando la stimolazione optogenetica della luce, l'artefatto optoelettrico deve essere minimizzato o almeno preso in considerazione nel disegno sperimentale (ad esempio, includendo un ritardo dopo l'insorgenza o l'offset della luce). Idealmente, la luce viene erogata nell'area tra gli elettrodi utilizzando un piccolo diametro della fibra ottica, oppure focalizzando o collimando la luce. Se questo artefatto non può essere completamente evitato (ma si vedano gli studi che propongono diversi modelli di sonda 15,20,43 inclusi elettrodi trasparenti), può essere ridotto utilizzando la minor quantità di luce necessaria. Le opsine di nuova generazione richiedono meno luce per essere efficaci44,45. Si consiglia di calibrare la potenza luminosa optogenetica prima dell'esperimento utilizzando sonde laminari. La forma dell'artefatto può anche essere modificata e ridotta evitando transizioni brusche nello stimolo luminoso (ad esempio, utilizzando una rampa luminosa invece di un impulso quadrato). In ogni caso, le condizioni di controllo che utilizzano animali che non esprimono opsine sono consigliabili per differenziare i cambiamenti reali nell'attività neurale dai segnali correlati agli artefatti. Infine, il processo di elettrodeposizione crea un rivestimento ruvido e ad alta area superficiale che migliora il trasferimento di carica tra elettrodo e tessuto mantenendo la stabilità meccanica durante le registrazioni, riducendo l'impedenza dell'elettrodo di 1-2 ordini di grandezza rispetto al platino nudo e consentendo un migliore rilevamento del segnale neurale46.
La μECoG acuta offre flessibilità e complessità ridotta nelle configurazioni sperimentali, consentendo una mappatura dettagliata dell'attività neurale nel corso di decine di minuti di registrazioni. Come metodo a mesoscala, consente un tracciamento inter-areale ma non dell'intero cervello dell'attività corticale, sebbene le fonti esatte dei segnali rimangano incerte 1,47. In futuro, gli studi multimodali dovrebbero fornire un quadro migliore dell'origine del segnale. La μECoG acuta è limitata nel catturare le dinamiche neurali a lungo termine e può essere influenzata da fattori transitori come il recupero chirurgico o l'anestesia48,49. Al contrario, la μECoG cronica consente un'osservazione prolungata dell'attività neurale, fornendo informazioni su processi come l'apprendimento, la plasticità e la progressione della malattia10,13. La μECoG cronica presenta anche sfide come la stabilità degli elettrodi, la potenziale degradazione del segnale e i rischi associati all'impianto a lungo termine, tra cui cicatrici tissutali o infezioni50,51. Queste sfide tendono ad essere meno gravi rispetto agli elettrodi penetranti e si suppone che siano ulteriormente ridotte con l'impianto epidurale del μECoG nei topi (al costo di una minore qualità del segnale)52. È possibile riutilizzare la stessa griglia μECoG in più sessioni nello stesso animale o in animali diversi, rimuovendo la griglia alla fine di una sessione e sostituendola nella sessione successiva. In questa configurazione sub-acuta, il cervello deve essere mantenuto sempre umido e protetto con un vetrino coprioggetti tra una sessione e l'altra. Abbiamo osservato che le griglie μECoG sono abbastanza resistenti; Una singola griglia può essere riutilizzata ~20 volte con una corretta manipolazione e pulizia, rendendoli dispositivi di registrazione convenienti. Le griglie possono essere progettate con diversi numeri e geometrie di layout degli elettrodi. I risultati suggeriscono che la riduzione del passo degli elettrodi a <200 μm si traduce in miglioramenti solo trascurabili nella risoluzione funzionale a causa della granularità delle rappresentazioni neurali nella corteccia sottostante.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato supportato dal Lawrence Berkeley National Laboratory LDRD for the Neural Systems and Machine Learning Lab (K.E.B.), NINDSR01 NS118648A (K.E.B.& D.E.F.) e NINDS R01 NS092367 (D.E.F.).
Materiali
| Name | Company | Catalog Number | Comments |
| 1 disposable #11 blade | Swann Morton | 303 | For surgical procedures |
| 2 disposable #10 blades | Swann Morton | 3901 | For surgical procedures |
| 30 mm cage bars | Thorlabs | ER | cage components |
| 30 mm cage plate | Thorlabs | CP33T | holding the lenses |
| 70% ethanol | Decon Labs | V1016 | Cleaning / Disinfectant (diluted to 70%) |
| Amalgambond PLUS Adjustable Precision Applicator Brush Teal 200/Bx | Henry Schein | 1869563 | precision applicator for the cement |
| Amalgambond PLUS Catalyst 0.7 mL Syringe Ea | Henry Schein | 1861119 | cement component |
| Amplifier (Tucker-Davis Technologies) | Tucker-Davis Technologies | PZ5M-512 | Used for auditory stimulus and recording software. |
| Articulated arm | Noga | DG60103 | for holding the fine adjustment screw system |
| Aspheric lenses for light collection (and one for focusing the light) | Thorlabs | ACL25416U-B | for collecting LED light |
| Auditory equipment | Tucker-Davis Technologies, Sony, Cortera | RP2.1 Enhanced Real-Time Processor/HB7 Headphone Drive | Used for auditory stimulus and recording software. |
| Buprenorphine | Sterile Products LLC | #42023017905 | General analgesia |
| C&B Metabond Base Cement Ea | Henry Schein | 1864477 | cement component |
| C&B Metabond L-Powder Cement Clear 3 g | Henry Schein | 1861068 | cement component |
| Chlorprothixene hydrochloride (mouse) | Sigma Aldrich | Cat. No. C1671 | For sedation, must be prepared the same day and kept at 4 |
| Custom-designed 128-channel micro-electrocorticography (μECoG) grids | Neuronexus | E128-200-8-40-HZ64 | For neurophysiology recordings. Placed onto the cortex. |
| Dengofoam gelatin sponges | Dengen dental | 600034 (SKU) | can be used dry or wet, saturated with sterile sodium chloride solution |
| Drill bit, size 5 to 9 (Mouse) | Fine Science Tools | 19007-XX | XX is the size of the drill bit e.g. 05 or 09. For mouse procedures |
| Drill bitSteel Round Bur (5.5 mm/7.5 mm) | LZQ Tools | Dental Bar Drill Bit Stainless Steel Bur | For rat procedures |
| Dumont No. 5 forceps | Fine Science Tools | 11251-10 | For surgical procedures |
| Dumont tweezers #5 bent 45° | World precision instruments | 14101 | for removing craniotomy window |
| DVD Player (Sony) | Sony | CDP-C345 | System used to accept and play back stimulus sets |
| Electrostatic Speaker | Sony | XS-162ES | Used for auditory stimulus and recording software. Located within the rig, plays sound to the sedated rodent |
| Enzymatic detergent (Enzol) | Advanced sterilization products | 2252 | Cleaning/Disinfectant |
| EverEdge 2.0 Scaler Sickle Double End H6/H7 #9 | Henry Schein | 6011862 | for scrubing the skull |
| Fine adjustment screw system in 3 dimension | Narishige | U-3C | for precise positioning of the optical fiber end |
| Gold pin | Harwin Inc | G125-1020005 | Used for contact reference in mouse Soldered to the silver wire |
| Gripping forceps | Fine Science Tools | 00632-11 | For surgical procedures |
| Isoflurane | Covetrus | 11695067772 | require a vaporizer |
| Ketamine (Hydrochloride Injection) (Rat) | Dechra | 17033-101-10 | Anesthesia/Analgesic |
| LED | New Energy | LED XLAMP XPE2 BLUE STARBOARD | Blue LED light source |
| LED driver | Thorlabs | LEDD1B | LED driver |
| Lidocaine | Covetrus | VINB-0024-6800 | to be diluted to 1% in saline |
| Meloxicam | Covetrus | 6451603845 | Anti-inflammatory used for general analgesia |
| Micromanipulator | Narishige (Stereotaxic Rig) | SR-6R + SR-10R-HT components | Used to manipulate ECoG and rodent with fine movements |
| No. 2 forceps | Fine Science Tools | 91117-10 | For surgical procedures |
| No. 55 forceps | Fine Science Tools | 1129551 | For surgical procedures |
| Ophtalmic lubricant (Artificial tears) | Akorn | 17478-062-35 | Used to protect eyes from dessication during surgical procedures |
| Optical fiber 200µm Core diameter | Thorlabs | M133L02 | FC/PC connector 2 m long |
| Pentobarbital (Rat) | Covetrus / Dechra | VINV-C0II-0008 | Anesthesia/Analgesic |
| Platinum Black | Sigma | 205915-250MG | For neurophysiology recordings (Used for electroplating the contacts on the μECoG grids). |
| Povidone Iodine 10% | Betadine | https://betadine.com/medical-professionals/betadine-solution/ | no catalog number ( not retail ) |
| Powder detergent (Contrex AP) | Decon Labs | 5204 | Cleaning / Disinfectant |
| Pre-cut tape for oxygen tube | ULINE (Various Providers) | S-14726 | Used to attach oxygen tube to the nose-cone of the rodent stereotaxic rig |
| Scalpel handle # 3 | World precision instruments | 500236-G | for blades # 10, #11 and #15 |
| Scraper | Fine Science Tools | 1007516 | For surgical procedures |
| Short 30 G needles | ExelInt | 26437 | For surgical procedures and injections |
| Silver Wire | Warner Instruments | 63-1319 | For neurophysiology recordings (Used for grounding and as a reference electrode). |
| Sterilized saline (0.9% sodium chloride for injection) | Hospira | 00409-7101-67 (NDC) | For dilution of injectable, and replacement of body fluids |
| Stoelting Hopkins Bulldog | Fine Science Tools | 10-000-481 | For surgical procedures |
| Surface disinfectant (Coverage Plus NDP Disinfectant) | Steris life science | 638708 | Cleaning/Disinfectant |
| TDT ZIF-clip connectors for acquisition. | Tucker-Davis Technologies | ZIF-Clip Analog Headstages | Connects ECoG with outside acquisition equipement |
| Two-pronged holding fork | Tucker-Davis Technologies | Z-ROD128 | Used to connect the TDT-clips with the micromanipulator |
| Xylazine (Rat) | Covetrus | 1XYL006 | Anesthesia/Analgesic |
Riferimenti
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nunez, P. L., Srinivasan, R. . Electric Fields of the Brain: The Neurophysics of EEG. , (2006).
- Mountcastle, V. B., Powell, T. P. Central nervous mechanisms subserving position sense and kinesthesis. Bull Johns Hopkins Hosp. 105, 173-200 (1959).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci. 18 (2), 310-315 (2015).
- Lewis, C. M., Bosman, C. A., Womelsdorf, T., Fries, P. Stimulus-induced visual cortical networks are recapitulated by spontaneous local and interareal synchronization. Proc Natl Acad Sci U S A. 113 (5), E606-E615 (2016).
- Bouchard, K. E., Mesgarani, N., Johnson, K., Chang, E. F. Functional organization of human sensorimotor cortex for speech articulation. Nature. 495 (7441), 327-332 (2013).
- Ledochowitsch, P., et al. Fabrication and testing of a large area, high density, parylene MEMS µECoG array. , (2011).
- Bosman, C. A., et al. Attentional stimulus selection through selective synchronization between monkey visual areas. Neuron. 75 (5), 875-888 (2012).
- Rubehn, B., Bosman, C., Oostenveld, R., Fries, P., Stieglitz, T. A MEMS-based flexible multichannel ECoG-electrode array. J Neural Eng. 6 (3), 036003 (2009).
- Baratham, V. L., et al. Columnar localization and laminar origin of cortical surface electrical potentials. J Neurosci. 42 (18), 3733-3748 (2022).
- Kellis, S., et al. Decoding spoken words using local field potentials recorded from the cortical surface. J Neural Eng. 7 (5), 056007 (2010).
- Viventi, J., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci. 14 (12), 1599-1605 (2011).
- Ledochowitsch, P., Olivero, E., Blanche, T., Maharbiz, M. M. A transparent µECoG array for simultaneous recording and optogenetic stimulation. , (2011).
- Ledochowitsch, P., et al. Strategies for optical control and simultaneous electrical readout of extended cortical circuits. J Neurosci Methods. 256, 220-231 (2015).
- Dougherty, M. E., Nguyen, A. P. Q., Baratham, V. L., Bouchard, K. E. Laminar origin of evoked ECoG highgamma activity. Annu Int Conf IEEE Eng Med Biol Soc. 2019, 4391-4394 (2019).
- Tian, H., Xu, K., Zou, L., Fang, Y. Multimodal neural probes for combined optogenetics and electrophysiology. iScience. 25 (1), 103612 (2022).
- Gonzales, D. L., et al. A translaminar spacetime code supports touchevoked traveling waves. bioRxiv. , (2024).
- Leonard, M. K., et al. Largescale singleneuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Renz, A. F., et al. OptoEDura: a soft, stretchable ECoG array for multimodal, multiscale neuroscience. Adv Healthc Mater. 9 (17), 2000814 (2020).
- Buzsáki, G. . Rhythms of the brain. , (2006).
- Yang, W., et al. A fully transparent, flexible PEDOT:PSS-ITO-Ag-ITO based microelectrode array for ECoG recording. Lab Chip. 21 (6), 1096-1108 (2021).
- Buzsáki, G. Largescale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Schalk, G., et al. Realtime detection of eventrelated brain activity. Neuroimage. 43 (2), 245-249 (2008).
- Kellis, S., et al. Multiscale analysis of neural activity in humans: implications for microscale electrocorticography. Clin Neurophysiol. 127 (1), 591-601 (2016).
- Buzsáki, G., Schomburg, E. W. What does gamma coherence tell us about interregional neural communication. Nat Neurosci. 18 (4), 484-489 (2015).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecondtimescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Cardin, J. A., et al. Driving fastspiking cells induces gamma rhythm and controls sensory responses. Nature. 459 (7247), 663-667 (2009).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decisionrelated activity propagate in a cortical feedback loop during touch perception. Nat Neurosci. 19 (9), 1243-1249 (2016).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56 (2), 339-355 (2007).
- Crone, N. E., Sinai, A., Korzeniewska, A. Highfrequency gamma oscillations and human brain mapping with electrocorticography. Prog Brain Res. 159, 275-295 (2006).
- Gerfen, C. R., Paletzki, R., Heintz, N. GENSAT BAC crerecombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron. 80 (6), 1368-1383 (2013).
- Mountcastle, V. The columnar organization of the neocortex. Brain. 120 (4), 701-722 (1997).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Muller, L., Chavane, F., Reynolds, J., Sejnowski, T. J. Cortical travelling waves: mechanisms and computational principles. Nat Rev Neurosci. 19 (5), 255-268 (2018).
- Sato, T. K., Nauhaus, I., Carandini, M. Traveling waves in visual cortex. Neuron. 75 (2), 218-229 (2012).
- Gilbert, C. D., Wiesel, T. N. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortex. J Neurosci. 9 (7), 2432-2442 (1989).
- Angelucci, A., et al. Circuits and mechanisms for surround modulation in visual cortex. Annu Rev Neurosci. 40 (1), 425-451 (2017).
- Singer, W., Gray, C. M. Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci. 18, 555-586 (1995).
- Quiroga, R. Q., et al. Invariant visual representation by single neurons in the human brain. Nature. 435 (7045), 1102-1107 (2005).
- Fusi, S., Miller, E. K., Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr Opin Neurobiol. 37, 66-74 (2016).
- Stringer, C., et al. Spontaneous behaviors drive multidimensional, brainwide activity. Science. 364 (6437), eaav7893 (2019).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using celltypespecific expression of channelrhodopsin2. Nat Protoc. 5 (2), 247-254 (2010).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nat Neurosci. 21 (6), 881-893 (2018).
- Mahn, M., et al. Highefficiency optogenetic silencing with somatargeted anionconducting channelrhodopsins. Nat Commun. 9 (1), 4125 (2018).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating lowimpedance tetrodes by electroplating with additives. Sens Actuators A Phys. 156 (2), 388-393 (2009).
- Halnes, G., et al. . Electric Brain Signals: Foundations and Applications of Biophysical Modeling. , (2024).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nat Rev Neurosci. 9 (5), 370-386 (2008).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and anesthesia. Science. 322 (5903), 876-880 (2008).
- Schalk, G., Leuthardt, E. C. Braincomputer interfaces using electrocorticographic signals. IEEE Rev Biomed Eng. 4, 140-154 (2011).
- Chestek, C. A., et al. Longterm stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex. J Neural Eng. 8 (4), 045005 (2011).
- Branco, M. P., et al. Nine decades of electrocorticography: a comparison between epidural and subdural recordings. Eur J Neurosci. 57 (8), 1260-1288 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon