Method Article
설치류의 미세 전기 피질 조영술과 층류 폴리트로드 및 광유전학을 통합하여 피질 처리의 멀티스케일 조사
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 쥐와 생쥐의 고밀도 마이크로 전기 피질 검사(μEcoG) 기록을 위한 수술, 이식 및 기록 방법을 포함한 두 가지 프로토콜을 제시합니다. μECoG 기록은 쥐의 청각 피질에서 층류 다원(laminar polytrode) 기록 또는 쥐의 체성 감각 피질(somatosensory cortex)에서 신경 활동의 광유전학적 조작과 함께 수행됩니다.
초록
피질전기검사(ECoG)는 기본 신경 과학과 건강 및 질병에 대한 인간의 뇌 기능에 대한 이해 사이의 방법론적 다리입니다. ECoG는 대뇌피질 조직의 넓은 영역에 걸쳐 밀리초의 시간 해상도와 원주 공간 해상도로 대뇌피질 표면에서 직접 신경생리학적 신호를 기록하여 국소 및 분산된 대뇌피질 계산을 모두 연구할 수 있는 독보적인 위치에 있습니다. 여기에서는 맞춤형 고밀도 마이크로 ECoG(μECoG) 장치의 설계와 그 사용법을 두 가지 절차로 설명합니다. 이 그리드에는 전극 사이에 천공이 있는 투명한 폴리머 기판에 제작된 200μm 간격의 128개의 저임피던스 전극이 있습니다. 이러한 기능을 통해 층류 폴리트로드 기록 및 광유전학적 조작과 동시 μECoG 기록이 가능합니다. 먼저, 유전적으로 정의된 특정 피질 세포 유형의 광유전학적 조작과 마우스의 수염 체성 감각 피질에 대한 경막외 μECoG 기록을 결합하기 위한 프로토콜을 제시합니다. 이를 통해 감각 처리에 대한 다양한 뉴런 집단의 뚜렷한 기여도를 인과 적으로 해부하는 동시에 μECoG 신호에서 특정 서명을 모니터링 할 수 있습니다. 둘째, μECoG 그리드와 층류 폴리트로드를 사용하여 쥐 청각 피질의 신경 활동을 기록하는 급성 실험을 위한 프로토콜을 제시합니다. 이를 통해 피질 표면 전체에 걸쳐 감각 유발 신경 반응의 상세한 지형 매핑과 동시에 피질 깊이에 분포된 여러 신경 단위의 기록이 가능합니다. 이러한 프로토콜은 분산된 대뇌피질 활동을 특성화하는 실험을 가능하게 하고 다양한 신경 장애에 대한 이해와 궁극적인 개입에 기여할 수 있습니다.
서문
감각, 인지 및 행동의 기초가 되는 뇌 기능은 단일 뉴런의 스파이크에서 피질 기둥의 뉴런 집단에 의해 생성된 전기장, 뇌 영역(예: 체성 감각 피질의 체성체성, 1차 청각 피질의 성토피)에 걸친 기둥의 지형적 구성에 이르기까지 광범위한 공간적, 시간적 규모에 걸쳐 조직되고 분포되어 있습니다. 뇌 기능을 이해하려면 이러한 공간 규모1에서 전기 신호를 감지해야 합니다. 신경 과학은 현재 뇌의 활동을 모니터링하기 위해 널리 사용되는 많은 방법을 가지고 있습니다. 전기생리학적으로 층류 다원(예: Neuropixels)을 사용하면 일반적으로 높은 (≥1kHz) 시간 해상도로 멀리 떨어진 소수의 열 내에서 적당한 수(~300)의 단일 뉴런을 모니터링할 수 있습니다. Ca2+ 이미징을 통해 더 낮은(~10Hz) 시간 해상도에서 ~1-2mm 공간 범위 내에서 유전적으로 및 해부학적으로 확인된 중간 수에서 많은 수의 단일 뉴런을 모니터링할 수 있습니다2. fMRI를 사용하면 매우 낮은(~0.2Hz) 시간 해상도에서 전체 뇌에 걸쳐 많은 수의 뉴런(36mm3 볼륨의 ~1M 뉴런)의 대사 상태를 모니터링할 수 있습니다. EEG/MEG를 사용하면 적당한 시간 해상도(<100Hz)와 매우 낮은 공간 해상도(센티미터)3에서 전체 피질 표면/뇌의 전기 활동을 모니터링할 수 있습니다. 이러한 각 방법론은 뇌 기능에 대한 근본적이고 시너지 효과적인 통찰력을 제공했지만, 피질의 넓은 공간 영역에 걸쳐 정확한 해부학적 위치에서 높은 시간 해상도로 전기생리학적 신호를 직접 감지할 수 있는 방법은 아직 초기 단계입니다. 넓은 공간 커버리지의 필요성은 뇌에서 뉴런 기능이 깊이4에 비해 표면 전체에서 훨씬 더 극적으로 변화한다는 사실에 의해 강조됩니다.
전기 피질 조영술(ECoG)은 저임피던스 전극 그리드를 뇌 표면에 이식하고 피질 1,5를 기록하거나 자극할 수 있는 방법입니다. ECoG는 일반적으로 약리학적으로 난치성 간질을 치료하기 위한 임상 정밀 검사의 일환으로 인간 신경외과 환경에 배치됩니다. 그러나 이는 또한 언어 및 감각 지형 매핑(speech and sensory topographic mapping)과 같은 인간의 분산된 피질 처리(transmitted cortical processing)에 대한 독특한 통찰을 제공한다 6,7. 이러한 기능은 원숭이, 쥐 및 생쥐를 포함한 동물 모델에서 사용하도록 동기를 부여했습니다 5,8,9,10,11. 설치류의 경우, 최근 micro-ECoG(μECoG)가 원주 공간 해상도(~200μm)와 넓은 공간 범위(수 밀리미터)로 뉴런 집단의 높은 시간 해상도(~100Hz) 직접 전기 모니터링을 가능하게 하는 것으로 나타났습니다. μECoG를 통해 연구자들은 동물 모델에서 복잡한 감각 처리, 인지 기능 및 운동 행동과 관련된 분산된 신경 역학을 조사할 수 있습니다12,13. 최근의 발전은 μECoG를 광유전학 및 층류 폴리트로드 기록 14,15,16,17,18,19,20 과 통합하여 피질 네트워크에 대한 다중 규모 조사를 가능하게 하고 미시적 규모의 신경 세포 활동과 거시적 피질 역학 사이의 격차를 해소했습니다 21,22. 비판적으로, μECoG 신호는 인간과 비인간 동물 모델에서 매우 유사하기 때문에 μECoG를 사용하면 동물 모델의 결과와 결과를 인간에게 훨씬 더 직접적으로 번역할 수 있습니다23. 따라서 통합적 접근법은 신경 회로에 대한 이해를 진전시키는 데 중요하며 신경 장애에 대한 새로운 치료 개입을 개발할 수 있는 가능성을 가지고 있습니다 5,24,25.
결과적으로, 피질 처리에 대한 포괄적인 다중 스케일 조사를 가능하게 하기 위해 고밀도 μECoG 어레이를 층류 기록 및 광유전학 도구와 통합하는 프로토콜에 대한 필요성이 부상하고 있습니다 8,26. 이러한 간극을 해소하기 위해 당사는 전극 사이에 천공이 있는 유연하고 투명한 폴리머 기판(파릴렌-C 및 폴리이미드)에 40μm 전극 직경과 20μm 전극 간 간격을 가진 128개의 저임피던스 전극을 특징으로 하는 맞춤형 설계 μECoG 장치를 개발하여 광유전학적 조작을 통해 μECoG 및 층류 폴리트로드를 동시에 기록할 수 있습니다13,22. 이 실험 프로토콜의 주요 측면은 다음과 같습니다 : (i) 고밀도 μECoG 어레이를 통한 대뇌 피질 활동의 원주 공간 해상도 및 대규모 커버리지; (ii) μECoG 그리드를 통해 삽입된 층류 폴리트로드를 사용하여 여러 피질층에서 기록하는 능력; (iii) 특정 신경 세포 집단을 선택적으로 활성화하거나 억제하기 위한 광유전학 기술의 통합, 따라서 신경 회로의 인과 해부를 가능하게 함 27,28,29. 고밀도 구성은 높은 공간 해상도 기록을 가능하게 하여 대뇌피질 활동의 "원주형 보기"를 효과적으로 제공하며, 이전 연구에서 μECoG 신호가 설치류 피질 기둥의 직경(~20μm)11에 필적하는 공간 규모에서 활동을 해결할 수 있음을 보여주었습니다. 이 통합 방법론은 신경 활동의 동시 멀티스케일 모니터링 및 조작을 가능하게 하여 잠재적으로 인과 실험을 통해 μECoG 신호의 신경 소스를 결정하고 분산된 피질 처리를 가능하게 합니다. 이러한 목표를 달성하기 위해 이 원고는 고밀도 μECoG 어레이를 두 가지 조합으로 사용하기 위한 자세한 프로토콜을 제공합니다.
먼저, 마우스의 1차 체감각 피질(S1)에서 레이어 5(L5) 피라미드 세포의 조작과 결합된 μECoG에 대해 설명합니다. 마우스에서 μECoG 어레이는 경막외로 배치됩니다(마우스에서 공막절개술의 외과적 난치로 인해). 광섬유는 그리드 위에 배치되거나 렌즈와 결합되어 피질 표면의 작은 목표 영역에 광유전학적 빛을 집중시킵니다. 광유전학 전략은 레이어 5 흥분성 뉴런의 억제를 위해 여기에 설명되어 있지만 해당 집단 특이적 Cre 발현 마우스 라인과 함께 제공되는 모든 뉴런 집단에 쉽게 적용할 수 있습니다. 둘째, 쥐의 청각 피질(A1)에서 피질층을 가로지르는 여러 뉴런의 피질 표면 전위(CSEP)와 단일 단위 스파이킹 활동을 동시에 기록하기 위해 μECoG와 실리콘 층류 폴리트로드를 함께 사용하는 방법을 설명합니다. 어레이에는 전극 사이에 천공이 있어 그리드를 통해 다채널 층류 폴리트로드를 삽입하여 서로 다른 피질층에 걸친 뉴런 활동을 기록할 수 있습니다. 개두술 절차 동안 μECoG 어레이는 청각 피질 위에 경막하 위치에 배치되고 층류 니트로드는 천공을 통해 삽입됩니다. μECoG 및 층류 프로브의 신경 신호는 디지털 신호 프로세서에 광학적으로 연결된 증폭기 시스템을 사용하여 각각 6kHz 및 24kHz로 샘플링되어 동시에 기록됩니다.
프로토콜
두 프로토콜 모두 동일한 주요 단계(마취, 고정, 개두술, μECoG 기록)를 따르지만 눈에 띄는 차이점이 있습니다. 다음 설명에서는 공유 단계가 병합되고 각 프로토콜의 세부 사항에 주석이 추가됩니다. 아래 단계는 광유전학을 사용한 μECoG 기록(마우스) 또는 층류 프로브(Rat)를 사용한 μECoG 기록에 해당합니다. 여기에 설명된 모든 절차는 현지 윤리 또는 법적 기관(IACUC 또는 윤리 위원회)에 따라 수행되었습니다. 사용되는 약물은 승인된 윤리 프로토콜에 따라 달라질 수 있습니다.
1. 마우스 및 랫트 절차를 위한 준비 및 프로토콜
- 마우스와 랫 프로토콜의 주목할만한 차이점
- 수술 대 전기생리학적 기록을 위한 설정
- 쥐의 경우 수술 및 전기 생리학적 기록 모두에서 동일한 설정을 사용합니다.
- 마우스의 경우 첫 번째 설정에서 수술을 수행하고 두 번째 설정에서 전기생리학적 기록을 수행합니다.
- 헤드 고정
- 쥐의 경우 수술 및 전기 생리학적 기록을 위해 동일한 클램프를 사용합니다.
- 마우스의 경우 수술에는 클램프를 사용하고 전기 생리학 설정에는 외부 금속 헤드바를 사용하여 가벼운 이소플루란 마취 하에 고정할 수 있습니다. 두개골에 치과용 시멘트로 헤드바를 이식합니다.
- 기록 설정: 두 종에 대해 서로 다른 수집 전자 장치, 기록 소프트웨어 및 감각 자극 소프트웨어를 사용합니다.
- 마우스 프로토콜의 경우 데이터 수집을 위해 SpikeGadgets 시스템(https://spikegadgets.com) 및 오픈 소스 Trodes 소프트웨어(https://spikegadgets.com/trodes/)를 활용합니다.
- 랫트 프로토콜의 경우 데이터 수집을 위해 기록 소프트웨어 Synapse - Neurophysiology Suite(https://www.tdt.com/component/synapse-software/)를 활용합니다.
- 주사(Rat) 또는 흡입(Mouse)으로 마취를 유도합니다.
- 녹화 위치
- 마우스의 체감각 피질(S1)에서 녹음을 수행합니다.
- 쥐의 1차 청각 피질(A1)에서 녹음을 수행합니다.
참고: 이러한 해부학적 국소화의 차이는 각 종에 대해 다른 개두술 부위를 필요로 합니다.
- 수술 대 전기생리학적 기록을 위한 설정
- 그리드 준비 및 테스트
- 그리드(커넥터 보드 제외)를 희석된 효소 세제(50% 세제, 50% 증류수)에 최소 1시간 동안 담그십시오.
- 순수한 증류수가 담긴 욕조에 옮겨 안전하고 깨끗한 장소에서 자연 건조시키십시오.
- 모든 녹음 세션 전이 아닌 μECoG 장치의 초기 준비의 일부로 플래티넘 블랙 전착을 수행합니다.
참고: 일단 증착되면 플래티넘 블랙 코팅은 여러 녹음에 효과적인 안정적인 층을 형성하지만 정기적인 임피던스 테스트를 통해 성능을 모니터링해야 합니다. 플래티넘 블랙 전착(1kHz에서 10-20kΩ의 목표 범위)은 전극 임피던스를 감소시키고 신경 기록에서 신호 대 잡음비를 개선합니다. - 전착을 수행하기 위해 소량의 아세트산 납(약 0.005%)을 증착 조절제로 함유한 클로로플라틴산 용액(일반적으로 1-3% 클로로플라틴산[H2PtCl6])을 준비합니다. 백금 상대 전극 및 Ag/AgCl 기준 전극과 함께 3전극 전기화학 셀에서 작동 전극 역할을 하도록 μECoG 전극을 연결합니다.
- 임피던스 값을 모니터링하면서 10-30초 동안 약 -0.5--2mA/cm²의 정전류 밀도를 적용합니다.
- 그리드 전극의 임피던스를 테스트하고 기록합니다(예: Nano-Z 사용).
- 광원 위의 그리드를 확인하고 수술 후 기록에 사용할 그리드를 준비합니다.
- 레퍼런스 케이블 솔더링
- 마우스의 경우 은선(길이 10mm, 30G)의 끝을 금색 핀에 납땜하여 녹음 시스템의 기준 리드에 연결합니다.
2. 수술
- 재료 준비 및 일반 모니터링 (동물 관리 및 기록)
- 준비: 적절한 소독제로 수술 부위를 철저히 청소하고 소독합니다. 일반적으로 오토클레이브를 사용하여 모든 수술 기구가 멸균되었는지 확인하십시오.
- 수술 도구 배치: 멸균 수술 패드에 수술 도구를 배치합니다. 수술 부위에 면 팁 애플리케이터와 흡수성 면 수술용 삼각형을 채우십시오. 생물학적 유해 폐기물은 전용 폐기 봉투에 버리십시오.
- 온도 조절: 수술 및 전기 생리학적 기록 부위 내에서 발열 패드를 켭니다. 수술 및 기록 전반에 걸쳐 발열 패드의 온도를 제어합니다.
- 수술용 패드: 온도 조절 침대 위에 파란색 수술용 패드나 담요를 놓습니다.
알림: 이 패드는 부드러운 면 흰색 바닥이 위를 향해야 합니다. - 현미경 포지셔닝: 현미경과 부착된 조명기(예: LED 링)를 수술 부위의 한쪽으로 준비합니다. 제대로 작동하는지 확인하십시오.
- 수술 드릴: 개두술 절차를 위한 수술 드릴을 준비합니다.
- 산소 공급: 산소 탱크 유량을 1.0L/min(쥐) 또는 0.5L/분(마우스)으로 설정하고 산소 마스크를 조절 패드 근처에 놓습니다. 동물은 마취 후 지속적인 산소가 필요합니다.
- 수액 교체: 수술 전반에 걸쳐 동물 체중의 최소 1.5%(마우스) 또는 시간당 1mL(쥐)의 교체를 목표로 하는 모든 체액 손실을 교체하십시오. 그에 따라 등장 용액을 준비하십시오.
- 동물: 승인된 절차에 따라 동물 시설에서 수술실로 동물을 데려옵니다. C57Bl6 배경의 8주에서 16주 사이의 수컷 또는 암컷 마우스를 사용합니다. 마찬가지로, Sprague Dawley 균주의 7 주 된 수컷 쥐를 사용하십시오.
- 약물 준비: 0.1g 정밀도의 저울을 사용하여 동물의 무게를 잰다. 필요한 경우 미리 희석된 용액을 사용하여 수술에 적합한 약물 양을 준비합니다.
- 마취 유도
- 마우스에 대한 마취 유도
- 동물을 이소플루란 유도 챔버(0.5 L/min O2에 3-5% 이소플루란)에 넣습니다.
- 깊은 마취가 확인되면(꼬리/발가락 꼬집음에 반사 없음) 동물을 수술 발열 패드에 놓고 머리를 고정합니다.
- 전신 진통제를 위한 피하 약물 주입: Meloxicam: 5mg/kg 및 부프레노르핀: 0.1mg/kg.
- 2.2.1.5-2.2.1.6 단계에 따라 마우스를 고정합니다.
- 주둥이를 마취 마스크에 넣고 머리를 헤드 마운트에 느슨하게 놓습니다. 마우스를 바이트 바에 놓으려면 먼저 혀가 막대와 입천장 사이가 아니라 막대 아래에 있는지 확인하십시오. 필요한 경우 집게를 사용하여 혀를 움직입니다.
- 동물의 앞니를 바이트 바의 막대에 있는 구멍에 삽입합니다. 고정 나사를 부드럽게 조여 마우스 마취 마스크(1.5L/min O2에서 0.5-2% Isoflurane)를 고정합니다. 수술 중 머리 안정화는 바이트 바에 의해서만 보장됩니다.
- 수술 중 건조를 방지하기 위해 석유 기반 안연고나 윤활제로 동물의 눈을 보호하십시오.
- 마스크를 통해 이소플루란이 지속적으로 흐르도록 시술 내내 마취를 유지합니다.
- 쥐를 위한 마취 유도
- 유도 마취 주입을 용이하게 하기 위해 동물을 진정시키기 위해 초기에 이소플루란을 사용하십시오.
- 마취 및 진통제를 위한 약물 투여:
Meloxicam: 5 mg/kg의 복용량, 농도 10 mg/mL, 0.4 mL/kg
케타민 : 90 mg / kg, 농도 100 mg / mL, 0.9 mL / kg의 복용량
자일라진 : 10 mg / kg, 농도 100 mg / mL, 0.1 mL / kg의 투여 량 - 동물이 체중과 나이에 따라 15-30분 이내에 깊은 마취에 도달하도록 합니다.
- 마취 모니터링
- 절차 전반에 걸쳐 동물의 바이탈(호흡수)을 지속적으로 모니터링합니다. 마취 상태의 초기 변화를 나타내는 특히 유용한 신호로 호흡수를 확인하고, 호흡수가 변하면 마취 수준을 조정합니다.
- 발 금단 반사는 마취 상태의 중요한 징후입니다. 이 반사 작용이 완전히 없으면 수술을 위한 충분한 수준의 마취가 보장되므로 주기적으로 이 반사를 테스트하십시오.
- 마우스에 대한 마취 유도
- 머리 고정 및 활력 징후 모니터링
- 동물 바이탈 모니터링
- 실험 시트에 동물의 활력 징후를 확인하고 기록하십시오. 동물의 반사 신경(예: 발 철수)이 완전히 사라지지 않으면 보조 케타민(쥐)을 추가로 절반 용량으로 투여하거나 이소플루란 농도를 0.5%씩 증가시킵니다(마우스).
- 쥐를 위한 머리 고정
- 쥐가 완전히 마취되면(발이나 꼬리 반사 신경 없음) 동물의 앞니를 헤드 마운트의 막대에 있는 구멍에 삽입합니다.
- 수술 중 머리를 고정하기 위해 장착 암의 끝을 콧구멍에 조심스럽게 삽입하고 눈에 닿지 않도록 합니다.
- 동물의 입 천장이 막대에 단단히 눌릴 때까지 팔의 각도를 조정하십시오. 두개골이 압력을 받아도 움직이지 않는지 확인합니다.
- 육각 렌치로 나사를 조여 마운트의 양쪽 암을 고정합니다.
- 쥐를 위한 산소 설정
- 산소통의 플라스틱 튜브를 동물의 주둥이와 코에 고정하고 수술용 테이프로 고정합니다. 공기 흐름을 방해할 수 있는 튜브의 주름을 피하십시오. 산소 탱크를 1L/min의 유속으로 설정하십시오.
알림: 심박수 및 호흡수를 포함한 동물 바이탈은 절차 전반에 걸쳐 15-30분 간격으로 확인해야 합니다.
- 산소통의 플라스틱 튜브를 동물의 주둥이와 코에 고정하고 수술용 테이프로 고정합니다. 공기 흐름을 방해할 수 있는 튜브의 주름을 피하십시오. 산소 탱크를 1L/min의 유속으로 설정하십시오.
- 동물 바이탈 모니터링
- 두피 절개
- 면도 및 준비
- 위쪽 주둥이부터 머리 뒤쪽까지 한쪽 눈에서 다른 쪽 눈으로, 귀 주위를 깎습니다. 가위나 전기 가위로 털을 대부분 제거한 다음 제모 크림을 바릅니다.
- 소독
- 베타딘에 적신 면봉을 사용하여 해당 부위를 소독한 다음 70% 에탄올에 적신 면봉으로 헹굽니다. 이 과정을 세 번 반복하고 해당 부위가 멸균되었는지 확인하기 위해 최종 베타 딘 도포로 마무리합니다.
- 국소 마취 주사
- 국소 마취제인 리도카인(1%, 마우스의 경우 0.1mL/랫드의 경우 kg당 0.4mL)을 동물의 두피 정중선에 피하주사합니다. 두피를 부드럽게 마사지하여 리도카인이 펴 바를 수 있도록 하고 마취제가 효과를 발휘할 때까지 5분 동안 기다립니다.
- 베기
- 쥐의 경우 핀셋으로 피부의 한 점을 들어 올리고 수술 용 가위를 사용하여 피부의 작은 부분 (직경 약 1cm)을 절제합니다.
- 쥐의 경우 메스를 사용하여 두피 앞쪽, 코 바로 위, 정중선을 정확하게 절개합니다. 피부를 부드럽게 뒤로 당겨 눈 사이에서 두개골 기저부까지 직선 절개를 만듭니다. 조심스럽게 두피를 들어 올리고 결합 조직을 잘라내고 두개골을 완전히 드러냅니다.
- 2.4.4.4-2.4.4.5 단계에 따라 개두술 사이트를 노출합니다.
- 스크레이퍼를 사용하여 두개골 상단의 결합 조직과 골막을 제거합니다. 식염수를 씻어내고 흡인 또는 수술용 스폰지를 사용하여 부위를 청소합니다.
- 개두술이 수행될 두개골 부위가 명확하게 노출될 수 있도록 피부 가장자리에 수술용 클립을 사용합니다.
- 면도 및 준비
- 개두술
- 일반 드릴링 절차
- 숙련된 외과의를 위해 수술용 드릴 속도를 5000rpm 또는 7000rpm의 낮은 설정으로 설정하십시오. 현미경을 통해 시각화하는 동안 모든 드릴링을 수행합니다.
- 드릴을 두개골 표면과 평행하게 잡고 표면에 부드럽게 대십시오.
- 페달을 가볍게 밟으면서 한 위치에서 드릴링을 시작합니다. 짧은 간격(5-10초)으로 드릴링을 수행하고 뼈 색상의 변화를 자주 확인합니다.
참고: 뼈는 불투명한 흰색으로 시작하며 구멍이 깊어질수록 더 반투명해져서 분홍색 색조를 드러냅니다. - 드릴링이 뇌에 가까워지면 속도를 늦추고 구멍으로 수분이 스며드는 징후를 찾으십시오. 구멍이 짙은 분홍색이고 약간 빛나면 드릴링을 중지하십시오. 30g의 짧은 바늘을 사용하여 남은 뼈층을 부드럽게 뚫습니다. 새 구멍에서 맑은 액체가 잘 나와야 합니다.
- 마우스의 드릴링 절차
- 생리학적 기록을 위한 기준 전극을 배치하려면 기록된 영역에 대한 반구 동측의 정면 부분에 버 구멍을 뚫습니다.
- 개두술의 윤곽을 정의하려면 주변에 얕은 도랑을 뚫습니다. medio-lateral axis에서 lateral bone ridge에서 시작하여 기준으로 4mm 창을 추적합니다.
- 전후 축에서 후방 뼈 융기의 전방에서 시작하여 3mm ~ 1mm 창을 뚫습니다. 최종 개두술 크기는 약 4 x 3mm 창입니다.
- 쥐를 위한 드릴링 절차
- 두 개의 구멍을 뚫습니다: 하나는 왼쪽 후방 사분면에, 다른 하나는 오른쪽 전방 사분면에 있습니다.
- 교근에 2차 용량의 리도카인(10mg/mL에서 0.4mL/kg)을 주입하고 절단할 부위에 고르게 분배합니다.
- 개두술 부위를 노출시키는 데 필요한 최소한의 근육만 절제합니다.
- 새로운 #10 메스 날을 사용하여 동물의 턱(오른쪽) 위의 근육 다발에 가로 등쪽-복부 절단을 만듭니다. 꽉 잡는 집게로 절단의 뒤쪽 가장자리를 잡고 광대뼈의 뼈 융기를 따라 절단하면서 두개골에서 벗겨냅니다. 이런 식으로 최소한의 출혈로 근육을 뼈에서 분리할 수 있습니다.
- 두개골의 열구선이 드러날 때까지 비슷한 방식으로 전방 근육을 절제합니다. 이 선은 개두창의 전방 경계가 됩니다.
- 메스와 겸자로 뒤쪽 융기 주변의 근육을 제거하고 강한 광원을 사용하여 혈관이 많이 있는 부위를 절단하지 않도록 합니다.
- 드릴을 사용하여 두개골 표면 위로 더 이상 올라가지 않을 때까지 뒤쪽 융기를 갈아냅니다.
참고: 이 단계는 피질 표면과 직접 접촉하기 위해 μECoG 그리드를 설정하는 데 필수적입니다. - 절제된 근육이 부착된 능선 바로 위에 있는 창의 등 가장자리를 뚫습니다. 뒤쪽 가장자리를 드릴다운된 뒤쪽 융기 앞쪽에 놓습니다. 안와 근처에서 아래로 뻗어 있는 열구선 뒤쪽에 앞쪽 가장자리를 놓습니다.
알림: 전방 근육을 청소할 때 눈을 피하도록 주의해야 합니다.
- 일반 드릴링 절차
- 개두술 창 드릴링
- 개두술 창 드릴링(팁)
- 드릴링할 때 드릴 비트가 두개골 표면과 평행을 유지하는지 확인하십시오. 드릴을 브러시처럼 사용하여 드릴이 두개골에 가볍게 닿도록 하면서 의도한 개두술 라인을 따라 짧고 반복적인 동작을 사용하여 가능한 한 적은 힘을 가합니다.
참고: 쥐의 경우 창의 뒤쪽 가장자리가 가장 두꺼운 뼈를 가지고 있습니다. 너무 뒤로 드릴링하면 뼈가 벗겨지기 쉽고 "바삭바삭한" 품질을 나타낼 수 있어 드릴링 진행 상황을 측정하기 복잡할 수 있습니다. 잘못 배치하면 이 뼈 부위에 핏줄이 붉게 변하여 뇌에 가까이 있다는 잘못된 인상을 줄 수 있습니다. - 뼈가 옅은 분홍색으로 나타나고 뼈의 길이를 따라 얇은 흰색 균열이나 균열이 나타날 때까지 개두창의 양쪽을 뚫습니다. 가벼운 압력을 가하십시오. 뼈는 완전히 뚫렸을 때 뚜렷한 "흔들림"을 생성해야 합니다. 균열이 분리된 것처럼 보이면 연속적인 라인이 될 때까지 가볍게 드릴링을 계속하십시오.
- 드릴링할 때 드릴 비트가 두개골 표면과 평행을 유지하는지 확인하십시오. 드릴을 브러시처럼 사용하여 드릴이 두개골에 가볍게 닿도록 하면서 의도한 개두술 라인을 따라 짧고 반복적인 동작을 사용하여 가능한 한 적은 힘을 가합니다.
- 개두술 창 내에서 얇아진 두개골 제거
- 두개골이 매우 가벼운 압력으로 인해 창 전체가 눈에 띄게 흔들릴 정도로 얇아지면 얇아진 두개골을 제거합니다.
- 식염수 한 방울로 개두술 부위를 씻어내고 최소 1분 동안 기다립니다. 이렇게 하면 얇아진 뼈가 약해지고 뼈가 경막에서 분리되는 데 도움이 됩니다. 흡수성 면 삼각형 또는 진공 청소기로 과도한 식염수를 배출하십시오.
- 집게를 사용하여 얇아진 두개골을 조심스럽게 들어 올려 밑에 있는 조직이 손상되지 않도록 합니다.
- 지혈 스펀지를 사용하여 뇌를 촉촉하게 유지하십시오.
- 톱니가 있는 집게로 등쪽과 복부 쪽의 창을 단단히 잡고 두개골에서 직접 잡아당깁니다. 현장에서 창문을 빼내는 데 어려움이 있는 경우 뼈가 충분히 약해질 때까지 가벼운 드릴링을 중지하고 다시 시작하십시오.
- 마우스 μECoG 기록의 경우 경막을 그대로 둡니다.
- 개두술 창 드릴링(팁)
- 마우스용 시멘트 및 헤드포스트 임플란트
- 참조선을 삽입하고 고정합니다.
- 은색 와이어 끝을 버 구멍에 ~1mm 삽입하여 뇌 표면에 닿을 수 있을 만큼 충분히 삽입하지만 출혈을 일으키지 않도록 합니다.
- 첫 번째 층을 적용하는 동안 치과 시멘트를 제자리에 적용합니다.
- 치과 용 시멘트의 준비
- 냉각된 세라믹 혼합 접시를 사용하여 치과 시멘트 혼합물을 준비합니다. 이 시멘트는 빠르게 두꺼워지며 새로운 혼합물을 정기적으로 준비해야 합니다. 새로운 혼합물을 준비하기 전에 혼합 접시를 깨끗이 닦으십시오.
알림: 시멘트는 뇌와 직접 접촉해서는 안 됩니다.
- 냉각된 세라믹 혼합 접시를 사용하여 치과 시멘트 혼합물을 준비합니다. 이 시멘트는 빠르게 두꺼워지며 새로운 혼합물을 정기적으로 준비해야 합니다. 새로운 혼합물을 준비하기 전에 혼합 접시를 깨끗이 닦으십시오.
- 첫 번째 레이어의 적용
- 마이크로 애플리케이터를 사용하여 개두술 주위와 두개골 전체에 시멘트의 첫 번째 층을 적용합니다. 이 층은 두개골과 금속 헤드바 사이의 전기 절연 역할을 합니다.
- 개두술을 측면 덮개를 포함한 시멘트로 완전히 둘러싸서 개두술 및 μECoG 그리드를 적절하게 보호합니다.
- 금속 헤드바 위치 지정
- 헤드바의 큰 부분을 완전히 조이지 않고 홀더에 부착합니다.
- 원하는 대로 헤드바를 배치하고 시멘트 표면과 접촉하는 두개골 정중선을 따라 얇은 부분을 놓습니다.
- 임플란트 고정
- 헤드바를 치과용 시멘트로 덮고 시멘트 표면에 연결합니다.
- 홀더 제거
- 치과용 시멘트가 강화될 때까지 몇 분 동안 기다립니다.
- 헤드바가 완전히 고정되면 먼저 홀더에서 나사를 제거하여 헤드바를 제거합니다. 그런 다음 홀더를 뒤로 집어넣어 헤드바에 힘이 가해지지 않도록 합니다.
- 참조선을 삽입하고 고정합니다.
- 쥐 수술을 위한 절개술
참고: 이것은 까다로운 수술 단계입니다.- 경막을 들어 올리기
- 5번 겸자를 사용하여 뇌 표면과 가능한 한 평행하게 잡고 경막의 작은 부분을 뇌에서 들어 올립니다.
- 새 30G 바늘(가능한 한 짧게)을 사용하여 들어 올린 경막을 조심스럽게 찢습니다.
참고: 경막은 뇌 바로 위에 있는 얇고 투명한 조직층입니다. 쥐의 μECoG 기록을 위해 제거됩니다. 뇌 표면의 혈관 구조를 방해하지 않고 공막 절개술을 수행하는 것이 중요합니다. 듀로절개술을 수행하기 위해 권장되는 방법에는 집게와 주사기 바늘을 사용하여 경막을 뒤로 당기기 전에 경막에 구멍을 뚫거나 두개골 근처에 고정된 경막암 도구를 사용하여 경막을 조심스럽게 후퇴시키는 것이 포함됩니다.
- 경막의 절제
- 집게로 경막을 계속 잡고 뇌에서 들어 올립니다. 들어 올리는 동안 바늘로 대각선 찢어짐을 만듭니다.
- 집게를 사용하여 개두창 옆쪽으로 경막을 조심스럽게 벗겨내어 뇌 표면이 방해받지 않도록 합니다.
- 경막을 들어 올리기
- 전기생리학적 기록을 위한 설정으로 마우스 전송
- 앞니 막대에서 주둥이와 앞니를 부드럽게 들어 올린 다음 동물을 뒤로 당겨 수술 설정에서 동물을 제거합니다. 더 낮은 이소플루란 농도를 사용하여 지속적인 마취를 유지할 수 있는 진정제인 클로프로틱센(1mg/kg, 복강내[IP])을 주사합니다.
- 전기생리학적 기록 설정에 마우스를 놓습니다.
- 발열 패드가 제자리에 있고 제대로 작동하는지 확인하십시오.
- 머리는 전기 생리학 설정에서 홀더의 헤드 바를 사용하여 동물을 고정합니다.
- 이소플루란 마스크를 가까이 가져가 동물의 주둥이를 완전히 덮습니다.
- 마취 조정
- 점차적으로 마취 수준을 0.7-1% 이소플루란으로 낮춥니다(5분마다 최대 0.5%씩 증가).
- 동물의 호흡수와 움직임을 모니터링합니다.
참고: 호흡수는 수술 상태에 비해 약간 증가해야 하지만 동물이 움직이지 않아야 합니다. - 동물이 움직이면 즉시 이소플루란 농도를 2%로 높인 다음 0.5%씩 천천히 낮은 수준으로 되돌립니다.
- 감각 자극을 위한 수염 삽입
- 마우스의 vibrissae를 수염 자극 장치에 부착합니다. 이 프로토콜에서는 vibrissae의 빠른 편향을 제공하는 압전 액추에이터에 연결된 짧은 10 μL 피펫 팁에 9개의 vibrissae를 삽입합니다.
3. 녹음
- 그리드 설치
- 예비 단계
- 녹음 시스템을 켜고 amp리퍼.
- 동물의 활력 징후를 확인하십시오.
- 절차
- 동물과 도구를 배치하려면 3.1.2.2-3.1.2.4 단계를 따르십시오.
- 동물을 기록 설정에 넣고 정기적으로 식염수를 도포하여 개두술이 촉촉하게 유지되도록 합니다.
- 쥐의 경우, 간섭을 피하기 위해 개두술 부위 훨씬 뒤에 위치한 리그의 난간에 미세 조작기를 배치하십시오.
- 쥐의 경우, 미세 조작기를 동물과 함께 개두술 부위 옆으로 놓습니다.
- 마우스에 그리드를 연결하고 배치하려면 3.1.2.6-3.1.2.12단계를 수행합니다.
- ZIF 클립 커넥터(헤드스테이지 커넥터)를 사용하여 μECoG 그리드를 헤드스테이지에 연결합니다. 헤드 잡기tage의 전자 보드는 마이크로 매니퓰레이터에 고정된 기계식 막대를 통해 제자리에 고정됩니다.
- μECoG 그리드를 수평으로 내려 전후 축을 따라 개두술 위에 평평하게 정렬합니다.
참고: 측면-내측 축을 따라 그리드의 가장자리는 개두술의 내측 경계 근처에 있어야 합니다. - 그리드가 뇌 근처에 위치하지만 뇌와 접촉하지 않으면 그리드의 참조 와이어를 이식된 은색 와이어-금색 핀에 연결합니다. 필요한 경우 접지선을 동물(예: 덮이지 않은 근육)에 연결하여 전기 노이즈를 줄이십시오.
- 또한 그리드를 낮추어 뇌와 접촉합니다.
- 그리드를 측면으로 움직여 촉촉한 듀라 표면 위를 "미끄러지게" 합니다. 그리드가 중간 축을 따라 중심이 될 때까지 계속 조정합니다.
- 흡인 또는 수술용 스펀지를 사용하여 개두술 가장자리 주위를 사용하여 과도한 식염수를 제거합니다.
- 제제가 약간 더 건조되면 그리드가 듀라에 더 단단히 부착되고 표면 위로 미끄러지지 않는지 확인하십시오. 더 건조해지면 유연한 그리드에 측면-내측 이동을 적용하여 가장 측면의 전극과 접촉하도록 합니다. 그리드의 유연한 케이블은 뇌의 윤곽에 맞게 자연스럽게 구부러집니다.
- 쥐에 그리드를 배치하려면 3.1.2.14-3.1.2.18 단계를 따르십시오.
- 마이크로 매니퓰레이터에 고정 포크의 줄기를 고정하고 그리드의 커넥터 보드가 내릴 때 개두창의 뒤쪽에 대해 마우스를 올려 놓도록 합니다.
- 그리드가 개두술 부위보다 대략 위에 오도록 난간에 있는 미세 조작기의 위치를 조정합니다. 그리드가 뇌 표면 위로 가까이 떠오를 때까지 그리드를 낮춥니다. 소량의 식염수로 뇌 표면을 적십니다.
- 현미경을 사용하여 다음 단계를 수행합니다. 미세 조작기의 다이얼을 사용하여 개두술 중앙의 뇌 표면에 평평하게 놓일 때까지 그리드 위치를 조정합니다.
- 그리드 자체를 건드리지 않고 흡수성 면 삼각형을 사용하여 조심스럽게 수분을 흡수합니다. 그리드의 모든 행이 뇌 표면과 접촉하고 있는지 확인합니다.
참고: 수분을 제거하면 피질 표면과 그리드 사이의 유체를 통해 전기 신호가 수동적으로 확산되는 것을 방지할 수 있으며, 이는 전극에서 감지된 신호를 공간적으로 확산시킵니다. - 숫자 2 또는 숫자 5 집게를 사용하여 그리드 접지선을 동일한 버 구멍에 삽입하거나 참조 와이어를 버 구멍에 삽입하고 접지선을 근처의 근육 조직에 삽입합니다.
참고: 전선은 뇌에 닿을 수 있을 만큼 ~1mm만 삽입해야 하지만 뇌에 출혈이나 외상을 일으키지 않아야 합니다.
- 예비 단계
- 그리드의 위치 확인
- 전기생리학적 활동 모니터링
- 기록 소프트웨어를 사용하여 전기 생리학적 활동을 관찰합니다. 광선 마취 하에서 뇌 신호는 가변적이며 다양한 패턴을 보일 수 있습니다.
- 그리드, 레퍼런스 및 접지선을 적절하게 연결하면 신호 진폭이 mV 범위의 높은 신호 대 잡음비를 생성해야 합니다. Trodes(예: 100-6000Hz)를 사용한 대역통과 필터링을 사용하여 고주파 범위의 잡음을 모니터링하고 수십 마이크로볼트(μV)를 초과하지 않도록 합니다.
- 가시적인 이벤트 관련 피질 표면 전기 전위(CSEP)를 유도하기 위해 소음(예: 손뼉 치거나 튕기는 소리)을 사용하여 감각 반응성을 평가합니다.
참고: 단일 수염을 자극하면 몇 개의 채널(마우스)에서만 명확하고 선명한 이벤트 관련 CSEP를 유발해야 합니다. - 그리드 위치 확인
- 쥐의 경우 그리드가 청각 피질 위에 올바르게 배치되었는지 확인합니다. 기록되는 첫 번째 블록은 일반적으로 그리드가 뇌의 적절한 반응을 등록하는지 확인하기 위해 설정된 60초 백색 잡음 자극이어야 합니다. polytrode를 삽입하기 전에만 그리드와 함께 백색 잡음 및 톤 진단 기록을 수행하여 그리드가 올바르게 배치되었는지, 신호 응답이 있는지 확인하는 데 도움이 됩니다.
- 마우스의 경우 그리드 위치를 확인하려면 350ms 간격으로 20-30개의 수염 편향을 사용하여 빠른 매핑 세션을 수행합니다. Trodes를 사용하여 LFP(국소자기장전위) 대역의 활동을 기록하고 사용자 지정 MATLAB 코드로 오프라인으로 분석하여 수염 유발 활동의 공간적 범위를 시각화합니다.
- 재배치
- 그리드를 조정해야 하는 경우 그리드 위에 식염수 방울로 피질 표면을 적십니다.
- 그리드를 들어 올리기 전에 식염수를 30초에서 1분 동안 그대로 두십시오.
- 그리드를 조심스럽게 천천히 들어 올립니다.
- 3.1단계에 설명된 단계를 사용하여 위치를 변경합니다.
- 전기생리학적 활동 모니터링
- 쥐를 위한 층류 polytrodes
- Polytrode 설정
- 먼저 헤드스테이지 어댑터를 폴리트로드 뒷면에 연결합니다. 커넥터를 어댑터의 보드에 있는 세 번째 채널 세트에 클립합니다. 클립의 검은색 표시가 polytrode의 비즈니스 끝의 오른쪽을 향하도록 합니다.
- 폴리트로드 삽입
- 가장 마지막(맨 위) 전극이 피질 표면 위로 보일 때까지 폴리트로드를 뇌에 삽입합니다. 느린 하강(1μm/s까지 내려가면)은 신호 품질을 향상시킵니다. 뇌가 다원체의 존재에 적응할 수 있도록 15분 동안 기다립니다.
- 15분 후 마지막 전극이 피질 표면에 들어갔는지 확인합니다. 그렇지 않은 경우 폴리트로드를 약간 더 낮추고 10분 더 기다렸다가 계속 진행하십시오.
- Polytrode 설정
- 마우스에 광유전학 광원 배치
- 관절 암에 장착된 3차원의 미세 조정 나사 시스템 또는 미세 조작기를 사용하여 광섬유 홀더를 장착하십시오.
- 광원을 안내하고 광섬유를 배치하는 데 도움이 되도록 광유전학을 낮은 강도로 켜십시오. 관절이 있는 팔을 사용하여 광유전학적 빛을 대상 영역을 향해 거칠게 배치합니다.
- micromanipulator 또는 미세 조정 나사를 사용하여 광섬유의 위치를 집중시키고 미세 조정합니다.
- 신호 기록
- 준비
- 수술 장비에서 불필요한 모든 조명, 연장 코드 및 서지 보호기의 플러그를 뽑아 전기 간섭을 줄이십시오. 장비의 머리 위 조명을 끕니다.
- 실험을 시작하기 전에 격리된 녹음 공간의 문과 수술실의 문을 닫으십시오.
- 인수 시작
- 쥐의 경우 녹음 플랫폼/컴퓨터에서 Synapse를 시작하고 사전을 통해 획득이 작동하는지 확인합니다.view신호를 확인하고 확인합니다. 동물 근처에 자극을 가하여(즉, 박수) μECoG 신호에서 크고 날카로운 전압 과도 현상을 유도합니다.
- 마우스의 경우 Trodes에서 녹음 세션을 시작합니다.
- 하이드
- 탈수를 방지하기 위해 기록 중 1-2시간마다 쥐 또는 쥐에 각각 1mL 또는 0.1mL의 식염수를 피하주사합니다. 쥐의 경우, 식염수를 투여한 후 새 기록 블록을 실행하기 전에 5-10분 정도 기다립니다.
- 자극 변수
- 쥐의 경우, 기록 부위가 확인되면 필요한 자극 세트를 기록하는 것을 진행한다. 예제 집합에는 다음이 포함될 수 있습니다
백색 소음(60초)
톤 진단(5분)
퓨어 톤 (23분)
다이나믹 무빙 리플
톤 150 (15분)
TIMIT (38분) - 쥐의 경우 그리드가 재배치될 때마다 백색 소음 및 톤 진단을 다시 표시합니다.
- 마우스에 대한 촉각 자극: 시험 구조에서 촉각 자극을 제공하며, 각 시험에는 350ms마다 무작위 수염 편향 트레인이 포함됩니다. 제공된 예제에서 각 시도에는 4500ms 동안 표시되는 14개의 편향이 포함됩니다.
- 마우스에 대한 광유전학적 자극: 일부 시험에서는 전체 시험 기간(5초)에 걸쳐 광유전학적 빛의 사각형 펄스를 적용합니다. 사용된 옵신과 광 투과 추정치(https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php)를 사용하여 도달해야 할 조직의 깊이를 기반으로 필요한 광 수준을 결정합니다.
- 쥐의 경우, 기록 부위가 확인되면 필요한 자극 세트를 기록하는 것을 진행한다. 예제 집합에는 다음이 포함될 수 있습니다
- 준비
- 정리
- 그리드 리프팅 및 청소
- 녹음이 완료되면 녹음 소프트웨어를 닫고 리그의 광원을 다시 연결합니다.
- 뇌가 건조하면 주사기를 사용하여 뇌 표면에 식염수 한 방울을 떨어뜨립니다. 그리드를 들어 올리기 전에 식염수를 30초에서 1분 동안 그대로 두십시오.
- 현미경 아래에서 작업하면서 미세 조작기를 사용하여 뇌 표면에서 그리드를 부드럽게 들어 올립니다.
- 그리드를 들어 올리는 동안 추가 힘이 필요한 경우 탄소 팁 집게(닫힘)를 사용하여 뇌에서 그리드를 부드럽게 들어 올립니다. 미세 조작기의 움직임이 약간 앞쪽에 있는지 확인하여 그리드를 뇌 표면에서 부드럽게 벗겨냅니다.
- 그리드가 완전히 제거되면 그립 포크에서 그리드를 분리하고 3.6.1.6-3.6.1.7 단계에 따라 청소합니다.
- 그리드(커넥터 보드 제외)를 희석된 효소 세제(50% Enzol, 50% 증류수)에 최소 1시간 동안 담그십시오. 그런 다음 순수한 증류수를 섞은 두 번째 수조로 옮기고 안전하고 깨끗한 장소에서 자연 건조하십시오.
- 그리드 영역에 혈액이나 조직이 침전된 경우 효소 용액에 적신 면 삼각형을 사용하여 부드럽게 닦아냅니다.
- 건조되면 그리드를 상자로 되돌립니다.
- 동물을 안락사시키는 것
- 쥐의 경우, 동물을 머리 고정에서 제거하고 안락사 챔버에 넣으십시오. 5mL 이소플루란이 함유된 거즈를 추가하고 호흡이 멈춘 후 60초 동안 기다립니다. 금단 반사가 없는지 확인하고 날카로운 가위를 사용하여 목을 베십시오.
- 쥐의 경우 0.2mL의 펜토바르비탈 IP를 주입합니다. 호흡이 멈춘 후 60초 동안 기다렸다가 동물을 등에 눕히고 #11 칼날을 사용하여 이중 개흉술을 수행합니다.
- 장비 청소
- 모든 수술 도구를 실험실 싱크대로 가져가 수술 수건 위에 올려 놓습니다. 도구에 10% 표백제 용액을 뿌리고 싱크대에서 철저히 세척하십시오. 더 더러운 도구의 경우 세탁하기 전에 표백제 용액에 담그십시오.
- 또는 싱크대에서 브러시로 기구를 문질러 물과 함께 분말 세제(예: Contrex AP)를 사용하십시오.
- 도구를 청소하고 헹구면 알코올 물티슈로 닦고 보관 공간에 다시 넣으십시오.
- 작업 공간 소독
- 사용한 모든 바늘과 칼날은 날카로운 물건 용기에 버리십시오.
- 오염된 면봉, 삼각형 및 알코올 물티슈는 생물학적 위험 백에 폐기하십시오.
- 작업 공간을 닫기 전에 굴착실의 모든 작업 표면을 알코올로 닦고 모든 기구를 청소하십시오.
- 그리드 리프팅 및 청소
결과
우리는 광유전학적 방법 및 층류 기록과 결합된 전기 피질 신호 기록을 위한 프로토콜에 대해 설명했습니다. 여기에서는 쥐의 체성 감각 피질(그림 1, 그림 2 및 그림 3)과 감각 자극에 대한 반응으로 쥐의 청각 피질(그림 4, 그림 5 및 그림 6)에서 얻은 일반적인 신호가 제시됩니다.
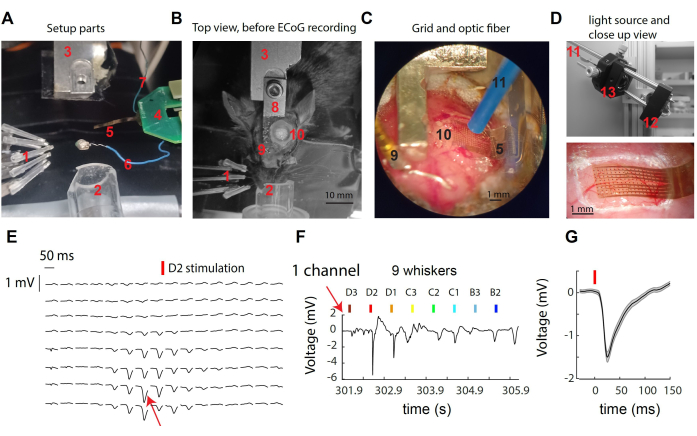
그림 1: 마우스 수염 체성 감각 피질을 통해 μECoG 신호 기록.(A) 설정의 구성 요소. 텍스트를 참조하십시오. (B) μECoG 기록 전 수술 설정의 상단 모습으로, 머리 지지대와 개두술 부위의 위치를 보여줍니다. (C) 노출된 피질에 위치한 μECoG 그리드 및 광섬유의 상세 보기. (D) 상단: 광원이 레코딩 박스 외부에 있습니다. 473nm LED의 빛은 탠덤 렌즈를 통해 광섬유에 수집됩니다. 아래: 예시 기록에서 마우스 피질 위의 피질 격자 클로즈업. (E) 휘스커 D2 자극에 대한 임상시험 평균 반응을 보여주는 모든 16x8 채널의 대표적인 μECoG 추적. (F) (E)에 표시된 단일 채널의 원시 전압 트레이스, 여러 수염의 단일 편향에 걸친 트레이스. 채널은 수염 D2를 자극하는 동안 가장 강한 반응을 보였습니다. (G) 단일 채널(E,F)에서 시행 전반에 걸쳐 평균 유발 반응으로, 휘스커 자극 후 급격한 전압 편향을 나타냈습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 1A-D는 마우스 S1 피질에서 기록 및 광유전학 조작에 사용되는 시스템의 다양한 구성 요소의 이미지를 제공합니다. 라벨이 붙은 요소는 다음과 같습니다 : 1- 3 x 3 어레이의 9 개의 독립적 인 수염 자극기, 이소 플루란 마취를위한 2- 코 콘, 3- 헤드 포스트 홀더 / 대응물, 4- μECoG 백엔드 PCB, 이중 ZIF 커넥터로 헤드 스테이지 PCB에 연결; 8mm 플렉시블 케이블 끝에 있는 5-μECoG 전극 그리드; 6- 기준 와이어; 7- 접지선; 8- 헤드 포스트 임플란트; 9- 참조 골드 핀(치과 시멘트로 헤드포스트에서 절연됨); 10- 왼쪽 반구의 개두술, S1 수염 배럴 피질 위; 11- 1 mm 직경의 광유전 섬유(micromanipulator에 의해 유지됨, 표시되지 않음); 12- LED 드라이버에 의해 구동되는 별 모양의 LED(도시되지 않음); 13- 비구면 렌즈의 탠덤을 통한 빛 수집. 단일 수염을 자극할 때 적은 수의 전극에서 표면 전위의 급격한 편향이 관찰됩니다(그림 1E). 이 전극 클러스터는 자극된 수염(30)의 피질 기둥에서 최고조에 달하는 국소 신호를 나타냅니다. 단일 전극을 살펴보면 선호하는 수염의 자극에 대한 반응이 가장 강하고 더 먼 수염의 자극에 대한 반응이 약하거나 전혀 반응하지 않는 것을 관찰할 수 있습니다(그림 1F). 이 예에서 편향은 휘스커 진동 후 약 10ms 후에 발생하며 평균 진폭은 1mV입니다(그림 1G).
그림 2는 광유전학적 억제 중 기록의 예를 보여줍니다. 빛은 그리드의 투명한 기질을 통해 피질 조직에 도달할 수 있습니다(그림 2A). 그러나 직경이 큰 광섬유나 공간적으로 넓은 광원을 사용할 때 광자도 전극에 부딪혀 광전기 아티팩트를 생성합니다(그림 2B). 이 억제 프로토콜에서는 5초 길이의 사각형 광 펄스를 사용했습니다. 그 결과로 발생하는 광전기 아티팩트는 빛의 시작과 오프셋 시에만 존재합니다. 옵신이 없는 동물의 경우, 불을 켠 상태에서 나타나는 수염 자극은 불을 끈 상태에서 시도에서 제시된 수염 자극과 다른 반응을 유발하지 않습니다(그림 2C). 대조적으로, 흥분성 뉴런의 하위 집단에서 억제성 옵신(inhibitory opsin)의 광 자극은 감각 유발 반응의 진폭을 감소시킵니다(그림 2D)
그림 2C,D는 시간-주파수 영역에서 광유전학적 억제의 예를 보여줍니다. μECoG 데이터를 분석하기 위해 먼저 공통 평균 참조(CAR)를 적용하여 전극 간에 구별되지 않은 신호(예: 호흡)를 제거한 다음, 시간 경과에 따른 활성 주파수 대역을 나타내는 모스 웨이블릿 변환을 적용합니다. 주파수 영역에서의 신경 활동은 일반적으로 1/f 2,3의 대략적인 멱법칙을 나타냅니다. 주파수 영역에서 감각 유발 신호를 보다 균일하게 나타내기 위해 각 주파수 대역에 대해 개별적으로 Z-스코어링을 적용합니다. Z 스코어링은 기준선 epoch 동안의 신호 통계를 기반으로 합니다. 여기서는 시험 시작 전에 -3000ms에서 -1000ms까지 자극 이전의 시간 창을 사용합니다. 이 프로세스는 각 주파수 대역에 대해 자극 유발 Z-점수를 산출합니다(그림 2C, D).
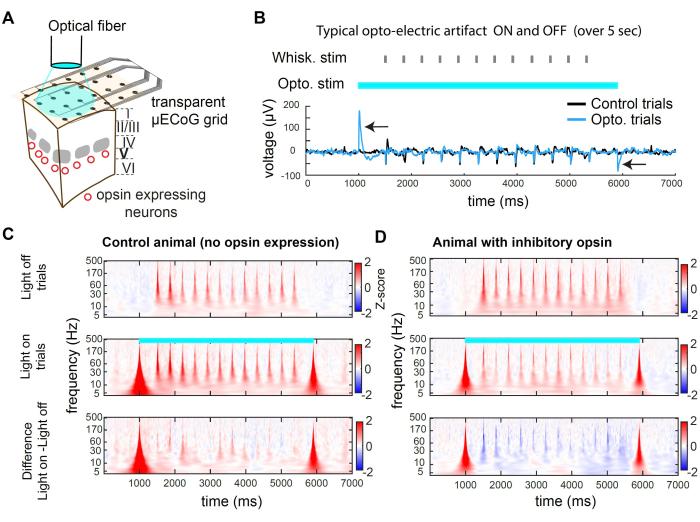
그림 2: 마우스에서 μECoG 기록 중 wS1의 광유전학적 억제. (A) 대표적인 광유전학 실험의 개략도. 광섬유는 뇌를 직접 향하게 하여 억제성 옵신(opsin)을 발현하는 뉴런 집단의 일시적인 억제를 가능하게 합니다. (B) 광유전학적 자극의 중심에 있는 채널에 기록된 전압 추적, 시행 전반에 걸쳐 평균화된 추적. 검은색 화살표는 473nm 광의 시작 및 오프셋에서 광전기 아티팩트를 나타냅니다. 시험 중간에 수염 편향(무작위 수염 식별)에 대한 반응을 주목하십시오. 아티팩트는 일시적이며 지연 후 감각 유발 활동의 기록에 영향을 미치지 않습니다(여기서는 500ms). (C) 옵신이 발현되지 않은 동물에서 light-off trials, light-on trials, 및 이 둘의 차이에서 예시 채널의 평균 스펙트로그램. 광전기 효과는 광대역, 일시적인 아티팩트를 유도하고 수염 유발 반응은 빛의 영향을 받지 않습니다. (D) light-off trial, light-on trial 및 st-GtACR2.0이 layer 5의 흥분성 뉴런에서 발현된 Rbp4-Cre 마우스32 에서 둘 사이의 차이에 걸친 trial-average spectrogram의 예. 스펙트로그램에서 수염 유발 반응의 억제에 주목하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 3은 광 전달 시스템에서 구현하기 쉬운 변형을 보여줍니다. 더 작은 광섬유나 간단한 렌즈를 사용하여 피질15의 특정 영역을 표적으로 삼을 수 있습니다. 섬유에서 나오는 빛은 빠르게 발산하여 목표 영역을 넘어 피질 조직에 도달합니다. 광섬유 출력에 비구면 렌즈(f =16mm)를 통합하면 빛을 더 작은 표면적(그림 3A, C)으로 대략 단일 피질 기둥의 직경(그림 3C)까지 집중시킬 수 있습니다. 빛은 또한 피질 내에서 덜 갈라집니다. 이상적으로는 레이저 또는 탠덤 렌즈 세트와 함께 강력한 광원을 사용하면 시준된 광선으로 단일 피질 기둥을 대상으로 할 수 있습니다. 그러나 빛이 조직 내에서 산란되어 이웃 기둥을 부분적으로 비출 수 있다는 점을 고려하는 것이 중요합니다. μECoG 데이터에서 측정된 빛 아티팩트는 빛이 피질 표면을 통해 전달된 위치를 보여줍니다. 그림 3B 와 그림 3D의 비교를 참조하십시오. 광 아티팩트는 광 발생 후 5ms 후 고주파 범위(65-500Hz)에서 피크 전력으로 측정됩니다.

그림 3: 피질의 초점으로의 빛 전달. (A) 직경 1mm의 광섬유에서 나오는 빛은 뇌 표면에 집중됩니다. 이 간단한 조정을 통해 뇌 표면과 조직 내에서 빛을 보다 정확하게 조준할 수 있습니다. (B) 뇌에 전달되는 빛의 공간적 범위는 광전기 인공물에서 측정됩니다. (씨,디) 설정은 200μm 광섬유가 있는 패널 A, B와 같으며, 이를 통해 대략 피질 기둥 크기인 250μm 직경의 영역을 직접 대상으로 할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Rat μECoG 및 Laminar Polytrode 녹음
도 4A-D는 쥐의 1차 청각 피질 기록에 사용되는 시스템의 다양한 구성 요소의 이미지를 제공합니다. 구체적으로 (1) μECoG 마이크로 매니퓰레이터, (2) 설치류 입체 리그, (3) ZIF 클립 커넥터가 있는 μECoG 케이블, (4) 층류 폴리트로드 마이크로 매니퓰레이터, (5) 쥐 코 원뿔 및 머리 안정화 장치, (6) 자극 프레젠테이션을 위한 정전기 스피커, (7) ZIF 클립 어댑터가 있는 층류 폴리트로드 케이블, (8) 두 갈래 포크로 부착된 μECoGZIF 클립, (9) 32채널 폴리트로드 장치, (10) 정전기 스피커, (11) 수술 부위를 열린 상태로 유지하기 위한 악어 클립, (12) 접지선, 하나는 왼쪽 후방 사분면 또는 오른쪽 전방 사분면의 버 구멍을 통해 피질에 삽입되고 다른 하나는 조직에 접지, (13) μECoG 그리드의 클로즈업 뷰, (14) 삽입 된 polytrode의 클로즈업 뷰. 그림 4E는 동일한 주파수 및 감쇠(N = 20 시도)의 50ms 톤 핍에 대한 응답으로 단일 μECoG 전극의 기록된 전위에서 파생된 평균 신경 스펙트로그램을 표시합니다. 주파수에 걸쳐, 유발된 반응은 자극 시작 후 25ms에서 30ms(빨간색 실선으로 표시) 사이의 날카로운 피크를 나타냅니다(왼쪽 회색 점선). 자극 시작(표면상 acausal) 이전의 명백한 응답은 신호를 필터링(인과적이지만 위상 오프셋을 유도)하는 대신 평활화(acausal, 위상 오프셋 없음)하는 constant-Q 변환의 낮은 주파수에서 대역폭이 크기 때문입니다. 따라서 피크 응답의 시간은 정확한 상태로 유지됩니다. 최대 유발 반응 시점에, 우리는 z-점수가 매겨진 피질 표면 전위(CSEP)가 주파수에 걸쳐 다중 모드임을 관찰했습니다. 구체적으로, 3개의 1차 비조화 피크를 나타냈습니다: 첫 번째는 40-180Hz 감마/고감마(γ/Hγ) 범위, 두 번째는 200-450Hz 초고감마(uHγ) 범위, 최종 피크는 MUA(Multi-Unit Activity)와 관련된 500Hz 이상입니다(그림 4F)11. 이 자극 유발 다중 모드 구조는 모든 튜닝된 전극에서 견고합니다. 여기에서는 인간 피질검사(ECoG) 기록에서 Hγ가 널리 퍼져 있기 때문에 Hγ에 초점을 맞춥니다31. 그림 4G에서는 피질 표면 전위(CSEP)와 피질 층류 전반의 스파이크 활동을 동시에 측정하기 위해 실리콘 층류 폴리트로드와 함께 경막하 위치에 배치된 μECoG 어레이를 보여줍니다. 맞춤형으로 제작된 μECoG 어레이는 20μm 피치와 4μm 접촉 직경의 8×16개 전극으로 구성되었으며, 4μm 피치 및 1μm 접촉 직경의 2개 × 16개 채널로 구성된 32채널 층류 폴리트로드를 사용했습니다. μECoG 어레이는 전체 쥐의 1차 청각 피질(A1)을 커버할 수 있을 만큼 충분히 컸으며, 직경이 4μm인 작은 전극을 통해 청각 튜닝을 유도하는 데 적합한 국소 CSEP를 측정할 수 있었습니다. μECoG 고감마(Hγ) 신호의 공간 분해능은 ~20μm로, 쥐 피질 기둥의 반경과 비슷합니다. 따라서 μECoG는 피질 활동의 "원주적 관점"을 제공합니다. μECoG 그리드의 천공을 통해 층류 폴리트로드가 표면 접촉 사이를 통과할 수 있어 피질 층을 가로지르는 뉴런 활동을 직접 기록할 수 있습니다(그림 4H). μECoG 및 층류 폴리트로드 전극에서 기록된 전압 트레이스의 예는 그림 4I에 나와 있습니다.

그림 4: 쥐의 1차 청각 피질(A1)을 통한 μECoG 및 층류 다중(laminar polytrode) 신호 기록. (A) μECoG 및 층류 폴리트로드 설정의 구성 요소. 텍스트를 참조하십시오. (B) μECoG 및 층류 폴리트로드 기록 전 수술 설정의 평면도, 머리 지지대 및 개두술 부위의 위치를 보여줍니다. (C) 노출된 청각 피질의 μECoG 그리드 및 층류 폴리트로드의 상세 보기. (D) 개별 전극(40μm) 및 전극 사이(200μm)의 크기를 포함하여 피질의 μECoG 그리드 배치에 대한 근접 보기. (E) 단일 주파수-감쇠 쌍에 대한 단일 채널 응답의 평균 z-스코어 웨이블릿 분해. 빨간색 세로선은 F.(F) Red- 단일 주파수-감쇠 쌍의 20개 프레젠테이션에 걸친 평균 피크 주파수 응답에 표시된 피크 주파수 응답 기간을 나타냅니다. 회색- 표준 오류입니다. 주파수 축은 로그 스케일에 있습니다. 표준 신경 주파수 대역은 상단에 표시되어 있습니다. (G) 쥐의 1차 청각 피질 표면에 있는 8 16 μECoG 그리드의 현미경 사진(A1). 32채널 층류 폴리트로드가 중앙 μECoG 창에 삽입되었습니다. (H) 피질 활동의 3D 멀티스케일 기록의 개략도. (I) 상단: 50ms 순음 pips의 스펙트로그램. 중간: 빨간색은 4μECoG 전극(회색)의 평균 피질 표면 전위입니다. 하단: 32채널 층류 폴리트로드 전압 트레이스는 피질 깊이에 따라 정렬됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 5는 층류 실리콘 폴리트로드(Camb64)를 사용하여 스파이크 활동과 동시에 μECoG 신호를 기록한 것을 보여줍니다. 표면 전극에서 기록된 μECoG 신호는 원시 전압 트레이스(그림 5A) 및 웨이블릿 변환으로 표시되어 시간 경과에 따른 주파수 분해를 강조합니다 (그림 5B). 다중 장치 활성은 단일 채널(그림 5C)의 대표적인 원시 전압 트레이스에서 알 수 있듯이 폴리트로드를 사용하여 기록되었으며, 여기서 간단한 임계값 설정(-120μV 임계값을 넘는 전압)을 사용하여 개별 활동 전위(스파이크)를 감지했습니다. 이 채널에서 추출된 스파이크 파형은 여러 뉴런 소스에서 발생할 수 있지만 대부분의 스파이크에 대해 잘 정의되어 있습니다(그림 5D, 삽입 사진). 동일한 침투의 여러 채널에서 평균 스파이크 파형은 잘 정의된 스파이크 활동 기록의 일관성을 더욱 확인시켜줍니다(그림 5E). 따라서 이러한 기록 방법은 스파이크 정렬 분석 및 인터스파이크 간격 또는 발사 속도와 같은 품질 지표 분석을 통한 단일 단위 기록을 지원할 수 있습니다(그림 5F). 요약하면, 층류 프로브 기록의 품질은 양호하며 단일 채널에서 명확한 파형 형태를 제공합니다. 이러한 결과는 이 방법을 통해 μECoG와 스파이크 활성을 동시에 획득할 수 있음을 보여줍니다.

그림 5: μECoG 및 원주형 스파이크 활동의 동시 기록. (A) 단일 μECoG 채널의 원시 전압 추적의 예. (B) 동일한 μECoG 채널의 웨이블릿 변환, 시간 경과에 따른 주파수 분해를 보여줍니다. (C) 단일 폴리트로드 채널(예: 64채널 실리콘 프로브 camb64)의 원시 전압 트레이스, 간단한 전압 임계값을 사용하여 감지된 활동 전위(스파이크)를 보여줍니다. (D) (C)의 폴리트로드 채널에서 추출된 스파이크 파형은 전압 진폭의 분포에 따라 정렬되고 색상으로 구분되었습니다. 142개의 스파이크 파형 중 7개는 스파이크 너비와 진폭에서 메인 클러스터로부터의 거리에 따라 이상값으로 간주되었기 때문에 표시되지 않습니다(삽입 참조). (E) 동일한 침투에서 9개 채널에서 추출된 평균 다중 장치 스파이크 파형. (F) 서로 다른 폴리트로드 채널(예: 채널 21, 27, 63 및 61)에 대한 인터스파이크 간격(ISI) 히스토그램, 해당 발사 속도(FR)는 Hz로 표시됩니다. ISI 위반(< 5ms)은 모든 장치에서 스파이크의 5% 미만을 나타냈습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
맞춤형으로 설계된 μECoG 어레이와 층류 폴리트로드를 사용하여 동시 녹음을 수행할 수 있는 기능을 통해 청각 튜닝 측면에서 피질 깊이에 걸쳐 μECoG 신호가 신경 단위 기록과 어떻게 비교되는지 조사했습니다. 그림 6A 는 고감마(Hγ) 응답을 청각 자극 주파수 및 진폭의 함수로 나타내는 FRA(Frequency-Response Amplitude) 플롯을 보여줍니다. 상단 패널은 청각 피질에 위치한 μECoG 전극의 2 × 16 하위 집합에서 FRA를 표시하고, 하단 패널은 μECoG 어레이의 천공(회색 화살표로 표시)을 통해 삽입된 층류 폴리트로드 전극의 1×16 하위 집합에서 FRA를 표시합니다. 놀랍게도, μECoG 전극에서 얻은 FRA는 층류 폴리트로드 기록의 FRA와 매우 유사하며, 이는 μECoG 신호가 피질층을 가로지르는 신경 단위 활동과 유사하게 조정됨을 시사합니다.
μECoG 어레이의 높은 공간 해상도를 활용하여 Hγ 활동11을 기반으로 여러 청각 피질 필드의 고해상도 토노토픽 맵을 생성했습니다. 그림 6B에서 각 전극의 최적 주파수는 색상으로 구분되어 피질 표면을 가로지르는 토노토피 조직을 드러냅니다. 8 × 16 μECoG 어레이는 1차 청각 피질(A1), 후방 청각 필드(PAF) 및 복부 청각 필드(VAF)를 포함한 여러 청각 피질 필드를 커버하며 대략적인 경계는 검은색 선으로 구분되었습니다. 이 상세한 매핑은 대뇌피질 활동의 "원주형 보기"를 제공하는 μECoG 어레이의 기능을 강조하며, 쥐 피질 기둥의 치수에 필적하는 20μm 미만의 공간 해상도로 기능적 조직을 캡처합니다. 이러한 결과는 μECoG 기록이 대뇌피질 깊이에 걸친 신경 단위 기록에서 관찰된 튜닝 특성을 반영할 뿐만 아니라 기능적 대뇌피질 조직의 고해상도 매핑을 가능하게 한다는 것을 보여줍니다.
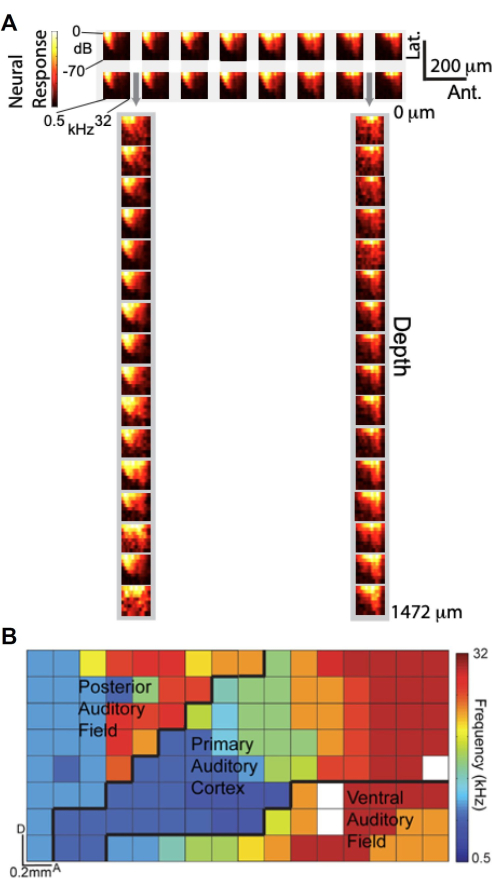
그림 6. μECoG 신호는 깊이 전반에 걸친 신경 단위 스파이크 기록과 유사하게 조정되어 청각 피질의 토노토픽 조직을 드러냅니다. (A) 주파수 응답 진폭 플롯(FRA)은 고감마 응답(컬러 바)을 청각 자극의 주파수(x축) 및 진폭(y축)의 함수로 표시합니다. (맨 위) 청각 피질에 있는 μECoG 전극의 2 16개 하위 집합에서 나온 FRA; (아래) μECoG 어레이의 천공을 통해 삽입된 층류 폴리트로드 전극의 1 16 하위 집합의 FRA는 회색 화살표로 표시됩니다. (B) 고감마 활동에서 파생된 여러 청각 피질 필드의 고해상도 토노토픽 조직. 각 픽셀은 해당 전극의 최적 주파수에 따라 색상으로 구분됩니다. 여기에 표시된 8x16 μECoG 어레이는 여러 청각 피질 필드(A1, PAF 및 VAF)를 포함하며 대략적인 경계(검은색 선)가 표시되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명된 프로토콜을 통해 고밀도 마이크로 전기 피질검사(μECoG) 어레이를 층류 프로브 및 광유전학 기술과 통합할 수 있습니다. 설치류 모델에서 이 프로토콜의 사용이 용이하기 때문에 피질 역학 조사를 위한 강력한 도구가 되며 피험자 수를 쉽게 늘릴 수 있습니다. 고밀도 μECoG 그리드는 생쥐와 쥐의 여러 영역에 걸쳐 피질 지형을 효율적이고 공간적으로 정밀하게 매핑할 수 있도록 하여 뇌 조직에서 지형 표현의 중요한 역할을 활용합니다33. 층류 기록(laminar recording)을 추가하면 여러 공간 및 시간 규모에 걸쳐 피질 역학을 검사할 수 있습니다. 광유전학을 포함하면 인과 조작을 통해 특정 신경 집단과 피질 표면 유발 전위(CSEP) 및 피질 처리에 대한 기여도 사이의 관계를 결정할 수 있습니다34.
광유전학은 특정 뉴런 집단의 선택적 조절을 가능하게 하여 피질 활동 패턴을 생성하는 데 있어 인과적 역할을 조사하고 μECoG로 서명을 감지할 수 있는 계산에 참여할 수 있도록 합니다. 예를 들어, 본 연구는 특정 세포 유형을 표적으로 삼는 것이 피질 표면 전위(CSEP)를 변화시킬 수 있음을 보여줍니다. 이 접근 방식은 μECoG 신호의 신경 세포 유형 기반을 해부하는 데 사용할 수 있으며, 이를 통해 높은 감마 대역에서 관찰되는 것과 같은 특징적인 감각 유발 활동에 기여하는 신경 세포 유형을 식별할 수 있습니다. 다른 주파수 대역21의 피질 리듬과 같은 다른 대규모 현상이나 진행파35,36를 포함한 공간적으로 조직된 활동도 유사하게 조사할 수 있습니다. 또한 다양한 유전자 변형 마우스 라인과 옵신을 쉽게 사용할 수 있어 특정 회로 메커니즘을 탐색할 수 있는 기회를 제공합니다. 광유전학적 기법은 주위 억제(surround suppression)38 또는 지각 결합(perceptual binding 39)과 같은 다양한 감각 계산에서 결정적인 역할을 하는 열(37) 사이의 수평 연결의 기능적 효과를 조사하기 위해 사용될 수 있다. 요약하면, 광유전학을 통해 뉴런 활동을 조작할 수 있는 기능을 통해 특정 뉴런 집단과 CSEP의 속성 간의 연결 또는 μECoG로 측정할 수 있는 특정 피질 계산과 집단 간의 연결을 테스트할 수 있습니다. 이 접근법은 국소 신경 구조와 전체 피질 활동 사이의 관계를 효과적으로 해부할 수 있습니다.
층류 폴리트로드 기록은 작은 피질 부피 내, 즉 개별 피질 기둥 내의 여러 뉴런에서 단일 뉴런 활동을 샘플링할 수 있습니다. 이러한 기록은 개별 뉴런이 Quiroga et al.40에 의해 기술된 "Jennifer Aniston 뉴런"과 같은 자극의 선택적 코딩을 사용하거나 혼합 선택성41에서 볼 수 있듯이 더 높은 차원 공간에서 보완적인 표현을 제공함으로써 고유한 정보를 독립적으로 인코딩할 수 있기 때문에 중요합니다. 전통적으로 전기생리학자들은 단순하고 파라메트릭하게 설계된 자극과 행동(예: 여기에 배치된 단일 수염 편향 또는 순수한 음색)의 맥락에서 신경 활동을 연구했습니다. 이러한 자극의 표현은 상당히 공간적으로 국소화되는 경향이 있습니다(예: 개별 열). 그러나 많은 행동학적으로 관련된 자극과 행동은 더 복잡하기 때문에 이러한 패러다임 동안 신경 활동의 전형적인 패턴은 종종 단일 열을 넘어 뇌 전체로 확장됩니다42. 이러한 경우 μECoG는 여러 컬럼에 걸쳐 동시에 높은 시간 분해능, 컬럼 분해 활성을 캡처하는 포괄적인 판독값을 제공합니다. 요약하면, 여기에 설명된 프로토콜은 개별 피질 열 내의 로컬 처리와 전체 피질 영역 및 영역에 걸쳐 여러 열에서 발생하는 보다 광범위한 역학 사이의 격차를 효과적으로 연결합니다.
일반적인 지침 및 문제 해결로 몇 가지 권장 사항을 제안합니다. 기존의 급성 생체 내 전기생리학 프로토콜은 일반적으로 노출된 뇌의 건강을 연장하는 수단으로 노출 중에 뇌를 젖은 상태로 유지하는 것이 좋습니다. 이것은 일부 상황에서 유용할 수 있지만, 우리의 경험에 따르면 설치류의 μECoG 기록에는 그 반대가 사실입니다. 실제로, 우리는 μECoG 어레이를 약간 건조한 피질 표면에 배치했을 때 기록 품질이 질적으로 더 우수하다는 것을 발견했습니다. 우리는 이것이 피질 표면과 기록 전극 사이에 위치한 전도성이 높은 이온 용액인 식염수가 뇌에서 생성된 전기 신호를 균질화하기 때문에 발생한다고 믿습니다. 실질적으로, 식염수는 전극을 함께 '단락'시키는 것입니다. μECoG 그리드는 뉴런 집단에 의해 생성된 연속적인 전기장을 모니터링하기 때문에 전기생리학적 시스템이 잘 조립되고 잡음이 제거되었는지 확인하는 것이 중요합니다. 녹음하는 동안 기준 전극과의 연결이 중요합니다. 기록 중 개선이 없으면 데이터 전처리 시 50Hz 또는 60Hz에서 노치 필터를 통합하여 라인 노이즈를 제거할 수 있습니다. 그러나 이는 신호를 극적으로 변화시키므로 후속 분석에서 고려해야 합니다. 광유전학적 광 자극을 고려할 때, 광전기 아티팩트는 최소화하거나 최소한 실험 설계에서 설명되어야 합니다(예: 빛의 시작 또는 오프셋에 따른 지연을 포함하여). 이상적으로는, 작은 광섬유 직경을 사용하거나 빛을 집중시키거나 시준하여 전극 사이의 영역으로 빛이 전달됩니다. 이 아티팩트를 완전히 피할 수 없는 경우(그러나 투명 전극을 포함하여 다른 프로브 설계 15,20,43을 제안하는 연구 참조) 필요한 최소한의 빛을 사용하여 줄일 수 있습니다. 차세대 옵신은 효과를 위해 더 적은 빛을 필요로 한다44,45. 층류 프로브를 사용하여 실험하기 전에 광유전학적 광 출력을 보정하는 것이 좋습니다. 아티팩트 모양은 또한 광 자극의 급격한 전환을 피함으로써 수정 및 감소할 수 있습니다(예: 사각형 펄스 대신 광 램프 사용). 어쨌든, 옵신을 발현하지 않는 동물을 사용한 대조 조건은 신경 활동의 진정한 변화를 인공물 관련 신호와 구별하기 위해 바람직합니다. 마지막으로, 전착 공정은 전극과 조직 사이의 전하 전달을 향상시키는 거칠고 높은 표면적 코팅을 생성하며, 기록 중 기계적 안정성을 유지하고, 베어 플래티넘에 비해 전극 임피던스를 1-2배 감소시키며, 더 나은 신경 신호 감지를 가능하게 합니다46.
Acute μECoG는 실험 설정에서 유연성을 제공하고 복잡성을 줄여 수십 분 분량의 기록 과정에서 신경 활동을 자세히 매핑할 수 있습니다. 중간 규모 방법으로서, 그것은 피질 활동의 영역 간 추적을 가능하게하지만 전체 뇌 추적은 가능하지 않지만 신호의 정확한 소스는 불확실합니다 1,47. 앞으로는 멀티모달 연구를 통해 신호의 출처에 대한 더 나은 그림을 제공할 수 있을 것입니다. 급성 μECoG는 장기적인 신경 역학을 포착하는 데 한계가 있으며 외과적 회복 또는 마취와 같은 일시적인 요인의 영향을 받을 수 있습니다48,49. 이와는 대조적으로, 만성 μECoG는 신경 활동을 장기간 관찰할 수 있게 하여 학습, 가소성 및 질병 진행과 같은 과정에 대한 통찰력을 제공합니다10,13. 만성 μECoG는 또한 전극 안정성, 잠재적인 신호 저하 및 조직 흉터 또는 감염을 포함한 장기 이식과 관련된 위험과 같은 문제를 제시합니다50,51. 이러한 문제는 관통 전극과 비교할 때 덜 심각한 경향이 있으며 마우스에 μECoG를 경막외 이식하면 더욱 감소하는 것으로 추정됩니다(신호 품질이 낮아짐)52. 동일하거나 다른 동물의 여러 세션에서 동일한 μECoG 그리드를 재사용하여 세션이 끝날 때 그리드를 제거하고 다음 세션에서 교체할 수 있습니다. 이 아급성 구성에서 뇌는 항상 촉촉한 상태를 유지해야 하며 세션 사이에 유리 커버슬립으로 보호해야 합니다. 우리는 μECoG 그리드가 상당히 내구성이 있음을 관찰했습니다. 개별 그리드는 적절한 취급 및 청소를 통해 ~20회 재사용할 수 있으므로 비용 효율적인 기록 장치가 됩니다. 그리드는 전극 레이아웃의 다양한 수와 형상으로 설계할 수 있습니다. 여기서의 결과는 전극 피치를 <200μm로 줄이면 기본 피질에서 신경 표현의 세분성으로 인해 기능 해상도가 미미하게 개선된다는 것을 시사합니다.
공개
저자는 경쟁하는 재정적 이해관계가 없다고 선언합니다.
감사의 말
이 작업은 로렌스 버클리 국립 연구소 LDRD for the Neural Systems and Machine Learning Lab (K.E.B.), NINDSR01 NS118648A (K.E.B.& D.E.F.) 및 NINDS R01 NS092367 (D.E.F.)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 disposable #11 blade | Swann Morton | 303 | For surgical procedures |
| 2 disposable #10 blades | Swann Morton | 3901 | For surgical procedures |
| 30 mm cage bars | Thorlabs | ER | cage components |
| 30 mm cage plate | Thorlabs | CP33T | holding the lenses |
| 70% ethanol | Decon Labs | V1016 | Cleaning / Disinfectant (diluted to 70%) |
| Amalgambond PLUS Adjustable Precision Applicator Brush Teal 200/Bx | Henry Schein | 1869563 | precision applicator for the cement |
| Amalgambond PLUS Catalyst 0.7 mL Syringe Ea | Henry Schein | 1861119 | cement component |
| Amplifier (Tucker-Davis Technologies) | Tucker-Davis Technologies | PZ5M-512 | Used for auditory stimulus and recording software. |
| Articulated arm | Noga | DG60103 | for holding the fine adjustment screw system |
| Aspheric lenses for light collection (and one for focusing the light) | Thorlabs | ACL25416U-B | for collecting LED light |
| Auditory equipment | Tucker-Davis Technologies, Sony, Cortera | RP2.1 Enhanced Real-Time Processor/HB7 Headphone Drive | Used for auditory stimulus and recording software. |
| Buprenorphine | Sterile Products LLC | #42023017905 | General analgesia |
| C&B Metabond Base Cement Ea | Henry Schein | 1864477 | cement component |
| C&B Metabond L-Powder Cement Clear 3 g | Henry Schein | 1861068 | cement component |
| Chlorprothixene hydrochloride (mouse) | Sigma Aldrich | Cat. No. C1671 | For sedation, must be prepared the same day and kept at 4 |
| Custom-designed 128-channel micro-electrocorticography (μECoG) grids | Neuronexus | E128-200-8-40-HZ64 | For neurophysiology recordings. Placed onto the cortex. |
| Dengofoam gelatin sponges | Dengen dental | 600034 (SKU) | can be used dry or wet, saturated with sterile sodium chloride solution |
| Drill bit, size 5 to 9 (Mouse) | Fine Science Tools | 19007-XX | XX is the size of the drill bit e.g. 05 or 09. For mouse procedures |
| Drill bitSteel Round Bur (5.5 mm/7.5 mm) | LZQ Tools | Dental Bar Drill Bit Stainless Steel Bur | For rat procedures |
| Dumont No. 5 forceps | Fine Science Tools | 11251-10 | For surgical procedures |
| Dumont tweezers #5 bent 45° | World precision instruments | 14101 | for removing craniotomy window |
| DVD Player (Sony) | Sony | CDP-C345 | System used to accept and play back stimulus sets |
| Electrostatic Speaker | Sony | XS-162ES | Used for auditory stimulus and recording software. Located within the rig, plays sound to the sedated rodent |
| Enzymatic detergent (Enzol) | Advanced sterilization products | 2252 | Cleaning/Disinfectant |
| EverEdge 2.0 Scaler Sickle Double End H6/H7 #9 | Henry Schein | 6011862 | for scrubing the skull |
| Fine adjustment screw system in 3 dimension | Narishige | U-3C | for precise positioning of the optical fiber end |
| Gold pin | Harwin Inc | G125-1020005 | Used for contact reference in mouse Soldered to the silver wire |
| Gripping forceps | Fine Science Tools | 00632-11 | For surgical procedures |
| Isoflurane | Covetrus | 11695067772 | require a vaporizer |
| Ketamine (Hydrochloride Injection) (Rat) | Dechra | 17033-101-10 | Anesthesia/Analgesic |
| LED | New Energy | LED XLAMP XPE2 BLUE STARBOARD | Blue LED light source |
| LED driver | Thorlabs | LEDD1B | LED driver |
| Lidocaine | Covetrus | VINB-0024-6800 | to be diluted to 1% in saline |
| Meloxicam | Covetrus | 6451603845 | Anti-inflammatory used for general analgesia |
| Micromanipulator | Narishige (Stereotaxic Rig) | SR-6R + SR-10R-HT components | Used to manipulate ECoG and rodent with fine movements |
| No. 2 forceps | Fine Science Tools | 91117-10 | For surgical procedures |
| No. 55 forceps | Fine Science Tools | 1129551 | For surgical procedures |
| Ophtalmic lubricant (Artificial tears) | Akorn | 17478-062-35 | Used to protect eyes from dessication during surgical procedures |
| Optical fiber 200µm Core diameter | Thorlabs | M133L02 | FC/PC connector 2 m long |
| Pentobarbital (Rat) | Covetrus / Dechra | VINV-C0II-0008 | Anesthesia/Analgesic |
| Platinum Black | Sigma | 205915-250MG | For neurophysiology recordings (Used for electroplating the contacts on the μECoG grids). |
| Povidone Iodine 10% | Betadine | https://betadine.com/medical-professionals/betadine-solution/ | no catalog number ( not retail ) |
| Powder detergent (Contrex AP) | Decon Labs | 5204 | Cleaning / Disinfectant |
| Pre-cut tape for oxygen tube | ULINE (Various Providers) | S-14726 | Used to attach oxygen tube to the nose-cone of the rodent stereotaxic rig |
| Scalpel handle # 3 | World precision instruments | 500236-G | for blades # 10, #11 and #15 |
| Scraper | Fine Science Tools | 1007516 | For surgical procedures |
| Short 30 G needles | ExelInt | 26437 | For surgical procedures and injections |
| Silver Wire | Warner Instruments | 63-1319 | For neurophysiology recordings (Used for grounding and as a reference electrode). |
| Sterilized saline (0.9% sodium chloride for injection) | Hospira | 00409-7101-67 (NDC) | For dilution of injectable, and replacement of body fluids |
| Stoelting Hopkins Bulldog | Fine Science Tools | 10-000-481 | For surgical procedures |
| Surface disinfectant (Coverage Plus NDP Disinfectant) | Steris life science | 638708 | Cleaning/Disinfectant |
| TDT ZIF-clip connectors for acquisition. | Tucker-Davis Technologies | ZIF-Clip Analog Headstages | Connects ECoG with outside acquisition equipement |
| Two-pronged holding fork | Tucker-Davis Technologies | Z-ROD128 | Used to connect the TDT-clips with the micromanipulator |
| Xylazine (Rat) | Covetrus | 1XYL006 | Anesthesia/Analgesic |
참고문헌
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nunez, P. L., Srinivasan, R. . Electric Fields of the Brain: The Neurophysics of EEG. , (2006).
- Mountcastle, V. B., Powell, T. P. Central nervous mechanisms subserving position sense and kinesthesis. Bull Johns Hopkins Hosp. 105, 173-200 (1959).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci. 18 (2), 310-315 (2015).
- Lewis, C. M., Bosman, C. A., Womelsdorf, T., Fries, P. Stimulus-induced visual cortical networks are recapitulated by spontaneous local and interareal synchronization. Proc Natl Acad Sci U S A. 113 (5), E606-E615 (2016).
- Bouchard, K. E., Mesgarani, N., Johnson, K., Chang, E. F. Functional organization of human sensorimotor cortex for speech articulation. Nature. 495 (7441), 327-332 (2013).
- Ledochowitsch, P., et al. Fabrication and testing of a large area, high density, parylene MEMS µECoG array. , (2011).
- Bosman, C. A., et al. Attentional stimulus selection through selective synchronization between monkey visual areas. Neuron. 75 (5), 875-888 (2012).
- Rubehn, B., Bosman, C., Oostenveld, R., Fries, P., Stieglitz, T. A MEMS-based flexible multichannel ECoG-electrode array. J Neural Eng. 6 (3), 036003 (2009).
- Baratham, V. L., et al. Columnar localization and laminar origin of cortical surface electrical potentials. J Neurosci. 42 (18), 3733-3748 (2022).
- Kellis, S., et al. Decoding spoken words using local field potentials recorded from the cortical surface. J Neural Eng. 7 (5), 056007 (2010).
- Viventi, J., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci. 14 (12), 1599-1605 (2011).
- Ledochowitsch, P., Olivero, E., Blanche, T., Maharbiz, M. M. A transparent µECoG array for simultaneous recording and optogenetic stimulation. , (2011).
- Ledochowitsch, P., et al. Strategies for optical control and simultaneous electrical readout of extended cortical circuits. J Neurosci Methods. 256, 220-231 (2015).
- Dougherty, M. E., Nguyen, A. P. Q., Baratham, V. L., Bouchard, K. E. Laminar origin of evoked ECoG highgamma activity. Annu Int Conf IEEE Eng Med Biol Soc. 2019, 4391-4394 (2019).
- Tian, H., Xu, K., Zou, L., Fang, Y. Multimodal neural probes for combined optogenetics and electrophysiology. iScience. 25 (1), 103612 (2022).
- Gonzales, D. L., et al. A translaminar spacetime code supports touchevoked traveling waves. bioRxiv. , (2024).
- Leonard, M. K., et al. Largescale singleneuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Renz, A. F., et al. OptoEDura: a soft, stretchable ECoG array for multimodal, multiscale neuroscience. Adv Healthc Mater. 9 (17), 2000814 (2020).
- Buzsáki, G. . Rhythms of the brain. , (2006).
- Yang, W., et al. A fully transparent, flexible PEDOT:PSS-ITO-Ag-ITO based microelectrode array for ECoG recording. Lab Chip. 21 (6), 1096-1108 (2021).
- Buzsáki, G. Largescale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Schalk, G., et al. Realtime detection of eventrelated brain activity. Neuroimage. 43 (2), 245-249 (2008).
- Kellis, S., et al. Multiscale analysis of neural activity in humans: implications for microscale electrocorticography. Clin Neurophysiol. 127 (1), 591-601 (2016).
- Buzsáki, G., Schomburg, E. W. What does gamma coherence tell us about interregional neural communication. Nat Neurosci. 18 (4), 484-489 (2015).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecondtimescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Cardin, J. A., et al. Driving fastspiking cells induces gamma rhythm and controls sensory responses. Nature. 459 (7247), 663-667 (2009).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decisionrelated activity propagate in a cortical feedback loop during touch perception. Nat Neurosci. 19 (9), 1243-1249 (2016).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56 (2), 339-355 (2007).
- Crone, N. E., Sinai, A., Korzeniewska, A. Highfrequency gamma oscillations and human brain mapping with electrocorticography. Prog Brain Res. 159, 275-295 (2006).
- Gerfen, C. R., Paletzki, R., Heintz, N. GENSAT BAC crerecombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron. 80 (6), 1368-1383 (2013).
- Mountcastle, V. The columnar organization of the neocortex. Brain. 120 (4), 701-722 (1997).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Muller, L., Chavane, F., Reynolds, J., Sejnowski, T. J. Cortical travelling waves: mechanisms and computational principles. Nat Rev Neurosci. 19 (5), 255-268 (2018).
- Sato, T. K., Nauhaus, I., Carandini, M. Traveling waves in visual cortex. Neuron. 75 (2), 218-229 (2012).
- Gilbert, C. D., Wiesel, T. N. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortex. J Neurosci. 9 (7), 2432-2442 (1989).
- Angelucci, A., et al. Circuits and mechanisms for surround modulation in visual cortex. Annu Rev Neurosci. 40 (1), 425-451 (2017).
- Singer, W., Gray, C. M. Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci. 18, 555-586 (1995).
- Quiroga, R. Q., et al. Invariant visual representation by single neurons in the human brain. Nature. 435 (7045), 1102-1107 (2005).
- Fusi, S., Miller, E. K., Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr Opin Neurobiol. 37, 66-74 (2016).
- Stringer, C., et al. Spontaneous behaviors drive multidimensional, brainwide activity. Science. 364 (6437), eaav7893 (2019).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using celltypespecific expression of channelrhodopsin2. Nat Protoc. 5 (2), 247-254 (2010).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nat Neurosci. 21 (6), 881-893 (2018).
- Mahn, M., et al. Highefficiency optogenetic silencing with somatargeted anionconducting channelrhodopsins. Nat Commun. 9 (1), 4125 (2018).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating lowimpedance tetrodes by electroplating with additives. Sens Actuators A Phys. 156 (2), 388-393 (2009).
- Halnes, G., et al. . Electric Brain Signals: Foundations and Applications of Biophysical Modeling. , (2024).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nat Rev Neurosci. 9 (5), 370-386 (2008).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and anesthesia. Science. 322 (5903), 876-880 (2008).
- Schalk, G., Leuthardt, E. C. Braincomputer interfaces using electrocorticographic signals. IEEE Rev Biomed Eng. 4, 140-154 (2011).
- Chestek, C. A., et al. Longterm stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex. J Neural Eng. 8 (4), 045005 (2011).
- Branco, M. P., et al. Nine decades of electrocorticography: a comparison between epidural and subdural recordings. Eur J Neurosci. 57 (8), 1260-1288 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유