Method Article
חקירות רב-ממדיות של עיבוד קליפת המוח על ידי שילוב פוליטרודים למינאריים ואופטוגנטיקה עם מיקרו אלקטרוקורטיקוגרפיה במכרסמים
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים שני פרוטוקולים לרישום מיקרו-אלקטרוקורטיקוגרפיה בצפיפות גבוהה (μEcoG) בחולדות ועכברים, כולל שיטות כירורגיות, השתלה והקלטה. הקלטות μECoG מבוצעות בשילוב עם הקלטת פוליטרודה למינרית בקליפת המוח השמיעתית של החולדה או עם מניפולציה אופטוגנטית של פעילות עצבית בקליפת המוח הסומטוסנסורית של העכבר.
Abstract
אלקטרוקורטיקוגרפיה (ECoG) היא גשר מתודולוגי בין מדעי המוח הבסיסיים להבנת תפקוד המוח האנושי בבריאות ובחולי. ECoG מתעד אותות נוירופיזיולוגיים ישירות מפני השטח של קליפת המוח ברזולוציה זמנית של אלפית שנייה ורזולוציה מרחבית עמודית על פני אזורים גדולים של רקמת קליפת המוח בו זמנית, מה שהופך אותו לממוקם באופן ייחודי לחקר חישובים קליפת המוח המקומיים והמבוזרים כאחד. כאן, אנו מתארים את התכנון של התקני מיקרו-ECoG (μECoG) מותאמים אישית בצפיפות גבוהה ואת השימוש בהם בשני הליכים. לרשתות אלו יש 128 אלקטרודות בעלות עכבה נמוכה עם מרווח של 200 מיקרומטר המיוצרות על מצע פולימרי שקוף עם נקבים בין האלקטרודות; תכונות אלו מאפשרות הקלטת μECoG בו-זמנית עם הקלטות פוליטרודות למינריות ומניפולציות אופטוגנטיות. ראשית, אנו מציגים פרוטוקול לרישום משולב של μECoG אפידורלי על קליפת המוח הסומטוסנסורית של עכברים עם מניפולציה אופטוגנטית של סוגי תאים ספציפיים בקליפת המוח המוגדרים גנטית. זה מאפשר ניתוח סיבתי של התרומות המובהקות של אוכלוסיות עצביות שונות לעיבוד חושי תוך ניטור החתימות הספציפיות שלהן באותות μECoG. שנית, אנו מציגים פרוטוקול לניסויים אקוטיים לתיעוד פעילות עצבית מקליפת המוח השמיעתית של חולדה באמצעות רשתות μECoG ופוליטרודים למינריים. זה מאפשר מיפוי טופוגרפי מפורט של תגובות עצביות מעוררות חושים על פני השטח של קליפת המוח בו זמנית עם הקלטות מיחידות עצביות מרובות המפוזרות על פני עומק קליפת המוח. פרוטוקולים אלה מאפשרים ניסויים המאפיינים פעילות מבוזרת בקליפת המוח ועשויים לתרום להבנה ולהתערבויות בסופו של דבר בהפרעות נוירולוגיות מגוונות.
Introduction
תפקודי המוח העומדים בבסיס התחושה, הקוגניציה והפעולה מאורגנים ומופצים על פני קני מידה מרחביים וזמניים עצומים, החל מעלייה של נוירונים בודדים דרך שדות חשמליים הנוצרים על ידי אוכלוסיות של נוירונים בעמודה קליפת המוח ועד לארגון טופוגרפי של עמודות על פני אזורי מוח (למשל, סומטוטופיה בקליפת המוח הסומטוסנסורית, טונוטופיה בקליפת המוח השמיעתית הראשונית). הבנת תפקוד המוח דורשת חישת אותות חשמליים על פני קני מידה מרחביים אלה1. למדעי המוח יש כיום שיטות רבות בשימוש נרחב לניטור פעילות המוח. מבחינה אלקטרופיזיולוגית, פוליטרודים למינאריים (כגון Neuropixels) מאפשרים ניטור של מספר צנוע (~300) של נוירונים בודדים, בדרך כלל בתוך קומץ עמודות מרוחקות, עם רזולוציה זמנית גבוהה (≥1 קילו-הרץ). הדמיית Ca2+ מאפשרת ניטור של מספר צנוע עד גדול של נוירונים בודדים המזוהים גנטית ואנטומית בטווח מרחבי של ~1-2 מ"מ ברזולוציה זמנית נמוכה יותר (~10 הרץ)2. fMRI מאפשר לנטר את המצב המטבולי של מספר רב של נוירונים (~1 מיליון נוירוניםבנפח 36 מ"מ 3) על פני המוח כולו ברזולוציה זמנית נמוכה מאוד (~0.2 הרץ). EEG/MEG מאפשר ניטור של פעילות חשמלית מכל פני השטח/מוח בקליפת המוח ברזולוציה זמנית צנועה (<100 הרץ) וברזולוציה מרחבית נמוכה מאוד (סנטימטרים)3. בעוד שכל אחת מהמתודולוגיות הללו סיפקה תובנות בסיסיות וסינרגטיות לגבי תפקוד המוח, שיטות המאפשרות חישה ישירה של אותות אלקטרופיזיולוגיים ברזולוציה זמנית גבוהה ממיקומים אנטומיים מדויקים על פני אזורים מרחביים רחבים של קליפת המוח הן בחיתוליהן. הצורך בכיסוי מרחבי רחב מודגש על ידי העובדה שבמוח, תפקוד העצבים משתנה בצורה הרבה יותר דרמטית על פני השטח בהשוואה לעומק4.
אלקטרוקורטיקוגרפיה (ECoG) היא שיטה שבה רשתות של אלקטרודות בעלות עכבה נמוכה מושתלות על פני המוח ומאפשרות הקלטה או גירוי של קליפת המוח 1,5. ECoG נפרס בדרך כלל במסגרות נוירוכירורגיות אנושיות כחלק מהעבודה הקלינית לטיפול באפילפסיה עקשנית מבחינה פרמקולוגית. עם זאת, הוא גם מספק תובנות ייחודיות לגבי עיבוד קליפת המוח המבוזר בבני אדם, כגון דיבור ומיפוי טופוגרפי חושי 6,7. יכולות אלו הניעו את השימוש בו במודלים של בעלי חיים, כולל קופים, חולדות ועכברים 5,8,9,10,11. במכרסמים, הוכח לאחרונה כי מיקרו-ECoG (μECoG) מאפשר ניטור חשמלי ישיר ברזולוציה זמנית גבוהה (~100 הרץ) של אוכלוסיות נוירונים ברזולוציה מרחבית עמודית (~200 מיקרומטר) וכיסוי מרחבי רחב (מילימטרים רבים). μECoG מאפשר לחוקרים לחקור דינמיקה עצבית מבוזרת הקשורה לעיבוד חושי מורכב, תפקודים קוגניטיביים והתנהגויות מוטוריות במודלים של בעלי חיים12,13. ההתקדמות האחרונה שילבה μECoG עם אופטוגנטיקה ורישומי פוליטרודה למינרית 14,15,16,17,18,19,20, מה שמאפשר חקירות רב-ממדיות של רשתות קליפת המוח ומגשר על הפער בין פעילות עצבית בקנה מידה מיקרו לבין דינמיקה קליפת המוח בקנה מידה מאקרו 21,22. באופן קריטי, מכיוון שאות μECoG דומה מאוד בבני אדם ובמודלים של בעלי חיים שאינם אנושיים, השימוש ב-μECoG הופך את תרגום התוצאות והממצאים ממודלים של בעלי חיים לבני אדם להרבה יותר ישיר23. ככאלה, גישות אינטגרטיביות חיוניות לקידום הבנתנו את המעגלים העצביים וטומנות בחובן הבטחה לפיתוח התערבויות טיפוליות חדשות להפרעות נוירולוגיות 5,24,25.
כתוצאה מכך, קיים צורך מתעורר בפרוטוקולים המשלבים מערכי μECoG בצפיפות גבוהה עם הקלטות למינריות וכלים אופטוגנטיים כדי לאפשר חקירות מקיפות בקנה מידה רב של עיבוד קליפת המוח 8,26. כדי להתמודד עם פער זה, פיתחנו התקני μECoG בהתאמה אישית הכוללים 128 אלקטרודות בעלות עכבה נמוכה עם קוטר אלקטרודה של 40 מיקרומטר ומרווח בין אלקטרודות של 20 מיקרומטר על מצע פולימרי גמיש ושקוף (פארילן-C ופולימיד) עם נקבים בין האלקטרודות, המאפשרים רישומי μECoG ופוליטרודה למינרית בו-זמנית עם מניפולציות אופטוגנטיות13,22. היבטים מרכזיים של פרוטוקול ניסיוני זה כוללים: (i) רזולוציה מרחבית עמודית וכיסוי בקנה מידה גדול של פעילות קליפת המוח באמצעות מערכי μECoG בצפיפות גבוהה; (ii) היכולת להקליט משכבות קליפת המוח המרובות באמצעות פוליטרודים למינאריים המוחדרים דרך רשת μECoG; ו-(iii) שילוב של טכניקות אופטוגנטיות להפעלה או עיכוב סלקטיבי של אוכלוסיות עצביות ספציפיות, ובכך לאפשר דיסקציה סיבתית של מעגלים עצביים 27,28,29. התצורה בצפיפות גבוהה מאפשרת הקלטות ברזולוציה מרחבית גבוהה, ומספקת למעשה "תצוגה עמודית" של פעילות קליפת המוח, שכן מחקרים קודמים הראו שאותות μECoG יכולים לפתור פעילות בקנה מידה מרחבי הדומה לקוטר עמוד קליפת המוח של המכרסם (~20 מיקרומטר)11. מתודולוגיה משולבת זו מאפשרת ניטור ומניפולציה בו-זמנית של פעילות עצבית, מה שעשוי לאפשר ניסויים סיבתיים לקבוע את המקורות העצביים של אותות μECoG כמו גם עיבוד קליפת המוח המבוזר. כדי להשיג מטרות אלה, כתב יד זה מספק פרוטוקולים מפורטים לשימוש במערכי μECoG בצפיפות גבוהה בשני שילובים.
ראשית, אנו מתארים μECoG בשילוב עם מניפולציה של תאים פירמידליים בשכבה 5 (L5) בקליפת המוח הסומטוסנסורית הראשונית של העכבר (S1). בעכבר, מערך μECoG ממוקם אפידורלית (בשל העקשנות הכירורגית של דורוטומיה בעכברים). סיב אופטי ממוקם מעל הרשת או משולב עם עדשה כדי למקד את האור האופטוגנטי על פני שטח מטרה קטן של פני השטח של קליפת המוח. האסטרטגיה האופטוגנטית מתוארת כאן לעיכוב של נוירונים מעוררים בשכבה 5, אך ניתן להתאים אותה בקלות לכל אוכלוסיית נוירונים המסופקת עם קו העכבר המתאים, הספציפי לאוכלוסייה, המבטא Cre. שנית, אנו מתארים את השימוש המשולב ב-μECoG עם פוליטרודים למינאריים מסיליקון כדי לתעד בו זמנית פוטנציאלים חשמליים של פני השטח בקליפת המוח (CSEPs) ופעילות זינוק של יחידה אחת מנוירונים מרובים על פני שכבות קליפת המוח השמיעתית של חולדות (A1). למערך יש נקבים בין האלקטרודות, המאפשרים החדרה של פוליטרודים למינאריים רב-ערוציים דרך הרשת כדי לתעד פעילות עצבית על פני שכבות קליפת המוח השונות. במהלך הליך הגולגולת, מערך μECoG ממוקם תת-דוראלי מעל קליפת המוח השמיעתית, והפוליטרודה הלמינרית מוחדרת דרך הנקבים. אותות עצביים מ-μECoG ומהגשושית הלמינרית נרשמים בו זמנית, נדגמים ב-6 קילו-הרץ ו-24 קילו-הרץ, בהתאמה, באמצעות מערכת מגבר המחוברת אופטית למעבד אותות דיגיטלי.
Protocol
שני הפרוטוקולים עוקבים אחר אותם שלבי מפתח (הרדמה, קיבוע, קרניוטומיה, הקלטת μECoG) אך יש להם הבדלים בולטים. בתיאור הבא, השלבים המשותפים ממוזגים, בעוד שהפרטים הספציפיים של כל פרוטוקול מופיעים. שלבים אלה שלהלן תואמים להקלטת μECoG עם אופטוגנטיקה (עכבר) או הקלטת μECoG עם בדיקה למינרית (חולדה). כל ההליכים המתוארים כאן נערכו בהתאם לרשויות האתיות או החוקיות המקומיות (IACUC או ועדות אתיקה). התרופות המשמשות עשויות להשתנות בהתאם לפרוטוקול האתי המאושר.
1. הכנה ופרוטוקול להליכי עכברים וחולדות
- הבדלים בולטים בין פרוטוקולי עכבר וחולדה
- הגדרות לניתוח מול הקלטות אלקטרופיזיולוגיות
- עבור חולדה, השתמש באותה הגדרה הן במהלך ניתוח והן במהלך הקלטות אלקטרופיזיולוגיות.
- עבור עכבר, בצע את הניתוח בהגדרה הראשונה והקלטות אלקטרופיזיולוגיות בהגדרה השנייה.
- קיבוע ראש
- עבור חולדה, השתמש באותו מהדק חוטם לניתוח ורישום אלקטרופיזיולוגי.
- עבור עכבר, השתמש במהדק חוטם לניתוח ובמוט מתכת חיצוני במערך לאלקטרופיזיולוגיה כדי לאפשר קיבוע בהרדמה איזופלורן קלה. השתל את מוט הראש עם מלט דנטלי על הגולגולת.
- הגדרת הקלטה: השתמש באלקטרוניקת רכישה מובחנת, תוכנת הקלטה ותוכנת גירוי חושי עבור שני המינים.
- עבור פרוטוקול העכבר, השתמש במערכת SpikeGadgets (https://spikegadgets.com) ובתוכנת הקוד הפתוח Trodes (https://spikegadgets.com/trodes/) לרכישת נתונים.
- עבור פרוטוקול העכברושים, השתמש בתוכנת ההקלטה Synapse - Neurophysiology Suite (https://www.tdt.com/component/synapse-software/) לרכישת נתונים.
- לגרום להרדמה על ידי הזרקה (חולדה) או שאיפה (עכבר).
- מיקום הקלטה
- בצע הקלטות בקליפת המוח הסומטוסנסורית (S1) עבור עכבר.
- לבצע הקלטות בקליפת המוח השמיעתית הראשונית (A1) עבור חולדה.
הערה: הבדל זה בלוקליזציה האנטומית דורש אתרי קרניוטומיה שונים לכל מין.
- הגדרות לניתוח מול הקלטות אלקטרופיזיולוגיות
- הכנה ובדיקה של הרשת
- השרו את הרשת (למעט לוח המחברים) בחומר ניקוי אנזימטי מדולל (50% חומר ניקוי, 50% מים מזוקקים) למשך שעה אחת לפחות.
- העבירו אותו לאמבט של מים מזוקקים טהורים והניחו לו להתייבש באוויר במקום בטוח ונקי.
- בצע אלקטרודפוזיציה של שחור פלטינה כחלק מההכנה הראשונית של התקן μECoG, לא לפני כל הפעלת הקלטה.
הערה: לאחר ההפקדה, ציפוי הפלטינה השחור יוצר שכבה יציבה שנשארת יעילה עבור הקלטות מרובות, אם כי יש לעקוב אחר ביצועיו באמצעות בדיקת עכבה רגילה. אלקטרודפוזיציה שחורה פלטינה (טווח יעד של 10-20 kΩ ב-1 קילו-הרץ) מפחיתה את עכבת האלקטרודה ומשפרת את יחס האות לרעש בהקלטות עצביות. - כדי לבצע את האלקטרודפוזיציה, הכינו תמיסת חומצה כלורופלטינית (בדרך כלל 1-3% חומצה כלורופלטינית [H2PtCl6]) המכילה כמות קטנה של אצטט עופרת (בסביבות 0.005%) כמשנה תצהיר. חבר את האלקטרודות μECoG כדי לשמש כאלקטרודה העובדת בתא אלקטרוכימי בעל שלוש אלקטרודות, עם אלקטרודה נגדית פלטינה ואלקטרודת ייחוס Ag/AgCl.
- החל צפיפות זרם קבועה של כ-0.5--2 mA/cm² למשך 10-30 שניות תוך ניטור ערכי עכבה.
- בדוק ורשום את העכבה של אלקטרודות רשת (למשל, עם Nano-Z).
- בדוק את הרשת מעל מקור אור והכן את הרשת לשימוש בהקלטה לאחר הניתוח.
- הלחמת כבלים התייחסות
- עבור עכבר, הלחמו את קצה חוט הכסף (אורך 10 מ"מ, 30 גרם) לסיכת זהב לחיבור לכבל הייחוס של מערכת ההקלטה.
2. ניתוח
- הכנת חומרים וניטור כללי (טיפול ורישום בעלי חיים)
- הכנה: יש לנקות ולחטא היטב את אזור הניתוח עם חומר חיטוי מתאים. ודא שכל המכשירים הכירורגיים מעוקרים, בדרך כלל באמצעות חיטוי.
- מיקום כלי כירורגי: סדרו כלים כירורגיים על משטח הניתוח הסטרילי. מלאי את אזור הניתוח באפליקטורים עם קצה כותנה ומשולשים כירורגיים סופגים מכותנה. השלך כל פסולת ביולוגית מסוכנת בשקית סילוק ייעודית.
- ויסות טמפרטורה: הפעל את כרית החימום באתר ההקלטה הניתוחי והאלקטרופיזיולוגי. שלוט בטמפרטורת כרית החימום לאורך כל הניתוח וההקלטה.
- כרית כירורגית: הניחו כרית כירורגית כחולה או שמיכה מעל מיטת ויסות הטמפרטורה.
הערה: כרית זו צריכה לכלול תחתית כותנה לבנה רכה, שאמורה לפנות כלפי מעלה. - מיקום מיקרוסקופ: הכן את המיקרוסקופ ואת התאורה המצורפת (למשל, טבעת LED) לצד אחד של אזור הניתוח. בדוק שהוא פועל כראוי.
- תרגיל כירורגי: הכן את המקדחה הכירורגית להליך הגולגולת.
- אספקת חמצן: הגדר את קצב זרימת מיכל החמצן ל-1.0 ליטר/דקה (חולדה) או 0.5 ליטר/דקה (עכבר) והנח את מסכת החמצן ליד כרית הוויסות. בעל החיים יזדקק לחמצן רציף לאחר ההרדמה.
- החלפת נוזלים: במהלך הניתוח יש להחליף כל אובדן נוזלים המכוון להחלפה של לפחות 1.5% ממשקל הגוף של בעל החיים (עכבר) או 1 מ"ל לשעה (חולדה). הכן פתרונות איזוטוניים בהתאם.
- בעל חיים: יש להביא את בעל החיים ממתקן החי לחדר הניתוח על פי נהלים מאושרים. השתמש בעכברים בגילאי 8 עד 16 שבועות, זכר או נקבה, מרקע C57Bl6; כמו כן, השתמש בחולדות בנות 7 שבועות, זכרים, מזן Sprague Dawley.
- הכנת תרופות: שקלו את החיה באמצעות משקל בדיוק של 0.1 גרם. הכינו את כמויות התרופות המתאימות לניתוח, תוך שימוש בתמיסות מדוללות מראש במידת הצורך.
- אינדוקציה להרדמה
- השראת הרדמה לעכבר
- הנח את החיה בתא האינדוקציה של איזופלורן (3-5% איזופלורן ב-0.5 ליטר/דקה O2).
- לאחר אישור הרדמה עמוקה (היעדר רפלקס בצביטת הזנב/הבוהן), הניחו את החיה על כרית החימום של הניתוח וקבעו אותה בראש.
- הזרקת תרופות תת עוריות לשיכוך כאבים כללי: מלוקסיקם: 5 מ"ג/ק"ג ובופרנורפין: 0.1 מ"ג/ק"ג.
- תקן את העכבר לפי השלבים 2.2.1.5-2.2.1.6.
- הנח את החוטם במסכת ההרדמה ואת הראש בצורה רופפת בתושבת הראש. כדי למקם את העכבר במוט הנשיכה, ראשית, ודא שהלשון נמצאת מתחת למוט ולא בין המוט לגג הפה. השתמש במלקחיים כדי להזיז את הלשון במידת הצורך.
- הכנס את החותכות של החיה לחור במוט של מוט הנשיכה. אבטח את מסכת ההרדמה של העכבר (1.5-2% איזופלורן ב-0.5 ליטר/דקה O2) על ידי הידוק עדין של בורג הקיבוע. ייצוב הראש במהלך הניתוח מובטח אך ורק על ידי מוט הנשיכה.
- הגן על עיני החיה עם משחת עיניים או חומר סיכה על בסיס נפט למניעת ייבוש במהלך הניתוח.
- שמור על הרדמה לאורך כל ההליך עם זרימה רציפה של איזופלורן דרך המסכה.
- השראת הרדמה לחולדה
- השתמש באיזופלורן בתחילה כדי להרגיע את בעל החיים כדי להקל על הזרקת הרדמה אינדוקציה.
- נהל את התרופות להרדמה ושיכוך כאבים:
מלוקסיקם: מינון של 5 מ"ג/ק"ג, ריכוז 10 מ"ג/מ"ל, 0.4 מ"ל/ק"ג
קטמין: מינון של 90 מ"ג/ק"ג, ריכוז 100 מ"ג/מ"ל, 0.9 מ"ל/ק"ג
קסילזין: מינון של 10 מ"ג/ק"ג, ריכוז 100 מ"ג/מ"ל, 0.1 מ"ל/ק"ג - אפשר לבעל החיים להגיע להרדמה עמוקה תוך 15-30 דקות, תלוי במשקל ובגיל.
- ניטור הרדמה
- עקוב באופן רציף אחר החיוניות (קצב הנשימה) של בעל החיים לאורך כל ההליך. בדוק את קצב הנשימה כסימן שימושי במיוחד לשינויים מוקדמים במצב ההרדמה, והתאם את רמת ההרדמה אם קצב הנשימה משתנה.
- רפלקס נסיגת הכפות הוא סימן קריטי למצב ההרדמה. בדוק רפלקס זה מעת לעת, שכן היעדרו המוחלט מבטיח רמות הרדמה מספיקות לניתוח.
- השראת הרדמה לעכבר
- קיבוע ראש וניטור סימנים חיוניים
- ניטור מדדים חיוניים של בעלי חיים
- בדוק ורשום את הסימנים החיוניים של החיה על גיליון ניסוי. אם הרפלקסים של בעל החיים (למשל, נסיגת כפות) אינם כבויים לחלוטין, יש לתת חצי מנה נוספת של קטמין משלים (חולדה) או להגדיל את ריכוז האיזופלורן במרווחים של 0.5% (עכבר).
- קיבוע ראש לחולדה
- לאחר שהחולדה מורדמת לחלוטין (ללא רפלקסים של כפות או זנב), הכנס את החותכות של החיה לחור במוט של תושבת הראש.
- הכנס בזהירות את נקודות זרועות ההרכבה לרכס האף כדי לתקן את הראש במהלך הניתוח, וודא שהוא לא יוצר מגע עם העיניים.
- כוונן את זווית הזרועות עד שגג הפה של החיה נלחץ בחוזקה אל המוט. ודא שהגולגולת נשארת ללא תנועה תחת לחץ.
- אבטח את שתי זרועות התושבת על ידי הידוק הברגים בעזרת מפתח ברגים משושה.
- הגדרת חמצן לחולדה
- אבטח את צינור הפלסטיק ממיכל החמצן מעל הלוע והאף של החיה, והדק אותו עם סרט כירורגי. הימנע מקמטים בצינור שעלולים לחסום את זרימת האוויר. הגדר את מיכל החמצן לקצב זרימה של 1 ליטר לדקה.
הערה: יש לבדוק מדדים חיוניים של בעלי חיים, כולל קצב לב וקצב נשימה, במרווחים של 15-30 דקות לאורך כל ההליך.
- אבטח את צינור הפלסטיק ממיכל החמצן מעל הלוע והאף של החיה, והדק אותו עם סרט כירורגי. הימנע מקמטים בצינור שעלולים לחסום את זרימת האוויר. הגדר את מיכל החמצן לקצב זרימה של 1 ליטר לדקה.
- ניטור מדדים חיוניים של בעלי חיים
- חתך בקרקפת
- גילוח והכנה
- לגלח את האזור מהחוטם העליון לחלק האחורי של הראש, המשתרע מעין אחת לשנייה וסביב האוזניים. הסר את עיקר הפרווה בעזרת מספריים או קוצץ חשמלי, ולאחר מכן מרח קרם אפילציה.
- חיטוי
- יש לחטא את האזור באמצעות צמר גפן ספוג בבטאדין, ולאחר מכן לשטוף בעזרת צמר גפן ספוג באתנול 70%. חזור על תהליך זה שלוש פעמים וסיים עם מריחת בטדין אחרונה כדי להבטיח שהאזור סטרילי.
- הזרקת הרדמה מקומית
- הזרקת חומר ההרדמה המקומית לידוקאין (1%, 0.1 מ"ל לעכבר/0.4 מ"ל לק"ג לחולדה) תת עורית לקו האמצע של קרקפת החיה. עסו בעדינות את הקרקפת כדי לפזר את הלידוקאין, והמתינו 5 דקות כדי לאפשר לחומר ההרדמה להשפיע.
- החתך
- עבור עכבר, הרם נקודה על העור בעזרת פינצטה וכרת קטע עור קטן (בקוטר של כ -1 ס"מ) בעזרת מספריים כירורגיים.
- עבור חולדה, בצע חתך מדויק בצד הקדמי של הקרקפת, ממש מעל האף, בקו האמצע באמצעות האזמל. משוך בעדינות את העור לאחור ויוצר חתך ישר מבין העיניים לבסיס הגולגולת. הרימו בזהירות את הקרקפת, חתכו את רקמת החיבור וחשפו את הגולגולת במלואה.
- חשוף את אתר הגולגולת לפי שלבים 2.4.4.4-2.4.4.5.
- בעזרת מגרד, נקה רקמת חיבור ופריאוסטאום בחלק העליון של הגולגולת. יש לשטוף מי מלח ולהשתמש בשאיפה או בספוג כירורגי לניקוי האתר.
- השתמש בקליפסים כירורגיים בשולי העור כדי להקל על חשיפה ברורה של אזור הגולגולת בו תבוצע הגולגולת.
- גילוח והכנה
- קרניוטומיה
- נוהל קידוח כללי
- הגדר את מהירות המקדחה הכירורגית להגדרה נמוכה של 5000 סל"ד או 7000 סל"ד עבור מנתחים מנוסים. בצע את כל הקידוחים תוך כדי הדמיה דרך המיקרוסקופ.
- החזק את המקדחה במקביל לפני השטח של הגולגולת והנח בעדינות על פני השטח.
- עם לחץ קל על הדוושה, התחל לקדוח במקום אחד. בצע קידוחים במרווחי זמן קצרים (5-10 שניות) עם בדיקות תכופות לשינויים בצבע העצם.
הערה: העצם תתחיל בלבן אטום, וככל שהחור יהיה עמוק יותר, היא תהפוך שקופה יותר ותחשוף גוון ורוד. - כאשר הקידוח התקרב למוח, האטו וחפשו סימני לחות המחלחלים לתוך החור. כאשר החור ורוד כהה ובעל ברק קל, הפסק לקדוח. בעזרת מחט קצרה של 30 גרם, נקבו בעדינות את שכבת העצם שנותרה. נוזל צלול צריך לצאת מהחור החדש.
- נוהל קידוח לעכבר
- כדי למקם אלקטרודת ייחוס לרישומים פיזיולוגיים, קדחו חור בור בחלק הקדמי של חצי הכדור המקביל לאזור המוקלט.
- הגדר את קווי המתאר של הגולגולת על ידי קידוח תעלה רדודה בהיקפו. בציר הבינוני-לטרלי, התחל מרכס העצם הצדדי כהפניה, ועקוב אחר חלון של 4 מ"מ.
- בציר האנטרו-אחורי, קדחו חלון 3 מ"מ המתחיל ~ 1 מ"מ קדמי של רכס העצם האחורי. גודל הגולגולת הפתוח הסופי הוא חלון בגודל 4X3 מ"מ בקירוב.
- נוהל קידוח לחולדה
- קדחו שני חורים: אחד ברבע האחורי השמאלי, השני ברביע הקדמי הימני.
- הזריקו לשריר המאסטר מנה שנייה של לידוקאין (0.4 מ"ל/ק"ג ב-10 מ"ג/מ"ל), ופזרו באופן שווה היכן שיש לבצע את החיתוך.
- כרתו רק את קבוצת השרירים המינימלית הדרושה לחשיפת אזור הגולגולת.
- בעזרת להב אזמל טרי #10, צור חתך גבי-גחוני רוחבי בצרור השריר מעל הלסת של החיה (צד ימין). החזיקו את הקצה האחורי של החתך בעזרת מלקחיים אוחזים וקילפו הרחק מהגולגולת תוך כדי חיתוך לאורך הרכס הגרמי של עצם הלחי. באופן זה ניתן לנתק את השריר מהעצם עם דימום מינימלי.
- כרתו את השריר הקדמי בצורה דומה עד שמתגלה קו סדק בגולגולת. קו זה יהיה הגבול הקדמי של חלון הגולגולת.
- נקה שריר מסביב לרכס האחורי בעזרת האזמל והמלקחיים, תוך שימוש במקור אור חזק כדי להימנע מחיתוך לאזורים בעלי כלי דם גבוהים.
- טוחנים את הרכס האחורי בעזרת המקדחה עד שהוא כבר לא מורם מעל פני הגולגולת.
הערה: שלב זה חיוני להגדרת רשת μECoG ליצירת מגע ישיר עם פני השטח בקליפת המוח. - קדחו את הקצה הגבי של החלון ממש מעל הרכס שבו הוצמד השריר הכרות. הנח את הקצה האחורי הקדמי לרכס האחורי הקדוח. הנח את הקצה הקדמי אחורי לקו הסדק המשתרע כלפי מטה ליד ארובת העין.
הערה: בעת ניקוי השריר הקדמי, יש להקפיד להימנע מהעין.
- נוהל קידוח כללי
- קידוח חלון קרניוטומיה
- קידוח חלון הגולגולת (טיפים)
- בעת הקידוח, ודא שהמקדחה נשמרת במקביל למשטח הגולגולת. הפעל כמה שפחות כוח, השתמש במקדחה כמו מברשת על ידי מתן אפשרות למקדחה ליצור מגע קל עם הגולגולת תוך שימוש בתנועות קצרות וחוזרות על עצמן לאורך קו הגולגולת המיועד.
הערה: בחולדות, בקצה האחורי של החלון יש את העצם העבה ביותר. אם קודחים רחוק מדי לאחור, העצם עלולה להפגין איכות מתקלפת ו"פריכה" שמקשה על מדידת התקדמות הקידוח. אם הוא ממוקם בצורה לא נכונה, אזור עצם זה עלול לחשוף צבע אדום ורידים שנותן רושם מוטעה של קרבה למוח. - קדחו כל צד של חלון הגולגולת עד שהעצם נראית ורודה בהירה עם סדק לבן דק או סדק העובר לאורכו. הפעל לחץ קל; העצם צריכה לייצר "תנועה" מובהקת כאשר היא נקדחת במלואה. אם הסדק נראה מפורק, המשך לקדוח קלות עד להשגת קו רציף.
- בעת הקידוח, ודא שהמקדחה נשמרת במקביל למשטח הגולגולת. הפעל כמה שפחות כוח, השתמש במקדחה כמו מברשת על ידי מתן אפשרות למקדחה ליצור מגע קל עם הגולגולת תוך שימוש בתנועות קצרות וחוזרות על עצמן לאורך קו הגולגולת המיועד.
- הסרת הגולגולת הדלילה בתוך חלון הגולגולת
- כאשר הגולגולת מדוללת מספיק כך שלחץ קל במיוחד גורם לכל החלון להתנועע באופן גלוי, הסר את הגולגולת המדוללת.
- יש לשטוף את אתר הגולגולת עם טיפת מי מלח ולהמתין לפחות דקה. זה מחליש את העצם הדלילה ועוזר לעצם להתנתק מהדורה. מסננים עודפי מלח בעזרת משולש כותנה סופג או ואקום.
- הרם בזהירות את הגולגולת הדלילה באמצעות מלקחיים, הימנע מנזק לרקמה הבסיסית.
- השתמש בספוג המוסטטי כדי לשמור על לחות המוח.
- אחזו בחוזקה בחלון בצד הגב והגחון בעזרת מלקחיים עם שיניים ומשכו ישירות מהגולגולת. אם יש קושי כלשהו לשלוף את החלון מהאתר, עצור והמשך את הקידוח הקל עד שהעצם נחלשת מספיק.
- עבור הקלטות μECoG של עכבר, השאר את הדורה שלמה.
- קידוח חלון הגולגולת (טיפים)
- שתל מלט ועמוד ראש לעכבר
- הכנס ואבטח את חוט הייחוס.
- הכניסו את קצה חוט הכסף ~1 מ"מ לתוך חור הבור, מספיק כדי ליצור קשר עם פני השטח של המוח אך לא לגרום לדימום.
- מרחו את המלט הדנטלי במקום תוך כדי מריחת השכבה הראשונה.
- הכנת מלט שיניים
- השתמש בכלי ערבוב קרמי מקורר להכנת תערובת המלט הדנטלי. מלט זה מתעבה במהירות ודורש הכנה קבועה של תערובת חדשה. נגב את כלי הערבוב לפני הכנת תערובת חדשה.
הערה: המלט לעולם לא צריך להיות במגע ישיר עם המוח.
- השתמש בכלי ערבוב קרמי מקורר להכנת תערובת המלט הדנטלי. מלט זה מתעבה במהירות ודורש הכנה קבועה של תערובת חדשה. נגב את כלי הערבוב לפני הכנת תערובת חדשה.
- יישום שכבה ראשונה
- מרחו את שכבת המלט הראשונה סביב הגולגולת ועל פני כל הגולגולת באמצעות אפליקטורים זעירים. שכבה זו משמשת כבידוד חשמלי בין הגולגולת למוט המתכת.
- הקף לחלוטין את הגולגולת במלט, כולל כיסוי לרוחב, כדי לספק הגנה נאותה לקרניוטומיה פתוחה ורשת μECoG.
- מיקום מוט המתכת
- חבר את החלק הגדול של מוט הראש למחזיק שלו מבלי להדק אותו במלואו.
- מקם את מוט הראש כרצונך, והניח את החלק הדק לאורך קו האמצע של הגולגולת במגע עם משטח המלט.
- אבטחת השתל
- מכסים את המוט במלט דנטלי ומחברים אותו למשטח המלט.
- הסרת המחזיק
- המתינו מספר דקות להתחזקות הצמנט הדנטלי.
- לאחר שהמוט מאובטח במלואו, הסר אותו על ידי הסרת הבורג מהמחזיק. לאחר מכן, החזר את המחזיק לאחור, וודא שלא מופעל כוח על מוט הראש.
- הכנס ואבטח את חוט הייחוס.
- דורוטומיה לניתוח חולדות
הערה: זהו שלב כירורגי מאתגר.- הרמת הדורה
- באמצעות מלקחיים מס' 5, המוחזקים במקביל לפני השטח של המוח, מרימים חלק קטן מהדורה הרחק מהמוח.
- השתמש במחט טרייה של 30 גרם (קצרה ככל האפשר) כדי לקרוע בזהירות את הדורה המורמת.
הערה: הדורה מאטר היא שכבה דקה ושקופה של רקמה המונחת ישירות על גבי המוח. הוא מוסר עבור הקלטות μECoG בחולדות. זה קריטי לבצע את הדורוטומיה מבלי להפריע לכלי הדם על פני המוח. שיטות מומלצות לביצוע הדורוטומיה כוללות שימוש במלקחיים ובמחט מזרק כדי לנקב את הדורה לפני משיכתה לאחור או שימוש בכלי דוראטום המעוגן ליד הגולגולת כדי למשוך את הדורה בזהירות.
- כריתת הדורה
- המשיכו לאחוז בדורה עם המלקחיים ולהרים אותה הרחק מהמוח. צור קרע אלכסוני עם המחט בזמן ההרמה.
- השתמש במלקחיים כדי לקלף בזהירות את הדורה לכיוון צידי חלון הגולגולת, ולהבטיח שפני המוח יישאר ללא הפרעה.
- הרמת הדורה
- העברת העכבר להתקנה להקלטה אלקטרופיזיולוגית
- הסר את החיה ממערך הניתוח על ידי הרמת החוטם והחותכות בעדינות מהמוט החותך ולאחר מכן משיכת החיה לאחור. להזריק כלורפרותיקסן (1 מ"ג/ק"ג, תוך-צפק), תרופת הרגעה המאפשרת לשמור על הרדמה רציפה באמצעות ריכוז איזופלורן נמוך יותר.
- הנח את העכבר במערך ההקלטה האלקטרופיזיולוגית.
- ודא שכרית החימום נמצאת במקומה ופועלת כהלכה.
- ראש תקן את החיה באמצעות מוט הראש על המחזיק במערך האלקטרופיזיולוגי.
- קרבו את מסכת האיזופלורן כדי לכסות לחלוטין את חוטם החיה.
- התאמת הרדמה
- הפחיתו בהדרגה את רמות ההרדמה ל-0.7-1% איזופלורן (במרווחים של 0.5% מקסימום כל 5 דקות).
- עקוב אחר קצב הנשימה והתנועות של בעל החיים.
הערה: קצב הנשימה צריך לעלות מעט בהשוואה למצב הניתוח, אך החיה לא צריכה לזוז. - אם בעל החיים זז, הגדל מיד את ריכוז האיזופלורן ל-2% לפני שתחזיר אותו לאט לרמה נמוכה יותר במרווחים של 0.5%.
- החדרת שפם לגירוי חושי
- חבר את הרטט של העכבר למכשיר גירוי השפם. בפרוטוקול זה, הכנס תשע ויבריסות לקצות פיפטה קצרים של 10 מיקרוליטר, המחוברים למפעילים פיזואלקטריים המספקים סטיות מהירות של הוויבריסה.
3. הקלטה
- התקנת הרשת
- צעדים מקדימים
- הפעל את מערכת ההקלטה והמגבר.
- בדוק את הסימנים החיוניים של בעל החיים.
- פרוצדורה
- למיקום החיה והכלים, בצע את השלבים 3.1.2.2-3.1.2.4.
- הנח את החיה במערך ההקלטה, וודא שהגולגולת נשארת לחה על ידי מריחה קבועה של תמיסת מלח.
- עבור חולדה, מקם את המיקרומניפולטור על מעקה האסדה, הממוקם היטב מאחורי אתר הגולגולת, כדי למנוע הפרעות.
- עבור עכבר, הנח את המיקרומניפולטור לרוחב לאתר הגולגולת לצד החיה.
- כדי לחבר ולמקם את הרשת על עכבר, בצע את השלבים 3.1.2.6-3.1.2.12.
- חבר את רשת μECoG ל-headstage באמצעות מחברי ה-ZIF-clip (מחבר headstage). החזיקו את הלוח האלקטרוני של ראש הבמה במקומו באמצעות מוט מכני המקובע למיקרומניפולטור.
- הורד את רשת μECoG אופקית כדי ליישר שטוח מעל הגולגולת לאורך הציר האנטרופוסטריורי.
הערה: לאורך הציר הרוחבי-מדיאלי, קצה הרשת צריך להיות ליד הגבול המדיאלי של הגולגולת. - ברגע שהרשת ממוקמת ליד המוח אך לא במגע איתו, חבר את חוט הייחוס של הרשת לסיכת חוט הזהב המושתל. במידת הצורך, חבר את חוט ההארקה לבעל החיים (למשל, לשריר חשוף) כדי להפחית את הרעש החשמלי.
- יתר על כן, הנמיכו את הרשת כדי ליצור קשר עם המוח.
- הזז את הרשת לרוחב כדי "להחליק" על פני משטח הדורה הלח. המשך להתאים עד שהרשת מרוכזת לאורך הציר הבינוני.
- השתמש בשאיפה או בספוג כירורגי סביב קצוות הגולגולת כדי להסיר עודפי תמיסת מלח.
- לאחר שהתכשיר מעט יבש יותר, ודא שהרשת נצמדת חזק יותר לדורה ואינה מחליקה על פני השטח שלה. כאשר יבש יותר, יש למרוח תנועה רוחבית למדיאלית על הרשת הגמישה, תוך הבטחת מגע עם האלקטרודות הרוחביות ביותר. הכבל הגמיש של הרשת יתכופף באופן טבעי כדי להתאים לקווי המתאר של המוח.
- כדי למקם את הגריד על חולדה, בצע את השלבים 3.1.2.14-3.1.2.18.
- אבטח את גזע מזלג האחיזה במיקרומניפולטור, וודא שלוח המחבר של הרשת ירחף כנגד הצד האחורי של חלון הגולגולת כאשר הוא מונמך.
- התאם את מיקום המיקרומניפולטור על המעקה כך שהרשת תהיה בערך מעל אתר הגולגולת. הנמיכו את הרשת עד שהיא תרחף קרוב מעל פני השטח של המוח. הרטיבו את פני המוח עם טיפה קטנה של מי מלח.
- בצע את השלבים הללו באמצעות המיקרוסקופ. בעזרת החוגות של המיקרומניפולטור, התאימו את מיקום הרשת עד שהיא שוכבת שטוחה על פני המוח במרכז הגולגולת.
- נדפו לחות בזהירות באמצעות משולש כותנה סופג מבלי לגעת ברשת עצמה. ודאו שכל שורה ברשת נמצאת במגע עם פני השטח של המוח.
הערה: הסרת לחות מונעת את ההתפשטות הפסיבית של האות החשמלי דרך הנוזל בין משטח קליפת המוח לרשת, מה שמפזר מרחבית את האות המורגש באלקטרודה. - בעזרת מלקחיים מספר 2 או מספר 5, הכנס את חוט הארקת הרשת לאותו חור בור או הכנס את חוט הייחוס לחור בור ואת חוט ההארקה לרקמת השריר הסמוכה.
הערה: יש להכניס חוטים רק ~1 מ"מ, מספיק כדי ליצור קשר עם המוח אך לא לגרום לדימום או טראומה למוח.
- צעדים מקדימים
- בדיקת מיקום הרשת
- ניטור פעילות אלקטרופיזיולוגית
- התבוננו בפעילות האלקטרופיזיולוגית באמצעות תוכנת ההקלטה. בהרדמה קלה, אותות המוח משתנים ויכולים להפגין מגוון דפוסים.
- חיבור נכון של הרשת, הייחוס וחוטי ההארקה אמור להניב יחס אות לרעש גבוה, עם אמפליטודות אות בטווח של mV. עקוב אחר רעש בתחום התדרים הגבוהים באמצעות סינון פס פס עם Trodes (למשל, 100-6000 הרץ) וודא שהוא אינו עולה על כמה עשרות מיקרו-וולט (μV).
- העריכו את ההיענות החושית באמצעות רעש (למשל, מחיאות כפיים או נקישת אצבעות) כדי לגרום לפוטנציאלים חשמליים של פני השטח בקליפת המוח (CSEPs).
הערה: גירוי של שפם בודד אמור לעורר CSEP ברור וחד הקשור לאירוע בכמה ערוצים בלבד (עכבר). - אימות מיקום הגריד
- עבור חולדה, ודאו שהרשת ממוקמת נכון מעל קליפת המוח השמיעתית. הבלוק הראשון שנרשם צריך להיות גירוי רעש לבן של 60 שניות כדי לוודא שהרשת רושמת תגובה תקינה מהמוח. בצע הקלטות אבחון רעש לבן וצלילים עם הרשת רק לפני הכנסת פוליטרוד כדי לעזור לקבוע אם הרשת הוצבה כהלכה ואם יש תגובת אות.
- עבור עכבר, כדי לאמת את מיקום הרשת, בצע הפעלת מיפוי מהירה עם 20-30 סטיות שפם במרווח של 350 אלפיות השנייה. הקלט את הפעילות ברצועת פוטנציאל השדה המקומי (LFP) באמצעות Trodes ונתח אותה במצב לא מקוון עם קוד MATLAB מותאם אישית כדי לדמיין את ההיקף המרחבי של פעילות מעוררת שפם.
- מיצוב מחדש
- אם הרשת דורשת התאמה, הרטיבו את פני השטח בקליפת המוח בטיפות מי מלח מעל הרשת.
- השאירו את מי המלח למשך 30 שניות עד דקה אחת לפני שתנסו להרים את הרשת.
- הרם בזהירות ולאט את הרשת.
- מקם אותו מחדש באמצעות השלבים המתוארים בשלב 3.1.
- ניטור פעילות אלקטרופיזיולוגית
- פוליטרודים למינאריים לחולדה
- הגדרת פוליטרודה
- ראשית, חבר את מתאם headstage לצד האחורי של הפוליטרודה. הצמד את המחבר לסט הערוצים השלישי על לוח המתאם. ודא שהסימן השחור על הקליפ פונה לצד ימין של הקצה העסקי של הפוליטרודה.
- הכנסת פוליטרוד
- הכניסו את הפוליטרוד למוח עד שהאלקטרודות האחרונות (העליונות) נראות מעל פני השטח של קליפת המוח. ירידה איטית (עד 1 מיקרומטר לשנייה) משפרת את איכות האות. המתן 15 דקות, מה שמאפשר למוח להסתגל לנוכחות הפוליטרודה.
- לאחר 15 דקות, בדוק אם האלקטרודות האחרונות נכנסו למשטח קליפת המוח. אם לא, הורד את הפוליטרוד מעט יותר והמתן 10 דקות נוספות לפני שתמשיך.
- הגדרת פוליטרודה
- מיקום מקור האור האופטוגנטי על עכבר
- השתמש במערכת בורג כוונון עדינה בתלת מימד, המותקנת על זרוע מפרקית, או במיקרומניפולטור כדי להרכיב את מחזיק הסיבים האופטיים.
- כדי להנחות את מקור האור ולסייע במיקום הסיב, הפעל את האור האופטוגנטי בעוצמה נמוכה. השתמש בזרוע המפרקית כדי למקם גס את האור האופטוגנטי לכיוון אזור המטרה.
- התמקד וכוונן את מיקום הסיב באמצעות מיקרומניפולטור או ברגי כוונון עדינים.
- הקלטת האותות
- הכנה
- נתק את כל האורות, הכבלים המאריכים ומגני המתח המיותרים במתקן הניתוח כדי להפחית הפרעות חשמליות. כבה את האורות העיליים באסדה.
- סגור את הדלת לחלל ההקלטה המבודד ואת הדלת לחדר הניתוח לפני תחילת הניסוי.
- התחלת רכישה
- עבור חולדה, הפעל את Synapse בפלטפורמת ההקלטה/מחשב ואשר שהרכישה מתפקדת על ידי תצוגה מקדימה ובדיקת אותות. עורר מעברי מתח גדולים וחדים באות μECoG על ידי הצגת גירויים ליד החיה, כלומר מחיאות כפיים.
- עבור עכבר, התחל את הפעלת ההקלטה ב-Trodes.
- הידרציה
- הזריק לחולדה או לעכבר תת עורית 1 מ"ל או 0.1 מ"ל של מי מלח כל 1-2 שעות במהלך ההקלטה כדי למנוע התייבשות. עבור חולדה, המתן 5-10 דקות לאחר מתן מי מלח לפני הפעלת בלוק הקלטה חדש.
- ערכות גירויים
- עבור חולדה, לאחר אישור אתר ההקלטה, המשך ברישום ערכות הגירוי הנדרשות. קבוצה לדוגמה עשויה לכלול
רעש לבן (60 שניות)
אבחון טון (5 דקות)
גוון טהור (23 דקות)
אדווה נעה דינמית
טון 150 (15 דקות)
טימית (38 דקות) - עבור חולדה, הצג מחדש רעש לבן ואבחון גוונים בכל פעם שהרשת ממוקמת מחדש.
- גירויים מישוש לעכבר: ספק גירויים מישוש במבנה ניסוי, כאשר כל ניסוי מכיל שורה של סטיות שפם אקראיות כל 350 אלפיות השנייה. בדוגמה שסופקה, כל ניסוי כולל 14 סטיות שהוצגו מעל 4500 אלפיות השנייה.
- גירויים אופטוגנטיים לעכבר: בניסויים מסוימים, הפעל פולס מרובע של אור אופטוגנטי לאורך כל משך הניסוי (5 שניות). קבע את רמת האור הנדרשת על סמך האופסין המשמש ועל עומק הרקמה שיש להגיע אליה באמצעות הערכות של חדירת אור (https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php)
- עבור חולדה, לאחר אישור אתר ההקלטה, המשך ברישום ערכות הגירוי הנדרשות. קבוצה לדוגמה עשויה לכלול
- הכנה
- ניקוי
- הרמה וניקוי של הרשת
- לאחר סיום ההקלטה, סגור את תוכנת ההקלטה וחבר מחדש את מקורות האור למתקן.
- אם המוח יבש, מרחו טיפה קטנה של מי מלח על פני המוח באמצעות מזרק. השאירו את מי המלח למשך 30 שניות עד דקה אחת לפני שתנסו להרים את הרשת.
- בעבודה מתחת למיקרוסקופ, הרם בעדינות את הרשת מפני השטח של המוח באמצעות מיקרומניפולטורים.
- אם יש צורך בכוח נוסף בזמן הרמת הרשת, השתמשו במלקחיים עם קצה פחמן (סגורים) כדי להרים בעדינות את הרשת מהמוח. ודא שתנועת המיקרומניפולטור מעט קדמית כדי לקלף בעדינות את הרשת הרחק מפני השטח של המוח.
- לאחר הסרת הרשת במלואה, נתק אותה ממזלג האחיזה ונקה אותה לפי שלבים 3.6.1.6-3.6.1.7.
- יש להשרות את הרשת (למעט לוח המחברים) בחומר ניקוי אנזימטי מדולל (50% אנזול, 50% מים מזוקקים) למשך שעה אחת לפחות. לאחר מכן, העבירו אותו לאמבטיה שנייה של מים מזוקקים טהורים והניחו לו להתייבש באוויר במקום בטוח ונקי.
- אם באזורים ברשת הצטברו דם או רקמות, השתמשו במשולש כותנה ספוג בתמיסה אנזימטית כדי לנגב אותו בעדינות.
- לאחר הייבוש, החזירו את הרשת לקופסה שלה.
- המתת חסד של החיה
- עבור עכבר, הסר את החיה מקיבוע הראש והנח אותה בתא המתת החסד. הוסף גזה עם איזופלורן 5 מ"ל והמתן 60 שניות לאחר הפסקת הנשימה. ודא היעדר רפלקס נסיגה וערוף את הראש באמצעות מספריים חדים.
- עבור חולדה, הזריק 0.2 מ"ל של פנטוברביטל IP. המתן 60 שניות לאחר הפסקת הנשימה, השכיב את החיה על גבה והשתמש בלהב #11 כדי לבצע כריתת בית חזה כפולה.
- ניקוי הציוד
- קח את כל כלי הניתוח לכיור המעבדה והניח אותם על מגבת כירורגית. מרססים את הכלים בתמיסת אקונומיקה של 10% ושוטפים היטב בכיור. לכלים מלוכלכים יותר, הניחו להם להשרות בתמיסת אקונומיקה לפני הכביסה.
- לחלופין, השתמש באבקת ניקוי (למשל, Contrex AP) עם מים על ידי קרצוף המכשירים בעזרת מברשת בכיור.
- לאחר שהכלים נקיים ושטופים, נגבו אותם במגבוני אלכוהול והחזירו אותם לשטח האחסון שלהם.
- חיטוי סביבת העבודה
- השלך את כל המחטים והלהבים המשומשים למיכל החדים.
- השלך צמר גפן מזוהם, משולשים ומגבוני אלכוהול בשקית הביולוגית.
- נגב את כל משטחי העבודה בחדר האסדה באלכוהול ונקה את כל המכשירים לפני סגירת סביבת העבודה.
- הרמה וניקוי של הרשת
תוצאות
תיארנו את הפרוטוקולים לרישום אותות אלקטרוקורטיקוגרפיים בשילוב שיטות אופטוגנטיות והקלטות למינריות. כאן, מוצגים אותות טיפוסיים שמתקבלים מקליפת המוח הסומטוסנסורית של העכבר (איור 1, איור 2 ואיור 3) ובתוך קליפת המוח השמיעתית של חולדות בתגובה לגירוי חושי (איור 4, איור 5 ואיור 6).
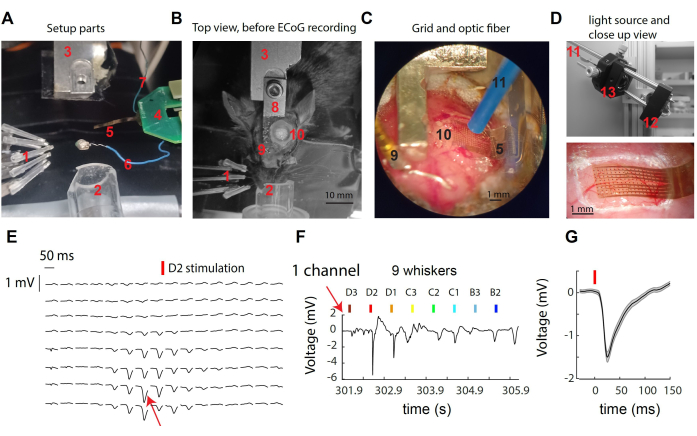
איור 1: הקלטת אותות μECoG מעל קליפת המוח הסומטוסנסורית של שפם העכבר. (A) רכיבי המערך. ראה טקסט. (B) מבט עליון של המערך הניתוחי לפני הקלטת μECoG, שמראה את מיקום משענת הראש ואתר הגולגולת. (C) תצוגה מפורטת של רשת μECoG והסיב האופטי הממוקמים על קליפת המוח החשופה. (D) למעלה: מקור האור ממוקם מחוץ לקופסת ההקלטה. אור מנורת LED של 473 ננומטר נאסף בסיב האופטי דרך טנדם עדשה. למטה: תקריב של הרשת הקורטיקלית מעל קליפת העכבר בהקלטה לדוגמה. (E) עקבות מייצגות של μECoG מכל ערוצי ה-16x8 שמראים תגובות ממוצעות בניסוי לגירוי שפם D2. (F) עקבות מתח גולמי מהערוץ היחיד המצוין ב-(E) על פני סטיות בודדות של מספר שפמים. הערוץ הראה את התגובה החזקה ביותר במהלך גירוי השפם D2. (G) התגובה הממוצעת שעוררה על פני ניסויים בערוץ היחיד (E,F), שהציגה סטיית מתח חדה בעקבות גירוי שפם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 1A-D מספק תמונות של רכיבים שונים של המערכת המשמשים להקלטה ולמניפולציה אופטוגנטית בקליפת המוח S1 של העכבר. האלמנטים המסומנים כוללים: 1- תשעה ממריצי שפם עצמאיים במערך 3 x 3, 2 חרוט אף להרדמה איזופלורנית, 3 - מחזיק עמוד ראש/מקביל, 4- μECoG PCB אחורי, המחובר ל-PCB הקדמית עם מחבר ZIF כפול; רשת 5- μECoG של אלקטרודות בקצה כבל גמיש 8 מ"מ; 6- חוט התייחסות; 7- חוט קרקע; 8- שתל עמוד ראש; 9- סיכת זהב התייחסות (מבודדת מעמוד הראש עם מלט שיניים); 10- קרניוטומיה בחצי הכדור השמאלי, מעל קליפת חבית השפם S1; סיבים אופטוגנטיים בקוטר 11-1 מ"מ (מוחזקים על ידי מיקרומניפולטור, לא מוצג); 12- נורית LED בצורת כוכב המונעת על ידי דרייבר LED (לא מוצג); 13- איסוף אור באמצעות טנדם של עדשות אספריות. כאשר מגרים שפם בודד, נצפית סטייה מהירה של פוטנציאל פני השטח במספר קטן של אלקטרודות (איור 1E). אשכול אלקטרודות זה מייצג את האות המקומי שמגיע לשיאו בעמודת קליפת המוח של השפם המגורה. כשאנו מסתכלים על אלקטרודה בודדת, אנו רואים את התגובה החזקה ביותר לגירוי של השפם המועדף עליה, ואת התגובה החלשה יותר או ללא תגובה לגירוי של שפם מרוחק יותר (איור 1F). בדוגמה זו, תחילת הסטייה מתרחשת בסביבות 10 ms לאחר רטט שפם, עם אמפליטודה ממוצעת של mV 1 (איור 1G).
איור 2 מציג הקלטות לדוגמה במהלך עיכוב אופטוגנטי. האור יכול להגיע לרקמת קליפת המוח דרך המצע השקוף של הרשת (איור 2A). עם זאת, כאשר משתמשים בסיב בקוטר גדול או בכל מקור אור רחב מרחבית, פוטונים פוגעים גם באלקטרודות, ומייצרים חפץ אופטו-חשמלי (איור 2B). בפרוטוקול העיכוב הזה, השתמשנו בפולס מרובע של אור באורך 5 שניות. החפצים האופטו-חשמליים המתקבלים קיימים רק בתחילת האור ובהיסטו. אצל חיה ללא אופסין, גירוי שפם שמוצג במהלך האור לא מעורר תגובה שונה מגירוי השפם שהוצג בניסויים כשהאור כבוי (איור 2C). בניגוד לכך, גירוי אור של האופסין המעכב בתת-אוכלוסייה של תאי עצב מעוררים מוביל לירידה במשרעת של התגובה המעוררת חושית (איור 2D)
איור 2C,D מציג דוגמאות לדיכוי אופטוגנטי בתחום תדר הזמן. כדי לנתח את נתוני μECoG, אנו מיישמים תחילה התייחסות ממוצעת משותפת (CAR) כדי להסיר אותות שאינם מובחנים על פני אלקטרודות (למשל, נשימה) ואחריהם טרנספורמציה של גל מורס, החושפת פסי תדרים פעילים לאורך זמן. פעילות עצבית בתחום התדרים מציגה בדרך כלל חוק כוח משוער של 1/f 2,3. כדי לחשוף את האות המעורר החושי בצורה אחידה יותר על פני תחום התדרים, אנו מיישמים ניקוד Z בנפרד עבור כל פס תדרים. ניקוד ה-Z מבוסס על הסטטיסטיקה של האות במהלך תקופות הבסיס. כאן, אנו משתמשים בחלון זמן שלפני הגירוי, -3000 אלפיות השנייה עד -1000 אלפיות השנייה לפני תחילת הניסוי. תהליך זה מניב את ציון ה-Z המעורר בגירוי עבור כל פס תדרים (איור 2C,D).
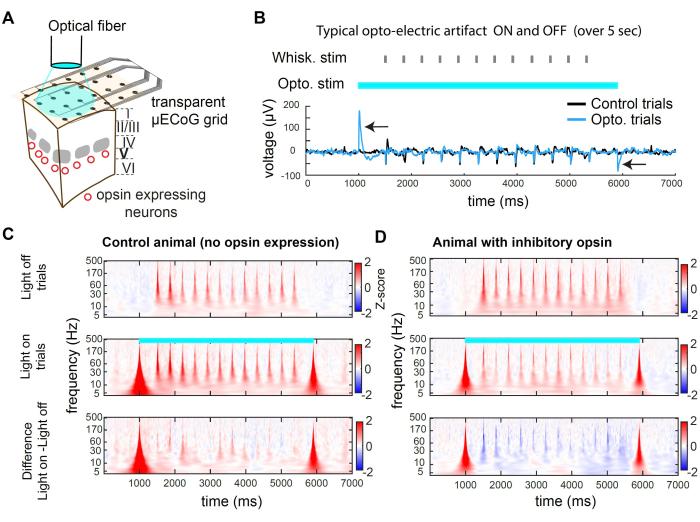
איור 2: דיכוי אופטוגנטי ב-wS1 במהלך רישום μECoG בעכברים. (A) סכמטי של ניסוי אופטוגנטי מייצג. סיב אופטי מכוון ישירות למוח, ומאפשר עיכוב חולף של אוכלוסיית הנוירונים המבטאת אופסין מעכב. (B) עקבות מתח שנרשמו בערוץ במרכז הגירוי האופטוגנטי, בממוצע על פני ניסויים. החץ השחור מציין חפצים אופטו-חשמליים בהתחלה ובהיסט של האור 473 ננומטר. שימו לב לתגובה להטיית שפם (זהות שפם אקראית) באמצע המשפט. החפץ חולף ואינו משפיע על הקלטת הפעילות המעוררת חושית לאחר עיכוב (כאן 500 אלפיות השנייה). (C) ספקטרוגרמה ממוצעת של ערוץ לדוגמה בניסויי כיבוי אור, ניסויי אור וההבדל בין השניים, בבעל חיים שבו לא התבטא אופסין. שימו לב שהאפקט האופטו-חשמלי גורם לחפץ חולף בפס רחב, והתגובה המעוררת בשפם אינה מושפעת מהאור. (D) דוגמה לספקטרוגרמה ממוצעת של ניסוי על פני ניסויים בכיבוי אור, ניסויים באור וההבדל בין השניים בעכבר Rbp4-Cre32 שבו st-GtACR2.0 התבטא בתאי עצב מעוררים של שכבה 5. שימו לב לדיכוי התגובה המעוררת שפם בספקטרוגרמה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 3 מציג וריאציות קלות למימוש במערכת אספקת האור. באמצעות סיב אופטי קטן יותר, או עדשה פשוטה, ניתן לכוון לאזור מסוים בקליפת המוח15. האור היוצא מהסיב מתפצל במהירות ומגיע לרקמת קליפת המוח מעבר לאזור הממוקד. על ידי שילוב עדשה אספרית (f = 16 מ"מ) ביציאת הסיבים האופטיים, ניתן למקד את האור לשטח פנים קטן יותר (איור 3A,C), עד לקוטר של עמוד קליפת המוח היחיד (איור 3C). האור גם פחות מתפצל בתוך קליפת המוח. באופן אידיאלי באמצעות לייזר או מקור אור רב עוצמה עם סט עדשות טנדם, ניתן למקד עמוד קליפת המוח יחיד עם קרן אור קולימית. עם זאת, חשוב לקחת בחשבון שאור יתפזר בתוך הרקמה, מה שעשוי להאיר חלקית את העמודים הסמוכים. חפץ האור שנמדד בנתוני μECoG יגלה היכן הועבר האור על פני השטח של קליפת המוח; ראו השוואה בין איור 3B לעומת איור 3D. חפץ האור נמדד כעוצמת השיא בתחום תדרים גבוהים (65-500 הרץ) 5 אלפיות השנייה לאחר הופעת האור.

איור 3: העברת אור לנקודות מוקד של קליפת המוח. (A) אור מהסיב האופטי בקוטר 1 מ"מ ממוקד על פני השטח של המוח. התאמה פשוטה זו מאפשרת מיקוד מדויק יותר של האור על פני המוח ובתוך הרקמה. (B) ההיקף המרחבי של האור שמועבר למוח נמדד מהחפץ האופטו-חשמלי. (ג,ד) ההגדרה היא כמו בפאנלים A,B עם סיב אופטי של 200 מיקרומטר, המאפשר לו לכוון ישירות לאזור בקוטר 250 מיקרומטר, בערך בגודל של עמוד קליפת המוח. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
הקלטות μECoG של עכברוש ו-Laminar Polytrode
איור 4A-D מספק תמונות של רכיבים שונים של המערכת המשמשים להקלטות קליפת המוח השמיעתית הראשונית של חולדות. באופן ספציפי, האלמנטים המסומנים כוללים: (1) מיקרומניפולטור μECoG, (2) מתקן סטריאוטקסי למכרסמים, (3) כבל μECoG עם מחברי קליפ ZIF, (4) מיקרומניפולטור פוליטרוד למינרי, (5) חרוט אף חולדה ומנגנון ייצוב ראש, (6) רמקול אלקטרוסטטי להצגת גירוי, (7) כבל פוליטרודה למינרי עם מתאם קליפ ZIF, (8) קליפ μECoGZIF המחובר על ידי מזלג דו-כיווני, (9) מכשיר פוליטרוד 32 ערוצים, (10) רמקול אלקטרוסטטי, (11) תפסי תנין להחזקת אתר ניתוח פתוח, (12) חוטי הארקה, אחד מוחדר לקליפת המוח דרך חורי הקוצים ברבע האחורי השמאלי או ברביע הקדמי הימני והשני מקורקע לרקמה, (13) מבט מקרוב על רשת μECoG, (14) מבט מקרוב על הפוליטרוד שהוכנס. איור 4E מציג את הספקטרוגרמה העצבית הממוצעת הנגזרת מהפוטנציאלים החשמליים המוקלטים של אלקטרודה μECoG בודדת בתגובה לנקודות טון של 50 אלפיות השנייה באותו תדר והנחתה (N = 20 ניסויים). על פני התדרים, התגובה המעוררת מציגה שיא חד בין 25 אלפיות השנייה ל-30 אלפיות השנייה (מסומן בקווים מלאים אדומים) לאחר תחילת הגירוי (קו מקווקו אפור שמאלי). התגובה לכאורה שקדמה להופעת הגירוי (לכאורה סיבתי) נובעת מרוחב הפס הגדול בתדרים נמוכים יותר של התמרת ה-Q הקבועה, המחליקה (סיבתי, אך ללא קיזוז פאזה) במקום לסנן (סיבתי, אך גורמת לקיזוז פאזה) את האות. לכן, זמן תגובת השיא נשאר מדויק. בזמן שיא התגובה המעוררת, ראינו כי הפוטנציאל החשמלי של פני השטח בקליפת המוח (CSEP) היה רב-מודאלי על פני תדרים. באופן ספציפי, הוא הציג שלוש פסגות לא-הרמוניות עיקריות: הראשונה והגדולה ביותר בתחום גמא/גמא גבוה (γ/Hγ) של 40-180 הרץ, השנייה בתחום 200-450 הרץ אולטרה-גמא (uHγ), ושיא סופי מעל 500 הרץ הקשור לפעילות מרובת יחידות (MUA) (איור 4F)11. מבנה רב-מודאלי זה מעורר גירוי הוא חזק בכל האלקטרודות המכוונות. כאן, אנו מתמקדים ב-Hγ בגלל השכיחות שלו בהקלטות אלקטרוקורטיקוגרפיה אנושית (ECoG)31. באיור 4G, אנו מציגים מערך μECoG שהוצב תת-דוראלי לצד פוליטרוד למינרי סיליקון כדי למדוד בו זמנית פוטנציאלים חשמליים של פני השטח בקליפת המוח (CSEPs) ופעילות זינוק על פני הלמינה בקליפת המוח. מערך ה-μECoG המיוצר בהתאמה אישית כלל 8×16 אלקטרודות עם פסיעה של 20 מיקרומטר וקוטר מגע של 4 מיקרומטר, והשתמשנו בפוליטרודה למינרית של 32 ערוצים המוגדרת כ-2 ×-16 ערוצים עם פסיעה של 4 מיקרומטר וקוטר מגע של 1 מיקרומטר. מערך ה-μECoG היה גדול מספיק כדי לכסות את כל קליפת המוח השמיעתית הראשונית של החולדה (A1), והאלקטרודות הקטנות שלו בקוטר 4 מיקרומטר אפשרו מדידה של CSEPs מקומיים המתאימים לגזירת כוונון שמיעתי. הרזולוציה המרחבית של אות μECoG high-gamma (Hγ) היא ~20 מיקרומטר, בהשוואה לרדיוס של עמוד קליפת המוח של חולדה. לפיכך, μECoG מספק "תצוגה עמודית" של פעילות קליפת המוח. נקבים ברשת μECoG אפשרו לפוליטרודה הלמינרית לעבור בין מגעים על פני השטח, מה שמאפשר רישום ישיר של פעילות עצבית על פני הלמינה בקליפת המוח (איור 4H). עקבות מתח לדוגמה שנרשמו מאלקטרודות μECoG ופוליטרודות למינריות מוצגות באיור 4I.

איור 4: הקלטת אותות μECoG ופוליטרודה למינרית מעל קליפת המוח השמיעתית הראשונית של החולדה (A1). (A) רכיבים של מערך μECoG ופוליטרודה למינרית. ראה טקסט. (B) מבט עליון של המערך הניתוחי לפני μECoG ורישום פוליטרוד למינר, שמראה את מיקום משענת הראש ואתר הגולגולת. (C) תצוגה מפורטת של רשת μECoG והפוליטרודה הלמינרית על קליפת המוח השמיעתית החשופה. (D) מבט מקרוב על מיקום רשת μECoG על קליפת המוח, כולל גודל של אלקטרודות בודדות (40 מיקרומטר) ובין אלקטרודות (200 מיקרומטר). (E) פירוק גל ממוצע עם ניקוד z של תגובה חד-ערוצית לזוג הנחתת תדר יחיד. הקווים האדומים האנכיים מציינים את תקופת תגובת תדר השיא המוצגת ב-F.(F) אדום- תגובת תדר שיא ממוצעת על פני 20 מצגות של זוג הנחתת תדר יחיד. אפור- שגיאת תקן. ציר התדרים הוא בסולם לוג. רצועות תדרים עצביות קנוניות מסומנות בחלק העליון. (G) פוטומיקרוגרף של רשת 8 16 μECoG על פני השטח של קליפת המוח השמיעתית הראשונית של חולדה (A1). פוליטרודה למינרית בת 32 ערוצים הוכנסה לחלון המרכזי של μECoG. (H) סכמטי של רישום תלת-ממדי רב-ממדי של פעילות קליפת המוח. (I) למעלה: ספקטרוגרמה של 50 אלפיות השנייה בנקודות טון טהור. באמצע: באדום, הפוטנציאל החשמלי הממוצע של פני השטח בקליפת המוח של 4 אלקטרודות μECoG (אפור). למטה: עקבות מתח פוליטרודה למינרית 32 ערוצים מסודרים לפי עומק קליפת המוח אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 5 מציג את ההקלטה של אותות μECoG בו-זמנית עם פעילות זינוק באמצעות פוליטרודת סיליקון למינרית (Camb64). אות μECoG, המוקלט מאלקטרודה משטחית, מוצג כעקבת מתח גולמי (איור 5A) והתמרת הגל שלו, תוך הדגשת פירוק התדר לאורך זמן (איור 5B). פעילות מרובת יחידות נרשמה באמצעות הפוליטרודה, כפי שמודגם על ידי מעקב מתח גולמי מייצג מערוץ יחיד (איור 5C), שבו זוהו פוטנציאל פעולה בודד (ספייקים) בשיטת סף פשוטה (מתח החוצה סף -120 μV). צורות הגל של הספייק שחולצו מערוץ זה מוגדרות היטב עבור רוב הקוצים, אם כי הן יכולות לנבוע ממקורות מרובים של נוירונים (איור 5D, משובץ). על פני מספר ערוצים באותה חדירה, צורות הגל הממוצעות של הספייק מאשרות עוד יותר את העקביות של רישומי פעילות זינוק מוגדרים היטב (איור 5E). לפיכך, שיטות הקלטה אלו יכולות לתמוך בהקלטה של יחידה אחת עם ניתוח מיון ספייק וניתוח מדדי איכות כגון מרווח הבין-ספייק או שיעורי הירי (איור 5F). לסיכום, איכות הקלטות הגשושית הלמינרית טובה, עם מורפולוגיה ברורה של צורת גל בערוצים בודדים. תוצאות אלו ממחישות כי שיטה זו מאפשרת רכישה בו-זמנית של μECoG ופעילות זינוק.

איור 5: הקלטות סימולטניות של μECoG ופעילות זינוק עמודית. (A) דוגמה למעקב אחר מתח גולמי מערוץ μECoG יחיד. (B) התמרת גל של אותו ערוץ μECoG, המראה פירוק תדרים לאורך זמן. (ג) דוגמה למעקב מתח גולמי מתעלת פוליטרודה בודדת (בדיקת סיליקון חריפה של 64 ערוצים camb64), המציגה פוטנציאל פעולה (קוצים) שזוהו באמצעות סף מתח פשוט. (D) צורות גל ספייק שחולצו מתעלת הפוליטרוד ב-(C) מיושרות ומקודדות בצבע על סמך התפלגות משרעת המתח. 7 מתוך 142 צורות גל של ספייק אינן מוצגות, מכיוון שהן נחשבו חריגות על סמך מרחקן מהצביר הראשי ברוחב ובמשרעת של ספייק (ראה שיבוץ). (E) צורות גל ספייק ממוצעות מרובות יחידות שחולצו מ-9 ערוצים באותה חדירה. (F) היסטוגרמות אינטרוולים (ISI) עבור ערוצי פוליטרוד שונים (למשל, ערוצים 21, 27, 63 ו-61), עם קצבי ירי תואמים (FR) המצוינים ב-Hz. הפרות ISI (< 5ms) ייצגו פחות מ-5% מהקוצים בכל היחידות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
עם היכולת לבצע הקלטות בו-זמנית באמצעות מערך μECoG שתוכנן בהתאמה אישית ופוליטרודה למינרית, חקרנו כיצד אותות μECoG משתווים להקלטות יחידה עצבית על פני עומק קליפת המוח במונחים של כוונון שמיעתי. איור 6A מציג עלילות משרעת תגובת תדר (FRA), המתארות את תגובת הגמא הגבוהה (Hγ) כפונקציה של תדר ומשרעת הגירוי השמיעתי. הפאנל העליון מציג FRAs מתת-קבוצה של 2 × 16 של אלקטרודות μECoG הממוקמות על קליפת המוח השמיעתית, בעוד שהפאנל התחתון מציג FRAs מתת-קבוצה של 1×16 של אלקטרודות פוליטרודות למינריות המוכנסות דרך הנקבים של מערך μECoG (מסומן על ידי חיצים אפורים). באופן מדהים, ה-FRA המתקבלים מהאלקטרודות μECoG דומים מאוד לאלה מהקלטות הפוליטרודה הלמינרית, מה שמרמז על כך שאותות μECoG מכוונים באופן דומה לפעילות היחידה העצבית על פני שכבות קליפת המוח.
תוך מינוף הרזולוציה המרחבית הגבוהה של מערך μECoG, יצרנו מפה טונוטופית ברזולוציה גבוהה של שדות קליפת המוח השמיעתית המרובים המבוססת על פעילות Hγ11. באיור 6B, התדר הטוב ביותר של כל אלקטרודה מקודד בצבע, וחושף את הארגון הטונוטופי על פני השטח של קליפת המוח. מערך 8 × 16 μECoG כיסה מספר שדות קליפת המוח השמיעתית - כולל קליפת המוח השמיעתית הראשונית (A1), שדה השמיעה האחורי (PAF) ושדה השמיעה הגחוני (VAF) - עם גבולות משוערים המסומנים בקווים שחורים. מיפוי מפורט זה מדגיש את יכולתו של מערך μECoG לספק "תצוגה עמודית" של פעילות קליפת המוח, ללכוד ארגון פונקציונלי ברזולוציה מרחבית של פחות מ-20 מיקרומטר, בהשוואה לממדים של עמוד קליפת המוח של חולדה. ממצאים אלה מדגימים כי הקלטות μECoG לא רק משקפות את תכונות הכוונון שנצפו בהקלטות יחידות עצביות על פני עומק קליפת המוח, אלא גם מאפשרות מיפוי ברזולוציה גבוהה של ארגון קליפת המוח התפקודי.
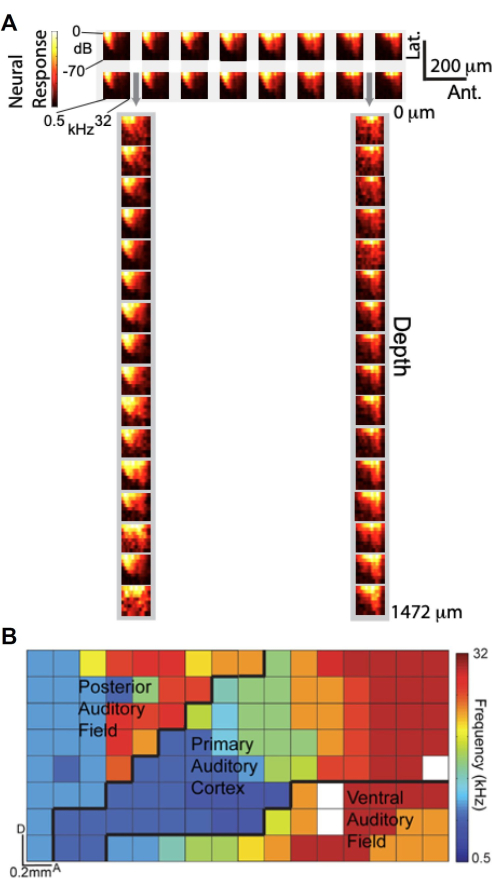
איור 6. אותות μECoG מכוונים באופן דומה להקלטות ספייק של יחידה עצבית על פני העומק וחושפים את הארגון הטונוטופי של קליפת המוח השמיעתית. (A) תרשימי משרעת תגובת תדר (FRAs), שמציגים את תגובת הגמא הגבוהה (סרגל הצבע) כפונקציה של התדר (ציר ה-x) והמשרעת (ציר ה-y) של הגירוי השמיעתי. (למעלה) FRAs מ-2 16 תת-קבוצה של אלקטרודות μECoG בקליפת המוח השמיעתית; (למטה) FRAs מ-1 16 תת-קבוצה של אלקטרודות פוליטרודות למינריות המוכנסות דרך נקבים במערך μECoG, המסומנות על ידי חיצים אפורים. (B) ארגון טונוטופי ברזולוציה גבוהה של שדות קליפת המוח השמיעתיים המרובים שמקורם בפעילות גמא גבוהה. כל פיקסל מקודד בצבע לפי התדר הטוב ביותר של אותה אלקטרודה. מערך 8x16 μECoG המוצג כאן מכסה שדות קליפת המוח השמיעתיים המרובים (A1, PAF ו-VAF), והגבולות המשוערים מסומנים (קווים שחורים). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
הפרוטוקולים המתוארים כאן מאפשרים שילוב מערכי מיקרו-אלקטרוקורטיקוגרפיה בצפיפות גבוהה (μECoG) עם בדיקות למינריות וטכניקות אופטוגנטיות. קלות השימוש בפרוטוקול זה במודלים של מכרסמים הופכת אותו לכלי רב עוצמה לחקירת דינמיקה בקליפת המוח, וניתן להגדיל את מספר הנבדקים בקלות. רשת μECoG בצפיפות גבוהה מאפשרת מיפוי יעיל ומדויק מבחינה מרחבית של טופוגרפיה קליפת המוח על פני אזורים מרובים בעכברים וחולדות, וממנפת את התפקיד הקריטי של ייצוגים טופוגרפיים בארגון המוח33. התוספת של רישום למינרי מאפשרת בחינה של דינמיקה קליפת המוח על פני קני מידה מרחביים וזמניים מרובים. הכללת אופטוגנטיקה מאפשרת מניפולציה סיבתית כדי לקבוע את הקשרים בין אוכלוסיות עצביות ספציפיות ותרומתן לפוטנציאלים מעוררי פני השטח בקליפת המוח (CSEPs) ועיבוד קליפת המוח34.
אופטוגנטיקה מאפשרת אפנון סלקטיבי של אוכלוסיות עצביות ספציפיות, ומאפשרת לחקור את תפקידיהם הסיבתיים ביצירת דפוסי פעילות בקליפת המוח ולהשתתף בחישוב שניתן לחוש את חתימותיו באמצעות μECoG. לדוגמה, המחקרים שלנו מראים כי התמקדות בסוג תא ספציפי יכולה לשנות פוטנציאלים חשמליים של פני השטח בקליפת המוח (CSEPs). גישה זו יכולה לשמש כדי לנתח את בסיס סוג התא העצבי של אותות μECoG, מה שמאפשר לנו לזהות אילו סוגי תאים עצביים תורמים לפעילויות מעוררות חושים אופייניות, כמו אלה שנצפו בפס הגמא הגבוה. תופעות אחרות בקנה מידה גדול, כגון מקצבים קליפת המוח ברצועות תדרים שונות21, או פעילות מאורגנת מרחבית, כולל גלים נעים35,36, ניתנות למחקר דומה. בנוסף, מגוון קווים ואופסינים של עכברים מהונדסים גנטית זמינים, ומספקים הזדמנויות לחקור מנגנוני מעגלים ספציפיים. ניתן להשתמש בטכניקות אופטוגנטיות כדי לבחון את ההשפעות הפונקציונליות של קשרים אופקיים בין עמודות37, הממלאות תפקיד מכריע בחישובים חושיים שונים, כגון דיכוי סראונד38 או קשירה תפיסתית39. לסיכום, היכולת לתמרן את הפעילות העצבית באמצעות אופטוגנטיקה מאפשרת לבחון את הקשרים בין אוכלוסיות עצביות ספציפיות לתכונות של CSEPs או בין אוכלוסייה לחישובים ספציפיים בקליפת המוח הניתנים למדידה באמצעות μECoG. גישה זו יכולה לנתח ביעילות את הקשרים בין מבנים עצביים מקומיים לפעילות קליפת המוח הגלובלית.
רישומי פוליטרודה למינרית מאפשרים דגימה של פעילות נוירונים בודדים ממספר נוירונים בתוך נפחים קליפת המוח הקטנים, כלומר בתוך עמודה קליפת המוח הבודדת. הקלטות אלה חיוניות מכיוון שתאי עצב בודדים יכולים לקודד באופן עצמאי מידע מובחן, תוך שימוש בקידוד סלקטיבי של גירויים - כגון "נוירוני ג'ניפר אניסטון" שתוארו על ידי Quiroga et al.40 - או לספק ייצוגים משלימים במרחב ממדי גבוה יותר, כפי שניתן לראות בסלקטיביות מעורבת41. באופן מסורתי, אלקטרופיזיולוגים חקרו פעילות עצבית בהקשר של גירויים והתנהגויות פשוטים ומתוכננים באופן פרמטרי (למשל, סטיית שפם בודד או צלילים טהורים, כפי שנפרס כאן). הייצוג של גירויים כאלה נוטה להיות מקומי למדי מבחינה מרחבית (למשל, עמודות בודדות). עם זאת, גירויים והתנהגויות רבים הרלוונטיים מבחינה אתולוגית הם מורכבים יותר, וככאלה, דפוסים אופייניים של פעילות עצבית במהלך פרדיגמות כאלה משתרעים לעתים קרובות מעבר לעמודות בודדות - אפילו בכלרחבי המוח. במקרים אלה, μECoG מציעה קריאה מקיפה הלוכדת רזולוציה זמנית גבוהה, פעילות בפתרון עמודים על פני מספר עמודות בו-זמנית. לסיכום, הפרוטוקול המתואר כאן מגשר ביעילות על הפער בין עיבוד מקומי בתוך עמודות קליפת המוח בודדות לבין הדינמיקה הנרחבת יותר המתרחשת על פני עמודות מרובות באזור קליפת המוח כולו ובין אזורים.
כהנחיות כלליות ופתרון בעיות, אנו מציעים כמה המלצות. פרוטוקולים אלקטרופיזיולוגיים קונבנציונליים אקוטיים in vivo מייעצים בדרך כלל לשמור על המוח רטוב במהלך החשיפה כאמצעי להאריך את בריאות המוח החשוף. בעוד שזה ככל הנראה שימושי בנסיבות מסוימות, הניסיון שלנו מצביע על כך שההפך הוא הנכון עבור הקלטות μECoG במכרסמים. ואכן, מצאנו שאיכות ההקלטה הייתה טובה יותר מבחינה איכותית כאשר מערכי μECoG הונחו על משטח קליפת המוח מעט יבש. אנו מאמינים שזה נובע מכך שיש מי מלח, תמיסה יונית מוליכה מאוד הממוקמת בין פני השטח של קליפת המוח לאלקטרודות ההקלטה, הופכת אותות חשמליים להומוגניזציה שנוצרים על ידי המוח. למעשה, מי מלח 'מקצרים' את האלקטרודות יחד. מכיוון שרשתות μECoG מנטרות את השדה החשמלי הרציף שנוצר על ידי אוכלוסיות של נוירונים, חשוב לוודא שמערכות אלקטרופיזיולוגיות מורכבות היטב ומנוטרלות. במהלך ההקלטות, החיבור עם אלקטרודת הייחוס הוא קריטי. ללא שיפור במהלך ההקלטה, העיבוד המקדים של הנתונים יכול לשלב מסנן חריץ ב-50 הרץ או 60 הרץ כדי להסיר רעשי קו. עם זאת, זה ישנה באופן דרמטי את האות ולכן יש לקחת בחשבון בניתוח הבא. בהתחשב בגירוי אור אופטוגנטי, יש למזער את החפץ האופטו-חשמלי או לפחות לקחת בחשבון בתכנון הניסוי (למשל, על ידי הכללת עיכוב לאחר התחלה או היסט של אור). באופן אידיאלי, האור מועבר באזור שבין האלקטרודות באמצעות קוטר סיב אופטי קטן, או מיקוד או קולימציה של האור. אם לא ניתן להימנע לחלוטין מחפץ זה (אך ראה מחקרים המציעים עיצובי בדיקה שונים 15,20,43 כולל אלקטרודות שקופות), ניתן להפחית אותו על ידי שימוש בכמות האור הנמוכה ביותר הדרושה. אופסינים מהדור החדש דורשים פחות אור ליעילות44,45. אנו מציעים לכייל את עוצמת האור האופטוגנטית לפני הניסוי באמצעות בדיקות למינריות. ניתן גם לשנות ולהקטין את צורת החפץ על ידי הימנעות ממעברים חדים בגירוי האור (למשל, שימוש ברמפה קלה במקום בפולס מרובע). בכל מקרה, תנאי בקרה המשתמשים בבעלי חיים שאינם מבטאים אופסינים מומלצים כדי להבדיל בין שינויים אמיתיים בפעילות העצבית לבין אותות הקשורים לחפצים. לבסוף, תהליך האלקטרו-דיפוזיציה יוצר ציפוי מחוספס ושטח פנים גבוה המשפר את העברת המטען בין האלקטרודה לרקמה תוך שמירה על יציבות מכנית במהלך ההקלטות, מפחית את עכבת האלקטרודה ב-1-2 סדרי גודל בהשוואה לפלטינה חשופה ומאפשר זיהוי אותות עצביים טוב יותר46.
μECoG אקוטי מציע גמישות ומורכבות מופחתת במערכי ניסוי, ומאפשר מיפוי מפורט של פעילות עצבית במהלך עשרות דקות של הקלטות. כשיטה בקנה מידה בינוני, היא מאפשרת מעקב בין-אזורי אך לא אחר כל המוח של פעילות קליפת המוח, אם כי המקורות המדויקים של האותות נותרו לא ברורים 1,47. בעתיד, מחקרים רב-מודאליים אמורים לספק תמונה טובה יותר של מקור האות. μECoG חריף מוגבל בלכידת דינמיקה עצבית ארוכת טווח ועשוי להיות מושפע מגורמים חולפים כגון התאוששות כירורגית או הרדמה48,49. לעומת זאת, μECoG כרוני מאפשר התבוננות ממושכת בפעילות עצבית, ומספק תובנות לגבי תהליכים כמו למידה, פלסטיות והתקדמות מחלה10,13. μECoG כרוני מציב גם אתגרים כגון יציבות אלקטרודות, ירידה פוטנציאלית באותות וסיכונים הקשורים להשתלה ארוכת טווח, כולל הצטלקות או זיהום ברקמות50,51. אתגרים אלה נוטים להיות פחות חמורים בהשוואה לאלקטרודות חודרות והם כביכול מופחתים עוד יותר עם השתלה אפידורלית של μECoG בעכברים (במחיר של איכות אות נמוכה יותר)52. אפשר לעשות שימוש חוזר באותה רשת μECoG על פני סשנים רבים באותן חיות או בחיות שונות, להסיר את הרשת בסוף הסשן ולהחליף אותה בסשן הבא. בתצורה תת-חריפה זו, יש לשמור על המוח לח בכל עת ולהגן עליו באמצעות כיסוי זכוכית בין הפגישות. ראינו שרשתות μECoG עמידות למדי; ניתן לעשות שימוש חוזר ברשת בודדת ~ 20 פעמים עם טיפול וניקוי נאותים, מה שהופך אותם למכשירי הקלטה חסכוניים. ניתן לעצב רשתות עם מספרים וגיאומטריות מגוונות של פריסות אלקטרודות. התוצאות כאן מצביעות על כך שהפחתת גובה האלקטרודה ל-<200 מיקרומטר מביאה לשיפורים זניחים בלבד ברזולוציה התפקודית עקב הפירוטיות של ייצוגים עצביים בקליפת המוח הבסיסית.
Disclosures
המחברים מצהירים שאין אינטרסים פיננסיים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי המעבדה הלאומית לורנס ברקלי LDRD עבור המעבדה למערכות עצביות ולמידת מכונה (K.E.B.), NINDSR01 NS118648A (K.E.B.& D.E.F.), ו-NINDS R01 NS092367 (D.E.F).
Materials
| Name | Company | Catalog Number | Comments |
| 1 disposable #11 blade | Swann Morton | 303 | For surgical procedures |
| 2 disposable #10 blades | Swann Morton | 3901 | For surgical procedures |
| 30 mm cage bars | Thorlabs | ER | cage components |
| 30 mm cage plate | Thorlabs | CP33T | holding the lenses |
| 70% ethanol | Decon Labs | V1016 | Cleaning / Disinfectant (diluted to 70%) |
| Amalgambond PLUS Adjustable Precision Applicator Brush Teal 200/Bx | Henry Schein | 1869563 | precision applicator for the cement |
| Amalgambond PLUS Catalyst 0.7 mL Syringe Ea | Henry Schein | 1861119 | cement component |
| Amplifier (Tucker-Davis Technologies) | Tucker-Davis Technologies | PZ5M-512 | Used for auditory stimulus and recording software. |
| Articulated arm | Noga | DG60103 | for holding the fine adjustment screw system |
| Aspheric lenses for light collection (and one for focusing the light) | Thorlabs | ACL25416U-B | for collecting LED light |
| Auditory equipment | Tucker-Davis Technologies, Sony, Cortera | RP2.1 Enhanced Real-Time Processor/HB7 Headphone Drive | Used for auditory stimulus and recording software. |
| Buprenorphine | Sterile Products LLC | #42023017905 | General analgesia |
| C&B Metabond Base Cement Ea | Henry Schein | 1864477 | cement component |
| C&B Metabond L-Powder Cement Clear 3 g | Henry Schein | 1861068 | cement component |
| Chlorprothixene hydrochloride (mouse) | Sigma Aldrich | Cat. No. C1671 | For sedation, must be prepared the same day and kept at 4 |
| Custom-designed 128-channel micro-electrocorticography (μECoG) grids | Neuronexus | E128-200-8-40-HZ64 | For neurophysiology recordings. Placed onto the cortex. |
| Dengofoam gelatin sponges | Dengen dental | 600034 (SKU) | can be used dry or wet, saturated with sterile sodium chloride solution |
| Drill bit, size 5 to 9 (Mouse) | Fine Science Tools | 19007-XX | XX is the size of the drill bit e.g. 05 or 09. For mouse procedures |
| Drill bitSteel Round Bur (5.5 mm/7.5 mm) | LZQ Tools | Dental Bar Drill Bit Stainless Steel Bur | For rat procedures |
| Dumont No. 5 forceps | Fine Science Tools | 11251-10 | For surgical procedures |
| Dumont tweezers #5 bent 45° | World precision instruments | 14101 | for removing craniotomy window |
| DVD Player (Sony) | Sony | CDP-C345 | System used to accept and play back stimulus sets |
| Electrostatic Speaker | Sony | XS-162ES | Used for auditory stimulus and recording software. Located within the rig, plays sound to the sedated rodent |
| Enzymatic detergent (Enzol) | Advanced sterilization products | 2252 | Cleaning/Disinfectant |
| EverEdge 2.0 Scaler Sickle Double End H6/H7 #9 | Henry Schein | 6011862 | for scrubing the skull |
| Fine adjustment screw system in 3 dimension | Narishige | U-3C | for precise positioning of the optical fiber end |
| Gold pin | Harwin Inc | G125-1020005 | Used for contact reference in mouse Soldered to the silver wire |
| Gripping forceps | Fine Science Tools | 00632-11 | For surgical procedures |
| Isoflurane | Covetrus | 11695067772 | require a vaporizer |
| Ketamine (Hydrochloride Injection) (Rat) | Dechra | 17033-101-10 | Anesthesia/Analgesic |
| LED | New Energy | LED XLAMP XPE2 BLUE STARBOARD | Blue LED light source |
| LED driver | Thorlabs | LEDD1B | LED driver |
| Lidocaine | Covetrus | VINB-0024-6800 | to be diluted to 1% in saline |
| Meloxicam | Covetrus | 6451603845 | Anti-inflammatory used for general analgesia |
| Micromanipulator | Narishige (Stereotaxic Rig) | SR-6R + SR-10R-HT components | Used to manipulate ECoG and rodent with fine movements |
| No. 2 forceps | Fine Science Tools | 91117-10 | For surgical procedures |
| No. 55 forceps | Fine Science Tools | 1129551 | For surgical procedures |
| Ophtalmic lubricant (Artificial tears) | Akorn | 17478-062-35 | Used to protect eyes from dessication during surgical procedures |
| Optical fiber 200µm Core diameter | Thorlabs | M133L02 | FC/PC connector 2 m long |
| Pentobarbital (Rat) | Covetrus / Dechra | VINV-C0II-0008 | Anesthesia/Analgesic |
| Platinum Black | Sigma | 205915-250MG | For neurophysiology recordings (Used for electroplating the contacts on the μECoG grids). |
| Povidone Iodine 10% | Betadine | https://betadine.com/medical-professionals/betadine-solution/ | no catalog number ( not retail ) |
| Powder detergent (Contrex AP) | Decon Labs | 5204 | Cleaning / Disinfectant |
| Pre-cut tape for oxygen tube | ULINE (Various Providers) | S-14726 | Used to attach oxygen tube to the nose-cone of the rodent stereotaxic rig |
| Scalpel handle # 3 | World precision instruments | 500236-G | for blades # 10, #11 and #15 |
| Scraper | Fine Science Tools | 1007516 | For surgical procedures |
| Short 30 G needles | ExelInt | 26437 | For surgical procedures and injections |
| Silver Wire | Warner Instruments | 63-1319 | For neurophysiology recordings (Used for grounding and as a reference electrode). |
| Sterilized saline (0.9% sodium chloride for injection) | Hospira | 00409-7101-67 (NDC) | For dilution of injectable, and replacement of body fluids |
| Stoelting Hopkins Bulldog | Fine Science Tools | 10-000-481 | For surgical procedures |
| Surface disinfectant (Coverage Plus NDP Disinfectant) | Steris life science | 638708 | Cleaning/Disinfectant |
| TDT ZIF-clip connectors for acquisition. | Tucker-Davis Technologies | ZIF-Clip Analog Headstages | Connects ECoG with outside acquisition equipement |
| Two-pronged holding fork | Tucker-Davis Technologies | Z-ROD128 | Used to connect the TDT-clips with the micromanipulator |
| Xylazine (Rat) | Covetrus | 1XYL006 | Anesthesia/Analgesic |
References
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nunez, P. L., Srinivasan, R. . Electric Fields of the Brain: The Neurophysics of EEG. , (2006).
- Mountcastle, V. B., Powell, T. P. Central nervous mechanisms subserving position sense and kinesthesis. Bull Johns Hopkins Hosp. 105, 173-200 (1959).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci. 18 (2), 310-315 (2015).
- Lewis, C. M., Bosman, C. A., Womelsdorf, T., Fries, P. Stimulus-induced visual cortical networks are recapitulated by spontaneous local and interareal synchronization. Proc Natl Acad Sci U S A. 113 (5), E606-E615 (2016).
- Bouchard, K. E., Mesgarani, N., Johnson, K., Chang, E. F. Functional organization of human sensorimotor cortex for speech articulation. Nature. 495 (7441), 327-332 (2013).
- Ledochowitsch, P., et al. Fabrication and testing of a large area, high density, parylene MEMS µECoG array. , (2011).
- Bosman, C. A., et al. Attentional stimulus selection through selective synchronization between monkey visual areas. Neuron. 75 (5), 875-888 (2012).
- Rubehn, B., Bosman, C., Oostenveld, R., Fries, P., Stieglitz, T. A MEMS-based flexible multichannel ECoG-electrode array. J Neural Eng. 6 (3), 036003 (2009).
- Baratham, V. L., et al. Columnar localization and laminar origin of cortical surface electrical potentials. J Neurosci. 42 (18), 3733-3748 (2022).
- Kellis, S., et al. Decoding spoken words using local field potentials recorded from the cortical surface. J Neural Eng. 7 (5), 056007 (2010).
- Viventi, J., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci. 14 (12), 1599-1605 (2011).
- Ledochowitsch, P., Olivero, E., Blanche, T., Maharbiz, M. M. A transparent µECoG array for simultaneous recording and optogenetic stimulation. , (2011).
- Ledochowitsch, P., et al. Strategies for optical control and simultaneous electrical readout of extended cortical circuits. J Neurosci Methods. 256, 220-231 (2015).
- Dougherty, M. E., Nguyen, A. P. Q., Baratham, V. L., Bouchard, K. E. Laminar origin of evoked ECoG highgamma activity. Annu Int Conf IEEE Eng Med Biol Soc. 2019, 4391-4394 (2019).
- Tian, H., Xu, K., Zou, L., Fang, Y. Multimodal neural probes for combined optogenetics and electrophysiology. iScience. 25 (1), 103612 (2022).
- Gonzales, D. L., et al. A translaminar spacetime code supports touchevoked traveling waves. bioRxiv. , (2024).
- Leonard, M. K., et al. Largescale singleneuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Renz, A. F., et al. OptoEDura: a soft, stretchable ECoG array for multimodal, multiscale neuroscience. Adv Healthc Mater. 9 (17), 2000814 (2020).
- Buzsáki, G. . Rhythms of the brain. , (2006).
- Yang, W., et al. A fully transparent, flexible PEDOT:PSS-ITO-Ag-ITO based microelectrode array for ECoG recording. Lab Chip. 21 (6), 1096-1108 (2021).
- Buzsáki, G. Largescale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Schalk, G., et al. Realtime detection of eventrelated brain activity. Neuroimage. 43 (2), 245-249 (2008).
- Kellis, S., et al. Multiscale analysis of neural activity in humans: implications for microscale electrocorticography. Clin Neurophysiol. 127 (1), 591-601 (2016).
- Buzsáki, G., Schomburg, E. W. What does gamma coherence tell us about interregional neural communication. Nat Neurosci. 18 (4), 484-489 (2015).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecondtimescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Cardin, J. A., et al. Driving fastspiking cells induces gamma rhythm and controls sensory responses. Nature. 459 (7247), 663-667 (2009).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decisionrelated activity propagate in a cortical feedback loop during touch perception. Nat Neurosci. 19 (9), 1243-1249 (2016).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56 (2), 339-355 (2007).
- Crone, N. E., Sinai, A., Korzeniewska, A. Highfrequency gamma oscillations and human brain mapping with electrocorticography. Prog Brain Res. 159, 275-295 (2006).
- Gerfen, C. R., Paletzki, R., Heintz, N. GENSAT BAC crerecombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron. 80 (6), 1368-1383 (2013).
- Mountcastle, V. The columnar organization of the neocortex. Brain. 120 (4), 701-722 (1997).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Muller, L., Chavane, F., Reynolds, J., Sejnowski, T. J. Cortical travelling waves: mechanisms and computational principles. Nat Rev Neurosci. 19 (5), 255-268 (2018).
- Sato, T. K., Nauhaus, I., Carandini, M. Traveling waves in visual cortex. Neuron. 75 (2), 218-229 (2012).
- Gilbert, C. D., Wiesel, T. N. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortex. J Neurosci. 9 (7), 2432-2442 (1989).
- Angelucci, A., et al. Circuits and mechanisms for surround modulation in visual cortex. Annu Rev Neurosci. 40 (1), 425-451 (2017).
- Singer, W., Gray, C. M. Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci. 18, 555-586 (1995).
- Quiroga, R. Q., et al. Invariant visual representation by single neurons in the human brain. Nature. 435 (7045), 1102-1107 (2005).
- Fusi, S., Miller, E. K., Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr Opin Neurobiol. 37, 66-74 (2016).
- Stringer, C., et al. Spontaneous behaviors drive multidimensional, brainwide activity. Science. 364 (6437), eaav7893 (2019).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using celltypespecific expression of channelrhodopsin2. Nat Protoc. 5 (2), 247-254 (2010).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nat Neurosci. 21 (6), 881-893 (2018).
- Mahn, M., et al. Highefficiency optogenetic silencing with somatargeted anionconducting channelrhodopsins. Nat Commun. 9 (1), 4125 (2018).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating lowimpedance tetrodes by electroplating with additives. Sens Actuators A Phys. 156 (2), 388-393 (2009).
- Halnes, G., et al. . Electric Brain Signals: Foundations and Applications of Biophysical Modeling. , (2024).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nat Rev Neurosci. 9 (5), 370-386 (2008).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and anesthesia. Science. 322 (5903), 876-880 (2008).
- Schalk, G., Leuthardt, E. C. Braincomputer interfaces using electrocorticographic signals. IEEE Rev Biomed Eng. 4, 140-154 (2011).
- Chestek, C. A., et al. Longterm stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex. J Neural Eng. 8 (4), 045005 (2011).
- Branco, M. P., et al. Nine decades of electrocorticography: a comparison between epidural and subdural recordings. Eur J Neurosci. 57 (8), 1260-1288 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved