Method Article
Многомасштабные исследования кортикального процессинга путем интеграции ламинарных политродов и оптогенетики с микроэлектрокортикографией у грызунов
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной работе мы представляем два протокола для регистрации микроэлектрокортикографии высокой плотности (μEcoG) у крыс и мышей, включая хирургический, имплантационный и регистрирующий методы. Запись μECoG выполняется в сочетании либо с записью ламинарного политрода в слуховой коре крыс, либо с оптогенетическими манипуляциями нейронной активности в соматосенсорной коре мышей.
Аннотация
Электрокортикография (ЭКоГ) является методологическим мостом между основами нейробиологии и пониманием функции мозга человека в здоровье и болезни. ECoG регистрирует нейрофизиологические сигналы непосредственно с поверхности коры головного мозга с миллисекундным временным разрешением и столбчатым пространственным разрешением на больших участках корковой ткани одновременно, что делает его уникальным для изучения как локальных, так и распределенных корковых вычислений. В этой статье мы опишем проектирование специализированных микро-ECoG (μECoG) устройств высокой плотности и их использование в двух процедурах. Эти сетки имеют 128 низкоимпедансных электродов с шагом 200 мкм, изготовленных на прозрачной полимерной подложке с перфорацией между электродами; эти особенности позволяют одновременно регистрировать μECoG с записью ламинарного политрода и оптогенетическими манипуляциями. Во-первых, мы представляем протокол комбинированной эпидуральной записи μECoG на соматосенсорную кору усов мышей с оптогенетическими манипуляциями с конкретными генетически определенными типами клеток коры головного мозга. Это позволяет анализировать причинно-следственную связь различных нейронных популяций в сенсорную обработку, а также отслеживать их специфические сигнатуры в сигналах μECoG. Во-вторых, мы представляем протокол для острых экспериментов по регистрации нейронной активности слуховой коры головного мозга крысы с использованием сеток μECoG и ламинарных политродов. Это позволяет детально картографировать сенсорно-вызванные нейронные реакции по всей поверхности коры головного мозга одновременно с записями от нескольких нейронных единиц, распределенных по глубине коры головного мозга. Эти протоколы позволяют проводить эксперименты, которые характеризуют распределенную активность коры головного мозга и могут способствовать пониманию и возможным вмешательствам при различных неврологических расстройствах.
Введение
Функции мозга, лежащие в основе ощущений, познания и действия, организованы и распределены в обширных пространственных и временных масштабах, начиная от всплесков отдельных нейронов и заканчивая электрическими полями, генерируемыми популяциями нейронов в корковой колонке, и топографической организацией колонок в областях мозга (например, соматотопия в соматосенсорной коре, тонотопия в первичной слуховой коре). Понимание функций мозга требует восприятия электрических сигналов в этих пространственных масштабах1. В настоящее время в нейронауке существует множество широко используемых методов мониторинга активности мозга. С электрофизиологической точки зрения, ламинарные политроды (такие как нейропиксели) позволяют контролировать небольшое количество (~300) отдельных нейронов, обычно в пределах нескольких удаленно расположенных колонок, с высоким (≥1 кГц) временным разрешением. Визуализация Ca2+ позволяет осуществлять мониторинг от умеренного до большого числа генетически и анатомически идентифицированных одиночных нейронов в пределах ~1-2 мм в пространственном пространстве при более низком (~10 Гц) временном разрешении2. ФМРТ позволяет контролировать метаболическое состояние большого числа нейронов (~1 М нейронов в объеме 36мм3 ) по всему мозгу с очень низким (~0,2 Гц) временным разрешением. ЭЭГ/МЭГ позволяет контролировать электрическую активность всей корковой поверхности/мозга со скромным временным разрешением (<100 Гц) и очень низким пространственным разрешением (сантиметры)3. В то время как каждая из этих методологий обеспечила фундаментальное, синергетическое понимание функций мозга, методы, которые позволяют напрямую ощущать электрофизиологические сигналы с высоким временным разрешением из точных анатомических мест в обширных пространственных областях коры головного мозга, находятся в зачаточном состоянии. Необходимость широкого пространственного охвата подчеркивается тем фактом, что в головном мозге функция нейронов изменяется гораздо более резко по всей поверхности по сравнению с глубиной4.
Электрокортикография (ЭКоГ) — это метод, при котором сетки электродов с низким импедансом имплантируются на поверхность мозга и позволяют регистрировать или стимулировать кору головного мозга 1,5. ЭКоГ обычно используется в нейрохирургических условиях человека как часть клинических исследований для лечения фармакологически трудноизлечимой эпилепсии. Тем не менее, он также дает уникальную информацию о распределенной обработке коры головного мозга у человека, такую как речь и сенсорное топографическое картографирование 6,7. Эти возможности мотивировали его использование на животных моделях, включая обезьян, крыс и мышей 5,8,9,10,11. На грызунах недавно было показано, что микро-ЭКоГ (μECoG) позволяет осуществлять прямой электрический мониторинг нейронных популяций с высоким временным разрешением (~100 Гц) с столбчатым пространственным разрешением (~200 мкм) и широким пространственным охватом (многие миллиметры). μECoG позволяет исследователям исследовать распределенную нейронную динамику, связанную со сложной сенсорной обработкой, когнитивными функциями и моторным поведением в животных моделях12,13. Последние достижения объединили μECoG с оптогенетикой и пластинчатыми политродными записями 14,15,16,17,18,19,20, что позволило проводить многомасштабные исследования корковых сетей и преодолеть разрыв между микромасштабной нейронной активностью и макромасштабной динамикой коры головного мозга 21,22. Важно отметить, что, поскольку сигнал μECoG очень схож в моделях человека и животных, использование μECoG делает трансляцию результатов и выводов из животных моделей на людей гораздоболее прямой. Таким образом, интегративные подходы имеют решающее значение для углубления нашего понимания нейронных схем и являются перспективными для разработки новых терапевтических вмешательств при неврологических расстройствах 5,24,25.
Следовательно, возникает потребность в протоколах, которые интегрируют массивы μECoG высокой плотности с ламинарными записями и оптогенетическими инструментами для обеспечения всесторонних многомасштабных исследований коркового процессинга 8,26. Чтобы восполнить этот пробел, мы разработали специально разработанные устройства μECoG, состоящие из 128 низкоимпедансных электродов с диаметром электродов 40 мкм и расстоянием между электродами 20 мкм на гибкой прозрачной полимерной подложке (парилен-С и полиимид) с перфорацией между электродами, что позволяет одновременно регистрировать μECoG и ламинарный политрод с оптогенетическими манипуляциями13,22. Ключевые аспекты этого экспериментального протокола включают: (i) столбчатое пространственное разрешение и крупномасштабное покрытие активности коры головного мозга с помощью массивов μECoG высокой плотности; (ii) возможность записи из нескольких слоев коры головного мозга с использованием ламинарных политродов, вставленных через сетку μECoG; и (iii) внедрение оптогенетических методов для селективной активации или ингибирования определенных популяций нейронов, что позволяет проводить причинно-следственную диссекцию нейронных цепей 27,28,29. Конфигурация с высокой плотностью позволяет получать записи с высоким пространственным разрешением, эффективно обеспечивая «столбчатое представление» активности коры головного мозга, поскольку предыдущие исследования показали, что сигналы μECoG могут разрешать активность в пространственном масштабе, сравнимом с диаметром колонки коры головного мозга грызуна (~20 мкм)11. Эта интегрированная методология позволяет осуществлять одновременный многомасштабный мониторинг и манипулирование нейронной активностью, потенциально позволяя проводить причинно-следственные эксперименты для определения нейронных источников сигналов μECoG, а также распределенной обработки коры головного мозга. Для достижения этих целей в данной рукописи представлены подробные протоколы использования массивов μECoG высокой плотности в двух комбинациях.
Во-первых, мы описываем μECoG в сочетании с манипуляциями с пирамидальными клетками слоя 5 (L5) в первичной соматосенсорной коре (S1) мыши. У мышей массив μECoG помещается эпидурально (из-за хирургической неподатливости дуротомии у мышей). Оптическое волокно располагается над сеткой или в сочетании с линзой для фокусировки оптогенетического света на небольшой целевой области поверхности коры головного мозга. Оптогенетическая стратегия описана здесь для ингибирования возбуждающих нейронов слоя 5, но может быть легко адаптирована к любой популяции нейронов, снабженной соответствующей популяционно-специфичной, Cre-экспрессирующей мышиной линией. Во-вторых, мы описываем совместное использование μECoG с кремниевыми ламинарными политродами для одновременной регистрации электрических потенциалов кортикальной поверхности (CSEP) и одиночной спайковой активности от нескольких нейронов через корковые слои из слуховой коры (A1) крысы. Массив имеет перфорацию между электродами, что позволяет вставлять многоканальные ламинарные политроды через сетку для записи нейронной активности в различных слоях коры головного мозга. Во время процедуры трепанации черепа массив μECoG размещается субдурально над слуховой корой, а ламинарный политрод вводится через перфорацию. Нейронные сигналы от μECoG и ламинарного зонда записываются одновременно, дискретизируются на частотах 6 кГц и 24 кГц соответственно с помощью усилительной системы, оптически подключенной к цифровому сигнальному процессору.
протокол
Оба протокола следуют одним и тем же ключевым этапам (анестезия, фиксация, краниотомия, запись μECoG), но имеют заметные различия. В приведенном ниже описании общие шаги объединены, а особенности каждого протокола аннотированы. Эти шаги ниже соответствуют записи μECoG с помощью оптогенетики (мышь) или записи μECoG с помощью ламинарного зонда (Rat). Все описанные здесь процедуры были проведены в соответствии с местными этическими или юридическими органами (IACUC или Комитетами по этике). Используемые лекарства могут различаться в зависимости от утвержденного этического протокола.
1. Подготовка и протокол процедур на мышах и крысах
- Заметные различия между мышиными и крысиными протоколами
- Установки для хирургии в сравнении с электрофизиологической записью
- Для крысы используйте одну и ту же установку как во время операции, так и во время электрофизиологической записи.
- Для мыши выполните операцию в первой установке, а электрофизиологическую запись — во второй.
- Фиксация головы
- Для крысы используйте тот же зажим для хирургии и электрофизиологической записи.
- Для мыши используйте зажим для хирургии и внешнюю металлическую головку в установке для электрофизиологии, чтобы обеспечить фиксацию под легкой изофлурановой анестезией. Имплантируйте оголовье с помощью стоматологического цемента на череп.
- Настройка записи: Используйте отдельную электронику для сбора данных, программное обеспечение для записи и программное обеспечение для сенсорной стимуляции для двух видов.
- Для протокола мыши используйте систему SpikeGadgets (https://spikegadgets.com) и программное обеспечение Trodes с открытым исходным кодом (https://spikegadgets.com/trodes/) для сбора данных.
- Для протокола на крысах используйте программное обеспечение для записи Synapse - Neurophysiology Suite (https://www.tdt.com/component/synapse-software/) для сбора данных.
- Вызвать анестезию с помощью инъекции (Rat) или ингаляции (Mouse).
- Место записи
- Проводите записи в соматосенсорной коре (S1) у мыши.
- Проведение записей в первичной слуховой коре (А1) у крысы.
Примечание: Эта разница в анатомической локализации требует разных мест трепанации черепа для каждого вида.
- Установки для хирургии в сравнении с электрофизиологической записью
- Подготовка и тестирование сетки
- Замочите сетку (за исключением соединительной платы) в разведенном ферментном моющем средстве (50% моющего средства, 50% дистиллированной воды) не менее чем на 1 час.
- Переложите его в ванну с чистой дистиллированной водой и дайте ему высохнуть на воздухе в безопасном и чистом месте.
- Проводите электроосаждение платинового черного цвета в рамках первоначальной подготовки устройства μECoG, а не перед каждым сеансом записи.
ПРИМЕЧАНИЕ: После нанесения платиново-черное покрытие образует стабильный слой, который остается эффективным при многократной записи, хотя его производительность следует контролировать с помощью регулярных испытаний импеданса. Платиново-черное электроосаждение (целевой диапазон 10-20 кОм на частоте 1 кГц.) снижает импеданс электродов и улучшает соотношение сигнал/шум при нейронных записях. - Для проведения электроосаждения готовят раствор хлорпластиновой кислоты (обычно 1-3% хлорпластиновой кислоты [H2PtCl6]), содержащий небольшое количество ацетата свинца (около 0,005%) в качестве модификатора осаждения. Соедините электроды μECoG в качестве рабочего электрода в трехэлектродной электрохимической ячейке с платиновым контрэлектродом и электродом сравнения Ag/AgCl.
- Подайте постоянную плотность тока примерно -0,5--2 мА/см² в течение 10-30 с, контролируя значения импеданса.
- Проверьте и запишите импеданс сетчатых электродов (например, с помощью нано-Z).
- Проверьте сетку на источнике света и подготовьте сетку для использования в послеоперационной записи.
- Пайка опорного кабеля
- Для мыши припаяйте конец серебряного провода (длиной 10 мм, 30 G) к золотому контакту для подключения к эталонному проводу записывающей системы.
2. Хирургия
- Подготовка материалов и общий мониторинг (уход за животными и учет)
- Подготовка: Тщательно очистите и продезинфицируйте операционную область с помощью соответствующего дезинфицирующего средства. Убедитесь, что все хирургические инструменты стерилизованы, как правило, с помощью автоклава.
- Размещение хирургических инструментов: Расположите хирургические инструменты на стерильной хирургической прокладке. Наполните операционную область аппликаторами с ватным наконечником и абсорбирующими хлопчатобумажными хирургическими треугольниками. Утилизируйте любые биологически опасные отходы в специальном мешке для утилизации.
- Регулировка температуры: Включите грелку в месте хирургической и электрофизиологической записи. Контролируйте температуру грелки на протяжении всей операции и записи.
- Хирургическая прокладка: Положите синюю хирургическую прокладку или одеяло на кровать для регулирования температуры.
ПРИМЕЧАНИЕ: Эта прокладка должна иметь мягкую хлопчатобумажную белую нижнюю часть, которая должна быть обращена вверх. - Расположение микроскопа: Подготовьте микроскоп и прикрепленный к нему осветитель (например, светодиодное кольцо) с одной стороны операционной зоны. Убедитесь, что он функционирует правильно.
- Хирургическое сверло: Подготовьте хирургическое сверло к процедуре трепанации черепа.
- Подача кислорода: установите расход кислородного баллона на 1,0 л/мин (Rat) или 0,5 л/мин (Mouse) и поместите кислородную маску рядом с регулирующей площадкой. Животное будет нуждаться в постоянном кислороде после анестезии.
- Замена жидкости: На протяжении всей операции восполняйте потерю жидкости с целью восполнения не менее 1,5% от массы тела животного (мышь) или 1 мл в час (крысы). Приготовьте изотонические растворы соответственно.
- Животное: Приведите животное из помещения для животных в операционную в соответствии с утвержденными процедурами. Используйте мышей в возрасте от 8 до 16 недель, самцов или самок, с фоном C57Bl6; также используйте крыс в возрасте 7 недель, самцов, штамма Sprague Dawley.
- Приготовление лекарств: Взвесьте животное с помощью весов с точностью до 0,1 г. Подготовьте достаточное количество лекарств для операции, при необходимости используя предварительно разведенные растворы.
- Индукция анестезии
- Индукция анестезии для мыши
- Поместите животное в индукционную камеру изофлурана (3-5% изофлуран в 0,5 л/мин О2).
- Как только глубокая анестезия подтвердится (отсутствие рефлекса при защемлении хвоста/пальца ноги), поместите животное на операционную грелку и зафиксируйте ее головой.
- Вводите подкожные препараты для общего обезболивания: Мелоксикам: 5 мг/кг и Бупренорфин: 0,1 мг/кг.
- Зафиксируйте мышь на голове, выполнив шаги 2.2.1.5-2.2.1.6.
- Поместите морду в маску для анестезии, а голову свободно в крепление для головы. Чтобы поместить мышь в планку для укуса, сначала убедитесь, что язык находится ниже стержня, а не между стержнем и нёбом. При необходимости используйте щипцы для перемещения языка.
- Вставьте резцы животного в отверстие на стержне прикусочной планки. Закрепите маску для мышиной анестезии (1,5-2% изофлуран в 0,5 л/мин О2), осторожно затянув фиксирующий винт. Стабилизация головы во время операции обеспечивается исключительно прикусной планкой.
- Защитите глаза животного глазной мазью или лубрикантом на нефтяной основе, чтобы предотвратить высыхание во время операции.
- Поддерживайте анестезию на протяжении всей процедуры с помощью непрерывного потока изофлурана через маску.
- Индукция анестезии крысе
- Первоначально используйте изофлуран для успокоения животного, чтобы облегчить инъекцию индукционной анестезии.
- Применяют препараты для обезболивания и обезболивания:
Мелоксикам: дозировка 5 мг/кг, концентрация 10 мг/мл, 0,4 мл/кг
Кетамин: дозировка 90 мг/кг, концентрация 100 мг/мл, 0,9 мл/кг
Ксилазин: дозировка 10 мг/кг, концентрация 100 мг/мл, 0,1 мл/кг - Дайте животному достичь глубокой анестезии в течение 15-30 минут, в зависимости от веса и возраста.
- Мониторинг анестезии
- Постоянно контролируйте жизненно важные показатели животного (частоту дыхания) на протяжении всей процедуры. Проверьте частоту дыхания как особенно полезный признак ранних изменений состояния анестезии и отрегулируйте уровень анестезии, если частота дыхания изменяется.
- Рефлекс отведения лапы является критическим признаком обезболивающего состояния. Периодически проверяйте этот рефлекс, так как его полное отсутствие обеспечивает достаточный уровень анестезии для хирургического вмешательства.
- Индукция анестезии для мыши
- Фиксация головы и контроль жизненно важных показателей
- Мониторинг жизнедеятельности животных
- Проверьте и запишите жизненные показатели животного на экспериментальном листе. Если рефлексы животного (например, отведение лапы) не полностью гаснут, введите дополнительную половинную дозу дополнительного кетамина (Крыса) или увеличьте концентрацию изофлурана с шагом 0,5% (Мышь).
- Фиксация головы у крысы
- Как только крыса будет полностью обезболена (никаких лапьих или хвостовых рефлексов), вставьте резцы животного в отверстие на стержне головного крепления.
- Осторожно вставьте точки крепежных кронштейнов в гребень носа, чтобы зафиксировать голову во время операции, следя за тем, чтобы она не соприкасалась с глазами.
- Регулируйте угол наклона рук до тех пор, пока нёбо животного не будет плотно прижато к стержню. Убедитесь, что череп остается неподвижным под давлением.
- Закрепите оба рычага крепления, затянув винты шестигранным ключом.
- Кислородная установка для крысы
- Закрепите пластиковую трубку от кислородного баллона над мордой и носом животного, закрепив ее хирургическим скотчем. Избегайте складок на трубке, которые могут препятствовать потоку воздуха. Установите кислородный баллон на скорость потока 1 л/мин.
ПРИМЕЧАНИЕ: Жизненно важные показатели животных, включая частоту сердечных сокращений и дыхания, следует проверять с интервалом 15-30 минут на протяжении всей процедуры.
- Закрепите пластиковую трубку от кислородного баллона над мордой и носом животного, закрепив ее хирургическим скотчем. Избегайте складок на трубке, которые могут препятствовать потоку воздуха. Установите кислородный баллон на скорость потока 1 л/мин.
- Мониторинг жизнедеятельности животных
- Разрез кожи головы
- Бритье и подготовка к нему
- Выбрейте область от верхней морды до затылка, простирающуюся от одного глаза к другому и вокруг ушей. Удалите основную массу шерсти ножницами или электрической машинкой для стрижки, а затем нанесите крем для депиляции.
- Дезинфекция
- Продезинфицируйте участок с помощью ватного тампона, смоченного в бетадине, затем промойте ватным тампоном, смоченным в 70% этаноле. Повторите этот процесс три раза и завершите окончательным нанесением бетадина, чтобы убедиться, что область стерильна.
- Инъекция местного анестетика
- Введите местный анестетик Лидокаин (1%, 0,1 мл для мышей/0,4 мл на кг для крыс) подкожно в среднюю линию волосистой части головы животного. Аккуратно помассируйте кожу головы, чтобы распределить лидокаин, и подождите 5 минут, чтобы анестетик подействовал.
- Надрез
- Для мыши приподнимите точку на коже пинцетом и рассеките небольшой участок кожи (примерно 1 см в диаметре) с помощью хирургических ножниц.
- Для крысы сделайте точный разрез на передней стороне волосистой части головы, чуть выше носа, по средней линии с помощью скальпеля. Аккуратно оттяните кожу, создав прямой разрез между глазами до основания черепа. Осторожно поднимите кожу головы, отрежьте соединительную ткань и полностью обнажите череп.
- Обнажите место трепанации черепа, выполнив шаги 2.4.4.4-2.4.4.5.
- С помощью скребка очистите соединительную ткань и надкостницу на верхней части черепа. Промойте физиологический раствор и используйте аспирацию или хирургическую губку для очистки участка.
- Используйте хирургические зажимы на краях кожи, чтобы обеспечить четкое обнажение области черепа, где будет проводиться трепанация черепа.
- Бритье и подготовка к нему
- Краниотомия
- Общая процедура сверления
- Установите скорость хирургического сверла на низкую настройку 5000 об/мин или 7000 об/мин для опытных хирургов. Выполняйте все сверление во время визуализации через микроскоп.
- Держите сверло параллельно поверхности черепа и осторожно упритесь в поверхность.
- Слегка надавливая на педаль, начните сверление в одном месте. Выполняйте сверление с короткими интервалами (5-10 с) с частыми проверками на изменение цвета костей.
ПРИМЕЧАНИЕ: Кость будет начинаться с непрозрачного белого цвета, и по мере того, как отверстие становится глубже, оно становится более прозрачным, открывая розовый оттенок. - Когда сверление приблизится к мозгу, замедлите темп и обратите внимание на признаки просачивания влаги в отверстие. Когда отверстие станет темно-розовым и будет иметь легкий блеск, прекратите сверление. С помощью короткой иглы 30 G аккуратно проколите оставшийся слой кости. Прозрачная жидкость должна хорошо выйти из нового отверстия.
- Порядок сверления для мыши
- Чтобы разместить электрод сравнения для физиологической регистрации, просверлите отверстие для заусенцев в лобной части полусферы ипсилатерально к регистрируемой области.
- Определите контур трепанации черепа, просверлив по ее периметру неглубокую траншею. По медиолатеральной оси начните с бокового костного гребня в качестве ориентира и проведите окно диаметром 4 мм.
- В передне-задней оси просверлите окно 3 мм, начиная ~ 1 мм вперед от заднего костного гребня. Окончательный размер открытого трепанации черепа составляет примерно окно 4 х 3 мм.
- Процедура сверления крысы
- Просверлите два отверстия: одно в левом заднем квадранте, другое в правом переднем квадранте.
- Введите в жевательную мышцу вторую дозу лидокаина (0,4 мл/кг в дозе 10 мг/мл) и равномерно распределите в месте разреза.
- Резецируйте только минимальный набор мышц, необходимый для обнажения области трепанации черепа.
- Используя свежее лезвие скальпеля #10, сделайте поперечный спинно-вентральный разрез в пучке мышц над челюстью животного (правая сторона). Удерживайте задний край разреза захватывающими щипцами и отклеивайте от черепа во время разреза вдоль костного гребня скулы. Таким образом, мышца может быть отделена от кости с минимальным кровотечением.
- Аналогичным образом резецируйте переднюю мышцу до тех пор, пока не будет выявлена линия трещины в черепе. Эта линия будет передней границей окна трепанации черепа.
- Очистите мышцы вокруг заднего гребня с помощью скальпеля и щипцов, используя сильный источник света, чтобы избежать разреза в сильно васкуляризированных областях.
- Шлифуйте задний гребень с помощью сверла до тех пор, пока он не перестанет возвышаться над поверхностью черепа.
ПРИМЕЧАНИЕ: Этот шаг необходим для установки сетки μECoG для прямого контакта с поверхностью коры головного мозга. - Просверлите дорсальный край окна прямо над гребнем, где была прикреплена резецированная мышца. Поместите задний край впереди просверленного заднего гребня. Поместите передний край позади линии трещины, идущей вниз возле глазницы.
ПРИМЕЧАНИЕ: При очистке передней мышцы необходимо соблюдать осторожность, чтобы не попасть в глаз.
- Общая процедура сверления
- Краниотомия сверления окон
- Сверление окна трепанации черепа (Советы)
- При сверлении следите за тем, чтобы сверло было расположено параллельно поверхности черепа. Прикладывайте как можно меньше усилий, используя сверло как щетку, позволяя сверлу легко соприкасаться с черепом, используя короткие, повторяющиеся движения вдоль предполагаемой линии трепанации черепа.
ПРИМЕЧАНИЕ: У крыс задний край окна имеет самую толстую кость. Если сверлить слишком далеко назад, кость может иметь шелушащуюся, «хрустящую» поверхность, что затрудняет оценку хода сверления. При неправильном размещении эта область кости может иметь венозно-красную окраску, которая создает ложное впечатление близости к мозгу. - Сверлите каждую сторону окна трепанации черепа до тех пор, пока кость не станет бледно-розовой с тонкой белой трещиной или трещиной, проходящей по ее длине. Слегка надавите; Кость должна давать отчетливое «покачивание» при полном сверлении. Если трещина кажется разъединенной, продолжайте слегка сверлить, пока не получится непрерывная линия.
- При сверлении следите за тем, чтобы сверло было расположено параллельно поверхности черепа. Прикладывайте как можно меньше усилий, используя сверло как щетку, позволяя сверлу легко соприкасаться с черепом, используя короткие, повторяющиеся движения вдоль предполагаемой линии трепанации черепа.
- Удаление истонченного черепа в пределах окна трепанации черепа
- Когда череп истончится настолько, что чрезвычайно легкое давление заставляет все окно заметно покачиваться, удалите истонченный череп.
- Промойте место трепанации черепа каплей физиологического раствора и подождите не менее 1 минуты. Это ослабляет истонченную кость и помогает кости отсоединиться от твердой мозговой оболочки. Слейте излишки физраствора с помощью абсорбирующего ватного треугольника или пропылесосите.
- Осторожно приподнимите истонченный череп с помощью щипцов, не допуская повреждения подлежащих тканей.
- Используйте гемостатическую губку, чтобы поддерживать мозг влажным.
- Плотно обхватите окно с дорсальной и брюшной стороны зубчатыми щипцами и потяните прямо от черепа. Если возникают трудности с вытаскиванием окна за пределы участка, остановитесь и возобновите легкое сверление до тех пор, пока кость не станет достаточно слабой.
- Для записи μECoG мыши оставьте твердую мозговую оболочку нетронутой.
- Сверление окна трепанации черепа (Советы)
- Имплантат из цемента и головного столба для мыши
- Вставьте и закрепите контрольный провод.
- Вставьте конец серебряной проволоки на ~1 мм в отверстие для заусенца, достаточно, чтобы он соприкасался с поверхностью мозга, но не вызывал кровотечения.
- Нанесите стоматологический цемент на место во время нанесения первого слоя.
- Приготовление стоматологического цемента
- Используйте охлажденную керамическую форму для смешивания для приготовления стоматологической цементной смеси. Этот цемент быстро загустевает и требует регулярного приготовления новой смеси. Протрите форму для смешивания перед приготовлением новой смеси.
ПРИМЕЧАНИЕ: Цемент никогда не должен находиться в прямом контакте с мозгом.
- Используйте охлажденную керамическую форму для смешивания для приготовления стоматологической цементной смеси. Этот цемент быстро загустевает и требует регулярного приготовления новой смеси. Протрите форму для смешивания перед приготовлением новой смеси.
- Нанесение первого слоя
- Нанесите первый слой цемента вокруг трепанации черепа и по всему черепу с помощью микроаппликаторов. Этот слой действует как электрическая изоляция между черепом и металлической оголовьем.
- Полностью окружите трепанацию черепа цементом, включая боковое покрытие, чтобы обеспечить достаточную защиту для открытой трепанации черепа и сетки μECoG.
- Позиционирование металлической оголовки
- Прикрепите большую секцию оголовья к его держателю, не затягивая его полностью.
- Расположите перекладину по желанию, уложив тонкий участок вдоль средней линии черепа, соприкасающейся с цементной поверхностью.
- Фиксация имплантата
- Покройте перекладину зубным цементом и соедините ее с цементной поверхностью.
- Снятие держателя
- Подождите несколько минут, чтобы стоматологический цемент укрепился.
- После того, как оголовок будет полностью закреплен, снимите его, предварительно открутив винт из держателя. Затем втяните держатель назад, следя за тем, чтобы к перекладине не прикладывалось усилие.
- Вставьте и закрепите контрольный провод.
- Дуротомия для хирургии крыс
ПРИМЕЧАНИЕ: Это сложный хирургический этап.- Подтяжка твердой мозговой оболочки
- С помощью щипцов No 5, расположенных максимально параллельно поверхности мозга, приподнимите небольшую часть твердой мозговой оболочки от мозга.
- С помощью свежей иглы 30 G (как можно более короткой) аккуратно оторвите приподнятую твердую мозговую оболочку.
ПРИМЕЧАНИЕ: Твердая мозговая оболочка представляет собой тонкий прозрачный слой ткани, который лежит непосредственно на верхней части мозга. Его удаляют для регистрации μECoG у крыс. Очень важно выполнить дуротомию без нарушения сосудистой сети на поверхности мозга. Рекомендуемые методы выполнения дуротомии включают использование щипцов и иглы шприца для прокола твердой мозговой оболочки перед ее оттягиванием или использование инструмента duratome, закрепленного рядом с черепом, для осторожного втягивания твердой мозговой оболочки.
- Резекция твердой мозговой оболочки
- Продолжайте захватывать твердую мозговую оболочку щипцами и поднимать ее в сторону от мозга. Создайте диагональный разрыв иглой во время подъема.
- С помощью щипцов осторожно отклейте твердую мозговую оболочку по направлению к сторонам окна трепанации черепа, следя за тем, чтобы поверхность мозга оставалась нетронутой.
- Подтяжка твердой мозговой оболочки
- Перенос мыши в установку для электрофизиологической записи
- Извлеките животное из операционной, осторожно приподняв морду и резцы от резцов, а затем оттянув животное назад. Введите хлорпротиксен (1 мг/кг, внутрибрюшинно [IP]), седативное средство, которое позволяет поддерживать непрерывную анестезию при более низкой концентрации изофлурана.
- Поместите мышь в установку электрофизиологической записи.
- Убедитесь, что грелка на месте и работает исправно.
- Голова фиксируется животным с помощью оголовья на держателе в электрофизиологической установке.
- Поднесите изофлурановую маску близко, чтобы полностью закрыть морду животного.
- Корректировка анестезии
- Постепенно снижайте уровень анестезии до 0,7-1% изофлурана (с шагом 0,5% максимум каждые 5 минут).
- Следите за частотой дыхания и движениями животного.
ПРИМЕЧАНИЕ: Частота дыхания должна немного увеличиться по сравнению с хирургическим состоянием, но животное не должно двигаться. - Если животное движется, немедленно увеличьте концентрацию изофлурана до 2%, а затем медленно возвращайте ее к более низкому уровню с шагом 0,5%.
- Вставка усов для сенсорной стимуляции
- Прикрепите вибриссы мыши к устройству для стимуляции усов. В этом протоколе вставьте девять вибрисс в короткие наконечники пипеток объемом 10 μл, которые соединены с пьезоэлектрическими приводами, обеспечивающими быстрое отклонение вибрисс.
3. Запись
- Установка сетки
- Предварительные шаги
- Включите систему записи и усилитель.
- Проверьте жизненные показатели животного.
- Процедура
- Для позиционирования животного и инструментов выполните шаги 3.1.2.2-3.1.2.4.
- Поместите животное в установку для записи и убедитесь, что трепанация черепа остается влажной, регулярно применяя физиологический раствор.
- Если речь идет о крысе, расположите микроманипулятор на перилах буровой установки, расположенных далеко за местом трепанации черепа, чтобы избежать помех.
- Для мыши поместите микроманипулятор сбоку к месту трепанации черепа рядом с животным.
- Чтобы прикрепить и расположить сетку на мыши, выполните шаги 3.1.2.6-3.1.2.12.
- Прикрепите сетку μECoG к сцене с помощью разъемов ZIF-clip (разъем для головы). Удерживайте электронную плату сцены на месте с помощью механической планки, закрепленной на микроманипуляторе.
- Опустите сетку μECoG горизонтально, чтобы выровнять ее по краниотомии вдоль переднезадней оси.
ПРИМЕЧАНИЕ: Вдоль латерально-медиальной оси край сетки должен находиться рядом с медиальной границей краниотомии. - Как только решетка будет расположена рядом с мозгом, но не будет соприкасаться с ним, прикрепите контрольный провод сетки к имплантированному серебряному проволочному золотому штифту. При необходимости прикрепите провод заземления к животному (например, к непокрытой мышце) для снижения электрического шума.
- Далее опустите сетку, чтобы контактировать с мозгом.
- Переместите сетку в сторону, чтобы «скользить» по влажной поверхности твердой мозговой оболочки. Продолжайте корректировку до тех пор, пока сетка не будет центрирована вдоль медиолатеральной оси.
- Используйте аспирацию или хирургическую губку по краям трепанации черепа, чтобы удалить избыток физиологического раствора.
- Когда препарат немного подсохнет, убедитесь, что сетка более плотно прилегает к твердой мозговой оболочке и не скользит по ее поверхности. Когда станет суше, приложите боковое или медиальное движение к гибкой сетке, обеспечивая контакт с наиболее боковыми электродами. Гибкий кабель сетки будет естественным образом изгибаться в соответствии с контуром мозга.
- Чтобы расположить сетку на крысе, выполните шаги 3.1.2.14-3.1.2.18.
- Закрепите стержень удерживающей вилки в микроманипуляторе, следя за тем, чтобы соединительная плата сетки зависала над задней стороной краниотомического окна при опускании.
- Отрегулируйте положение микроманипулятора на перилах так, чтобы сетка находилась примерно над местом трепанации черепа. Опустите сетку до тех пор, пока она не приблизится к поверхности мозга. Смочите поверхность мозга небольшой каплей физиологического раствора.
- Выполните эти действия с помощью микроскопа. С помощью циферблатов микроманипулятора отрегулируйте положение сетки до тех пор, пока она не ляжет ровно на поверхность мозга в центре трепанации черепа.
- Осторожно отводите влагу с помощью впитывающего ватного треугольника, не касаясь самой сетки. Убедитесь, что каждый ряд сетки соприкасается с поверхностью мозга.
ПРИМЕЧАНИЕ: Удаление влаги предотвращает пассивное распространение электрического сигнала через жидкость между поверхностью коры головного мозга и сеткой, которая пространственно рассеивает сигнал, воспринимаемый на электроде. - С помощью щипцов No 2 или No 5 вставьте сетчатый заземляющий провод в то же отверстие для заусенцев или вставьте контрольный провод в отверстие для заусенцев, а заземляющий провод — в близлежащую мышечную ткань.
ПРИМЕЧАНИЕ: Провода должны быть вставлены всего на ~1 мм, достаточно для контакта с мозгом, но не для того, чтобы вызвать кровотечение или травму мозга.
- Предварительные шаги
- Проверка позиционирования сетки
- Мониторинг электрофизиологической активности
- Наблюдайте за электрофизиологической активностью с помощью записывающего программного обеспечения. Под легкой анестезией сигналы мозга изменчивы и могут проявлять различные паттерны.
- Правильное подключение сетки, опорного провода и провода заземления должно обеспечивать высокое отношение сигнал/шум с амплитудой сигнала в диапазоне мВ. Контролируйте шум в высокочастотном диапазоне с помощью полосовой фильтрации с помощью Trodes (например, 100-6000 Гц) и следите за тем, чтобы он не превышал нескольких десятков микровольт (мкВ).
- Оцените сенсорную реакцию с помощью шума (например, хлопков или щелчка пальцев) для индуцирования электрических потенциалов кортикальной поверхности (CSEP), связанных с видимыми событиями.
ПРИМЕЧАНИЕ: Стимуляция одного уса должна вызывать четкий, резкий CSEP, связанный с событием, только в нескольких каналах (мышь). - Проверка положения в сетке
- Для крысы убедитесь, что сетка правильно расположена над слуховой корой. Первый записываемый блок обычно должен быть набором белого шума 60-х секунд, чтобы убедиться, что сетка регистрирует надлежащую реакцию мозга. Проводите запись белого шума и диагностики тона с помощью сетки только перед вставкой политрода, чтобы определить, правильно ли была размещена сетка и есть ли отклик сигнала.
- Для мыши, чтобы проверить позиционирование сетки, выполните сеанс быстрого отображения с 20-30 отклонениями усов с интервалом 350 мс. Запишите активность в канале локального полевого потенциала (LFP) с помощью Trodes и проанализируйте ее в автономном режиме с помощью пользовательского кода MATLAB для визуализации пространственной протяженности активности, вызванной усами.
- Перемещение
- Если сетка требует регулировки, смочите кортикальную поверхность каплями физиологического раствора поверх сетки.
- Оставьте солевой раствор на 30 с - 1 минуту, прежде чем пытаться поднять решетку.
- Осторожно и медленно поднимаем сетку.
- Переместите его, выполнив действия, описанные в шаге 3.1.
- Мониторинг электрофизиологической активности
- Ламинарные политроды для крысы
- Установка Polytrode
- Сначала подключите адаптер для настила к тыльной стороне политрода. Закрепите разъем на плате адаптера с помощью зажима для третьего набора каналов. Убедитесь, что черная метка на зажиме обращена к правой стороне рабочего конца политрода.
- Вставка из политрода
- Вводите политрод в мозг до тех пор, пока над поверхностью коры не будут видны самые последние (самые верхние) электроды. Медленный спуск (до 1 мкм/с) улучшает качество сигнала. Подождите 15 минут, давая мозгу приспособиться к присутствию политрода.
- Через 15 минут проверьте, вошли ли последние электроды в поверхность коры головного мозга. Если нет, опустите политрод еще немного и подождите еще 10 минут, прежде чем продолжить.
- Установка Polytrode
- Позиционирование оптогенетического источника света на мыши
- Используйте либо систему винтов точной регулировки в трех измерениях, установленную на шарнирном кронштейне, либо микроманипулятор для крепления держателя оптического волокна.
- Чтобы направить источник света и помочь в позиционировании волокна, включите оптогенетический свет с низкой интенсивностью. Используйте шарнирную руку, чтобы грубо расположить оптогенетический свет по направлению к целевой области.
- Фокусируйте и точно настраивайте положение волокна с помощью микроманипулятора или винтов точной регулировки.
- Запись сигналов
- Подготовка
- Отключите от сети все ненужные лампы, удлинители и сетевые фильтры в хирургической установке, чтобы уменьшить электрические помехи. Выключите верхнее освещение в буровой установке.
- Перед началом эксперимента закройте дверь в изолированное помещение для записи и дверь в операционную.
- Начало набора
- Для крысы запустите Synapse на записывающей платформе/компьютере и убедитесь, что сбор данных работает, предварительно просмотрев и проверив сигналы. Вызывайте большие, резкие переходные процессы напряжения в сигнале μECoG путем подачи стимулов рядом с животным, т.е. хлопков.
- Если у вас есть мышь, запустите сессию записи в Trodes.
- Гидратация
- Вводите крысе или мыши подкожно 1 мл или 0,1 мл физиологического раствора соответственно каждые 1-2 часа во время записи для предотвращения обезвоживания. Для крысы подождите 5-10 минут после введения физиологического раствора, прежде чем запускать новый блок записи.
- Наборы стимулов
- Для крысы, как только место записи подтверждено, приступайте к записи необходимых наборов стимулов. Пример набора может включать в себя
Белый шум (60 с)
Тональная диагностика (5 мин)
Чистый тон (23 мин)
Динамическая движущаяся рябь
Тон 150 (15 мин)
ТИМИТ (38 мин) - Для крысы повторное воспроизведение белого шума и диагностики тона каждый раз при изменении положения сетки.
- Тактильные стимулы для мыши: Предоставляйте тактильные стимулы в пробной структуре, при этом каждая попытка содержит цепочку случайных отклонений усов каждые 350 мс. В приведенном примере каждое испытание включает 14 отклонений, представленных в течение 4500 мс.
- Оптогенетические стимулы для мыши: В некоторых испытаниях применяют квадратный импульс оптогенетического света в течение всего испытания (5 с). Определите необходимый уровень освещенности на основе используемого опсина и глубины ткани, которая должна быть достигнута, используя оценки легкой проникающей способности (https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php)
- Для крысы, как только место записи подтверждено, приступайте к записи необходимых наборов стимулов. Пример набора может включать в себя
- Подготовка
- Уборка
- Подъем и очистка сетки
- После завершения записи закройте программное обеспечение для записи и снова подключите источники света в установке.
- Если мозг сухой, нанесите небольшую каплю физиологического раствора на поверхность мозга с помощью шприца. Оставьте солевой раствор на 30 с - 1 минуту, прежде чем пытаться поднять решетку.
- Работая под микроскопом, аккуратно приподнимайте сетку с поверхности мозга с помощью микроманипуляторов.
- Если при подъеме сетки требуется дополнительная сила, используйте щипцы с угольным наконечником (закрытые), чтобы аккуратно поднять сетку из мозга. Убедитесь, что микроманипулятор движется немного вперед, чтобы аккуратно отодвинуть сетку от поверхности мозга.
- После того, как решетка будет полностью снята, отсоедините ее от хватной вилки и очистите, выполнив шаги 3.6.1.6-3.6.1.7.
- Замочите сетку (за исключением соединительной платы) в разведенном ферментном моющем средстве (50% Энзола, 50% дистиллированной воды) не менее чем на 1 час. После этого переложите его во вторую ванну с чистой дистиллированной водой и дайте ему высохнуть на воздухе в безопасном и чистом месте.
- Если на участках сетки отложилась кровь или ткань, используйте ватный треугольник, смоченный в ферментативном растворе, чтобы аккуратно протереть его.
- После высыхания верните сетку в коробку.
- Усыпление животного
- В случае с мышью извлеките животное из фиксации головы и поместите его в камеру эвтаназии. Добавьте марлю с 5 мл изофлурана и подождите 60 с после прекращения дыхания. Проверьте отсутствие рефлекса отмены и обезглавьте с помощью острых ножниц.
- Крысе вводят 0,2 мл пентобарбитала ИП. Подождите 60 с после остановки дыхания, положите животное на спину и с помощью лезвия #11 выполните двойную торакотомию.
- Чистка оборудования
- Отнесите все хирургические инструменты в лабораторную раковину и положите их на хирургическое полотенце. Сбрызните инструменты 10% раствором отбеливателя и тщательно промойте в раковине. Для более грязных инструментов дайте им впитаться в раствор отбеливателя перед мытьем.
- В качестве альтернативы можно использовать порошковое моющее средство (например, Contrex AP) с водой, протирая инструменты щеткой в раковине.
- После того, как инструменты будут чистыми и промытыми, протрите их спиртовыми салфетками и верните в место для хранения.
- Дезинфекция рабочего пространства
- Выбросьте все использованные иглы и лезвия в контейнер для острых предметов.
- Выбросьте загрязненные ватные палочки, треугольники и спиртовые салфетки в пакет для биологически опасных веществ.
- Протрите все рабочие поверхности в буровой установке спиртом и очистите все инструменты перед закрытием рабочего места.
- Подъем и очистка сетки
Результаты
Описаны протоколы регистрации электрокортикографических сигналов в сочетании с оптогенетическими методами и ламинарной записью. Здесь представлены типичные сигналы, полученные из соматосенсорной коры головного мозга мыши (рис. 1, рис. 2 и рис. 3) и из слуховой коры крыс в ответ на сенсорную стимуляцию (рис. 4, рис. 5 и рис. 6).
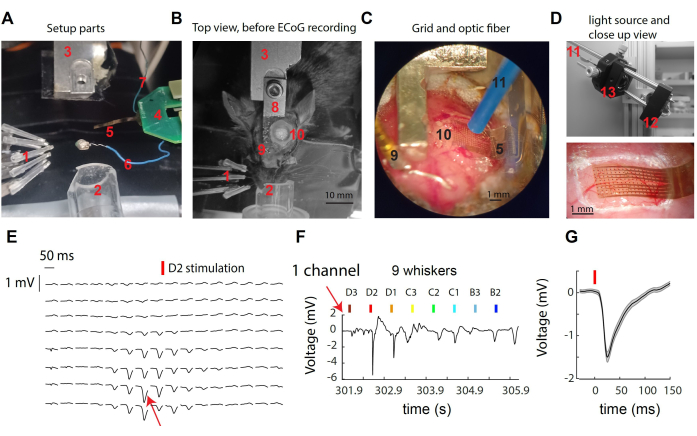
Рисунок 1: Запись сигналов μECoG через соматосенсорную кору уса мыши. (A) Компоненты установки. Смотрите текст. (B) Вид сверху на хирургическую установку до регистрации μECoG, показывающий размещение подголовника и места трепанации черепа. (C) Детальный вид сетки μECoG и оптического волокна, расположенного на открытой коре головного мозга. (D) Верх: Источник света расположен снаружи записывающей коробки. Свет от светодиода с длиной волны 473 нм собирается в оптическое волокно через тандем линз. Внизу: крупный план корковой сетки над корой головного мозга мыши в примере записи. (E) Репрезентативные μЭКоГ-следы со всех каналов 16x8, показывающие усредненные по пробам ответы на стимуляцию усов D2. (F) Кривая исходного напряжения от одного канала, указанного на рисунке (E), через одиночные отклонения нескольких усов. Канал проявлял наиболее сильную реакцию при стимуляции усов D2. (G) Средний вызванный отклик в испытаниях в одном канале (E,F), который продемонстрировал резкое отклонение напряжения после стимуляции усов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
На рисунке 1A-D представлены изображения различных компонентов системы, используемых для регистрации и оптогенетических манипуляций в коре S1 мыши. Маркированные элементы включают: 1- девятинезависимый стимулятор усов в массиве 3 x 3, 2- носовой конус для изофлурановой анестезии, 3- держатель головки/аналог, 4- внутренняя печатная плата ЭКоГ, соединенная с печатной платой головки с двойным разъемом ZIF; сетка электродов 5 мкЭГ на кончике гибкого кабеля толщиной 8 мм; 6 - опорный провод; 7 - провод заземления; 8- имплантат для стойки головы; 9- эталонный золотой штифт (изолирован от оголовка стоматологическим цементом); 10- трепанация черепа в левом полушарии, над корой усатого ствола S1; оптогенетическое волокно диаметром 11 мм (удерживается микроманипулятором, не показано); 12 - светодиод в форме звезды, приводимый в действие светодиодным драйвером (не показан); 13- Сбор света через тандем асферических линз. При стимуляции одного уса наблюдается быстрое отклонение поверхностного потенциала на малом числе электродов (рис. 1Е). Этот кластер электродов представляет собой локальный сигнал, который достигает пиков в корковом столбе стимулированного уса30. Глядя на один электрод, мы наблюдаем самую сильную реакцию на стимуляцию предпочитаемого им уса и более слабую реакцию или ее отсутствие на стимуляцию более отдаленных усов (рис. 1F). В этом примере начало отклонения происходит примерно через 10 мс после вибрации уса со средней амплитудой 1 мВ (рис. 1G).
На рисунке 2 представлены примеры записей во время оптогенетического ингибирования. Свет может достигать корковой ткани через прозрачную подложку сетки (рис. 2А). Однако при использовании волокна большого диаметра или любого пространственно широкого источника света фотоны также попадают на электроды, создавая оптоэлектрический артефакт (рис. 2B). В этом протоколе торможения мы использовали квадратный импульс света длиной 5 с. Результирующие оптоэлектрические артефакты присутствуют только в начале и смещении света. У животного без опсина стимуляция усов при включенном свете не вызывает реакции, отличной от стимуляции усов, представленной в опытах при выключенном свете (рисунок 2C). Напротив, световая стимуляция ингибиторного опсина в субпопуляции возбуждающих нейронов приводит к снижению амплитуды сенсорно-вызванного ответа (рис. 2D)
На рисунках 2C, D представлены примеры оптогенетического подавления во временно-частотной области. Для анализа данных μECoG мы сначала применяем общую среднюю привязку (CAR) для удаления сигналов, которые не дифференцированы по электродам (например, дыхание), а затем следует вейвлет-преобразование Морзе, которое выявляет активные полосы частот с течением времени. Нейронная активность в частотной области обычно демонстрирует приближенный степенной закон 1/f 2,3. Чтобы более равномерно выявить сенсорный вызванный сигнал в частотной области, мы применяем Z-оценку отдельно для каждой полосы частот. Z-скоринг основан на статистике сигнала в течение базовых эпох. Здесь мы используем временное окно, которое предшествует стимулу, от -3000 мс до -1000 мс до начала испытания. Этот процесс дает вызванный стимулом Z-показатель для каждой полосы частот (рис. 2C, D).
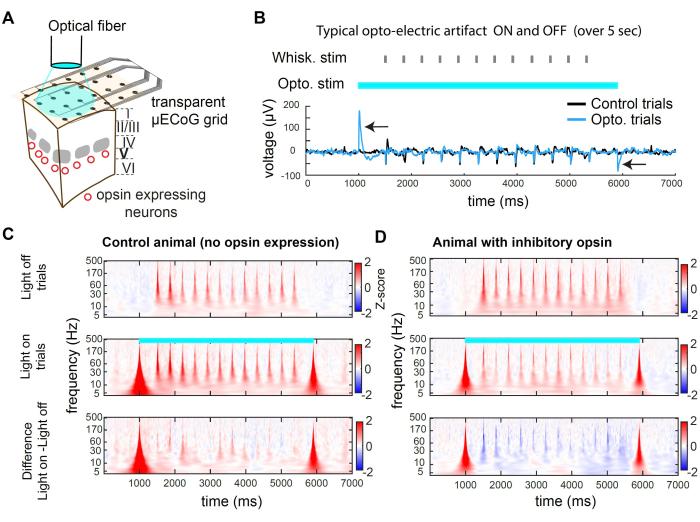
Рисунок 2: Оптогенетическое подавление в wS1 во время регистрации μECoG у мышей. (A) Схема репрезентативного оптогенетического эксперимента. Оптическое волокно направлено непосредственно на мозг, что позволяет временно ингибировать популяцию нейронов, экспрессирующих ингибирующий опсин. (B) Кривая напряжения, зарегистрированная в канале в центре оптогенетической стимуляции, усредненная по испытаниям. Черная стрелка указывает на оптоэлектрические артефакты в начале и смещении света с длиной волны 473 нм. Обратите внимание на реакцию на отклонение усов (случайную идентичность усов) в середине испытания. Артефакт является преходящим и не влияет на запись сенсорно-вызванной активности после задержки (в данном случае 500 мс). (C) Средняя спектрограмма примера канала в испытаниях при выключенном свете, испытаниях при включении света и разница между ними у животного, у которого опсин не экспрессировался. Обратите внимание, что оптоэлектрический эффект индуцирует широкополосный переходный артефакт, и свет, вызванный усами, не зависит от света. (D) Пример спектрограммы, усредненной по испытаниям при выключении света, испытаниях при включении света и разнице между ними у мыши Rbp4-Cre32 , в которой st-GtACR2.0 экспрессировался в возбуждающих нейронах слоя 5. Обратите внимание на подавление вызванной реакцией усов на спектрограмме. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
На рисунке 3 представлены простые в реализации варианты системы доставки света. Используя оптическое волокно меньшего размера или простую линзу, можно нацелиться на определенную область коры15. Свет, выходящий из волокна, быстро расходится и достигает корковой ткани за пределами целевой области. Установив асферическую линзу (f = 16 мм) на выходе оптического волокна, можно сфокусировать свет на меньшую площадь поверхности (рис. 3A, C), вплоть до примерно диаметра одного кортикального столба (рис. 3C). Свет также меньше расходится в коре головного мозга. В идеале с помощью лазера или мощного источника света с тандемным набором линз можно нацелить коллимированный луч света на один столбик коры головного мозга. Однако важно учитывать, что свет будет рассеиваться внутри тканей, что может частично освещать соседние колонки. Световой артефакт, измеренный в данных μECoG, покажет, где свет был доставлен по поверхности коры головного мозга; см. сравнение рисунка 3B с рисунком 3D. Световой артефакт измеряется как пиковая мощность в высокочастотном диапазоне (65-500 Гц) через 5 мс после начала света.

Рисунок 3: Подача света к фокальным точкам коры головного мозга. (A) Свет от оптического волокна диаметром 1 мм фокусируется на поверхности мозга. Эта простая регулировка позволяет более точно направлять свет на поверхность мозга и внутри тканей. (B) Пространственная протяженность света, поступающего в мозг, измеряется по оптоэлектрическому артефакту. (К,Г) Настройка такая же, как на панелях A,B с оптическим волокном 200 мкм, что позволяет ему напрямую нацеливаться на область диаметром 250 мкм, что примерно соответствует размеру коркового столба. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Запись μECoG и ламинарного политрода крысы
На рисунке 4A-D представлены изображения различных компонентов системы, используемых для записи первичной слуховой коры крыс. В частности, маркированные элементы включают: (1) микроманипулятор μECoG, (2) стереотаксическую установку для грызунов, (3) кабель μECoG с разъемами ZIF-clip, (4) микроманипулятор из ламинарного политрода, (5) конус и стабилизацию головы крысиного носа, (6) электростатический динамик для предъявления стимулов, (7) ламинарный политродный кабель с адаптером ZIF-clip, (8) μECoGZIF-зажим, прикрепленный к двухконтактной вилке, (9) 32-канальное устройство из политрода, (10) электростатический динамик, (11) зажимы типа «крокодил» для удержания хирургического поля в открытом положении, (12) заземляющие провода, один из которых вводится в кору головного мозга через отверстия в левом заднем квадранте или правом переднем квадранте, а другой заземляется на ткани, (13) крупный план сетки μECoG, (14) крупный план вставленного политрода. На рисунке 4E показана средняя нейронная спектрограмма, полученная на основе зарегистрированных электрических потенциалов одного электрода μECoG в ответ на тональные пипы 50 мс той же частоты и затухания (N = 20 попыток). На всех частотах вызванная реакция демонстрирует резкий пик между 25 мс и 30 мс (обозначено красными сплошными линиями) после начала стимула (левая серая пунктирная линия). Кажущаяся реакция, предшествующая возникновению стимула (якобы акаузальная), обусловлена большой полосой пропускания на более низких частотах преобразования постоянной добротности, которое сглаживает (акаузальное, но не смещение фазы), а не фильтрует (причинно-следственно, но индуцирует смещение фазы) сигнала. Таким образом, время пиковой реакции остается точным. Во время пикового вызванного отклика мы наблюдали, что z-оцененный электрический потенциал корковой поверхности (CSEP) был мультимодальным на всех частотах. В частности, он продемонстрировал три первичных негармонических пика: первый и самый большой в диапазоне гамма/высокая гамма (γ/Hγ) с частотой 40-180 Гц, второй в диапазоне сверхвысоких гамма (uHγ) с частотой 200-450 Гц, и конечный пик выше 500 Гц, связанный с мультиюнитной активностью (MUA) (рис. 4F)11. Эта мультимодальная структура, вызванная стимулами, устойчива ко всем настроенным электродам. Здесь мы сосредоточимся на Hγ из-за его распространенности в записях электрокортикографии человека (ЭКоГ)31. На рисунке 4G мы отображаем матрицу μECoG, которая была размещена субдурально рядом с кремниевым ламинарным политродом для одновременного измерения электрических потенциалов кортикальной поверхности (CSEP) и спайковой активности на кортикальных пластинках. Специально изготовленная матрица μECoG состояла из 8×16 электродов с шагом 20 мкм и диаметром контакта 4 мкм, и мы использовали 32-канальный ламинарный политрод, сконфигурированный как 2 × 16 каналов с шагом 4 мкм и диаметром контакта 1 мкм. Массив μECoG был достаточно большим, чтобы охватить всю первичную слуховую кору крысы (A1), а его небольшие электроды диаметром 4 мкм позволили измерить локальные CSEP, пригодные для получения слуховой настройки. Пространственное разрешение высокогамма-сигнала (Hγ) μECoG составляет ~20 мкм, что сравнимо с радиусом колонки коры головного мозга крысы. Таким образом, μECoG обеспечивает «столбчатое представление» активности коры головного мозга. Перфорация в сетке μECoG позволяла ламинарному политроду проходить между поверхностными контактами, что позволяло напрямую регистрировать нейрональную активность в корковых пластинках (рис. 4H). Примеры кривых напряжения, записанных с μECoG и ламинарных политродных электродов, показаны на рисунке 4I.

Рисунок 4: Запись сигналов μECoG и ламинарного политрода над первичной слуховой корой (A1) крысы. (A) Компоненты μECoG и ламинарной политродной установки. Смотрите текст. (B) Вид сверху на хирургическую установку перед записью μECoG и ламинарного политрода, показывающий размещение подголовника и места трепанации черепа. (C) Детальный вид сетки μECoG и ламинарного политрода на открытой слуховой коре. (D) Крупный план размещения сетки μECoG на коре головного мозга, включая размер отдельных электродов (40 мкм) и между электродами (200 мкм). (E) Среднее z-оцененное вейвлет-разложение одноканального отклика на одну пару частотного затухания. Вертикальные красные линии указывают на период пиковой частотной характеристики, показанный в F.(F) Красный - Средняя пиковая частотная характеристика по 20 проявлениям одной пары частота-затухание. Серый - Стандартная ошибка. Частотная ось находится на логарифмической шкале. Канонические нейронные полосы частот обозначены сверху. (G) Микрофотография сетки размером 8 16 мкГ на поверхности первичной слуховой коры (А1) крысы. В центральное окно μECoG вставлен 32-канальный ламинарный политрод. (H) Схема 3D-многомасштабной записи активности коры головного мозга. (I) Вверху: спектрограмма 50 мс чистых тональных точек. Посередине: Красным цветом обозначен средний электрический потенциал поверхности коры головного мозга 4 электродов ЭКоГ (серый). Внизу: 32-канальные трассы напряжения ламинарного политрода упорядочены по глубине коры головного мозга Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
На рисунке 5 показана запись сигналов μECoG одновременно с пиковой активностью с использованием ламинарного кремниевого политрода (Camb64). Сигнал μECoG, записанный с поверхностного электрода, отображается в виде кривой необработанного напряжения (рисунок 5A) и его вейвлет-преобразования, подчеркивая частотное разложение с течением времени (рисунок 5B). Многокомпонентная активность регистрировалась с помощью политрода, что было проиллюстрировано репрезентативной кривой исходного напряжения из одного канала (рис. 5C), где отдельные потенциалы действия (спайки) были обнаружены с помощью простого порогового метода (напряжение, пересекающее пороговое значение -120 мкВ). Формы волн спайков, извлеченные из этого канала, хорошо определены для большинства спайков, хотя они могут исходить от нескольких источников нейронов (рис. 5D, врезка). По нескольким каналам при одном и том же проникновении средние формы спайковых сигналов еще раз подтверждают согласованность четко определенных записей спайковой активности (рис. 5E). Таким образом, эти методы записи могут поддерживать одноблочную запись с анализом сортировки спайков и анализом качественных показателей, таких как интервал между спайками или скорость срабатывания (рис. 5F). Таким образом, качество записей ламинарного зонда хорошее, с четкой морфологией формы сигнала на отдельных каналах. Эти результаты показывают, что этот метод позволяет одновременно регистрировать μECoG и спайкинговую активность.

Рисунок 5: Одновременная регистрация μECoG и активности столбчатого спайкинга. (A) Пример кривой исходного напряжения от одного канала μECoG. (B) Вейвлет-преобразование того же канала μECoG, показывающее частотное разложение во времени. (C) Пример исходной кривой напряжения от одного политродного канала (острый 64-канальный кремниевый зонд camb64), показывающая потенциалы действия (спайки), обнаруженные с использованием простого порога напряжения. (D) Извлеченные формы спайковых сигналов из политродного канала в (C) выровнены и помечены цветом на основе распределения амплитуды напряжения. 7 из 142 спайковых сигналов не показаны, так как они были признаны выбросами на основе их удаленности от основного кластера по ширине и амплитуде спайков (см. врезку). (E) Усредненные формы спайковых сигналов, извлеченные из 9 каналов с одним и тем же проникновением. (F) Гистограммы межспайкового интервала (ISI) для различных политродных каналов (например, каналов 21, 27, 63 и 61) с соответствующими скоростями срабатывания (FR), указанными в Гц. Нарушения ISI (< 5 мс) составляли менее 5% спайков во всех единицах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Имея возможность выполнять одновременную запись с использованием специально разработанной матрицы μECoG и ламинарного политрода, мы исследовали, как сигналы μECoG соотносятся с записями нейронных единиц по всей глубине коры головного мозга с точки зрения слуховой настройки. На рисунке 6A представлены графики амплитуды частотной характеристики (FRA), которые отображают высокую гамма-реакцию (Hγ) как функцию частоты и амплитуды слухового стимула. На верхней панели отображаются FRA от 2 × 16 подмножества электродов μECoG, расположенных на слуховой коре, в то время как на нижней панели отображаются FRA от 1×16 подмножества ламинарных политродных электродов, вставленных через перфорацию матрицы μECoG (обозначены серыми стрелками). Примечательно, что FRA, полученные от электродов μECoG, очень похожи на те, что получены от записей ламинарного политрода, что позволяет предположить, что сигналы μECoG аналогичным образом настроены на активность нейронных единиц в корковых слоях.
Используя высокое пространственное разрешение массива μECoG, мы создали тонотопическую карту с высоким разрешением нескольких полей слуховой коры на основе активности Hγ11. На рисунке 6B лучшая частота каждого электрода обозначена цветом, что показывает тонотопическую организацию по всей поверхности коры головного мозга. Массив из 8 × 16 мкЭКоГ охватывал несколько полей слуховой коры, включая первичную слуховую кору (A1), заднее слуховое поле (PAF) и вентральное слуховое поле (VAF), с приблизительными границами, обозначенными черными линиями. Это подробное картирование подчеркивает способность массива μECoG обеспечивать «столбчатое представление» активности коры головного мозга, захватывая функциональную организацию с пространственным разрешением менее 20 мкм, сравнимым с размерами колонки коры головного мозга крысы. Эти результаты показывают, что записи μECoG не только отражают свойства настройки, наблюдаемые в записях нейронных единиц по всей глубине коры головного мозга, но и позволяют с высоким разрешением отображать функциональную организацию коры головного мозга.
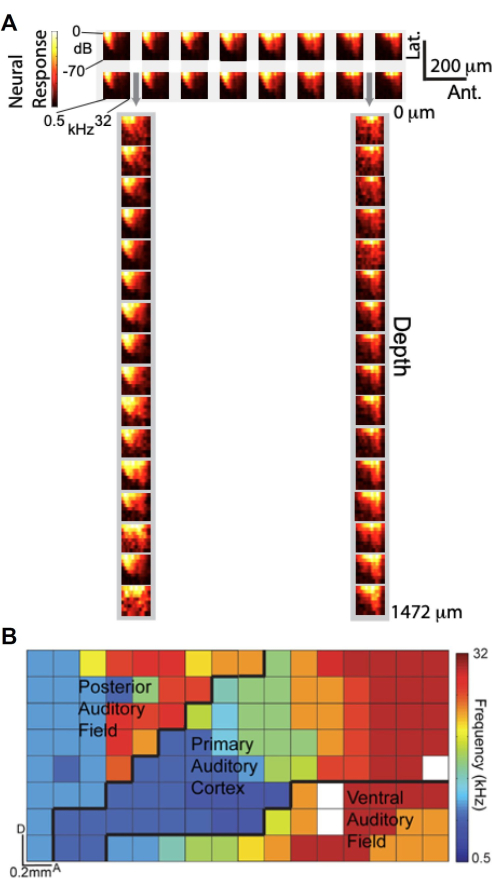
Рисунок 6. Сигналы μECoG аналогичным образом настраиваются на записи спайков нейронных единиц по всей глубине и выявляют тонотопическую организацию слуховой коры. (A) Графики амплитуды частотной характеристики (FRA), которые отображают высокую гамма-реакцию (цветная полоса) как функцию частоты (ось x) и амплитуды (ось y) слухового стимула. (наверх) FRA из 2 16 подмножества электродов μECoG на слуховой коре; (внизу) FRA из 1 16 подмножества ламинарных политродных электродов, вставленных через перфорации в массиве μECoG, обозначены серыми стрелками. (B) Тонотопическая организация множественных полей слуховой коры с высоким разрешением, полученная в результате высокой гамма-активности. Каждый пиксель имеет цветовую маркировку в соответствии с наилучшей частотой этого электрода. Показанная здесь матрица 8x16 μECoG охватывает несколько полей слуховой коры (A1, PAF и VAF), а приблизительные границы обозначены черными линиями. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Описанные здесь протоколы позволяют интегрировать матрицы микроэлектрокортикографии высокой плотности (μECoG) с ламинарными зондами и оптогенетическими методами. Простота использования этого протокола на моделях грызунов делает его мощным инструментом для исследования динамики коры головного мозга, а количество испытуемых может быть легко увеличено. Сетка μECoG высокой плотности позволяет эффективно, пространственно точно картировать топографию коры головного мозга в нескольких областях у мышей и крыс, используя критическую роль топографических представлений в организации мозга33. Добавление ламинарной записи позволяет изучать динамику коры головного мозга в нескольких пространственных и временных масштабах. Включение оптогенетики позволяет манипулировать причинно-следственными связями для определения отношений между конкретными нейронными популяциями и их вкладом в корковые поверхностно-вызванные потенциалы (CSEP) и корковую обработку34.
Оптогенетика позволяет проводить селективную модуляцию конкретных популяций нейронов, что позволяет исследовать их причинную роль в формировании паттернов активности коры головного мозга и участвовать в вычислениях, сигнатуры которых могут быть обнаружены с помощью μECoG. Например, наши исследования показывают, что нацеливание на определенный тип клеток может изменить электрические потенциалы коры головного мозга (CSEP). Этот подход может быть использован для анализа типов нейронных клеток сигналов μECoG, что позволит нам определить, какие типы нейронных клеток вносят свой вклад в характерную сенсорно-вызванную активность, например, наблюдаемую в диапазоне высокого гамма-диапазона. Другие крупномасштабные явления, такие как корковые ритмы в различных частотных диапазонах21 или пространственно организованная активность, включая бегущие волны35,36, могут быть исследованы аналогичным образом. Кроме того, существует ряд генетически модифицированных мышиных линий и опсинов, что дает возможность исследовать конкретные механизмы цепей. Оптогенетические методы могут быть использованы для изучения функциональных эффектов горизонтальных связей между столбцами37, которые играют решающую роль в различных сенсорных вычислениях, таких как подавление окружающего звука38 или перцептивное связывание39. Таким образом, способность манипулировать нейронной активностью с помощью оптогенетики позволяет проверять связи между конкретными нейронными популяциями и свойствами CSEPs или между популяцией и конкретными корковыми вычислениями, измеряемыми с помощью μECoG. Этот подход может эффективно анализировать отношения между локальными нейронными структурами и глобальной корковой активностью.
Записи ламинарного политрода позволяют отбирать активность одного нейрона от нескольких нейронов в небольших корковых объемах, т.е. в пределах отдельной колонки коры. Эти записи имеют решающее значение, потому что отдельные нейроны могут независимо кодировать различную информацию, используя избирательное кодирование стимулов, таких как «нейроны Дженнифер Энистон», описанные Quiroga et al.40, или обеспечивая дополнительные представления в пространстве более высокой размерности, как это видно при смешаннойизбирательности. Традиционно электрофизиологи изучали нейронную активность в контексте простых, параметрически спроектированных стимулов и поведения (например, отклонение одного уса или чистые тона, как показано здесь). Представление таких стимулов имеет тенденцию быть довольно пространственно локализованным (например, отдельные столбцы). Тем не менее, многие этологически значимые стимулы и модели поведения являются более сложными, и поэтому типичные паттерны нейронной активности во время таких парадигм часто выходят за рамки отдельных колонок - даже повсему мозгу. В этих случаях μECoG предлагает комплексное считывание, которое фиксирует активность с высоким временным разрешением и разрешением столбцов в нескольких столбцах одновременно. Таким образом, описанный здесь протокол эффективно устраняет разрыв между локальной обработкой в отдельных колонках коры головного мозга и более обширной динамикой, которая происходит в нескольких колонках во всей области коры головного мозга и между областями.
В качестве общего руководства и устранения неполадок мы предлагаем несколько рекомендаций. Традиционные электрофизиологические протоколы для острых состояний in vivo обычно рекомендуют сохранять мозг влажным во время воздействия в качестве средства продления здоровья мозга, подвергшегося воздействию. Хотя это, вероятно, полезно в некоторых обстоятельствах, наш опыт показывает, что для регистрации μECoG у грызунов верно обратное. Действительно, мы обнаружили, что качество записи было качественно лучше, когда массивы μECoG размещались на слегка сухой поверхности коры головного мозга. Мы считаем, что это происходит потому, что физиологический раствор, высокопроводящий ионный раствор, расположенный между поверхностью коры головного мозга и записывающими электродами, гомогенизирует электрические сигналы, генерируемые мозгом. По сути, физиологический раствор «замыкает» электроды вместе. Поскольку сетки μECoG контролируют непрерывное электрическое поле, генерируемое популяциями нейронов, важно убедиться, что электрофизиологические системы хорошо собраны и шумоизолированы. Во время записи соединение с электродом сравнения имеет решающее значение. Без улучшения во время записи для предварительной обработки данных можно использовать режекторный фильтр с частотой 50 Гц или 60 Гц для удаления линейного шума. Однако это приведет к резкому изменению сигнала и поэтому должно быть учтено при последующем анализе. Рассматривая оптогенетическую световую стимуляцию, оптоэлектрический артефакт должен быть сведен к минимуму или, по крайней мере, учтен в плане эксперимента (например, путем включения задержки после начала или смещения света). В идеале свет подается в область между электродами с помощью оптического волокна малого диаметра, либо путем фокусировки или коллимации света. Если этого артефакта нельзя полностью избежать (но см. исследования, предлагающие различные конструкции зондов 15,20,43, включая прозрачные электроды), его можно уменьшить, используя минимально необходимое количество света. Опсины нового поколения требуют меньше света для эффективности 44,45. Мы предлагаем откалибровать оптогенетическую мощность света перед экспериментом с помощью ламинарных зондов. Форма артефакта также может быть изменена и уменьшена путем исключения резких переходов в световом стимуле (например, использование светового пандуса вместо квадратного импульса). В любом случае, рекомендуется использовать контрольные условия с использованием животных, которые не экспрессируют опсины, чтобы дифференцировать подлинные изменения в нейронной активности от сигналов, связанных с артефактами. Наконец, в процессе электронапыления создается шероховатое покрытие с большой площадью поверхности, которое улучшает передачу заряда между электродом и тканью, сохраняя при этом механическую стабильность во время записи, снижая импеданс электрода на 1-2 порядка по сравнению с голой платиной и обеспечиваялучшее обнаружение нейронных сигналов.
Acute μECoG обеспечивает гибкость и меньшую сложность в экспериментальных установках, позволяя детально картировать нейронную активность в течение десятков минут записи. Как мезомасштабный метод, он позволяет отслеживать активность коры головного мозга между площадями, но не всем мозгом, хотя точные источники сигналов остаются неопределенными. В будущем мультимодальные исследования должны дать более точную картину происхождения сигнала. Острый μЭКоГ ограничен в захвате долгосрочной нейронной динамики и может зависеть от преходящих факторов, таких как хирургическое восстановление или анестезия48,49. В отличие от этого, хроническая μECoG позволяет длительное наблюдение за нейронной активностью, давая представление о таких процессах, как обучение, пластичность и прогрессирование заболевания10,13. Хроническая μЭКоГ также сопряжена с такими проблемами, как стабильность электродов, потенциальная деградация сигнала и риски, связанные с долгосрочной имплантацией, включая рубцевание тканей или инфекцию50,51. Эти проблемы, как правило, менее серьезны по сравнению с проникающими электродами и, предположительно, еще больше уменьшаются при эпидуральной имплантации μECoG у мышей (за счет более низкого качества сигнала)52. Можно повторно использовать одну и ту же сетку μECoG в течение нескольких сеансов на одних и тех же или разных животных, удаляя сетку в конце сеанса и заменяя ее в следующем сеансе. В этой подострой конфигурации мозг должен постоянно оставаться влажным и защищен стеклянным покровным стеклом между сеансами. Мы заметили, что сетки μECoG довольно долговечны; Индивидуальная сетка может быть повторно использована ~20 раз при правильном обращении и очистке, что делает их экономичными записывающими устройствами. Сетки могут быть спроектированы с различным количеством и геометрией расположения электродов. Полученные результаты свидетельствуют о том, что уменьшение шага электродов до <200 мкм приводит лишь к незначительному улучшению функционального разрешения из-за гранулярности нейронных представлений в основной коре головного мозга.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана Национальной лабораторией Лоуренса в Беркли LDRD для Лаборатории нейронных систем и машинного обучения (K.E.B.), NINDSR01 NS118648A (K.E.B.& D.E.F.) и NINDS R01 NS092367 (D.E.F.).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 disposable #11 blade | Swann Morton | 303 | For surgical procedures |
| 2 disposable #10 blades | Swann Morton | 3901 | For surgical procedures |
| 30 mm cage bars | Thorlabs | ER | cage components |
| 30 mm cage plate | Thorlabs | CP33T | holding the lenses |
| 70% ethanol | Decon Labs | V1016 | Cleaning / Disinfectant (diluted to 70%) |
| Amalgambond PLUS Adjustable Precision Applicator Brush Teal 200/Bx | Henry Schein | 1869563 | precision applicator for the cement |
| Amalgambond PLUS Catalyst 0.7 mL Syringe Ea | Henry Schein | 1861119 | cement component |
| Amplifier (Tucker-Davis Technologies) | Tucker-Davis Technologies | PZ5M-512 | Used for auditory stimulus and recording software. |
| Articulated arm | Noga | DG60103 | for holding the fine adjustment screw system |
| Aspheric lenses for light collection (and one for focusing the light) | Thorlabs | ACL25416U-B | for collecting LED light |
| Auditory equipment | Tucker-Davis Technologies, Sony, Cortera | RP2.1 Enhanced Real-Time Processor/HB7 Headphone Drive | Used for auditory stimulus and recording software. |
| Buprenorphine | Sterile Products LLC | #42023017905 | General analgesia |
| C&B Metabond Base Cement Ea | Henry Schein | 1864477 | cement component |
| C&B Metabond L-Powder Cement Clear 3 g | Henry Schein | 1861068 | cement component |
| Chlorprothixene hydrochloride (mouse) | Sigma Aldrich | Cat. No. C1671 | For sedation, must be prepared the same day and kept at 4 |
| Custom-designed 128-channel micro-electrocorticography (μECoG) grids | Neuronexus | E128-200-8-40-HZ64 | For neurophysiology recordings. Placed onto the cortex. |
| Dengofoam gelatin sponges | Dengen dental | 600034 (SKU) | can be used dry or wet, saturated with sterile sodium chloride solution |
| Drill bit, size 5 to 9 (Mouse) | Fine Science Tools | 19007-XX | XX is the size of the drill bit e.g. 05 or 09. For mouse procedures |
| Drill bitSteel Round Bur (5.5 mm/7.5 mm) | LZQ Tools | Dental Bar Drill Bit Stainless Steel Bur | For rat procedures |
| Dumont No. 5 forceps | Fine Science Tools | 11251-10 | For surgical procedures |
| Dumont tweezers #5 bent 45° | World precision instruments | 14101 | for removing craniotomy window |
| DVD Player (Sony) | Sony | CDP-C345 | System used to accept and play back stimulus sets |
| Electrostatic Speaker | Sony | XS-162ES | Used for auditory stimulus and recording software. Located within the rig, plays sound to the sedated rodent |
| Enzymatic detergent (Enzol) | Advanced sterilization products | 2252 | Cleaning/Disinfectant |
| EverEdge 2.0 Scaler Sickle Double End H6/H7 #9 | Henry Schein | 6011862 | for scrubing the skull |
| Fine adjustment screw system in 3 dimension | Narishige | U-3C | for precise positioning of the optical fiber end |
| Gold pin | Harwin Inc | G125-1020005 | Used for contact reference in mouse Soldered to the silver wire |
| Gripping forceps | Fine Science Tools | 00632-11 | For surgical procedures |
| Isoflurane | Covetrus | 11695067772 | require a vaporizer |
| Ketamine (Hydrochloride Injection) (Rat) | Dechra | 17033-101-10 | Anesthesia/Analgesic |
| LED | New Energy | LED XLAMP XPE2 BLUE STARBOARD | Blue LED light source |
| LED driver | Thorlabs | LEDD1B | LED driver |
| Lidocaine | Covetrus | VINB-0024-6800 | to be diluted to 1% in saline |
| Meloxicam | Covetrus | 6451603845 | Anti-inflammatory used for general analgesia |
| Micromanipulator | Narishige (Stereotaxic Rig) | SR-6R + SR-10R-HT components | Used to manipulate ECoG and rodent with fine movements |
| No. 2 forceps | Fine Science Tools | 91117-10 | For surgical procedures |
| No. 55 forceps | Fine Science Tools | 1129551 | For surgical procedures |
| Ophtalmic lubricant (Artificial tears) | Akorn | 17478-062-35 | Used to protect eyes from dessication during surgical procedures |
| Optical fiber 200µm Core diameter | Thorlabs | M133L02 | FC/PC connector 2 m long |
| Pentobarbital (Rat) | Covetrus / Dechra | VINV-C0II-0008 | Anesthesia/Analgesic |
| Platinum Black | Sigma | 205915-250MG | For neurophysiology recordings (Used for electroplating the contacts on the μECoG grids). |
| Povidone Iodine 10% | Betadine | https://betadine.com/medical-professionals/betadine-solution/ | no catalog number ( not retail ) |
| Powder detergent (Contrex AP) | Decon Labs | 5204 | Cleaning / Disinfectant |
| Pre-cut tape for oxygen tube | ULINE (Various Providers) | S-14726 | Used to attach oxygen tube to the nose-cone of the rodent stereotaxic rig |
| Scalpel handle # 3 | World precision instruments | 500236-G | for blades # 10, #11 and #15 |
| Scraper | Fine Science Tools | 1007516 | For surgical procedures |
| Short 30 G needles | ExelInt | 26437 | For surgical procedures and injections |
| Silver Wire | Warner Instruments | 63-1319 | For neurophysiology recordings (Used for grounding and as a reference electrode). |
| Sterilized saline (0.9% sodium chloride for injection) | Hospira | 00409-7101-67 (NDC) | For dilution of injectable, and replacement of body fluids |
| Stoelting Hopkins Bulldog | Fine Science Tools | 10-000-481 | For surgical procedures |
| Surface disinfectant (Coverage Plus NDP Disinfectant) | Steris life science | 638708 | Cleaning/Disinfectant |
| TDT ZIF-clip connectors for acquisition. | Tucker-Davis Technologies | ZIF-Clip Analog Headstages | Connects ECoG with outside acquisition equipement |
| Two-pronged holding fork | Tucker-Davis Technologies | Z-ROD128 | Used to connect the TDT-clips with the micromanipulator |
| Xylazine (Rat) | Covetrus | 1XYL006 | Anesthesia/Analgesic |
Ссылки
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nunez, P. L., Srinivasan, R. . Electric Fields of the Brain: The Neurophysics of EEG. , (2006).
- Mountcastle, V. B., Powell, T. P. Central nervous mechanisms subserving position sense and kinesthesis. Bull Johns Hopkins Hosp. 105, 173-200 (1959).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci. 18 (2), 310-315 (2015).
- Lewis, C. M., Bosman, C. A., Womelsdorf, T., Fries, P. Stimulus-induced visual cortical networks are recapitulated by spontaneous local and interareal synchronization. Proc Natl Acad Sci U S A. 113 (5), E606-E615 (2016).
- Bouchard, K. E., Mesgarani, N., Johnson, K., Chang, E. F. Functional organization of human sensorimotor cortex for speech articulation. Nature. 495 (7441), 327-332 (2013).
- Ledochowitsch, P., et al. Fabrication and testing of a large area, high density, parylene MEMS µECoG array. , (2011).
- Bosman, C. A., et al. Attentional stimulus selection through selective synchronization between monkey visual areas. Neuron. 75 (5), 875-888 (2012).
- Rubehn, B., Bosman, C., Oostenveld, R., Fries, P., Stieglitz, T. A MEMS-based flexible multichannel ECoG-electrode array. J Neural Eng. 6 (3), 036003 (2009).
- Baratham, V. L., et al. Columnar localization and laminar origin of cortical surface electrical potentials. J Neurosci. 42 (18), 3733-3748 (2022).
- Kellis, S., et al. Decoding spoken words using local field potentials recorded from the cortical surface. J Neural Eng. 7 (5), 056007 (2010).
- Viventi, J., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci. 14 (12), 1599-1605 (2011).
- Ledochowitsch, P., Olivero, E., Blanche, T., Maharbiz, M. M. A transparent µECoG array for simultaneous recording and optogenetic stimulation. , (2011).
- Ledochowitsch, P., et al. Strategies for optical control and simultaneous electrical readout of extended cortical circuits. J Neurosci Methods. 256, 220-231 (2015).
- Dougherty, M. E., Nguyen, A. P. Q., Baratham, V. L., Bouchard, K. E. Laminar origin of evoked ECoG highgamma activity. Annu Int Conf IEEE Eng Med Biol Soc. 2019, 4391-4394 (2019).
- Tian, H., Xu, K., Zou, L., Fang, Y. Multimodal neural probes for combined optogenetics and electrophysiology. iScience. 25 (1), 103612 (2022).
- Gonzales, D. L., et al. A translaminar spacetime code supports touchevoked traveling waves. bioRxiv. , (2024).
- Leonard, M. K., et al. Largescale singleneuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Renz, A. F., et al. OptoEDura: a soft, stretchable ECoG array for multimodal, multiscale neuroscience. Adv Healthc Mater. 9 (17), 2000814 (2020).
- Buzsáki, G. . Rhythms of the brain. , (2006).
- Yang, W., et al. A fully transparent, flexible PEDOT:PSS-ITO-Ag-ITO based microelectrode array for ECoG recording. Lab Chip. 21 (6), 1096-1108 (2021).
- Buzsáki, G. Largescale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Schalk, G., et al. Realtime detection of eventrelated brain activity. Neuroimage. 43 (2), 245-249 (2008).
- Kellis, S., et al. Multiscale analysis of neural activity in humans: implications for microscale electrocorticography. Clin Neurophysiol. 127 (1), 591-601 (2016).
- Buzsáki, G., Schomburg, E. W. What does gamma coherence tell us about interregional neural communication. Nat Neurosci. 18 (4), 484-489 (2015).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecondtimescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Cardin, J. A., et al. Driving fastspiking cells induces gamma rhythm and controls sensory responses. Nature. 459 (7247), 663-667 (2009).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decisionrelated activity propagate in a cortical feedback loop during touch perception. Nat Neurosci. 19 (9), 1243-1249 (2016).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56 (2), 339-355 (2007).
- Crone, N. E., Sinai, A., Korzeniewska, A. Highfrequency gamma oscillations and human brain mapping with electrocorticography. Prog Brain Res. 159, 275-295 (2006).
- Gerfen, C. R., Paletzki, R., Heintz, N. GENSAT BAC crerecombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron. 80 (6), 1368-1383 (2013).
- Mountcastle, V. The columnar organization of the neocortex. Brain. 120 (4), 701-722 (1997).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Muller, L., Chavane, F., Reynolds, J., Sejnowski, T. J. Cortical travelling waves: mechanisms and computational principles. Nat Rev Neurosci. 19 (5), 255-268 (2018).
- Sato, T. K., Nauhaus, I., Carandini, M. Traveling waves in visual cortex. Neuron. 75 (2), 218-229 (2012).
- Gilbert, C. D., Wiesel, T. N. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortex. J Neurosci. 9 (7), 2432-2442 (1989).
- Angelucci, A., et al. Circuits and mechanisms for surround modulation in visual cortex. Annu Rev Neurosci. 40 (1), 425-451 (2017).
- Singer, W., Gray, C. M. Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci. 18, 555-586 (1995).
- Quiroga, R. Q., et al. Invariant visual representation by single neurons in the human brain. Nature. 435 (7045), 1102-1107 (2005).
- Fusi, S., Miller, E. K., Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr Opin Neurobiol. 37, 66-74 (2016).
- Stringer, C., et al. Spontaneous behaviors drive multidimensional, brainwide activity. Science. 364 (6437), eaav7893 (2019).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using celltypespecific expression of channelrhodopsin2. Nat Protoc. 5 (2), 247-254 (2010).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nat Neurosci. 21 (6), 881-893 (2018).
- Mahn, M., et al. Highefficiency optogenetic silencing with somatargeted anionconducting channelrhodopsins. Nat Commun. 9 (1), 4125 (2018).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating lowimpedance tetrodes by electroplating with additives. Sens Actuators A Phys. 156 (2), 388-393 (2009).
- Halnes, G., et al. . Electric Brain Signals: Foundations and Applications of Biophysical Modeling. , (2024).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nat Rev Neurosci. 9 (5), 370-386 (2008).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and anesthesia. Science. 322 (5903), 876-880 (2008).
- Schalk, G., Leuthardt, E. C. Braincomputer interfaces using electrocorticographic signals. IEEE Rev Biomed Eng. 4, 140-154 (2011).
- Chestek, C. A., et al. Longterm stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex. J Neural Eng. 8 (4), 045005 (2011).
- Branco, M. P., et al. Nine decades of electrocorticography: a comparison between epidural and subdural recordings. Eur J Neurosci. 57 (8), 1260-1288 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены