Method Article
通过将层状多晶片和光遗传学与啮齿动物的微皮层电图相结合,对啮齿动物皮层加工进行多尺度研究
摘要
在这里,我们提出了两种用于大鼠和小鼠高密度微皮层电图 (μEcoG) 记录的方案,包括手术、植入和记录方法。μECoG 记录与大鼠听觉皮层中的层状 Polytrode 记录或小鼠体感皮层中神经活动的光遗传学作相结合进行。
摘要
皮层电图 (ECoG) 是基础神经科学与了解人类大脑在健康和疾病中的功能之间的方法桥梁。ECoG 以毫秒级时间分辨率和柱状空间分辨率同时记录皮层组织大面积的神经生理学信号,使其在研究局部和分布式皮层计算方面具有独特的优势。在这里,我们描述了定制的高密度 micro-ECoG (μECoG) 器件的设计及其在两个程序中的使用。这些网格具有 128 个低阻抗电极,间距为 200 μm,在透明聚合物基板上制造,电极之间有穿孔;这些功能可实现 μECoG 记录与层流多晶硅记录和光遗传学作的同时进行。首先,我们提出了一种方案,用于通过对特定遗传定义的皮质细胞类型的光遗传学作在小鼠的胡须体感皮层上进行联合硬膜外 μECoG 记录。这允许对不同神经元群对感觉处理的不同贡献进行因果解剖,同时还可以监测它们在 μECoG 信号中的特定特征。其次,我们提出了一种急性实验方案,以使用 μECoG 网格和层状多聚体记录大鼠听觉皮层的神经活动。这允许在整个皮层表面对感觉诱发的神经反应进行详细的地形映射,同时来自分布在皮层深度的多个神经单元的记录。这些协议使表征分布皮层活动的实验成为可能,并可能有助于理解和最终干预各种神经系统疾病。
引言
感觉、认知和动作背后的大脑功能在广阔的空间和时间尺度上组织和分布,范围从单个神经元的尖峰到皮层柱中神经元群产生的电场,再到跨大脑区域的柱的地形组织(例如,体感皮层中的体位,初级听觉皮层中的音调)。了解大脑功能需要感知这些空间尺度上的电信号1。神经科学目前有许多广泛使用的方法来监测大脑的活动。在电生理学上,层状多晶细胞(例如 Neuropixels)能够监测适量 (~300) 的单个神经元,通常在少数间隔较远的列内,具有高 (≥1 kHz) 时间分辨率。Ca2+ 成像能够以较低 (~10 Hz) 的时间分辨率监测 ~1-2 mm 空间范围内中度到大量遗传和解剖学鉴定的单个神经元2。fMRI 能够以非常低 (~0.2 Hz) 的时间分辨率监测整个大脑中大量神经元(~1 个 M 神经元,体积为 36 mm)的代谢状态。EEG/MEG 能够以中等时间分辨率 (<100 Hz) 和极低空间分辨率(厘米)3 监测整个皮层表面/大脑的电活动。虽然这些方法中的每一种都为大脑功能提供了基本的协同见解,但能够从皮层广泛空间区域的精确解剖位置以高时间分辨率直接感应电生理信号的方法仍处于起步阶段。在大脑中,与深度相比,神经元功能在表面上的变化要显着得多,这一事实强调了对广泛空间覆盖的需求4.
皮层电图 (ECoG) 是一种将低阻抗电极网格植入大脑表面并允许记录或刺激皮层的方法 1,5。ECoG 通常部署在人类神经外科环境中,作为治疗药物学难治性癫痫的临床检查的一部分。然而,它也为人类的分布式皮层处理提供了独特的见解,例如语音和感觉地形映射 6,7。这些功能促使其在动物模型中使用,包括猴子、大鼠和小鼠 5,8,9,10,11。在啮齿动物中,最近表明 micro-ECoG (μECoG) 能够以柱状空间分辨率 (~200 μm) 和宽空间覆盖范围(许多毫米)对神经元群进行高时间分辨率 (~100 Hz) 直接电监测。μECoG 使研究人员能够研究动物模型中与复杂感觉处理、认知功能和运动行为相关的分布式神经动力学12,13。最近的进展将 μECoG 与光遗传学和层流多晶硅记录 14,15,16,17,18,19,20 相结合,允许对皮层网络进行多尺度研究,并弥合微观尺度神经元活动和宏观尺度皮层动力学之间的差距 21,22.至关重要的是,由于 μECoG 信号在人类和非人类动物模型中非常相似,因此使用 μECoG 可以更直接地将结果和发现从动物模型转化为人类23。因此,综合方法对于促进我们对神经回路的理解至关重要,并有望为开发针对神经系统疾病的新型治疗干预措施 5,24,25。
因此,出现了将高密度 μECoG 阵列与层流记录和光遗传学工具集成的协议,以实现对皮层处理的全面多尺度研究 8,26。为了解决这一差距,我们开发了定制设计的 μECoG 器件,该器件具有 128 个低阻抗电极,电极直径为 40 μm,电极间距为 20 μm,位于柔性透明聚合物基材(聚对二甲苯-C 和聚酰亚胺)上,电极之间有穿孔,可通过光遗传学作同时进行 μECoG 和层流多晶硅记录13,22.该实验方案的关键方面包括:(i) 柱状空间分辨率和通过高密度 μECoG 阵列对皮层活动的大规模覆盖;(ii) 使用通过 μECoG 网格插入的层状多晶硅从多个皮层进行记录的能力;(iii) 结合光遗传学技术来选择性地激活或抑制特定的神经元群,从而能够对神经回路进行因果解剖 27,28,29。高密度配置允许高空间分辨率记录,有效地提供皮层活动的“柱状视图”,因为以前的研究表明,μECoG 信号可以在与啮齿动物皮层柱的直径 (~20 μm) 相当的空间尺度上解析活动 (~20 μm)11。这种集成方法允许同时对神经活动进行多尺度监测和作,从而有可能使因果实验能够确定 μECoG 信号的神经元来源以及分布式皮层处理。为了实现这些目标,本手稿提供了以两种组合使用高密度 μECoG 阵列的详细方案。
首先,我们描述了 μECoG 与小鼠初级体感皮层 (S1) 中第 5 层 (L5) 锥体细胞的作相结合。在小鼠中,将 μECoG 阵列硬膜外放置(由于小鼠硬膜切开术的手术难治性)。光纤位于网格上或与透镜结合,以将光遗传学光聚焦在皮质表面的小目标区域上。此处描述了用于抑制第 5 层兴奋性神经元的光遗传学策略,但可以很容易地适应具有相应的、群体特异性、表达 Cre 的小鼠系的任何神经元群。其次,我们描述了 μECoG 与硅层状聚合物的联合使用,以同时记录大鼠听觉皮层 (A1) 跨皮层的多个神经元的皮质表面电位 (CSEP) 和单单位尖峰活动。该阵列在电极之间有穿孔,能够通过网格插入多通道层状聚合物,以记录不同皮层的神经元活动。在开颅手术过程中,将 μECoG 阵列硬膜下放置在听觉皮层上,并通过穿孔插入层状多晶片。使用光学连接到数字信号处理器的放大器系统同时记录来自 μECoG 和层状探头的神经信号,分别以 6 kHz 和 24 kHz 采样。
研究方案
两种方案遵循相同的关键步骤(麻醉、固定、开颅手术、μECoG 记录),但存在显着差异。在以下描述中,合并了共享步骤,同时注释了每个协议的特性。以下步骤对应于使用光遗传学 (Mouse) 的 μECoG 记录或使用层状探针 (Rat) 的 μECoG 记录。此处描述的所有程序均按照当地道德或法律机构(IACUC 或道德委员会)进行。使用的药物可能因批准的道德协议而异。
1. 小鼠和大鼠程序的准备和方案
- 小鼠和大鼠方案之间的显著差异
- 手术设置与电生理记录
- 对于大鼠,在手术和电生理记录期间使用相同的设置。
- 对于鼠标,在第一个设置中执行手术,在第二个设置中执行电生理记录。
- 头部固定
- 对于大鼠,使用相同的鼻子夹进行手术和电生理记录。
- 对于小鼠,使用鼻子夹进行手术,在电生理学设置中使用外部金属头杆,以便在轻度异氟醚麻醉下进行固定。在头骨上植入牙科水泥。
- 记录设置:对两个物种使用不同的采集电子设备、记录软件和感觉刺激软件。
- 对于鼠标协议,使用 SpikeGadgets 系统 (https://spikegadgets.com) 和开源 Trodes 软件 (https://spikegadgets.com/trodes/) 进行数据采集。
- 对于大鼠方案,利用记录软件 Synapse - Neurophysiology Suite (https://www.tdt.com/component/synapse-software/) 进行数据采集。
- 通过注射 (大鼠) 或吸入 (小鼠) 诱导麻醉。
- 录制位置
- 在小鼠的体感皮层 (S1) 中进行记录。
- 在大鼠的初级听觉皮层 (A1) 中进行记录。
注意:解剖定位的这种差异需要每个物种不同的开颅手术部位。
- 手术设置与电生理记录
- 准备和测试网格
- 将网格(不包括连接器板)浸泡在稀释的酶清洁剂(50% 清洁剂,50% 蒸馏水)中至少 1 小时。
- 将其转移到纯蒸馏水浴中,并在安全、干净的地方风干。
- 作为 μECoG 设备初始准备的一部分进行铂黑电沉积,而不是在每次记录之前。
注意:一旦沉积,Platinum Black 涂层就会形成一个稳定的层,对多次录音仍然有效,但应通过定期阻抗测试来监测其性能。铂黑电沉积(1 kHz 时目标范围为 10-20 kΩ)可降低电极阻抗并提高神经记录中的信噪比。 - 为了进行电沉积,制备含有少量乙酸铅(约 0.005%)的氯铂酸溶液(通常为 1-3% 氯铂酸 [H2PtCl6])作为沉积改性剂。将 μECoG 电极连接起来,用作三电极电化学池中的工作电极,带有铂对电极和 Ag/AgCl 参比电极。
- 施加大约 -0.5--2 mA/cm² 的恒定电流密度 10-30 秒,同时监测阻抗值。
- 测试并记录栅极的阻抗(例如,使用 Nano-Z)。
- 检查光源上的网格,并准备用于术后记录的网格。
- 参考电缆焊接
- 对于鼠标,将银线(10 mm 长,30 G)的末端焊接到金引脚上,以连接到记录系统的参考引线。
2. 手术
- 准备材料和一般监控(动物护理和记录)
- 准备工作:使用适当的消毒剂彻底清洁和消毒手术区域。确保所有手术器械都经过消毒,通常使用高压灭菌器。
- 手术工具放置:将手术工具放在无菌手术垫上。在手术区域放置棉签涂抹器和吸水棉质手术三角形。将任何生物危害性废物丢弃在专用的处置袋中。
- 温度调节:打开手术和电生理记录部位内的加热垫。在整个手术和记录过程中控制加热垫的温度。
- 手术垫:将蓝色手术垫或毯子放在温度调节床上。
注意: 此垫子应具有柔软的棉白色底部,应朝上。 - 显微镜定位:将显微镜和连接的照明器(例如 LED 环)准备到手术区域的一侧。检查它是否正常运行。
- 手术演练:为开颅手术准备手术演练。
- 供氧:将氧气罐流速设置为 1.0 L/min (大鼠) 或 0.5 L/min (小鼠),并将氧气面罩放在调节垫附近。动物在麻醉后需要持续的氧气。
- 液体补充:在整个手术过程中,补充任何液体流失 - 旨在替代至少 1.5% 动物体重 (小鼠) 或每小时 1 mL (大鼠) 的液体流失。相应地准备等渗溶液。
- 动物:根据批准的程序将动物从动物设施带到手术室。使用 C57Bl6 背景的 8 至 16 周龄的小鼠,雄性或雌性;同样,使用 Sprague Dawley 菌株的 7 周龄雄性大鼠。
- 药物制备:使用精度为 0.1 g 的秤称量动物。为手术准备足够的药物量,必要时使用预先稀释的溶液。
- 麻醉诱导
- 小鼠的麻醉诱导
- 将动物置于异氟醚诱导室中(3-5% 异氟醚,0.5 L/min O2)。
- 一旦确认深度麻醉(尾巴/脚趾捏无反射),将动物放在手术加热垫上并固定头部。
- 用于一般镇痛的皮下注射药物:美洛昔康:5 mg/kg 和丁丙诺啡:0.1 mg/kg。
- 按照步骤 2.2.1.5-2.2.1.6 固定鼠标。
- 将鼻子放入麻醉面罩中,将头部松散地放入头架中。要将鼠标放入咬合杆中,首先,确保舌头在杆下方,而不是在杆和口腔顶部之间。如有必要,使用镊子移动舌头。
- 将动物的门牙插入咬杆杆上的孔中。轻轻拧紧固定螺钉,固定小鼠麻醉面罩(1.5-2% 异氟醚,溶于 0.5 L/min O2)。手术期间的头部稳定性仅由咬合杆确保。
- 用石油基眼膏或润滑剂保护动物的眼睛,以防止手术过程中干燥。
- 在整个手术过程中保持麻醉,异氟醚连续流过面罩。
- 大鼠的麻醉诱导
- 最初使用异氟醚镇静动物以简化诱导麻醉的注射。
- 服用麻醉和镇痛药物:
美洛昔康: 剂量 5 mg/kg,浓度 10 mg/mL,0.4 mL/kg
氯胺酮:剂量 90 mg/kg,浓度 100 mg/mL,0.9 mL/kg
甲苯噻嗪:剂量 10 mg/kg,浓度 100 mg/mL,0.1 mL/kg - 让动物在 15-30 分钟内达到深度麻醉,具体取决于体重和年龄。
- 麻醉监测
- 在整个过程中持续监测动物的生命体征(呼吸频率)。检查呼吸频率是麻醉状态早期变化的一个特别有用的标志,如果呼吸频率发生变化,请调整麻醉剂量。
- 爪子撤退反射是麻醉状态的关键标志。定期测试这种反射,因为它完全不存在可确保手术的麻醉水平足够。
- 小鼠的麻醉诱导
- 头部固定和生命体征监测
- 动物生命体征监测
- 检查并在实验表上记录动物的生命体征。如果动物的反射(例如,爪子退出)没有完全熄灭,则额外施用半剂量的补充氯胺酮 (大鼠) 或以 0.5% 的增量增加异氟醚浓度 (小鼠)。
- 大鼠头部固定
- 一旦大鼠完全麻醉(没有爪子或尾巴反射),将动物的门牙插入头架杆上的孔中。
- 在手术过程中,小心地将安装臂的尖端插入鼻脊以固定头部,确保它不会与眼睛接触。
- 调整手臂的角度,直到动物的嘴巴顶部牢牢地压在杆上。确保颅骨在压力下保持不动。
- 用六角扳手拧紧螺钉,固定支架的两个臂。
- 大鼠的氧气设置
- 将氧气罐中的塑料管固定在动物的口鼻和鼻子上,并用手术胶带固定。避免管道上的折痕,以免阻碍气流。将氧气罐设置为 1 L/min 的流速。
注意:在整个手术过程中,应每隔 15-30 分钟检查一次动物生命体征,包括心率和呼吸频率。
- 将氧气罐中的塑料管固定在动物的口鼻和鼻子上,并用手术胶带固定。避免管道上的折痕,以免阻碍气流。将氧气罐设置为 1 L/min 的流速。
- 动物生命体征监测
- 头皮切口
- 剃须和准备
- 剃掉从上鼻子到后脑勺的区域,从一只眼睛延伸到另一只眼睛,再到耳朵周围。用剪刀或电动剪刀去除大部分皮毛,然后涂抹脱毛霜。
- 消毒
- 使用蘸有 Betadine 的棉签对该区域进行消毒,然后用蘸有 70% 乙醇的棉签冲洗。重复此过程 3 次,最后使用 Betadine 以确保该区域无菌。
- 局部麻醉剂注射
- 将局部麻醉剂利多卡因(1%,小鼠 0.1 mL/大鼠 0.4 mL/kg)皮下注射到动物头皮的中线。轻轻按摩头皮,使利多卡因散布,等待 5 分钟,让麻醉剂生效。
- 切口
- 对于小鼠,用镊子在皮肤上提起一个点,然后用手术剪刀切开一小段皮肤(直径约 1 厘米)。
- 对于大鼠,使用手术刀在头皮前侧、鼻子正上方、中线处做一个精确的切口。轻轻拉回皮肤,从眼睛之间到颅底形成一个笔直的切口。小心提起头皮,切掉结缔组织,并完全露出头骨。
- 按照步骤 2.4.4.4-2.4.4.5 暴露开颅手术部位。
- 用刮刀清除颅骨顶部的结缔组织和骨膜。冲洗生理盐水并使用抽吸或手术海绵清洁该部位。
- 在皮肤边缘使用手术夹,以便于清楚地暴露将进行开颅手术的颅骨区域。
- 剃须和准备
- 颅骨切开术
- 一般钻孔程序
- 对于经验丰富的外科医生,将手术钻孔速度设置为 5000 rpm 或 7000 rpm 的低设置。在通过显微镜观察的同时进行所有钻孔。
- 将钻头平行于颅骨表面,轻轻靠在表面。
- 轻压踏板,开始在单个位置钻孔。以短间隔 (5-10 s) 进行钻孔,并经常检查骨骼颜色的变化。
注意:骨骼将开始呈现不透明的白色,随着孔的变深,它会变得更加半透明,露出粉红色调。 - 当钻孔接近大脑时,放慢速度并寻找水分渗入孔中的迹象。当孔呈深粉色并有轻微光泽时,停止钻孔。用一根 30 G 的短针轻轻刺穿剩余的骨层。透明液体应该从新孔中流出。
- 鼠标的钻孔程序
- 要放置用于生理记录的参考电极,请在记录区域同侧的半球前部钻一个毛刺孔。
- 通过在开颅手术的周边钻一条浅沟来定义开颅手术的轮廓。在内侧轴上,以外侧骨脊为参考,追踪一个 4 mm 的窗口。
- 在前后轴上,钻一个 3 毫米的窗口,从后骨脊前方 ~ 1 毫米开始。最终的开颅手术尺寸约为 4 x 3 毫米的窗口。
- 大鼠的钻孔程序
- 钻两个孔:一个在左后象限,另一个在右前象限。
- 用第二剂利多卡因注射咬肌(0.4 mL/kg,10 mg/mL),并均匀分布在要进行切割的位置。
- 仅切除暴露开颅手术区域所需的最小肌肉。
- 使用新的 #10 手术刀刀片,在动物下巴上方(右侧)的肌肉束中创建一个横向背腹切口。用夹持镊子握住切口的后边缘,沿着颧骨的骨脊切割,从颅骨上剥离。通过这种方式,肌肉可以从骨骼上分离,出血量最小。
- 以类似的方式切除前肌,直到露出颅骨中的裂缝线。这条线将是开颅窗的前边界。
- 用手术刀和镊子清除后嵴周围的肌肉,使用强光源避免切入高度血管化的区域。
- 用钻头磨碎后脊,直到它不再高于颅骨表面。
注意:此步骤对于设置 μECoG 网格以直接与皮质表面接触至关重要。 - 在连接切除肌肉的脊上方的窗户背侧边缘钻孔。将后边缘放在钻下来的后嵴前面。将前缘放在裂隙线的后面,向下延伸到眼窝附近。
注意:清理前肌时,必须注意避开眼睛。
- 一般钻孔程序
- 开颅手术窗钻孔
- 钻开颅窗 (Tips)
- 钻孔时,确保钻头与颅骨表面保持平行。尽可能少地用力,像刷子一样使用钻头,让钻头与颅骨轻轻接触,同时沿着预期的开颅手术线进行短而重复的动作。
注意:在大鼠中,窗户的后缘有最厚的骨头。如果钻得太靠后,骨头可能会表现出片状、“松脆”的品质,使测量钻孔进度变得复杂。如果放置不正确,该骨骼区域可能会显示出静脉红色,从而给人一种接近大脑的错觉。 - 在开颅手术窗口的每一侧钻孔,直到骨骼呈淡粉色,并沿其长度延伸有细的白色裂缝或裂缝。轻轻按压;完全钻孔后,骨骼应产生明显的“摆动”。如果裂纹看起来不相交,请继续轻轻钻孔,直到获得连续的线条。
- 钻孔时,确保钻头与颅骨表面保持平行。尽可能少地用力,像刷子一样使用钻头,让钻头与颅骨轻轻接触,同时沿着预期的开颅手术线进行短而重复的动作。
- 在开颅手术窗口内去除变薄的颅骨
- 当颅骨变薄到足以使极轻的压力导致整个窗户明显摆动时,取出变薄的颅骨。
- 用一滴生理盐水冲洗开颅部位并等待至少 1 分钟。这会削弱变薄的骨骼并帮助骨骼从硬脑膜上分离。用吸水棉三角或真空吸干多余的盐水。
- 使用镊子小心地提起变薄的颅骨,避免损伤下面的组织。
- 使用止血海绵保持大脑湿润。
- 用齿镊紧抓住窗口的背侧和腹侧,并直接从颅骨上拉开。如果难以将窗户拉出该部位,请停止并继续进行轻度钻孔,直到骨骼充分变弱。
- 对于小鼠 μECoG 记录,请保持硬脑膜完好无损。
- 钻开颅窗 (Tips)
- 小鼠的粘接剂和头柱植入物
- 插入并固定参考线。
- 将银丝端 ~1 mm 插入毛刺孔,足以接触大脑表面但不引起出血。
- 在涂抹第一层时将牙科粘结剂涂抹到位。
- 牙科粘接剂的制备
- 使用冷却的陶瓷搅拌皿制备牙科水泥混合物。这种水泥会迅速变稠,需要定期制备新的混合物。在准备新的混合物之前,将搅拌盘擦干净。
注意:水泥不应与大脑直接接触。
- 使用冷却的陶瓷搅拌皿制备牙科水泥混合物。这种水泥会迅速变稠,需要定期制备新的混合物。在准备新的混合物之前,将搅拌盘擦干净。
- 第一层的应用
- 使用微型涂抹器在开颅手术周围和整个颅骨上涂抹第一层粘接剂。该层在颅骨和金属头杆之间起到电绝缘的作用。
- 用水泥完全包围开颅手术,包括横向覆盖,为开放开颅手术和 μECoG 网格提供足够的保护。
- 定位金属头杆
- 将头杆的大部分连接到其支架上,而无需完全拧紧。
- 根据需要放置头杆,沿颅骨中线铺设薄部分,与水泥表面接触。
- 固定植入物
- 用牙科水泥覆盖头杆并将其连接到水泥表面。
- 卸下支架
- 等待几分钟让牙科粘结剂加强。
- 头架完全固定后,先从支架上卸下螺丝,将其卸下。然后,向后缩回支架,确保没有对头杆施加力。
- 插入并固定参考线。
- 大鼠手术的 Durotomy
注意:这是一个具有挑战性的手术步骤。- 提升硬脑膜
- 使用 5 号镊子,尽可能与大脑表面平行,将一小部分硬脑膜从大脑中抬起。
- 使用新鲜的 30 G 针头(尽可能短)小心地撕裂提起的硬脑膜。
注意:硬脑膜是直接位于大脑顶部的一层薄而透明的组织。对于大鼠的 μECoG 记录,它被去除。在不干扰大脑表面脉管系统的情况下进行硬膜切开术至关重要。进行硬膜切开术的推荐方法包括使用镊子和注射器针头刺穿硬脑膜,然后将其拉回,或使用固定在颅骨附近的硬膜刀工具小心地缩回硬脑膜。
- 硬脑膜切除术
- 继续用镊子夹住硬脑膜并将其从大脑中提起。抬起时用针头产生对角线撕裂。
- 使用镊子小心地将硬脑膜朝开颅手术窗的两侧剥离,确保大脑表面不受干扰。
- 提升硬脑膜
- 将鼠标转移到设置以进行电生理记录
- 轻轻地将鼻子和门牙从门牙杆上提起,然后将动物拉回,将动物从手术装置中取出。注射氯丙噻嗪(1 mg/kg,腹膜内 [IP]),这是一种镇静剂,可以使用较低的异氟醚浓度维持持续麻醉。
- 将鼠标置于电生理记录设置中。
- 确保加热垫就位并正常工作。
- 在电生理设置中使用支架上的头杆固定动物。
- 将异氟醚面罩靠近以完全覆盖动物的鼻子。
- 麻醉调整
- 逐渐将麻醉水平降低至 0.7-1% 异氟醚(每 5 分钟以最大 0.5% 的增量)。
- 监测动物的呼吸频率和运动。
注意:与手术状态相比,呼吸频率应略有增加,但动物不应移动。 - 如果动物正在移动,立即将异氟醚浓度增加到 2%,然后以 0.5% 的增量缓慢将其恢复到较低的水平。
- 插入胡须以进行感官刺激
- 将鼠标的震颤连接到晶须刺激装置上。在该方案中,将 9 个弧菌插入 10 μL 短移液器吸头中,这些吸头连接到压电致动器,可提供弧菌的快速偏转。
3. 录制
- 安装网格
- 初步步骤
- 打开录制系统和放大器。
- 检查动物的生命体征。
- 程序
- 要定位动物和工具,请按照步骤 3.1.2.2-3.1.2.4 进行作。
- 将动物置于记录装置中,并通过定期涂抹生理盐水溶液确保开颅手术保持湿润。
- 对于大鼠,将显微作器放在钻机的栏杆上,该栏杆位于开颅手术部位的后面,以避免干扰。
- 对于小鼠,将显微作器与动物一起横向放置在开颅部位。
- 要在鼠标上附加和定位网格,请按照步骤 3.1.2.6-3.1.2.12作。
- 使用 ZIF 夹连接器(头部连接器)将 μECoG 网格连接到头部。通过固定在显微纵器上的机械杆将 Headstage 的电子板固定到位。
- 水平降低 μECoG 网格,以沿前后轴平放在开颅手术上。
注意:沿外侧-内侧轴,网格的边缘应靠近开颅手术的内侧边界。 - 一旦网格位于大脑附近但不与大脑接触,将网格的参考线连接到植入的银线金针上。如果需要,将地线连接到动物身上(例如,连接到未覆盖的肌肉上)以减少电噪声。
- 此外,降低网格以联系大脑。
- 横向移动网格以在潮湿的硬脑膜表面“滑动”。继续调整,直到网格沿内侧轴居中。
- 在开颅手术边缘周围使用抽吸或手术海绵去除多余的盐水溶液。
- 一旦准备工作稍微干燥,确保网格更牢固地粘附在硬脑膜上,并且不会在其表面滑动。当干燥时,对柔性网格进行横向到内侧的运动,确保与最外侧的电极接触。网格的柔性电缆会自然弯曲以匹配大脑的轮廓。
- 要将网格放置在大鼠上,请按照步骤 3.1.2.14-3.1.2.18 进行作。
- 将固定叉的杆固定在显微作器中,确保网格的连接器板在降低时悬停在开颅手术窗的后侧。
- 调整显微作器在栏杆上的位置,使网格大致位于开颅手术部位上方。降低网格,直到它悬停在大脑表面上方。用一小滴生理盐水润湿大脑表面。
- 使用显微镜执行这些步骤。使用显微作器的刻度盘,调整网格位置,直到它平放在开颅手术中心的大脑表面。
- 使用吸水棉三角形小心吸走水分,不要接触网格本身。确保网格的每一行都与大脑表面接触。
注意:去除水分可以防止电信号通过皮质表面和网格之间的液体被动传播,从而在空间上扩散在电极上感应到的信号。 - 使用 2 号或 5 号镊子,将网格接地线插入同一个毛刺孔中,或将参考线插入毛刺孔中,将地线插入附近的肌肉组织。
注意:电线应仅插入 ~1 毫米,足以接触大脑但不会导致大脑出血或创伤。
- 初步步骤
- 检查网格的位置
- 监测电生理活性
- 使用记录软件观察电生理活动。在轻度麻醉下,大脑信号是可变的,可以表现出多种模式。
- 正确连接栅线、基准线和地线应产生高信噪比,信号幅度在 mV 范围内。使用 Trodes 带通滤波监测高频范围内的噪声(例如 100-6000 Hz),并确保其不超过几十微伏 (μV)。
- 使用噪声(例如,拍手或打响指)来评估感觉反应性,以诱导可见的事件相关皮质表面电位 (CSEP)。
注意:刺激单须应仅在少数通道(小鼠)中引起清晰、尖锐的事件相关 CSEP。 - 网格位置验证
- 对于大鼠,请确认网格正确位于听觉皮层上。记录的第一个块通常应该是 60 秒的白噪声刺激集,以验证网格是否记录了来自大脑的适当响应。仅在插入 polytrode 之前使用网格进行白噪声和音调诊断记录,以帮助确定网格是否放置正确以及是否有信号响应。
- 对于鼠标,要验证网格定位,请执行 20-30 根晶须偏转(间隔 350 毫秒)的快速映射会话。使用 Trodes 记录局部场势 (LFP) 波段中的活动,并使用自定义 MATLAB 代码对其进行离线分析,以可视化晶须诱发活动的空间范围。
- 定位
- 如果网格需要调整,请在网格上滴盐水润湿皮质表面。
- 在尝试提起网格之前,将盐水放置 30 秒到 1 分钟。
- 小心地慢慢抬起网格。
- 使用步骤 3.1 中描述的步骤重新定位它。
- 监测电生理活性
- 大鼠的层流多晶硅
- Polytrode 设置
- 首先,将 Headstage 适配器连接到 Polytrode 的背面。将连接器夹在适配器板上的第三组通道上。确保夹子上的黑色标记朝向 Polytrode 业务端的右侧。
- Polytrode 插入
- 将 Polytrode 插入大脑,直到皮质表面上方可以看到最后一个(最顶部)电极。缓慢下降(低至 1 μm/s)可提高信号质量。等待 15 分钟,让大脑适应 polytrode 的存在。
- 15 分钟后,检查最后一个电极是否进入皮质表面。如果没有,请将 polytrode 稍微降低并再等待 10 分钟,然后再继续。
- Polytrode 设置
- 将光遗传光源定位在鼠标上
- 使用安装在铰接臂上的三维微调螺钉系统,或使用显微作器安装光纤支架。
- 为了引导光源并帮助定位光纤,请以低强度打开光遗传学光。使用铰接臂将光遗传学光粗略地定位到目标区域。
- 使用显微作器或微调螺钉聚焦和微调纤维的位置。
- 记录信号
- 制备
- 拔下手术架中所有不必要的灯、延长线和电涌保护器,以减少电气干扰。关闭装置中的顶灯。
- 在开始实验之前,请关闭隔离记录空间的门和手术室的门。
- 开始客户获取
- 对于大鼠,在记录平台/计算机上启动 Synapse,并通过预览和检查信号来确认采集功能正常。通过在动物附近提供刺激(即拍手),在 μECoG 信号中引发大而尖锐的电压瞬变。
- 对于鼠标,请在 Trodes 中启动 Recording Session。
- 水合
- 在记录过程中,每 1-2 小时皮下注射大鼠或小鼠分别 1 mL 或 0.1 mL 生理盐水,以防止脱水。对于大鼠,在施用生理盐水后等待 5-10 分钟,然后再运行新的记录块。
- 刺激集
- 对于大鼠,一旦确认了记录位点,就继续记录所需的刺激集。示例集可能包括
白噪声 (60 s)
音调诊断 (5 分钟)
Pure Tone (23 分钟)
动态移动纹波
Tone 150 (15 分钟)
TIMIT (38 分钟) - 对于大鼠,请在重新定位网格时重新显示白噪声和色调诊断。
- 小鼠的触觉刺激:在试验结构中提供触觉刺激,每个试验每 350 毫秒包含一列随机晶须偏转。在提供的示例中,每个试验包括 14 次超过 4500 毫秒的偏转。
- 小鼠的光遗传学刺激:在一些试验中,在整个试验持续时间 (5 s) 内施加光遗传学光的方脉冲。根据使用的视蛋白和要达到的组织深度,使用光渗透率 (https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php) 的估计值确定所需的光照水平
- 对于大鼠,一旦确认了记录位点,就继续记录所需的刺激集。示例集可能包括
- 制备
- 清理
- 提升和清洁网格
- 录制完成后,关闭录制软件并重新插入装置中的光源。
- 如果大脑干燥,用注射器将一小滴生理盐水滴在大脑表面。在尝试提起网格之前,将盐水放置 30 秒到 1 分钟。
- 在显微镜下工作,使用显微纵器轻轻地从大脑表面提起网格。
- 如果在提升网格时需要额外的力,请使用碳尖镊子(闭合)轻轻地将网格从大脑中提起。确保显微作器的运动略微向前,以轻轻地将网格从大脑表面剥离。
- 网格完全移除后,将其从抓握叉上拆下并按照步骤 3.6.1.6-3.6.1.7 进行清洁。
- 将网格(不包括连接器板)浸泡在稀释的酶清洁剂(50% Enzol,50% 蒸馏水)中至少 1 小时。之后,将其转移到第二个纯蒸馏水浴中,并在安全、干净的地方风干。
- 如果网格区域沉积了血液或组织,请使用浸泡在酶溶液中的棉三角轻轻擦拭干净。
- 干燥后,将网格放回盒子中。
- 对动物实施安乐死
- 对于老鼠,将动物从头部固定中取出,并将其放入安乐死室中。加入含有 5 mL 异氟醚的纱布,并在停止呼吸后等待 60 秒。验证缺乏撤退反射并使用锋利的剪刀斩首。
- 对于大鼠,注射 0.2 mL 戊巴比妥 IP。停止呼吸后等待 60 秒,将动物仰卧,并使用 #11 刀片进行双开胸手术。
- 清洁设备
- 将所有手术工具带到实验室水槽中,并将它们放在手术毛巾上。用 10% 漂白剂溶液喷洒工具,并在水槽中彻底清洗。对于较脏的工具,请在清洗前将它们浸泡在漂白剂溶液中。
- 或者,使用粉末洗涤剂(例如 Contrex AP)蘸水,在水槽中用刷子擦洗器械。
- 清洁并冲洗工具后,用酒精湿巾擦拭并放回存储空间。
- 清理工作空间
- 将所有用过的针头和刀片丢弃在锐器容器中。
- 将受污染的棉签、三角棉签和酒精湿巾丢弃在生物危害袋中。
- 在关闭工作区之前,用酒精擦拭钻机室的所有工作台面并清洁所有仪器。
- 提升和清洁网格
结果
我们已经描述了结合光遗传学方法和层流记录记录皮层电图信号的协议。在这里,显示了从小鼠的体感皮层(图 1、 图 2 和 图 3)和大鼠听觉皮层内响应感觉刺激(图 4、 图 5 和 图 6)获得的典型信号。
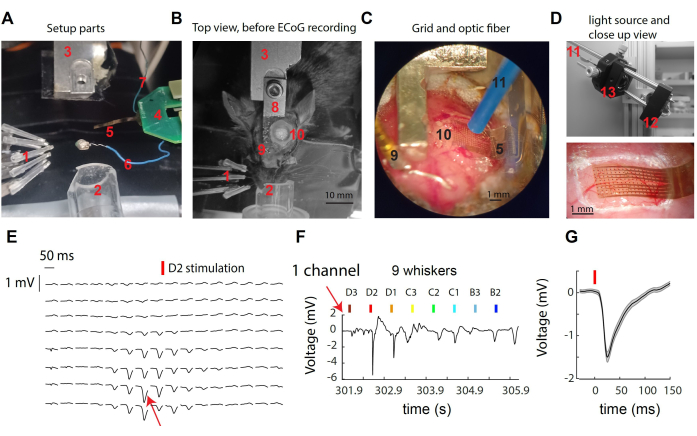
图 1:在小鼠胡须体感皮层上记录 μECoG 信号。(A) 设置的组件。见正文。(B) μECoG 记录前手术装置的俯视图,显示头枕和开颅手术部位的位置。(C) 位于暴露皮层上的 μECoG 网格和光纤的详细视图。(D) 顶部:光源位于录制盒外部。来自 473 nm LED 的光通过透镜串联收集在光纤中。下图:示例记录中鼠标皮层上皮质网格的特写。(E) 来自所有 16x8 通道的代表性 μECoG 轨迹,显示对晶须 D2 刺激的试验平均反应。(F) 来自 (E) 中指示的单个通道的原始电压迹线,跨越多晶须的单次偏转。该通道在刺激晶须 D2 期间表现出最强的反应。(G) 单通道 (E,F) 中试验的平均诱发电调反应,在晶须刺激后表现出急剧的电压偏转。请单击此处查看此图的较大版本。
图 1A-D 提供了用于记录和小鼠 S1 皮层光遗传学作的系统各种组件的图像。标记元件包括:1-9 个 3 x 3 阵列的独立晶须刺激器,2-用于异氟醚麻醉的鼻锥,3-头柱支架/对应物,4-μECoG 后端 PCB,通过双 ZIF 连接器连接到头台 PCB;5 μECoG 电极网格,位于 8 mm 柔性电缆的尖端;6- 参考线;7- 地线;8- 头柱植入物;9- 参考金针(用牙科水泥与头柱绝缘);10- 左半球开颅手术,在 S1 胡须桶皮层上方;11-1 mm 直径的光遗传学纤维(由显微作器固定,未显示);12- 由LED驱动器驱动的星形LED(未示出);13- 通过串联的非球面透镜收集光线。当刺激单个晶须时,观察到少量电极处的表面电位快速偏转(图 1E)。这簇电极代表在受刺激的晶须30 的皮质柱中达到峰值的局部信号。观察单个电极,我们观察到对其首选胡须的刺激反应最强,而对更远的胡须刺激的反应较弱或没有反应(图 1F)。在此示例中,偏转发生在晶须振动后约 10 ms 开始,平均振幅为 1 mV(图 1G)。
图 2 显示了光遗传学抑制期间的示例记录。光可以通过网格的透明基材到达皮质组织(图 2A)。然而,当使用大直径光纤或任何空间宽广的光源时,光子也会撞击电极,产生光电伪影(图 2B)。在这个抑制方案中,我们使用了 5 秒长的方形光脉冲。由此产生的光电伪影仅存在于光的开始和偏移处。在没有视蛋白的动物中,开灯时出现的胡须刺激与关灯试验中出现的胡须刺激不会引起不同的反应(图 2C)。相比之下,在兴奋性神经元亚群中对抑制性视蛋白的光刺激导致感觉诱发反应的振幅降低(图 2D)
图 2C,D 展示了时频域中光遗传学抑制的例子。为了分析 μECoG 数据,我们首先应用公共平均参考 (CAR) 来去除电极之间无差别的信号(例如呼吸),然后是莫尔斯小波变换,它揭示了随时间变化的有源频带。频域中的神经活动通常表现出 1/f 2,3 的近似幂律。为了在整个频域中更均匀地揭示感觉诱发信号,我们为每个频带分别应用 Z 评分。Z 分数基于基线 epoch 期间的信号统计数据。在这里,我们使用刺激之前的时间窗口,即试验开始前 -3000 毫秒到 -1000 毫秒。这个过程产生每个频段的刺激诱发 Z 分数(图 2C、D)。
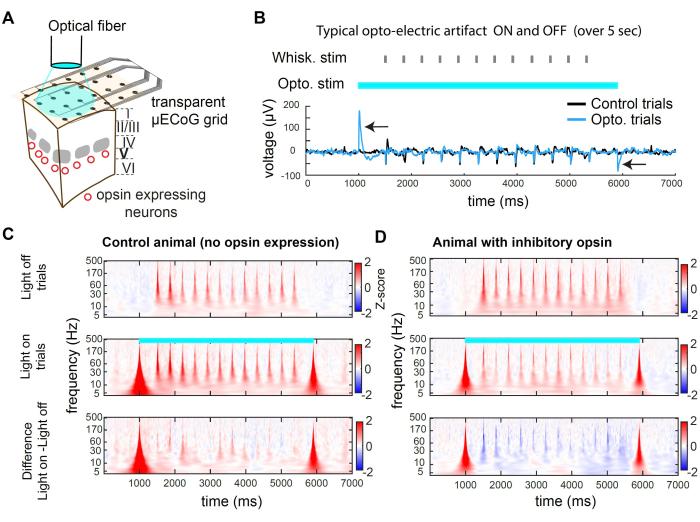
图 2:小鼠 μECoG 记录期间 wS1 中的光遗传学抑制。 (A) 代表性光遗传学实验的示意图。光纤直接指向大脑,允许对表达抑制性视蛋白的神经元群进行瞬时抑制。(B) 在光遗传学刺激中心的通道中记录的电压轨迹,在试验中平均。黑色箭头表示 473 nm 光开始和偏移时的光电伪影。请注意试验中间对晶须偏转(随机晶须身份)的响应。伪影是瞬态的,不会影响延迟后(此处为 500 毫秒)感觉诱发活动的记录。(C) 在未表达视蛋白的动物中,关灯试验、光照试验中示例通道的平均频谱图以及两者之间的差异。请注意,光电效应会引起宽带瞬态伪影,并且晶须诱发响应不受光线的影响。(D) 关灯试验、光照试验中的试验平均频谱图示例,以及 Rbp4-Cre 小鼠32 中两者之间的差异,其中 st-GtACR2.0 在第 5 层的兴奋性神经元中表达。请注意频谱图中对 whisker evoked response 的抑制。 请单击此处查看此图的较大版本。
图 3 显示了光传输系统中易于实现的变化。使用较小的光纤或简单的镜头,可以瞄准皮层15 的特定区域。从光纤发出的光迅速发散并到达目标区域以外的皮质组织。通过在光纤输出处加入非球面透镜 (f =16 mm),可以将光聚焦到较小的表面积(图 3A,C),小到大约单个皮质柱的直径(图 3C)。光在皮层内的发散也较小。理想情况下,使用激光或带有串联透镜组的强大光源,可以用准直光束瞄准单个皮质柱。但是,重要的是要考虑到光会在组织内散射,这可能会部分照亮相邻的柱子。在 μECoG 数据中测得的光伪影将揭示光线在皮质表面传输的位置;参见图 3B 与图 3D 的比较。光伪影的测量方式为光开始后 5 ms 高频范围 (65-500 Hz) 的峰值功率。

图 3:光传输到皮层的焦点。(A) 来自 1 mm 直径光纤的光聚焦在大脑表面。这种简单的调整可以更精确地将光线瞄准大脑表面和组织内部。(B) 传递到大脑的光的空间范围是通过光电伪影测量的。(C,D)其设置与图 A、B 中一样,具有 200 μm 光纤,这使得它能够直接瞄准直径为 250 μm 的区域,大约是皮质柱的大小。请单击此处查看此图的较大版本。
大鼠 μECoG 和层状 Polytrode 记录
图 4A-D 提供了用于大鼠初级听觉皮层记录的系统各种组件的图像。具体来说,标记元件包括:(1) μECoG 显微作器,(2) 啮齿动物立体定位装置,(3) 带 ZIF 夹连接器的 μECoG 电缆,(4) 层状 Polytrode 显微作器,(5) 大鼠鼻锥和头部稳定装置,(6) 用于刺激呈现的静电扬声器,(7) 带 ZIF 夹适配器的层状 Polytrode 电缆,(8) 通过双叉连接的 μECoGZIF 夹,(9) 32 通道 Polytrode 装置,(10) 静电扬声器,(11) 鳄鱼夹,用于保持手术部位开放, (12) 接地线,一根通过左后象限或右前象限的毛孔插入皮层,另一根接地到组织,(13) μECoG 网格的特写视图,(14) 插入的 Polytrode 的特写视图。图 4E 显示了从单个 μECoG 电极的记录电势得出的平均神经频谱图,以响应相同频率和衰减的 50 ms 音点(N = 20 次试验)。在整个频率中,诱发的响应在刺激开始后(左侧灰色虚线)后 25 ms 到 30 ms 之间表现出一个尖锐的峰值(由红色实线表示)。刺激开始之前的明显响应(表面上是非因果的)是由于常数 Q 变换在较低频率下的大带宽,它平滑(非因果,但没有相位偏移)而不是滤波器(因果,但会引起相位偏移)信号。因此,峰值响应的时间仍然准确。在峰值诱发电调反应时,我们观察到 z 评分的皮质表面电位 (CSEP) 在频率范围内是多模态的。具体来说,它表现出三个主要的非谐波峰:第一个也是最大的一个在 40-180 Hz gamma/高 gamma (γ/Hγ) 范围内,第二个在 200-450 Hz 超高 gamma (uHγ) 范围内,最后一个峰值在 500 Hz 以上,与多单位活性 (MUA) 相关(图 4F)11。这种刺激诱发的多模态结构在所有调谐电极上都很稳健。在这里,我们关注 Hγ,因为它在人体皮层电图 (ECoG) 记录中普遍存在31。在图 4G 中,我们展示了一个 μECoG 阵列,该阵列在硬膜下放置在硅层聚晶片旁边,以同时测量皮质表面电位 (CSEP) 和皮质层的尖峰活动。定制的 μECoG 阵列由 8×16 个电极组成,间距为 20 μm,接触直径为 4 μm,我们使用了一个 32 通道层流多路接头,配置为 2 × 16 个通道,间距为 4 μm,接触直径为 1 μm。μECoG 阵列足够大,可以覆盖整个大鼠初级听觉皮层 (A1),其直径为 4 μm 的小电极能够测量适合推导听觉调整的局部 CSEP。μECoG 高 γ (Hγ) 信号的空间分辨率为 ~20 μm,与大鼠皮质柱的半径相当。因此,μECoG 提供了皮层活动的“列状视图”。μECoG 网格中的穿孔允许层状多晶片在表面接触之间通过,从而能够直接记录跨皮质层的神经元活动(图 4H)。从 μECoG 和层流多圆电极记录的示例电压迹线如图 4I 所示。

图 4:在大鼠初级听觉皮层 (A1) 上记录 μECoG 和层状多旋律信号。 (A) μECoG 和层流多晶硅装置的组分。见正文。 (B) μECoG 和层状多旋律记录前手术装置的俯视图,显示头枕和开颅部位的位置。(C) 暴露的听觉皮层上 μECoG 网格和层状多裂片的详细视图。(D) μECoG 网格放置在皮层上的特写视图,包括单个电极的大小 (40 μm) 和电极之间的大小 (200 μm)。(E) 单通道对单个频率衰减对的响应的平均 z 分数小波分解。垂直红线表示 F.(F) 红色 - 单个频率衰减对的 20 次表示的平均峰值频率响应。Gray- 标准错误。频率轴位于对数刻度上。典型神经频带在顶部表示。(G) 大鼠初级听觉皮层表面 8 16 μECoG 网格的显微照片 (A1)。在中心 μECoG 窗口中插入了一个 32 通道层状聚合物。(H) 皮层活动的 3D 多尺度记录示意图。(I) 顶部:50 ms 纯音点的频谱图。中图:红色为 4 μECoG 电极的平均皮质表面电势(灰色)。底部:32 通道层状多晶硅电压迹线按皮质深度排列 请单击此处查看此图的较大版本。
图 5 显示了使用层状硅聚合物 (Camb64) 同时记录 μECoG 信号和加标活动。从表面电极记录的 μECoG 信号显示为原始电压轨迹(图 5A)及其小波变换,突出显示了频率随时间的分解 (图 5B)。使用聚乙烯醇记录多单元活动,如来自单个通道的代表性原始电压轨迹所示(图 5C),其中使用简单的阈值方法(电压超过 -120 μV 阈值)检测单个动作电位(尖峰)。从该通道中提取的尖峰波形对于大多数尖峰都是明确定义的,尽管它们可能来自神经元的多个来源(图 5D,插图)。在同一穿透的多个通道中,平均尖峰波形进一步证实了明确定义的尖峰活动记录的一致性(图 5E)。因此,这些记录方法可以支持带有尖峰排序分析和质量指标分析(如尖峰间隔或发射速率)的单单元记录(图 5F)。总之,层流探头的记录质量很好,在单通道上具有清晰的波形形态。这些结果表明,该方法能够同时采集 μECoG 和加标活性。

图 5:μECoG 和柱状加标活性的同时记录。 (A) 来自单个 μECoG 通道的原始电压迹线示例。(B) 同一 μECoG 通道的小波变换,显示频率随时间的变化。 (C) 来自单个 Polytrode 通道(急性 64 通道硅探针 camb64)的原始电压迹线示例,显示了使用简单电压阈值检测到的动作电位(尖峰)。(D) 从 Polytrode 通道中提取的尖峰波形 (C) 根据电压幅度的分布对齐和颜色编码。142 个尖峰波形中有 7 个未显示,因为根据它们在尖峰宽度和振幅上与主簇的距离,它们被视为异常值(见插图)。 (E) 从同一穿透的 9 个通道中提取的平均多单位尖峰波形。(F) 不同 polytrode 通道(例如,通道 21、27、63 和 61)的尖峰间隔 (ISI) 直方图,相应的发射速率 (FR) 以 Hz 表示。ISI 违规 (< 5ms) 在所有单元中占峰值的 5% 以下。 请单击此处查看此图的较大版本。
由于能够使用定制设计的 μECoG 阵列和层状多晶片进行同步记录,我们研究了 μECoG 信号在听觉调整方面与皮层深度的神经单元记录的比较。 图 6A 显示了频率-响应振幅 (FRA) 图,该图将高 γ (Hγ) 响应描述为听觉刺激频率和振幅的函数。顶部面板显示了位于听觉皮层上的 2 × 16 个 μECoG 电极子集的 FRA,而底部面板显示了来自 1×16 层状多晶电极子集的 FRA,这些电极通过 μECoG 阵列的穿孔插入(由灰色箭头表示)。值得注意的是,从 μECoG 电极获得的 FRA 与来自层状 polytrode 记录的 FRA 非常相似,这表明 μECoG 信号与皮层中的神经单元活动类似。
利用 μECoG 阵列的高空间分辨率,我们基于 Hγ 活性11 生成了多个听觉皮层视野的高分辨率音调图。在 图 6B 中,每个电极的最佳频率都用颜色编码,揭示了整个皮质表面的音调组织。8 × 16 μECoG 阵列覆盖了几个听觉皮层,包括初级听觉皮层 (A1)、后听觉场 (PAF) 和腹侧听觉场 (VAF),大致边界由黑线划定。这种详细的映射强调了 μECoG 阵列提供皮层活动的“柱状视图”的能力,以小于 20 μm 的空间分辨率捕获功能组织,与大鼠皮质柱的尺寸相当。这些发现表明,μECoG 记录不仅反映了在皮层深度的神经单元记录中观察到的调谐特性,而且还能够实现功能性皮层组织的高分辨率映射。
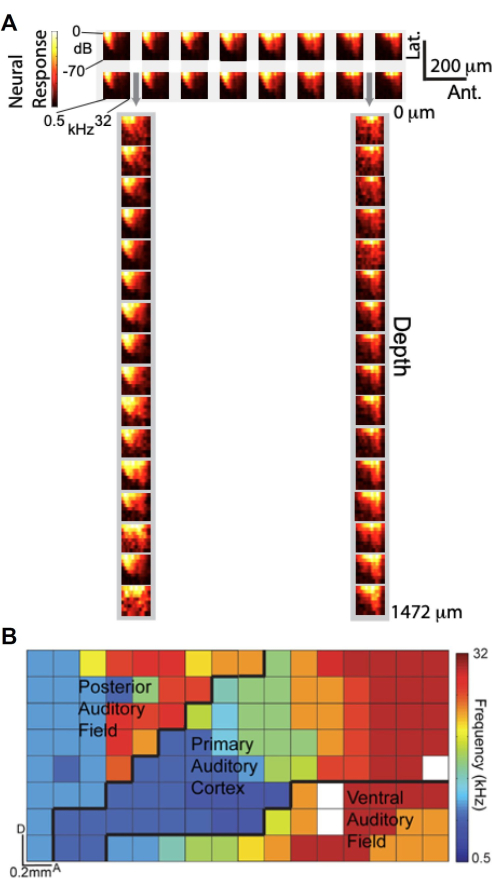
图 6.μECoG 信号与整个深度的神经单元尖峰记录类似,并揭示了听觉皮层的音调组织。 (A) 频率-响应振幅图 (FRA),将高伽马响应(彩条)显示为听觉刺激的频率(x 轴)和振幅(y 轴)的函数。(顶部)来自听觉皮层上 2 16 个 μECoG 电极子集的 FRA;(下)来自 1 16 个层状多晶电极子集的 FRA,通过 μECoG 阵列中的穿孔插入,由灰色箭头表示。 (B) 源自高 γ 活动的多个听觉皮层视野的高分辨率音调组织。每个像素都根据该电极的最佳频率进行颜色编码。此处显示的 8x16 μECoG 阵列覆盖多个听觉皮层区域(A1、PAF 和 VAF),并划定了大致边界(黑线)。 请单击此处查看此图的较大版本。
讨论
此处描述的方案能够将高密度微皮层电图 (μECoG) 阵列与层状探针和光遗传学技术集成。该协议在啮齿动物模型中的易用性使其成为研究皮层动力学的有力工具,并且可以轻松增加受试者的数量。高密度 μECoG 网格允许对小鼠和大鼠的多个区域的皮质地形进行高效、空间精确的映射,利用地形表示在大脑组织中的关键作用33。层流记录的添加允许跨多个空间和时间尺度检查皮层动力学。光遗传学的纳入使因果作能够确定特定神经群之间的关系及其对皮层表面诱发电位 (CSEP) 和皮层加工的贡献34。
光遗传学允许对特定神经元群进行选择性调节,从而能够研究它们在产生皮层活动模式和参与计算中的因果作用,其特征可以用 μECoG 感应。例如,我们的研究表明,靶向特定细胞类型可以改变皮质表面电位 (CSEP)。这种方法可用于剖析 μECoG 信号的神经细胞类型基础,使我们能够确定哪些神经元细胞类型有助于特征性感觉诱发活动,例如在高 γ 波段观察到的活动。其他大尺度现象,例如不同频段的皮层节律21,或空间组织的活动,包括行波35,36,也可以类似地研究。此外,一系列转基因小鼠品系和视蛋白很容易获得,为探索特定的电路机制提供了机会。光遗传学技术可用于检查柱子之间水平连接的功能效应37,这些连接在各种感觉计算中起着至关重要的作用,例如环绕抑制38 或知觉结合39。总之,通过光遗传学纵神经元活动的能力能够测试特定神经元群与 CSEP 特性之间的联系,或者群体与可通过 μECoG 测量的特定皮层计算之间的联系。这种方法可以有效地剖析局部神经结构和整体皮层活动之间的关系。
层状多旋律记录能够对小皮质体积内(即单个皮质柱内)内多个神经元的单神经元活动进行采样。这些记录至关重要,因为单个神经元可以独立编码不同的信息,采用刺激的选择性编码——例如 Quiroga 等人40 描述的“詹妮弗·安妮斯顿神经元”——或在更高维空间中提供互补表示,如混合选择性41 所示。传统上,电生理学家在简单的、参数设计的刺激和行为(例如,单须偏转或纯音,如此处部署)的背景下研究神经活动。这种刺激的表示往往在空间上相当局部(例如,单个列)。然而,许多与行为学相关的刺激和行为更为复杂,因此,在这种范式中,典型的神经活动模式经常延伸到单列之外——甚至整个大脑42。在这些情况下,μECoG 提供了全面的读数,可同时捕获多个列中的高时间分辨率、列式解析活动。总之,此处描述的协议有效地弥合了单个皮质柱内的局部处理与整个皮质区域和跨区域的多个柱之间发生的更广泛的动态之间的差距。
作为一般指导和故障排除,我们提出了一些建议。传统的急性体内电生理方案通常建议在暴露期间保持大脑湿润,以此来延长暴露大脑的健康。虽然这在某些情况下可能很有用,但我们的经验表明,啮齿动物的 μECoG 记录恰恰相反。事实上,我们发现当 μECoG 阵列放置在略微干燥的皮质表面上时,记录质量在质量上更好。我们认为这是因为盐水(一种位于皮质表面和记录电极之间的高导电离子溶液)使大脑产生的电信号均匀化。实际上,盐水是将电极“短接”在一起。由于 μECoG 网格监测神经元群产生的连续电场,因此确保电生理系统组装良好和去噪非常重要。在记录过程中,与参比电极的连接至关重要。在录制过程中如果不进行改进,数据的预处理可以包含 50 Hz 或 60 Hz 的陷波滤波器以消除线路噪声。然而,这将极大地改变信号,因此必须在后续分析中加以考虑。考虑到光遗传学光刺激,必须尽量减少或至少在实验设计中考虑光电伪影(例如,通过包括光开始或偏移后的延迟)。理想情况下,使用小直径的光纤将光传递到电极之间的区域,或者对光进行聚焦或准直。如果无法完全避免这种伪影(但请参阅建议不同探针设计 15,20,43 的研究,包括透明电极),可以通过使用所需的最少光量来减少它。新一代视蛋白需要更少的光才能有效44,45。我们建议在实验前使用层流探针校准光遗传学光功率。还可以通过避免光刺激中的急剧过渡来修改和减少伪影形状(例如,使用光斜坡而不是方形脉冲)。无论如何,建议使用不表达视蛋白的动物的控制条件,以区分神经活动的真正变化与伪影相关信号。最后,电沉积工艺会形成粗糙、高表面积的涂层,增强电极和组织之间的电荷转移,同时在记录过程中保持机械稳定性,与裸铂相比,电极阻抗降低 1-2 个数量级,并实现更好的神经信号检测46。
Acute μECoG 在实验设置中提供了灵活性并降低了复杂性,允许在数十分钟的记录过程中对神经活动进行详细映射。作为一种中尺度方法,它能够对皮层活动进行区域间跟踪,但不是全脑跟踪,尽管信号的确切来源仍不确定 1,47。未来,多模态研究应该可以更好地了解信号的来源。急性 μECoG 在捕获长期神经动力学方面受到限制,并且可能受手术恢复或麻醉等瞬态因素的影响48,49。相比之下,慢性 μECoG 能够长时间观察神经活动,从而深入了解学习、可塑性和疾病进展等过程10,13。慢性 μECoG 还带来了电极稳定性、潜在信号衰减以及与长期植入相关的风险(包括组织瘢痕形成或感染)等挑战50,51。与穿透电极相比,这些挑战往往不那么严重,并且据说在小鼠体内硬膜外植入 μECoG 会进一步减少(以较低的信号质量为代价)52。可以在相同或不同动物的多个会话中重复使用相同的 μECoG 网格,在会话结束时删除网格并在下一个会话中替换它。在这种亚急性配置中,大脑必须始终保持湿润,并在两次会议之间用玻璃盖玻片保护。我们观察到 μECoG 网格相当耐用;如果处理和清洁得当,单个网格可以重复使用 ~20 次,使其成为经济高效的记录设备。网格可以设计为具有不同数量和几何形状的电极布局。这里的结果表明,由于底层皮层中神经表示的粒度,将电极间距减小到 <200 μm 对功能分辨率的改进只能忽略不计。
披露声明
作者声明没有竞争性的经济利益。
致谢
这项工作得到了劳伦斯伯克利国家实验室 LDRD 对神经系统和机器学习实验室 (K.E.B.)、NINDSR01 NS118648A (K.E.B.& D.E.F.) 和 NINDS R01 NS092367 (D.E.F.) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 disposable #11 blade | Swann Morton | 303 | For surgical procedures |
| 2 disposable #10 blades | Swann Morton | 3901 | For surgical procedures |
| 30 mm cage bars | Thorlabs | ER | cage components |
| 30 mm cage plate | Thorlabs | CP33T | holding the lenses |
| 70% ethanol | Decon Labs | V1016 | Cleaning / Disinfectant (diluted to 70%) |
| Amalgambond PLUS Adjustable Precision Applicator Brush Teal 200/Bx | Henry Schein | 1869563 | precision applicator for the cement |
| Amalgambond PLUS Catalyst 0.7 mL Syringe Ea | Henry Schein | 1861119 | cement component |
| Amplifier (Tucker-Davis Technologies) | Tucker-Davis Technologies | PZ5M-512 | Used for auditory stimulus and recording software. |
| Articulated arm | Noga | DG60103 | for holding the fine adjustment screw system |
| Aspheric lenses for light collection (and one for focusing the light) | Thorlabs | ACL25416U-B | for collecting LED light |
| Auditory equipment | Tucker-Davis Technologies, Sony, Cortera | RP2.1 Enhanced Real-Time Processor/HB7 Headphone Drive | Used for auditory stimulus and recording software. |
| Buprenorphine | Sterile Products LLC | #42023017905 | General analgesia |
| C&B Metabond Base Cement Ea | Henry Schein | 1864477 | cement component |
| C&B Metabond L-Powder Cement Clear 3 g | Henry Schein | 1861068 | cement component |
| Chlorprothixene hydrochloride (mouse) | Sigma Aldrich | Cat. No. C1671 | For sedation, must be prepared the same day and kept at 4 |
| Custom-designed 128-channel micro-electrocorticography (μECoG) grids | Neuronexus | E128-200-8-40-HZ64 | For neurophysiology recordings. Placed onto the cortex. |
| Dengofoam gelatin sponges | Dengen dental | 600034 (SKU) | can be used dry or wet, saturated with sterile sodium chloride solution |
| Drill bit, size 5 to 9 (Mouse) | Fine Science Tools | 19007-XX | XX is the size of the drill bit e.g. 05 or 09. For mouse procedures |
| Drill bitSteel Round Bur (5.5 mm/7.5 mm) | LZQ Tools | Dental Bar Drill Bit Stainless Steel Bur | For rat procedures |
| Dumont No. 5 forceps | Fine Science Tools | 11251-10 | For surgical procedures |
| Dumont tweezers #5 bent 45° | World precision instruments | 14101 | for removing craniotomy window |
| DVD Player (Sony) | Sony | CDP-C345 | System used to accept and play back stimulus sets |
| Electrostatic Speaker | Sony | XS-162ES | Used for auditory stimulus and recording software. Located within the rig, plays sound to the sedated rodent |
| Enzymatic detergent (Enzol) | Advanced sterilization products | 2252 | Cleaning/Disinfectant |
| EverEdge 2.0 Scaler Sickle Double End H6/H7 #9 | Henry Schein | 6011862 | for scrubing the skull |
| Fine adjustment screw system in 3 dimension | Narishige | U-3C | for precise positioning of the optical fiber end |
| Gold pin | Harwin Inc | G125-1020005 | Used for contact reference in mouse Soldered to the silver wire |
| Gripping forceps | Fine Science Tools | 00632-11 | For surgical procedures |
| Isoflurane | Covetrus | 11695067772 | require a vaporizer |
| Ketamine (Hydrochloride Injection) (Rat) | Dechra | 17033-101-10 | Anesthesia/Analgesic |
| LED | New Energy | LED XLAMP XPE2 BLUE STARBOARD | Blue LED light source |
| LED driver | Thorlabs | LEDD1B | LED driver |
| Lidocaine | Covetrus | VINB-0024-6800 | to be diluted to 1% in saline |
| Meloxicam | Covetrus | 6451603845 | Anti-inflammatory used for general analgesia |
| Micromanipulator | Narishige (Stereotaxic Rig) | SR-6R + SR-10R-HT components | Used to manipulate ECoG and rodent with fine movements |
| No. 2 forceps | Fine Science Tools | 91117-10 | For surgical procedures |
| No. 55 forceps | Fine Science Tools | 1129551 | For surgical procedures |
| Ophtalmic lubricant (Artificial tears) | Akorn | 17478-062-35 | Used to protect eyes from dessication during surgical procedures |
| Optical fiber 200µm Core diameter | Thorlabs | M133L02 | FC/PC connector 2 m long |
| Pentobarbital (Rat) | Covetrus / Dechra | VINV-C0II-0008 | Anesthesia/Analgesic |
| Platinum Black | Sigma | 205915-250MG | For neurophysiology recordings (Used for electroplating the contacts on the μECoG grids). |
| Povidone Iodine 10% | Betadine | https://betadine.com/medical-professionals/betadine-solution/ | no catalog number ( not retail ) |
| Powder detergent (Contrex AP) | Decon Labs | 5204 | Cleaning / Disinfectant |
| Pre-cut tape for oxygen tube | ULINE (Various Providers) | S-14726 | Used to attach oxygen tube to the nose-cone of the rodent stereotaxic rig |
| Scalpel handle # 3 | World precision instruments | 500236-G | for blades # 10, #11 and #15 |
| Scraper | Fine Science Tools | 1007516 | For surgical procedures |
| Short 30 G needles | ExelInt | 26437 | For surgical procedures and injections |
| Silver Wire | Warner Instruments | 63-1319 | For neurophysiology recordings (Used for grounding and as a reference electrode). |
| Sterilized saline (0.9% sodium chloride for injection) | Hospira | 00409-7101-67 (NDC) | For dilution of injectable, and replacement of body fluids |
| Stoelting Hopkins Bulldog | Fine Science Tools | 10-000-481 | For surgical procedures |
| Surface disinfectant (Coverage Plus NDP Disinfectant) | Steris life science | 638708 | Cleaning/Disinfectant |
| TDT ZIF-clip connectors for acquisition. | Tucker-Davis Technologies | ZIF-Clip Analog Headstages | Connects ECoG with outside acquisition equipement |
| Two-pronged holding fork | Tucker-Davis Technologies | Z-ROD128 | Used to connect the TDT-clips with the micromanipulator |
| Xylazine (Rat) | Covetrus | 1XYL006 | Anesthesia/Analgesic |
参考文献
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat Rev Neurosci. 13 (6), 407-420 (2012).
- Chen, T. -W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nunez, P. L., Srinivasan, R. Electric Fields of the Brain: The Neurophysics of EEG. , Oxford University Press, USA. (2006).
- Mountcastle, V. B., Powell, T. P. Central nervous mechanisms subserving position sense and kinesthesis. Bull Johns Hopkins Hosp. 105, 173-200 (1959).
- Khodagholy, D., et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci. 18 (2), 310-315 (2015).
- Lewis, C. M., Bosman, C. A., Womelsdorf, T., Fries, P. Stimulus-induced visual cortical networks are recapitulated by spontaneous local and interareal synchronization. Proc Natl Acad Sci U S A. 113 (5), E606-E615 (2016).
- Bouchard, K. E., Mesgarani, N., Johnson, K., Chang, E. F. Functional organization of human sensorimotor cortex for speech articulation. Nature. 495 (7441), 327-332 (2013).
- Fabrication and testing of a large area, high density, parylene MEMS µECoG array. Ledochowitsch, P., et al. 2011 IEEE 24th International Conference on Micro Electro Mechanical Systems, Cancun, Mexico, , (2011).
- Bosman, C. A., et al. Attentional stimulus selection through selective synchronization between monkey visual areas. Neuron. 75 (5), 875-888 (2012).
- Rubehn, B., Bosman, C., Oostenveld, R., Fries, P., Stieglitz, T. A MEMS-based flexible multichannel ECoG-electrode array. J Neural Eng. 6 (3), 036003(2009).
- Baratham, V. L., et al. Columnar localization and laminar origin of cortical surface electrical potentials. J Neurosci. 42 (18), 3733-3748 (2022).
- Kellis, S., et al. Decoding spoken words using local field potentials recorded from the cortical surface. J Neural Eng. 7 (5), 056007(2010).
- Viventi, J., et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci. 14 (12), 1599-1605 (2011).
- A transparent µECoG array for simultaneous recording and optogenetic stimulation. Ledochowitsch, P., Olivero, E., Blanche, T., Maharbiz, M. M. 2011 Annual International Conference of the IEEE Engineering in Medicine and Biology Society, Boston, MA, USA, , (2011).
- Ledochowitsch, P., et al. Strategies for optical control and simultaneous electrical readout of extended cortical circuits. J Neurosci Methods. 256, 220-231 (2015).
- Laminar origin of evoked ECoG highgamma activity. Annu Int Conf IEEE Eng Med Biol Soc. Dougherty, M. E., Nguyen, A. P. Q., Baratham, V. L., Bouchard, K. E. 2019, 4391-4394 (2019).
- Tian, H., Xu, K., Zou, L., Fang, Y. Multimodal neural probes for combined optogenetics and electrophysiology. iScience. 25 (1), 103612(2022).
- Gonzales, D. L., et al. A translaminar spacetime code supports touchevoked traveling waves. bioRxiv. , (2024).
- Leonard, M. K., et al. Largescale singleneuron speech sound encoding across the depth of human cortex. Nature. 626 (7999), 593-602 (2024).
- Renz, A. F., et al. OptoEDura: a soft, stretchable ECoG array for multimodal, multiscale neuroscience. Adv Healthc Mater. 9 (17), 2000814(2020).
- Buzsáki, G. Rhythms of the brain. , Oxford University Press, USA. (2006).
- Yang, W., et al. A fully transparent, flexible PEDOT:PSS-ITO-Ag-ITO based microelectrode array for ECoG recording. Lab Chip. 21 (6), 1096-1108 (2021).
- Buzsáki, G. Largescale recording of neuronal ensembles. Nat Neurosci. 7 (5), 446-451 (2004).
- Schalk, G., et al. Realtime detection of eventrelated brain activity. Neuroimage. 43 (2), 245-249 (2008).
- Kellis, S., et al. Multiscale analysis of neural activity in humans: implications for microscale electrocorticography. Clin Neurophysiol. 127 (1), 591-601 (2016).
- Buzsáki, G., Schomburg, E. W. What does gamma coherence tell us about interregional neural communication. Nat Neurosci. 18 (4), 484-489 (2015).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecondtimescale, genetically targeted optical control of neural activity. Nat Neurosci. 8 (9), 1263-1268 (2005).
- Cardin, J. A., et al. Driving fastspiking cells induces gamma rhythm and controls sensory responses. Nature. 459 (7247), 663-667 (2009).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decisionrelated activity propagate in a cortical feedback loop during touch perception. Nat Neurosci. 19 (9), 1243-1249 (2016).
- Petersen, C. C. The functional organization of the barrel cortex. Neuron. 56 (2), 339-355 (2007).
- Crone, N. E., Sinai, A., Korzeniewska, A. Highfrequency gamma oscillations and human brain mapping with electrocorticography. Prog Brain Res. 159, 275-295 (2006).
- Gerfen, C. R., Paletzki, R., Heintz, N. GENSAT BAC crerecombinase driver lines to study the functional organization of cerebral cortical and basal ganglia circuits. Neuron. 80 (6), 1368-1383 (2013).
- Mountcastle, V. The columnar organization of the neocortex. Brain. 120 (4), 701-722 (1997).
- Deisseroth, K. Optogenetics. Nat Methods. 8 (1), 26-29 (2011).
- Muller, L., Chavane, F., Reynolds, J., Sejnowski, T. J. Cortical travelling waves: mechanisms and computational principles. Nat Rev Neurosci. 19 (5), 255-268 (2018).
- Sato, T. K., Nauhaus, I., Carandini, M. Traveling waves in visual cortex. Neuron. 75 (2), 218-229 (2012).
- Gilbert, C. D., Wiesel, T. N. Columnar specificity of intrinsic horizontal and corticocortical connections in cat visual cortex. J Neurosci. 9 (7), 2432-2442 (1989).
- Angelucci, A., et al. Circuits and mechanisms for surround modulation in visual cortex. Annu Rev Neurosci. 40 (1), 425-451 (2017).
- Singer, W., Gray, C. M. Visual feature integration and the temporal correlation hypothesis. Annu Rev Neurosci. 18, 555-586 (1995).
- Quiroga, R. Q., et al. Invariant visual representation by single neurons in the human brain. Nature. 435 (7045), 1102-1107 (2005).
- Fusi, S., Miller, E. K., Rigotti, M. Why neurons mix: high dimensionality for higher cognition. Curr Opin Neurobiol. 37, 66-74 (2016).
- Stringer, C., et al. Spontaneous behaviors drive multidimensional, brainwide activity. Science. 364 (6437), eaav7893(2019).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using celltypespecific expression of channelrhodopsin2. Nat Protoc. 5 (2), 247-254 (2010).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nat Neurosci. 21 (6), 881-893 (2018).
- Mahn, M., et al. Highefficiency optogenetic silencing with somatargeted anionconducting channelrhodopsins. Nat Commun. 9 (1), 4125(2018).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating lowimpedance tetrodes by electroplating with additives. Sens Actuators A Phys. 156 (2), 388-393 (2009).
- Halnes, G., et al. Electric Brain Signals: Foundations and Applications of Biophysical Modeling. , Cambridge University Press. (2024).
- Franks, N. P. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal. Nat Rev Neurosci. 9 (5), 370-386 (2008).
- Alkire, M. T., Hudetz, A. G., Tononi, G. Consciousness and anesthesia. Science. 322 (5903), 876-880 (2008).
- Schalk, G., Leuthardt, E. C. Braincomputer interfaces using electrocorticographic signals. IEEE Rev Biomed Eng. 4, 140-154 (2011).
- Chestek, C. A., et al. Longterm stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex. J Neural Eng. 8 (4), 045005(2011).
- Branco, M. P., et al. Nine decades of electrocorticography: a comparison between epidural and subdural recordings. Eur J Neurosci. 57 (8), 1260-1288 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。