Method Article
Solunum ve yutma sırasında gırtlak hareketinin yakından görüntülenmesi için minimal invaziv murin laringoskopi
Bu Makalede
Özet
Bu protokol, fareler ve sıçanlar için, optimize edilmiş bir anestezik rejim ve ince ayarlı endoskopik manipülasyon teknikleri kullanılarak solunum ve yutma sırasında gırtlağın yakından, engelsiz video görüntülemesine izin veren bir seri transoral laringoskopi yaklaşımını tanımlar.
Özet
Gırtlak, memelilerde nefes alma, yutma ve ses çıkarma olmak üzere üç temel işlevi olan önemli bir organdır. Nefes almada zorluk (nefes darlığı), yutma bozukluğu (disfaji) ve/veya ses bozukluğu (disfoni) ile sonuçlanan çok çeşitli bozuklukların laringeal fonksiyonu bozduğu bilinmektedir. Disfaji, özellikle, aspirasyon pnömonisine ve buna bağlı morbiditeye, tekrarlayan hastaneye yatışa ve erken mortaliteye yol açabilir. Bu ciddi sonuçlara rağmen, laringeal disfonksiyon için mevcut tedaviler büyük ölçüde, ne yazık ki tipik olarak normal laringeal fonksiyonu geri getirmeyen cerrahi ve davranışsal müdahaleleri hedeflemektedir ve bu nedenle yenilikçi çözümlere olan acil ihtiyacı vurgulamaktadır.
Bu boşluğu doldurmak için, murin (yani fare ve sıçan) modellerinde laringeal disfonksiyonu araştırmak için deneysel bir endoskopik yaklaşım geliştiriyoruz. Bununla birlikte, kemirgenlerde endoskopi, mevcut endoskop teknolojisine göre küçük boyutları, üst solunum yolundaki anatomik farklılıklar ve gırtlağa en iyi şekilde erişmek için anestezi gerekliliği nedeniyle oldukça zordur. Burada, farelerde ve sıçanlarda laringeal hareketin yakından, engelsiz video görüntülemesine izin veren yeni bir transoral laringoskopi yaklaşımını açıklıyoruz. Protokoldeki kritik adımlar arasında hassas anestezi yönetimi (yutmayı ortadan kaldıran ve/veya solunum sıkıntısına bağlı mortalite riskini ortadan kaldıran aşırı dozu önlemek için) ve endoskopun mikromanipülatör kontrolü (sonraki miktar tayini için tek bir araştırmacı tarafından laringeal hareketin stabil video kaydı için) yer alır.
Daha da önemlisi, protokol, çeşitli patolojik durumların özellikle laringeal fonksiyon üzerindeki etkisini incelemek için aynı hayvanlarda zaman içinde gerçekleştirilebilir. Bu protokolün yeni bir avantajı, yutma sırasında hava yolu korumasını görselleştirme yeteneğidir, bu da glottis görünümünü engelleyen laringeal giriş üzerindeki epiglottik inversiyon nedeniyle insanlarda mümkün değildir. Bu nedenle kemirgenler, normal laringeal fonksiyonu etkili bir şekilde eski haline getirmek için tedavileri keşfetmek amacıyla normal ve patolojik laringeal hava yolu koruma mekanizmalarını spesifik olarak araştırmak için eşsiz bir fırsat sağlar.
Giriş
Gırtlak, boğazdaki solunum ve sindirim yollarının kesiştiği noktada bulunan kıkırdaklı bir organdır ve burada yiyecek ve sıvıya (yani yutma sırasında) karşı havanın akışını ve yönünü (yani nefes alma ve ses çıkarma sırasında) hassas bir şekilde kontrol etmek için bir valving mekanizması olarak işlev görür. Konjenital (örneğin, laringomalazi, subglottik stenoz), neoplastik (örneğin, laringeal papillomatoz, skuamöz hücreli karsinom), nörolojik (örneğin, idiyopatik laringeal felç, inme, Parkinson hastalığı, amyotrofik lateral skleroz) ve iyatrojenik (örneğin, baş veya boyun cerrahisi sırasında kasıtsız yaralanma) dahil olmak üzere gırtlağı etkileyen çok çeşitli bozuklukların bilinmektedir. Etiyolojiden bağımsız olarak, laringeal disfonksiyon tipik olarak bir kişinin ekonomik ve sosyal refahını olumsuz yönde etkileyen dispne (nefes almada zorluk), disfoni (ses bozukluğu) ve disfaji (yutma bozukluğu) semptom üçlüsü ile sonuçlanır 1,2,3,4.
Ayrıca, disfaji, özellikle tıbbi olarak kırılgan bireylerde, aspirasyon pnömonisine (tam olarak kapalı olmayan bir gırtlaktan akciğerlere kaçan gıda veya sıvı nedeniyle) ve buna bağlı morbiditeye, tekrarlayan hastaneye yatışa ve erken mortaliteye yol açabilir 5,6. Bu ciddi sonuçlara rağmen, laringeal disfonksiyon için mevcut tedaviler büyük ölçüde normal laringeal fonksiyonu tipik olarak geri getirmeyen cerrahi ve davranışsal müdahaleleri hedeflemektedir 1,2,7,8,9,10, bu nedenle yenilikçi çözümlere olan acil ihtiyacı vurgulamaktadır. Bu amaca yönelik olarak, murin (yani fare ve sıçan) modellerinde laringeal disfonksiyonu araştırmak için deneysel bir endoskopik yaklaşım geliştiriyoruz.
İnsan tıbbında, laringeal disfonksiyonun değerlendirilmesi için altın standart, laringoskopi olarak adlandırılan endoskopik görselleştirmedir11,12. Tipik olarak, gırtlağı, özellikle vokal kıvrımları ve bitişik supraglottik ve subglottik laringeal yapıları incelemek için burundan esnek bir endoskop geçirilir. Ağız boşluğu yoluyla gırtlağı görselleştirmek için sert bir endoskop da kullanılabilir. Her iki yaklaşım da laringeal anatominin kaba incelemesine izin verir ve solunum, fonasyon ve öksürük ve laringeal adduktor refleksi gibi çeşitli hava yolu koruyucu refleksleri sırasında laringeal hareketliliği ve fonksiyonu değerlendirmek için kullanılabilir 13,14,15,16. Bununla birlikte, yutma sırasında, gırtlak, gırtlak girişini örtmek için ters döndüğü için epiglot tarafından tamamen gizlenir ve onu yutulan gıda / sıvı bolus yolundan korur. Sonuç olarak, yutma sırasında laringeal hareketin doğrudan görselleştirilmesi insanlarda mümkün değildir ve bu nedenle diğer tanısal yaklaşımlar (örneğin, floroskopi, elektromiyografi, elektroglottografi) kullanılarak dolaylı olarak çıkarılmalıdır.
Bu makale, fareler ve sıçanlar için hafif anestezi altında yutma sırasında solunumun yakın çekimine, engelsiz görüntülenmesine ve hava yolu korumasına izin veren yenilikçi bir laringoskopi protokolünü açıklamaktadır. Protokol, anestezi uygulanmış kemirgeni prosedür boyunca hareketsiz hale getirmek için özel bir platformla birlikte ticari olarak temin edilebilen çeşitli endoskopi sistemleriyle uyumludur. Daha da önemlisi, her laboratuvarın mevcut kaynaklarına ve araştırma gündemine bağlı olarak endoskopi platformlarının çok sayıda tasarımı/konfigürasyonu gerçekten mümkündür. Buradaki amacımız, araştırmacıların araştırmaları bağlamında düşünmeleri için rehberlik sağlamaktır. Ayrıca, bu laringoskopi protokolünün, laringeal disfonksiyon ve rejenerasyon anlayışımıza yeni bakış açıları kazandırabilecek çok sayıda objektif veriye nasıl yol açabileceğini göstermeyi amaçlıyoruz.
Bu murin laringoskopi protokolünde özetlenen tüm adımların birleşik etkisi, iyatrojenik yaralanmaya, hastalığın ilerlemesine ve / veya hava yolu korumasına göre tedavi müdahalesine yanıt olarak zaman içinde laringeal disfonksiyonu tespit etmek ve karakterize etmek için aynı hayvanlarda tekrarlanabilen yetişkin murin larinksinin minimal invaziv bir incelemesi ile sonuçlanır. Dikkat edilmesi gereken, bu protokol seslendirme ile ilgili gırtlak fonksiyonunu değerlendirmez.
Protokol
Murin laringoskopi protokolü, onaylanmış bir Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) protokolünü ve Ulusal Sağlık Enstitüleri (NIH) Yönergelerini takip eder. 100'den fazla yetişkin C57BL / 6J faresi ve 50'den fazla yetişkin Sprague Dawley sıçanı, her iki tür için de yaklaşık olarak eşit cinsiyette ve 6 hafta-12 aylık olmak üzere geliştirilmiştir. Daha genç / daha küçük kemirgenlere adaptasyon için ek protokol geliştirme gereklidir. Hayvanlar grup halinde barındırıldı (cinsiyete ve çöpe bağlı olarak kafes başına dört fare veya iki sıçan). Standart vivaryum koşulları, ortam sıcaklığının (20-26 °C), nemin (%30-%70) ve standart 12 saatlik ışık döngüsünün sıkı bir şekilde düzenlenmesine sahip statik kafesi içeriyordu. Tüm hayvanlara haftalık kafes değişimlerinde taze zenginleştirme malzemeleri (örneğin, kulübe / boru, diş tedavileri, yuva) verildi. Aşağıda tarif edildiği gibi anestezi öncesi kısa (4-6 saate kadar) gıda kısıtlaması dışında yiyecek ve suya sınırsız erişim sağlandı. Veteriner ve araştırma personeli hayvanları her gün izledi.
1. Yutmayı ortadan kaldırmayan hayvan anestezisi
- Kemirgenlerle çalışırken alerjen maruziyetini en aza indirmek için uygun kişisel koruyucu ekipman (örn. eldiven, maske) kullanın.
- Yiyeceklerin ağız boşluğunda ve farenkste tutulmasını en aza indirmek için anesteziden önce her bir kemirgen kafesini 4-6 saate kadar kısıtlayın, bu da endoskopik görselleştirmeyi engelleyebilir ve / veya işlem sırasında gıda aspirasyonuna neden olabilir.
NOT: Ağız boşluğunda gıda tutulması, disfajisi olmayan kemirgenlerde, gıda kısıtlaması yapılmamışsa normal bir bulgudur. - Hayvanların indüksiyonu/geri kazanımı için bir "ısıtma istasyonu" hazırlayın.
- Su sirkülasyonlu bir ısıtma yastığını tezgah üstü bir yüzeyde 37 °C'ye önceden ısıtın.
- Test edilen türler için uygun boyutta indüksiyon/geri kazanım kafesleri seçin. Örneğin, filtre üst kapaklı fare ayakkabı kutusu kafesleri, farelerin ve sıçanların indüksiyonu/geri kazanımı için uygun boyuttadır. Test edilen her hayvan için yeni bir indüksiyon/kurtarma kafesi kullanın; Aynı hayvan için hem indüksiyon hem de kurtarma kafesi olarak tek bir kafes kullanın.
- Anestezi indüksiyonu ve iyileşme sırasında vücut salgılarının ısınması ve emilmesi için indüksiyon/kurtarma kafesi tabanını hafif bir emici malzeme tabakası (örn. kavak talaşı, kağıt havlu, köpek pedi) ile hizalayın.
- Anestezi indüksiyonundan önce hazırlanan kafesleri (filtre üst kapakları ile) 30-60 dakika boyunca ısıtma yastığının üzerine tamamen yerleştirin.
NOT: Bu mikro çevre, indüksiyon ve iyileşme sırasında stabil anestezi metabolizmasını teşvik etmek için yeterli ek ısı sağlar.
- Anestezi indüksiyonundan yaklaşık 30 dakika önce hayvanın ev kafesini önceden ısıtılmış 37 °C ısıtma yastığının yarısına kadar yerleştirin.
NOT: İşlemden önce ek ısı sağlamak, anestezi indüksiyonunu hızlandırabilir ve hipotermiden kaynaklanan yavaşlamış / gecikmiş anestezi metabolizması nedeniyle kazara aşırı dozu önleyebilir. - Türe ve vücut ağırlığına göre ketamin-ksilazin (KX) anestezisi hazırlayın.
- Fareler için: 90 mg / kg ketamin ve 11 mg / kg ksilazin karışımı, her iki cinsiyetten yetişkin C57BL / 6 arka plan farelerinde transoral laringoskopi için yeterlidir. Diğer fare suşları ve yaşları için dozları ayarlayın.
- Sıçanlar için: Her iki cinsiyetten yetişkin Sprague Dawley sıçanlarında transoral laringoskopi için 60 mg / kg ketamin ve 6 mg / kg ksilazin karışımı yeterlidir. Diğer sıçan suşları ve yaşları için dozları ayarlayın.
- Hayvanlarda soğuk sıvılar enjekte edilirken meydana gelen ısı kaybını önlemek için şırınga dolu anestezik ajanları 37 °C ısıtma istasyonunda önceden ısıtın.
- Uygun boyutta bir şırınga (ör., 1 mL) ve iğne (ör., 26 G1 / 2) kullanarak kemirgene hesaplanan KX dozunu enjekte edin.
- Fareler için: Tek bir deri altı (SC) enjeksiyon uygulayın.
NOT: Deneyimlerimize göre, farelerde SC enjeksiyonları, intraperitoneal (IP) enjeksiyonlara kıyasla anesteziye bağlı mortaliteyi azaltır / ortadan kaldırır. - Sıçanlar için: Tek bir SC veya IP enjeksiyonu uygulayın. Tercih edilirse, KX enjeksiyonundan hemen önce bir indüksiyon odasında izofluran (ISO) (% 3-5) ile sıçanları sakinleştirin.
NOT: Spontan vücut hareketi, KX etkili olana kadar kısa bir süre (tipik olarak <1 dakika) devam edebilir.
- Fareler için: Tek bir deri altı (SC) enjeksiyon uygulayın.
- Transoral endoskopi sırasında gırtlağın görüntülenmesini engelleyebilecek ve/veya anestezi iyileşmesi sırasında üst solunum yolunu mekanik olarak tıkayabilecek aşırı tükürük salgılarını azaltmak için KX enjeksiyonundan hemen sonra glikopirrolat (antikolinerjik ajan) uygulayın.
NOT: Dozaj ve uygulama yolu fareler ve sıçanlar için aynıdır (0.01-0.02 mg / kg SC) ve etki neredeyse anında gerçekleşir ve birkaç saat sürer. - Glikopirrolat enjeksiyonundan sonra, anestezi uygulanmış kemirgeni ısıtma istasyonundaki önceden ısıtılmış indüksiyon kafesine yerleştirin ve 10 dakika boyunca rahatsız edilmeden görsel uyarımı en aza indiren karanlık bir ortam sağlamak için kafesi cerrahi bir örtü ile örtün.
- Kemirgen ilk KX dozundan 10 dakika sonra ayaktan kalırsa prosedürü sonlandırın.
NOT: Ek anestezi sağlama girişimleri (KX veya ketamin bakımı) muhtemelen boşuna olacaktır.
- Kemirgen ilk KX dozundan 10 dakika sonra ayaktan kalırsa prosedürü sonlandırın.
- 10 dakika sonra, bir idame ketamin dozu uygulayın (arka bacak refleksleri azalırsa başlangıç dozunun 1 / 4'ü veya arka bacak refleksleri hızlıysa başlangıç dozunun 1 / 2'si; Fareler için SC ve sıçanlar için SC / IP) anesteziyi sürdürmek için.
- Laringoskopi işlemi sırasında kornea kurumasını ve buna bağlı travmayı önlemek için her iki göze de oftalmik merhem sürün.
- Laringoskopi işlemine başlamak için anestezi uygulanmış kemirgeni özel bir endoskopi platformuna aktarın.
NOT: Endoskopi platformumuzu (Şekil 1), mutlaka endoskopi gerektirmeyen çeşitli kemirgen cerrahisi ve elektrofizyoloji yaklaşımlarıyla kullanım için birden fazla işlevselliğe sahip olacak şekilde tasarladık. Bu nedenle, tamamen endoskopik kullanım için üst üste inşa edilmiştir. İlgili olduğunda, bu laringoskopi protokolü için gerekli olan özellikleri/bileşenleri vurgulayacağız. - Bu noktadan itibaren, tüm prosedür boyunca her 15-20 dakikada bir arka bacak reflekslerini kontrol edin ve gerektiğinde en az 20 dakika aralıklarla ek ketamin idame dozları sağlayın. Bu nispeten kısa bir prosedür olduğundan (tipik olarak anestezi altında <45 dakika), ilk idame dozundan sonra nadiren ek ketamin gerekir.
2. Gırtlağı görselleştirmek için endoskopun transoral geçişi
- Hayvanı uyuşturmadan önce, video kayıt özelliğine sahip uygun büyüklükte bir endoskop hazırlayın.
NOT: Rutin olarak 1.9 mm şaft çapına ve 10 cm şaft uzunluğuna sahip özel bir metal kılıf ile sıfır derecelik bir Otoskop kullanıyoruz (Şekil 2), bu protokol boyunca kullanılan temsili endoskoptur.- Saniyede en az 30 kare (fps) hızında gerçek zamanlı görüntüleme ve video kaydı için endoskopu bir ışık kaynağına ve endoskopi kayıt sistemine bağlayın.
- Optimum görüntü kalitesi için kamerayı odaklayın ve beyaz dengesi yapın.
- Endoskopu bir mikromanipülatöre takın.
NOT: Laringeal hareket takibi için, stabil video çekimi için hassas endoskop kontrolüne izin vermek için endoskopu endoskopi platformundaki bir mikromanipülatöre sabitliyoruz.
- Kemirgeni ısıtılmış bir platform üzerinde sırt yaslanma ile sabitleyin. Kafayı kulak çubuklarıyla sabitleyerek sabitleyin ve hareketsiz hale getirin.
- Kemirgenin kafasının kulak çubuklarında kaymadan serbestçe yukarı/aşağı dönebildiğinden (ancak yan yana değil) emin olun. Bu serbestlik derecesi, endoskopun transoral yerleştirilmesini ve ilerlemesini gırtlağa ulaşmasını kolaylaştırır.
- Endoskopi sırasında solunum, yutma ve yutma-solunum koordinasyonunun senkron elektrofizyolojik kaydı isteniyorsa, bu amaç için uygun sensörlerin uygulanmasına devam edin (Şekil 3).
- Cerrahi bant kullanarak, bir solunum sensörünü orta hatta karın bölgesine, hemen ksifoid işlemine kaudal olarak sabitleyin.
- Enfeksiyonu önlemek için iğne elektrotlarını yerleştirmeden önce cildi alkollü bir mendille tıraş edin ve temizleyin/dezenfekte edin.
- Elektromiyografi (EMG) iğnesinin hasar görmesini önlemek için iğne elektrodunu yerleştirmeden önce deriden küçük bir açıklık açmak için 22 G'lik bir iğne kullanın.
- Steril bir konsantrik EMG iğne elektrodu (ör., 25 mm x 0.3 mm / 30 G) orta hattaki submental deriden dil tabanına (ör., iğne yerleştirme derinliğine bağlı olarak genioglossus veya geniohyoid kas).
- Kalçaya (her iki tarafta) deri altına bir toprak elektrodu (örn. 27 G paslanmaz çelik) yerleştirin.
- Solunum sensörünü ve EMG iğne elektrotlarını bir elektrofizyoloji kayıt sistemine (örneğin, senkron video yakalamalı biyoamplifikatör ve veri toplama sistemi) bağlayın ve devam etmeden önce her iki kanaldaki temiz elektrofizyoloji sinyallerini doğrulayın.
- Elektriksel gürültüye karşı koruma sağlamak ve ilgili elektrofizyolojik kayıtlarda sinyal-gürültü oranını iyileştirmek için elektrot bağlantı yerlerini alüminyum folyo ile sarın.
- Her iki kanalda da temiz elektrofizyoloji sinyalleri elde etmek için solunum sensörü konumunu ve EMG iğne elektrot derinliğini gerektiği gibi ayarlayın. Bu protokolü takip etmek için, solunum için 1k örnekleme hızı ve EMG için 20k örnekleme hızı ve bant geçiren filtre (örn., 150-3.000 Hz) kullanın.
- Solunum sırasında karın hareketinin görselleştirilmesine izin verirken termoregülasyonu kolaylaştırmak için kemirgenin gövdesini (ve solunum sensörünü) şeffaf bir örtü ile örtün. Refleks kontrolleri ve ketamin bakım yeniden dozlaması sırasında erişim için arka ayakları ve alt karın bölgesini serbestçe açıkta bırakın. Battaniyenin nefes alma sırasında karın hareketini kısıtlamadığından emin olun.
- Transoral endoskopi ile devam edin (Şekil 4).
- Merkezi kesici dişlerin arkasına, çeneye dik olacak şekilde konik, pamuk uçlu bir aplikatör yerleştirerek kemirgenin ağzını açın. Pamuklu çubuğu ağızdan hafifçe çıkıntı yapacak şekilde dilin sırt yüzeyinde döndürün.
- Hafif bir parmak kavrama yeri kullanarak, endoskop ucunu ağız boşluğuna sokarken dili ağızdan hafifçe dışarı çekerek merkezi kesici dişlerin bir tarafına doğru çekin (Şekil 4A,B).
- Kemirgenin gözlerine potansiyel olarak zarar vermemek için endoskop ucunu ağza soktuktan sonra ışık kaynağını açın.
- Endoskopu, geri çekilmiş dil ile aynı taraftaki kesici dişlerin yanına yerleştirin. Santral kesici dişler, endoskopun orta hatta yerleştirilmesini engeller ve bu nedenle bu lateral yerleştirme yaklaşımını gerektirir.
- Endoskopi (ve elektrofizyoloji) kayıt sistemlerini başlatın. Post hoc analiz için yeterli veriyi sağlamak için tüm prosedür boyunca sürekli olarak kaydedin veya çalışmanın ihtiyaçlarına bağlı olarak belirli zamanlarda kaydedin.
- Orofarenksi görselleştirmek için endoskopu dikkatlice ilerletin, sert damağa sürtmemeye veya dil üzerinde yaralanmaya neden olabilecek aşırı basınç uygulamamaya dikkat edin.
- Prosedür ilerledikçe aspirasyon riskini en aza indirmek için uygun boyutta bir çubuk (örn. 1,5 mm'lik bir mikro fırça) kullanarak görünür gıda parçacıklarını ve/veya fazla tükürük salgılarını çıkarın.
- Hipofarenks monitördeki görüş alanı içinde ortalanana ve temel anatomik yapılar tanımlanabilir hale gelene kadar endoskop pozisyonunu ilerletmeye/ayarlamaya devam edin (Şekil 4C). Bu noktada, tüm yapılar kamera görüş alanı içinde anatomik olarak hizalı/simetrik görünmelidir; Aksi takdirde, endoskopu gerektiği gibi yeniden konumlandırın.
- Endoskop ilerlemesi sırasında uyarılmış çene / dil hareketine dikkat edin. Aksi takdirde, daha fazla ketamin dozu olmadan devam edin. Varsa, ikinci bir ketamin idame dozu uygulayın (başlangıç ketamin dozunun 1/4 ila 1/2'si) ve devam etmeden önce etkili olması için yaklaşık 5 dakika bekleyin. Aşırı yüklenmeyi ve yutmanın ortadan kaldırılmasını önlemek için önceki enjeksiyondan bu yana en az 20 dakika geçmişse yeniden dozlayın.
- İskeminin göstergesi olan koyu renk değişikliği için prosedür boyunca her 5 dakikada bir kemirgenin dilini inceleyin. Bunu önlemek için endoskopu gerektiği gibi yeniden konumlandırın.
- Gırtlağı uzaktan görselleştirmek için yumuşak damak ve epiglotu ayırmak için endoskopun yanına yerleştirilmiş bir mikro prob (örneğin metal bir spatula) ile veluma hafif basınç uygulayın (Şekil 4D). Uygulanan basınç yumuşak doku hasarına neden olabileceğinden veya endoskop şaftını kalıcı olarak bükebileceğinden/hasar verebildiğinden, ayırma için endoskop ucunu kullanmaktan kaçının.
NOT: İnsanlardan farklı olarak, murin gırtlağı transoral bir perspektiften doğrudan görünmez. Bunun yerine, epiglot mekanik olarak velumun üzerindeki bir mukozal zarın altında sıkışır ve bu da bir çıkmaz kese hipofaringeal boşluğun oluşumuna neden olur. Velum üzerine hafif basınç uygulamak, gırtlağın kısmi bir görünümünü vermek için epiglotusu velar membrandan serbest bırakır. - Velum / epiglottis ayrışması sırasında uyarılmış kırlangıçları gözlemleyin.
- Kırlangıçları, sert damağa doğru ani, kısa arka dil yer değiştirmeleri olarak tanımlayın. Bu hareket tipik olarak kısa mandibular hareket / depresyon ile senkronize olarak gerçekleşir, böylece arka dil endoskop görüş alanında kolayca görülemediğinde yutmanın tanımlanması için bir vekil sağlar.
- Ayrıca, her ikisi de endoskopi videosundaki glottik kapanma olaylarıyla senkronize olarak meydana gelen elektrofizyoloji kaydındaki kısa apneik ataklarla bağlantılı olarak dil EMG patlama aktivitesi yoluyla kırlangıçları tanımlayın.
- Yetersiz anestezinin göstergesi olan hızlı tekrarlayan yutma durumunda (ör., çok hafif), devam etmeden önce yeniden doz alın ve ~ 5-10 dakika bekleyin. Aşırı yüklenmeyi ve yutmanın ortadan kaldırılmasını önlemek için önceki ketamin idame enjeksiyonundan sonra en az 20 dakika bekleyin.
- Velar-epiglottik ayrışma sırasında sadece birkaç kırlangıç uyandırıldığında anestezik derinliğin optimal olduğunu düşünün.
- Yutma kaldırılırsa, anestezi laringeal hava yolu korumasını değerlendirmek için çok derindir. Bu durumda, gırtlağın yakın plan görselleştirmesine devam etmeden önce ketamin metabolizması için 5-10 dakika bekleyin.
3. Solunum sırasında gırtlak hareketinin yakın çekim, engelsiz video kaydı ve uyarılmış yutma
NOT: Solunum, yutma ve yutma-solunum koordinasyonunun senkron elektrofizyolojik kaydı da bir seçenektir.
- Gırtlağı görüş alanının merkezinde tutarken endoskopu velum ve epiglot arasında yavaşça ilerletin (Şekil 5A-C).
NOT: Endoskop ucu, velar-epiglotik açıklıktan kuvvet olmadan kolayca geçecektir. Aksi takdirde, hayvana zarar vermemek için prosedürü iptal edin. Hipofarenksteki endoskop ucu ile gırtlağı belli bir mesafeden görüntülemek mümkündür. Bununla birlikte, bu yaklaşım tipik olarak gırtlağın daha iyi görselleştirilmesi için epiglotis, velum ve/veya dilin manuel olarak geri çekilmesini gerektirir. Bununla birlikte, gırtlağın bazı kısımları tipik olarak görünmez kalır ve geri çekme cihazları gırtlak hareketini kısıtlayabilir, bu da işlev bozukluğu ile karıştırılabilir. - Tek bir görüş alanında gırtlağın tüm ventral-dorsal ve lateral boyutlarının engelsiz bir yakından görüntüsünü elde etmek için endoskopu ilerletmeye devam edin (Şekil 5C).
NOT: Ventral komissür, özellikle daha genç / daha küçük farelerde epiglottis tarafından engellenebilir. Bu durumlarda, ventral komissürü görselleştirmek için endoskop ucunu daha agresif bir şekilde manipüle etmeye çalışmak, laringeal hareketi kısıtlayabilir ve bu da disfonksiyon ile karıştırılabilir. Ayrıca gırtlak hava akışını engelleyerek boğulmaya neden olabilir. - Her solunum döngüsü sırasında kemirgen nefes alırken (glottal genişleme) ve nefes verirken (glottal daralma) gırtlağın salınım hareketini gözlemleyin.
NOT: Laringeal / glottal hareketin hızı ve büyüklüğü anestezik derinliğe göre değişebilir; Bununla birlikte, bir glottal boşluk (yani, sol / sağ aritenoidler ve vokal kıvrımlar arasındaki hava boşluğu) tipik olarak sağlıklı kemirgenlerde solunum döngüsü boyunca görünür kalır.- Belirgin glottik daralma fark edilirse, üst solunum yolundan engelsiz hava akışını sağlamak için endoskop konumunu ayarlayın. Örneğin, burun hava yolunun yumuşak doku tıkanmasına neden olabilecek velum üzerine baskı uygulamaktan kaçının. Ayrıca endoskop ucunu glottal boşluğa sokmaktan kaçının, bu da boğulmaya yol açan gırtlak hava akışını engelleyebilir. Nadir durumlarda, solunum durursa, endoskopu çıkardıktan sonra birkaç orta sternal göğüs kompresyonu (bir parmak kullanarak) veya pozitif basınçlı ventilasyon (minyatür bir "resüsitasyon torbası" kullanarak) yapın.
- Post hoc değerlendirme amacıyla 30-60 saniye boyunca laringeal solunum hareketini video olarak kaydedin.
- Gırtlak hala yakın görünümdeyken, velum ve/veya epiglottis üzerindeki mukozaya mekanik stimülasyon uygulamak ve optimal anestezi uygulanmış kemirgenlerde yutmayı uyandırmak için gırtlak girişi içindeki endoskop ucunu hafifçe ayarlayın.
- Mukozal yaralanmayı ve / veya hava yolu tıkanıklığını önlemek için endoskop ucunun mikro düzeyde ayarlamalarını (yani, herhangi bir yönde ~ 1 mm) kullanın.
- Görünür çene çöküntüsü, dil EMG patlama aktivitesi ve solunum izinde görülebilen kısa (<1/2 sn) apne ile senkronize olarak meydana gelen ani glottik kapanma olayları olarak kolayca tanımlanabilen uyarılmış kırlangıçlara dikkat edin.
NOT: Birlikte meydana gelen çene hareketi olmadan glottik kapanma olayları meydana gelebilir; Bununla birlikte, bu vakalar için glottik kapatma tipik olarak eksiktir. Bunların, anestezinin etkisini yitirmeye başlamasıyla ortaya çıkan diğer hava yolu koruyucu refleksleri (örneğin, laringeal adduktör refleksi) olabileceğinden şüpheleniyoruz; ancak, daha fazla araştırma gerektiren nadir/tutarsız olaylardır. - Hayvan başına 5-10 kırlangıç uyandırılana ve video kaydedilene kadar tekrarlayın. Yutma kaldırılırsa, endoskopu çıkarın ve devam etmeden önce ketamin metabolizmasının gerçekleşmesi için 5-10 dakika bekleyin.
- Endoskopu dikkatlice orofarenkse geri çekin, ancak çıkarmayın ve epiglot ve velumu görselleştirmek için hipofarinksi görüş alanında ortalayın.
- Epiglotun yutulmasını ve velar zarın altında yeniden sıkışmasını uyandırmak için dil tabanına hafif basınç uygulamak için bir mikro çubuk kullanarak burun solunumunun yeniden başlaması için velum ve epiglotu yeniden birleştirin. Birkaç denemede yeniden birleştirme gerçekleşmezse, gırtlak yaralanması riskinden kaçınmak için yeniden birleştirme olmadan anestezi iyileşmesine devam edin.
- Endoskopi (ve elektrofizyoloji) kaydını durdurun.
- Dili ve merkezi kesici dişleri nemlendirmek ve dili ağız boşluğu içindeki anatomik konumuna geri döndürmek için tuzlu suyla ıslatılmış bir pamuklu çubuk kullanın.
- Anestezi iyileşmesine devam etmek için kulak çubuklarını çıkarın ve sıcaklık probunu, solunum sensörünü ve EMG elektrotlarını kemirgenden çıkarın.
4. Anestezi iyileşmesi
- Anesteziden kurtulmak için hayvanı önceden ısıtılmış bir kurtarma kafesine (yani indüksiyon kafesi ile aynı) "ısıtma istasyonu" üzerine yerleştirin.
- Kurumayı önlemek için göz kayganlaştırıcıyı tekrar uygulayın.
- Sıvı hidrasyonu için ısıtılmış salin SC uygulayın: sıçanlar için 5 mL'ye kadar ve fareler için 0,5 mL'ye kadar.
- Ksilazinin tersine çevrilmesi ve solunum sürüşünü arttırmak için atipamezol SC'yi uygulayın: sıçanlar ve fareler için 1-2 mg / kg.
- 2 mg / kg atipamezol ile başlayın, hemen ardından iyileşmeyi hızlandırmak için kemirgenin sırtı ve midesi boyunca manuel stimülasyon yapın.
NOT: Bu yaklaşımı kullanarak, spontan kafa hareketi tipik olarak 1-3 dakika içinde başlar. Bununla birlikte, ayaktan duruma dönüş, bireysel farklılıklar nedeniyle KX anestezisi altında laringoskopiyi takiben tipik olarak ortalama 2 saat (1 saat ila 5 saat arasında değişir) sürer. - Sık sık manuel stimülasyon sağlanmasına rağmen, anestezi iyileşmesinin ilk 15-30 dakikası içinde spontan vücut hareketi artmak yerine azalıyorsa, 1 mg / kg'da (ilk enjeksiyondan en az 15 dakika sonra) dozlanmış ek atipamezol sağlayın.
- Spontan aktivite azalmaya devam ederse doxapram (sıçanlar ve fareler için 5 mg / kg IP) uygulamasına devam edin. Spontan hareket ortaya çıkana kadar bu "acil kurtarma" ajanı ile 10-15 dakikalık aralıklarla (beş doza kadar) yeniden dozlayın. Kemirgenler can çekişiyorsa, onaylanmış ötenazi yöntemlerini kullanarak hayvanlara ötenazi yapın (örneğin, aşırı dozda ketamin ve ardından kafa kesme gibi ikincil bir yöntem).
- 2 mg / kg atipamezol ile başlayın, hemen ardından iyileşmeyi hızlandırmak için kemirgenin sırtı ve midesi boyunca manuel stimülasyon yapın.
- Solunum durumu, hareketlilik ve termoregülasyondaki olumsuz değişiklikleri tespit etmek ve gerektiğinde müdahale sağlamak için 15-20 dakikalık aralıklarla iyileşen kemirgenleri yakından izleyin (ör., manuel stimülasyon, ek oksijen, termal battaniye, atipamezol veya doksapram enjeksiyonları). Müdahale gerektiren kemirgenler için daha sık izleme sağlayın.
- Uzun süreli KX anestezi iyileşme süreleri olan kemirgenler için gerektiği gibi 10 dakikalık aralıklarla ek oksijen sağlayın (örneğin, ısıtılmış bir indüksiyon odasında ISO olmadan 1-2 L / dak). Alternatif olarak, SpO2 seviyelerini (% >94) normalleştirmek için hayvanın dorsal ve ventral yüzeyleri boyunca sık sık stimülasyon uygulayın.
- Spontan aktivitenin artmasını ve daha hızlı iyileşmeyi teşvik etmek için iyileşen kafes arkadaşlarını aynı kurtarma kafesine (kafes başına en fazla iki kemirgen) yerleştirin.
- Kurtarma kafesinin etrafında kendiliğinden hareket edebildiklerinde kemirgenleri ısıtılmış ev kafeslerine geri koyun.
- Standart yiyecek ve su şişesini ev kafesine geri koyun. Boğulma/aspirasyon riskini en aza indirmek için anestezi hala devam ederken yiyecek/su erişimi için özel konaklama yerleri sağlamayın.
- Ev kafesinin aktivitesini gözlemleyin ve ambulasyonu engelleyen tüm engelleri kaldırın (örn. kulübe, PVC boru).
- Önümüzdeki 12-16 saat boyunca (yani gece boyunca) ev kafesini yarısı açık, yarısı ısıtma istasyonunun dışına yerleştirin.
NOT: Ek ısının daha erken kesilmesi hipotermiye bağlı mortaliteye neden olabilir.
- Ertesi sabah standart sağlık kontrolleri yapın. Normal / başlangıç aktivitesinin yeniden başlaması, vücut fonksiyonları (ör. termoregülasyon, yeme, içme, idrar yapma, dışkılama) ve sabit kilo (yani sürdürme veya kazanma) ile hayvanları rutin günlük sağlık izlemesi ile standart vivaryum koşullarına geri döndürün. Kemirgenlerin aktivitesinin, vücut fonksiyonlarının veya vücut ağırlığının azaldığı nadir durumlarda, bir gün daha ek ısıya devam edin.
NOT: Sıçanlar için, porfirin lekelenmesinin anestezi iyileşme periyoduna ~ 3-6 saat içinde her iki gözün etrafında aniden ortaya çıkması yaygındır. Lekelenme tipik olarak 24 saat içinde düzelir.
5. Nefes alma ve yutma sırasında laringeal hareketin objektif olarak ölçülmesi
- Endoskopi videolarını izlemek için kare kare analiz özelliğine sahip video düzenleme yazılımı kullanın.
- Hayvan başına en az bir temsili 10-20 s spontan solunum atağı tanımlayın.
- Hayvan başına 3-5 temsili yutma olayı tanımlayın.
- Seçilen solunum ve yutma olaylarının/olaylarının aşağıdaki analiz kriterlerini karşıladığından emin olun: tüm gırtlak yapıları/sınırları görünür (yani, velum, epiglottis veya aşırı tükürük salgıları tarafından gizlenmemiş) kamera görüş alanında ortalanmış gırtlak), yeterli aydınlatma (yani, tüm gırtlak yapılarını/sınırlarını görebiliyor) ve kamera hareket artefaktı olmadan (yani, endoskop hareket etmiyor).
- Belirlenen nefes alma ve yutma olaylarını / olaylarını öznel ve / veya nesnel yaklaşımlar kullanarak analiz edin.
- Öznel analiz için: Video düzenleme yazılımı kullanarak gerçek zamanlı ve kare kare görüntüleme sırasında gırtlak hareketini öznel olarak puanlamak için bir Likert ölçeği kullanın. Bu protokolü takip etmek için, -2 ile +2 arasında değişen genişletilmiş bir Likert ölçeği kullanın, burada negatif değerler beklenenden ters yönde gırtlak hareketini gösterir. Yutma sırasında laringeal hava yolu korumasını tahmin edin, burada 0 = glottal boşluk boyutunda azalma yok (ör., laringeal hava yolu koruması yok), 1 = bir miktar glottal boşluk azalması (ör., eksik hava yolu koruması) ve 2 = aritenoidlerin tam addüksiyonu, vokal kıvrımlar arasında sadece küçük bir ventral glottal boşluk ile (ör., tam hava yolu koruması), negatif değerler paradoksal laringeal hareketi gösterir.
NOT: Kemirgen çalışmalarında 0 ile 2 arasında değişen bir Likert ölçeği yaygın olarak kullanılır, burada 0 = hareket yok, 1 = biraz hareket ve 2 = normal hareket 17,18,19,20,21,22. Bununla birlikte, bu ölçek, tekrarlayan laringeal sinir (RLN) yaralanmasını takiben sıklıkla ortaya çıkan paradoksal laringeal hareketi hesaba katmaz10. - Objektif analiz için: Dört ana video karesi tanımlayın - 1) laringeal addüksiyonun başlamasından hemen önceki dinlenme çerçevesi (yani, vokal kıvrımların eklenmesinden önceki çerçeve), 2) vokal kıvrımların addüksiyonu tamamladığı çerçeve, 3) vokal kıvrımların abdüksiyonundan hemen önceki çerçeve (bu #2 ile örtüşebilir) ve 4) vokal kıvrımların tamamen çekildiği ve nefes almaya devam etmek için dinlenme pozisyonuna geri döndürüldüğü çerçeve. Ses kıvrımı addüksiyonunun süresini (çerçeve 1'den kare 2'ye), glottik kapanışı (çerçeve 2'den kare 3'e), vokal kıvrım abdüksiyonunu (çerçeve 3'ten kare 4'e) ve toplam yutma süresini (çerçeve 1'den kare 4'e) hesaplamak için bu dört ana karenin zaman damgasını kullanın. Alternatif olarak, hareketsiz çerçeve görüntüleri17,18,24 kullanarak maksimum abdüksiyon ve maksimum addüksiyon sırasında glottal açıyı (yani, dorsal olarak aritenoidler veya ventral olarak vokal kıvrımlar arasında) ölçmek için mevcut diğer ticari yazılımları 23 kullanın. En az iki eğitimli hakemin bu süreci kör bir şekilde bağımsız olarak gerçekleştirmesini, hakemler arasındaki tutarsızlıkları belirlemesini ve her tutarsızlık için ortak bir fikir birliğine varmasını sağlayın.
NOT: Daha önce kemirgenlerde ve insanlarda ticari video düzenleme yazılımı kullanarak glottik kapanma zamanlama olaylarının (yani hava yolu koruyucu refleksleri sırasında) bu manuel kare kare analizini gerçekleştirmiştik14. Bununla birlikte, bu yaklaşım verimsizdir ve laringeal hareket dinamiklerinin yalnızca sınırlı bir şekilde ölçülmesini sağlar. Şu anda, solunum ve hava yolu koruyucu refleksleri 22,25,26,27,28,29,30 sırasında gırtlak hareketinin daha kapsamlı objektif ölçümünü gerçekleştirmek için şirket içi yerleşik laringeal izleme yazılımı kullanıyoruz. Yazılım, sol ve sağ taraflı gırtlak hareket mesafesinin (genlik) ve zamanlamanın (frekans) objektif olarak ölçülmesi için otomatik kare kare izleme özelliğine sahiptir. Bu parametreleri, solunum, yutma ve diğer hava yolu koruyucu refleksleri (örneğin, laringeal addüktör refleksi) sırasında laringeal disfonksiyonu (örneğin, glottal açı maksimum/minimum/aralık, laringeal hareket simetrisi ve senkronizasyon) tespit etmek/ölçmek için çeşitli harekete dayalı ölçümler türetmek için kullanırız. Bu yazılım hala geliştirilme aşamasındadır ve henüz ticari olarak/kamuya açık değildir.
- Öznel analiz için: Video düzenleme yazılımı kullanarak gerçek zamanlı ve kare kare görüntüleme sırasında gırtlak hareketini öznel olarak puanlamak için bir Likert ölçeği kullanın. Bu protokolü takip etmek için, -2 ile +2 arasında değişen genişletilmiş bir Likert ölçeği kullanın, burada negatif değerler beklenenden ters yönde gırtlak hareketini gösterir. Yutma sırasında laringeal hava yolu korumasını tahmin edin, burada 0 = glottal boşluk boyutunda azalma yok (ör., laringeal hava yolu koruması yok), 1 = bir miktar glottal boşluk azalması (ör., eksik hava yolu koruması) ve 2 = aritenoidlerin tam addüksiyonu, vokal kıvrımlar arasında sadece küçük bir ventral glottal boşluk ile (ör., tam hava yolu koruması), negatif değerler paradoksal laringeal hareketi gösterir.
Sonuçlar
Bu murin laringoskopi protokolünün başarılı kullanımı, Şekil 6'da gösterildiği gibi, sağlıklı ve hastalık koşulları altında spontan solunum ve uyarılmış yutma sırasında gırtlağın yakından görüntülenmesine neden olur. Ayrıca, bu protokol zaman içinde laringeal fonksiyon / disfonksiyonun araştırılmasına izin vermek için aynı kemirgenlerde birden çok kez tekrarlanabilir. Şekil 7'de gösterildiği gibi, RLN yaralanmasının bir sıçan cerrahi modelinde spontan iyileşme paternini araştırmak için bu laringoskopi protokolünü 4 aylık bir zaman dilimi boyunca 6 kez başarıyla tekrarladık (veriler henüz yayınlanmadı). KX yerine ISO anestezisi kullanma girişimleri, önceki deneylerimizde anlatıldığı gibi, yutmayı uyandırmak için sağ üst laringeal sinirin doğrudan elektriksel stimülasyonu uygulanan kemirgenlerde yutmanın neredeyse ortadan kalkmasına neden oldu (Şekil 8) 31,32. Bu, %2 gibi düşük bir ISO ile meydana geldi; ISO'nun bu seviyenin altına düşürülmesi, spontan hareketin geri dönüşüyle sonuçlandı ve bu nedenle önlendi. ISO'nun bu kafa karıştırıcı etkisi, bu protokolün başarılı bir şekilde kullanılması için anestezi seçiminin önemini vurgulamaktadır.
Endoskopik görüntü kalitesi iyi olduğunda, Şekil 9'da gösterildiği gibi, solunum ve yutmanın temsili video klipleri hareket izleme yazılımı kullanılarak analiz edilebilir. Özel gırtlak izleme yazılımımız tarafından otomatik olarak oluşturulan temsili sonuç ölçümleri Tablo 1'de listelenmiştir. Solunum ve yutma ile ilgili birkaç sonuç önleminin, aynı temsili sıçanda başlangıç ve RLN sonrası transeksiyon arasında belirgin şekilde farklı olduğunu unutmayın. Solunum sırasındaki glottal açılar başlangıç ve RLN sonrası transeksiyon arasında benzerken, solunum sırasında sağ / sol laringeal hareket genliği (yani, ortalama hareket aralığı oranı veya MMRR) ve frekans (açma-kapama döngüsü oranı veya OCCR) oranları transeksiyon sonrası daha düşüktü. Benzer şekilde, RLN transeksiyonunu takiben yutma süresi daha kısaydı.
Senkron elektrofizyolojik kayıtlar (ör., solunum pnömogramı ve genioglossus EMG) elde edilirse, laringoskopi verileriyle korelasyon için birkaç ek objektif sonuç ölçütü ölçülebilir. Araştırmamızı ilgilendiren elektrofizyoloji temelli sonuç ölçümlerinin örnekleri Şekil 10'da özetlenmiştir. Şu anda bu sonuç ölçümlerinin otomatik olarak ölçülmesi için algoritmalar geliştiriyoruz.

Şekil 1: Murin endoskopi platformu. (A) Özel murin endoskopi platformunun yandan ve (B) üstten görünümleri, temel bileşenler etiketlenmiş olarak gösterilmiştir. Isıtma yastığının altındaki masa tablasının boyutunun ayarlanabilir olduğunu unutmayın. Burada, daha küçük bir ısıtma yastığı (gösterilmemiştir) barındıran fare boyutunda bir masa tablasını ortaya çıkarmak için kolayca çıkarılabilen, farelerle kullanılan masa üstü ve ısıtma yastığı boyutları gösterilmiştir. Özel bir adaptör, bir endoskopu platform tabanına bağlı bir mikromanipülatöre sabitler. Bu stratejik tasarım, endoskopi prosedürü sırasında kasıtsız/kontrolsüz endoskop hareketinden hayvanın yaralanma riski olmadan tüm platformun bir ünite olarak hareket ettirilmesine izin verir. Mikromanipülatör, endoskop ucunun x (sol/sağ), y (ileri/geri), z (yukarı/aşağı) dahil olmak üzere birçok yönde brüt ve mikro ayarlamalarının yanı sıra y (eğim) ve z (sapma) etrafında dönmesine izin verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Murin laringoskopi için otoskop ve özel kılıf. (A) Ticari bir otoskopun demonte bileşenleri ve murin laringoskopi için adaptörlü özel paslanmaz çelik kılıf. (B) Monte edildiğinde, otoskop ucu metal kılıfın 1 mm ötesine uzanır, ancak gerektiğinde 5 mm'ye kadar ayarlanabilir. Bu stratejik tasarım, dar otoskop ucunun kemirgenin gırtlak girişine ilerlemesini kolaylaştırırken, biraz daha büyük çaplı (2,4 mm) metal kılıf, nefes alma ve yutma sırasında tüm gırtlağın en iyi şekilde görselleştirilmesi için velum ve epiglotu yeterince açık tutar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
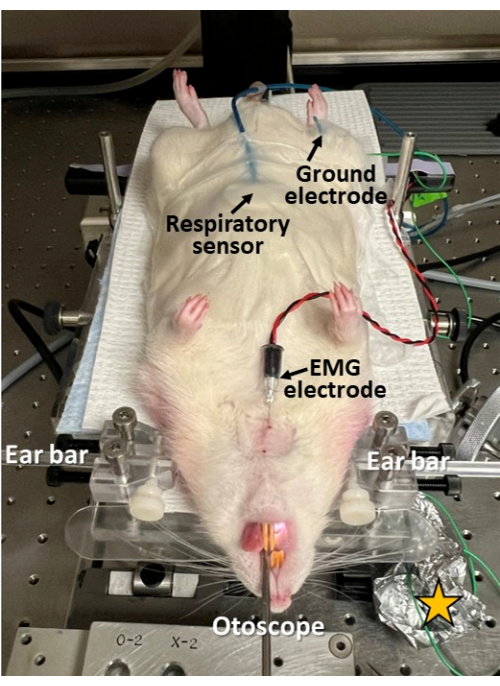
Şekil 3: Endoskopi sırasında minimal invaziv elektrofizyolojik kayıt. Kemirgenin karnına bir solunum sensörü bantlanır; deriden dilin genioglossus kasına bir EMG elektrodu yerleştirilir; ve kalçaya deri altından bir toprak elektrodu yerleştirilir. Bu yaklaşım, yutma, nefes alma ve yutma-solunum koordinasyonunun endoskopi ile senkronize olarak araştırılmasına olanak sağlar. Elektrot yerleştirme yerlerinde cildin tıraş edildiğini ve temizlendiğini/dezenfekte edildiğini unutmayın. Sarı yıldız = elektrofizyolojik kayıtlarda sinyal-gürültü oranını iyileştirmek için elektrot kurşun bağlantı bölgelerinin etrafına sarılmış alüminyum folyo. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Gırtlağı uzaktan görüntülemek için transoral endoskopi. (A) Dili hafif bir parmak tutuşu ile nazikçe geri çektikten sonra, endoskop dil ile merkezi kesici dişler arasına kırmızı yıldız konumunda (yani, endoskop şaftı ile anatomik hizalamayı korumak için geri çekilen dille aynı taraf) yerleştirilir. (B) Endoskop sert damağı geçtiğinde, (C) epiglot ve velum görünür hale gelir. (D) Glotisi görselleştirmek için, velum ve epiglot, velumun yüzeyine (resim C'deki siyah ana hatlı yıldızın konumunda) basınç uygulanarak "ayrılmalıdır". Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
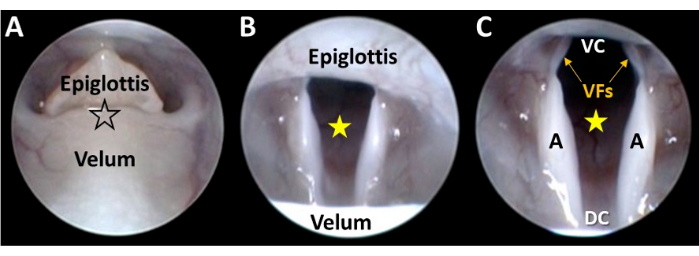
Şekil 5: Gırtlağın yakın çekim endoskopik görüntülemesi. (A) Endoskop ucu, ayrılmış velum ve epiglot (siyah çerçeveli yıldızın bulunduğu yerde) arasındaki mikromanipülatör kontrolü ile nazikçe yönlendirilir. Endoskop ilerledikçe, (B) gırtlak görünür hale gelir ve glottal boşluk (sarı yıldız) mikromanipülatör ayarlamaları ile kamera görüş alanında ortalanır. (C) Endoskopun devam eden mikromanipülatör ilerlemesi, gırtlağın tüm ventral-dorsal ve lateral boyutlarının görüntülenmesine neden olur. Kısaltmalar: VC = gırtlağın ventral komissürü (yani, vokal kıvrımlar arasındaki ventral birleşme noktası); DC = gırtlağın dorsal komissürü (yani, aritenoidler arasındaki dorsal birleşme noktası); VF'ler = ses telleri; A = aritenoid. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Solunum ve yutma sırasında murin gırtlağının görselleştirilmesi. Yetişkin bir Sprague Dawley sıçanında (AC) sağ RLN'nin cerrahi transeksiyonundan önce ve (DF) sonra nefes alma ve yutma sırasında laringeal hareketi gösteren temsili endoskopik görüntüler. Larinksin dinlenme duruşunun, RLN yaralanmasını takiben (A) taban çizgisine kıyasla değişmeden (D) göründüğünü unutmayın. (B,E) Maksimum inspirasyon sırasında, RLN yaralanmasını takiben laringeal asimetri belirginleşir. Başlangıçta gösterildiği gibi glottal boşluğu (sarı yıldız) genişletmek için her iki aritenoidin de kaçırılması yerine, (E) ipsilateral (sağ) aritenoid (siyah yıldız) ve vokal kıvrım, RLN hasarını takiben solunum döngüsü boyunca hareketsiz görünür. Yutma sırasında sağ taraflı asimetri de belirgindir. (C) Başlangıçta, aritenoidler yutma sırasında orta hatta yaklaşır ve vokal kıvrımlar arasında küçük bir ventral glottal boşluk bırakır. (F) RLN yaralanmasını takiben, ipsilateral aritenoid ve VF, yutma sırasında paradoksal olarak (yani, etkilenmeyen tarafla aynı yönde, kırmızı ok) hareket eder ve ventralden posterior laringeal komissürlere uzanan geniş bir glottal boşluk (sarı yıldız) bırakır. (F) Bu görüntü, iyatrojenik RLN hasarının bir sıçan modelinde bozulmuş laringeal hava yolu korumasının doğrudan kanıtını sağlar. (C,F) Gırtlağın yutma sırasında endoskopa daha yakın hareket ettiğini, epiglottis ve velumun artık kamera görüş alanında görünmediğini unutmayın. Siyah oklar normal gırtlak hareketinin yönünü gösterirken, kırmızı ok paradoksal hareketi gösterir; sarı yıldız = glottal boşluk. Kısaltmalar: VF'ler = ses telleri; A = aritenoid; RLN = tekrarlayan laringeal sinir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 7: İyatrojenik RLN hasarının bir sıçan modelinde solunum ve yutma sırasında laringeal disfonksiyonu araştırmak için seri laringoskopi kullanma. 4 aylık bir süre boyunca sekiz yetişkin Sprague-Dawley sıçanında laringeal hareket mesafesini ve yönünü tahmin etmek için -2 ile +2 arasında değişen bir Likert ölçeği kullanıldı. Başlangıç laringoskopisinden sonra, sıçanlara sağ RLN'yi kesmek için cerrahi bir prosedür uygulandı, ardından ameliyattan 1 hafta sonra seri laringoskopi, daha sonra ameliyattan 1 ila 4 ay sonra 1 aylık aralıklarla tekrar yapıldı. Sekiz sıçanın tümü prosedürden kurtuldu, böylece seri laringoskopi için anestezi rejimimizin etkinliğini gösterdi. (A) Videolar, solunum sırasında gırtlak hareketini ölçmek için gerçek zamanlı ve kare kare / yavaş harekette analiz edildi, burada 0 = hareket yok, 1 = biraz hareket ve 2 = etkilenen (sağ) tarafın sağlam (sol) tarafa kıyasla normal hareket mesafesi. (B) Yutma için, glottal boşluk boyutu şu şekilde tahmin edildi: 0 = glottal boşluk boyutunda azalma yok (ör., laringeal hava yolu koruması yok), 1 = bir miktar glottal boşluk azalması (ör., eksik hava yolu koruması) ve 2 = vokal kıvrımlar arasında sadece küçük bir ventral glottal boşluk ile aritenoidlerin tam addüksiyonu (yani, tam hava yolu koruması). Nefes alma ve yutma için negatif değerler, beklenenden zıt yönde gırtlak hareketini gösterir (ör., paradoksal). RLN yaralanmasını takiben hem nefes almanın hem de yutmanın olumsuz etkilendiğini unutmayın. İlginç bir şekilde, laringeal hava yolu koruması 1 WPS zaman noktasında (paradoksal da olsa) tamamlandı, ancak daha sonra daha da kötüleşti, koruma yokluğundan eksik korumaya kadar değişti. Kısaltmalar: WPS = ameliyat sonrası hafta; MPS = ameliyattan sonraki aylar; RLN = tekrarlayan laringeal sinir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8: Kemirgenlerde ISO tarafından inhibe edilen yutma. (A) ISO anestezisi altında laringoskopi yapılan bir kemirgenin, bu amaç için tasarlanmış özel ISO dağıtım sisteminin etiketli bileşenleriyle görüntüsü. Bu yenilikçi yaklaşımın önemli bir uyarısı, personelin ISO'ya maruz kalma riskidir. (B) Bu yaklaşımın bir başka dezavantajı, yutmanın ISO tarafından bastırılmasıdır. Bu yan yana kutu grafiği ve dağılım grafiği, yutmayı uyandırmak için sağ üst laringeal sinirin doğrudan elektriksel stimülasyonu uygulanan farelerde (grup başına 9) ISO ile KX anestezisinin etkisini karşılaştıran yayınlanmamış verileri özetlemektedir. Burada gösterilen, 20 s'lik 20 Hz stimülasyon ve ardından 10 s'lik dinlenmeden oluşan 5 dakikalık bir deneme sırasında uyandırılan kırlangıçların sayısıdır. KX ile karşılaştırıldığında, ISO ile anestezi uygulanan farelerde (% 2 kadar düşük) önemli ölçüde daha az yutma vardı (p < 0.001, bağımsız örnekler t-testi) ve yutma 4/9 farede bile kaldırıldı. Benzer bulgular hem fareler hem de sıçanlarla yapılan cerrahi olmayan deneylerden ortaya çıkmıştır (veriler gösterilmemiştir). Kısaltmalar: ISO = izofluran; KX = ketamin-ksilazin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 9: İzleme yazılımı kullanılarak murin laringeal hareketinin objektif olarak ölçülmesi. Şekil 6'daki Şekil 6'daki aynı görüntüler, RLN yaralanması sonrası ve başlangıçta bir sıçanda nefes almaya karşı yutmayı gösteren aynı görüntüler, özel yazılımımız tarafından eklenen laringeal hareket izleme çizgileri ile burada gösterilmektedir. Kalan video karelerinde sol (mavi çizgi) ve sağ (kırmızı çizgi) laringeal hareketin otomatik olarak izlenmesi için aritenoidlerin medial sınırı boyunca ilk video karesine izleme çizgileri manuel olarak eklendi. Özel yazılımımız tarafından 2,5 sn video kliplerden oluşturulan ilgili laringeal hareket grafikleri, (A, D) laringeal dinlenme duruşuna, (B, E) inspirasyon sırasında maksimum glottal boşluğa ve (C, F) yutma sırasında glottik kapanmaya karşılık gelen etiketlerle bireysel sol/sağ harekete karşı türetilmiş global laringeal hareketi gösterir. RLN yaralanması sonrası sağ tarafın (kırmızı oklar) paradoksal hareketine ve karşılık gelen türetilmiş küresel hareket grafiğinde gösterilen büyük glottal boşluğa dikkat edin. Temsili sonuç ölçütleri Tablo 1'de yer almaktadır. Kısaltma: RLN = tekrarlayan laringeal sinir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 10: Laringoskopi verileriyle korelasyon için elektrofizyoloji temelli sonuç ölçümleri. (A) Sağlıklı bir sıçan için solunum ve yutma sırasındaki elektrofizyoloji kayıtları gösterilmiştir. Üst pencere bir solunum izi (kemirgenin karnına bantlanmış bir solunum sensöründen), orta pencere genioglossus kasındaki EMG aktivitesini ve alt pencere filtrelenmiş EMG aktivitesini gösterir. Yutma olayları sırasında kesintiye uğrayan nefes alma sırasındaki ritmik solunum ve EMG paternine dikkat edin. Yutma olayları, solunum izindeki pürüzlü hareket (siyah oklar) ve hemen ardından kısa apne (kırmızı yıldız) ile kolayca tespit edilir. (B) A'daki kesikli dikdörtgen kutunun genişletilmiş bir penceresi, elektrofizyolojik kayıtlardan birkaç sonuç ölçümünün nasıl nicelleştirildiğini gösterir. (A) İnspirasyon sırasında (sarı paneller), solunum izinin (üst pencere), iki elektrofizyolojik yöntem arasındaki zamansal farklılıkları vurgulayan EMG patlama aktivitesine kıyasla ~ 150 ms (mavi çift ok) geciktiğini unutmayın. Temsili elektrofizyolojiye dayalı sonuç ölçümleri şunları içerir: 1) inspiratuar faz süresi (i); 2) solunumlar arası aralık (ii, solunum ve filtrelenmiş EMG kanalları yoluyla hesaplanır); eğrinin altındaki kırlangıç alanı (III); ve yutma apnesi (iv; solunum ve filtrelenmiş EMG kanalları aracılığıyla hesaplanır). Kısaltma: EMG = elektromiyografi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Sonuç Ölçütleri | Taban çizgisi | RLN Sonrası Yaralanma | |
| Nefes | Minimum glottal açı (derece) | 34.5 | 34.6 |
| Maksimum glottal açı (derece) | 52.9 | 49.9 | |
| Ortalama glottal açı (derece) | 43.7 | 42.2 | |
| Ortalama hareket aralığı oranı (MMRR) | 1.26 | 0.29 | |
| Açık kapalı döngü oranı (OCCR) | 1 | 0.11 | |
| Yutma | Laringeal addüksiyon (ms) | 200 | 233 |
| Glottik kapanma süresi (ms) | 67 | 0 | |
| Laringeal abdüksiyon (ms) | 233 | 67 | |
| Toplam yutma süresi (ms) | 500 | 300 | |
Tablo 1: Özel gırtlak izleme yazılımı tarafından otomatik olarak oluşturulan temsili sonuç ölçümleri. Kısaltma: RLN = tekrarlayan laringeal sinir.
Laringoskopi platformu hakkında ek metin. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Solunum ve yutma sırasında gırtlak hareketinin yakından görüntülenmesine izin veren, tekrarlanabilir bir murine özgü laringoskopi protokolünü başarıyla geliştirdik. Daha da önemlisi, protokol, çeşitli patolojik durumların özellikle laringeal fonksiyon üzerindeki etkisini incelemek için aynı hayvanlarda zaman içinde gerçekleştirilebilir. Bu protokol son on yılda geliştirildi ve yol boyunca önemli değişiklikler ve sorun giderme işlemlerinden geçti. Anestezi optimizasyonu, yutmayı ortadan kaldıran ve/veya solunum sıkıntısına bağlı mortalite riski taşıyan aşırı dozu önlemek için üstesinden gelinmesi gereken en büyük zorluktu. Başlangıçta ISO'yu kullandık, bu da yutmanın kaldırılması, aşırı tükürük üretimi (endoskopik görselleştirmeyi engelleyen) ve personelin maruz kalma riski ile sonuçlandı ve bu prosedür için ISO kullanımına karşı ciddi kontrendikasyonlar olarak kabul edildi. Bu nedenle, yaygın olarak kullanılan bir kemirgen anestezik 33,34,35 olduğu için KX'e odaklandık.
Bu amaç için potansiyel olarak uygun olan diğer endoskoplara kıyasla daha küçük şaft çapı (1.1 mm) nedeniyle sialendoskop kullanırken14,22,29,30,36 numaralı farelerle protokol geliştirmeye başladık. Daha da önemlisi, sialendoskopun başlangıçta laringeal adduktör refleksini14 uyandırmak/incelemek için hava darbeleri vermek için kullandığımız bir çalışma kanalı vardır. Bununla birlikte, laringeal adduktör refleksinin farelerde ve sıçanlarda, büyük olasılıkla genel anestezi ve / veya tekrarlanan hava darbesi dağıtımından mukozal kurumaya sekonder laringeal / faringeal duyu reseptörlerinin inaktivasyonu nedeniyle sıklıkla azaldığını / ortadan kalktığını bulduk. Çalışmalarımızda laringeal adduktor refleksi güvenilir bir şekilde uyandırılamasa da, yutma şaşırtıcı bir şekilde devam etti ve laringeal girişte / yakınında mekanik stimülasyon ile kolayca uyarıldı. Bu nedenle odağımızı mekanik olarak uyarılmış yutmanın endoskopik analizine çevirdik.
Bu süreçte, kırılmaya meyilli olan ve laringeal hareketi güvenilir bir şekilde görselleştirmek ve analiz etmek için yetersiz aydınlatma ve görüntü çözünürlüğüne sahip yarı sert sialendoskopu terk ettik. Çok sayıda alternatif endoskopun araştırılmasında, sonuçta hem farelerde hem de sıçanlarda laringoskopi için uygun olan spesifik bir otoskopa karar verdik. Deneyimlerimize dayanarak, murin laringoskopi için uygun bir endoskop seçerken en önemli özellik, yüksek kaliteli video çekimi için yeterince parlak ışığı iletebilen 2 mm'den daha küçük bir şaft çapıdır . Daha büyük çaplı endoskoplar, laringeal hareketin yakından görüntülenmesi için farelerde ve sıçanlarda laringeal girişten kolayca geçemez. Otoskoplar, mükemmel ışık geçirgenliği, sert / dayanıklı tasarımları ve diğer endoskop tiplerine (örneğin, sialendoskop, esnek endoskop) kıyasla nispeten düşük maliyetleri nedeniyle bu amaç için özellikle idealdir. Ek olarak, endoskopun manuel kontrolü sabit ellerde bir seçenek iken, mikromanipülatör kontrolünü bu laringoskopi protokolünün önemli bir özelliği olarak görüyoruz. Daha da önemlisi, endoskopun mikromanipülatör kontrolü, sonraki miktar tayini için tek bir araştırmacı tarafından laringeal hareketin stabil video kaydına izin verir. Bugüne kadar, bu otoskop tabanlı protokolü yetişkin fareler ve sıçanlarla başarıyla kullandık. Daha genç / daha küçük kemirgenlerle laringoskopi yapmak için daha küçük çaplı endoskop seçeneklerinin gerekli olacağından şüpheleniyoruz.
Laringoskopi protokolümüzün yeni bir avantajı, kemirgenlerde yutma sırasında hava yolu korumasını görselleştirme yeteneğidir, bu da glotsisin görünmesini engelleyen laringeal giriş üzerindeki epiglottik inversiyon nedeniyle insanlarda mümkün değildir. Bu nedenle kemirgenler, normal laringeal fonksiyonu etkili bir şekilde eski haline getirmek için tedavileri keşfetmek amacıyla normal ve patolojik laringeal hava yolu koruma mekanizmalarını spesifik olarak araştırmak için eşsiz bir fırsat sağlar. Bu murin laringoskopi protokolünün bu benzersiz yeteneği, şimdiye kadar geliştirdiğimiz/tanımladığımız çok sayıda kemirgen disfaji modelinde aspirasyonu tespit edemeyen videofloroskopiye (yani, disfaji için diğer "altın standart" test) göre büyük bir avantajdır 30,36,37,38,39,40. Bu negatif VFSS bazlı bulgu, transoral endoskopi yaklaşımımızla görülebilen kemirgenlerin üst solunum yolundaki çeşitli anatomik farklılıklara bağlanabilir. İlk olarak, kemirgen gırtlağı, nazofarenkste yüksekte konumlandırılır ve burada sıkıca bağlanmış bir epiglott ve çıkmaz bir ağız boşluğu oluşturan velum ile gizlenir. Ek olarak, istirahat halindeki epiglot, velumun üzerindeki mukozal bir kılıfın altında sıkışır. Bu anatomik konfigürasyon, kemirgenlerin zorunlu burun solunumu yapmasına neden olur; Bu nedenle, uyanık kemirgenlerde ağızdan nefes almak, solunum morbiditesinin bir işaretidir. Bununla birlikte, sağlıklı kemirgenlerde yutma sırasında, epiglot mukozal kılıftan dışarı kayar ve gırtlak nazofarenksin içine doğru yükselirken, bolus yolunun dışına çıkarken gırtlak girişi üzerinde ters döner. Bu dinamik üst solunum yolu olayları, sağlıklı kemirgenlerde ve laringeal disfonksiyon modellerinde laringoskopi yoluyla doğrudan görüntülenebilir / değerlendirilebilir.
Daha da önemlisi, VFSS testi sırasında aspirasyon yapılmamasına rağmen, kemirgen modellerinin (ör., iyatrojenik RLN yaralanması) gerçekten de disfaji ile ilişkili aspirasyonu olan insan hastalara translasyonel olan laringoskopi yoluyla laringeal hava yolu korumasının bozulduğuna dair kanıt gösterdiğini gösterdik. Bu nedenle, bu murin laringoskopi protokolü, şu anda hala zor olan hava yolu koruma mekanizmalarını ve hedefe yönelik tedavileri spesifik olarak araştırmak için yararlı bir translasyonel platform sağlar. Bu hedefe ulaşmak, yutmayı uyandırmak için laringeal/faringeal mukozanın kalibre edilmemiş mekanik stimülasyonunu sağlamak için endoskop ucunu kullanan mevcut yöntemimizin daha da geliştirilmesini/optimizasyonunu gerektirecektir. Üstün laringeal sinirin32,41 doğrudan elektriksel stimülasyonu ve laringeal/faringeal mukozanın kimyasal (örneğin, sitrik asit42) stimülasyonu dahil olmak üzere, yutmayı uyarmak için daha titiz, hassas kontrollü yöntemler şu anda laboratuvarımızda araştırılmaktadır. Bu protokolün ek bir sınırlaması, uyanık ve doğal beslenme davranışını taklit etmeyen kemirgenlerin sırtüstü konumlandırılmasıdır. İlk protokol geliştirme, sınırlı mandibular hareketle sonuçlanan ve aynı zamanda ağız boşluğunun görünürlüğünü sınırlayan ve endoskop geçişini belirgin şekilde engelleyen yüzüstü pozisyonlamayı içeriyordu. Hipofarenkste bulunan endoskop ucu ile gırtlağı belli bir mesafeden görüntülemek mümkündür; Bununla birlikte, bu yaklaşım tipik olarak gırtlağın daha iyi görselleştirilmesi için epiglottis, velum ve/veya dilin manuel olarak geri çekilmesini gerektirir. Bu amaç için çeşitli özel manuel geri çekme cihazları ürettik (örneğin, modifiye otoskop spekulusu, modifiye pipet uçları). Bununla birlikte, gırtlağın bazı kısımları tipik olarak görünmez kalır ve geri çekme cihazları gırtlak hareketini kısıtlayabilir, bu da işlev bozukluğu ile karıştırılabilir. Ayrıca, endoskopi platformunun son ek özellikleri (örneğin, Trendelenburg eğimi ve çene hareketine uyum sağlamak için kulak çubukları arasında bir kesik) yüzüstü pozisyonda kemirgenlerin test edilmesini kolaylaştırabilir. Kulak çubukları ve ek ısı, laringoskopi protokolünün gerekli özellikleridir. Kulak bantları, endoskopun transoral manipülasyonu sırasında başın hareket etmesini önler. Homeotermik bir ısıtma sistemi, stabil anesteziyi teşvik etmek ve prosedür boyunca hipotermiyi önlemek için vücut ısısını 36 °C ile 38 °C arasında tutar.
Artık kemirgenlerde nefes alma ve yutma sırasında gırtlak hareketini güvenilir bir şekilde videoya kaydetmek için metodoloji mevcut olduğundan, yüksek verimli miktar tayini önemli bir sonraki adımdır. Bu nedenle, özel yazılımımız tarafından oluşturulan hangi sonuç ölçümünün sağlıklı durumları hastalık koşullarından en iyi şekilde ayırt edebileceğini belirlemek ve aynı zamanda doğal hastalık ilerlemesine veya tedavi müdahalelerine yanıt olarak zaman içindeki değişiklikleri tespit etmek için video analiz çalışmalarımız devam etmektedir. En iyi adaylar, video görüntüleme analizini hızlandırmak için sonraki makine öğrenimi yaklaşımlarının odak noktası olacaktır. Daha da önemlisi, yetersiz görüntü kalitesi durumları (örneğin, yetersiz aydınlatma, görüş alanı dışındaki anatomik yapılar, gırtlak yapılarını gizleyen aşırı salgılar vb.) şu anda gırtlak takibi için uygun değildir; Ancak, bu engel gelecekte makine öğrenimi araçları aracılığıyla aşılabilir. O zamana kadar, gırtlak izleme analizi kriterlerini karşılayan video kare dizilerinin dikkatli bir şekilde seçilmesi (protokol bölüm 5'te açıklandığı gibi) çok önemlidir.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma kısmen iki NIH hibesi ile finanse edildi: 1) Ulusal Kalp, Akciğer ve Kan Enstitüsü'nden (NHLBI) çoklu PI (TL ve NN) R01 hibesi (HL153612) ve 2) Ulusal Sağırlık ve Diğer İletişim Bozuklukları Enstitüsü'nden (NIDCD) bir R03 hibesi (TL, DC0110895). Özel gırtlak hareket izleme yazılımı geliştirmemiz kısmen Coulter Vakfı hibesi (TL ve Filiz Bunyak) tarafından finanse edildi. Kate Osman, Chloe Baker, Kennedy Hoelscher ve Zola Stephenson'a laboratuvar kemirgenlerimize mükemmel bakım sağladıkları için teşekkür ederiz. Ayrıca, MU Fizik Makine Atölyesi'nden Roderic, Schlotzhauer ve Cheston Callais'e, özel endoskopi platformumuzun tasarımı, girdisi ve üretimi ve araştırma ihtiyaçlarımızı karşılamak için ticari endoskoplar ve mikromanipülatörlerde stratejik değişiklikler için teşekkür ederiz. Özel gırtlak hareket izleme yazılımımız, Dr. Filiz Bunyak ve Dr. Ali Hamad (MÜ Elektrik Mühendisliği ve Bilgisayar Bilimleri Bölümü) ile işbirliği içinde geliştirilmiştir. Ayrıca otoskop seçimi konusunda rehberlik sağladığı için Karl Storz Endoskopi'den Jim Marnatti'ye teşekkür ederiz. Son olarak, mevcut murin laringoskopi protokolümüzün geliştirilmesine katkıları sağlayan Lever Lab'daki çok sayıda önceki öğrenciyi/kursiyeri tanımak istiyoruz: Marlena Szewczyk, Cameron Hinkel, Abigail Rovnak, Bridget Hopewell, Leslie Shock, Ian Deninger, Chandler Haxton, Murphy Mastin ve Daniel Shu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Atipamezole | Zoetis | Antisedan; 5 mg/mL | Parsippany-Troy Hills, NJ |
| Bioamplifier | Warner Instrument Corp. | DP-304 | Hamden, CT |
| Concentric EMG needle electrode | Chalgren Enterprises, Inc. | 231-025-24TP; 25 mm x 0.3 mm/30 G | Gilroy, CA |
| Cotton tipped applicator (tapered) | Puritan Medical Products | REF 25-826 5W | Guilford, ME |
| Data Acquisition System | ADInstruments | PowerLab 8/30 | Colorado Springs, CO |
| DC Temperature Control System - for endoscopy platform | FHC, Inc. | 40-90-8D | Bowdoin, ME |
| Electrophysiology recording software | ADInstruments | LabChart 8 with video capture module | Colorado Springs, CO |
| Endoscope monitor | Karl Storz Endoscopy-America | Storz Tele Pack X monitor | El Segundo, CA |
| Glycopyrrolate | Piramal Critical Care | NDC 66794-204-02; 0.2 mg/mL | Bethlehem, PA |
| Ground electrode | Consolidated Neuro Supply, Inc. | 27 gauge stainless steel, #S43-438 | Loveland, OH |
| Isoflurane induction chamber | Braintree Scientific, Inc. | Gas Anesthetizing Box - Red | Braintree, MA |
| Ketamine hydrochloride | Covetrus North America | NDC 11695-0703-1, 100 mg/mL | Dublin, OH |
| Metal spatula to decouple epiglottis and velum | Fine Science Tools | Item No. 10091-12; | Foster City, CA |
| Micro-brush to remove food/secretions from oral cavity | Safeco Dental Supply | REF 285-0023, 1.5 mm | Buffalo Grove, IL |
| Mouse-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2-07 – 5 x 12.5 cm Heating Pad | Bowdoin, ME |
| Ophthalmic ointment (sterile) | Allergan, Inc. | Refresh Lacri-lube | Irvine, CA |
| Otoscope | Karl Storz | REF 1232AA | El Segundo, CA |
| Pneumogram Sensor | BIOPAC Systems, Inc. | RX110 | Goleta, CA |
| Pulse oximetry - Vetcorder Pro Veterinary Monitor | Sentier HC, LLC | Part No. 710-1750 | Waukesha, WI |
| Rat-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2 – 12.5X25cm Heating Pad | Bowdoin, ME |
| Sterile needles for drug injections | Becton, Dickinson and Company | REF 305110, 26 G x 3/8 inch, PrecisionGlide | Franklin Lakes, NJ |
| Sterile syringes for drug injections | Becton, Dickinson and Company | REF 309628; 1 mL, Luer-Lok tip | Franklin Lakes, NJ |
| Surgical drape to cover induction cage for dark environment | Covidien LP | Argyle Surgical Drape Material, Single Ply | Minneapolis, MN |
| Surgical tape to secure pneumograph sensor to abdomen | 3M Health Care | #1527-0, 1/2 inch | St. Paul, MN |
| Transparent blanket for thermoregulation | The Glad Products Company | Press’n Seal Cling Film | Oakland, CA |
| Video editing software | Pinnacle Systems, Inc. | Pinnacle Studio, v24 | Mountain View, CA |
| Water circulating heating pad - for anesthesia induction/recovery station | Adroit Medical Systems | HTP-1500 Heat Therapy Pump | Loudon, TN |
| Xylazine | Vet One | NDC 13985-701-10; Anased, 100 mg/mL | Boise, ID |
Referanslar
- Brunner, E., Friedrich, G., Kiesler, K., Chibidziura-Priesching, J., Gugatschka, M. Subjective breathing impairment in unilateral vocal fold paralysis. Folia Phoniatr Logop. 63 (3), 142-146 (2011).
- Chandrasekhar, S. S., et al. Clinical practice guideline: improving voice outcomes after thyroid surgery. Otolaryngol Head Neck Surg. 148 (6 Suppl), S1-S37 (2013).
- Fang, T. J., et al. Quality of life measures and predictors for adults with unilateral vocal cord paralysis. Laryngoscope. 118 (10), 1837-1841 (2008).
- Wang, W., et al. Laryngeal reinnervation using ansa cervicalis for thyroid surgery-related unilateral vocal fold paralysis: a long-term outcome analysis of 237 cases. PLoS One. 6 (4), e19128 (2011).
- Cohen, S. M., et al. Association between dysphagia and inpatient outcomes across frailty level among patients >/= 50 years of age. Dysphagia. 35 (5), 787-797 (2020).
- Poulsen, S. H., et al. Signs of dysphagia and associated outcomes regarding mortality, length of hospital stay and readmissions in acute geriatric patients: Observational prospective study. Clin Nutr ESPEN. 45, 412-419 (2021).
- Lin, R. J., Smith, L. J., Munin, M. C., Sridharan, S., Rosen, C. A. Innervation status in chronic vocal fold paralysis and implications for laryngeal reinnervation. Laryngoscope. 128 (7), 1628-1633 (2018).
- Choi, J. S., et al. Functional regeneration of recurrent laryngeal nerve injury during thyroid surgery using an asymmetrically porous nerve guide conduit in an animal model. Thyroid. 24 (1), 52-59 (2014).
- Wang, B., et al. Neurotrophin expression and laryngeal muscle pathophysiology following recurrent laryngeal nerve transection. Mol Med Rep. 13 (2), 1234-1242 (2016).
- Woodson, G., Randolph, G. W. Pathophysiology of recurrent laryngeal nerve injury. Surgery of the Thyroid and Parathyroid Glands (Third Edition). , 404-409.e2 (2021).
- James, M., Palmer, O. Instrumentation and techniques for examination of the ear, nose, throat, and sinus. Oral Maxillofac Surg Clin North Am. 24 (2), 167-174 (2012).
- Patel, R. R., et al. Recommended protocols for instrumental assessment of voice: American Speech-Language-Hearing Association Expert Panel to develop a protocol for instrumental assessment of vocal function. Am J Speech Lang Pathol. 27 (3), 887-905 (2018).
- Kamarunas, E. E., McCullough, G. H., Guidry, T. J., Mennemeier, M., Schluterman, K. Effects of topical nasal anesthetic on fiberoptic endoscopic examination of swallowing with sensory testing (FEESST). Dysphagia. 29 (1), 33-43 (2014).
- Shock, L. A., et al. Improving the utility of laryngeal adductor reflex testing: a translational tale of mice and men. Otolaryngol Head Neck Surg. 153 (1), 94-101 (2015).
- Aviv, J. E., et al. Laryngopharyngeal sensory discrimination testing and the laryngeal adductor reflex. Ann Otol Rhinol Laryngol. 108 (8), 725-730 (1999).
- Farneti, D. The instrumental gold standard: fees. J Gastroenterol Hepatol Res. 3, 1281-1291 (2014).
- Hernandez-Morato, I., et al. Reorganization of laryngeal motoneurons after crush injury in the recurrent laryngeal nerve of the rat. J Anat. 222 (4), 451-461 (2013).
- Hernandez-Morato, I., Sharma, S., Pitman, M. J. Changes in neurotrophic factors of adult rat laryngeal muscles during nerve regeneration. Neuroscience. 333, 44-53 (2016).
- Tessema, B., et al. Evaluation of functional recovery of recurrent laryngeal nerve using transoral laryngeal bipolar electromyography: a rat model. Ann Otol Rhinol Laryngol. 117 (8), 604-608 (2008).
- Tessema, B., et al. Observations of recurrent laryngeal nerve injury and recovery using a rat model. Laryngoscope. 119 (8), 1644-1651 (2009).
- Monaco, G. N., et al. Electrical stimulation and testosterone enhance recovery from recurrent laryngeal nerve crush. Restor Neurol Neurosci. 33 (4), 571-578 (2015).
- Haney, M. M., Hamad, A., Leary, E., Bunyak, F., Lever, T. E. Automated quantification of vocal fold motion in a recurrent laryngeal nerve injury mouse model. Laryngoscope. 129 (7), E247-E254 (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Wang, B., et al. Functional regeneration of the transected recurrent laryngeal nerve using a collagen scaffold loaded with laminin and laminin-binding BDNF and GDNF. Sci Rep. 6, 32292 (2016).
- Hamad, A., Haney, M. M., Lever, T. E., Bunyak, F. Automated segmentation of the vocal folds in laryngeal endoscopy videos using deep convolutional regression networks. , 140-148 (2019).
- Wang, Y. Y., Hamad, A. S., Palaniappan, K., Lever, T. E., Bunyak, F. LARNet-STC: Spatio-temporal orthogonal region selection network for laryngeal closure detection in endoscopy videos. Comput Biol Med. 144, 105339 (2022).
- Lever, T. E., et al. Advancing laryngeal adductor reflex testing beyond sensory threshold detection. Dysphagia. 37 (5), 1151-1171 (2022).
- Wang, Y. Y., Hamad, A. S., Lever, T. E., Bunyak, F. Orthogonal region selection network for laryngeal closure detection in laryngoscopy videos. Annu Int Conf IEEE Eng Med Biol Soc. 2020, 2167-2172 (2020).
- Haney, M. M., et al. Recurrent laryngeal nerve transection in mice results in translational upper airway dysfunction. J Comp Neurol. 528 (4), 574-596 (2020).
- Mok, A., et al. A surgical mouse model for advancing laryngeal nerve regeneration strategies. Dysphagia. 35 (3), 419-437 (2020).
- Haney, M. M., Ericsson, A. C., Lever, T. E. Effects of intraoperative vagal nerve stimulation on the gastrointestinal microbiome in a mouse model of amyotrophic lateral sclerosis. Comp Med. 68 (6), 452-460 (2018).
- Lever, T. E., et al. A mouse model of pharyngeal dysphagia in amyotrophic lateral sclerosis. Dysphagia. 25 (2), 112-126 (2010).
- Struck, M. B., Andrutis, K. A., Ramirez, H. E., Battles, A. H. Effect of a short-term fast on ketamine-xylazine anesthesia in rats. J Am Assoc Lab Anim Sci. 50 (3), 344-348 (2011).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress. Altern Lab Anim. 33 (2), 119-127 (2005).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Welby, L., Maynard, T., Zohn, I., Lever, T. Fluoroscopic and endoscopic investigation of dysphagia in a mouse model of DiGeorge syndrome. Dysphagia. 34, 1003-1004 (2019).
- Mueller, M., et al. Impact of limb phenotype on tongue denervation atrophy, dysphagia penetrance, and survival time in a mouse model of ALS. Dysphagia. 37 (6), 1777-1795 (2022).
- Osman, K. L., et al. Optimizing the translational value of mouse models of ALS for dysphagia therapeutic discovery. Dysphagia. 35 (2), 343-359 (2020).
- Lever, T. E., et al. Videofluoroscopic validation of a translational murine model of presbyphagia. Dysphagia. 30, 328-342 (2015).
- Lever, T. E., et al. Adapting human videofluoroscopic swallow study methods to detect and characterize dysphagia in murine disease models. J Vis Exp. (97), 52319 (2015).
- Ballenger, B., et al. Targeted electrical stimulation of the superior laryngeal nerve - a potential treatment for dysphagia in ALS. FASEB J. 36 (S1), (2022).
- Kloepper, A., et al. An experimental swallow evoked potential protocol to investigate the neural substrates of swallowing. OTO Open. 4 (1), (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır