Method Article
לרינגוסקופיה זעיר פולשנית של עכברים להדמיה מקרוב של תנועת הגרון במהלך נשימה ובליעה
In This Article
Summary
פרוטוקול זה מתאר גישת לרינגוסקופיה טרנס-אוראלית סדרתית לעכברים וחולדות המאפשרת הדמיית וידאו מקרוב וללא הפרעה של הגרון במהלך הנשימה והבליעה באמצעות משטר הרדמה אופטימלי וטכניקות מניפולציה אנדוסקופיות מכווננות היטב.
Abstract
הגרון הוא איבר חיוני ביונקים עם שלושה תפקידים עיקריים - נשימה, בליעה וקול. ידוע כי מגוון רחב של הפרעות פוגעות בתפקוד הגרון, מה שגורם לקשיי נשימה (קוצר נשימה), ליקוי בבליעה (דיספגיה) ו/או ליקוי קול (דיספוניה). דיספגיה, במיוחד, עלולה להוביל לדלקת ריאות שאיפה ותחלואה נלווית, אשפוזים חוזרים ותמותה מוקדמת. למרות ההשלכות החמורות הללו, הטיפולים הקיימים לתפקוד לקוי של הגרון מכוונים בעיקר להתערבויות כירורגיות והתנהגותיות שלמרבה הצער אינן משחזרות בדרך כלל את תפקוד הגרון התקין, ובכך מדגישות את הצורך הדחוף בפתרונות חדשניים.
כדי לגשר על הפער הזה, פיתחנו גישה אנדוסקופית ניסיונית לחקירת תפקוד לקוי של הגרון במודלים של עכברים (כלומר, עכברים וחולדות). עם זאת, אנדוסקופיה במכרסמים היא מאתגרת למדי בשל גודלם הקטן ביחס לטכנולוגיית האנדוסקופ הנוכחית, הבדלים אנטומיים בדרכי הנשימה העליונות והצורך בהרדמה כדי לגשת בצורה אופטימלית לגרון. כאן, אנו מתארים גישה חדשה של לרינגוסקופיה טרנס-אוראלית המאפשרת הדמיית וידאו מקרוב וללא הפרעה של תנועת הגרון בעכברים וחולדות. השלבים הקריטיים בפרוטוקול כוללים ניהול הרדמה מדויק (למניעת מנת יתר שמבטלת את הבליעה ו/או מסתכנת בתמותה הקשורה למצוקה נשימתית) ובקרת מיקרומניפולטור של האנדוסקופ (להקלטת וידאו יציבה של תנועת הגרון על ידי חוקר יחיד לכימות לאחר מכן).
חשוב לציין, ניתן לבצע את הפרוטוקול לאורך זמן באותם בעלי חיים כדי לחקור את ההשפעה של מצבים פתולוגיים שונים במיוחד על תפקוד הגרון. יתרון חדש של פרוטוקול זה הוא היכולת לדמיין הגנה על דרכי הנשימה במהלך הבליעה, דבר שאינו אפשרי בבני אדם עקב היפוך אפיגלוטי מעל כניסת הגרון החוסם את הגלוטיס מהעין. לכן מכרסמים מספקים הזדמנות ייחודית לחקור באופן ספציפי את המנגנונים של הגנה נורמלית לעומת פתולוגית על דרכי הנשימה של הגרון למטרה הסופית של גילוי טיפולים לשיקום יעיל של תפקוד גרון תקין.
Introduction
הגרון הוא איבר סחוסי הממוקם בצומת דרכי הנשימה והעיכול בגרון, שם הוא מתפקד כמנגנון שסתום לשליטה מדויקת על זרימת וכיוון האוויר (כלומר, במהלך נשימה וקול) לעומת מזון ונוזל (כלומר, בזמן בליעה). ידוע על מגוון רחב של הפרעות המשפיעות על הגרון, כולל מולדות (למשל, גרון, היצרות תת-גלוטית), ניאופלסטית (למשל, פפילומטוזיס גרון, קרצינומה של תאי קשקש), נוירולוגיות (למשל, שיתוק גרון אידיופטי שבץ מוחי, מחלת פרקינסון, טרשת אמיוטרופית צידית) ויאטרוגנית (למשל, פציעה לא מכוונת במהלך ניתוח ראש או צוואר). ללא קשר לאטיולוגיה, תפקוד לקוי של הגרון גורם בדרך כלל לשלישיית תסמינים של קוצר נשימה (קשיי נשימה), דיספוניה (ליקוי קול) ודיספגיה (ליקוי בליעה) המשפיעים לרעה על הרווחה הכלכלית והחברתית של האדם 1,2,3,4.
יתר על כן, דיספגיה, במיוחד אצל אנשים שבריריים מבחינה רפואית, עלולה להוביל לדלקת ריאות שאיפה (עקב בריחת מזון או נוזל דרך גרון לא סגור לחלוטין לריאות) ותחלואה נלווית, אשפוזים חוזרים ותמותה מוקדמת 5,6. למרות ההשלכות החמורות הללו, הטיפולים הקיימים לתפקוד לקוי של הגרון מכוונים בעיקר להתערבויות כירורגיות והתנהגותיות שבדרך כלל אינן משחזרות את תפקוד הגרון התקין 1,2,7,8,9,10, ובכך מדגישות את הצורך הדחוף בפתרונות חדשניים. לקראת מטרה זו, פיתחנו גישה אנדוסקופית ניסיונית לחקירת תפקוד לקוי של הגרון במודלים של עכברים (כלומר, עכברים וחולדות).
ברפואה האנושית, תקן הזהב להערכת תפקוד לקוי של הגרון הוא הדמיה אנדוסקופית, המכונה לרינגוסקופיה11,12. בדרך כלל, אנדוסקופ גמיש מועבר דרך האף כדי לבחון את הגרון, במיוחד את קפלי הקול ומבני הגרון הסופרגלוטיים והתת-גלוטיים הסמוכים. ניתן להשתמש באנדוסקופ קשיח גם כדי לדמיין את הגרון דרך חלל הפה. כל אחת מהגישות מאפשרת בדיקה גסה של אנטומיה של הגרון וניתן להשתמש בה כדי להעריך את הניידות והתפקוד של הגרון במהלך נשימה, פונציה ומגוון רפלקסים המגנים על דרכי הנשימה כגון שיעול ורפלקס מקרב הגרון 13,14,15,16. במהלך הבליעה, לעומת זאת, הגרון מוסתר לחלוטין על ידי האפיגלוטיס כשהוא מתהפך כדי לכסות את הכניסה לגרון, ומגן עליו מפני נתיב בולוס המזון/נוזל הנבלע. כתוצאה מכך, הדמיה ישירה של תנועת הגרון במהלך הבליעה אינה אפשרית בבני אדם ולכן יש להסיק אותה בעקיפין באמצעות גישות אבחון אחרות (למשל, פלואורוסקופיה, אלקטרומיוגרפיה, אלקטרוגלוטוגרפיה).
מאמר זה מתאר פרוטוקול לרינגוסקופיה חדשני לעכברים וחולדות המאפשר הדמיה מקרוב וללא הפרעה של הנשימה והגנה על דרכי הנשימה במהלך בליעה בהרדמה קלה. הפרוטוקול תואם למגוון מערכות אנדוסקופיה זמינות מסחרית בשילוב עם פלטפורמה מותאמת אישית לשיתוק המכרסם המורדם לאורך כל ההליך. חשוב לציין, עיצובים/תצורות רבות של פלטפורמות אנדוסקופיה אכן אפשריים, בהתאם למשאבים הזמינים ולאג'נדה המחקרית של כל מעבדה. כוונתנו כאן היא לספק הנחיות לחוקרים לשקול בהקשר של המחקר שלהם. יתר על כן, אנו שואפים להדגים כיצד פרוטוקול לרינגוסקופיה זה יכול להוביל לשפע של נתונים אובייקטיביים שעשויים לעורר תובנות חדשות לגבי הבנתנו את תפקוד הגרון והתחדשותו.
ההשפעה המשולבת של כל השלבים המתוארים בפרוטוקול לרינגוסקופיה עכברי זה מביאה לבדיקה זעיר פולשנית של גרון העכברים הבוגר שניתן לחזור עליה באותם בעלי חיים כדי לזהות ולאפיין תפקוד לקוי של הגרון לאורך זמן בתגובה לפגיעה יאטרוגנית, התקדמות המחלה ו/או התערבות טיפולית ביחס להגנה על דרכי הנשימה. יש לציין כי פרוטוקול זה אינו מעריך את תפקוד הגרון הקשור לקול.
Protocol
פרוטוקול לרינגוסקופיה של עכברים עוקב אחר פרוטוקול מאושר של הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) והנחיות המכונים הלאומיים לבריאות (NIH). הוא פותח לשימוש עם למעלה מ-100 עכברי C57BL/6J בוגרים ולמעלה מ-50 חולדות ספראג דולי בוגרות, בערך מינים שווים ובני 6 שבועות עד 12 חודשים לשני המינים. יש צורך בפיתוח פרוטוקול נוסף להתאמה למכרסמים צעירים/קטנים יותר. בעלי החיים שוכנו בקבוצה (עד ארבעה עכברים או שתי חולדות בכלוב, בהתבסס על מין והמלטה). תנאי הוויווריום הסטנדרטיים כללו כלוב סטטי עם ויסות קפדני של טמפרטורת הסביבה (20-26 מעלות צלזיוס), לחות (30%-70%) ומחזור אור סטנדרטי של 12 שעות. כל בעלי החיים קיבלו חומרי העשרה טריים (למשל, צריף/צינור, חטיפים דנטליים, נסטלט) בהחלפת כלובים שבועית. ניתנה גישה בלתי מוגבלת למזון ולמים, למעט במהלך הגבלת מזון קצרה (עד 4-6 שעות) לפני הרדמה, כמתואר להלן. צוות וטרינרי ומחקר עקבו אחר בעלי החיים מדי יום.
1. הרדמה לבעלי חיים שאינה מבטלת את הבליעה
- ללבוש ציוד מגן אישי מתאים (למשל, כפפות, מסכה) כדי למזער את החשיפה לאלרגנים בזמן עבודה עם מכרסמים.
- הגבל מזון לכל כלוב מכרסמים עד 4-6 שעות לפני ההרדמה כדי למזער את החזקת המזון בחלל הפה ובלוע, מה שעלול להפריע להדמיה אנדוסקופית ו/או לגרום לשאיבת מזון במהלך ההליך.
הערה: אגירת מזון בחלל הפה היא ממצא נורמלי במכרסמים ללא דיספגיה אם הם לא הוגבלו במזון. - הכינו "תחנת חימום" לאינדוקציה/התאוששות של בעלי החיים.
- יש לחמם מראש כרית חימום במחזור מים ל-37 מעלות צלזיוס על משטח ספסל.
- בחר כלובי אינדוקציה/התאוששות בגודל מתאים עבור המין הנבדק. לדוגמה, כלובי קופסאות נעליים של עכברים עם מכסים עליונים של מסנן הם בגודל מתאים לאינדוקציה/התאוששות של עכברים וחולדות. השתמש בכלוב אינדוקציה/התאוששות טרי עבור כל בעל חיים שנבדק; השתמש בכלוב יחיד גם ככלוב האינדוקציה וגם ככלוב ההתאוששות לאותה חיה.
- רפדו את רצפת כלוב האינדוקציה/התאוששות בשכבה קלה של חומר סופג (למשל, שבבי אספן, מגבת נייר, כרית גור) לחום וספיגת הפרשות הגוף במהלך השראת ההרדמה וההתאוששות.
- הנח את הכלובים המוכנים (עם מכסים עליונים מסננים) במלואם על כרית החימום למשך 30-60 דקות לפני השראת ההרדמה.
הערה: מיקרו-סביבה זו מספקת חום משלים מספיק כדי לקדם חילוף חומרים יציב בהרדמה במהלך האינדוקציה וההתאוששות.
- הנח את כלוב הבית של בעל החיים באמצע הדרך על כרית החימום שחוממה מראש ל-37 מעלות צלזיוס למשך כ-30 דקות לפני השראת ההרדמה.
הערה: מתן חום משלים לפני ההליך עשוי לזרז את השראת ההרדמה ולמנוע מנת יתר בשוגג עקב חילוף חומרים איטי/מושהה בהרדמה מהיפותרמיה. - הכן הרדמת קטמין-קסילזין (KX) על סמך המין ומשקל הגוף.
- לעכברים: תערובת של 90 מ"ג/ק"ג קטמין ו-11 מ"ג/ק"ג קסילזין מספיקה לרינגוסקופיה טרנס-אוראלית בעכברי רקע C57BL/6 בוגרים משני המינים. התאם את המינונים לזני עכברים אחרים ולגילאים אחרים.
- לחולדות: תערובת של 60 מ"ג/ק"ג קטמין ו-6 מ"ג/ק"ג קסילזין מספיקה לרינגוסקופיה טרנס-אוראלית בחולדות ספראג דולי בוגרות משני המינים. התאם את המינונים לזנים אחרים של חולדות ולגילאים אחרים.
- מחממים מראש את חומרי ההרדמה המלאים במזרק בתחנת החימום של 37 מעלות צלזיוס כדי למנוע אובדן חום בבעלי החיים המתרחש בעת הזרקת נוזלים קרים.
- הזריק למכרסם את מינון ה-KX המחושב באמצעות מזרק בגודל מתאים (למשל, 1 מ"ל) ומחט (למשל, 26 G1/2).
- לעכברים: יש לתת זריקה תת עורית אחת (SC).
הערה: מניסיוננו, זריקות SC בעכברים מפחיתות / מבטלות תמותה הקשורה להרדמה בהשוואה לזריקות תוך-צפקיות (IP). - לחולדות: תן זריקת SC או IP אחת. אם מעדיפים, יש להרגיע חולדות עם איזופלורן (ISO) (3-5%) בתא אינדוקציה מיד לפני הזרקת KX.
הערה: תנועת גוף ספונטנית עשויה להתחדש לתקופה קצרה (בדרך כלל <דקה אחת) עד שה-KX נכנס לתוקף.
- לעכברים: יש לתת זריקה תת עורית אחת (SC).
- מתן גליקופירולאט (חומר אנטיכולינרגי ) מיד לאחר הזרקת KX כדי להפחית הפרשות רוק עודפות שעלולות לעכב את ההדמיה של הגרון במהלך אנדוסקופיה טרנסאורלית ו/או לחסום מכנית את דרכי הנשימה העליונות במהלך התאוששות ההרדמה.
הערה: המינון ומסלול האספקה זהים עבור עכברים וחולדות (0.01-0.02 מ"ג/ק"ג SC), וההשפעה היא כמעט מיידית ונמשכת מספר שעות. - לאחר הזרקת גליקופירולאט, הניחו את המכרסם המורדם בכלוב האינדוקציה שחומם מראש בתחנת החימום וכסו את הכלוב בווילון כירורגי כדי לספק סביבה חשוכה הממזערת את הגירוי החזותי למשך 10 דקות, ללא הפרעה.
- הפסק את ההליך אם המכרסם נשאר אמבולטורי 10 דקות לאחר מינון ה-KX הראשוני.
הערה: ניסיונות לספק הרדמה נוספת (תחזוקת KX או קטמין) ככל הנראה יהיו חסרי תועלת.
- הפסק את ההליך אם המכרסם נשאר אמבולטורי 10 דקות לאחר מינון ה-KX הראשוני.
- לאחר 10 דקות, יש לתת מינון תחזוקה של קטמין (1/4 מהמינון הראשוני אם הרפלקסים בגפיים האחוריות מופחתים או 1/2 מהמינון הראשוני אם רפלקסים בגפיים האחוריות נמרצים; SC לעכברים ו- SC / IP לחולדות) לשמירה על הרדמה.
- מרחו משחה עיניים על שתי העיניים כדי למנוע התייבשות בקרנית וטראומה נלווית במהלך הליך הלרינגוסקופיה.
- העבר את המכרסם המורדם לפלטפורמת אנדוסקופיה מותאמת אישית כדי להתחיל בהליך הלרינגוסקופיה.
הערה: תכננו את פלטפורמת האנדוסקופיה שלנו (איור 1) כך שיהיו לה פונקציות מרובות לשימוש עם מגוון גישות כירורגיות ואלקטרופיזיולוגיות של מכרסמים שאינן דורשות בהכרח אנדוסקופיה. ככזה, הוא בנוי יתר על המידה לשימוש אנדוסקופי גרידא. במידת הצורך, נדגיש תכונות/רכיבים החיוניים לפרוטוקול לרינגוסקופיה זה. - מנקודה זו ואילך, בדוק את הרפלקסים של הגפיים האחוריות כל 15-20 דקות לאורך כל ההליך וספק מנות תחזוקה נוספות של קטמין לפי הצורך, במרווחים של לפחות 20 דקות זה מזה. מכיוון שמדובר בהליך קצר יחסית (בדרך כלל <45 דקות בהרדמה), לעתים רחוקות נדרש קטמין נוסף לאחר מנת התחזוקה הראשונית.
2. מעבר טרנסאורלי של האנדוסקופ כדי לדמיין את הגרון
- לפני הרדמת החיה, הכינו אנדוסקופ בגודל מתאים עם יכולת הקלטת וידאו.
הערה: אנו משתמשים באופן שגרתי באוטוסקופ בדרגה אפס עם קוטר פיר של 1.9 מ"מ ואורך פיר של 10 ס"מ עם מעטפת מתכת מותאמת אישית (איור 2), שהוא האנדוסקופ המייצג המשמש לאורך פרוטוקול זה.- חבר את האנדוסקופ למקור אור ולמערכת הקלטת אנדוסקופיה לצפייה בזמן אמת והקלטת וידאו במינימום של 30 פריימים לשנייה (fps).
- מיקוד ואיזון לבן של המצלמה לאיכות תמונה אופטימלית.
- חבר את האנדוסקופ למיקרומניפולטור.
הערה: למעקב אחר תנועת הגרון, אנו מאבטחים את האנדוסקופ למיקרומניפולטור בפלטפורמת האנדוסקופיה כדי לאפשר בקרת אנדוסקופ מדויקת לצילום וידאו יציב.
- אבטח את המכרסם בשכיבה גבית על פלטפורמה מחוממת. ייצב ושיתק את הראש על ידי אבטחתו באמצעות מוטות אוזניים.
- ודא שראש המכרסם יכול להסתובב בחופשיות למעלה/למטה (אך לא מצד לצד) במוטות האוזניים מבלי להחליק החוצה. דרגת חופש זו מאפשרת החדרה טרנסאורלית והתקדמות האנדוסקופ כדי להגיע לגרון.
- אם רצוי רישום אלקטרופיזיולוגי סינכרוני של תיאום נשימה, בליעה ובליעה-נשימה במהלך אנדוסקופיה, המשך ביישום חיישנים מתאימים למטרה זו (איור 3).
- הצמד חיישן נשימה לבטן בקו האמצע, מיד לתהליך הקסיפואיד, באמצעות סרט כירורגי.
- לגלח ולנקות/לחטא את העור במגבון אלכוהול לפני הכנסת אלקטרודות המחט למניעת זיהום.
- השתמש במחט 22 גרם כדי לנקב פתח קטן דרך העור לפני החדרת אלקטרודת המחט כדי למנוע נזק למחט אלקטרומיוגרפיה (EMG).
- הכנס אלקטרודת מחט EMG קונצנטרית סטרילית (למשל, 25 מ"מ x 0.3 מ"מ/30 גרם) דרך העור התת-מנטלי בקו האמצע לבסיס הלשון (למשל, שריר גניוגלוסוס או גניוהואיד, תלוי בעומק החדרת המחט).
- הכנס אלקטרודה טחונה (למשל, נירוסטה 27 גרם) תת עורית בירך (משני הצדדים).
- חבר את חיישן הנשימה ואלקטרודות מחט EMG למערכת הקלטה אלקטרופיזיולוגית (למשל, ביו-מגבר ומערכת רכישת נתונים עם לכידת וידאו סינכרוני) וודא אותות אלקטרופיזיולוגיה נקיים בשני הערוצים לפני שתמשיך.
- עטפו את אתרי חיבור האלקטרודות בנייר אלומיניום כדי להגן מפני רעש חשמלי ולשפר את יחס האות לרעש בהקלטות האלקטרופיזיולוגיות המתאימות.
- התאם את מיקום חיישן הנשימה ואת עומק האלקטרודה של מחט EMG לפי הצורך כדי להשיג אותות אלקטרופיזיולוגיה נקיים בשני הערוצים. כדי לעקוב אחר פרוטוקול זה, השתמש בקצב דגימה של 1k לנשימה ובקצב דגימה של 20k ומסנן מעבר פס (למשל, 150-3,000 הרץ) עבור EMG.
- כסו את פלג הגוף העליון של המכרסם (וחיישן הנשימה) בשמיכה שקופה כדי להקל על ויסות החום תוך מתן אפשרות להדמיה של תנועת הבטן במהלך הנשימה. השאירו את הגפיים האחוריות והבטן התחתונה חשופות באופן חופשי לגישה במהלך בדיקות רפלקס ומינון תחזוקה חוזר של קטמין. ודא שהשמיכה אינה מגבילה את תנועת הבטן במהלך הנשימה.
- המשך עם אנדוסקופיה טרנסאורלית (איור 4).
- פתח את פיו של המכרסם על ידי הכנסת אפליקטור מחודד עם קצה כותנה מאחורי החותכות המרכזיות, בניצב ללסת. סובב את צמר הגפן על פני השטח הגבי של הלשון כדי לבלוט אותו מעט מהפה.
- בעזרת אחיזת אצבע קלה, משכו בעדינות את הלשון מעט מהפה לצד אחד של החותכות המרכזיות תוך החדרת קצה האנדוסקופ לחלל הפה (איור 4A,B).
- הפעל את מקור האור לאחר הכנסת קצה האנדוסקופ לפה כדי למנוע פגיעה פוטנציאלית בעיני המכרסם.
- הכנס את האנדוסקופ לרוחב לחותכות באותו צד של הלשון הנסוגה. החותכות המרכזיות מונעות את החדרת האנדוסקופ בקו האמצע, ובכך מחייבות גישת החדרה רוחבית זו.
- הפעל את מערכות הרישום של אנדוסקופיה (ואלקטרופיזיולוגיה). תיעוד רציף לאורך כל ההליך כדי להבטיח נתונים מספיקים לניתוח פוסט הוק או תיעוד בזמנים נבחרים, בהתאם לצרכי המחקר.
- קדם בזהירות את האנדוסקופ כדי לדמיין את האורופרינקס, היזהר לא לגרד את החך הקשה או להפעיל לחץ עודף על הלשון שעלול לגרום לפציעה.
- הסר חלקיקי מזון גלויים ו/או הפרשות רוק עודפות באמצעות ספוגית בגודל מתאים (למשל, מיקרו-מברשת בגודל 1.5 מ"מ) כדי למזער את הסיכון לשאיפה ככל שההליך מתקדם.
- המשך להתקדם/להתאים את מיקום האנדוסקופ עד שההיפופרינקס מרוכז בתוך שדה הראייה על המוניטור וניתן לזהות מבנים אנטומיים מרכזיים (איור 4C). בשלב זה, כל המבנים צריכים להיראות מיושרים אנטומית/סימטריים בתוך שדה הראייה של המצלמה; אחרת, מקם מחדש את האנדוסקופ לפי הצורך.
- שימו לב לתנועה מעוררת של הלסת/לשון במהלך התקדמות האנדוסקופ. אם נעדר, המשך ללא מינון חוזר של קטמין. אם קיים, יש לתת מנת תחזוקה שנייה של קטמין (1/4 עד 1/2 מהמינון הראשוני של קטמין) ולהמתין כ-5 דקות כדי להיכנס לתוקף לפני שתמשיך. מינון חוזר רק אם עברו לפחות 20 דקות מאז ההזרקה הקודמת כדי למנוע הרגעת יתר וביטול הבליעה.
- בדוק את לשון המכרסם כל 5 דקות לאורך כל ההליך לאיתור שינוי צבע כהה, המעיד על איסכמיה. כדי להימנע מכך, מקם מחדש את האנדוסקופ לפי הצורך.
- הפעל לחץ קל על הקליפה עם מיקרו-בדיקה (למשל, מרית מתכת) המוחדרת לצד האנדוסקופ כדי לנתק את החך הרך והאפיגלוטיס כדי לדמיין את הגרון מרחוק (איור 4D). הימנע משימוש בקצה האנדוסקופ לניתוק, מכיוון שהלחץ המופעל עלול לגרום לנזק לרקמות רכות או לכופף/לפגוע לצמיתות בציר האנדוסקופ.
הערה: בניגוד לבני אדם, גרון העכברים אינו נראה ישירות מנקודת מבט טרנסאורלית. במקום זאת, האפיגלוטיס נלכד מכנית מתחת לקרום רירי המכסה את הקלף, מה שגורם להיווצרות חלל היפופרינגיאלי ללא מוצא. הפעלת לחץ קל על הוולום משחררת את האפיגלוטיס מהקרום הקטיפה כדי לתת מבט חלקי על הגרון. - שימו לב לסנוניות מעוררות במהלך ניתוק וולום/אפיגלוטיס.
- זהה סנוניות כתזוזות לשון אחוריות פתאומיות וקצרות לכיוון החך הקשה. תנועה זו מתרחשת בדרך כלל בסנכרון עם תנועה/דיכאון קצר של הלסת התחתונה, ובכך מספקת תחליף לזיהוי בליעה כאשר הלשון האחורית אינה נראית בקלות בשדה הראייה של האנדוסקופ.
- זהה גם סנוניות באמצעות פעילות התפוצצות EMG בלשון בשילוב עם אפיזודות דום נשימה קצרות בהקלטת האלקטרופיזיולוגיה, שניהם מתרחשים בסנכרון עם אירועי סגירה גלוטית בסרטון האנדוסקופיה.
- במקרה של בליעה חוזרת ומהירה המעידה על הרדמה לא מספקת (כלומר, קלה מדי), יש למנות מחדש ולהמתין ~5-10 דקות לפני שתמשיך. יש להמתין לפחות 20 דקות לאחר הזרקת התחזוקה הקודמת של קטמין כדי למנוע הרגעת יתר וביטול הבליעה.
- קחו בחשבון את עומק ההרדמה כאופטימלי כאשר רק כמה סנוניות מתעוררות במהלך ניתוק קטיפה-אפיגלוטי.
- אם הבליעה מבוטלת, ההרדמה עמוקה מדי להערכת הגנה על דרכי הנשימה של הגרון. במקרה זה, המתן 5-10 דקות לחילוף החומרים של קטמין לפני שתמשיך בהדמיה מקרוב של הגרון.
3. הקלטת וידאו תקריב ללא הפרעה של תנועת הגרון במהלך הנשימה ומעוררת בליעה
הערה: הקלטה אלקטרופיזיולוגית סינכרונית של נשימה, בליעה ותיאום בליעה-נשימה היא גם אופציה.
- קדם לאט את האנדוסקופ בין הוולום לאפיגלוטיס תוך שמירה על הגרון במרכז שדה הראייה (איור 5A-C).
הערה: קצה האנדוסקופ יעבור בקלות דרך הפתח הוולרי-אפיגלוטי ללא כוח. אחרת, בטל את ההליך כדי למנוע נזק פוטנציאלי לבעל החיים. אפשר לדמיין את הגרון מרחוק, עם קצה האנדוסקופ בהיפופרינקס. עם זאת, גישה זו דורשת בדרך כלל נסיגה ידנית של האפיגלוטיס, הוולום ו/או הלשון לצורך הדמיה משופרת של הגרון. עם זאת, חלקים מהגרון בדרך כלל נשארים מוסתרים מהעין, והתקני הנסיגה יכולים להגביל את תנועת הגרון, מה שעלול להתפרש בטעות כתפקוד לקוי. - המשך לקדם את האנדוסקופ כדי לקבל מבט מקרוב ללא הפרעה על כל הממדים הגחוניים-גביים והרוחביים של הגרון בשדה ראייה יחיד (איור 5C).
הערה: הקומיסורה הגחונית עלולה להיות חסומה על ידי האפיגלוטיס, במיוחד בעכברים צעירים/קטנים יותר. במקרים אלה, ניסיון לתפעל בצורה אגרסיבית יותר את קצה האנדוסקופ כדי לדמיין את הגחון יכול להגביל את תנועת הגרון, שעלולה להתפרש בטעות כתפקוד לקוי. זה עלול גם לחסום את זרימת האוויר בגרון וכתוצאה מכך לחנק. - שימו לב לתנועה התנודה של הגרון כאשר המכרסם שואף (התרחבות גלוטלית) ונושף (היצרות גלוטלית) במהלך כל מחזור נשימה.
הערה: קצב ועוצמת תנועת הגרון/גלוטל עשויים להשתנות בהתאם לעומק ההרדמה; עם זאת, פער גלוטאלי (כלומר, מרווח אוויר בין האריטנואידים השמאליים/ימניים לקפלי הקול) נשאר בדרך כלל גלוי לאורך כל מחזור הנשימה במכרסמים בריאים.- אם נצפתה היצרות גלוטית ניכרת, כוונן את מיקום האנדוסקופ כדי להבטיח זרימת אוויר ללא הפרעה דרך דרכי הנשימה העליונות. לדוגמה, הימנע מהפעלת לחץ על הקליפה, מה שעלול לגרום לחסימת רקמות רכות בדרכי הנשימה של האף. הימנע גם מהכנסת קצה האנדוסקופ לחלל הגלוטל, מה שעלול לחסום את זרימת האוויר בגרון ולהוביל לחנק. אם במקרים נדירים, הנשימה נפסקת, יש לבצע מספר לחיצות חזה באמצע החזה (באמצעות אצבע אחת) או אוורור בלחץ חיובי (באמצעות "שקית החייאה" מיניאטורית) לאחר הסרת האנדוסקופ.
- הקלטת וידאו של תנועת נשימת הגרון למשך 30-60 שניות למטרות הערכה פוסט-הוק.
- כאשר הגרון עדיין במבט מקרוב, כוונן מעט את קצה האנדוסקופ בתוך כניסת הגרון כדי להפעיל גירוי מכני על הרירית המכסה את הוולום ו/או האפיגלוטיס, ולעורר בליעה במכרסמים מורדמים בצורה אופטימלית.
- השתמש בהתאמות ברמת המיקרו של קצה האנדוסקופ (כלומר, ~1 מ"מ לכל כיוון) כדי למנוע פגיעה ברירית ו/או חסימת דרכי הנשימה.
- שימו לב לסנוניות מעוררות, שניתן לזהות בקלות כאירועי סגירה גלוטית פתאומית המתרחשים בסנכרון עם דיכאון בלסת הנראית לעין, פעילות התפוצצות EMG בלשון ודום נשימה קצר (<1/2 שניות) הנראה בעקבות הנשימה.
הערה: עלולים להתרחש אירועי סגירה גלוטית ללא תנועת לסת מקבילה; עם זאת, סגירה גלוטית בדרך כלל אינה שלמה במקרים אלה. אנו חושדים שאלו עשויים להיות רפלקסים אחרים להגנה על דרכי הנשימה (למשל, רפלקס מקרב גרון) המתעוררים כאשר ההרדמה מתחילה להתפוגג; עם זאת, מדובר בהתרחשויות נדירות/לא עקביות הדורשות חקירה נוספת. - חזור על הפעולה עד לעורר 5-10 סנוניות ולהקליט וידאו לכל חיה. אם הבליעה מבוטלת, הסר את האנדוסקופ והמתן 5-10 דקות עד שיתרחש חילוף החומרים של קטמין לפני שתמשיך.
- החזר בזהירות, אך אל תסיר, את האנדוסקופ לתוך האורופרינקס ומרכז את ההיפופרינקס בשדה הראייה כדי לדמיין את האפיגלוטיס והוולום.
- חבר מחדש את הוולום והאפיגלוטיס לחידוש נשימת האף על ידי שימוש במיקרו-ספוגית כדי להפעיל לחץ קל על בסיס הלשון כדי לעורר בליעה ולכידה מחדש של האפיגלוטיס מתחת לקרום הקטיפה. אם צימוד מחדש לא מתרחש תוך מספר ניסיונות, המשך בהתאוששות מהרדמה ללא צימוד מחדש כדי למנוע סיכון לפגיעה בגרון.
- הפסק את רישום האנדוסקופיה (והאלקטרופיזיולוגיה).
- השתמש בצמר גפן ספוג במי מלח כדי להרטיב את הלשון והחותכות המרכזיות ולהחזיר את הלשון למקומה האנטומי בתוך חלל הפה.
- נתק את מוטות האוזניים והסר את בדיקת הטמפרטורה, חיישן הנשימה ואלקטרודות EMG מהמכרסם כדי להמשיך בהתאוששות ההרדמה.
4. התאוששות מהרדמה
- הנח את החיה בכלוב התאוששות מחומם מראש (כלומר, זהה לכלוב האינדוקציה) על "תחנת החימום" כדי להתאושש מההרדמה.
- יש למרוח שוב חומר סיכה לעיניים כדי למנוע התייבשות.
- יש לתת תמיסת מלח מחוממת SC לנוזלים: עד 5 מ"ל לחולדות ועד 0.5 מ"ל לעכברים.
- מתן atipamezole SC להיפוך קסילזין ולהגברת הדחף הנשימתי: 1-2 מ"ג/ק"ג לחולדות ועכברים.
- יש להתחיל עם 2 מ"ג/ק"ג אטיפמזול, ומיד לאחר מכן גירוי ידני לאורך הגב והקיבה של המכרסם כדי להאיץ את ההתאוששות.
הערה: בגישה זו, תנועת ראש ספונטנית מתחילה בדרך כלל תוך 1-3 דקות. עם זאת, החזרה למצב אמבולטורי אורכת בדרך כלל שעתיים בממוצע (נע בין שעה ל-5 שעות) לאחר לרינגוסקופיה בהרדמת KX, עקב הבדלים אינדיבידואליים. - מתן טיפמזול נוסף במינון של 1 מ"ג/ק"ג (לפחות 15 דקות לאחר ההזרקה הראשונה) אם תנועת הגוף הספונטנית פוחתת במקום לעלות במהלך 15-30 הדקות הראשונות של התאוששות ההרדמה, למרות מתן גירוי ידני תכוף.
- המשך במתן דוקספרם (5 מ"ג/ק"ג IP לחולדות ועכברים) אם הפעילות הספונטנית ממשיכה לרדת. מינון חוזר עם חומר "הצלת חירום" זה במרווחים של 10-15 דקות (עד חמש מנות) עד להופעת תנועה ספונטנית. אם המכרסמים נשארים גוססים, המתת חסד של בעלי החיים בשיטות המתת חסד מאושרות (למשל, מנת יתר של קטמין ואחריה שיטה משנית כגון עריפת ראשים).
- יש להתחיל עם 2 מ"ג/ק"ג אטיפמזול, ומיד לאחר מכן גירוי ידני לאורך הגב והקיבה של המכרסם כדי להאיץ את ההתאוששות.
- עקוב מקרוב אחר מכרסמים מתאוששים במרווחים של 15-20 דקות כדי לזהות שינויים שליליים במצב הנשימה, הניידות והוויסות החום ולספק התערבות לפי הצורך (למשל, גירוי ידני, חמצן משלים, שמיכה תרמית, אטיפמזול או זריקות דוקספרם). ספק ניטור תכוף יותר למכרסמים הדורשים התערבות.
- ספק חמצן משלים (למשל, 1-2 ליטר לדקה בתא אינדוקציה מחומם, ללא ISO) למשך 10 דקות לפי הצורך למכרסמים עם זמני התאוששות ממושכים מהרדמת KX. לחלופין, הפעל גירוי תכוף לאורך משטחי הגב והגחון של החיה כדי לנרמל את רמות SpO2 (>94%).
- הניחו חברים לכלוב מתאוששים באותו כלוב התאוששות (עד שני מכרסמים בכלוב) כדי לקדם פעילות ספונטנית מוגברת והתאוששות מהירה יותר.
- החזירו מכרסמים לכלוב הבית המחומם שלהם כאשר הם מסוגלים לנוע באופן ספונטני סביב כלוב ההתאוששות.
- החזירו את בקבוק המזון והמים הסטנדרטי לכלוב הביתי. אל תספק התאמות מיוחדות לגישה למזון/מים בזמן שההרדמה עדיין מתפוגגת כדי למזער את הסיכון לחנק/שאיפה.
- התבונן בפעילות הכלוב הביתי והסר את כל המכשולים המעכבים את האמבולציה (למשל, צריף, צינור PVC).
- מקם את כלוב הבית חצי דולק, חצי מחוץ לתחנת החימום למשך 12-16 השעות הבאות (כלומר, לילה).
הערה: הפסקת חימום משלים מוקדם יותר עלולה לגרום לתמותה עקב היפותרמיה.
- בצע בדיקות בריאות סטנדרטיות למחרת בבוקר. החזר בעלי חיים עם חידוש פעילות רגילה/בסיסית, תפקודי גוף (למשל, ויסות חום, אכילה, שתייה, מתן שתן, עשיית צרכים) ומשקל יציב (כלומר, שמירה או עלייה) לתנאי ויווריום סטנדרטיים עם ניטור בריאות יומיומי שגרתי. במקרה הנדיר שבו למכרסמים יש ירידה בפעילות, בתפקודי הגוף או במשקל הגוף, המשיכו בתוספת חום ליום נוסף.
הערה: עבור חולדות, נפוץ שכתמי פורפירין מופיעים לפתע סביב שתי העיניים ~ 3-6 שעות לתוך תקופת ההחלמה מההרדמה. הצביעה נפתרת בדרך כלל תוך 24 שעות.
5. כימות אובייקטיבי של תנועת הגרון בזמן נשימה לעומת בליעה
- השתמש בתוכנת עריכת וידאו עם תכונת ניתוח מסגרת אחר מסגרת כדי לצפות בסרטוני האנדוסקופיה.
- זהה לפחות אפיזודה מייצגת אחת של 10-20 שניות של נשימה ספונטנית לכל בעל חיים.
- זהה 3-5 אירועי בליעה מייצגים לכל בעל חיים.
- ודא שאפיזודות/אירועי הנשימה והבליעה שנבחרו עומדים בקריטריוני הניתוח הבאים: הגרון מרוכז בשדה הראייה של המצלמה כאשר כל המבנים/גבולות הגרון נראים לעין (כלומר, לא מוסתר על ידי הקלף, האפיגלוטיס או הפרשות רוק עודפות), תאורה מספקת (כלומר, מסוגל לראות את כל המבנים/גבולות הגרון), וללא חפץ תנועה של המצלמה (כלומר, האנדוסקופ אינו זז).
- לנתח את אירועי הנשימה והבליעה שזוהו באמצעות גישות סובייקטיביות ו/או אובייקטיביות.
- לניתוח סובייקטיבי: השתמש בסולם Likert כדי לנקד באופן סובייקטיבי את תנועת הגרון במהלך צפייה בזמן אמת ופריים אחר פריים באמצעות תוכנת עריכת וידאו. כדי לעקוב אחר פרוטוקול זה, השתמש בסולם ליקרט מורחב הנע בין -2 ל-+2, כאשר ערכים שליליים מצביעים על תנועת גרון בכיוון ההפוך מהצפוי. הערך את ההגנה על דרכי הנשימה של הגרון במהלך הבליעה, כאשר 0 = אין הפחתה בגודל הפער הגלוטאלי (כלומר, אין הגנה על דרכי הנשימה של הגרון), 1 = הפחתה מסוימת של פער הגלוטאלי (כלומר, הגנה לא מלאה על דרכי הנשימה), ו-2 = הוספה מלאה של האריטנואידים, עם פער גחוני קטן בלבד בין קפלי הקול (כלומר, הגנה מלאה על דרכי הנשימה), כאשר ערכים שליליים מצביעים על תנועת גרון פרדוקסלית.
הערה: סולם ליקרט הנע בין 0 ל-2 נמצא בשימוש נפוץ במחקרי מכרסמים, כאשר 0 = ללא תנועה, 1 = תנועה מסוימת ו-2 = תנועה רגילה 17,18,19,20,21,22. עם זאת, סולם זה אינו לוקח בחשבון תנועת גרון פרדוקסלית המתרחשת לעתים קרובות בעקבות פגיעה חוזרת בעצב הגרון (RLN)10. - לניתוח אובייקטיבי: זהה ארבע מסגרות וידאו מרכזיות - 1) מסגרת המנוחה הקודמת ישירות להתחלת התקרבות הגרון (כלומר, המסגרת שלפני התקרבות קפלי הקול), 2) המסגרת שבה קפלי הקול השלימו את ההתקרבות, 3) המסגרת הקודמת לחטיפת קפלי הקול (זה עשוי לחפוף עם #2), ו-4) המסגרת שבה קפלי הקול נחטפו לחלוטין ומוחזרים למצב מנוחה כדי לחדש את הנשימה. השתמש בחותמת הזמן של ארבע מסגרות מפתח אלה כדי לחשב את משך התקרבות קיפול הקול (מסגרת 1 למסגרת 2), סגירה גלוטית (מסגרת 2 למסגרת 3), חטיפת קפל הקול (מסגרת 3 למסגרת 4) ומשך הבליעה הכולל (מסגרת 1 למסגרת 4). לחלופין, השתמש בתוכנה מסחרית קיימתאחרת 23 כדי למדוד את זווית הגלוטל (כלומר, בין האריטנואידים בגב או בקפלי הקול בגחון) במהלך חטיפה מקסימלית ותוספת מקסימלית באמצעות תמונות מסגרת סטילס 17,18,24. בקש משני סוקרים מיומנים לפחות לבצע תהליך זה באופן עצמאי בצורה עיוורת, לזהות פערים בין סוקרים ולהגיע להסכמה משותפת עבור כל אי התאמה.
הערה: בעבר ביצענו ניתוח ידני זה מסגרת אחר מסגרת של אירועי תזמון סגירה גלוטית (כלומר, במהלך רפלקסים מגנים על דרכי הנשימה) באמצעות תוכנת עריכת וידאו מסחרית במכרסמים ובבני אדם14. עם זאת, גישה זו אינה יעילה ומספקת רק כימות מוגבל של דינמיקת תנועת הגרון. כיום אנו משתמשים בתוכנת מעקב גרון שנבנתה בבית כדי לבצע כימות אובייקטיבי נרחב יותר של תנועת הגרון במהלך נשימה ורפלקסים מגנים על דרכי הנשימה 22,25,26,27,28,29,30. התוכנה כוללת יכולת מעקב אוטומטית מסגרת אחר מסגרת לכימות אובייקטיבי של מרחק תנועת גרון בצד שמאל לעומת ימין (משרעת) ותזמון (תדירות). אנו משתמשים בפרמטרים אלה כדי לגזור מגוון מדידות מבוססות תנועה כדי לזהות/לכמת תפקוד לקוי של הגרון (למשל, מקסימום/מינימום/טווח, סימטריית תנועת גרון וסנכרון) במהלך נשימה, בליעה ורפלקסים אחרים המגנים על דרכי הנשימה (למשל, רפלקס מקרב גרון). תוכנה זו עדיין עוברת שיפורים ועדיין אינה זמינה מסחרית/ציבורית.
- לניתוח סובייקטיבי: השתמש בסולם Likert כדי לנקד באופן סובייקטיבי את תנועת הגרון במהלך צפייה בזמן אמת ופריים אחר פריים באמצעות תוכנת עריכת וידאו. כדי לעקוב אחר פרוטוקול זה, השתמש בסולם ליקרט מורחב הנע בין -2 ל-+2, כאשר ערכים שליליים מצביעים על תנועת גרון בכיוון ההפוך מהצפוי. הערך את ההגנה על דרכי הנשימה של הגרון במהלך הבליעה, כאשר 0 = אין הפחתה בגודל הפער הגלוטאלי (כלומר, אין הגנה על דרכי הנשימה של הגרון), 1 = הפחתה מסוימת של פער הגלוטאלי (כלומר, הגנה לא מלאה על דרכי הנשימה), ו-2 = הוספה מלאה של האריטנואידים, עם פער גחוני קטן בלבד בין קפלי הקול (כלומר, הגנה מלאה על דרכי הנשימה), כאשר ערכים שליליים מצביעים על תנועת גרון פרדוקסלית.
תוצאות
שימוש מוצלח בפרוטוקול לרינגוסקופיה זה של עכברים מביא להדמיה מקרוב של הגרון במהלך נשימה ספונטנית ומעורר בליעה בתנאים בריאים וחולים, כפי שמוצג באיור 6. יתר על כן, ניתן לחזור על פרוטוקול זה מספר פעמים באותם מכרסמים כדי לאפשר חקירה של תפקוד/תפקוד לקוי של הגרון לאורך זמן. כפי שמוצג באיור 7, חזרנו בהצלחה על פרוטוקול לרינגוסקופיה זה 6 פעמים במשך פרק זמן של 4 חודשים כדי לחקור את דפוס ההתאוששות הספונטני במודל כירורגי של חולדות של פגיעת RLN (נתונים שטרם פורסמו). ניסיונות להשתמש בהרדמת ISO במקום KX הביאו לביטול כמעט מוחלט של הבליעה (איור 8) במכרסמים שעברו גירוי חשמלי ישיר של עצב הגרון העליון הימני כדי לעורר בליעה, כפי שתואר בניסויים הקודמים שלנו31,32. זה קרה עם ISO נמוך עד 2%; הפחתת ה-ISO מתחת לרמה זו הביאה להחזרת התנועה הספונטנית ולכן נמנעה. ההשפעה המבלבלת הזו של ISO מדגישה את החשיבות של בחירת הרדמה לשימוש מוצלח בפרוטוקול זה.
כאשר איכות התמונה האנדוסקופית טובה, ניתן לנתח קטעי וידאו מייצגים של נשימה ובליעה באמצעות תוכנת מעקב אחר תנועה, כפי שמוצג באיור 9. מדדי תוצאה מייצגים שנוצרו באופן אוטומטי על ידי תוכנת מעקב הגרון המותאמת אישית שלנו מפורטים בטבלה 1. שימו לב שמספר מדדי תוצאה הקשורים לנשימה ובליעה היו שונים באופן ניכר בין חתך RLN בסיסי לפוסט RLN באותה חולדה מייצגת. בעוד שזוויות הכדור במהלך הנשימה היו דומות בין חתך הבסיס לפוסט-RLN, היחסים בין משרעת התנועה של הגרון הימני/שמאלי (כלומר, יחס טווח התנועה הממוצע או MMRR) והתדירות (יחס מחזור פתוח-סגירה או OCCR) במהלך הנשימה היו נמוכים יותר לאחר החתך. באופן דומה, משך הבליעה היה קצר יותר לאחר חתך RLN.
אם נרכשות הקלטות אלקטרופיזיולוגיות סינכרוניות (למשל, פנאומוגרמה נשימתית ו-genioglossus EMG), ניתן לכמת מספר מדדי תוצאה אובייקטיביים נוספים למתאם עם נתוני לרינגוסקופיה. דוגמאות למדדי תוצאה מבוססי אלקטרופיזיולוגיה המעניינים את המחקר שלנו מסוכמות באיור 10. אנו מפתחים כעת אלגוריתמים לכימות אוטומטי של מדדי תוצאה אלה.

איור 1: פלטפורמת אנדוסקופיה של עכברים. (A) Sideand (B) מוצגות תצוגות עליונות של פלטפורמת האנדוסקופיה המותאמת אישית של עכברים, עם רכיבים חיוניים מסומנים. שימו לב שהשולחן מתחת לכרית החימום מתכוונן לגודל. מוצגים כאן גדלי השולחן וכרית החימום המשמשים לחולדות, אשר מוסרים בקלות כדי לחשוף משטח שולחן בגודל עכבר המכיל כרית חימום קטנה יותר (לא מוצג). מתאם מותאם אישית מאבטח אנדוסקופ למיקרומניפולטור המחובר לבסיס הפלטפורמה. תכנון אסטרטגי זה מאפשר להזיז את הפלטפורמה כולה כיחידה במהלך הליך האנדוסקופיה, מבלי להסתכן בפגיעה בבעל החיים כתוצאה מתנועת אנדוסקופ לא מכוונת/בלתי מבוקרת. המיקרומניפולטור מאפשר התאמות גסות ומיקרו של קצה האנדוסקופ במספר כיוונים, כולל x (שמאל/ימין), y (קדימה/אחורה), z (למעלה/למטה), כמו גם סיבוב סביב y (גובה) ו-z (סבסוב). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: אוטוסקופ ונדן מותאם אישית עבור לרינגוסקופיה של עכברים. (A) רכיבים מפורקים של אוטוסקופ מסחרי ומעטפת נירוסטה מותאמת אישית עם מתאם עבור לרינגוסקופיה של עכברים. (B) כאשר הוא מורכב, קצה האוטוסקופ משתרע 1 מ"מ מעבר לנדן המתכת אך ניתן לכוונון עד 5 מ"מ לפי הצורך. תכנון אסטרטגי זה מקל על התקדמות קצה האוטוסקופ הצר לתוך כניסת הגרון של המכרסם, בעוד שהמעטפת המתכתית בקוטר מעט גדול יותר (2.4 מ"מ) מחזיקה מספיק את הוולום והאפיגלוטיס פתוחים להדמיה אופטימלית של הגרון כולו במהלך הנשימה והבליעה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
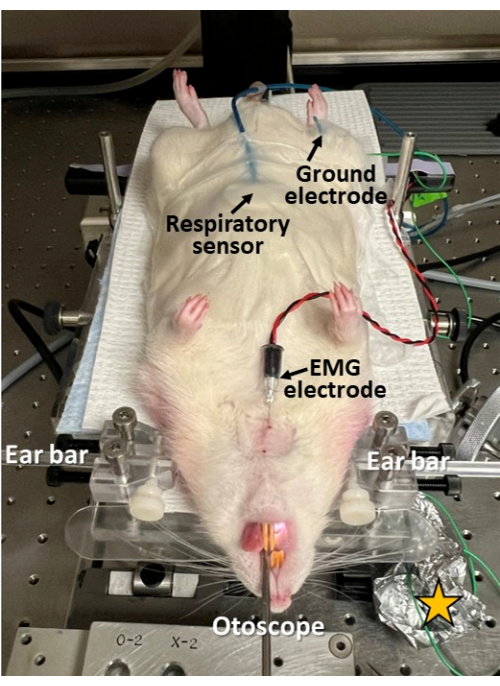
איור 3: רישום אלקטרופיזיולוגי זעיר פולשני במהלך אנדוסקופיה. חיישן נשימה מודבק לבטן המכרסם; אלקטרודת EMG מוחדרת דרך העור לשריר הגניוגלוסוס של הלשון; ואלקטרודה טחונה מוחדרת תת עורית בירך. גישה זו מאפשרת לחקור את תיאום הבליעה, הנשימה והבליעה-נשימה בסנכרון עם אנדוסקופיה. שימו לב שהעור מגולח ומנקה/מחוטא באתרי החדרת האלקטרודות. כוכב צהוב = רדיד אלומיניום עטוף סביב אתרי חיבור מוליכי האלקטרודה כדי לשפר את יחס האות לרעש בהקלטות האלקטרופיזיולוגיות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: אנדוסקופיה טרנסאורלית כדי לדמיין את הגרון מרחוק. (A) לאחר נסיגה עדינה של הלשון עם אחיזת אצבע קלה, האנדוסקופ מוחדר בין הלשון לחותכות המרכזיות במיקום הכוכב האדום (כלומר, אותו צד של הלשון הנסוגה, כדי לשמור על יישור אנטומי עם ציר האנדוסקופ). (B) כאשר האנדוסקופ מתקדם מעבר לחיך הקשה, (C) האפיגלוטיס והוולום נראים לעין. (D) כדי לדמיין את הגלוטיס, הוולום והאפיגלוטיס צריכים להיות "מנותקים" על ידי הפעלת לחץ על פני השטח של הוולום (במיקום של הכוכב השחור בתמונה C). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
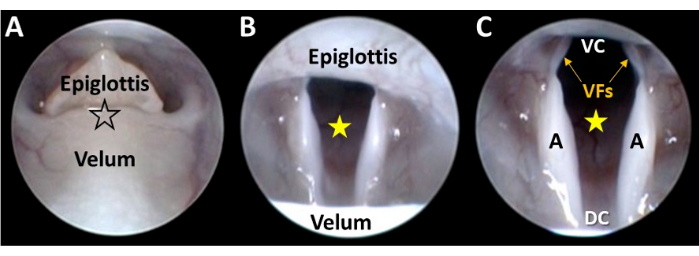
איור 5: הדמיה אנדוסקופית מקרוב של הגרון. (A) קצה האנדוסקופ מונחה בעדינות באמצעות בקרת מיקרומניפולטור בין הוולום המנותק לאפיגלוטיס (במיקום של הכוכב עם קווי המתאר השחורים). ככל שהאנדוסקופ מתקדם, (B) הגרון מופיע והחלל הגלוטאלי (כוכב צהוב) מרוכז בשדה הראייה של המצלמה באמצעות התאמות מיקרומניפולטור. (C) התקדמות מתמשכת של המיקרומניפולטור של האנדוסקופ מביאה להדמיה של כל הממדים הגחוניים-גביים והרוחביים של הגרון. קיצורים: VC = קומיסורה גחונית של הגרון (כלומר, נקודת הצומת הגחונית בין קפלי הקול); DC = קומיסורה גבית של הגרון (כלומר, נקודת הצומת הגבית בין האריטנואידים); VFs = קפלי קול; A = אריטנואיד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: הדמיה של גרון העכבר במהלך נשימה ובליעה. תמונות אנדוסקופיות מייצגות המתארות תנועת גרון במהלך נשימה ובליעה בחולדת ספראג דולי בוגרת (A-C) לפני ו-(D-F) לאחר חתך כירורגי של ה-RLN הימני. שימו לב שתנוחת המנוחה של הגרון נראית ללא שינוי (D) לאחר פגיעה ב-RLN בהשוואה ל-(A) קו הבסיס. (ב,ה) במהלך השראה מקסימלית, אסימטריה גרונית הופכת לברורה לאחר פגיעה ב-RLN. במקום ששני האריטנואידים יחטפו כדי להגדיל את החלל הגלוטאלי (כוכב צהוב), (B) כפי שמוצג בנקודת ההתחלה, (E) האריטנואיד המקביל (מימין) (כוכבית שחורה) וקפל הקול נראים משותקים לאורך כל מחזור הנשימה בעקבות פגיעה ב-RLN. אסימטריה בצד ימין ניכרת גם במהלך הבליעה. (C) בקו הבסיס, האריטנואידים מתקרבים לקו האמצע במהלך הבליעה, ומשאירים רווח גחוני קטן בין קפלי הקול. (F) בעקבות פגיעת RLN, האריטנואיד המקביל וה-VF נעים באופן פרדוקסלי (כלומר, באותו כיוון כמו הצד הלא פגוע, חץ אדום) במהלך הבליעה, ומשאירים מרווח גלוטאלי גדול (כוכב צהוב) המשתרע מהגחון לקומיסור הגרון האחורי. (F) התמונה הזו מספקת ראיות ישירות לפגיעה בהגנה על דרכי הנשימה של הגרון במודל של חולדה של פגיעה יאטרוגנית ב-RLN. (ג,ו) שימו לב שהגרון מתקרב לאנדוסקופ במהלך הבליעה, כפי שמצוין על ידי האפיגלוטיס והקליפה שאינם נראים עוד בשדה הראייה של המצלמה. חיצים שחורים מציינים את כיוון תנועת הגרון הרגילה ואילו החץ האדום מציין תנועה פרדוקסלית; כוכב צהוב = חלל גלוטל. קיצורים: VFs = קפלי קול; A = אריטנואיד; RLN = עצב גרון חוזר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: שימוש בגרון סדרתי כדי לחקור תפקוד לקוי של הגרון במהלך נשימה ובליעה במודל חולדה של פגיעה יאטרוגנית ב-RLN. סולם ליקרט שנע בין -2 ל-+2 שימש להערכת מרחק וכיוון תנועת הגרון בשמונה חולדות ספראג-דולי בוגרות במשך תקופה של 4 חודשים. לאחר לרינגוסקופיה בסיסית, החולדות עברו הליך כירורגי כדי לחצות את ה-RLN הימני, ואחריו לרינגוסקופיה סדרתית שבוע לאחר הניתוח, ואז שוב במרווחים של חודש אחד עד 4 חודשים לאחר הניתוח. כל שמונה החולדות שרדו את ההליך, ובכך הדגימו את יעילות משטר ההרדמה שלנו לרינגוסקופיה סדרתית. (A) סרטונים נותחו בזמן אמת ופריים אחר פריים/הילוך איטי כדי לכמת את תנועת הגרון במהלך הנשימה, כאשר 0 = ללא תנועה, 1 = תנועה מסוימת, ו-2 = מרחק תנועה רגיל של הצד הפגוע (הימני) בהשוואה לצד השלם (השמאלי). (B) עבור בליעה, גודל הפער הגלוטאלי הוערך באופן הבא: 0 = אין הפחתה בגודל הפער הגלוטאלי (כלומר, אין הגנה על דרכי הנשימה של הגרון), 1 = הפחתה מסוימת של פער הגלוטאלי (כלומר, הגנה לא מלאה על דרכי הנשימה), ו-2 = הוספה מלאה של האריטנואידים, עם רק מרווח גחוני קטן בין קפלי הקול (כלומר, הגנה מלאה על דרכי הנשימה). ערכים שליליים לנשימה ובליעה מצביעים על תנועת גרון בכיוון ההפוך מהצפוי (כלומר, פרדוקסלי). שימו לב שבעקבות פגיעת RLN, גם הנשימה וגם הבליעה הושפעו לרעה. מעניין שההגנה על דרכי הנשימה של הגרון הייתה מלאה (אם כי פרדוקסלית) בנקודת הזמן 1 WPS אך החמירה לאחר מכן, ונעה בין היעדר הגנה להגנה לא מלאה. קיצורים: WPS = שבוע לאחר הניתוח; MPS = חודשים לאחר הניתוח; RLN = עצב גרון חוזר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 8: בליעה מעוכבת על ידי ISO במכרסמים. (A) תמונה של מכרסם העובר לרינגוסקופיה בהרדמת ISO, עם רכיבים מסומנים של מערכת אספקת ISO מותאמת אישית המתוכננת למטרה זו. אזהרה עיקרית של גישה חדשנית זו היא הסיכון לחשיפת כוח אדם ל-ISO. (B) חיסרון נוסף לגישה זו הוא דיכוי ISO של בליעה. תרשים קופסה זה לצד זה ותרשים פיזור זה לצד זה מסכמים נתונים שלא פורסמו המשווים את ההשפעה של הרדמת ISO לעומת KX בעכברים (9 בקבוצה) העוברים גירוי חשמלי ישיר של עצב הגרון העליון הימני כדי לעורר בליעה. מוצג כאן מספר הסנוניות שהתעוררו במהלך ניסוי של 5 דקות המורכב מרכבות של 20 שניות של גירוי של 20 הרץ ואחריהם 10 שניות של מנוחה. בהשוואה ל-KX, לעכברים שהורדמו ב-ISO (עד 2%) היו פחות בליעות באופן משמעותי (p <-0.001, מבחן t של דגימות בלתי תלויות), והבליעה אפילו בוטלה ב-4/9 עכברים. ממצאים דומים עלו מניסויים לא ניתוחיים עם עכברים וחולדות (נתונים לא מוצגים). קיצורים: ISO = איזופלורן; KX = קטמין-קסילזין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 9: כימות אובייקטיבי של תנועת הגרון של עכברים באמצעות תוכנת מעקב. אותן תמונות מאיור 6 שמציגות נשימה לעומת בליעה בחולדה בנקודת ההתחלה לעומת לאחר פציעת RLN מוצגות כאן, עם קווי מעקב אחר תנועת הגרון שנוספו על ידי התוכנה המותאמת אישית שלנו. קווי מעקב נוספו ידנית למסגרת הווידאו הראשונה לאורך הגבול המדיאלי של האריטנואידים למעקב אוטומטי אחר תנועת הגרון השמאלית (קו כחול) לעומת ימינה (קו אדום) במסגרות הווידאו הנותרות. גרפים תואמים של תנועת גרון שנוצרו על ידי התוכנה המותאמת אישית שלנו מקטעי וידאו של 2.5 שניות מציגים תנועה בודדת שמאלה/ימינה לעומת תנועת גרון גלובלית נגזרת, עם תוויות המתאימות לתנוחת מנוחה גרונית (A,D), (B,E) פער גלוטאלי מקסימלי במהלך ההשראה, ו-(C,F) סגירה גלוטית במהלך הבליעה. שימו לב לתנועה הפרדוקסלית של הצד הימני (החצים האדומים) לאחר פגיעת RLN, כמו גם לפער הגלוטאלי הגדול המוצג בגרף התנועה הגלובלי הנגזר המתאים. מדדי תוצאה מייצגים כלולים בטבלה 1. קיצור: RLN = עצב גרון חוזר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 10: מדדי תוצאות מבוססי אלקטרופיזיולוגיה עבור מתאם עם נתוני לרינגוסקופיה. (A) רישומי אלקטרופיזיולוגיה במהלך נשימה ובליעה מוצגים עבור חולדה בריאה. החלון העליון מראה עקבות נשימה (מחיישן נשימה המודבק לבטן המכרסם), החלון האמצעי מראה פעילות EMG בשריר הגניוגלוסוס, והחלון התחתון מראה את פעילות ה-EMG המסוננת. שימו לב לדפוס הנשימה הקצבי וה-EMG במהלך הנשימה, שנקטע במהלך אירועי בליעה. אירועי בליעה מזוהים בקלות באמצעות תנועה משוננת בעקבות הנשימה (חיצים שחורים) ומיד אחריה דום נשימה קצר (כוכבית אדומה). (B) חלון מורחב של התיבה המלבנית המקווקו ב-A מראה כיצד כמה מדדי תוצאה מכומתים מההקלטות האלקטרופיזיולוגיות. (A) שימו לב שבמהלך ההשראה (לוחות צהובים), עקבות הנשימה (החלון העליון) מתעכבים ~150 אלפיות השנייה (חץ כפול כחול) בהשוואה לפעילות התפרצות EMG, מה שמדגיש הבדלים זמניים בין שתי השיטות האלקטרופיזיולוגיות. מדדי תוצאה מייצגים מבוססי אלקטרופיזיולוגיה כוללים 1) משך שלב השאיפה (i); 2) מרווח בין-נשימתי (ii, מחושב באמצעות ערוצי EMG נשימתיים ומסוננים); אזור בליעה מתחת לעקומה (iii); ודום נשימה בבליעה (IV; מחושב באמצעות ערוצי EMG נשימתיים ומסוננים). קיצור: EMG = אלקטרומיוגרפיה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מדדי תוצאות | בסיסית | פציעה לאחר RLN | |
| לנשום | זווית גלוטאלית מינימלית (מעלות) | 34.5 | 34.6 |
| זווית גלוטאלית מקסימלית (מעלות) | 52.9 | 49.9 | |
| זווית גלוטאלית ממוצעת (מעלות) | 43.7 | 42.2 | |
| יחס טווח תנועה ממוצע (MMRR) | 1.26 | 0.29 | |
| יחס מחזור סגירה פתוח (OCCR) | 1 | 0.11 | |
| בליעה | קירוב גרון (ms) | 200 | 233 |
| משך סגירה גלוטית (ms) | 67 | 0 | |
| חטיפת גרון (ms) | 233 | 67 | |
| משך הבליעה הכולל (ms) | 500 | 300 | |
טבלה 1: מדדי תוצאה מייצגים שנוצרו באופן אוטומטי על ידי תוכנת מעקב גרון מותאמת אישית. קיצור: RLN = עצב גרון חוזר.
טקסט משלים על פלטפורמת לרינגוסקופיה. אנא לחץ כאן להורדת קובץ זה.
Discussion
פיתחנו בהצלחה פרוטוקול לרינגוסקופיה ספציפי למורן הניתן לשכפול המאפשר הדמיה מקרוב של תנועת הגרון במהלך נשימה ובליעה. חשוב לציין, ניתן לבצע את הפרוטוקול לאורך זמן באותם בעלי חיים כדי לחקור את ההשפעה של מצבים פתולוגיים שונים במיוחד על תפקוד הגרון. פרוטוקול זה פותח בעשור האחרון ועבר שינויים משמעותיים ופתרון בעיות לאורך הדרך. אופטימיזציה של הרדמה הייתה האתגר הגדול ביותר להתגבר עליו כדי למנוע מינון יתר שמבטל את הבליעה ו/או מסתכן בתמותה הקשורה למצוקה נשימתית. בתחילה השתמשנו ב-ISO, מה שהביא לביטול הבליעה, ייצור עודף רוק (החוסם הדמיה אנדוסקופית), וסיכון לחשיפת כוח אדם, הנחשבים להתוויות נגד חמורות נגד שימוש ב-ISO להליך זה. לכן התמקדנו ב-KX מכיוון שמדובר בהרדמה נפוצה של מכרסמים 33,34,35.
התחלנו את פיתוח הפרוטוקול שלנו עם עכברים 14,22,29,30,36 תוך שימוש בסיאנדוסקופ בגלל קוטר הפיר הקטן יותר שלו (1.1 מ"מ) בהשוואה לאנדוסקופים אחרים שעשויים להתאים למטרה זו. חשוב לציין, לסיאנדוסקופ יש ערוץ עבודה, בו השתמשנו בתחילה כדי להעביר פולסי אוויר כדי לעורר/לחקור את רפלקס מקרב הגרון14. עם זאת, מצאנו כי רפלקס המקרב של הגרון הצטמצם/בוטל לעתים קרובות בעכברים וחולדות, ככל הנראה עקב הרדמה כללית ו/או השבתה של קולטני חישה גרוניים/לועיים משניים לייבוש רירי ממתן דופק אוויר חוזר. למרות שלא ניתן היה לעורר באופן מהימן את רפלקס המקרב של הגרון במחקרים שלנו, הבליעה נמשכה באופן מפתיע והתעוררה בקלות על ידי גירוי מכני ב/ליד כניסת הגרון. מסיבה זו, העברנו את המיקוד שלנו לניתוח אנדוסקופי של בליעה מעוררת מכנית.
בתהליך, נטשנו את הסילנדוסקופ החצי קשיח שהיה נוטה להישבר ולא היה לו מספיק תאורה ורזולוציית תמונה כדי לדמיין ולנתח באופן אמין את תנועת הגרון. בחקר אנדוסקופים חלופיים רבים, בסופו של דבר הסתפקנו באוטוסקופ ספציפי שהתאים ללרינגוסקופיה עם עכברים וחולדות כאחד. על סמך הניסיון שלנו, התכונה החיונית ביותר בבחירת אנדוסקופ מתאים לרינגוסקופיה של עכברים היא קוטר פיר של פחות מ-2 מ"מ שיכול להעביר אור בהיר מספיק לצילום וידאו באיכות גבוהה. אנדוסקופים בקוטר גדול יותר אינם יכולים לעבור בקלות דרך כניסת הגרון בעכברים וחולדות להדמיה מקרוב של תנועת הגרון. אוטוסקופים אידיאליים במיוחד למטרה זו, בהתחשב בהעברת האור המצוינת שלהם, העיצוב הקשיח/עמיד והעלות הנמוכה יחסית בהשוואה לסוגים אחרים של אנדוסקופים (למשל, סיאלאנדוסקופ, אנדוסקופ גמיש). בנוסף, בעוד ששליטה ידנית באנדוסקופ היא אופציה בידיים יציבות, אנו רואים בבקרת מיקרומניפולטור מאפיין חיוני של פרוטוקול לרינגוסקופיה זה. חשוב לציין, בקרת מיקרומניפולטור על האנדוסקופ מאפשרת הקלטת וידאו יציבה של תנועת הגרון על ידי חוקר יחיד לכימות לאחר מכן. עד כה, השתמשנו בהצלחה בפרוטוקול מבוסס אוטוסקופ זה עם עכברים וחולדות בוגרים. אנו חושדים שאפשרויות אנדוסקופ בקוטר קטן יותר יהיו חיוניות לביצוע לרינגוסקופיה עם מכרסמים צעירים / קטנים יותר.
יתרון חדש של פרוטוקול הגרון שלנו הוא היכולת לדמיין הגנה על דרכי הנשימה במהלך בליעה במכרסמים, דבר שאינו אפשרי בבני אדם עקב היפוך אפיגלוטי מעל כניסת הגרון החוסם את הגלוטיס מהעין. לכן מכרסמים מספקים הזדמנות ייחודית לחקור באופן ספציפי את המנגנונים של הגנה נורמלית לעומת פתולוגית על דרכי הנשימה של הגרון למטרה הסופית של גילוי טיפולים לשיקום יעיל של תפקוד גרון תקין. יכולת ייחודית זו של פרוטוקול לרינגוסקופיה של עכברים היא יתרון גדול על פני וידאו-פלואורוסקופיה (כלומר, מבחן "תקן הזהב" האחר לדיספגיה), שלא הצליח לזהות שאיפה במודלים הרבים של מכרסמים של דיספגיה שפיתחנו/זיהינו עד כה 30,36,37,38,39,40. ניתן לייחס ממצא שלילי זה המבוסס על VFSS למספר הבדלים אנטומיים בדרכי הנשימה העליונות של מכרסמים הניכרים באמצעות גישת האנדוסקופיה הטרנסאורלית שלנו. ראשית, גרון המכרסם ממוקם גבוה בלוע האף, שם הוא מוסתר על ידי אפיגלוטיס וקלום צמודים היטב היוצרים חלל פה ללא מוצא. בנוסף, האפיגלוטיס במנוחה נלכד מתחת לנדן רירי המכסה את הקליפה. תצורה אנטומית זו גורמת למכרסמים להיות נושמי אף מחייבים; לפיכך, נשימה אוראלית במכרסמים ערים היא סימן לתחלואה נשימתית. במהלך בליעה במכרסמים בריאים, לעומת זאת, האפיגלוטיס מחליק החוצה מהמעטפת הרירית ומתהפך מעל כניסת הגרון כאשר הגרון מתרומם עוד יותר לתוך הלוע האף, מחוץ לנתיב הבולוס. ניתן לדמיין/להעריך את אירועי דרכי הנשימה העליונות הדינמיים הללו ישירות באמצעות לרינגוסקופיה במכרסמים בריאים ובמודלים של תפקוד לקוי של הגרון.
חשוב לציין, הראינו שלמרות שלא שואפים במהלך בדיקת VFSS, מודלים של מכרסמים (למשל, פגיעה יאטרוגנית ב-RLN) אכן מראים עדות לפגיעה בהגנה על דרכי הנשימה של הגרון (כלומר, סגירה לא מלאה של הגלוטל) באמצעות לרינגוסקופיה המתרגמת לחולים אנושיים עם שאיפה הקשורה לדיספגיה. לפיכך, פרוטוקול לרינגוסקופיה זה של עכברים מספק פלטפורמה תרגומית שימושית לחקירה ספציפית של מנגנונים של הגנה על דרכי הנשימה וטיפולים ממוקדים, שנותרו חמקמקים כיום. השגת מטרה זו תדרוש פיתוח/אופטימיזציה נוספים של השיטה הנוכחית שלנו, המשתמשת בקצה האנדוסקופ כדי לספק גירוי מכני לא מכויל של רירית הגרון/הלוע כדי לעורר בליעה. שיטות קפדניות ומבוקרות יותר לעורר בליעה נחקרות כעת במעבדה שלנו, כולל גירוי חשמלי ישיר של עצב הגרון העליון32,41 וגירוי כימי (למשל, חומצת לימון42) של רירית הגרון/הלוע. מגבלה נוספת של פרוטוקול זה היא מיקום שכיבה של המכרסמים, שאינו מחקה התנהגות אכילה ערה וטבעית. פיתוח הפרוטוקול הראשוני כלל מיקום שכיבה, שהביא להגבלת תנועת הלסת התחתונה תוך הגבלת הנראות של חלל הפה, מה שפגע באופן ניכר במעבר האנדוסקופ. אפשר לדמיין את הגרון מרחוק עם קצה האנדוסקופ בהיפופרינקס; עם זאת, גישה זו דורשת בדרך כלל נסיגה ידנית של האפיגלוטיס, הקליפה ו/או הלשון להדמיה משופרת של הגרון. ייצרנו מגוון התקני נסיגה ידניים מותאמים אישית למטרה זו (למשל, ספקולה אוטוסקופית שונה, קצות פיפטה שונה). עם זאת, חלקים מהגרון בדרך כלל נשארים מוסתרים מהעין, והתקני הנסיגה יכולים להגביל את תנועת הגרון, מה שעלול להתפרש בטעות כתפקוד לקוי. יתר על כן, תכונות נוספות אחרונות של פלטפורמת האנדוסקופיה (למשל, הטיה של טרנדלנבורג, וחתך בין מוטות האוזניים כדי להתאים לתנועת הלסת) עשויות להקל על בדיקת מכרסמים במצב שכיבה. מוטות אוזניים וחום משלים הם מאפיינים הכרחיים של פרוטוקול הלרינגוסקופיה. מוטות אוזניים מונעים מהראש לנוע במהלך מניפולציה טרנסאורלית של האנדוסקופ. מערכת חימום הומותרמית שומרת על טמפרטורת הגוף בין 36 מעלות צלזיוס ל-38 מעלות צלזיוס כדי לקדם הרדמה יציבה ולמנוע היפותרמיה לאורך כל ההליך.
כעת, כאשר קיימת מתודולוגיה להקליט באופן אמין את תנועת הגרון במהלך נשימה ובליעה במכרסמים, כימות תפוקה גבוהה הוא הצעד הבא החיוני. לכן, מאמצי ניתוח הווידאו שלנו נמשכים כדי לקבוע איזה מדד תוצאה שנוצר על ידי התוכנה המותאמת אישית שלנו יכול להבחין בצורה הטובה ביותר בין מצבים בריאים למצבים של מחלה, כמו גם לזהות שינויים לאורך זמן בתגובה להתקדמות טבעית של המחלה או להתערבויות טיפוליות. המועמדים המובילים יהיו המוקד של גישות למידת מכונה הבאות כדי להאיץ את ניתוח הדמיית הווידאו. חשוב לציין, מקרים של איכות תמונה לא אופטימלית (למשל, תאורה לא מספקת, מבנים אנטומיים מחוץ לשדה הראייה, הפרשות עודפות המסתירות מבני גרון וכו') אינם ניתנים כיום למעקב גרון; עם זאת, ניתן להתגבר על מחסום זה בעתיד באמצעות כלי למידת מכונה. עד אז, בחירה קפדנית של רצפי פריימים של וידאו העומדים בקריטריונים לניתוח מעקב גרון (כמתואר בסעיף פרוטוקול 5 נותרה בעלת חשיבות עליונה.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
עבודה זו מומנה בחלקה על ידי שני מענקי NIH: 1) מענק Multi-PI (TL ו-NN) R01 (HL153612) מהמכון הלאומי ללב, ריאות ודם (NHLBI), ו-2) מענק R03 (TL, DC0110895) מהמכון הלאומי לחירשות והפרעות תקשורת אחרות (NIDCD). פיתוח התוכנה המותאמת אישית שלנו למעקב אחר תנועת הגרון מומן בחלקו על ידי מענק של קרן קולטר (TL & Filiz Bunyak). אנו מודים לקייט אוסמן, קלואי בייקר, קנדי הולשר וזולה סטיבנסון על הטיפול המצוין במכרסמי המעבדה שלנו. אנו מודים גם לרודריק שלוצהאואר וצ'סטון קאלייס מחנות מכונות הפיזיקה של MU על קלט העיצוב והייצור של פלטפורמת האנדוסקופיה המותאמת אישית שלנו ושינויים אסטרטגיים באנדוסקופים מסחריים ומיקרומניפולטורים כדי לענות על צרכי המחקר שלנו. תוכנת מעקב תנועת הגרון המותאמת אישית שלנו פותחה בשיתוף פעולה עם ד"ר פיליז בוניאק וד"ר עלי חמד (המחלקה להנדסת חשמל ומדעי המחשב ב-MU). אנו מודים גם לג'ים מרנטי מאנדוסקופיה של קארל סטורץ על מתן הדרכה בבחירת אוטוסקופ. לבסוף, ברצוננו להכיר במספר רב של סטודנטים/מתלמדים קודמים במעבדת Lever שתרומתם השפיעה על פיתוח פרוטוקול לרינגוסקופיה עכברי הנוכחי שלנו: מרלנה שבצ'יק, קמרון הינקל, אביגיל רובנק, ברידג'ט הופוול, לסלי שוק, איאן דנינגר, צ'נדלר הקסטון, מרפי מאסטין ודניאל שו.
Materials
| Name | Company | Catalog Number | Comments |
| Atipamezole | Zoetis | Antisedan; 5 mg/mL | Parsippany-Troy Hills, NJ |
| Bioamplifier | Warner Instrument Corp. | DP-304 | Hamden, CT |
| Concentric EMG needle electrode | Chalgren Enterprises, Inc. | 231-025-24TP; 25 mm x 0.3 mm/30 G | Gilroy, CA |
| Cotton tipped applicator (tapered) | Puritan Medical Products | REF 25-826 5W | Guilford, ME |
| Data Acquisition System | ADInstruments | PowerLab 8/30 | Colorado Springs, CO |
| DC Temperature Control System - for endoscopy platform | FHC, Inc. | 40-90-8D | Bowdoin, ME |
| Electrophysiology recording software | ADInstruments | LabChart 8 with video capture module | Colorado Springs, CO |
| Endoscope monitor | Karl Storz Endoscopy-America | Storz Tele Pack X monitor | El Segundo, CA |
| Glycopyrrolate | Piramal Critical Care | NDC 66794-204-02; 0.2 mg/mL | Bethlehem, PA |
| Ground electrode | Consolidated Neuro Supply, Inc. | 27 gauge stainless steel, #S43-438 | Loveland, OH |
| Isoflurane induction chamber | Braintree Scientific, Inc. | Gas Anesthetizing Box - Red | Braintree, MA |
| Ketamine hydrochloride | Covetrus North America | NDC 11695-0703-1, 100 mg/mL | Dublin, OH |
| Metal spatula to decouple epiglottis and velum | Fine Science Tools | Item No. 10091-12; | Foster City, CA |
| Micro-brush to remove food/secretions from oral cavity | Safeco Dental Supply | REF 285-0023, 1.5 mm | Buffalo Grove, IL |
| Mouse-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2-07 – 5 x 12.5 cm Heating Pad | Bowdoin, ME |
| Ophthalmic ointment (sterile) | Allergan, Inc. | Refresh Lacri-lube | Irvine, CA |
| Otoscope | Karl Storz | REF 1232AA | El Segundo, CA |
| Pneumogram Sensor | BIOPAC Systems, Inc. | RX110 | Goleta, CA |
| Pulse oximetry - Vetcorder Pro Veterinary Monitor | Sentier HC, LLC | Part No. 710-1750 | Waukesha, WI |
| Rat-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2 – 12.5X25cm Heating Pad | Bowdoin, ME |
| Sterile needles for drug injections | Becton, Dickinson and Company | REF 305110, 26 G x 3/8 inch, PrecisionGlide | Franklin Lakes, NJ |
| Sterile syringes for drug injections | Becton, Dickinson and Company | REF 309628; 1 mL, Luer-Lok tip | Franklin Lakes, NJ |
| Surgical drape to cover induction cage for dark environment | Covidien LP | Argyle Surgical Drape Material, Single Ply | Minneapolis, MN |
| Surgical tape to secure pneumograph sensor to abdomen | 3M Health Care | #1527-0, 1/2 inch | St. Paul, MN |
| Transparent blanket for thermoregulation | The Glad Products Company | Press’n Seal Cling Film | Oakland, CA |
| Video editing software | Pinnacle Systems, Inc. | Pinnacle Studio, v24 | Mountain View, CA |
| Water circulating heating pad - for anesthesia induction/recovery station | Adroit Medical Systems | HTP-1500 Heat Therapy Pump | Loudon, TN |
| Xylazine | Vet One | NDC 13985-701-10; Anased, 100 mg/mL | Boise, ID |
References
- Brunner, E., Friedrich, G., Kiesler, K., Chibidziura-Priesching, J., Gugatschka, M. Subjective breathing impairment in unilateral vocal fold paralysis. Folia Phoniatr Logop. 63 (3), 142-146 (2011).
- Chandrasekhar, S. S., et al. Clinical practice guideline: improving voice outcomes after thyroid surgery. Otolaryngol Head Neck Surg. 148 (6 Suppl), S1-S37 (2013).
- Fang, T. J., et al. Quality of life measures and predictors for adults with unilateral vocal cord paralysis. Laryngoscope. 118 (10), 1837-1841 (2008).
- Wang, W., et al. Laryngeal reinnervation using ansa cervicalis for thyroid surgery-related unilateral vocal fold paralysis: a long-term outcome analysis of 237 cases. PLoS One. 6 (4), e19128 (2011).
- Cohen, S. M., et al. Association between dysphagia and inpatient outcomes across frailty level among patients >/= 50 years of age. Dysphagia. 35 (5), 787-797 (2020).
- Poulsen, S. H., et al. Signs of dysphagia and associated outcomes regarding mortality, length of hospital stay and readmissions in acute geriatric patients: Observational prospective study. Clin Nutr ESPEN. 45, 412-419 (2021).
- Lin, R. J., Smith, L. J., Munin, M. C., Sridharan, S., Rosen, C. A. Innervation status in chronic vocal fold paralysis and implications for laryngeal reinnervation. Laryngoscope. 128 (7), 1628-1633 (2018).
- Choi, J. S., et al. Functional regeneration of recurrent laryngeal nerve injury during thyroid surgery using an asymmetrically porous nerve guide conduit in an animal model. Thyroid. 24 (1), 52-59 (2014).
- Wang, B., et al. Neurotrophin expression and laryngeal muscle pathophysiology following recurrent laryngeal nerve transection. Mol Med Rep. 13 (2), 1234-1242 (2016).
- Woodson, G., Randolph, G. W. Pathophysiology of recurrent laryngeal nerve injury. Surgery of the Thyroid and Parathyroid Glands (Third Edition). , 404-409.e2 (2021).
- James, M., Palmer, O. Instrumentation and techniques for examination of the ear, nose, throat, and sinus. Oral Maxillofac Surg Clin North Am. 24 (2), 167-174 (2012).
- Patel, R. R., et al. Recommended protocols for instrumental assessment of voice: American Speech-Language-Hearing Association Expert Panel to develop a protocol for instrumental assessment of vocal function. Am J Speech Lang Pathol. 27 (3), 887-905 (2018).
- Kamarunas, E. E., McCullough, G. H., Guidry, T. J., Mennemeier, M., Schluterman, K. Effects of topical nasal anesthetic on fiberoptic endoscopic examination of swallowing with sensory testing (FEESST). Dysphagia. 29 (1), 33-43 (2014).
- Shock, L. A., et al. Improving the utility of laryngeal adductor reflex testing: a translational tale of mice and men. Otolaryngol Head Neck Surg. 153 (1), 94-101 (2015).
- Aviv, J. E., et al. Laryngopharyngeal sensory discrimination testing and the laryngeal adductor reflex. Ann Otol Rhinol Laryngol. 108 (8), 725-730 (1999).
- Farneti, D. The instrumental gold standard: fees. J Gastroenterol Hepatol Res. 3, 1281-1291 (2014).
- Hernandez-Morato, I., et al. Reorganization of laryngeal motoneurons after crush injury in the recurrent laryngeal nerve of the rat. J Anat. 222 (4), 451-461 (2013).
- Hernandez-Morato, I., Sharma, S., Pitman, M. J. Changes in neurotrophic factors of adult rat laryngeal muscles during nerve regeneration. Neuroscience. 333, 44-53 (2016).
- Tessema, B., et al. Evaluation of functional recovery of recurrent laryngeal nerve using transoral laryngeal bipolar electromyography: a rat model. Ann Otol Rhinol Laryngol. 117 (8), 604-608 (2008).
- Tessema, B., et al. Observations of recurrent laryngeal nerve injury and recovery using a rat model. Laryngoscope. 119 (8), 1644-1651 (2009).
- Monaco, G. N., et al. Electrical stimulation and testosterone enhance recovery from recurrent laryngeal nerve crush. Restor Neurol Neurosci. 33 (4), 571-578 (2015).
- Haney, M. M., Hamad, A., Leary, E., Bunyak, F., Lever, T. E. Automated quantification of vocal fold motion in a recurrent laryngeal nerve injury mouse model. Laryngoscope. 129 (7), E247-E254 (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Wang, B., et al. Functional regeneration of the transected recurrent laryngeal nerve using a collagen scaffold loaded with laminin and laminin-binding BDNF and GDNF. Sci Rep. 6, 32292 (2016).
- Hamad, A., Haney, M. M., Lever, T. E., Bunyak, F. Automated segmentation of the vocal folds in laryngeal endoscopy videos using deep convolutional regression networks. , 140-148 (2019).
- Wang, Y. Y., Hamad, A. S., Palaniappan, K., Lever, T. E., Bunyak, F. LARNet-STC: Spatio-temporal orthogonal region selection network for laryngeal closure detection in endoscopy videos. Comput Biol Med. 144, 105339 (2022).
- Lever, T. E., et al. Advancing laryngeal adductor reflex testing beyond sensory threshold detection. Dysphagia. 37 (5), 1151-1171 (2022).
- Wang, Y. Y., Hamad, A. S., Lever, T. E., Bunyak, F. Orthogonal region selection network for laryngeal closure detection in laryngoscopy videos. Annu Int Conf IEEE Eng Med Biol Soc. 2020, 2167-2172 (2020).
- Haney, M. M., et al. Recurrent laryngeal nerve transection in mice results in translational upper airway dysfunction. J Comp Neurol. 528 (4), 574-596 (2020).
- Mok, A., et al. A surgical mouse model for advancing laryngeal nerve regeneration strategies. Dysphagia. 35 (3), 419-437 (2020).
- Haney, M. M., Ericsson, A. C., Lever, T. E. Effects of intraoperative vagal nerve stimulation on the gastrointestinal microbiome in a mouse model of amyotrophic lateral sclerosis. Comp Med. 68 (6), 452-460 (2018).
- Lever, T. E., et al. A mouse model of pharyngeal dysphagia in amyotrophic lateral sclerosis. Dysphagia. 25 (2), 112-126 (2010).
- Struck, M. B., Andrutis, K. A., Ramirez, H. E., Battles, A. H. Effect of a short-term fast on ketamine-xylazine anesthesia in rats. J Am Assoc Lab Anim Sci. 50 (3), 344-348 (2011).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress. Altern Lab Anim. 33 (2), 119-127 (2005).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Welby, L., Maynard, T., Zohn, I., Lever, T. Fluoroscopic and endoscopic investigation of dysphagia in a mouse model of DiGeorge syndrome. Dysphagia. 34, 1003-1004 (2019).
- Mueller, M., et al. Impact of limb phenotype on tongue denervation atrophy, dysphagia penetrance, and survival time in a mouse model of ALS. Dysphagia. 37 (6), 1777-1795 (2022).
- Osman, K. L., et al. Optimizing the translational value of mouse models of ALS for dysphagia therapeutic discovery. Dysphagia. 35 (2), 343-359 (2020).
- Lever, T. E., et al. Videofluoroscopic validation of a translational murine model of presbyphagia. Dysphagia. 30, 328-342 (2015).
- Lever, T. E., et al. Adapting human videofluoroscopic swallow study methods to detect and characterize dysphagia in murine disease models. J Vis Exp. (97), 52319 (2015).
- Ballenger, B., et al. Targeted electrical stimulation of the superior laryngeal nerve - a potential treatment for dysphagia in ALS. FASEB J. 36 (S1), (2022).
- Kloepper, A., et al. An experimental swallow evoked potential protocol to investigate the neural substrates of swallowing. OTO Open. 4 (1), (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved