Method Article
Laringoscopia murina mínimamente invasiva para obtener imágenes de cerca del movimiento laríngeo durante la respiración y la deglución
En este artículo
Resumen
Este protocolo describe un enfoque de laringoscopia transoral seriada para ratones y ratas que permite obtener imágenes de video de cerca y sin obstrucciones de la laringe durante la respiración y la deglución utilizando un régimen anestésico optimizado y técnicas de manipulación endoscópica finamente ajustadas.
Resumen
La laringe es un órgano esencial en los mamíferos con tres funciones principales: respirar, tragar y vocalizar. Se sabe que una amplia gama de trastornos afectan la función laríngea, lo que provoca dificultad para respirar (disnea), deterioro de la deglución (disfagia) y/o deterioro de la voz (disfonía). La disfagia, en particular, puede provocar neumonía por aspiración y morbilidad asociada, hospitalización recurrente y mortalidad prematura. A pesar de estas graves consecuencias, los tratamientos existentes para la disfunción laríngea se dirigen en gran medida a intervenciones quirúrgicas y conductuales que, por desgracia, no suelen restaurar la función laríngea normal, lo que pone de manifiesto la necesidad urgente de soluciones innovadoras.
Para cerrar esta brecha, hemos estado desarrollando un enfoque endoscópico experimental para investigar la disfunción laríngea en modelos murinos (es decir, ratón y rata). Sin embargo, la endoscopia en roedores es bastante desafiante debido a su pequeño tamaño en relación con la tecnología actual de endoscopios, las diferencias anatómicas en la vía aérea superior y la necesidad de anestesia para acceder de manera óptima a la laringe. Aquí, describimos un nuevo enfoque de laringoscopia transoral que permite obtener imágenes de video en primer plano y sin obstrucciones del movimiento laríngeo en ratones y ratas. Los pasos críticos en el protocolo incluyen el manejo preciso de la anestesia (para evitar una sobredosis que suprima la deglución y/o corra el riesgo de mortalidad relacionada con la dificultad respiratoria) y el control del endoscopio con micromanipulador (para la grabación de video estable del movimiento laríngeo por un solo investigador para su posterior cuantificación).
Es importante destacar que el protocolo se puede realizar a lo largo del tiempo en los mismos animales para estudiar el impacto de diversas condiciones patológicas específicamente en la función laríngea. Una ventaja novedosa de este protocolo es la capacidad de visualizar la protección de las vías respiratorias durante la deglución, lo que no es posible en los humanos debido a la inversión epiglótica sobre la entrada laríngea que obstruye la glotis de la vista. Por lo tanto, los roedores brindan una oportunidad única para investigar específicamente los mecanismos de protección de las vías respiratorias laríngeas normales frente a las patológicas con el propósito final de descubrir tratamientos para restaurar eficazmente la función laríngea normal.
Introducción
La laringe es un órgano cartilaginoso ubicado en la intersección de los tractos respiratorio y digestivo en la garganta, donde funciona como un mecanismo de válvulas para controlar con precisión el flujo y la dirección del aire (es decir, durante la respiración y la vocalización) frente a los alimentos y líquidos (es decir, durante la deglución). Se sabe que una amplia gama de trastornos afectan a la laringe, incluidos los congénitos (por ejemplo, laringomalacia, estenosis subglótica), neoplásicos (por ejemplo, papilomatosis laríngea, carcinoma de células escamosas), neurológicos (por ejemplo, parálisis laríngea idiopática, accidente cerebrovascular, enfermedad de Parkinson, esclerosis lateral amiotrófica) e iatrogénicos (por ejemplo, lesiones inadvertidas durante una cirugía de cabeza o cuello). Independientemente de la etiología, la disfunción laríngea suele dar lugar a una tríada de síntomas de disnea (dificultad para respirar), disfonía (alteración de la voz) y disfagia (alteración de la deglución) que repercuten negativamente en el bienestar económico y social de la persona 1,2,3,4.
Además, la disfagia, particularmente en individuos médicamente frágiles, puede conducir a neumonía por aspiración (debido a que los alimentos o líquidos se escapan a través de una laringe incompletamente cerrada hacia los pulmones) y morbilidad asociada, hospitalización recurrente y mortalidad precoz 5,6. A pesar de estas graves consecuencias, los tratamientos existentes para la disfunción laríngea se dirigen en gran medida a intervenciones quirúrgicas y conductuales que normalmente no restauran la función laríngea normal 1,2,7,8,9,10, lo que pone de manifiesto la necesidad urgente de soluciones innovadoras. Con este objetivo, hemos estado desarrollando un enfoque endoscópico experimental para investigar la disfunción laríngea en modelos murinos (es decir, ratón y rata).
En medicina humana, el estándar de oro para la evaluación de la disfunción laríngea es la visualización endoscópica, denominada laringoscopia 11,12. Por lo general, se pasa un endoscopio flexible a través de la nariz para examinar la laringe, particularmente las cuerdas vocales y las estructuras laríngeas supraglóticas y subglóticas adyacentes. También se puede utilizar un endoscopio rígido para visualizar la laringe a través de la cavidad oral. Cualquiera de los dos enfoques permite el examen macroscópico de la anatomía laríngea y puede utilizarse para evaluar la movilidad y la función laríngea durante la respiración, la fonación y una variedad de reflejos protectores de las vías respiratorias, como la tos y el reflejo del aductor laríngeo 13,14,15,16. Sin embargo, durante la deglución, la laringe queda completamente oscurecida por la epiglotis a medida que se invierte para cubrir la entrada laríngea, protegiéndola del camino del bolo alimenticio/líquido que se traga. Como resultado, la visualización directa del movimiento laríngeo durante la deglución no es posible en humanos y, por lo tanto, debe inferirse indirectamente utilizando otros enfoques de diagnóstico (por ejemplo, fluoroscopia, electromiografía, electroglottografía).
Este artículo describe un innovador protocolo de laringoscopia para ratones y ratas que permite obtener imágenes de cerca y sin obstrucciones de la respiración y la protección de las vías respiratorias durante la deglución bajo anestesia ligera. El protocolo es compatible con una variedad de sistemas de endoscopia disponibles en el mercado en combinación con una plataforma personalizada para inmovilizar al roedor anestesiado durante todo el procedimiento. Es importante destacar que son posibles numerosos diseños/configuraciones de plataformas endoscópicas, dependiendo de los recursos disponibles y la agenda de investigación de cada laboratorio. Nuestra intención aquí es proporcionar orientación para que los investigadores la consideren en el contexto de su investigación. Además, nuestro objetivo es demostrar cómo este protocolo de laringoscopia puede conducir a una gran cantidad de datos objetivos que pueden generar nuevos conocimientos sobre nuestra comprensión de la disfunción laríngea y la regeneración.
El efecto combinado de todos los pasos descritos en este protocolo de laringoscopia murina da como resultado un examen mínimamente invasivo de la laringe murina adulta que se puede repetir en los mismos animales para detectar y caracterizar la disfunción laríngea a lo largo del tiempo en respuesta a una lesión iatrogénica, progresión de la enfermedad y/o intervención de tratamiento en relación con la protección de las vías respiratorias. Cabe destacar que este protocolo no evalúa la función laríngea relacionada con la vocalización.
Protocolo
El protocolo de laringoscopia murina sigue un protocolo aprobado por el Comité Institucional de Cuidado y Uso de Animales (IACUC, por sus siglas en inglés) y las pautas de los Institutos Nacionales de Salud (NIH, por sus siglas en inglés). Fue desarrollado para su uso con más de 100 ratones C57BL/6J adultos y más de 50 ratas Sprague Dawley adultas, de sexos aproximadamente iguales y de 6 semanas a 12 meses de edad para ambas especies. Es necesario el desarrollo de protocolos adicionales para la adaptación a roedores más jóvenes/pequeños. Los animales se alojaron en grupos (hasta cuatro ratones o dos ratas por jaula, según el sexo y la camada). Las condiciones estándar del vivero incluían jaulas estáticas con una regulación estricta de la temperatura ambiente (20-26 °C), la humedad (30%-70%) y un ciclo de luz estándar de 12 h. Todos los animales recibieron materiales de enriquecimiento frescos (p. ej., cabaña/pipa, golosinas dentales, polluelos) en los cambios semanales de jaula. Se proporcionó acceso ilimitado a alimentos y agua, excepto durante una restricción de alimentos corta (hasta 4-6 h) antes de la anestesia, como se describe a continuación. El personal veterinario y de investigación monitoreaba a los animales todos los días.
1. Anestesia animal que no suprime la deglución
- Use equipo de protección personal adecuado (p. ej., guantes, mascarilla) para minimizar la exposición a alérgenos mientras trabaja con roedores.
- Restrinja la alimentación de cada jaula de roedores hasta 4-6 horas antes de la anestesia para minimizar la retención de comida en la cavidad oral y la faringe, lo que puede interferir con la visualización endoscópica y/o provocar la aspiración de alimentos durante el procedimiento.
NOTA: La retención de alimentos en la cavidad bucal es un hallazgo normal en roedores sin disfagia si no han sido restringidos por alimentos. - Preparar una "estación de calentamiento" para la inducción/recuperación de los animales.
- Precaliente una almohadilla térmica que circula con agua a 37 °C sobre una superficie de sobremesa.
- Seleccione jaulas de inducción/recuperación del tamaño adecuado para las especies que se están probando. Por ejemplo, las jaulas de cajas de zapatos para ratones con tapas superiores con filtro tienen el tamaño adecuado para la inducción/recuperación de ratones y ratas. Utilice una jaula de inducción/recuperación nueva para cada animal que se esté sometiendo a pruebas; Utilice una sola jaula como jaula de inducción y recuperación para el mismo animal.
- Cubra el piso de la jaula de inducción/recuperación con una capa ligera de material absorbente (por ejemplo, virutas de álamo, toalla de papel, almohadilla para cachorros) para calentar y absorber las secreciones corporales durante la inducción y recuperación de la anestesia.
- Coloque las jaulas preparadas (con tapas superiores de filtro) completamente sobre la almohadilla térmica durante 30-60 minutos antes de la inducción de la anestesia.
NOTA: Este microambiente proporciona suficiente calor suplementario para promover un metabolismo estable de la anestesia durante la inducción y la recuperación.
- Coloque la jaula del animal a mitad de camino sobre la almohadilla térmica precalentada a 37 °C durante aproximadamente 30 minutos antes de la inducción de la anestesia.
NOTA: Proporcionar calor suplementario antes del procedimiento puede acelerar la inducción de la anestesia y prevenir una sobredosis accidental debido al metabolismo lento o retrasado de la anestesia debido a la hipotermia. - Prepare la anestesia con ketamina-xilacina (KX) según la especie y el peso corporal.
- Para ratones: Una mezcla de 90 mg/kg de ketamina y 11 mg/kg de xilacina es suficiente para la laringoscopia transoral en ratones adultos de fondo C57BL/6 de ambos sexos. Ajuste las dosis para otras cepas de ratones y edades.
- Para ratas: Una mezcla de 60 mg/kg de ketamina y 6 mg/kg de xilacina es suficiente para la laringoscopia transoral en ratas Sprague Dawley adultas de ambos sexos. Ajuste las dosis para otras cepas y edades de ratas.
- Precaliente los agentes anestésicos llenos de jeringa en la estación de calentamiento a 37 °C para evitar la pérdida de calor en los animales que se produce al inyectar líquidos fríos.
- Inyecte al roedor la dosis KX calculada utilizando una jeringa (p. ej., 1 mL) y una aguja (p. ej., 26 G1/2) del tamaño adecuado.
- Para ratones: Administrar una sola inyección subcutánea (SC).
NOTA: En nuestra experiencia, las inyecciones de SC en ratones reducen/suprimen la mortalidad relacionada con la anestesia en comparación con las inyecciones intraperitoneales (IP). - Para ratas: Administrar una sola inyección SC o IP. Si se prefiere, sedar ratas con isoflurano (ISO) (3-5%) en una cámara de inducción inmediatamente antes de la inyección de KX.
NOTA: El movimiento espontáneo del cuerpo puede reanudarse durante un breve período (generalmente <1 minuto) hasta que el KX haga efecto.
- Para ratones: Administrar una sola inyección subcutánea (SC).
- Administrar glicopirrolato (agente anticolinérgico) inmediatamente después de la inyección de KX para reducir el exceso de secreciones salivales que pueden dificultar la visualización de la laringe durante la endoscopia transoral y/o obstruir mecánicamente la vía aérea superior durante la recuperación de la anestesia.
NOTA: La dosis y la vía de administración son idénticas para ratones y ratas (0,01-0,02 mg/kg SC), y el efecto es casi inmediato y dura varias horas. - Después de la inyección de glicopirrolato, coloque el roedor anestesiado en la jaula de inducción precalentada en la estación de calentamiento y cubra la jaula con un paño quirúrgico para proporcionar un ambiente oscuro que minimice la estimulación visual durante 10 minutos, sin molestias.
- Finalice el procedimiento si el roedor permanece ambulatorio 10 minutos después de la dosis inicial de KX.
NOTA: Los intentos de proporcionar anestesia adicional (ya sea mantenimiento con KX o ketamina) probablemente serán inútiles.
- Finalice el procedimiento si el roedor permanece ambulatorio 10 minutos después de la dosis inicial de KX.
- Después de 10 minutos, administre una dosis de mantenimiento de ketamina (1/4 de la dosis inicial si los reflejos de las extremidades posteriores están disminuidos o 1/2 de la dosis inicial si los reflejos de las extremidades posteriores son enérgicos; SC para ratones y SC/IP para ratas) para mantener la anestesia.
- Aplique ungüento oftálmico en ambos ojos para prevenir la sequedad de la córnea y el trauma asociado durante el procedimiento de laringoscopia.
- Transfiera el roedor anestesiado a una plataforma endoscópica personalizada para comenzar el procedimiento de laringoscopia.
NOTA: Diseñamos nuestra plataforma de endoscopia (Figura 1) para que tenga múltiples funcionalidades para su uso con una variedad de enfoques quirúrgicos y electrofisiológicos en roedores que no necesariamente requieren endoscopia. Como tal, está sobreconstruido para uso puramente endoscópico. Cuando sea relevante, destacaremos las características/componentes que son esenciales para este protocolo de laringoscopia. - A partir de este momento, verifique los reflejos de las extremidades traseras cada 15-20 minutos durante todo el procedimiento y proporcione dosis adicionales de mantenimiento de ketamina según sea necesario, espaciadas al menos 20 minutos. Como este es un procedimiento relativamente corto (generalmente <45 min bajo anestesia), rara vez se requiere ketamina adicional después de la dosis de mantenimiento inicial.
2. Paso transoral del endoscopio para visualizar la laringe
- Antes de anestesiar al animal, prepare un endoscopio de tamaño adecuado con capacidad de grabación de video.
NOTA: Utilizamos habitualmente un otoscopio de cero grados con un diámetro de eje de 1,9 mm y una longitud de eje de 10 cm con una funda metálica personalizada (Figura 2), que es el endoscopio representativo utilizado en todo este protocolo.- Conecte el endoscopio a una fuente de luz y a un sistema de grabación endoscópica para visualizarlo y grabarlo en vídeo en tiempo real a un mínimo de 30 fotogramas por segundo (fps).
- Enfoque y balance de blancos de la cámara para obtener una calidad de imagen óptima.
- Conecte el endoscopio a un micromanipulador.
NOTA: Para el seguimiento del movimiento laríngeo, aseguramos el endoscopio a un micromanipulador en la plataforma de endoscopia para permitir un control preciso del endoscopio para una captura de video estable.
- Asegure al roedor en decúbito dorsal en una plataforma climatizada. Estabilice e inmovilice la cabeza asegurándola con barras para los oídos.
- Asegúrese de que la cabeza del roedor pueda girar libremente hacia arriba o hacia abajo (pero no de lado a lado) en las barras de los oídos sin salirse. Este grado de libertad facilita la inserción transoral y el avance del endoscopio para llegar a la laringe.
- Si se desea un registro electrofisiológico sincrónico de la respiración, la deglución y la coordinación de la deglución-respiración durante la endoscopia, se proceda a la aplicación de sensores adecuados para este fin (Figura 3).
- Fije un sensor respiratorio al abdomen en la línea media, inmediatamente caudal a la apófisis xifoidea, utilizando cinta quirúrgica.
- Afeitar y limpiar/desinfectar la piel con una toallita con alcohol antes de insertar los electrodos de la aguja para prevenir infecciones.
- Use una aguja de 22 G para perforar una pequeña abertura a través de la piel antes de insertar el electrodo de aguja para evitar daños en la aguja de electromiografía (EMG).
- Inserte un electrodo de aguja EMG concéntrico estéril (p. ej., 25 mm x 0,3 mm/30 G) a través de la piel submentoniana en la línea media hasta la base de la lengua (p. ej., músculo geniogloso o geniohioideo, dependiendo de la profundidad de inserción de la aguja).
- Inserte un electrodo de tierra (por ejemplo, acero inoxidable de 27 G) por vía subcutánea en la cadera (a ambos lados).
- Conecte el sensor respiratorio y los electrodos de aguja EMG a un sistema de registro de electrofisiología (por ejemplo, bioamplificador y sistema de adquisición de datos con captura de video síncrona) y verifique las señales de electrofisiología limpias en ambos canales antes de continuar.
- Envuelva los sitios de conexión de los electrodos con papel de aluminio para protegerlos contra el ruido eléctrico y mejorar la relación señal-ruido en los registros electrofisiológicos correspondientes.
- Ajuste la ubicación del sensor respiratorio y la profundidad del electrodo de la aguja EMG según sea necesario para obtener señales electrofisiológicas limpias en ambos canales. Para seguir este protocolo, utilice una frecuencia de muestreo de 1k para la respiración y una frecuencia de muestreo de 20k y un filtro de paso de banda (por ejemplo, 150-3.000 Hz) para EMG.
- Cubra el torso del roedor (y el sensor respiratorio) con una manta transparente para facilitar la termorregulación y permitir la visualización del movimiento abdominal durante la respiración. Deje las extremidades traseras y la parte inferior del abdomen expuestas libremente para acceder a ellas durante los controles de reflejos y la redosis de mantenimiento de ketamina. Asegúrese de que la manta no restrinja el movimiento abdominal durante la respiración.
- Continuar con la endoscopia transoral (Figura 4).
- Abra la boca del roedor insertando un aplicador cónico con punta de algodón detrás de los incisivos centrales, perpendicular a la mandíbula. Gire el hisopo de algodón en la superficie dorsal de la lengua para que sobresalga ligeramente de la boca.
- Con un ligero agarre con el dedo, tire suavemente de la lengua ligeramente fuera de la boca hacia un lado de los incisivos centrales mientras inserta la punta del endoscopio en la cavidad oral (Figura 4A, B).
- Encienda la fuente de luz después de insertar la punta del endoscopio en la boca para evitar dañar potencialmente los ojos del roedor.
- Inserte el endoscopio lateral a los incisivos en el mismo lado que la lengua retraída. Los incisivos centrales impiden que el endoscopio se inserte en la línea media, por lo que es necesario este abordaje de inserción lateral.
- Poner en marcha los sistemas de registro de endoscopia (y electrofisiología). Registre continuamente a lo largo de todo el procedimiento para garantizar datos suficientes para el análisis post hoc o registre en momentos seleccionados, según las necesidades del estudio.
- Avance con cuidado el endoscopio para visualizar la orofaringe, teniendo cuidado de no raspar el paladar duro ni aplicar una presión excesiva sobre la lengua que pueda causar lesiones.
- Elimine cualquier partícula de comida visible y/o el exceso de secreciones salivales con un hisopo del tamaño adecuado (por ejemplo, un microcepillo de 1,5 mm) para minimizar el riesgo de aspiración a medida que avanza el procedimiento.
- Continúe avanzando/ajustando la posición del endoscopio hasta que la hipofaringe esté centrada dentro del campo de visión del monitor y se identifiquen las estructuras anatómicas clave (Figura 4C). En este punto, todas las estructuras deben aparecer anatómicamente alineadas/simétricas dentro del campo de visión de la cámara; De lo contrario, vuelva a colocar el endoscopio según sea necesario.
- Esté atento al movimiento evocado de la mandíbula/lengua durante el avance del endoscopio. Si está ausente, proceda sin volver a dosificar la ketamina. Si está presente, administre una segunda dosis de mantenimiento de ketamina (1/4 a 1/2 de la dosis inicial de ketamina) y espere aproximadamente 5 minutos para que haga efecto antes de continuar. Vuelva a administrar la dosis solo si han pasado al menos 20 minutos desde la inyección anterior para evitar la sedación excesiva y la abolición de la deglución.
- Examine la lengua del roedor cada 5 minutos durante todo el procedimiento para ver si hay decoloración oscurecida, que es indicativa de isquemia. Para evitar esto, vuelva a colocar el endoscopio según sea necesario.
- Aplique una ligera presión sobre el velo con una microsonda (por ejemplo, una espátula de metal) insertada junto al endoscopio para desacoplar el paladar blando y la epiglotis para visualizar la laringe a distancia (Figura 4D). Evite utilizar la punta del endoscopio para desacoplarla, ya que la presión aplicada puede causar daños en los tejidos blandos o doblar/dañar permanentemente el eje del endoscopio.
NOTA: A diferencia de los humanos, la laringe murina no es directamente visible desde una perspectiva transoral. En cambio, la epiglotis queda atrapada mecánicamente debajo de una membrana mucosa que recubre el velo, lo que da lugar a la formación de un espacio hipofaríngeo sin salida. La aplicación de una ligera presión sobre el velo libera la epiglotis de la membrana velar para dar una vista parcial de la laringe. - Observe si hay golondrinas evocadas durante el desacoplamiento del velo y la epiglotis.
- Identifique las degluciones como desplazamientos bruscos y breves de la lengua posterior hacia el paladar duro. Este movimiento generalmente ocurre en sincronía con un breve movimiento/depresión mandibular, lo que proporciona un sustituto para la identificación de la deglución cuando la lengua posterior no es fácilmente visible en el campo de visión del endoscopio.
- También identifique las degluciones a través de la actividad de ruptura de EMG de la lengua junto con breves episodios de apnea en el registro electrofisiológico, ambos ocurriendo en sincronía con los eventos de cierre glótico en el video endoscópico.
- En el caso de deglución rápida y repetitiva indicativa de anestesia insuficiente (es decir, demasiado ligera), vuelva a dosificar y espere ~ 5-10 minutos antes de continuar. Espere al menos 20 minutos después de la inyección de mantenimiento de ketamina anterior para evitar la sobresedación y la abolición de la deglución.
- Considere que la profundidad anestésica es óptima cuando solo se evocan unas pocas degluciones durante el desacoplamiento velar-epiglótico.
- Si se suprime la deglución, la anestesia es demasiado profunda para evaluar la protección de las vías respiratorias laríngeas. En este caso, espere de 5 a 10 minutos para el metabolismo de la ketamina antes de continuar con la visualización de cerca de la laringe.
3. Grabación de video en primer plano, sin obstrucciones, del movimiento laríngeo durante la respiración y la deglución evocada
NOTA: El registro electrofisiológico sincrónico de la respiración, la deglución y la coordinación de la deglución y la respiración también es una opción.
- Avance lentamente el endoscopio entre el velo y la epiglotis mientras mantiene la laringe en el centro del campo de visión (Figura 5A-C).
NOTA: La punta del endoscopio pasará fácilmente a través de la abertura velar-epiglótica sin fuerza. De lo contrario, aborte el procedimiento para evitar posibles daños al animal. Es posible visualizar la laringe a distancia, con la punta del endoscopio en la hipofaringe. Sin embargo, este enfoque generalmente requiere la retracción manual de la epiglotis, el velo y/o la lengua para mejorar la visualización de la laringe. Sin embargo, partes de la laringe suelen permanecer ocultas a la vista, y los dispositivos de retracción pueden restringir el movimiento laríngeo, lo que puede confundirse con una disfunción. - Continúe avanzando el endoscopio para obtener una vista cercana sin obstrucciones de todas las dimensiones ventral-dorsal y lateral de la laringe en un solo campo de visión (Figura 5C).
NOTA: La comisura ventral puede estar obstruida por la epiglotis, particularmente en ratones más jóvenes/pequeños. En estos casos, intentar manipular de manera más agresiva la punta del endoscopio para visualizar la comisura ventral puede restringir el movimiento laríngeo, lo que puede confundirse con una disfunción. También puede bloquear el flujo de aire laríngeo, lo que resulta en asfixia. - Observe el movimiento oscilatorio de la laringe a medida que el roedor inhala (ensanchamiento glotal) y exhala (estrechamiento glotal) durante cada ciclo respiratorio.
NOTA: La velocidad y la magnitud del movimiento laríngeo/glotal pueden variar con la profundidad del anestésico; Sin embargo, un espacio glotal (es decir, el espacio de aire entre los aritenoides izquierdo/derecho y las cuerdas vocales) generalmente permanece visible durante todo el ciclo respiratorio en roedores sanos.- Si se observa un estrechamiento glótico marcado, ajuste la posición del endoscopio para garantizar un flujo de aire sin obstrucciones a través de las vías respiratorias superiores. Por ejemplo, evite aplicar presión sobre el velo, lo que puede causar la obstrucción de los tejidos blandos de las vías respiratorias nasales. También evite insertar la punta del endoscopio en el espacio glotal, ya que puede bloquear el flujo de aire laríngeo y provocar asfixia. Si en casos raros, la respiración cesa, realice varias compresiones torácicas del esternón medio (con un dedo) o ventilación con presión positiva (usando una "bolsa de reanimación" en miniatura) después de retirar el endoscopio.
- Grabación de vídeo del movimiento respiratorio laríngeo durante 30-60 s con fines de evaluación post hoc.
- Con la laringe aún a la vista de cerca, ajuste ligeramente la punta del endoscopio dentro de la entrada laríngea para aplicar estimulación mecánica a la mucosa que recubre el velo y/o la epiglotis, y evocar la deglución en roedores anestesiados de manera óptima.
- Utilice ajustes de micronivel de la punta del endoscopio (es decir, ~ 1 mm en cualquier dirección) para evitar lesiones en la mucosa y/o obstrucción de las vías respiratorias.
- Esté atento a las degluciones evocadas, que pueden identificarse fácilmente como eventos de cierre glótico abrupto que ocurren en sincronía con depresión visible de la mandíbula, actividad de estallido de EMG de la lengua y apnea breve (<1/2 s) que es visible en el rastro respiratorio.
NOTA: Pueden ocurrir eventos de cierre glótico sin movimiento simultáneo de la mandíbula; Sin embargo, el cierre glótico suele ser incompleto en estos casos. Sospechamos que pueden tratarse de otros reflejos protectores de las vías respiratorias (p. ej., reflejo del aductor laríngeo) que surgen a medida que el efecto de la anestesia comienza a desaparecer; sin embargo, son ocurrencias raras o inconsistentes que requieren una investigación más profunda. - Repita hasta que se evoquen de 5 a 10 golondrinas y se grabe un video por animal. Si se suprime la deglución, retire el endoscopio y espere de 5 a 10 minutos a que se produzca el metabolismo de la ketamina antes de continuar.
- Retraiga con cuidado, pero no retire, el endoscopio en la orofaringe y centre la hipofaringe en el campo de visión para visualizar la epiglotis y el velo.
- Vuelva a acoplar el velo y la epiglotis para reanudar la respiración nasal mediante el uso de un microhisopo para aplicar una ligera presión contra la base de la lengua para evocar la deglución y el reatrapamiento de la epiglotis debajo de la membrana velar. Si el reacoplamiento no ocurre en unos pocos intentos, proceda con la recuperación de la anestesia sin reacoplamiento para evitar el riesgo de lesión laríngea.
- Detenga el registro de la endoscopia (y la electrofisiología).
- Use un hisopo de algodón empapado en solución salina para humedecer la lengua y los incisivos centrales y devolver la lengua a su posición anatómica dentro de la cavidad oral.
- Separe las barras de los oídos y retire la sonda de temperatura, el sensor respiratorio y los electrodos EMG del roedor para continuar con la recuperación de la anestesia.
4. Recuperación de la anestesia
- Coloque al animal en una jaula de recuperación precalentada (es decir, igual que la jaula de inducción) en la "estación de calentamiento" para recuperarse de la anestesia.
- Vuelva a aplicar el lubricante para ojos para evitar que se seque.
- Administrar solución salina tibia SC para la hidratación de líquidos: hasta 5 mL para ratas y hasta 0,5 mL para ratones.
- Administrar atipamezol SC para revertir la xilacina y aumentar el impulso respiratorio: 1-2 mg/kg para ratas y ratones.
- Comience con 2 mg/kg de atipamezol, seguido inmediatamente por la estimulación manual a lo largo de la espalda y el estómago del roedor para acelerar la recuperación.
NOTA: Con este enfoque, el movimiento espontáneo de la cabeza generalmente comienza dentro de 1-3 minutos. Sin embargo, el retorno al estado ambulatorio suele tardar un promedio de 2 h (entre 1 h y 5 h) después de la laringoscopia bajo anestesia KX, debido a las diferencias individuales. - Proporcionar atipamezol adicional en dosis de 1 mg/kg (al menos 15 minutos después de la primera inyección) si el movimiento espontáneo del cuerpo está disminuyendo en lugar de aumentar dentro de los primeros 15-30 minutos de la recuperación de la anestesia, a pesar de proporcionar estimulación manual frecuente.
- Proceda con la administración de doxapram (5 mg/kg IP para ratas y ratones) si la actividad espontánea continúa disminuyendo. Vuelva a dosificar con este agente de "rescate de emergencia" a intervalos de 10 a 15 minutos (hasta cinco dosis) hasta que surja un movimiento espontáneo. Si los roedores permanecen moribundos, eutanasia a los animales utilizando métodos de eutanasia aprobados (por ejemplo, una sobredosis de ketamina seguida de un método secundario como la decapitación).
- Comience con 2 mg/kg de atipamezol, seguido inmediatamente por la estimulación manual a lo largo de la espalda y el estómago del roedor para acelerar la recuperación.
- Vigile de cerca a los roedores en recuperación a intervalos de 15 a 20 minutos para detectar cambios adversos en el estado respiratorio, la movilidad y la termorregulación y proporcionar intervención según sea necesario (p. ej., estimulación manual, oxígeno suplementario, manta térmica, inyecciones de atipamezol o doxapram). Proporcionar un monitoreo más frecuente de los roedores que requieren intervención.
- Proporcione oxígeno suplementario (p. ej., 1-2 L/min en una cámara de inducción calentada, sin ISO) durante intervalos de 10 minutos, según sea necesario para roedores con tiempos prolongados de recuperación de la anestesia KX. Alternativamente, aplique estimulación frecuente a lo largo de las superficies dorsal y ventral del animal para normalizar los niveles de SpO2 (>94%).
- Coloque a los compañeros de jaula en recuperación en la misma jaula de recuperación (hasta dos roedores por jaula) para promover una mayor actividad espontánea y una recuperación más rápida.
- Regrese los roedores a su jaula doméstica calentada cuando puedan moverse espontáneamente alrededor de la jaula de recuperación.
- Regrese la botella estándar de comida y agua a la jaula de la casa. No proporcione adaptaciones especiales para el acceso a alimentos/agua mientras el efecto de la anestesia aún está desapareciendo para minimizar el riesgo de asfixia/aspiración.
- Observe la actividad de la jaula en casa y retire cualquier obstáculo que impida la deambulación (por ejemplo, cabaña, tubería de PVC).
- Coloque la jaula de casa medio encendida y mitad alejada de la estación de calentamiento durante las próximas 12-16 h (es decir, toda la noche).
NOTA: La interrupción temprana del calor suplementario puede provocar la mortalidad debido a la hipotermia.
- Realice controles de salud estándar a la mañana siguiente. Regrese a los animales con la reanudación de la actividad normal/inicial, las funciones corporales (p. ej., termorreguladores, comer, beber, orinar, defecar) y el peso estable (es decir, mantener o aumentar) a las condiciones estándar del vivero con un monitoreo de salud diario de rutina. En el raro caso de que los roedores hayan disminuido la actividad, las funciones corporales o el peso corporal, continúe con el calor suplementario durante otro día.
NOTA: Para las ratas, es común que la tinción de porfirina aparezca repentinamente alrededor de ambos ojos ~ 3-6 h en el período de recuperación de la anestesia. La tinción suele resolverse en 24 horas.
5. Cuantificación objetiva del movimiento laríngeo durante la respiración frente a la deglución
- Utilice un software de edición de vídeo con una función de análisis fotograma a fotograma para ver los vídeos de endoscopia.
- Identifique al menos un episodio representativo de 10 a 20 s de respiración espontánea por animal.
- Identifique de 3 a 5 eventos representativos de deglución por animal.
- Asegúrese de que los episodios/eventos de respiración y deglución seleccionados cumplan con los siguientes criterios de análisis: la laringe centrada en el campo de visión de la cámara con todas las estructuras/bordes laríngeos visibles (es decir, no oscurecidos por el vévulo, la epiglotis o el exceso de secreciones salivales), suficiente iluminación (es decir, capaz de ver todas las estructuras/bordes laríngeos) y sin artefacto de movimiento de la cámara (es decir, el endoscopio no se mueve).
- Analizar los episodios/eventos de respiración y deglución identificados utilizando enfoques subjetivos y/u objetivos.
- Para el análisis subjetivo: Utilice una escala Likert para puntuar subjetivamente el movimiento laríngeo durante la visualización en tiempo real y fotograma a fotograma utilizando un software de edición de vídeo. Para seguir este protocolo, utilice una escala de Likert ampliada que vaya de -2 a +2, donde los valores negativos indican el movimiento laríngeo en la dirección opuesta a la esperada. Estimación de la protección de la vía aérea laríngea durante la deglución, donde 0 = ninguna reducción en el tamaño del espacio glotal (es decir, sin protección de la vía aérea laríngea), 1 = cierta reducción del espacio glotal (es decir, protección incompleta de la vía aérea) y 2 = aducción completa de los aritenoides, con solo un pequeño espacio glotal ventral entre las cuerdas vocales (es decir, protección completa de la vía aérea), con valores negativos que indican movimiento laríngeo paradójico.
NOTA: Una escala de Likert que va de 0 a 2 se usa comúnmente en estudios con roedores, donde 0 = sin movimiento, 1 = algo de movimiento y 2 = movimiento normal 17,18,19,20,21,22. Sin embargo, esta escala no tiene en cuenta el movimiento laríngeo paradójico que a menudo ocurre después de una lesión recurrente del nervio laríngeo (RLN)10. - Para el análisis objetivo: Identifique cuatro fotogramas clave de vídeo: 1) el fotograma de reposo que precede directamente al inicio de la aducción laríngea (es decir, el fotograma antes de que las cuerdas vocales se aducyan), 2) el fotograma en el que las cuerdas vocales han completado la aducción, 3) el fotograma inmediatamente anterior a la abducción de las cuerdas vocales (esto puede superponerse con el #2), y 4) el fotograma en el que las cuerdas vocales han abducido completamente y vuelven a una posición de reposo para reanudar la respiración. Utilice la marca de tiempo de estos cuatro fotogramas clave para calcular la duración de la aducción de las cuerdas vocales (fotograma 1 a fotograma 2), el cierre glótico (fotograma 2 al fotograma 3), la abducción de las cuerdas vocales (fotograma 3 a fotograma 4) y la duración total de la deglución (fotograma 1 a fotograma 4). Alternativamente, utilice otro software comercial existente23 para medir el ángulo glotal (es decir, entre los aritenoides dorsalmente o las cuerdas vocales ventralmente) durante la abducción máxima y la aducción máxima utilizando imágenes fijas 17,18,24. Hacer que al menos dos revisores capacitados realicen este proceso de forma independiente y ciega, identificar discrepancias entre los revisores y llegar a un consenso conjunto para cada discrepancia.
NOTA: Anteriormente realizamos este análisis manual fotograma a fotograma de los eventos de tiempo de cierre glótico (es decir, durante los reflejos protectores de las vías respiratorias) utilizando software comercial de edición de video en roedores y humanos14. Sin embargo, este enfoque es ineficiente y solo proporciona una cuantificación limitada de la dinámica del movimiento laríngeo. Actualmente utilizamos software de seguimiento laríngeo propio para realizar una cuantificación objetiva más extensa del movimiento laríngeo durante la respiración y los reflejos protectores de las vías respiratorias 22,25,26,27,28,29,30. El software cuenta con capacidad de seguimiento automatizado fotograma a fotograma para la cuantificación objetiva del movimiento, la distancia (amplitud) y el tiempo (frecuencia) del movimiento laríngeo del lado izquierdo frente al derecho. Utilizamos estos parámetros para derivar una variedad de mediciones basadas en el movimiento para detectar/cuantificar la disfunción laríngea (p. ej., ángulo glotal máximo/mínimo/rango, simetría del movimiento laríngeo y sincronía) durante la respiración, la deglución y otros reflejos protectores de las vías respiratorias (p. ej., reflejo del aductor laríngeo). Este software aún está en proceso de perfeccionamiento y aún no está disponible comercialmente/públicamente.
- Para el análisis subjetivo: Utilice una escala Likert para puntuar subjetivamente el movimiento laríngeo durante la visualización en tiempo real y fotograma a fotograma utilizando un software de edición de vídeo. Para seguir este protocolo, utilice una escala de Likert ampliada que vaya de -2 a +2, donde los valores negativos indican el movimiento laríngeo en la dirección opuesta a la esperada. Estimación de la protección de la vía aérea laríngea durante la deglución, donde 0 = ninguna reducción en el tamaño del espacio glotal (es decir, sin protección de la vía aérea laríngea), 1 = cierta reducción del espacio glotal (es decir, protección incompleta de la vía aérea) y 2 = aducción completa de los aritenoides, con solo un pequeño espacio glotal ventral entre las cuerdas vocales (es decir, protección completa de la vía aérea), con valores negativos que indican movimiento laríngeo paradójico.
Resultados
El uso exitoso de este protocolo de laringoscopia murina da como resultado la visualización de cerca de la laringe durante la respiración espontánea y la deglución evocada en condiciones saludables y de enfermedad, como se muestra en la Figura 6. Además, este protocolo puede repetirse varias veces en los mismos roedores para permitir la investigación de la función/disfunción laríngea a lo largo del tiempo. Como se muestra en la Figura 7, repetimos con éxito este protocolo de laringoscopia 6 veces durante un período de tiempo de 4 meses para investigar el patrón de recuperación espontánea en un modelo quirúrgico de rata de lesión por RLN (datos aún no publicados). Los intentos de utilizar la anestesia ISO en lugar de KX resultaron en la casi abolición de la deglución (Figura 8) en roedores sometidos a estimulación eléctrica directa del nervio laríngeo superior derecho para evocar la deglución, como se describe en nuestros experimentos previos31,32. Esto ocurrió con un ISO tan bajo como el 2%; la reducción de ISO por debajo de este nivel resultó en el retorno del movimiento espontáneo y, por lo tanto, se evitó. Este efecto de confusión de la ISO pone de manifiesto la importancia de la selección de la anestesia para el uso exitoso de este protocolo.
Cuando la calidad de la imagen endoscópica es buena, los clips de vídeo representativos de la respiración y la deglución se pueden analizar utilizando un software de seguimiento del movimiento, como se muestra en la Figura 9. En la Tabla 1 se enumeran las medidas de resultado representativas generadas automáticamente por nuestro software de seguimiento laríngeo personalizado. Obsérvese que varias medidas de resultado relacionadas con la respiración y la deglución fueron marcadamente diferentes entre la transección inicial y la post-RLN en la misma rata representativa. Mientras que los ángulos glotales durante la respiración fueron similares entre la transección basal y la post-RLN, las proporciones de amplitud del movimiento laríngeo derecho/izquierdo (es decir, relación del rango de movimiento medio o MMRR) y frecuencia (relación de ciclo abierto-cerrado o OCCR) durante la respiración fueron menores después de la transección. Del mismo modo, la duración de la deglución fue más corta después de la transección de RLN.
Si se obtienen registros electrofisiológicos sincrónicos (p. ej., neumograma respiratorio y EMG geniogloso), se pueden cuantificar varias medidas de resultado objetivas adicionales para la correlación con los datos de laringoscopia. En la Figura 10 se resumen ejemplos de medidas de resultado basadas en la electrofisiología de interés para nuestra investigación. Actualmente estamos desarrollando algoritmos para la cuantificación automatizada de estas medidas de resultado.

Figura 1: Plataforma de endoscopia murina. (A) Se muestran las vistas laterales y (B) superiores de la plataforma de endoscopia murina personalizada, con los componentes esenciales etiquetados. Tenga en cuenta que el tablero de la mesa debajo de la almohadilla térmica es ajustable en tamaño. Aquí se muestran los tamaños de mesa y almohadillas térmicas que se usan con ratas, que se quitan fácilmente para exponer una mesa del tamaño de un ratón que acomoda una almohadilla térmica más pequeña (no se muestra). Un adaptador personalizado asegura un endoscopio a un micromanipulador que está conectado a la base de la plataforma. Este diseño estratégico permite que toda la plataforma se mueva como una unidad durante el procedimiento endoscópico, sin riesgo de lesiones al animal debido al movimiento involuntario o incontrolado del endoscopio. El micromanipulador permite ajustes macroscópicos y micro de la punta del endoscopio en múltiples direcciones, incluyendo x (izquierda/derecha), y (adelante/atrás), z (arriba/abajo), así como la rotación alrededor de y (cabeceo) y z (guiñada). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Otoscopio y funda personalizada para laringoscopia murina. (A) Componentes desmontados de un otoscopio comercial y funda personalizada de acero inoxidable con adaptador para laringoscopia murina. (B) Cuando está ensamblado, la punta del otoscopio se extiende 1 mm más allá de la vaina metálica, pero se puede ajustar hasta 5 mm según sea necesario. Este diseño estratégico facilita el avance de la estrecha punta del otoscopio en la entrada laríngea del roedor, mientras que la vaina metálica de diámetro ligeramente mayor (2,4 mm) mantiene suficientemente abiertos el velo y la epiglotis para una visualización óptima de toda la laringe durante la respiración y la deglución. Haga clic aquí para ver una versión más grande de esta figura.
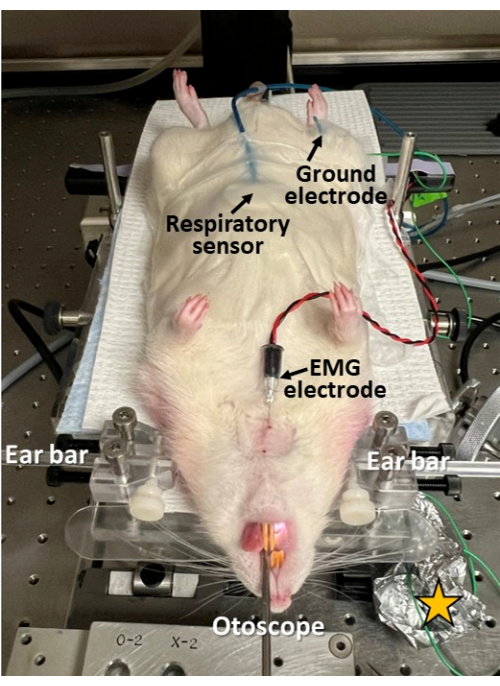
Figura 3: Registro electrofisiológico mínimamente invasivo durante la endoscopia. Un sensor respiratorio se pega con cinta adhesiva al abdomen del roedor; se inserta un electrodo EMG a través de la piel hasta el músculo geniogloso de la lengua; y se inserta un electrodo de tierra por vía subcutánea en la cadera. Este enfoque permite la investigación de la deglución, la respiración y la coordinación de la deglución-respiración en sincronía con la endoscopia. Tenga en cuenta que la piel se afeita y se limpia/desinfecta en los sitios de inserción de los electrodos. Estrella amarilla = papel de aluminio envuelto alrededor de los sitios de conexión del cable del electrodo para mejorar la relación señal-ruido en los registros electrofisiológicos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Endoscopia transoral para visualizar la laringe a distancia. (A) Después de retraer suavemente la lengua con un ligero agarre con el dedo, el endoscopio se inserta entre la lengua y los incisivos centrales en la ubicación de la estrella roja (es decir, el mismo lado que la lengua retraída para mantener la alineación anatómica con el eje del endoscopio). (B) A medida que el endoscopio avanza más allá del paladar duro, (C) la epiglotis y el velo aparecen a la vista. (D) Para visualizar la glotis, el velo y la epiglotis deben "desacoplarse" aplicando presión contra la superficie del velo (en la ubicación de la estrella delineada en negro en la imagen C). Haga clic aquí para ver una versión más grande de esta figura.
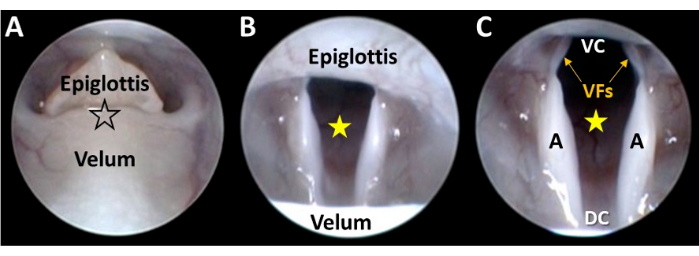
Figura 5: Visualización endoscópica en primer plano de la laringe. (A) La punta del endoscopio se guía suavemente a través del control del micromanipulador entre el velo desacoplado y la epiglotis (en la ubicación de la estrella con contorno negro). A medida que el endoscopio avanza, (B) la laringe aparece a la vista y el espacio glotal (estrella amarilla) se centra en el campo de visión de la cámara a través de ajustes del micromanipulador. (C) El avance continuo del endoscopio con el micromanipulador da como resultado la visualización de todas las dimensiones ventral-dorsal y lateral de la laringe. Abreviaturas: VC = comisura ventral de la laringe (es decir, el punto de unión ventral entre las cuerdas vocales); DC = comisura dorsal de la laringe (es decir, el punto de unión dorsal entre los aritenoides); FV = cuerdas vocales; A = aritenoides. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Visualización de la laringe murina durante la respiración y la deglución. Imágenes endoscópicas representativas que muestran el movimiento laríngeo durante la respiración y la deglución en una rata Sprague Dawley adulta (A-C) antes y (D-F) después de la transección quirúrgica de la RLN derecha. Obsérvese que la postura de reposo de la laringe parece no haber cambiado (D) después de una lesión de RLN en comparación con (A) basal. (B,E) Durante la máxima inspiración, la asimetría laríngea se hace evidente después de una lesión de RLN. En lugar de que ambos aritenoides abducen para agrandar el espacio glotal (estrella amarilla), (B) como se muestra al inicio, (E) el aritenoides ipsilateral (derecho) (asterisco negro) y la cuerda vocal aparecen inmovilizados durante todo el ciclo respiratorio después de la lesión de RLS. La asimetría del lado derecho también es evidente durante la deglución. (C) Al inicio del estudio, los aritenoides se aproximan a la línea media durante la deglución, dejando un pequeño espacio glotal ventral entre las cuerdas vocales. (F) Después de una lesión de RLN, el aritenoides ipsilateral y la FV se mueven paradójicamente (es decir, en la misma dirección que el lado no afectado, flecha roja) durante la deglución, dejando un gran espacio glotal (estrella amarilla) que se extiende desde las comisuras laríngeas ventrales hasta las posteriores. (F) Esta imagen proporciona evidencia directa de deterioro de la protección de las vías respiratorias laríngeas en un modelo de rata de lesión iatrogénica por RLN. (C,F) Obsérvese que la laringe se acerca al endoscopio durante la deglución, como lo indica el hecho de que la epiglotis y el velo ya no son visibles en el campo de visión de la cámara. Las flechas negras indican la dirección del movimiento laríngeo normal, mientras que la flecha roja indica el movimiento paradójico; estrella amarilla = espacio glotal. Abreviaturas: VFs = cuerdas vocales; A = aritenoides; RLN = nervio laríngeo recurrente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Uso de la laringoscopia seriada para investigar la disfunción laríngea durante la respiración y la deglución en un modelo de rata con lesión iatrogénica por RLN. Se utilizó una escala de Likert que osciló entre -2 y +2 para estimar la distancia y dirección del movimiento laríngeo en ocho ratas Sprague-Dawley adultas durante un período de 4 meses. Después de la laringoscopia basal, las ratas se sometieron a un procedimiento quirúrgico para seccionar la RLN derecha, seguido de una laringoscopia seriada a 1 semana después de la cirugía, y luego nuevamente a intervalos de 1 mes de 1 a 4 meses después de la cirugía. Las ocho ratas sobrevivieron al procedimiento, lo que demuestra la eficacia de nuestro régimen de anestesia para la laringoscopia seriada. (A) Los videos se analizaron en tiempo real y fotograma a fotograma/cámara lenta para cuantificar el movimiento laríngeo durante la respiración, donde 0 = sin movimiento, 1 = algo de movimiento y 2 = distancia de movimiento normal del lado afectado (derecho) en comparación con el lado intacto (izquierdo). (B) Para la deglución, el tamaño del espacio glotal se estimó de la siguiente manera: 0 = sin reducción en el tamaño del espacio glotal (es decir, sin protección de la vía aérea laríngea), 1 = cierta reducción del espacio glotal (es decir, protección incompleta de las vías respiratorias) y 2 = aducción completa de los aritenoides, con solo un pequeño espacio glotal ventral entre las cuerdas vocales (es decir, protección completa de las vías respiratorias). Los valores negativos para la respiración y la deglución indican un movimiento laríngeo en la dirección opuesta a la esperada (es decir, paradójico). Tenga en cuenta que después de una lesión por RLN, tanto la respiración como la deglución se vieron afectadas negativamente. Curiosamente, la protección de la vía aérea laríngea fue completa (aunque paradójica) en el momento 1 WPS, pero empeoró a partir de entonces, pasando de ninguna protección a una protección incompleta. Abreviaturas: WPS = semana después de la cirugía; MPS = meses después de la cirugía; RLN = nervio laríngeo recurrente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Deglución inhibida por ISO en roedores. (A) Imagen de un roedor sometido a una laringoscopia bajo anestesia ISO, con componentes etiquetados del sistema de administración ISO personalizado diseñado para este propósito. Una advertencia importante de este enfoque innovador es el riesgo de exposición del personal a ISO. (B) Otra desventaja de este enfoque es la supresión ISO de la deglución. Este diagrama de caja y diagrama de dispersión resume los datos no publicados que comparan el efecto de la anestesia ISO frente a la anestesia KX en ratones (9 por grupo) sometidos a estimulación eléctrica directa del nervio laríngeo superior derecho para evocar la deglución. Aquí se muestra el número de degluciones evocadas durante un ensayo de 5 minutos que consistió en 20 s de estimulación de 20 Hz seguidos de 10 s de descanso. En comparación con KX, los ratones anestesiados con ISO (tan bajo como 2%) tuvieron significativamente menos degluciones (p < 0,001, prueba t de muestras independientes), e incluso se abolió la deglución en 4/9 ratones. Hallazgos similares surgieron de experimentos no quirúrgicos con ratones y ratas (datos no mostrados). Abreviaturas: ISO = isoflurano; KX = ketamina-xilacina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Cuantificación objetiva del movimiento laríngeo murino mediante software de seguimiento. Aquí se muestran las mismas imágenes de la Figura 6 que muestran la respiración frente a la deglución en una rata al inicio del estudio en comparación con la lesión posterior a la RLN, con líneas de seguimiento del movimiento laríngeo añadidas por nuestro software personalizado. Las líneas de seguimiento se añadieron manualmente al primer fotograma de vídeo a lo largo del borde medial de los aritenoides para el seguimiento automatizado del movimiento laríngeo izquierdo (línea azul) frente al derecho (línea roja) en los fotogramas de vídeo restantes. Los gráficos de movimiento laríngeo correspondientes generados por nuestro software personalizado a partir de clips de vídeo de 2,5 s muestran el movimiento individual izquierda/derecha frente al movimiento laríngeo global derivado, con etiquetas correspondientes a la postura de reposo laríngeo (A,D), el espacio glotal máximo durante la inspiración y el cierre glótico (C,F) durante la deglución. Obsérvese el movimiento paradójico del lado derecho (flechas rojas) después de la lesión de RLN, así como el gran espacio glotal que se muestra en el gráfico de movimiento global derivado correspondiente. En la Tabla 1 se incluyen medidas de resultado representativas. Abreviatura: RLN = nervio laríngeo recurrente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Medidas de resultado basadas en electrofisiología para la correlación con los datos de laringoscopia. (A) Se muestran los registros electrofisiológicos durante la respiración y la deglución de una rata sana. La ventana superior muestra un rastro respiratorio (de un sensor respiratorio pegado al abdomen del roedor), la ventana central muestra la actividad EMG en el músculo genioglo y la ventana inferior muestra la actividad EMG filtrada. Obsérvese el patrón respiratorio rítmico y EMG durante la respiración, que se interrumpe durante los eventos de deglución. Los eventos de deglución se detectan fácilmente a través de un movimiento irregular en el rastro respiratorio (flechas negras) que es seguido inmediatamente por una breve apnea (asterisco rojo). (B) Una ventana expandida de la caja rectangular discontinua en A muestra cómo se cuantifican varias medidas de resultado a partir de los registros electrofisiológicos. (A) Tenga en cuenta que durante la inspiración (paneles amarillos), el rastro respiratorio (ventana superior) se retrasa ~ 150 ms (flecha doble azul) en comparación con la actividad de ráfaga EMG, lo que destaca las diferencias temporales entre los dos métodos electrofisiológicos. Las medidas de resultado representativas basadas en la electrofisiología incluyen: 1) duración de la fase inspiratoria (i); 2) intervalo interrespiratorio (ii, calculado a través de los canales respiratorios y EMG filtrados); área de deglución bajo la curva (iii); y apnea de deglución (IV; calculada a través de los canales respiratorio y EMG filtrado). Abreviatura: EMG = electromiografía. Haga clic aquí para ver una versión más grande de esta figura.
| Medidas de resultados | Referencia | Lesión post-RLN | |
| Respiración | Ángulo glotal mínimo (grados) | 34.5 | 34.6 |
| Ángulo glotal máximo (grados) | 52.9 | 49.9 | |
| Ángulo glotal promedio (grados) | 43.7 | 42.2 | |
| Relación de rango de movimiento medio (MMRR) | 1.26 | 0.29 | |
| Relación de ciclo de apertura y cierre (OCCR) | 1 | 0.11 | |
| Deglución | Aducción laríngea (ms) | 200 | 233 |
| Duración del cierre glótico (ms) | 67 | 0 | |
| Abducción laríngea (ms) | 233 | 67 | |
| Duración total de la deglución (ms) | 500 | 300 | |
Tabla 1: Medidas de resultado representativas generadas automáticamente por un software de seguimiento laríngeo personalizado. Abreviatura: RLN = nervio laríngeo recurrente.
Texto complementario sobre la plataforma de laringoscopia. Haga clic aquí para descargar este archivo.
Discusión
Hemos desarrollado con éxito un protocolo de laringoscopia murino específico replicable que permite la visualización de cerca del movimiento laríngeo durante la respiración y la deglución. Es importante destacar que el protocolo se puede realizar a lo largo del tiempo en los mismos animales para estudiar el impacto de diversas condiciones patológicas específicamente en la función laríngea. Este protocolo se desarrolló durante la última década y ha sufrido modificaciones sustanciales y soluciones de problemas a lo largo del camino. La optimización de la anestesia fue el mayor desafío a superar para prevenir la sobredosis que suprime la deglución y/o corre el riesgo de mortalidad relacionada con la dificultad respiratoria. Inicialmente se utilizó la ISO, lo que resultó en la abolición de la deglución, el exceso de producción de saliva (que obstruye la visualización endoscópica) y el riesgo de exposición del personal, que se consideran contraindicaciones graves para el uso de la ISO para este procedimiento. Por lo tanto, nos enfocamos en KX porque es un anestésico para roedores de uso común33,34,35.
Comenzamos el desarrollo de nuestro protocolo con ratones 14,22,29,30,36 mientras utilizaban un sialendoscopio debido a su menor diámetro de eje (1,1 mm) en comparación con otros endoscopios potencialmente adecuados para este propósito. Es importante destacar que el sialendoscopio tiene un canal de trabajo, que inicialmente utilizamos para administrar pulsos de aire para evocar/estudiar el reflejo del aductor laríngeo14. Sin embargo, encontramos que el reflejo del aductor laríngeo a menudo estaba disminuido/abolido en ratones y ratas, muy probablemente debido a la anestesia general y/o la inactivación de los receptores sensoriales laríngeos/faríngeos secundarios a la desecación de la mucosa por la administración repetida de pulsos de aire. Aunque el reflejo del aductor laríngeo no pudo evocarse de manera confiable en nuestros estudios, la deglución persistió sorprendentemente y se evocó fácilmente mediante estimulación mecánica en / cerca de la entrada laríngea. Por esta razón, cambiamos nuestro enfoque al análisis endoscópico de la deglución evocada mecánicamente.
En el proceso, abandonamos el sialendoscopio semirrígido que era propenso a romperse y tenía una iluminación y una resolución de imagen insuficientes para visualizar y analizar de manera confiable el movimiento laríngeo. En la exploración de numerosos endoscopios alternativos, finalmente nos decidimos por un otoscopio específico que era adecuado para la laringoscopia tanto con ratones como con ratas. Según nuestra experiencia, la característica más esencial a la hora de seleccionar un endoscopio adecuado para la laringoscopia murina es un diámetro del eje de menos de 2 mm que pueda transmitir una luz suficientemente brillante para una captura de vídeo de alta calidad. Los endoscopios de mayor diámetro no pueden pasar fácilmente a través de la entrada laríngea en ratones y ratas para la visualización de cerca del movimiento laríngeo. Los otoscopios son particularmente ideales para este propósito, dada su excelente transmisión de luz, su diseño rígido/duradero y su costo relativamente bajo en comparación con otros tipos de endoscopios (por ejemplo, sialendoscopio, endoscopio flexible). Además, si bien el control manual del endoscopio es una opción en manos estables, consideramos que el control con micromanipulador es una característica esencial de este protocolo de laringoscopia. Es importante destacar que el control del endoscopio por micromanipulador permite la grabación de vídeo estable del movimiento laríngeo por parte de un solo investigador para su posterior cuantificación. Hasta la fecha, hemos utilizado con éxito este protocolo basado en otoscopio con ratones y ratas adultos. Sospechamos que las opciones de endoscopios de diámetro más pequeño serán esenciales para realizar una laringoscopia con roedores más jóvenes/pequeños.
Una ventaja novedosa de nuestro protocolo de laringoscopia es la capacidad de visualizar la protección de las vías respiratorias durante la deglución en roedores, lo que no es posible en los humanos debido a la inversión epiglótica sobre la entrada laríngea que obstruye la glotis de la vista. Por lo tanto, los roedores brindan una oportunidad única para investigar específicamente los mecanismos de protección de las vías respiratorias laríngeas normales frente a las patológicas con el propósito final de descubrir tratamientos para restaurar eficazmente la función laríngea normal. Esta capacidad única de este protocolo de laringoscopia murina es una gran ventaja sobre la videofluoroscopia (es decir, la otra prueba "estándar de oro" para la disfagia), que no ha logrado detectar la aspiración en los numerosos modelos de disfagia en roedores que hemos desarrollado/identificado hasta ahora 30,36,37,38,39,40. Este hallazgo negativo basado en VFSS se puede atribuir a varias diferencias anatómicas en las vías respiratorias superiores de los roedores que son evidentes a través de nuestro enfoque de endoscopia transoral. En primer lugar, la laringe del roedor se coloca en lo alto de la nasofaringe, donde queda oculta por una epiglotis y un velo estrechamente acoplados que crean una cavidad oral sin salida. Además, la epiglotis en reposo queda atrapada debajo de una vaina mucosa que recubre el velo. Esta configuración anatómica hace que los roedores sean respiradores nasales obligados; Por lo tanto, la respiración oral en roedores despiertos es un signo de morbilidad respiratoria. Sin embargo, durante la deglución en roedores sanos, la epiglotis se desliza fuera de la vaina mucosa y se invierte sobre la entrada laríngea a medida que la laringe se eleva más hacia la nasofaringe, fuera del camino del bolo. Estos eventos dinámicos de las vías respiratorias superiores se pueden visualizar/evaluar directamente a través de la laringoscopia en roedores sanos y modelos de disfunción laríngea.
Es importante destacar que hemos demostrado que, a pesar de no aspirar durante la prueba de VFSS, los modelos de roedores (por ejemplo, lesión iatrogénica por RLN) muestran evidencia de deterioro de la protección de las vías respiratorias laríngeas (es decir, cierre glotal incompleto) a través de la laringoscopia que es traslacional a pacientes humanos con aspiración relacionada con la disfagia. Por lo tanto, este protocolo de laringoscopia murina proporciona una plataforma traslacional útil para investigar específicamente los mecanismos de protección de las vías respiratorias y los tratamientos dirigidos, que actualmente siguen siendo difíciles de alcanzar. Lograr este objetivo requerirá un mayor desarrollo/optimización de nuestro método actual, que utiliza la punta del endoscopio para proporcionar una estimulación mecánica no calibrada de la mucosa laríngea/faríngea para evocar la deglución. Actualmente se están explorando en nuestro laboratorio métodos más rigurosos y controlados con precisión para evocar la deglución, incluida la estimulación eléctrica directa del nervio laríngeo superior32,41 y la estimulación química (p. ej., ácido cítrico42) de la mucosa laríngea/faríngea. Una limitación adicional de este protocolo es la posición supina de los roedores, que no imita el comportamiento de alimentación despierto y natural. El desarrollo inicial del protocolo incluyó el posicionamiento en decúbito prono, lo que resultó en un movimiento mandibular restringido y al mismo tiempo limitó la visibilidad de la cavidad oral, lo que impidió notablemente el paso del endoscopio. Es posible visualizar la laringe a distancia con la punta del endoscopio en la hipofaringe; Sin embargo, este enfoque generalmente requiere la retracción manual de la epiglotis, el velo y/o la lengua para mejorar la visualización de la laringe. Hemos fabricado una variedad de dispositivos de retracción manual personalizados para este propósito (por ejemplo, espéculos de otoscopio modificados, puntas de pipeta modificadas). Sin embargo, partes de la laringe suelen permanecer ocultas a la vista, y los dispositivos de retracción pueden restringir el movimiento laríngeo, lo que puede confundirse con una disfunción. Además, las características adicionales recientes de la plataforma endoscópica (p. ej., inclinación de Trendelenburg y un corte entre las barras de la oreja para acomodar el movimiento de la mandíbula) pueden facilitar la prueba de roedores en posición prona. Las barras para los oídos y el calor suplementario son características necesarias del protocolo de laringoscopia. Las barras de los oídos evitan que la cabeza se mueva durante la manipulación transoral del endoscopio. Un sistema de calentamiento homeotérmico mantiene la temperatura corporal entre 36 °C y 38 °C para promover una anestesia estable y prevenir la hipotermia durante todo el procedimiento.
Ahora que existe una metodología para registrar de forma fiable el movimiento laríngeo durante la respiración y la deglución en roedores, la cuantificación de alto rendimiento es un siguiente paso esencial. Por lo tanto, nuestros esfuerzos de análisis de video están en curso para determinar qué medida de resultado generada por nuestro software personalizado puede distinguir mejor las condiciones saludables de las enfermedades, así como detectar cambios a lo largo del tiempo en respuesta a la progresión natural de la enfermedad o a las intervenciones de tratamiento. Los principales candidatos serán el foco de los enfoques posteriores de aprendizaje automático para acelerar el análisis de imágenes de video. Es importante destacar que los casos de calidad de imagen subóptima (por ejemplo, iluminación insuficiente, estructuras anatómicas fuera del campo de visión, exceso de secreciones que oscurecen las estructuras laríngeas, etc.) actualmente no son susceptibles de seguimiento laríngeo; Sin embargo, esta barrera puede superarse en el futuro a través de herramientas de aprendizaje automático. Hasta entonces, sigue siendo primordial seleccionar cuidadosamente las secuencias de fotogramas de vídeo que cumplan los criterios para el análisis de seguimiento laríngeo (como se describe en la sección 5 del protocolo).
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo fue financiado en parte por dos subvenciones de los NIH: 1) una subvención R01 (HL153612) del Instituto Nacional del Corazón, los Pulmones y la Sangre (NHLBI), y 2) una subvención R03 (TL, DC0110895) del Instituto Nacional de la Sordera y Otros Trastornos de la Comunicación (NIDCD). Nuestro desarrollo de software personalizado de seguimiento del movimiento laríngeo fue parcialmente financiado por una subvención de la Fundación Coulter (TL y Filiz Bunyak). Agradecemos a Kate Osman, Chloe Baker, Kennedy Hoelscher y Zola Stephenson por brindar un excelente cuidado a nuestros roedores de laboratorio. También agradecemos a Roderic Schlotzhauer y Cheston Callais del MU Physics Machine Shop por su aporte al diseño y la fabricación de nuestra plataforma de endoscopia personalizada y las modificaciones estratégicas a los endoscopios y micromanipuladores comerciales para satisfacer nuestras necesidades de investigación. Nuestro software personalizado de seguimiento del movimiento laríngeo fue desarrollado en colaboración con el Dr. Filiz Bunyak y el Dr. Ali Hamad (Departamento de Ingeniería Eléctrica y Ciencias de la Computación de MU). También agradecemos a Jim Marnatti de Karl Storz Endoscopy por brindar orientación sobre la selección de otoscopios. Por último, nos gustaría reconocer a numerosos estudiantes/aprendices anteriores en el Lever Lab cuyas contribuciones han informado el desarrollo de nuestro protocolo actual de laringoscopia murina: Marlena Szewczyk, Cameron Hinkel, Abigail Rovnak, Bridget Hopewell, Leslie Shock, Ian Deninger, Chandler Haxton, Murphy Mastin y Daniel Shu.
Materiales
| Name | Company | Catalog Number | Comments |
| Atipamezole | Zoetis | Antisedan; 5 mg/mL | Parsippany-Troy Hills, NJ |
| Bioamplifier | Warner Instrument Corp. | DP-304 | Hamden, CT |
| Concentric EMG needle electrode | Chalgren Enterprises, Inc. | 231-025-24TP; 25 mm x 0.3 mm/30 G | Gilroy, CA |
| Cotton tipped applicator (tapered) | Puritan Medical Products | REF 25-826 5W | Guilford, ME |
| Data Acquisition System | ADInstruments | PowerLab 8/30 | Colorado Springs, CO |
| DC Temperature Control System - for endoscopy platform | FHC, Inc. | 40-90-8D | Bowdoin, ME |
| Electrophysiology recording software | ADInstruments | LabChart 8 with video capture module | Colorado Springs, CO |
| Endoscope monitor | Karl Storz Endoscopy-America | Storz Tele Pack X monitor | El Segundo, CA |
| Glycopyrrolate | Piramal Critical Care | NDC 66794-204-02; 0.2 mg/mL | Bethlehem, PA |
| Ground electrode | Consolidated Neuro Supply, Inc. | 27 gauge stainless steel, #S43-438 | Loveland, OH |
| Isoflurane induction chamber | Braintree Scientific, Inc. | Gas Anesthetizing Box - Red | Braintree, MA |
| Ketamine hydrochloride | Covetrus North America | NDC 11695-0703-1, 100 mg/mL | Dublin, OH |
| Metal spatula to decouple epiglottis and velum | Fine Science Tools | Item No. 10091-12; | Foster City, CA |
| Micro-brush to remove food/secretions from oral cavity | Safeco Dental Supply | REF 285-0023, 1.5 mm | Buffalo Grove, IL |
| Mouse-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2-07 – 5 x 12.5 cm Heating Pad | Bowdoin, ME |
| Ophthalmic ointment (sterile) | Allergan, Inc. | Refresh Lacri-lube | Irvine, CA |
| Otoscope | Karl Storz | REF 1232AA | El Segundo, CA |
| Pneumogram Sensor | BIOPAC Systems, Inc. | RX110 | Goleta, CA |
| Pulse oximetry - Vetcorder Pro Veterinary Monitor | Sentier HC, LLC | Part No. 710-1750 | Waukesha, WI |
| Rat-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2 – 12.5X25cm Heating Pad | Bowdoin, ME |
| Sterile needles for drug injections | Becton, Dickinson and Company | REF 305110, 26 G x 3/8 inch, PrecisionGlide | Franklin Lakes, NJ |
| Sterile syringes for drug injections | Becton, Dickinson and Company | REF 309628; 1 mL, Luer-Lok tip | Franklin Lakes, NJ |
| Surgical drape to cover induction cage for dark environment | Covidien LP | Argyle Surgical Drape Material, Single Ply | Minneapolis, MN |
| Surgical tape to secure pneumograph sensor to abdomen | 3M Health Care | #1527-0, 1/2 inch | St. Paul, MN |
| Transparent blanket for thermoregulation | The Glad Products Company | Press’n Seal Cling Film | Oakland, CA |
| Video editing software | Pinnacle Systems, Inc. | Pinnacle Studio, v24 | Mountain View, CA |
| Water circulating heating pad - for anesthesia induction/recovery station | Adroit Medical Systems | HTP-1500 Heat Therapy Pump | Loudon, TN |
| Xylazine | Vet One | NDC 13985-701-10; Anased, 100 mg/mL | Boise, ID |
Referencias
- Brunner, E., Friedrich, G., Kiesler, K., Chibidziura-Priesching, J., Gugatschka, M. Subjective breathing impairment in unilateral vocal fold paralysis. Folia Phoniatr Logop. 63 (3), 142-146 (2011).
- Chandrasekhar, S. S., et al. Clinical practice guideline: improving voice outcomes after thyroid surgery. Otolaryngol Head Neck Surg. 148 (6 Suppl), S1-S37 (2013).
- Fang, T. J., et al. Quality of life measures and predictors for adults with unilateral vocal cord paralysis. Laryngoscope. 118 (10), 1837-1841 (2008).
- Wang, W., et al. Laryngeal reinnervation using ansa cervicalis for thyroid surgery-related unilateral vocal fold paralysis: a long-term outcome analysis of 237 cases. PLoS One. 6 (4), e19128 (2011).
- Cohen, S. M., et al. Association between dysphagia and inpatient outcomes across frailty level among patients >/= 50 years of age. Dysphagia. 35 (5), 787-797 (2020).
- Poulsen, S. H., et al. Signs of dysphagia and associated outcomes regarding mortality, length of hospital stay and readmissions in acute geriatric patients: Observational prospective study. Clin Nutr ESPEN. 45, 412-419 (2021).
- Lin, R. J., Smith, L. J., Munin, M. C., Sridharan, S., Rosen, C. A. Innervation status in chronic vocal fold paralysis and implications for laryngeal reinnervation. Laryngoscope. 128 (7), 1628-1633 (2018).
- Choi, J. S., et al. Functional regeneration of recurrent laryngeal nerve injury during thyroid surgery using an asymmetrically porous nerve guide conduit in an animal model. Thyroid. 24 (1), 52-59 (2014).
- Wang, B., et al. Neurotrophin expression and laryngeal muscle pathophysiology following recurrent laryngeal nerve transection. Mol Med Rep. 13 (2), 1234-1242 (2016).
- Woodson, G., Randolph, G. W. Pathophysiology of recurrent laryngeal nerve injury. Surgery of the Thyroid and Parathyroid Glands (Third Edition). , 404-409.e2 (2021).
- James, M., Palmer, O. Instrumentation and techniques for examination of the ear, nose, throat, and sinus. Oral Maxillofac Surg Clin North Am. 24 (2), 167-174 (2012).
- Patel, R. R., et al. Recommended protocols for instrumental assessment of voice: American Speech-Language-Hearing Association Expert Panel to develop a protocol for instrumental assessment of vocal function. Am J Speech Lang Pathol. 27 (3), 887-905 (2018).
- Kamarunas, E. E., McCullough, G. H., Guidry, T. J., Mennemeier, M., Schluterman, K. Effects of topical nasal anesthetic on fiberoptic endoscopic examination of swallowing with sensory testing (FEESST). Dysphagia. 29 (1), 33-43 (2014).
- Shock, L. A., et al. Improving the utility of laryngeal adductor reflex testing: a translational tale of mice and men. Otolaryngol Head Neck Surg. 153 (1), 94-101 (2015).
- Aviv, J. E., et al. Laryngopharyngeal sensory discrimination testing and the laryngeal adductor reflex. Ann Otol Rhinol Laryngol. 108 (8), 725-730 (1999).
- Farneti, D. The instrumental gold standard: fees. J Gastroenterol Hepatol Res. 3, 1281-1291 (2014).
- Hernandez-Morato, I., et al. Reorganization of laryngeal motoneurons after crush injury in the recurrent laryngeal nerve of the rat. J Anat. 222 (4), 451-461 (2013).
- Hernandez-Morato, I., Sharma, S., Pitman, M. J. Changes in neurotrophic factors of adult rat laryngeal muscles during nerve regeneration. Neuroscience. 333, 44-53 (2016).
- Tessema, B., et al. Evaluation of functional recovery of recurrent laryngeal nerve using transoral laryngeal bipolar electromyography: a rat model. Ann Otol Rhinol Laryngol. 117 (8), 604-608 (2008).
- Tessema, B., et al. Observations of recurrent laryngeal nerve injury and recovery using a rat model. Laryngoscope. 119 (8), 1644-1651 (2009).
- Monaco, G. N., et al. Electrical stimulation and testosterone enhance recovery from recurrent laryngeal nerve crush. Restor Neurol Neurosci. 33 (4), 571-578 (2015).
- Haney, M. M., Hamad, A., Leary, E., Bunyak, F., Lever, T. E. Automated quantification of vocal fold motion in a recurrent laryngeal nerve injury mouse model. Laryngoscope. 129 (7), E247-E254 (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Wang, B., et al. Functional regeneration of the transected recurrent laryngeal nerve using a collagen scaffold loaded with laminin and laminin-binding BDNF and GDNF. Sci Rep. 6, 32292 (2016).
- Hamad, A., Haney, M. M., Lever, T. E., Bunyak, F. Automated segmentation of the vocal folds in laryngeal endoscopy videos using deep convolutional regression networks. , 140-148 (2019).
- Wang, Y. Y., Hamad, A. S., Palaniappan, K., Lever, T. E., Bunyak, F. LARNet-STC: Spatio-temporal orthogonal region selection network for laryngeal closure detection in endoscopy videos. Comput Biol Med. 144, 105339 (2022).
- Lever, T. E., et al. Advancing laryngeal adductor reflex testing beyond sensory threshold detection. Dysphagia. 37 (5), 1151-1171 (2022).
- Wang, Y. Y., Hamad, A. S., Lever, T. E., Bunyak, F. Orthogonal region selection network for laryngeal closure detection in laryngoscopy videos. Annu Int Conf IEEE Eng Med Biol Soc. 2020, 2167-2172 (2020).
- Haney, M. M., et al. Recurrent laryngeal nerve transection in mice results in translational upper airway dysfunction. J Comp Neurol. 528 (4), 574-596 (2020).
- Mok, A., et al. A surgical mouse model for advancing laryngeal nerve regeneration strategies. Dysphagia. 35 (3), 419-437 (2020).
- Haney, M. M., Ericsson, A. C., Lever, T. E. Effects of intraoperative vagal nerve stimulation on the gastrointestinal microbiome in a mouse model of amyotrophic lateral sclerosis. Comp Med. 68 (6), 452-460 (2018).
- Lever, T. E., et al. A mouse model of pharyngeal dysphagia in amyotrophic lateral sclerosis. Dysphagia. 25 (2), 112-126 (2010).
- Struck, M. B., Andrutis, K. A., Ramirez, H. E., Battles, A. H. Effect of a short-term fast on ketamine-xylazine anesthesia in rats. J Am Assoc Lab Anim Sci. 50 (3), 344-348 (2011).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress. Altern Lab Anim. 33 (2), 119-127 (2005).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Welby, L., Maynard, T., Zohn, I., Lever, T. Fluoroscopic and endoscopic investigation of dysphagia in a mouse model of DiGeorge syndrome. Dysphagia. 34, 1003-1004 (2019).
- Mueller, M., et al. Impact of limb phenotype on tongue denervation atrophy, dysphagia penetrance, and survival time in a mouse model of ALS. Dysphagia. 37 (6), 1777-1795 (2022).
- Osman, K. L., et al. Optimizing the translational value of mouse models of ALS for dysphagia therapeutic discovery. Dysphagia. 35 (2), 343-359 (2020).
- Lever, T. E., et al. Videofluoroscopic validation of a translational murine model of presbyphagia. Dysphagia. 30, 328-342 (2015).
- Lever, T. E., et al. Adapting human videofluoroscopic swallow study methods to detect and characterize dysphagia in murine disease models. J Vis Exp. (97), 52319 (2015).
- Ballenger, B., et al. Targeted electrical stimulation of the superior laryngeal nerve - a potential treatment for dysphagia in ALS. FASEB J. 36 (S1), (2022).
- Kloepper, A., et al. An experimental swallow evoked potential protocol to investigate the neural substrates of swallowing. OTO Open. 4 (1), (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados