Method Article
Минимально инвазивная мышиная ларингоскопия для визуализации движения гортани крупным планом во время дыхания и глотания
В этой статье
Резюме
Этот протокол описывает последовательный подход к трансоральной ларингоскопии у мышей и крыс, который позволяет беспрепятственно визуализировать гортань крупным планом во время дыхания и глотания с использованием оптимизированного режима анестезии и тонко настроенных эндоскопических техник манипуляций.
Аннотация
Гортань является важным органом у млекопитающих с тремя основными функциями - дыханием, глотанием и вокализацией. Известно, что широкий спектр расстройств нарушает функцию гортани, что приводит к затруднению дыхания (одышка), нарушению глотания (дисфагия) и/или нарушению голоса (дисфония). Дисфагия, в частности, может привести к аспирационной пневмонии и связанной с ней заболеваемости, повторной госпитализации и ранней смертности. Несмотря на эти серьезные последствия, существующие методы лечения дисфункции гортани в основном направлены на хирургические и поведенческие вмешательства, которые, к сожалению, обычно не восстанавливают нормальную функцию гортани, что подчеркивает острую потребность в инновационных решениях.
Чтобы восполнить этот пробел, мы разрабатываем экспериментальный эндоскопический подход к исследованию дисфункции гортани на моделях мышей (т.е. мышей и крыс). Тем не менее, эндоскопия у грызунов является довольно сложной задачей из-за их небольшого размера по сравнению с современной технологией эндоскопов, анатомических различий в верхних дыхательных путях и необходимости анестезии для оптимального доступа к гортани. В этой статье мы описываем новый подход к трансоральной ларингоскопии, который позволяет беспрепятственно визуализировать движение гортани крупным планом у мышей и крыс. Важнейшие шаги в протоколе включают точное управление анестезией (для предотвращения передозировки, которая приводит к отмене глотания и/или риску смертности, связанной с респираторным дистрессом) и управление эндоскопом с помощью микроманипулятора (для стабильной видеозаписи движения гортани одним исследователем для последующей количественной оценки).
Важно отметить, что протокол может быть выполнен в течение определенного времени на одних и тех же животных для изучения влияния различных патологических состояний, в частности, на функцию гортани. Новым преимуществом этого протокола является возможность визуализировать защиту дыхательных путей во время глотания, что невозможно у людей из-за эпиглоттической инверсии над входом в гортань, которая закрывает голосовую щель от обзора. Таким образом, грызуны предоставляют уникальную возможность специально исследовать механизмы нормальной и патологической защиты дыхательных путей гортани с конечной целью поиска методов лечения для эффективного восстановления нормальной функции гортани.
Введение
Гортань — это хрящевой орган, расположенный на пересечении дыхательных и пищеварительных путей в горле, где он функционирует как клапанный механизм для точного контроля потока и направления воздуха (например, во время дыхания и вокализации) по сравнению с пищей и жидкостью (например, во время глотания). Известно, что гортань поражает широкий спектр заболеваний, включая врожденные (например, ларингомаляция, подсвязочный стеноз), опухолевые (например, папилломатоз гортани, плоскоклеточный рак), неврологические (например, идиопатический паралич гортани, инсульт, болезнь Паркинсона, боковой амиотрофический склероз) и ятрогенные (например, непреднамеренная травма во время операции на голове или шее). Независимо от этиологии, дисфункция гортани обычно приводит к триаде симптомов: одышка (затрудненное дыхание), дисфония (нарушение голоса) и дисфагия (нарушение глотания), которые негативно влияют на экономическое и социальное благосостояние человека 1,2,3,4.
Кроме того, дисфагия, особенно у ослабленных с медицинской точки зрения людей, может привести к аспирационной пневмонии (из-за попадания пищи или жидкости через не полностью закрытую гортань в легкие) и связанной с ней заболеваемости, повторной госпитализации и ранней смертности. Несмотря на эти серьезные последствия, существующие методы лечения дисфункции гортани в основном направлены на хирургические и поведенческие вмешательства, которые обычно не восстанавливают нормальную функцию гортани 1,2,7,8,9,10, что подчеркивает острую потребность в инновационных решениях. С этой целью мы разработали экспериментальный эндоскопический подход к исследованию дисфункции гортани на моделях мышей (т.е. мышей и крыс).
В медицине человека золотым стандартом для оценки дисфункции гортани является эндоскопическая визуализация, называемая ларингоскопии11,12. Как правило, гибкий эндоскоп вводится через нос для осмотра гортани, особенно голосовых складок и прилегающих надгортанных и подсвязочных структур гортани. Жесткий эндоскоп также может быть использован для визуализации гортани через ротовую полость. Любой из подходов позволяет тщательно изучить анатомию гортани и может быть использован для оценки подвижности и функции гортани во время дыхания, фонации и различных защитных рефлексов дыхательных путей, таких как кашель и аддукторный рефлексгортани 13,14,15,16. Однако во время глотания гортань полностью закрыта надгортанником, поскольку она выворачивается, чтобы закрыть вход в гортань, защищая его от пути проглатывания пищевой/жидкой жидкости. В результате, прямая визуализация движения гортани во время глотания невозможна у людей и поэтому должна быть косвенно выведена с помощью других диагностических подходов (например, рентгеноскопии, электромиографии, электроглоттографии).
В этой статье описывается инновационный протокол ларингоскопии для мышей и крыс, который позволяет беспрепятственно визуализировать дыхание и защиту дыхательных путей во время глотания под легкой анестезией. Протокол совместим с различными коммерчески доступными эндоскопическими системами в сочетании с индивидуальной платформой для иммобилизации обезболенного грызуна на протяжении всей процедуры. Важно отметить, что действительно возможны различные конструкции/конфигурации эндоскопических платформ, в зависимости от доступных ресурсов и программы исследований каждой лаборатории. Наша цель состоит в том, чтобы предоставить исследователям руководство, которое они могут учитывать в контексте своих исследований. Кроме того, мы стремимся продемонстрировать, как протокол ларингоскопии может привести к обилию объективных данных, которые могут привести к новому пониманию нашей дисфункции и регенерации гортани.
Комбинированный эффект всех этапов, описанных в данном протоколе ларингоскопии мышей, приводит к минимально инвазивному исследованию гортани взрослых мышей, которое может быть повторено на тех же животных для выявления и характеристики дисфункции гортани с течением времени в ответ на ятрогенное повреждение, прогрессирование заболевания и/или вмешательство в лечение в отношении защиты дыхательных путей. Следует отметить, что этот протокол не оценивает функцию гортани, связанную с вокализацией.
протокол
Протокол ларингоскопии мышей соответствует утвержденному протоколу Комитета по институциональному уходу за животными и их использованию (IACUC) и рекомендациям Национальных институтов здравоохранения (NIH). Он был разработан для использования с более чем 100 взрослыми мышами C57BL/6J и более чем 50 взрослыми крысами Sprague Dawley, примерно равного пола и в возрасте от 6 недель до 12 месяцев для обоих видов. Для адаптации к более молодым/мелким грызунам необходима разработка дополнительного протокола. Животные содержались в группах (до четырех мышей или двух крыс в клетке, в зависимости от пола и помета). Стандартные условия вивария включали в себя статическое содержание в клетке со строгим регулированием температуры окружающей среды (20-26 °C), влажности (30%-70%) и стандартный 12-часовой световой цикл. Все животные получали свежие материалы для обогащения (например, хижину/трубу, зубные лакомства, гнездо) при еженедельной смене клеток. Был обеспечен неограниченный доступ к пище и воде, за исключением короткого (до 4-6 ч) ограничения приема пищи перед анестезией, как описано ниже. Ветеринарный и научный персонал ежедневно следил за животными.
1. Животная анестезия, которая не отменяет глотание
- Носите соответствующие средства индивидуальной защиты (например, перчатки, маску), чтобы свести к минимуму воздействие аллергенов при работе с грызунами.
- Ограничьте прием пищи в каждой клетке грызунов за 4-6 часов до анестезии, чтобы свести к минимуму задержку пищи в полости рта и глотке, что может помешать эндоскопической визуализации и/или привести к аспирации пищи во время процедуры.
ПРИМЕЧАНИЕ: Задержка пищи в полости рта является нормальным явлением у грызунов без дисфагии, если они не были ограничены в пище. - Подготовьте «станцию обогрева» для индукции/выздоровления животных.
- Разогрейте циркуляционную электрогрелку до 37 °C на поверхности столешницы.
- Выберите индукционные/восстановительные клетки соответствующего размера для испытуемых видов. Например, клетки для обуви для мышей с крышками с фильтрующими крышками подходят по размеру для индукции/восстановления мышей и крыс. Используйте новую индукционную/восстановительную клетку для каждого тестируемого животного; Используйте одну клетку в качестве индукционной и восстановительной клетки для одного и того же животного.
- Выстелите пол индукционной/восстановительной клетки легким слоем абсорбирующего материала (например, осиновой стружкой, бумажным полотенцем, подушечкой для щенков) для согревания и поглощения выделений организма во время индукции анестезии и восстановления.
- Подготовленные кейджи (с крышками фильтрующего верха) полностью поместить на грелку за 30-60 минут до введения анестезии.
ПРИМЕЧАНИЕ: Эта микросреда обеспечивает достаточное дополнительное тепло для содействия стабильному метаболизму анестезии во время индукции и восстановления.
- Поместите домашнюю клетку животного наполовину на предварительно нагретую до 37 °C грелку примерно за 30 минут до введения анестезии.
ПРИМЕЧАНИЕ: Предоставление дополнительного тепла перед процедурой может ускорить индукцию анестезии и предотвратить случайную передозировку из-за замедления/задержки метаболизма анестезии из-за гипотермии. - Готовят кетамин-ксилазиновую анестезию (КХ) в зависимости от вида и массы тела.
- Для мышей: Смеси 90 мг/кг кетамина и 11 мг/кг ксилазина достаточно для трансоральной ларингоскопии у взрослых мышей C57BL/6 обоего пола. Отрегулируйте дозы для других штаммов и возраста мышей.
- Для крыс: Смеси 60 мг/кг кетамина и 6 мг/кг ксилазина достаточно для трансоральной ларингоскопии у взрослых крыс Sprague Dawley любого пола. Корректируйте дозы для других штаммов и возраста крыс.
- Предварительно разогрейте заполненные шприцем анестетики на станции нагрева при температуре 37 °C, чтобы предотвратить потерю тепла у животных, которая происходит при введении холодных жидкостей.
- Введите грызуну рассчитанную дозу KX с помощью шприца соответствующего размера (например, 1 мл) и иглы (например, 26 г1/2).
- Для мышей: Введите однократную подкожную (SC) инъекцию.
ПРИМЕЧАНИЕ: По нашему опыту, инъекции СК мышам снижают/устраняют смертность, связанную с анестезией, по сравнению с внутрибрюшинными инъекциями (ИП). - Для крыс: Введите одну инъекцию SC или IP. При желании усыпьте крыс изофлураном (ISO) (3-5%) в индукционной камере непосредственно перед инъекцией KX.
ПРИМЕЧАНИЕ: Спонтанные движения тела могут возобновиться на короткий период времени (обычно <1 минута) до тех пор, пока KX не начнет действовать.
- Для мышей: Введите однократную подкожную (SC) инъекцию.
- Введите гликопирролат (антихолинергическое средство) сразу после инъекции KX для уменьшения избыточного секрета слюны, который может препятствовать визуализации гортани во время трансоральной эндоскопии и/или механически препятствовать верхним дыхательным путям во время восстановления после анестезии.
ПРИМЕЧАНИЕ: Дозировка и способ доставки идентичны для мышей и крыс (0,01-0,02 мг/кг/к/к), а эффект практически немедленный и длится несколько часов. - После инъекции гликопирролата поместите грызуна, находящегося под наркозом, в предварительно нагретую индукционную клетку на станции обогрева и накройте клетку хирургической простыней, чтобы обеспечить затемненную среду, сводящую к минимуму визуальную стимуляцию в течение 10 минут.
- Прекратите процедуру, если грызун остается в амбулаторном состоянии через 10 минут после первоначальной дозы KX.
ПРИМЕЧАНИЕ: Попытки обеспечить дополнительную анестезию (КХ или кетамин), скорее всего, будут тщетными.
- Прекратите процедуру, если грызун остается в амбулаторном состоянии через 10 минут после первоначальной дозы KX.
- Через 10 минут введите поддерживающую дозу кетамина (1/4 от начальной дозы, если рефлексы задних конечностей снижены, или 1/2 от начальной дозы, если рефлексы задних конечностей активны; SC для мышей и SC/IP для крыс) для поддержания анестезии.
- Нанесите офтальмологическую мазь на оба глаза, чтобы предотвратить высыхание роговицы и связанную с этим травму во время процедуры ларингоскопии.
- Перенесите грызуна, находящегося под наркозом, на специальную эндоскопическую платформу, чтобы начать процедуру ларингоскопии.
ПРИМЕЧАНИЕ: Мы разработали нашу эндоскопическую платформу (Рисунок 1) таким образом, чтобы она обладала множеством функциональных возможностей для использования с различными хирургическими и электрофизиологическими подходами к грызунам, которые не обязательно требуют эндоскопии. Таким образом, он предназначен для чисто эндоскопического использования. Там, где это уместно, мы выделим особенности/компоненты, которые важны для этого протокола ларингоскопии. - С этого момента проверяйте рефлексы задних конечностей каждые 15-20 минут на протяжении всей процедуры и при необходимости вводите дополнительные поддерживающие дозы кетамина с интервалом не менее 20 минут. Поскольку это относительно короткая процедура (обычно <45 минут под анестезией), дополнительное введение кетамина редко требуется после начальной поддерживающей дозы.
2. Трансоральный проход эндоскопа для визуализации гортани
- Перед обезболиванием животного подготовьте эндоскоп подходящего размера с возможностью видеозаписи.
ПРИМЕЧАНИЕ: Мы обычно используем отоскоп нулевого градуса с диаметром стержня 1,9 мм и длиной стержня 10 см с металлической оболочкой (Рисунок 2), который является репрезентативным эндоскопом, используемым во всем этом протоколе.- Подключите эндоскоп к источнику света и системе записи эндоскопии для просмотра в режиме реального времени и записи видео со скоростью не менее 30 кадров в секунду (fps).
- Фокусировка и баланс белого камеры для оптимального качества изображения.
- Подсоедините эндоскоп к микроманипулятору.
ПРИМЕЧАНИЕ: Для отслеживания движений гортани мы крепим эндоскоп к микроманипулятору на эндоскопической платформе, чтобы обеспечить точный контроль эндоскопом для стабильной видеосъемки.
- Закрепите грызуна в спинном положении лежа на подогреваемой платформе. Стабилизируйте и обездвижьте голову, закрепив ее ушными планками.
- Убедитесь, что голова грызуна может свободно вращаться вверх/вниз (но не из стороны в сторону) в ушных планках, не выскальзывая. Такая степень свободы облегчает трансоральное введение и продвижение эндоскопа к гортани.
- Если во время эндоскопии требуется синхронная электрофизиологическая запись дыхания, глотания и координации глотания и дыхания, продолжайте применять для этого соответствующие датчики (рис. 3).
- Закрепите респираторный датчик на животе по средней линии, непосредственно каудально к ксифоидному отростку, с помощью хирургической ленты.
- Побрейте и очистите/продезинфицируйте кожу спиртовой салфеткой перед введением игольчатых электродов для предотвращения инфекции.
- Используйте иглу 22 G, чтобы проколоть небольшое отверстие в коже перед введением игольчатого электрода, чтобы предотвратить повреждение иглы электромиографии (ЭМГ).
- Введите стерильный концентрический игольчатый электрод ЭМГ (например, 25 мм x 0,3 мм/30 G) через подбородочную кожу по средней линии в основание языка (например, genioglossus или geniohyoid muscal, в зависимости от глубины введения иглы).
- Вставьте заземляющий электрод (например, из нержавеющей стали 27 G) подкожно в бедро (с любой стороны).
- Подключите респираторный датчик и игольчатые электроды ЭМГ к системе электрофизиологической регистрации (например, биоусилителю и системе сбора данных с синхронным захватом видео) и проверьте чистоту электрофизиологических сигналов в обоих каналах, прежде чем продолжить.
- Оберните места подключения электродов алюминиевой фольгой, чтобы защитить от электрических шумов и улучшить соотношение сигнал/шум в соответствующих электрофизиологических записях.
- При необходимости отрегулируйте расположение датчика дыхания и глубину игольчатого электрода ЭМГ, чтобы получить чистые электрофизиологические сигналы в обоих каналах. Чтобы следовать этому протоколу, используйте частоту дискретизации 1k для дыхания и частоту дискретизации 20k и полосовой фильтр (например, 150-3000 Гц) для ЭМГ.
- Накройте туловище грызуна (и дыхательный сенсор) прозрачным одеялом, чтобы облегчить терморегуляцию и позволить визуализировать движения брюшной полости во время дыхания. Оставьте задние конечности и нижнюю часть живота свободно открытыми для доступа во время рефлекторных проверок и восстановления поддерживающей кетамина. Убедитесь, что одеяло не стесняет движений живота во время дыхания.
- Проведите трансоральную эндоскопию (рисунок 4).
- Откройте рот грызуна, вставив конический аппликатор с ватным наконечником за центральными резцами, перпендикулярно челюсти. Поверните ватный тампон на тыльной поверхности языка, чтобы немного выпячивать его изо рта.
- С помощью легкого захвата пальцами осторожно слегка вытяните язык изо рта в сторону от центральных резцов, одновременно вводя кончик эндоскопа в ротовую полость (рис. 4A, B).
- Включите источник света после того, как кончик эндоскопа будет вставлен в рот, чтобы не нанести потенциальный вред глазам грызуна.
- Введите эндоскоп латерально к резцам с той же стороны, что и втянутый язык. Центральные резцы препятствуют введению эндоскопа по средней линии, что обуславливает необходимость такого бокового подхода к введению.
- Запустите эндоскопические (и электрофизиологические) регистрирующие системы. Непрерывная запись на протяжении всей процедуры, чтобы обеспечить достаточный объем данных для апостериорного анализа, или запись в выбранное время, в зависимости от потребностей исследования.
- Осторожно продвигайте эндоскоп, чтобы визуализировать ротоглотку, соблюдая осторожность, чтобы не поцарапать твердое нёбо и не оказать чрезмерного давления на язык, что может привести к травме.
- Удалите все видимые частицы пищи и/или избыток слюнных выделений с помощью тампона соответствующего размера (например, микрощетки диаметром 1,5 мм), чтобы свести к минимуму риск аспирации по мере продвижения процедуры.
- Продолжайте продвигать/регулировать положение эндоскопа до тех пор, пока гипофаринкс не будет центрирован в поле зрения монитора и не станут различимы ключевые анатомические структуры (рис. 4C). На этом этапе все структуры должны выглядеть анатомически выровненными/симметричными в поле зрения камеры; В противном случае при необходимости измените положение эндоскопа.
- Следите за движением челюсти/языка во время продвижения эндоскопа. Если он отсутствует, продолжайте без дальнейшей дозировки кетамина. При наличии кетамина введите вторую поддерживающую дозу кетамина (от 1/4 до 1/2 от первоначальной дозы кетамина) и подождите примерно 5 минут, чтобы эффект подействовал, прежде чем продолжить. Повторную дозу следует применять только в том случае, если с момента предыдущей инъекции прошло не менее 20 минут, чтобы избежать чрезмерной седации и отмены глотания.
- Осматривайте язык грызуна каждые 5 минут на протяжении всей процедуры на предмет потемневшего обесцвечивания, которое свидетельствует об ишемии. Чтобы избежать этого, при необходимости измените положение эндоскопа.
- Слегка надавите на велум с помощью микрозонда (например, металлического шпателя), вставленного рядом с эндоскопом, чтобы разъединить мягкое небо и надгортанник и визуализировать гортань на расстоянии (Рисунок 4D). Избегайте использования наконечника эндоскопа для разъединения, так как приложенное давление может привести к повреждению мягких тканей или необратимому изгибу/повреждению стержня эндоскопа.
ПРИМЕЧАНИЕ: В отличие от человека, гортань мышей не видна непосредственно с трансоральной точки зрения. Вместо этого надгортанник механически застревает под слизистой оболочкой, находящейся над велумом, что приводит к образованию тупикового гипофарингеального пространства. При легком надавливании на велум надгортанник освобождается от велярной мембраны, что дает частичный обзор гортани. - Наблюдайте за вызванными глотаниями во время разъединения велума/надгортанника.
- Определите глотание как резкие, краткие задние смещения языка к твердому нёбу. Это движение обычно происходит синхронно с кратким движением нижней челюсти/впадением, тем самым обеспечивая суррогат для идентификации глотания, когда задний язык не виден в поле зрения эндоскопа.
- Также идентифицируйте глотания с помощью лопающей активности ЭМГ языка в сочетании с короткими эпизодами апноэ в электрофизиологической записи, которые происходят синхронно с событиями закрытия глоттиков на эндоскопическом видео.
- В случае быстрого повторного глотания, свидетельствующего о недостаточной анестезии (т.е. слишком легкой), повторите дозу и подождите ~5-10 минут, прежде чем продолжить. Подождите не менее 20 минут после предыдущей поддерживающей инъекции кетамина, чтобы избежать чрезмерной седации и прекращения глотания.
- Считайте, что глубина анестезии является оптимальной, когда во время веляр-эпиглоттического разъединения вызывается всего несколько глотков.
- Если глотание отменено, анестезия слишком глубока для оценки защиты дыхательных путей гортани. В этом случае подождите 5-10 минут для метаболизма кетамина, прежде чем приступать к визуализации гортани крупным планом.
3. Крупная, беспрепятственная видеосъемка движения гортани во время дыхания и вызванного глотания
ПРИМЕЧАНИЕ: Синхронная электрофизиологическая запись дыхания, глотания и координации глотания и дыхания также является опцией.
- Медленно продвигайте эндоскоп между велумом и надгортанником, сохраняя гортань в центре поля зрения (рисунок 5A-C).
ПРИМЕЧАНИЕ: Наконечник эндоскопа легко пройдет через велярно-эпиглоттическое отверстие без усилия. В противном случае прервите процедуру, чтобы избежать потенциального вреда для животного. Можно визуализировать гортань на расстоянии, с помощью наконечника эндоскопа в гипофаринксе. Тем не менее, этот подход обычно требует ручного втягивания надгортанника, велума и/или языка для лучшей визуализации гортани. Тем не менее, части гортани обычно остаются скрытыми от глаз, а устройства втягивания могут ограничивать движение гортани, что может быть ошибочно принято за дисфункцию. - Продолжайте продвигаться по эндоскопу, чтобы получить беспрепятственный крупный план всего вентрально-дорсального и латерального размеров гортани в одном поле зрения (рис. 5C).
ПРИМЕЧАНИЕ: Вентральная комиссура может быть затруднена надгортанником, особенно у молодых/мелких мышей. В этих случаях попытка более агрессивно манипулировать кончиком эндоскопа для визуализации вентральной спайки может ограничить движение гортани, что может быть ошибочно принято за дисфункцию. Он также может блокировать поток воздуха в гортани, что приводит к удушью. - Наблюдайте за колебательным движением гортани при вдохе грызуна (гортанное расширение) и выдохе (гортанное сужение) в течение каждого дыхательного цикла.
ПРИМЕЧАНИЕ: Скорость и величина движения гортани/гортани могут варьироваться в зависимости от глубины анестезии; Тем не менее, гортанная щель (т.е. воздушное пространство между левой/правой эратеноидами и голосовыми складками) обычно остается видимой на протяжении всего дыхательного цикла у здоровых грызунов.- Если отмечается заметное сужение глотки, отрегулируйте положение эндоскопа, чтобы обеспечить беспрепятственный поток воздуха через верхние дыхательные пути. Например, избегайте давления на велум, которое может вызвать обструкцию мягких тканей носовых дыхательных путей. Также избегайте введения наконечника эндоскопа в гортанное пространство, которое может блокировать поток воздуха в гортани, что приведет к удушью. Если в редких случаях дыхание прекращается, после снятия эндоскопа выполните несколько компрессий средней части грудины грудной клетки (с помощью одного пальца) или вентиляцию с положительным давлением (с помощью миниатюрного «реанимационного мешка»).
- Видеозапись дыхательных движений гортани в течение 30-60 с с целью апостериорной оценки.
- Пока гортань все еще находится в поле зрения крупным планом, слегка отрегулируйте наконечник эндоскопа в пределах входного отверстия гортани, чтобы применить механическую стимуляцию слизистой оболочки, расположенной над велумом и/или надгортанником, и вызвать глотание у грызунов под оптимальным наркозом.
- Используйте микроуровневую регулировку наконечника эндоскопа (т.е. ~1 мм в любом направлении) для предотвращения травмирования слизистой оболочки и/или обструкции дыхательных путей.
- Следите за вызванными глотаниями, которые можно легко идентифицировать как резкие события закрытия глотки, происходящие синхронно с видимым вдавливанием челюсти, лопающей ЭМГ языка и кратким (<1/2 с) апноэ, которое видно в дыхательных путях.
ПРИМЕЧАНИЕ: Могут возникать события закрытия глоттики без сопутствующего движения челюсти; Тем не менее, закрытие глоттика обычно является неполным в этих случаях. Мы подозреваем, что это могут быть другие защитные рефлексы дыхательных путей (например, аддукторный рефлекс гортани), возникающие по мере того, как анестезия начинает ослабевать; Тем не менее, это редкие/непоследовательные случаи, которые требуют дальнейшего изучения. - Повторяйте до тех пор, пока не будет вызвано 5-10 глотаний и записано видео для каждого животного. Если глотание прекращено, снимите эндоскоп и подождите 5-10 минут, пока произойдет метаболизм кетамина, прежде чем продолжить.
- Осторожно втяните, но не удаляйте, эндоскоп в ротоглотку и центрируйте гипофаринкс в поле зрения, чтобы визуализировать надгортанник и велум.
- Восстановите соединение велума и надгортанника для возобновления носового дыхания с помощью микротампона, чтобы слегка надавить на основание языка, чтобы вызвать глотание и повторное ущемление надгортанника под велярной мембраной. Если повторное соединение не происходит в течение нескольких попыток, продолжайте восстановление после анестезии без повторного соединения, чтобы избежать риска травмы гортани.
- Прекратите запись эндоскопии (и электрофизиологии).
- С помощью ватного тампона, смоченного солевым раствором, смочите язык и центральные резцы и верните язык в его анатомическое положение в ротовой полости.
- Отсоедините ушные накладки и снимите с грызуна датчик температуры, датчик дыхания и электроды ЭМГ, чтобы продолжить восстановление после анестезии.
4. Восстановление после анестезии
- Поместите животное в предварительно разогретую клетку для восстановления (т.е. такую же, как индукционную клетку) на «станцию обогрева», чтобы оно восстановилось после анестезии.
- Повторно нанесите смазку для глаз, чтобы предотвратить высыхание.
- Вводите подогретый физиологический раствор SC для гидратации жидкости: до 5 мл для крыс и до 0,5 мл для мышей.
- Назначают атипамезол/к для реверсирования ксилазина и повышения дыхательного драйва: 1-2 мг/кг крысам и мышам.
- Начните с 2 мг/кг атипамезола, сразу после чего последует ручная стимуляция вдоль спины и желудка грызуна для ускорения выздоровления.
ПРИМЕЧАНИЕ: При использовании этого подхода спонтанные движения головы обычно начинаются в течение 1-3 минут. Тем не менее, возвращение к амбулаторному состоянию обычно занимает в среднем 2 часа (от 1 до 5 часов) после ларингоскопии под анестезией KX из-за индивидуальных различий. - Дайте дополнительный атипамезол в дозе 1 мг/кг (не менее чем через 15 минут после первой инъекции), если спонтанные движения тела уменьшаются, а не увеличиваются в течение первых 15-30 минут восстановления после анестезии, несмотря на частую ручную стимуляцию.
- Продолжайте прием доксапрама (5 мг/кг ВП для крыс и мышей), если спонтанная активность продолжает снижаться. Повторно вводите препарат с интервалом в 10-15 минут (до пяти доз) до появления спонтанного движения. Если грызуны остаются умирающими, усыпьте животных, используя одобренные методы эвтаназии (например, передозировка кетамина с последующим вторичным методом, таким как обезглавливание).
- Начните с 2 мг/кг атипамезола, сразу после чего последует ручная стимуляция вдоль спины и желудка грызуна для ускорения выздоровления.
- Внимательно наблюдайте за выздоравливающими грызунами с интервалом в 15-20 минут, чтобы обнаружить неблагоприятные изменения в респираторном статусе, подвижности и терморегуляции и обеспечить вмешательство по мере необходимости (например, ручная стимуляция, дополнительный кислород, тепловое одеяло, атипамезол или инъекции доксапрама). Обеспечьте более частое наблюдение за грызунами, требующими вмешательства.
- Подавайте дополнительный кислород (например, 1-2 л/мин в подогретой индукционной камере, без ISO) с интервалом в 10 минут по мере необходимости для грызунов с длительным временем восстановления после анестезии KX. В качестве альтернативы применяйте частую стимуляцию вдоль спинной и вентральной поверхностей животного для нормализации уровняSpO2 (>94%).
- Поместите выздоравливающих соседей по клетке в одну клетку для восстановления (до двух грызунов в клетке), чтобы способствовать повышению спонтанной активности и более быстрому восстановлению.
- Возвращайте грызунов в их утепленную домашнюю клетку, когда они могут спонтанно перемещаться по клетке для восстановления.
- Верните стандартную бутылку с едой и водой в домашнюю клетку. Не предоставляйте специальных помещений для доступа к пище/воде, пока анестезия еще не закончилась, чтобы свести к минимуму риск удушья/аспирации.
- Наблюдайте за действиями домашней клетки и устраните все препятствия, мешающие передвижению (например, хижина, труба из ПВХ).
- Поместите домашнюю клетку наполовину, а наполовину отключите станцию обогрева на следующие 12-16 часов (т.е. на ночь).
ПРИМЕЧАНИЕ: Более раннее прекращение дополнительного нагрева может привести к смерти из-за переохлаждения.
- Проведите стандартные проверки работоспособности на следующее утро. Возвращение животных с возобновлением нормальной/исходной активности, функций организма (например, терморегуляция, еда, питье, мочеиспускание, дефекация) и стабильного веса (т.е. поддержание или набор) в стандартные условия вивария с регулярным ежедневным мониторингом здоровья. В редких случаях, когда у грызунов снижается активность, функции организма или масса тела, продолжайте дополнительное тепло в течение следующего дня.
ПРИМЕЧАНИЕ: У крыс окрашивание порфирином обычно внезапно появляется вокруг обоих глаз через ~3-6 часов после начала периода восстановления после анестезии. Окрашивание обычно рассасывается в течение 24 часов.
5. Объективная количественная оценка движения гортани при дыхании в сравнении с глотанием
- Используйте программное обеспечение для редактирования видео с функцией покадрового анализа для просмотра эндоскопических видео.
- Определите, по крайней мере, один репрезентативный эпизод спонтанного дыхания в течение 10-20 секунд у каждого животного.
- Определите 3-5 репрезентативных случаев глотания на одно животное.
- Убедитесь, что выбранные эпизоды/события дыхания и глотания соответствуют следующим критериям анализа: гортань центрирована в поле зрения камеры со всеми видимыми структурами/границами гортани (т.е. не закрыта велумом, надгортанником или избыточным выделением слюны), достаточным освещением (т.е. способна видеть все структуры/границы гортани) и без артефактов движения камеры (т.е. эндоскоп не движется).
- Проанализируйте выявленные эпизоды/события дыхания и глотания с использованием субъективного и/или объективного подхода.
- Для субъективного анализа: используйте шкалу Лайкерта для субъективной оценки движения гортани во время просмотра в реальном времени и покадрового просмотра с помощью программного обеспечения для редактирования видео. Чтобы следовать этому протоколу, используйте расширенную шкалу Лайкерта в диапазоне от -2 до +2, где отрицательные значения указывают на движение гортани в направлении, противоположном ожидаемому. Оцените защиту гортанных дыхательных путей во время глотания, где 0 = отсутствие уменьшения размера гортанной щели (т.е. отсутствие защиты гортанных дыхательных путей), 1 = некоторое уменьшение гортанной щели (т.е. неполная защита дыхательных путей) и 2 = полное приведение крыловидных костей с небольшим вентральным голосовым зазором между голосовыми складками (т.е. полная защита дыхательных путей), с отрицательными значениями, указывающими на парадоксальное движение гортани.
Шкала Лайкерта в диапазоне от 0 до 2 обычно используется в исследованиях на грызунах, где 0 = отсутствие движения, 1 = некоторое движение, а 2 = нормальное движение 17,18,19,20,21,22. Однако эта шкала не учитывает парадоксальную подвижность гортани, которая часто возникает после повторного повреждения гортанного нерва (ЛН)10. - Для объективного анализа: Определите четыре ключевых видеокадра: 1) оставшийся кадр, непосредственно предшествующий началу приведения гортани (т.е. кадр перед приведением голосовых складок), 2) кадр, в котором голосовые складки завершили приведение, 3) кадр, непосредственно предшествующий отведению голосовых складок (он может перекрываться с #2), и 4) кадр, в котором голосовые складки полностью отведены и возвращаются в положение покоя для возобновления дыхания. Используйте временную метку этих четырех ключевых кадров для вычисления продолжительности приведения голосовых связок (кадр с 1 по кадр 2), смыкания глоттики (кадр со 2 по кадр 3), отведение голосовых складок (кадр с 3 по кадр 4) и общую продолжительность глотания (кадр с 1 по кадр 4). В качестве альтернативы можно использовать другое существующее коммерческое программное обеспечение23 для измерения угла гортани (т.е. между дорсально крыльевыми краями или вентрально голосовыми складками) во время максимальной абдукции и максимальной аддукции с использованием неподвижных кадров 17,18,24. Пусть по крайней мере два обученных рецензента выполнят этот процесс независимо друг от друга, выявят расхождения между рецензентами и достигнут совместного консенсуса по каждому несоответствию.
ПРИМЕЧАНИЕ: Ранее мы проводили этот ручной покадровый анализ событий времени закрытия глоттиков (т.е. во время защитных рефлексов дыхательных путей) с использованием коммерческого программного обеспечения для редактирования видео на грызунах и людях14. Однако этот подход неэффективен и обеспечивает лишь ограниченную количественную оценку динамики движения гортани. В настоящее время мы используем собственное программное обеспечение для отслеживания гортани для выполнения более обширной объективной количественной оценки движения гортани во время дыхания и защитных рефлексов дыхательных путей 22,25,26,27,28,29,30. Программное обеспечение имеет возможность автоматического покадрового слежения для объективной количественной оценки расстояния (амплитуды) и времени (частоты) левостороннего и правостороннего движения гортани. Мы используем эти параметры для получения различных измерений на основе движения для обнаружения/количественной оценки дисфункции гортани (например, максимум/минимум/диапазон угла гортани, симметрия движения гортани и синхронность) во время дыхания, глотания и других защитных рефлексов дыхательных путей (например, рефлекса приводящей мышцы гортани). Это программное обеспечение все еще находится в стадии доработки и еще не является коммерчески / общедоступным.
- Для субъективного анализа: используйте шкалу Лайкерта для субъективной оценки движения гортани во время просмотра в реальном времени и покадрового просмотра с помощью программного обеспечения для редактирования видео. Чтобы следовать этому протоколу, используйте расширенную шкалу Лайкерта в диапазоне от -2 до +2, где отрицательные значения указывают на движение гортани в направлении, противоположном ожидаемому. Оцените защиту гортанных дыхательных путей во время глотания, где 0 = отсутствие уменьшения размера гортанной щели (т.е. отсутствие защиты гортанных дыхательных путей), 1 = некоторое уменьшение гортанной щели (т.е. неполная защита дыхательных путей) и 2 = полное приведение крыловидных костей с небольшим вентральным голосовым зазором между голосовыми складками (т.е. полная защита дыхательных путей), с отрицательными значениями, указывающими на парадоксальное движение гортани.
Результаты
Успешное использование этого протокола ларингоскопии мышей приводит к визуализации гортани крупным планом во время спонтанного дыхания и вызванного глотания в здоровых и больных условиях, как показано на рисунке 6. Более того, этот протокол может быть повторен несколько раз на одних и тех же грызунах, чтобы можно было исследовать функцию/дисфункцию гортани с течением времени. Как показано на рисунке 7, мы успешно повторили этот протокол ларингоскопии 6 раз в течение 4 месяцев для изучения модели спонтанного восстановления в хирургической модели повреждения RLN у крыс (данные еще не опубликованы). Попытки использовать анестезию ISO вместо KX привели к практически полной отмене глотания (рис. 8) у грызунов, подвергавшихся прямой электрической стимуляции правого верхнего гортанного нерва для стимуляции глотания, как описано в наших предыдущих экспериментах31,32. Это произошло при ISO на уровне всего 2%; снижение ISO ниже этого уровня приводило к возвращению спонтанного движения и, следовательно, было предотвращено. Этот сбивающий с толку эффект ISO подчеркивает важность выбора анестезии для успешного использования этого протокола.
При хорошем качестве эндоскопического изображения репрезентативные видеоклипы дыхания и глотания могут быть проанализированы с помощью программного обеспечения для отслеживания движения, как показано на рисунке 9. Репрезентативные показатели исходов, автоматически сгенерированные нашим специализированным программным обеспечением для отслеживания гортани, перечислены в таблице 1. Обратите внимание, что некоторые критерии исходов, связанных с дыханием и глотанием, заметно различались между исходным уровнем и после транссекции RLN у одной и той же репрезентативной крысы. В то время как гортанные углы во время дыхания были схожими между исходным уровнем и после РЛН, соотношения амплитуды движения правой и левой гортани (т.е. отношение среднего диапазона движения или MMRR) и частоты (отношение открытого и закрытого цикла или OCCR) во время дыхания были ниже после пересечения. Аналогичным образом, продолжительность глотания была короче после пересечения RLN.
Если получены синхронные электрофизиологические записи (например, респираторная пневмограмма и ЭМГ гениоглоссуса), можно количественно оценить несколько дополнительных объективных показателей исходов для корреляции с данными ларингоскопии. Примеры основанных на электрофизиологии показателей исходов, представляющих интерес для нашего исследования, обобщены на рисунке 10. В настоящее время мы разрабатываем алгоритмы для автоматизированной количественной оценки этих показателей результатов.

Рисунок 1: Мышиная эндоскопическая платформа. (A) Боковой и (B) Вид сверху специальной мышиной эндоскопической платформы с маркировкой основных компонентов. Обратите внимание, что столешница под грелкой регулируется по размеру. Здесь показаны размеры столешницы и грелки, используемые с крысами, которые легко снимаются, чтобы обнажить столешницу размером с мышь, которая вмещает меньшую грелку (не показана). Специальный адаптер крепит эндоскоп к микроманипулятору, который крепится к основанию платформы. Такая стратегическая конструкция позволяет перемещать всю платформу как единое целое во время эндоскопической процедуры, не рискуя травмировать животное из-за непреднамеренного/неконтролируемого движения эндоскопа. Микроманипулятор позволяет выполнять грубую и микрорегулировку наконечника эндоскопа в нескольких направлениях, включая x (влево/вправо), y (вперед/назад), z (вверх/вниз), а также вращение вокруг y (шаг) и z (рыскание). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Отоскоп и специальная оболочка для мышиной ларингоскопии. (A) Разобранные компоненты коммерческого отоскопа и изготовленная на заказ оболочка из нержавеющей стали с адаптером для мышиной ларингоскопии. (B) В собранном виде наконечник отоскопа выступает на 1 мм за пределы металлической оболочки, но при необходимости регулируется до 5 мм. Такая стратегическая конструкция способствует продвижению узкого наконечника отоскопа в входное отверстие гортани грызуна, в то время как металлическая оболочка немного большего диаметра (2,4 мм) достаточно удерживает велум и надгортанник открытыми для оптимальной визуализации всей гортани во время дыхания и глотания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
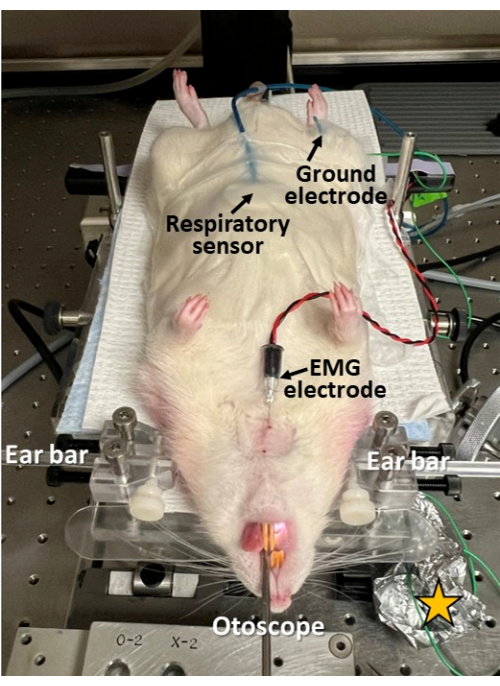
Рисунок 3: Минимально инвазивная электрофизиологическая запись во время эндоскопии. Дыхательный датчик приклеивается к брюшной полости грызуна; электрод ЭМГ вводится через кожу в гениоглоссусную мышцу языка; А заземляющий электрод вводится подкожно в тазобедренный сустав. Этот подход позволяет исследовать глотание, дыхание и координацию глотания и дыхания синхронно с эндоскопией. Обратите внимание, что кожа сбривается и очищается/дезинфицируется в местах введения электродов. Желтая звезда = алюминиевая фольга, обернутая вокруг мест подключения электродов, для улучшения соотношения сигнал/шум в электрофизиологических записях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Трансоральная эндоскопия для визуализации гортани на расстоянии. (A) После осторожного втягивания языка легким захватом пальцами, эндоскоп вводится между языком и центральными резцами в месте красной звезды (т.е. на той же стороне, что и втянутый язык, для поддержания анатомического выравнивания со стержнем эндоскопа). (В) Когда эндоскоп продвигается за твердое нёбо, (В) в поле зрения появляются надгортанник и велум. (D) Чтобы визуализировать голосовую щель, велум и надгортанник должны быть «разъединены» путем приложения давления на поверхность голосовой щели (в месте расположения черной очерченной звезды на изображении C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
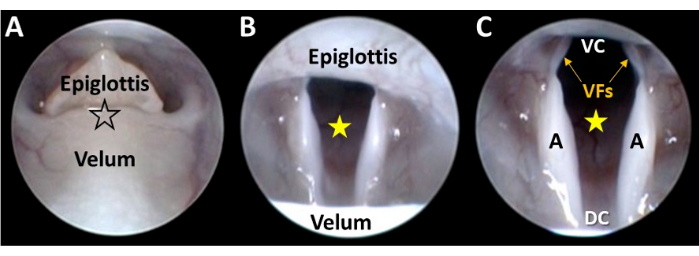
Рисунок 5: Эндоскопическая визуализация гортани крупным планом. (A) Наконечник эндоскопа мягко направляется с помощью микроманипулятора между разъединенным велумом и надгортанником (в месте расположения звезды, обведенной черным цветом). По мере продвижения эндоскопа (B) гортань становится видимой, а гортанное пространство (желтая звезда) центрируется в поле зрения камеры с помощью регулировки микроманипулятора. (C) Продолжительное продвижение эндоскопа с помощью микроманипулятора приводит к визуализации всего вентрально-дорсального и латерального размеров гортани. Сокращения: VC = вентральная комиссура гортани (т.е. точка вентрального соединения между голосовыми складками); DC = дорсальная комиссура гортани (т.е. точка дорсального соединения между крыльевыми краями); VF = голосовые складки; А = эритеноид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Визуализация гортани мыши во время дыхания и глотания. Репрезентативные эндоскопические изображения, изображающие движение гортани во время дыхания и глотания у взрослой крысы Sprague Dawley (A-C) до и (D-F) после хирургической транссекции правой RLN. Обратите внимание, что положение гортани в состоянии покоя остается неизменным (D) после травмы RLN по сравнению с исходным уровнем (A). (В,Э) Во время максимального вдоха асимметрия гортани становится очевидной после травмы RLN. Вместо того, чтобы оба эритеноида отведены для увеличения гортанного пространства (желтая звезда), (B), как показано на исходном уровне, (E) ипсилатеральный (справа) аритеноид (черная звездочка) и голосовая связка кажутся обездвиженными на протяжении всего дыхательного цикла после повреждения RLN. Правосторонняя асимметрия также проявляется во время глотания. (C) На исходном уровне перитеноиды приближаются к средней линии во время глотания, оставляя небольшой вентральный гортанный промежуток между голосовыми складками. (F) После повреждения RLN ипсилатеральный перитеноид и VF перемещаются парадоксально (т.е. в том же направлении, что и непораженная сторона, красная стрелка) во время глотания, оставляя большую гортанную щель (желтую звезду), простирающуюся от вентральной до задней спайки гортани. (F) Это изображение является прямым доказательством нарушения защиты дыхательных путей гортани на модели ятрогенного повреждения RLN у крыс. (К,Ж) Обратите внимание, что гортань смещается ближе к эндоскопу во время глотания, о чем свидетельствует то, что надгортанник и велум больше не видны в поле зрения камеры. Черные стрелки указывают направление нормального движения гортани, тогда как красная стрелка указывает на парадоксальное движение; Желтая звезда = гортанное пространство. Сокращения: VFs = голосовые складки; A = черлиновидная оболочка; RLN = возвратный гортанный нерв. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Использование серийной ларингоскопии для исследования дисфункции гортани во время дыхания и глотания на модели ятрогенного повреждения RLN у крыс. Шкала Лайкерта в диапазоне от -2 до +2 была использована для оценки расстояния и направления движения гортани у восьми взрослых крыс Спрэг-Доули в течение 4-месячного периода. После исходной ларингоскопии крысам была проведена хирургическая процедура по пересечению правой RLN, за которой последовала серийная ларингоскопия через 1 неделю после операции, а затем снова с интервалом в 1 месяц от 1 до 4 месяцев после операции. Все восемь крыс выжили после процедуры, тем самым продемонстрировав эффективность нашего режима анестезии для серийной ларингоскопии. (A) Видеозаписи анализировались в режиме реального времени и покадрово/в замедленном темпе для количественной оценки движения гортани во время дыхания, где 0 = отсутствие движения, 1 = некоторое движение, а 2 = нормальное расстояние движения пораженной (правой) стороны по сравнению с неповрежденной (левой) стороной. (В) При глотании размер гортанной щели оценивался следующим образом: 0 = отсутствие уменьшения размера гортанной щели (т.е. отсутствие защиты гортанных дыхательных путей), 1 = некоторое уменьшение гортанной щели (т.е. неполная защита дыхательных путей) и 2 = полное приведение перитеноидов с небольшим вентральным голосовым зазором между голосовыми складками (т.е. полная защита дыхательных путей). Отрицательные значения для дыхания и глотания указывают на движение гортани в направлении, противоположном ожидаемому (т.е. парадоксально). Обратите внимание, что после повреждения RLN негативное влияние сказалось как на дыхании, так и на глотании. Интересно, что защита дыхательных путей гортани была полной (хотя и парадоксальной) в момент времени 1 WPS, но после этого ухудшилась, варьируясь от отсутствия защиты до неполной защиты. Сокращения: WPS = неделя после операции; МПС = месяцы после операции; RLN = возвратный гортанный нерв. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 8: Глотание, ингибированное ISO у грызунов. (A) Изображение грызуна, проходящего ларингоскопию под анестезией ISO, с маркированными компонентами специальной системы доставки ISO, разработанной для этой цели. Основным предостережением этого инновационного подхода является риск воздействия ИСО на персонал. (B) Еще одним недостатком этого подхода является подавление глотания в соответствии со стандартом ISO. Эта параллельная диаграмма и диаграмма рассеяния обобщают неопубликованные данные, сравнивающие эффект анестезии ISO и KX у мышей (9 в группе), подвергавшихся прямой электрической стимуляции правого верхнего гортанного нерва для вызова глотания. Здесь показано количество глотаний, вызванных во время 5-минутного эксперимента, состоящего из 20 с последовательностей стимуляции 20 Гц с последующим 10 секундами отдыха. По сравнению с KX, мыши, получавшие анестезию ISO (всего 2%), имели значительно меньше глотаний (p < 0,001, t-критерий независимых выборок), а у 4/9 мышей глотание было отменено даже. Аналогичные результаты были получены в результате нехирургических экспериментов на мышах и крысах (данные не показаны). Сокращения: ISO = изофлуран; KX = кетамин-ксилазин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 9: Объективная количественная оценка движения гортани мышей с помощью программного обеспечения для слежения. Здесь показаны те же изображения с рисунка 6 , показывающие дыхание в сравнении с глотанием у крысы на исходном уровне и после травмы RLN, с линиями отслеживания движений гортани, добавленными нашим специальным программным обеспечением. Линии слежения были вручную добавлены к первому видеокадру вдоль медиальной границы перитеноидов для автоматизированного слежения за левым (синяя линия) и правым (красная линия) движением гортани в остальных видеокадрах. Соответствующие графики движения гортани, созданные нашим специальным программным обеспечением из видеоклипов продолжительностью 2,5 с, показывают отдельное движение влево/вправо в зависимости от производного глобального движения гортани, с метками, соответствующими (A,D) положению гортани в состоянии покоя, (B,E) максимальному гортанному промежутку во время вдоха и (C,F) закрытию глотки во время глотания. Обратите внимание на парадоксальное движение правой стороны (красные стрелки) после травмы RLN, а также на большой гортанный зазор, показанный на соответствующем графике полученного глобального движения. Репрезентативные критерии оценки исходов включены в Таблицу 1. Сокращение: RLN = возвратный гортанный нерв. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 10: Основанные на электрофизиологии показатели исходов для корреляции с данными ларингоскопии. (A) Электрофизиологические записи во время дыхания и глотания показаны для здоровой крысы. В верхнем окне отображается след дыхания (от дыхательного датчика, прикрепленного к брюшной полости грызуна), в среднем окне отображается активность ЭМГ в мышце гениоглоссуса, а в нижнем окне отображается отфильтрованная активность ЭМГ. Обратите внимание на ритмичное дыхание и ЭМГ во время дыхания, которое прерывается во время глотания. События глотания легко обнаруживаются по неровным движениям в дыхательном следе (черные стрелки), за которыми сразу же следует кратковременное апноэ (красная звездочка). (B) Развернутое окно пунктирного прямоугольного поля в точке А показывает, как некоторые критерии исхода количественно оцениваются на основе электрофизиологических записей. (A) Обратите внимание, что во время вдоха (желтые панели) дыхательный след (верхнее окно) задерживается на ~150 мс (синяя двойная стрелка) по сравнению с активностью взрыва ЭМГ, что подчеркивает временные различия между двумя электрофизиологическими методами. Репрезентативные показатели исходов, основанные на электрофизиологии, включают: 1) продолжительность фазы вдоха (i); 2) междыхательный интервал (ii, рассчитанный по дыхательному и фильтрованному каналам ЭМГ); площадь ласточки под кривой (iii); и глотательное апноэ (в/в; рассчитывается по дыхательным и фильтруемым каналам ЭМГ). Аббревиатура: ЭМГ = электромиография. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Критерии оценки результатов | Базис | После травмы RLN | |
| Дыхание | Минимальный угол гортани (градусы) | 34.5 | 34.6 |
| Максимальный угол гортани (градусы) | 52.9 | 49.9 | |
| Средний угол гортани (градусы) | 43.7 | 42.2 | |
| Отношение средней дальности движения (MMRR) | 1.26 | 0.29 | |
| Коэффициент открытого цикла закрытия (OCCR) | 1 | 0.11 | |
| Глотание | Приведение гортани (мс) | 200 | 233 |
| Продолжительность закрытия глоттической связки (мс) | 67 | 0 | |
| Отведение гортани (мс) | 233 | 67 | |
| Общая продолжительность глотания (мс) | 500 | 300 | |
Таблица 1: Репрезентативные показатели исходов, автоматически генерируемые специальным программным обеспечением для отслеживания гортани. Сокращение: RLN = возвратный гортанный нерв.
Дополнительный текст о платформе ларингоскопии. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Мы успешно разработали воспроизводимый протокол ларингоскопии, специфичный для мыши, который позволяет визуализировать движение гортани крупным планом во время дыхания и глотания. Важно отметить, что протокол может быть выполнен в течение определенного времени на одних и тех же животных для изучения влияния различных патологических состояний, в частности, на функцию гортани. Этот протокол разрабатывался в течение последнего десятилетия и претерпел существенные изменения и устранение неполадок. Оптимизация анестезии была самой большой проблемой, которую необходимо было преодолеть, чтобы предотвратить передозировку, которая отменяет глотание и/или рискует смертностью, связанной с респираторным дистрессом. Первоначально мы использовали ISO, что привело к отмене глотания, избыточной выработке слюны (что затрудняет эндоскопическую визуализацию) и риску контакта с персоналом, что считается серьезным противопоказанием против использования ISO для этой процедуры. Поэтому мы сосредоточились на KX, потому что это широко используемый анестетик для грызунов 33,34,35.
Мы начали разработку протокола с мышей 14,22,29,30,36 при использовании сиалэндоскопа из-за его меньшего диаметра стержня (1,1 мм) по сравнению с другими потенциально подходящими эндоскопами для этой цели. Важно отметить, что сиалендоскоп имеет рабочий канал, который мы изначально использовали для подачи воздушных импульсов для вызова/изучения рефлекса14 приводящей мышцы гортани. Тем не менее, мы обнаружили, что аддукторный рефлекс гортани часто снижался/отменялся у мышей и крыс, скорее всего, из-за общей анестезии и/или инактивации сенсорных рецепторов гортани/глотки на фоне высыхания слизистой оболочки в результате повторной подачи воздушных импульсов. Несмотря на то, что в наших исследованиях не удалось достоверно вызвать приводящий рефлекс гортани, глотание на удивление сохранялось и легко вызывалось механической стимуляцией у входа в гортань или рядом с ним. По этой причине мы переключили наше внимание на эндоскопический анализ механически вызванного глотания.
При этом мы отказались от полужесткого сиалендоскопа, который был склонен к поломке и имел недостаточное освещение и разрешение изображения для надежной визуализации и анализа движения гортани. Изучая многочисленные альтернативные эндоскопы, мы в конечном итоге остановились на конкретном отоскопе, который подходил для ларингоскопии как у мышей, так и у крыс. Исходя из нашего опыта, самым важным признаком при выборе подходящего эндоскопа для ларингоскопии мышей является диаметр стержня менее 2 мм , который может пропускать достаточно яркий свет для высококачественной видеосъемки. Эндоскопы большего диаметра не могут легко пройти через входное отверстие гортани у мышей и крыс для визуализации движения гортани крупным планом. Отоскопы особенно идеально подходят для этой цели, учитывая их отличное светопропускание, жесткую/долговечную конструкцию и относительно низкую стоимость по сравнению с другими типами эндоскопов (например, сиалэндоскопом, гибким эндоскопом). Кроме того, в то время как ручное управление эндоскопом является опцией в стабильных руках, мы считаем управление микроманипулятором важной особенностью этого протокола ларингоскопии. Важно отметить, что управление эндоскопом с помощью микроманипулятора позволяет одному исследователю вести стабильную видеозапись движения гортани для последующей количественной оценки. На сегодняшний день мы успешно применяем этот протокол, основанный на отоскопе, на взрослых мышах и крысах. Мы подозреваем, что варианты эндоскопов меньшего диаметра будут иметь важное значение для проведения ларингоскопии у молодых/мелких грызунов.
Новым преимуществом нашего протокола ларингоскопии является возможность визуализации защиты дыхательных путей во время глотания у грызунов, что невозможно у людей из-за эпиглоттической инверсии над входом в гортань, которая закрывает голосовую щель от обзора. Таким образом, грызуны предоставляют уникальную возможность специально исследовать механизмы нормальной и патологической защиты дыхательных путей гортани с конечной целью поиска методов лечения для эффективного восстановления нормальной функции гортани. Эта уникальная возможность протокола ларингоскопии мышей является основным преимуществом по сравнению с видеофлюороскопией (т.е. другим «золотым стандартом» теста на дисфагию), которая не смогла обнаружить аспирацию в многочисленных моделях дисфагии у грызунов, которые мы разработали/идентифицировали до сих пор 30,36,37,38,39,40. Этот отрицательный результат, полученный с помощью VFSS, можно объяснить несколькими анатомическими различиями в верхних дыхательных путях грызунов, которые очевидны с помощью нашего трансорального эндоскопического подхода. Во-первых, гортань грызуна расположена высоко в носоглотке, где она скрыта плотно прилегающим надгортанником и велумом, что создает тупиковую ротовую полость. Кроме того, надгортанник в состоянии покоя застревает под слизистой оболочкой, находящейся над велумом. Такая анатомическая конфигурация приводит к тому, что грызуны являются облигатными носовыми дышащими; Таким образом, оральное дыхание у бодрствующих грызунов является признаком респираторной заболеваемости. Однако во время глотания у здоровых грызунов надгортанник выскальзывает из слизистой оболочки и заворачивается над входом в гортань, поскольку гортань поднимается дальше в носоглотку, в сторону от пути болюса. Эти динамические события верхних дыхательных путей могут быть непосредственно визуализированы/оценены с помощью ларингоскопии у здоровых грызунов и моделей дисфункции гортани.
Важно отметить, что мы показали, что, несмотря на отсутствие аспирации во время тестирования VFSS, модели грызунов (например, ятрогенное повреждение RLN) действительно демонстрируют признаки нарушения защиты дыхательных путей гортани (т.е. неполное закрытие гортани) с помощью ларингоскопии, которая является трансляционной для пациентов с аспирацией, связанной с дисфагией. Таким образом, этот протокол ларингоскопии мышей обеспечивает полезную трансляционную платформу для конкретного исследования механизмов защиты дыхательных путей и целевого лечения, которые в настоящее время остаются неуловимыми. Достижение этой цели потребует дальнейшего развития/оптимизации нашего текущего метода, который использует наконечник эндоскопа для обеспечения некалиброванной механической стимуляции слизистой оболочки гортани/глотки для вызова глотания. В настоящее время в нашей лаборатории исследуются более строгие, точно контролируемые методы стимуляции глотания, включая прямую электрическую стимуляцию верхнего гортанного нерва32,41 и химическую (например, лимонную кислоту42) стимуляцию слизистой оболочки гортани/глотки. Дополнительным ограничением этого протокола является лежачее положение грызунов на спине, которое не имитирует бодрствующее и естественное пищевое поведение. Первоначальная разработка протокола включала положение лежа на животе, что привело к ограничению движения нижней челюсти, а также к ограничению видимости полости рта, что заметно затрудняло прохождение эндоскопа. Есть возможность визуализировать гортань на расстоянии с помощью наконечника эндоскопа в области гипофаринкса; Однако этот подход обычно требует ручного втягивания надгортанника, велума и/или языка для лучшей визуализации гортани. Для этой цели мы изготовили различные специализированные устройства ручного втягивания (например, модифицированные зеркала отоскопа, модифицированные наконечники для пипеток). Тем не менее, части гортани обычно остаются скрытыми от глаз, а устройства втягивания могут ограничивать движение гортани, что может быть ошибочно принято за дисфункцию. Кроме того, недавние дополнительные функции эндоскопической платформы (например, наклон Тренделенбурга и вырез между ушными планками для приспособления движения челюсти) могут облегчить тестирование грызунов в положении лежа. Ушные планки и дополнительное тепло являются необходимыми элементами протокола ларингоскопии. Ушные планки препятствуют движению головы во время трансоральных манипуляций с эндоскопом. Гомеотермная система нагрева поддерживает температуру тела в диапазоне от 36 °C до 38 °C, чтобы обеспечить стабильную анестезию и предотвратить гипотермию на протяжении всей процедуры.
Теперь, когда существует методология надежной видеозаписи движения гортани во время дыхания и глотания у грызунов, количественная оценка с высокой пропускной способностью является важным следующим шагом. Поэтому мы продолжаем работу по анализу видео, чтобы определить, какой показатель исхода, сгенерированный нашим специализированным программным обеспечением, может наилучшим образом отличить здоровые состояния от больных, а также выявить изменения с течением времени в ответ на естественное прогрессирование заболевания или лечебные вмешательства. Лучшие кандидаты будут в центре внимания последующих подходов к машинному обучению для ускорения анализа видеоизображений. Важно отметить, что случаи неоптимального качества изображения (например, недостаточное освещение, анатомические структуры вне поля зрения, избыток выделений, скрывающих структуры гортани и т. д.) в настоящее время не поддаются отслеживанию гортани; Тем не менее, этот барьер может быть преодолен в будущем с помощью инструментов машинного обучения. До тех пор первостепенное значение имеет тщательный отбор последовательностей видеокадров, отвечающих критериям анализа отслеживания гортани (как описано в разделе 5 протокола).
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Эта работа была частично профинансирована двумя грантами NIH: 1) грантом Multi-PI (TL и NN) R01 (HL153612) от Национального института сердца, легких и крови (NHLBI) и 2) грантом R03 (TL, DC0110895) от Национального института глухоты и других коммуникативных расстройств (NIDCD). Наша разработка программного обеспечения для отслеживания движения гортани была частично профинансирована грантом Фонда Култера (TL & Filiz Bunyak). Мы благодарим Кейт Осман, Хлою Бейкер, Кеннеди Хелшера и Золу Стивенсон за отличный уход за нашими лабораторными грызунами. Мы также выражаем признательность Родерику Шлотцхауэру и Честону Калле из MU Physics Machine Shop за их вклад в разработку и изготовление нашей специализированной эндоскопической платформы, а также за стратегические модификации коммерческих эндоскопов и микроманипуляторов в соответствии с нашими исследовательскими потребностями. Наше программное обеспечение для отслеживания движений гортани было разработано в сотрудничестве с доктором Филиз Буньяк и доктором Али Хамадом (факультет электротехники и компьютерных наук Университета Миссури). Мы также благодарим Джима Марнатти из клиники Karl Storz Endoscopy за рекомендации по выбору отоскопа. Наконец, мы хотели бы выразить признательность многочисленным бывшим студентам/стажерам лаборатории Lever, чей вклад послужил основой для разработки нашего текущего протокола ларингоскопии мышей: Марлене Шевчик, Кэмерону Хинкелю, Эбигейл Ровнак, Бриджит Хоупвелл, Лесли Шок, Яну Денингеру, Чендлеру Хэкстону, Мерфи Мастину и Даниэлю Шу.
Материалы
| Name | Company | Catalog Number | Comments |
| Atipamezole | Zoetis | Antisedan; 5 mg/mL | Parsippany-Troy Hills, NJ |
| Bioamplifier | Warner Instrument Corp. | DP-304 | Hamden, CT |
| Concentric EMG needle electrode | Chalgren Enterprises, Inc. | 231-025-24TP; 25 mm x 0.3 mm/30 G | Gilroy, CA |
| Cotton tipped applicator (tapered) | Puritan Medical Products | REF 25-826 5W | Guilford, ME |
| Data Acquisition System | ADInstruments | PowerLab 8/30 | Colorado Springs, CO |
| DC Temperature Control System - for endoscopy platform | FHC, Inc. | 40-90-8D | Bowdoin, ME |
| Electrophysiology recording software | ADInstruments | LabChart 8 with video capture module | Colorado Springs, CO |
| Endoscope monitor | Karl Storz Endoscopy-America | Storz Tele Pack X monitor | El Segundo, CA |
| Glycopyrrolate | Piramal Critical Care | NDC 66794-204-02; 0.2 mg/mL | Bethlehem, PA |
| Ground electrode | Consolidated Neuro Supply, Inc. | 27 gauge stainless steel, #S43-438 | Loveland, OH |
| Isoflurane induction chamber | Braintree Scientific, Inc. | Gas Anesthetizing Box - Red | Braintree, MA |
| Ketamine hydrochloride | Covetrus North America | NDC 11695-0703-1, 100 mg/mL | Dublin, OH |
| Metal spatula to decouple epiglottis and velum | Fine Science Tools | Item No. 10091-12; | Foster City, CA |
| Micro-brush to remove food/secretions from oral cavity | Safeco Dental Supply | REF 285-0023, 1.5 mm | Buffalo Grove, IL |
| Mouse-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2-07 – 5 x 12.5 cm Heating Pad | Bowdoin, ME |
| Ophthalmic ointment (sterile) | Allergan, Inc. | Refresh Lacri-lube | Irvine, CA |
| Otoscope | Karl Storz | REF 1232AA | El Segundo, CA |
| Pneumogram Sensor | BIOPAC Systems, Inc. | RX110 | Goleta, CA |
| Pulse oximetry - Vetcorder Pro Veterinary Monitor | Sentier HC, LLC | Part No. 710-1750 | Waukesha, WI |
| Rat-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2 – 12.5X25cm Heating Pad | Bowdoin, ME |
| Sterile needles for drug injections | Becton, Dickinson and Company | REF 305110, 26 G x 3/8 inch, PrecisionGlide | Franklin Lakes, NJ |
| Sterile syringes for drug injections | Becton, Dickinson and Company | REF 309628; 1 mL, Luer-Lok tip | Franklin Lakes, NJ |
| Surgical drape to cover induction cage for dark environment | Covidien LP | Argyle Surgical Drape Material, Single Ply | Minneapolis, MN |
| Surgical tape to secure pneumograph sensor to abdomen | 3M Health Care | #1527-0, 1/2 inch | St. Paul, MN |
| Transparent blanket for thermoregulation | The Glad Products Company | Press’n Seal Cling Film | Oakland, CA |
| Video editing software | Pinnacle Systems, Inc. | Pinnacle Studio, v24 | Mountain View, CA |
| Water circulating heating pad - for anesthesia induction/recovery station | Adroit Medical Systems | HTP-1500 Heat Therapy Pump | Loudon, TN |
| Xylazine | Vet One | NDC 13985-701-10; Anased, 100 mg/mL | Boise, ID |
Ссылки
- Brunner, E., Friedrich, G., Kiesler, K., Chibidziura-Priesching, J., Gugatschka, M. Subjective breathing impairment in unilateral vocal fold paralysis. Folia Phoniatr Logop. 63 (3), 142-146 (2011).
- Chandrasekhar, S. S., et al. Clinical practice guideline: improving voice outcomes after thyroid surgery. Otolaryngol Head Neck Surg. 148 (6 Suppl), S1-S37 (2013).
- Fang, T. J., et al. Quality of life measures and predictors for adults with unilateral vocal cord paralysis. Laryngoscope. 118 (10), 1837-1841 (2008).
- Wang, W., et al. Laryngeal reinnervation using ansa cervicalis for thyroid surgery-related unilateral vocal fold paralysis: a long-term outcome analysis of 237 cases. PLoS One. 6 (4), e19128 (2011).
- Cohen, S. M., et al. Association between dysphagia and inpatient outcomes across frailty level among patients >/= 50 years of age. Dysphagia. 35 (5), 787-797 (2020).
- Poulsen, S. H., et al. Signs of dysphagia and associated outcomes regarding mortality, length of hospital stay and readmissions in acute geriatric patients: Observational prospective study. Clin Nutr ESPEN. 45, 412-419 (2021).
- Lin, R. J., Smith, L. J., Munin, M. C., Sridharan, S., Rosen, C. A. Innervation status in chronic vocal fold paralysis and implications for laryngeal reinnervation. Laryngoscope. 128 (7), 1628-1633 (2018).
- Choi, J. S., et al. Functional regeneration of recurrent laryngeal nerve injury during thyroid surgery using an asymmetrically porous nerve guide conduit in an animal model. Thyroid. 24 (1), 52-59 (2014).
- Wang, B., et al. Neurotrophin expression and laryngeal muscle pathophysiology following recurrent laryngeal nerve transection. Mol Med Rep. 13 (2), 1234-1242 (2016).
- Woodson, G., Randolph, G. W. Pathophysiology of recurrent laryngeal nerve injury. Surgery of the Thyroid and Parathyroid Glands (Third Edition). , 404-409.e2 (2021).
- James, M., Palmer, O. Instrumentation and techniques for examination of the ear, nose, throat, and sinus. Oral Maxillofac Surg Clin North Am. 24 (2), 167-174 (2012).
- Patel, R. R., et al. Recommended protocols for instrumental assessment of voice: American Speech-Language-Hearing Association Expert Panel to develop a protocol for instrumental assessment of vocal function. Am J Speech Lang Pathol. 27 (3), 887-905 (2018).
- Kamarunas, E. E., McCullough, G. H., Guidry, T. J., Mennemeier, M., Schluterman, K. Effects of topical nasal anesthetic on fiberoptic endoscopic examination of swallowing with sensory testing (FEESST). Dysphagia. 29 (1), 33-43 (2014).
- Shock, L. A., et al. Improving the utility of laryngeal adductor reflex testing: a translational tale of mice and men. Otolaryngol Head Neck Surg. 153 (1), 94-101 (2015).
- Aviv, J. E., et al. Laryngopharyngeal sensory discrimination testing and the laryngeal adductor reflex. Ann Otol Rhinol Laryngol. 108 (8), 725-730 (1999).
- Farneti, D. The instrumental gold standard: fees. J Gastroenterol Hepatol Res. 3, 1281-1291 (2014).
- Hernandez-Morato, I., et al. Reorganization of laryngeal motoneurons after crush injury in the recurrent laryngeal nerve of the rat. J Anat. 222 (4), 451-461 (2013).
- Hernandez-Morato, I., Sharma, S., Pitman, M. J. Changes in neurotrophic factors of adult rat laryngeal muscles during nerve regeneration. Neuroscience. 333, 44-53 (2016).
- Tessema, B., et al. Evaluation of functional recovery of recurrent laryngeal nerve using transoral laryngeal bipolar electromyography: a rat model. Ann Otol Rhinol Laryngol. 117 (8), 604-608 (2008).
- Tessema, B., et al. Observations of recurrent laryngeal nerve injury and recovery using a rat model. Laryngoscope. 119 (8), 1644-1651 (2009).
- Monaco, G. N., et al. Electrical stimulation and testosterone enhance recovery from recurrent laryngeal nerve crush. Restor Neurol Neurosci. 33 (4), 571-578 (2015).
- Haney, M. M., Hamad, A., Leary, E., Bunyak, F., Lever, T. E. Automated quantification of vocal fold motion in a recurrent laryngeal nerve injury mouse model. Laryngoscope. 129 (7), E247-E254 (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Wang, B., et al. Functional regeneration of the transected recurrent laryngeal nerve using a collagen scaffold loaded with laminin and laminin-binding BDNF and GDNF. Sci Rep. 6, 32292 (2016).
- Hamad, A., Haney, M. M., Lever, T. E., Bunyak, F. Automated segmentation of the vocal folds in laryngeal endoscopy videos using deep convolutional regression networks. , 140-148 (2019).
- Wang, Y. Y., Hamad, A. S., Palaniappan, K., Lever, T. E., Bunyak, F. LARNet-STC: Spatio-temporal orthogonal region selection network for laryngeal closure detection in endoscopy videos. Comput Biol Med. 144, 105339 (2022).
- Lever, T. E., et al. Advancing laryngeal adductor reflex testing beyond sensory threshold detection. Dysphagia. 37 (5), 1151-1171 (2022).
- Wang, Y. Y., Hamad, A. S., Lever, T. E., Bunyak, F. Orthogonal region selection network for laryngeal closure detection in laryngoscopy videos. Annu Int Conf IEEE Eng Med Biol Soc. 2020, 2167-2172 (2020).
- Haney, M. M., et al. Recurrent laryngeal nerve transection in mice results in translational upper airway dysfunction. J Comp Neurol. 528 (4), 574-596 (2020).
- Mok, A., et al. A surgical mouse model for advancing laryngeal nerve regeneration strategies. Dysphagia. 35 (3), 419-437 (2020).
- Haney, M. M., Ericsson, A. C., Lever, T. E. Effects of intraoperative vagal nerve stimulation on the gastrointestinal microbiome in a mouse model of amyotrophic lateral sclerosis. Comp Med. 68 (6), 452-460 (2018).
- Lever, T. E., et al. A mouse model of pharyngeal dysphagia in amyotrophic lateral sclerosis. Dysphagia. 25 (2), 112-126 (2010).
- Struck, M. B., Andrutis, K. A., Ramirez, H. E., Battles, A. H. Effect of a short-term fast on ketamine-xylazine anesthesia in rats. J Am Assoc Lab Anim Sci. 50 (3), 344-348 (2011).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress. Altern Lab Anim. 33 (2), 119-127 (2005).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Welby, L., Maynard, T., Zohn, I., Lever, T. Fluoroscopic and endoscopic investigation of dysphagia in a mouse model of DiGeorge syndrome. Dysphagia. 34, 1003-1004 (2019).
- Mueller, M., et al. Impact of limb phenotype on tongue denervation atrophy, dysphagia penetrance, and survival time in a mouse model of ALS. Dysphagia. 37 (6), 1777-1795 (2022).
- Osman, K. L., et al. Optimizing the translational value of mouse models of ALS for dysphagia therapeutic discovery. Dysphagia. 35 (2), 343-359 (2020).
- Lever, T. E., et al. Videofluoroscopic validation of a translational murine model of presbyphagia. Dysphagia. 30, 328-342 (2015).
- Lever, T. E., et al. Adapting human videofluoroscopic swallow study methods to detect and characterize dysphagia in murine disease models. J Vis Exp. (97), 52319 (2015).
- Ballenger, B., et al. Targeted electrical stimulation of the superior laryngeal nerve - a potential treatment for dysphagia in ALS. FASEB J. 36 (S1), (2022).
- Kloepper, A., et al. An experimental swallow evoked potential protocol to investigate the neural substrates of swallowing. OTO Open. 4 (1), (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены