Method Article
呼吸および嚥下中の喉頭運動のクローズアップイメージングのための低侵襲マウス喉頭鏡検査
要約
このプロトコルは、マウスおよびラットの連続経口喉頭鏡検査アプローチについて説明しており、最適化された麻酔レジメンと微調整された内視鏡操作技術を使用して、呼吸および嚥下中の喉頭のクローズアップ、遮るもののないビデオイメージングを可能にします。
要約
喉頭は、呼吸、嚥下、発声の3つの主要な機能を持つ哺乳類の必須臓器です。喉頭機能を損なうさまざまな障害が知られており、呼吸困難(呼吸困難)、嚥下障害(嚥下障害)、および/または音声障害(発声障害)を引き起こします。特に嚥下障害は、誤嚥性肺炎およびそれに伴う罹患率、再発性入院、早期死亡につながる可能性があります。これらの深刻な結果にもかかわらず、喉頭機能障害に対する既存の治療法は、残念ながら通常は正常な喉頭機能を回復させない外科的および行動的介入を主に目的としているため、革新的な解決策が緊急に必要であることが浮き彫りになっています。
このギャップを埋めるために、マウス(マウスおよびラット)モデルにおける喉頭機能障害を調査するための実験的内視鏡的アプローチを開発しています。しかし、げっ歯類の内視鏡検査は、現在の内視鏡技術に比べてサイズが小さいこと、上気道の解剖学的違い、および喉頭に最適にアクセスするための麻酔の必要性のために、非常に困難です。ここでは、マウスとラットの喉頭運動のクローズアップで遮るもののないビデオイメージングを可能にする新しい経口喉頭鏡検査アプローチについて説明します。プロトコルの重要なステップには、正確な麻酔管理(嚥下を廃止する過剰摂取や呼吸困難関連の死亡リスクを防ぐため)と内視鏡のマイクロマニピュレーター制御(その後の定量化のために1人の研究者による喉頭運動の安定したビデオ記録)が含まれます。
重要なことに、このプロトコルは、特に喉頭機能に対するさまざまな病理学的状態の影響を研究するために、同じ動物で経時的に実施できます。このプロトコルの新たな利点は、嚥下中の気道保護を視覚化する能力ですが、これは喉頭入口の喉頭蓋の逆転により声門が視界から閉まるため、人間では不可能です。したがって、げっ歯類は、正常な喉頭機能を効果的に回復するための治療法を発見するという究極の目的のために、正常な喉頭気道保護と病的な喉頭気道保護のメカニズムを具体的に調査するユニークな機会を提供します。
概要
喉頭は、喉の気道と消化管の交点に位置する軟骨器官であり、呼吸や発声中(呼吸中)と食物や液体(嚥下中)に対する空気の流れと方向を正確に制御する弁膜機構として機能しています。先天性(例:.、喉頭軟化症、声門下狭窄症)、腫瘍性(例:.、喉頭乳頭腫症、扁平上皮癌)、神経学的(例:.、特発性喉頭麻痺、脳卒中、パーキンソン病、筋萎縮性側索硬化症)、医原性(例:.、頭頸部手術中の不注意による損傷)。.病因に関係なく、喉頭機能障害は通常、呼吸困難(呼吸困難)、発声障害(音声障害)、および嚥下障害(嚥下障害)の症状の三重になり、人の経済的および社会的福祉に悪影響を及ぼします1,2,3,4。
さらに、特に医学的に脆弱な個人の嚥下障害は、誤嚥性肺炎(食物や液体が不完全に閉じた喉頭から肺に漏れることによる)とそれに関連する罹患率、再発性入院、および早期死亡につながる可能性があります5,6。これらの深刻な結果にもかかわらず、喉頭機能障害に対する既存の治療法は、主に正常な喉頭機能を回復させない外科的および行動的介入を対象としており、1,2,7,8,9,10 したがって、革新的な解決策の緊急の必要性が浮き彫りになっています。この目標に向けて、マウス(マウスやラット)モデルにおける喉頭機能障害の実験的内視鏡的アプローチを開発しています。
人間の医学では、喉頭機能障害の評価のゴールドスタンダードは、喉頭鏡検査11,12と呼ばれる内視鏡的視覚化です。通常、軟性内視鏡を鼻に通して、喉頭、特に声帯、および隣接する声門上および声門下喉頭の構造を検査します。硬性内視鏡を使用して、口腔を介して喉頭を視覚化することもできます。どちらのアプローチも、喉頭の解剖学的構造の肉眼的検査を可能にし、呼吸、発声、および咳や喉頭内転筋反射などのさまざまな気道保護反射中の喉頭の可動性と機能を評価するために使用できます13、14、15、16。ただし、嚥下中、喉頭は喉頭蓋によって完全に隠され、喉頭蓋が反転して喉頭の入り口を覆い、飲み込まれる食物/液体ボーラスの経路から喉頭を保護します。その結果、嚥下中の喉頭運動を直接視覚化することはヒトでは不可能であり、したがって、他の診断アプローチ (透視法、筋電図法、声門法など) を使用して間接的に推測する必要があります。
この論文では、マウスとラットの革新的な喉頭鏡検査プロトコルについて説明し、光麻酔下での嚥下での呼吸と気道保護のクローズアップ、遮るもののないイメージングを可能にします。このプロトコルは、さまざまな市販の内視鏡システムと互換性があり、カスタムプラットフォームと組み合わせて、処置中に麻酔をかけたげっ歯類を固定します。重要なことは、内視鏡検査プラットフォームの多数の設計/構成が、各ラボの利用可能なリソースと研究課題に応じて、実際に可能であるということです。ここでの私たちの意図は、研究者が研究の文脈で考えるためのガイダンスを提供することです。さらに、この喉頭鏡検査プロトコルが、喉頭の機能障害と再生の理解に新たな洞察をもたらす可能性のある豊富な客観的データにどのようにつながるかを示すことを目指しています。
このマウス喉頭鏡検査プロトコルで概説されているすべてのステップの複合効果により、成体マウス喉頭の低侵襲検査が可能となり、同じ動物で繰り返すことができ、医原性損傷、疾患の進行、および/または気道保護に対する治療介入に応答して、時間の経過とともに喉頭機能障害を検出し、特徴付けることができます。注目すべきは、このプロトコルは発声関連の喉頭機能を評価しないことです。
プロトコル
マウス喉頭鏡検査のプロトコルは、承認された動物管理委員会(IACUC)のプロトコルと国立衛生研究所(NIH)のガイドラインに従っています。これは、100匹以上の成体C57BL/6Jマウスと50匹以上の成体Sprague Dawleyラット、ほぼ等しい性別、両方の種で6週間から12ヶ月齢で使用するために開発されました。より若い/より小さなげっ歯類への適応のためには、追加のプロトコル開発が必要です。動物はグループで飼育されました(性別と同腹仔に基づいて、ケージあたり最大4匹のマウスまたは2匹のラット)。標準的なビバリウム条件には、周囲温度(20-26°C)、湿度(30%-70%)、および標準的な12時間の光サイクルを厳密に制御する静的ケージが含まれていました。すべての動物は、毎週のケージ交換時に新鮮な濃縮材料(小屋/パイプ、歯科用治療薬、雛など)を受け取りました。以下に説明するように、麻酔前の短い(最大4〜6時間)食事制限中を除いて、食物と水への無制限のアクセスが提供されました。獣医と研究スタッフは毎日動物を監視しました。
1.嚥下を廃止しない動物麻酔
- げっ歯類と作業する際のアレルゲン曝露を最小限に抑えるために、適切な個人用保護具(手袋、マスクなど)を着用してください。
- 麻酔の4〜6時間前に各げっ歯類のケージを食物制限して、口腔や咽頭での食物の保持を最小限に抑えます。これは、内視鏡の視覚化を妨げたり、手順中に食物を誤嚥する可能性があります。
注:口腔内での食物貯留は、食物制限を受けていない場合、嚥下障害のないげっ歯類の正常な所見です。 - 動物の誘導/回復のための「ウォーミングステーション」を準備します。
- ベンチトップの表面で水循環加熱パッドを37°Cに予温します。
- 試験対象動物種に適したサイズのインダクション/リカバリーケージをお選びください。例えば、フィルター上蓋付きのマウスシューボックスケージは、マウスやラットの誘導/回復に適したサイズになっています。テストする各動物に新しい誘導/回復ケージを使用してください。同じ動物の誘導ケージと回復ケージの両方として、単一のケージを使用します。
- 麻酔導入および回復中の体分泌物の暖かさと吸収のために、吸気性材料(アスペンの削りくず、ペーパータオル、子犬パッドなど)の薄い層で誘導/回復ケージの床を裏打ちします。
- 準備したケージ(フィルターの上蓋付き)を、麻酔導入の30〜60分前に加熱パッドに完全に置きます。
注:この微小環境は、導入および回復中に安定した麻酔代謝を促進するのに十分な補助熱を提供します。
- 麻酔導入の前に、予熱した37°Cの加熱パッドに動物のホームケージを半分ほど置き、約30分間待ちます。
注:手順の前に補助的な熱を提供することで、麻酔導入を早め、低体温症による麻酔代謝の遅延/遅延による偶発的な過剰摂取を防ぐことができます。. - ケタミン-キシラジン(KX)麻酔薬を種類と体重に基づいて準備します。
- マウスの場合:90 mg / kgケタミンと11 mg / kgキシラジンの混合物は、性別を問わず、成人のC 57BL / 6バックグラウンドマウスの経口喉頭鏡検査に十分です。.他のマウス株と年齢に合わせて用量を調整します。.
- ラットの場合:60 mg / kgケタミンと6 mg / kgキシラジンの混合物は、どちらの性別の成体Sprague Dawleyラットの経口喉頭鏡検査にも十分です。.他のラット株と年齢に合わせて用量を調整します。.
- 37°Cの加温ステーションで注射器で満たされた麻酔薬を予温し、冷たい液体を注入するときに発生する動物の熱損失を防ぎます。
- 適切なサイズの注射器(例:.、1 mL)と針(例:.、26 G1/2)を使用して、計算されたKX用量をげっ歯類に注射します。.
- マウスの場合:皮下(SC)注射を1回行います。
注: 私たちの経験では、マウスの SC 注射は、腹腔内 (IP) 注射と比較して、麻酔関連の死亡率を減少/廃止します。 - ラットの場合:SCまたはIP注射を1回投与します。必要に応じて、KX注射の直前に導入チャンバー内でイソフルラン(ISO)(3-5%)でラットを鎮静します。.
注意: 自発的な体の動きは、KXが有効になるまでの短時間(通常は<1分)再開される場合があります。
- マウスの場合:皮下(SC)注射を1回行います。
- KX注射の直後にグリコピロレート(抗コリン薬)を投与して、経口内視鏡検査中に喉頭の視覚化を妨げたり、麻酔回復中に上気道を機械的に閉塞したりする可能性のある過剰な唾液分泌を減らします。.
注:投与量と送達経路はマウスとラット(0.01-0.02 mg / kg SC)で同じであり、効果はほぼ即時的で数時間持続します。 - グリコピロレート注射後、麻酔したげっ歯類を温暖化ステーションの予熱された誘導ケージに入れ、ケージを外科用ドレープで覆って、視覚刺激を10分間邪魔されずに最小限にする暗い環境を提供します。
- げっ歯類が最初のKX投与から10分後に歩行可能なままの場合は、手順を終了します。.
注:追加の麻酔(KXまたはケタミンの維持)を提供する試みは、おそらく無駄になります。.
- げっ歯類が最初のKX投与から10分後に歩行可能なままの場合は、手順を終了します。.
- 10分後、ケタミンの維持用量(後肢反射が減少した場合は初期用量の1/4、後肢反射が活発な場合は初期用量の1/2)を投与します。マウスの場合はSC、ラットの場合はSC / IP)を使用して麻酔を維持します。
- 喉頭鏡検査中の角膜の乾燥と関連する外傷を防ぐために、両目に眼科用軟膏を塗布します。.
- 麻酔をかけたげっ歯類をカスタム内視鏡プラットフォームに移して、喉頭鏡検査の手順を開始します。
注:内視鏡検査プラットフォーム(図1)は、必ずしも内視鏡検査を必要としないさまざまなげっ歯類の外科的および電気生理学的アプローチで使用するための複数の機能を持つように設計されています。そのため、純粋に内視鏡的に使用するために過剰に作られています。関連する場合は、この喉頭鏡検査プロトコルに不可欠な機能/コンポーネントを強調します。 - この時点から、手順全体を通じて15〜20分ごとに後肢反射をチェックし、必要に応じて少なくとも20分の間隔を空けて追加のケタミン維持用量を提供します。これは比較的短い手順(通常、麻酔下で<45分)であるため、最初の維持投与後に追加のケタミンが必要になることはめったにありません。
2.喉頭を視覚化するための内視鏡の経経口通路
- 動物に麻酔をかける前に、ビデオ録画機能を備えた適切なサイズの内視鏡を準備してください。
注:私たちは日常的に、このプロトコル全体で使用される代表的な内視鏡であるカスタム金属シース(図2)を備えた、シャフト径1.9 mm、シャフト長10 cmのゼロ度耳鏡を使用しています。- 内視鏡を光源と内視鏡記録システムに接続して、最低 30フレーム/秒 (fps)でのリアルタイム表示とビデオ録画を実現します。
- カメラに焦点を合わせ、ホワイトバランスを取り、最適な画質を実現します。
- 内視鏡をマイクロマニピュレーターに取り付けます。
注:喉頭の動き追跡の場合、内視鏡を内視鏡プラットフォーム上のマイクロマニピュレーターに固定して、安定したビデオキャプチャのための正確な内視鏡制御を可能にします。
- げっ歯類を加熱されたプラットフォーム上で背側に横たわらせて固定します。頭をイヤーバーで固定して安定させ、固定します。
- げっ歯類の頭が耳のバー内で滑り落ちることなく自由に上下に回転できることを確認します(ただし、左右には回転しません)。この自由度により、内視鏡の経口挿入と喉頭への前進が容易になります。
- 内視鏡検査中に呼吸、嚥下、および嚥下-呼吸協調の同期電気生理学的記録が必要な場合は、この目的に適したセンサーの適用を進めてください(図3)。
- サージカルテープを使用して、正中線で腹部に固定し、すぐにキシポイド突起の尾側に呼吸センサーを固定します。
- 感染を防ぐために、針電極を挿入する前にアルコールワイプで皮膚を剃り、洗浄/消毒してください。
- 22Gの針を使用して、針電極を挿入する前に皮膚に小さな開口部を開け、筋電図(EMG)針の損傷を防ぎます。
- 滅菌同心筋電図針電極(例:25 mm x 0.3 mm / 30 G)を正中線のオトガイ下皮膚から舌根(例:針挿入深さに応じて、ゲニオグロッサスまたはジェニオ舌骨筋)に挿入します。
- 接地電極(27 Gステンレス鋼など)を股関節(両側)に皮下に挿入します。
- 呼吸センサーとEMG針電極を電気生理学記録システム(バイオアンプや同期ビデオキャプチャー付きデータ収集システムなど)に接続し、両方のチャンネルでクリーンな電気生理学的信号を確認してから作業を進めます。
- 電極接続部位をアルミホイルで包んで電気ノイズからシールドし、対応する電気生理学的記録の信号対雑音比を改善します。
- 必要に応じて呼吸センサーの位置とEMG針電極の深さを調整し、両方のチャネルでクリーンな電気生理学的信号を取得します。このプロトコルに従うには、呼吸には1kのサンプリングレートを使用し、EMGには20kのサンプリングレートとバンドパスフィルター(150〜3,000Hzなど)を使用します。
- げっ歯類の胴体(および呼吸センサー)を透明な毛布で覆い、体温調節を容易にすると同時に、呼吸中の腹部の動きを視覚化できるようにします。後肢と下腹部を自由に露出させて、反射チェックやケタミン維持の再投与中にアクセスできるようにします。ブランケットが呼吸中の腹部の動きを制限しないようにしてください。
- 経口内視鏡検査に進みます(図4)。
- 顎に垂直な中央切歯の後ろに先細りの綿先端のアプリケーターを挿入して、げっ歯類の口を開きます。舌の背側表面で綿棒を回転させて、口から少し突き出します。
- 軽い指のグリップを使用して、内視鏡の先端を口腔に挿入しながら、舌を口から少し引き出して中央切歯の片側にそっと引きます(図4A、B)。
- 内視鏡の先端を口に挿入した後、げっ歯類の目を傷つけないように光源をオンにします。
- 内視鏡を、引っ込めた舌と同じ側の切歯の外側に挿入します。中央切歯は内視鏡が正中線に挿入されるのを防ぐため、この横方向の挿入アプローチが必要になります。
- 内視鏡検査(および電気生理学)記録システムを起動します。事後分析に十分なデータを確保するために、手順全体を通じて継続的に記録するか、研究のニーズに応じて選択した時間に記録します。
- 内視鏡を慎重に進めて中咽頭を視覚化し、硬口蓋をこすったり、怪我の原因となる可能性のある舌に過度の圧力を加えたりしないように注意します。
- 適切なサイズの綿棒(例:.、1.5 mmマイクロブラシ)を使用して、目に見える食物粒子や過剰な唾液分泌物を取り除き、手順が進むにつれて誤嚥のリスクを最小限に抑えます。.
- 下咽頭がモニターの視野の中央に配置され、主要な解剖学的構造が識別できるようになるまで、内視鏡の位置を前進/調整し続けます(図4C)。この時点で、すべての構造はカメラの視野内で解剖学的に整列/対称に見えるはずです。それ以外の場合は、必要に応じて内視鏡の位置を変更します。
- 内視鏡の進行中に誘発される顎/舌の動きに注意してください。存在しない場合は、それ以上のケタミンの再溶解を行わずに続行します。.存在する場合は、2回目のケタミン維持用量(ケタミンの初期用量の1/4〜1/2)を投与し、効果が出るまで約5分待ってから続行します。.過剰鎮静と ?? 嚥の廃止を避けるために、前回の注射から少なくとも20分が経過した場合にのみ再投与。.
- 手順全体を通して5分ごとにげっ歯類の舌を調べ、虚血の兆候である黒ずんだ変色がないか調べます。これを回避するには、必要に応じて内視鏡の位置を変更します。
- 内視鏡の横に挿入されたマイクロプローブ(金属ヘラなど)を使用して口蓋に軽い圧力をかけ、軟口蓋と喉頭蓋を切り離して喉頭を遠くから視覚化します(図4D)。圧力が加えられると、軟部組織の損傷や内視鏡シャフトの永久的な曲げ/損傷を引き起こす可能性があるため、デカップリングに内視鏡の先端を使用することは避けてください。
注:人間とは異なり、マウスの喉頭は経口的観点から直接見えません。それどころか、喉頭蓋は口蓋を覆う粘膜の下に機械的に閉じ込められ、その結果、袋小路の下咽頭腔が形成されます。口蓋に軽い圧力を加えると、喉頭蓋が口蓋膜から解放され、喉頭が部分的に見えるようになります。 - 口蓋/喉頭蓋のデカップリング中に誘発された嚥下を観察します。
- ツバメは、硬口蓋に向かって突然、短い後舌の変位として識別します。この動きは通常、短い下顎の動き/陥凹と同期して発生するため、内視鏡の視野で後部舌が容易に見えない場合に嚥下を識別するための代用を提供します。
- また、舌筋電図の破裂活動と電気生理学記録の短い無呼吸エピソードを組み合わせて嚥下を特定します。これらはどちらも、内視鏡ビデオの声門閉鎖イベントと同期して発生します。
- 麻酔が不十分であることを示す急速な反復嚥下の場合 (つまり、 軽すぎる)、再投与して 5 ~ 10 分待ってから進行します。前回のケタミン維持注射後、過剰鎮静や嚥下禁止を避けるために、少なくとも20分待ってください。.
- 口蓋-喉頭蓋デカップリング中に数個のツバメのみが誘発される場合、麻酔の深さが最適であると考えてください。.
- 嚥下が廃止された場合、麻酔が深すぎて喉頭気道保護を評価できません。この場合、ケタミン代謝を5〜10分待ってから、喉頭のクローズアップ視覚化に進みます。
3.呼吸中の喉頭運動のクローズアップ、遮るもののないビデオ録画、および誘発された嚥下
注:呼吸、嚥下、および嚥下-呼吸の調整の同期電気生理学的記録もオプションです。
- 喉頭を視野の中央に保ちながら、口蓋と喉頭蓋の間で内視鏡をゆっくりと進めます view(図5A-C)。
注:内視鏡の先端は、力を入れなくても口蓋喉頭蓋の開口部を容易に通過します。それ以外の場合は、動物への潜在的な危害を避けるために手順を中止してください。喉頭を遠くから視覚化することが可能です、内視鏡の先端を下咽頭に。ただし、このアプローチでは通常、喉頭の視覚化を強化するために、喉頭蓋、口蓋、および/または舌を手動で収縮させる必要があります。ただし、喉頭の一部は通常、視界から隠されたままであり、収縮装置は喉頭の動きを制限する可能性があり、これは機能障害と間違われる可能性があります。 - 内視鏡を前進させ続けて、喉頭の腹側-背側と横方向の寸法全体を遮るもののないクローズアップを取得します view単一の視野(図(図5C)。
注:腹側交連は、特に若い/小さいマウスでは、喉頭蓋によって塞がれる可能性があります。.このような場合、内視鏡の先端をより積極的に操作して腹側交連を視覚化しようとすると、喉頭の動きが制限され、機能障害と間違われる可能性があります。また、喉頭の空気の流れを遮断し、窒息を引き起こす可能性があります。 - 各呼吸サイクル中にげっ歯類が息を吸い込む(声門が広がる)と吐く(声門が狭くなる)ときの喉頭の振動運動を観察します。
注:喉頭/声門の動きの速度と大きさは、麻酔薬の深さによって異なる場合があります。ただし、声門のギャップ(つまり、左右の橈骨と声帯の間の空隙)は、通常、健康なげっ歯類の呼吸サイクルを通じて見えるままです。- 顕著な声門の狭窄が認められた場合は、内視鏡の位置を調整して、上気道を通る空気の流れが妨げられないようにします。たとえば、鼻腔に圧力をかけると、鼻気道の軟部組織が閉塞する可能性があります。また、内視鏡の先端を声門腔に挿入しないでください。これにより、喉頭の空気の流れが妨げられ、窒息につながる可能性があります。まれに呼吸が止まる場合は、内視鏡を取り外した後、胸骨中央部の胸骨圧迫(1本の指を使用)または陽圧換気(小型の「蘇生バッグ」を使用)を数回行います。
- 事後評価の目的で、喉頭の呼吸運動を 30 秒から 60 秒間ビデオ記録します。
- 喉頭をクローズアップしたまま、喉頭入口内の内視鏡の先端をわずかに調整して、口蓋および/または喉頭蓋を覆う粘膜に機械的刺激を加え、最適に麻酔をかけたげっ歯類の嚥下を呼び起こします。
- 内視鏡の先端をマイクロレベルで調整(つまり、任意の方向に~1 mm)して、粘膜の損傷や気道閉塞を防ぎます。
- 誘発された嚥下は、目に見える顎の陥凹、舌のEMG破裂活動、および呼吸器痕跡に見える短い(<1/2秒)無呼吸と同期して発生する突然の声門閉鎖イベントとして容易に識別できます。
注:顎の動きが同時に発生しない声門閉鎖イベントが発生する可能性があります。ただし、これらの場合、声門閉鎖は通常不完全です。これらは、麻酔が切れ始めているときに現れる他の気道保護反射(例:喉頭内転筋反射)である可能性があると思われます。ただし、これらはまれな/一貫性のない出来事であり、さらなる調査が必要です。 - 5〜10匹のツバメが誘発され、動物ごとにビデオが記録されるまで繰り返します。嚥下がなくなった場合は、内視鏡を取り外し、ケタミン代謝が起こるまで5〜10分待ってから進行します。.
- 内視鏡を中咽頭に慎重に引っ込めますが、取り外さないでください、そして下咽頭を視野の中央に置き、喉頭蓋と静脈を視覚化します。
- 鼻呼吸を再開するために、マイクロスワブを使用して舌根に軽い圧力をかけ、口蓋膜の下の喉頭蓋の嚥下と再閉じ込めを呼び起こすことにより、鼻蓋と喉頭蓋を再び結合します。数回の試行でリカップリングが起こらない場合は、喉頭の損傷のリスクを避けるために、リカップリングせずに麻酔回復を進めてください。
- 内視鏡検査(および電気生理学)の記録を停止します。
- 生理食塩水に浸した綿棒を使用して、舌と中切歯を湿らせ、舌を口腔内の解剖学的位置に戻します。
- イヤーバーを取り外し、温度プローブ、呼吸センサー、EMG電極をげっ歯類から取り外して、麻酔回復を進めます。
4.麻酔の回復
- 麻酔から回復するために、「加温ステーション」の予熱した回復ケージ(つまり、誘導ケージと同じ)に動物を置きます。
- 乾燥を防ぐために、アイローションを再度塗布してください。
- 水分補給のために温めた生理食塩水SCを投与します:ラットの場合は最大5 mL、マウスの場合は最大0.5 mL。
- キシラジンの逆転と呼吸ドライブの増加のためにアチパメゾールSCを投与します:ラットとマウスの場合は1〜2 mg / kg。
- 2 mg / kgのアチパメゾールから始め、直後にげっ歯類の背中と胃に沿って手動刺激を行い、回復を促進します。.
注:このアプローチを使用すると、通常、自発的な頭の動きは1〜3分以内に始まります。ただし、歩行状態に戻るには、個人差があるため、KX麻酔下での喉頭鏡検査後、通常平均2時間(1時間から5時間の範囲)かかります。 - 自発的な体の動きが麻酔回復の最初の15〜30分以内に増加するのではなく減少している場合は、1 mg / kg(最初の注射の少なくとも15分後)で投与された追加のアチパメゾールを提供します。
- 自発的な活動が減少し続ける場合は、ドキサプラム(ラットおよびマウスの場合は5 mg / kg IP)の投与を続行します。.この「緊急救助」剤を10〜15分間隔(最大5回投与)で自発的な動きが現れるまで再投与します。.げっ歯類が瀕死の状態にある場合は、承認された安楽死方法(例:ケタミンの過剰摂取とそれに続く斬首などの二次的方法)を使用して動物を安楽死させます。
- 2 mg / kgのアチパメゾールから始め、直後にげっ歯類の背中と胃に沿って手動刺激を行い、回復を促進します。.
- 回復するげっ歯類を15〜20分間隔で注意深く監視して、呼吸状態、可動性、体温調節の有害な変化を検出し、必要に応じて介入を提供します(例:.、手動刺激、酸素補給、サーマルブランケット、アチパメゾール、またはドキサプラム注射)。介入が必要なげっ歯類に対して、より頻繁なモニタリングを提供します。
- KX麻酔の回復時間が長引くげっ歯類には、必要に応じて10分間隔で酸素補給(例:ISOなしで、温めた誘導チャンバーで1〜2 L / min)を提供します。あるいは、動物の背側と腹側の表面に沿って頻繁に刺激を加えて、SpO2 レベル(>94%)を正常化します。
- 回復するケージの仲間を同じ回復ケージ(ケージごとに最大2匹のげっ歯類)に配置すると、自発的な活動の増加と回復の迅速化が促進されます。
- げっ歯類を温めたホームケージに戻します。リカバリーケージ内を自発的に移動できるようになったら、ケージを温めます。
- 標準のフードとウォーターボトルをホームケージに戻します。窒息/誤嚥のリスクを最小限に抑えるために、麻酔がまだ切れている間は、食べ物や水へのアクセスに特別な配慮を提供しないでください。
- ホームケージの活動を観察し、歩行を妨げる障害物(小屋、PVCパイプなど)を取り除きます。
- ホームケージを半分オンにし、ウォーミングステーションを半分オフにして、次の12〜16時間(つまり、一晩)配置します。
注意: サプリメントの熱を早期に中止すると、低体温症により死亡する可能性があります。
- 翌朝、標準的なヘルスチェックを実行します。正常/ベースライン活動、身体機能(例:.、体温調節、食事、飲酒、排尿、排便)、および安定した体重(すなわち、維持または増加)の再開で動物を標準的なビバリウム状態に戻します。げっ歯類が活動、身体機能、または体重が低下したというまれなケースでは、別の日のために補助的な熱を続けます。
注:ラットの場合、麻酔回復期間の3~6時間後にポルフィリン染色が突然両眼の周りに現れるのが一般的です。染色は通常24時間以内に溶解します。
5. 呼吸時と嚥下時の喉頭運動の客観的な定量化
- フレームごとの分析機能を備えたビデオ編集ソフトウェアを使用して、内視鏡検査ビデオを表示します。
- 動物ごとに自発呼吸の代表的な10〜20秒のエピソードを少なくとも1つ特定します。
- 動物ごとに3〜5の代表的なツバメイベントを特定します。
- 選択した呼吸および嚥下エピソード/イベントが次の分析基準を満たしていることを確認します:喉頭がカメラの視野の中央にあり、すべての喉頭構造/境界が見える(つまり、静脈、喉頭蓋、または過剰な唾液分泌物によって隠されていない)、十分な照明(つまり、すべての喉頭構造/境界を見ることができる)、およびカメラモーションアーティファクトがない(つまり、内視鏡が動いていない)。
- 特定された呼吸および嚥下エピソード/イベントを、主観的および/または客観的なアプローチを使用して分析します。
- 主観的な分析の場合:リッカートスケールを使用して、ビデオ編集ソフトウェアを使用して、リアルタイムおよびフレームごとの視聴中に喉頭の動きを主観的にスコアリングします。このプロトコルに従うには、-2 から +2 の範囲の拡張リッカート スケールを使用します。負の値は、予想とは反対方向の喉頭運動を示します。嚥下中の喉頭気道保護を推定し、0 = 声門間隙サイズの縮小なし (つまり、喉頭気道保護なし)、1 = 声門間隙の縮小 (つまり、不完全な気道保護)、2 = 披裂骨の完全な内転、声帯間の腹側声門隙間が小さい (つまり、完全な気道保護)、負の値は逆説的な喉頭運動を示します。
注:げっ歯類の研究では、0から2の範囲のリッカートスケールが一般的に使用され、0 =動きなし、1 =何らかの動き、2 =通常の動き17,18,19,20,21,22です。しかし、この尺度では、反回神経(RLN)損傷10の後にしばしば起こる逆説的な喉頭運動は考慮されていない。 - 客観的な分析のために: 4 つの主要なビデオ フレームを特定します - 1) 喉頭内転の開始直前の静止フレーム (つまり、声帯付属部の前のフレーム)、2) 声帯が内転を完了したフレーム、3) 声帯の外転の直前のフレーム (これは #2 と重複する可能性があります)、および 4) 声帯が完全に外転し、呼吸を再開するために休息位置に戻されたフレーム。これら 4 つのキー フレームのタイム スタンプを使用して、声帯内転 (フレーム 1 からフレーム 2)、声門閉鎖 (フレーム 2 からフレーム 3)、声帯外転 (フレーム 3 からフレーム 4)、および総嚥下時間 (フレーム 1 からフレーム 4) の持続時間を計算します。あるいは、静止フレーム画像17、18、24を使用して、最大外転および最大内転中の声門角(すなわち、披裂体背側または声帯襞腹側)を測定するために、他の既存の商用ソフトウェア23を使用する。少なくとも 2 人の訓練を受けたレビュアーに、このプロセスを盲検化して独立して実行してもらい、レビュアー間の不一致を特定し、各不一致について共同のコンセンサスに達します。
注:私たちは以前に、げっ歯類とヒトの商用ビデオ編集ソフトウェアを使用して、声門閉鎖タイミングイベント(すなわち、気道保護反射中)のこの手動フレームごとのフレーム分析を実行しました14。ただし、このアプローチは非効率的であり、喉頭運動ダイナミクスの定量化は限られています。現在、社内で構築された喉頭追跡ソフトウェアを使用して、呼吸中の喉頭運動と気道保護反射 22,25,26,27,28,29,30 のより広範な客観的定量化を行っています。このソフトウェアは、左側と右側の喉頭運動距離(振幅)とタイミング(周波数)を客観的に定量化するための自動フレームバイフレームトラッキング機能を備えています。これらのパラメータを使用して、呼吸、嚥下、およびその他の気道保護反射(喉頭内転筋反射など)中の喉頭機能障害(声門角の最大/最小/範囲、喉頭運動対称性、同期性など)を検出/定量化するためのさまざまな運動ベースの測定値を導き出します。このソフトウェアはまだ改良中であり、まだ商用/公開されていません。
- 主観的な分析の場合:リッカートスケールを使用して、ビデオ編集ソフトウェアを使用して、リアルタイムおよびフレームごとの視聴中に喉頭の動きを主観的にスコアリングします。このプロトコルに従うには、-2 から +2 の範囲の拡張リッカート スケールを使用します。負の値は、予想とは反対方向の喉頭運動を示します。嚥下中の喉頭気道保護を推定し、0 = 声門間隙サイズの縮小なし (つまり、喉頭気道保護なし)、1 = 声門間隙の縮小 (つまり、不完全な気道保護)、2 = 披裂骨の完全な内転、声帯間の腹側声門隙間が小さい (つまり、完全な気道保護)、負の値は逆説的な喉頭運動を示します。
結果
このマウス喉頭鏡検査プロトコルをうまく使用すると、図6に示すように、健康および疾患条件下での自発呼吸および誘発された嚥下時の喉頭のクローズアップ視覚化が得られます。さらに、このプロトコルを同じげっ歯類で複数回繰り返すことで、喉頭の機能/機能障害を経時的に調査することができます。図7に示すように、この喉頭鏡検査プロトコルを4か月にわたって6回繰り返すことに成功し、RLN損傷のラット手術モデルにおける自発的な回復パターンを調査しました(データはまだ公開されていません)。KXの代わりにISO麻酔を使用する試みは、以前の実験31,32で説明したように、嚥下を誘発するために右上喉頭神経の直接電気刺激を受けたげっ歯類の嚥下がほぼ廃止されました(図8)。これは、ISOが2%と低い場合に発生しました。ISOをこのレベル以下に下げると、自発的な動きが戻ったため、回避されました。ISOのこの交絡効果は、このプロトコルを成功裏に使用するための麻酔選択の重要性を強調しています。
内視鏡の画質が良好な場合、 図9に示すように、呼吸と嚥下に関する代表的なビデオクリップをモーショントラッキングソフトウェアを使用して分析できます。当社のカスタム喉頭追跡ソフトウェアによって自動的に生成される代表的なアウトカム指標を 表 1 に示します。いくつかの呼吸および嚥下関連のアウトカム指標は、同じ代表的なラットのベースラインとRLN切断後とで著しく異なっていたことに注意してください。.呼吸中の声門角はベースラインとRLN離断後で類似していたが、呼吸中の右/左喉頭運動振幅(すなわち、平均運動範囲比またはMMRR)と頻度(開閉サイクル比またはOCCR)の比率は、切断後に低かった。同様に、嚥下期間はRLN切断後に短くなりました。
同期電気生理学的記録 (呼吸器肺計や genioglossus EMG など) が取得された場合、喉頭鏡検査データとの相関について、いくつかの追加の客観的結果測定値を定量化できます。私たちの研究が関心を持つ電気生理学に基づくアウトカム指標の例を 図10にまとめます。現在、これらのアウトカム指標を自動的に定量化するためのアルゴリズムを開発しています。

図1:マウス内視鏡プラットフォーム カスタムマウス内視鏡プラットフォームの(A)側面図と(B)上面図が示され、必須コンポーネントがラベル付けされています。加熱パッドの下の卓上はサイズ調節可能であることに注意してください。ここに示されているのは、ラットで使用される卓上と加熱パッドのサイズであり、これらは簡単に取り外すと、小さな加熱パッド(図には示されていません)を収容するマウスサイズの卓上が露出します。カスタムアダプターは、プラットフォームベースに取り付けられたマイクロマニピュレーターに内視鏡を固定します。この戦略的な設計により、内視鏡検査中にプラットフォーム全体をユニットとして移動させることができ、不注意/制御不能な内視鏡の動きによる動物の損傷のリスクはありません。マイクロマニピュレータは、内視鏡の先端をx(左/右)、y(前方/後方)、z(上/下)、y(ピッチ)とz(ヨー)を中心とした回転など、複数の方向に全体的および微小に調整することができます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:マウス喉頭鏡検査用の耳鏡とカスタムシース(A)市販の耳鏡の分解されたコンポーネントと、マウス喉頭鏡検査用のアダプター付きカスタムステンレス鋼シース。(B)組み立てると、耳鏡の先端は金属シースから1mm伸びますが、必要に応じて最大5mmまで調整できます。この戦略的な設計により、狭い耳鏡の先端をげっ歯類の喉頭入口に進めることができ、わずかに大きめの直径(2.4mm)の金属シースが口蓋と喉頭蓋を十分に開いたままにし、呼吸中や嚥下時に喉頭全体を最適に視覚化することができます。この図の拡大版を表示するには、ここをクリックしてください。
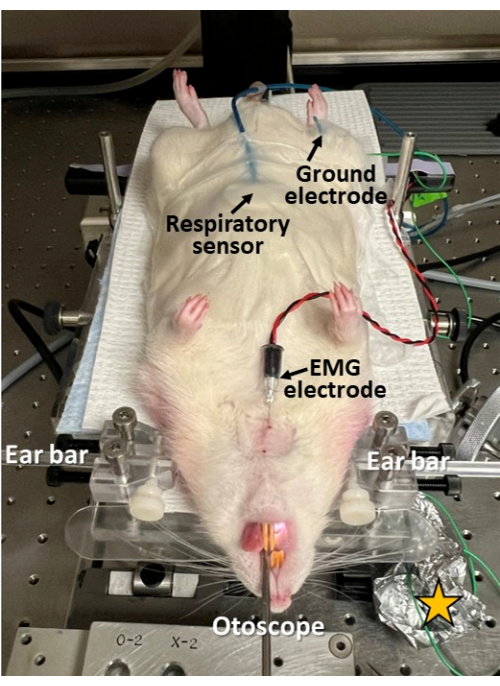
図3:内視鏡検査中の低侵襲電気生理学的記録。 呼吸センサーはげっ歯類の腹部にテープで固定されています。EMG電極は、皮膚を通して舌の舌の筋肉に挿入されます。接地電極は股関節に皮下に挿入されます。このアプローチにより、内視鏡検査と同期した嚥下、呼吸、および嚥下呼吸の調整の調査が可能になります。皮膚は剃られ、電極挿入部位で洗浄/消毒されることに注意してください。黄色の星 = 電極リード接続部位に巻き付けられたアルミホイルで、電気生理学的記録のS/N比を改善します。 この図の拡大版を表示するには、ここをクリックしてください。

図4:喉頭を遠くから観察するための経経口内視鏡 検査 (A)軽い指のグリップで舌を静かに引っ込めた後、内視鏡を舌と中央切歯の間に赤い星の位置(つまり、内視鏡シャフトとの解剖学的位置を維持するために引っ込めた舌と同じ側)に挿入します。(B)内視鏡が硬口蓋を越えて進むと、(C)喉頭蓋と口蓋が見えてきます。(D)声門を視覚化するには、口蓋と喉頭蓋を、口蓋の表面(画像 Cの黒い輪郭の星の位置)に圧力を加えることによって「分離」する必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
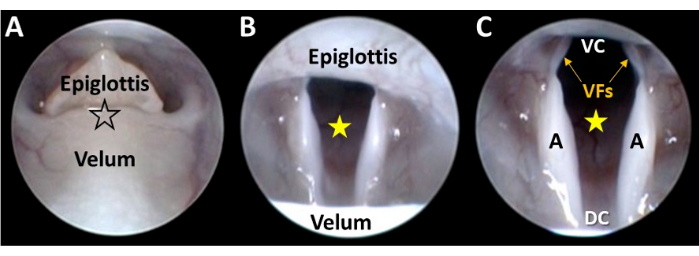
図5:喉頭の内視鏡的可視化 (A) 内視鏡の先端は、マイクロマニピュレーター制御により、分離された口蓋と喉頭蓋の間(黒枠の星の位置)に優しく誘導されます。内視鏡が進むと、(B)喉頭が見えてきて、声門空間(黄色の星)がマイクロマニピュレーターの調整によってカメラの視野の中央に配置されます。(C)内視鏡のマイクロマニピュレーターの継続的な前進により、喉頭の腹側-背側および横方向の寸法全体が視覚化されます。略語:VC =喉頭の腹側交連(つまり、声帯の間の腹側接合点)。DC =喉頭の背側交連(すなわち、披裂骨間の背側接合点)。VFs = 声帯;A =アリテノイド。 この図の拡大版を表示するには、ここをクリックしてください。

図6:呼吸および嚥下中のマウス喉頭の視覚化。右 RLN の外科的切断前および手術後の成体 Sprague Dawley ラット (A-C) の呼吸および嚥下中の喉頭運動を描いた代表的な内視鏡画像。喉頭の安静姿勢は、(A) ベースラインと比較して、RLN 損傷後の (D) 変化しないように見えることに注意してください。(B,E)最大吸気時には、RLN損傷後に喉頭の非対称性が明らかになります。 (B) ベースラインに示されているように、両方の Arytenoid が外転して声門腔 (黄色の星) を拡大する代わりに、(E) 同側 (右) の Arytenoid (黒いアスタリスク) と声帯は、RLN 損傷後の呼吸周期全体で固定されているように見えます。右側の非対称性は、嚥下中にも明らかです。(C)ベースラインでは、嚥下中にアリテノイドは正中線で近似し、声帯の間に小さな腹側声門隙間が残ります。(F)RLN損傷後、同側の披裂状突起とVFは、嚥下中に逆説的に(つまり、影響を受けていない側と同じ方向、赤い矢印)動き、腹側から後喉頭交連に伸びる大きな声門隙間(黄色の星)を残します。(F)この画像は、医原性RLN損傷のラットモデルにおける喉頭気道保護障害の直接的な証拠を提供します。(C,F)喉頭蓋と口蓋がカメラの視野に表示されなくなることで示されるように、喉頭蓋が内視鏡に近づくと、喉頭蓋が内視鏡に近づくことに注意してください。黒い矢印は正常な喉頭運動の方向を示し、赤い矢印は逆説的な運動を示します。黄色い星=声門空間。略語:VFs =声帯。A =アリテノイド;RLN = 反回神経。この図の拡大版を表示するには、ここをクリックしてください。

図7:医原性RLN損傷のラットモデルで呼吸および嚥下中の喉頭機能障害を調査するための連続喉頭鏡検査の使用。 -2から+2の範囲のリッカートスケールを使用して、4か月間にわたる8匹の成体Sprague-Dawleyラットの喉頭運動距離と方向を推定しました。ベースライン喉頭鏡検査の後、ラットは右RLNを切断する外科的処置を受け、続いて手術後1週間で連続喉頭鏡検査を受け、その後、手術後1〜4か月の1か月間隔で再度手術を受けました。8匹のラット全員がこの手順を生き延び、連続喉頭鏡検査に対する麻酔レジメンの有効性を実証しました。(A)ビデオは、呼吸中の喉頭運動を定量化するために、リアルタイムでフレームごと/スローモーションで分析されました。0 = 動きなし、1 = 何らかの動き、2 = 影響を受けた(右側)の正常な動作距離と無傷の(左側)側を比較しました。(B)嚥下の場合、声門隙間サイズは次のように推定されました:0 =声門隙隙サイズの縮小なし(つまり、喉頭気道保護なし)、1 =声門隙間縮小(つまり、不完全な気道保護)、および2 =披裂骨の完全な内転、声帯間の小さな腹側声門隙間のみ(つまり、完全な気道保護)。呼吸と嚥下が負の値の場合は、予想とは反対方向への喉頭の動きを示します(つまり、逆説的です)。RLN損傷後、呼吸と嚥下の両方が悪影響を受けたことに注意してください。興味深いことに、喉頭気道の保護は (逆説的ではあるが) 1 WPS の時点では完全でしたが、その後悪化し、保護なしから不完全な保護までさまざまでした。略語:WPS =手術後週。MPS = 手術後数ヶ月;RLN = 反回神経。 この図の拡大版を表示するには、ここをクリックしてください。

図8:げっ歯類のISOによって阻害された嚥下 (A)ISO麻酔下で喉頭鏡検査を受けているげっ歯類の画像で、この目的のために設計されたカスタムISO送達システムのラベル付きコンポーネント。この革新的なアプローチの主な注意点は、人員がISOにさらされるリスクです。(B)このアプローチのもう一つの欠点は、嚥下に対するISOの抑制です。この横並びの箱ひげ図と散布図は、嚥下を誘発するために右上喉頭神経を直接電気刺激したマウス (グループあたり 9 匹) の ISO 麻酔と KX 麻酔の効果を比較した未発表のデータをまとめたものです。ここに示されているのは、20 Hz 刺激の 20 秒の列車とそれに続く 10 秒の休息からなる 5 分間の試行中に誘発された嚥下の数です。ISOで麻酔したマウス(2%)は、KXと比較して、嚥下が有意に少なく(p < 0.001、独立サンプル のt検定)、4/9マウスでは嚥下がさらに廃止されました。同様の知見は、マウスとラットの両方を用いた非外科的実験からも明らかになった(データは示さず)。略語:ISO =イソフルラン。KX =ケタミン-キシラジン。 この図の拡大版を表示するには、ここをクリックしてください。

図9:追跡ソフトウェアを使用したマウス喉頭運動の客観的定量化。図6の同じ画像は、ベースライン時とRLN損傷後のラットの呼吸と嚥下を示しており、カスタムソフトウェアによって喉頭運動追跡線が追加されています。トラッキング ラインは、披裂骨の内側境界に沿った最初のビデオ フレームに手動で追加され、残りのビデオ フレームの左 (青線) と右 (赤線) の喉頭運動を自動的に追跡しました。2.5秒のビデオクリップからカスタムソフトウェアによって生成された対応する喉頭運動グラフは、(A、D)喉頭安静時の姿勢、(B、E)吸気時の最大声門間隙、(C、F)嚥下時の声門閉鎖に対応するラベルで、個々の左右の動きと派生した全体的な喉頭運動を示しています。RLN損傷後の右側(赤い矢印)の逆説的な動きと、対応する派生グローバルモーショングラフに示されている大きな声門ギャップに注意してください。代表的なアウトカム指標を表1に示します。略語:RLN =反回神経。この図の拡大版を表示するには、ここをクリックしてください。

図10:喉頭鏡データとの相関関係に関する電気生理学に基づくアウトカム測定 (A)健康なラットについて、呼吸および嚥下中の電気生理学記録が示されています。上部のウィンドウには、げっ歯類の腹部にテープで固定された呼吸センサーからの呼吸痕跡が表示され、中央のウィンドウにはゲニオグロッサス筋のEMG活動が表示され、下部のウィンドウにはフィルタリングされたEMG活動が表示されます。呼吸中のリズミカルな呼吸パターンとEMGパターンに注意してください。これは、嚥下イベント中に中断されます。嚥下イベントは、呼吸痕跡(黒い矢印)のギザギザの動きによって容易に検出され、その直後に短時間の無呼吸(赤いアスタリスク)が続きます。(B) A の破線の長方形のボックスの拡大ウィンドウは、電気生理学的記録からいくつかの結果測定がどのように定量化されるかを示しています。(A)吸気中(黄色のパネル)は、EMGバースト活動と比較して、呼吸痕跡(上部窓)が~150ミリ秒(青い二重矢印)遅れることに注意し、2つの電気生理学的方法の時間的な違いを強調しています。代表的な電気生理学ベースのアウトカム指標には、1) 吸気段階の持続時間 (i);2) 呼吸間インターバル (ii、呼吸およびフィルタリングされた EMG チャネルを介して計算)。曲線の下の飲み込む領域(iii);および嚥下無呼吸(IV;呼吸器およびフィルタリングされたEMGチャネルを介して計算)。略語:EMG =筋電図。 この図の拡大版を表示するには、ここをクリックしてください。
| アウトカム指標 | ベースライン | RLN後の損傷 | |
| 呼吸 | 最小声門角(度) | 34.5 | 34.6 |
| 最大声門角(度) | 52.9 | 49.9 | |
| 平均声門角(度) | 43.7 | 42.2 | |
| 平均運動距離比(MMRR) | 1.26 | 0.29 | |
| オープン・クローズ・サイクル・レシオ(OCCR) | 1 | 0.11 | |
| 嚥下 | 喉頭内転(ms) | 200 | 233 |
| 声門閉鎖時間 (ms) | 67 | 0 | |
| 喉頭外転(ms) | 233 | 67 | |
| 合計嚥下時間 (ms) | 500 | 300 | |
表1:カスタム喉頭追跡ソフトウェアによって自動的に生成された代表的な結果測定値。 略語:RLN =反回神経。
喉頭鏡プラットフォームに関する補足テキスト。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
私たちは、呼吸中および嚥下中の喉頭運動のクローズアップ視覚化を可能にする、複製可能なマウス特異的喉頭鏡検査プロトコルの開発に成功しました。重要なことに、このプロトコルは、特に喉頭機能に対するさまざまな病理学的状態の影響を研究するために、同じ動物で経時的に実施できます。このプロトコルは過去10年間に開発され、その過程で大幅な変更とトラブルシューティングが行われてきました。麻酔の最適化は、嚥下を廃止したり、呼吸困難に関連する死亡のリスクを冒したりする過剰摂取を防ぐために克服すべき最大の課題でした。当初はISOを使用していましたが、その結果、嚥下、過剰な唾液分泌(内視鏡の可視化を妨げる)、人員被ばくのリスクが廃止されました。これらは、この手順にISOを使用することに対する深刻な禁忌と考えられています。したがって、KXは一般的に使用されるげっ歯類の麻酔薬33,34,35であるため、KXに焦点を当てました。
私たちは、この目的に適した他の内視鏡と比較してシャフト径が小さい(1.1mm)ため、唾液内視鏡を使用しながらマウス14、22、29、30、36 でプロトコル開発を開始しました。重要なことに、唾液内視鏡にはワーキングチャネルがあり、最初は喉頭内転筋反射14を呼び起こす/研究するための空気パルスを送達するために使用しました。しかし、マウスやラットでは、喉頭内転筋反射がしばしば減少/消失することがわかったが、これはおそらく全身麻酔および/または繰り返される空気パルス送達による粘膜乾燥に続発する喉頭/咽頭感覚受容体の不活性化によるものと思われる。私たちの研究では、喉頭内転筋反射を確実に誘発することはできませんでしたが、嚥下は驚くほど持続し、喉頭入口/近くでの機械的刺激によって容易に誘発されました。このため、機械的に誘発された嚥下に関する内視鏡的分析に焦点を切り替えました。
その過程で、折れやすく、照明や画像解像度が不十分な半硬質の唾液内視鏡を捨て、喉頭の動きを確実に可視化・解析することに成功しました。数多くの代替内視鏡の検討の結果、最終的にマウスとラットの両方を用いた喉頭鏡検査に適した特定の耳鏡に落ち着きました。私たちの経験から、マウス喉頭鏡に適した内視鏡を選択する際の最も重要な特徴は、高品質のビデオキャプチャのために十分に明るい光を透過できる シャフト径が2mm未満 であることです。大口径の内視鏡は、マウスやラットの喉頭入口を容易に通過できず、喉頭の動きをクローズアップして視覚化できます。耳鏡は、優れた光透過率、剛性/耐久性のある設計、および他のタイプの内視鏡(唾液内視鏡、軟性内視鏡など)と比較して比較的低コストであることから、この目的に特に理想的です。また、内視鏡の手動制御は安定した手では選択肢の一つですが、マイクロマニピュレーターの制御がこの喉頭鏡検査プロトコルの重要な特徴であると考えています。重要なことに、内視鏡のマイクロマニピュレーター制御により、1人の研究者が喉頭運動を安定してビデオ記録し、その後の定量化が可能になります。今日まで、この耳鏡ベースのプロトコルを成体のマウスとラットで成功裏に使用してきました。私たちは、より若い/より小さなげっ歯類で喉頭鏡検査を行うために、より小さな直径の内視鏡オプションが不可欠であると思われます。
私たちの喉頭鏡検査プロトコルの新たな利点は、げっ歯類の嚥下中の気道保護を視覚化する能力です。これは、声門を視界から閉める喉頭入口の喉頭蓋の逆転により、人間では不可能です。したがって、げっ歯類は、正常な喉頭機能を効果的に回復するための治療法を発見するという究極の目的のために、正常な喉頭気道保護と病的な喉頭気道保護のメカニズムを具体的に調査するユニークな機会を提供します。このマウス喉頭鏡検査プロトコルのこのユニークな機能は、ビデオ透視法(すなわち、嚥下障害の他の「ゴールドスタンダード」テスト)よりも大きな利点であり、これまでに開発/同定した嚥下障害の多数のげっ歯類モデルで誤嚥を検出することができませんでした30,36,37,38,39,40 .この否定的な VFSS に基づく所見は、げっ歯類の上気道のいくつかの解剖学的違いに起因する可能性があります。まず、げっ歯類の喉頭は鼻咽頭の高い位置にあり、喉頭蓋と口蓋が密接に結合して袋小路の口腔を作り出します。さらに、安静時の喉頭蓋は、静脈を覆う粘膜鞘の下に閉じ込められています。この解剖学的構成により、げっ歯類は義務的な鼻呼吸者になります。したがって、覚醒しているげっ歯類の経口呼吸は呼吸器疾患の兆候です。しかし、健康なげっ歯類の嚥下中、喉頭蓋は粘膜鞘から滑り落ち、喉頭がボーラスの経路から鼻咽頭にさらに上昇すると、喉頭入口を反転します。これらの動的な上気道イベントは、健康なげっ歯類や喉頭機能障害のモデルで喉頭鏡検査を介して直接視覚化/評価できます。
重要なことに、VFSS試験中に誤嚥しないにもかかわらず、げっ歯類モデル(医原性RLN損傷など)は、喉頭鏡検査による喉頭気道保護障害(すなわち、不完全な声門閉鎖)の証拠を実際に示していることを示しました。したがって、このマウス喉頭鏡検査プロトコルは、気道保護と標的治療のメカニズムを具体的に調査するための有用な翻訳プラットフォームを提供します。この目標を達成するには、内視鏡の先端を利用して喉頭/咽頭粘膜の未校正の機械的刺激を提供し、嚥下を誘発する現在の方法のさらなる開発/最適化が必要になります。現在、私たちの研究室では、上喉頭神経32,41の直接電気刺激や喉頭/咽頭粘膜の化学的(クエン酸42など)刺激など、嚥下を誘発するためのより厳密で正確に制御された方法が研究されています。このプロトコルのさらなる制限は、げっ歯類の仰臥位であり、これは覚醒状態および自然な摂食行動を模倣しない。初期のプロトコル開発には腹臥位が含まれていたため、下顎の動きが制限されると同時に口腔の視認性も制限され、内視鏡の通過が著しく妨げられました。下咽頭の内視鏡の先端で遠くから喉頭を視覚化することが可能です。ただし、このアプローチでは、通常、喉頭蓋の視覚化を強化するために、喉頭蓋、静脈、および/または舌を手動で収縮させる必要があります。この目的のために、さまざまなカスタム手動引き込み装置(例:改造された耳鏡鏡、変更されたピペットチップ)を製造しました。ただし、喉頭の一部は通常、視界から隠されたままであり、収縮装置は喉頭の動きを制限する可能性があり、これは機能障害と間違われる可能性があります。さらに、内視鏡検査プラットフォームの最近の追加機能(例えば、トレンデレンブルグチルト、顎の動きに対応するためのイヤーバー間の切り欠き)は、腹臥位でのげっ歯類のテストを容易にする可能性があります。イヤーバーと補助的な熱は、喉頭鏡検査プロトコルの必要な機能です。イヤーバーは、内視鏡の経口操作中に頭が動くのを防ぎます。恒温性加熱システムは、体温を36°Cから38°Cに維持し、安定した麻酔を促進し、処置全体を通して低体温症を防ぎます。
げっ歯類の呼吸中および嚥下中の喉頭運動を確実にビデオ記録する方法論が存在する今、ハイスループット定量化は重要な次のステップです。したがって、当社のビデオ分析の取り組みは、カスタムソフトウェアによって生成されたどのアウトカム指標が健康状態と病気の状態を最もよく区別できるか、また、自然な病気の進行や治療介入に応じて時間の経過に伴う変化を検出できるかを判断するために進行中です。最有力候補は、ビデオ画像解析を高速化するための後続の機械学習アプローチの焦点となります。重要なことに、最適でない画質の場合(例:不十分な照明、視野外の解剖学的構造、喉頭構造を覆い隠す過剰な分泌物など)は、現在、喉頭追跡に適していません。ただし、この障壁は、将来、機械学習ツールによって克服される可能性があります。それまでは、喉頭追跡分析の基準を満たすビデオフレームシーケンスを慎重に選択することが最優先事項であることに変わりはありません。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
この研究は、1)National Heart, Lung, and Blood Institute(NHLBI)からのMulti-PI(TLおよびNN)R01助成金(HL153612)、および2)National Institute on Deafness and Other Communication Disorders(NIDCD)からのR03助成金(TL、DC0110895)の2つのNIH助成金によって部分的に資金提供されました。当社のカスタム喉頭運動追跡ソフトウェア開発は、コールター財団の助成金(TL & Filiz Bunyak)によって部分的に資金提供されました。Kate Osman、Chloe Baker、Kennedy Hoelscher、Zola Stephensonには、研究室のげっ歯類の優れたケアを提供していただいたことに感謝します。また、MU Physics Machine ShopのRoderic Schlotzhauer氏とCheston Callais氏には、カスタム内視鏡プラットフォームの設計と製造、および当社の研究ニーズを満たすための商用内視鏡とマイクロマニピュレーターの戦略的な変更に感謝します。当社のカスタム喉頭モーショントラッキングソフトウェアは、Filiz Bunyak博士とAli Hamad博士(MU電気工学およびコンピュータサイエンス学部)と共同で開発されました。また、耳鏡の選択に関するガイダンスを提供してくださったカールストルツ内視鏡検査のジム・マルナッティ氏にも感謝します。最後に、現在のマウス喉頭鏡検査プロトコルの開発に貢献したLever Labの多数の以前の学生/研修生に感謝したいと思います:Marlena Szewczyk、Cameron Hinkel、Abigail Rovnak、Bridget Hopewell、Leslie Shock、Ian Deninger、Chandler Haxton、Murphy Mastin、Daniel Shu。
資料
| Name | Company | Catalog Number | Comments |
| Atipamezole | Zoetis | Antisedan; 5 mg/mL | Parsippany-Troy Hills, NJ |
| Bioamplifier | Warner Instrument Corp. | DP-304 | Hamden, CT |
| Concentric EMG needle electrode | Chalgren Enterprises, Inc. | 231-025-24TP; 25 mm x 0.3 mm/30 G | Gilroy, CA |
| Cotton tipped applicator (tapered) | Puritan Medical Products | REF 25-826 5W | Guilford, ME |
| Data Acquisition System | ADInstruments | PowerLab 8/30 | Colorado Springs, CO |
| DC Temperature Control System - for endoscopy platform | FHC, Inc. | 40-90-8D | Bowdoin, ME |
| Electrophysiology recording software | ADInstruments | LabChart 8 with video capture module | Colorado Springs, CO |
| Endoscope monitor | Karl Storz Endoscopy-America | Storz Tele Pack X monitor | El Segundo, CA |
| Glycopyrrolate | Piramal Critical Care | NDC 66794-204-02; 0.2 mg/mL | Bethlehem, PA |
| Ground electrode | Consolidated Neuro Supply, Inc. | 27 gauge stainless steel, #S43-438 | Loveland, OH |
| Isoflurane induction chamber | Braintree Scientific, Inc. | Gas Anesthetizing Box - Red | Braintree, MA |
| Ketamine hydrochloride | Covetrus North America | NDC 11695-0703-1, 100 mg/mL | Dublin, OH |
| Metal spatula to decouple epiglottis and velum | Fine Science Tools | Item No. 10091-12; | Foster City, CA |
| Micro-brush to remove food/secretions from oral cavity | Safeco Dental Supply | REF 285-0023, 1.5 mm | Buffalo Grove, IL |
| Mouse-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2-07 – 5 x 12.5 cm Heating Pad | Bowdoin, ME |
| Ophthalmic ointment (sterile) | Allergan, Inc. | Refresh Lacri-lube | Irvine, CA |
| Otoscope | Karl Storz | REF 1232AA | El Segundo, CA |
| Pneumogram Sensor | BIOPAC Systems, Inc. | RX110 | Goleta, CA |
| Pulse oximetry - Vetcorder Pro Veterinary Monitor | Sentier HC, LLC | Part No. 710-1750 | Waukesha, WI |
| Rat-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2 – 12.5X25cm Heating Pad | Bowdoin, ME |
| Sterile needles for drug injections | Becton, Dickinson and Company | REF 305110, 26 G x 3/8 inch, PrecisionGlide | Franklin Lakes, NJ |
| Sterile syringes for drug injections | Becton, Dickinson and Company | REF 309628; 1 mL, Luer-Lok tip | Franklin Lakes, NJ |
| Surgical drape to cover induction cage for dark environment | Covidien LP | Argyle Surgical Drape Material, Single Ply | Minneapolis, MN |
| Surgical tape to secure pneumograph sensor to abdomen | 3M Health Care | #1527-0, 1/2 inch | St. Paul, MN |
| Transparent blanket for thermoregulation | The Glad Products Company | Press’n Seal Cling Film | Oakland, CA |
| Video editing software | Pinnacle Systems, Inc. | Pinnacle Studio, v24 | Mountain View, CA |
| Water circulating heating pad - for anesthesia induction/recovery station | Adroit Medical Systems | HTP-1500 Heat Therapy Pump | Loudon, TN |
| Xylazine | Vet One | NDC 13985-701-10; Anased, 100 mg/mL | Boise, ID |
参考文献
- Brunner, E., Friedrich, G., Kiesler, K., Chibidziura-Priesching, J., Gugatschka, M. Subjective breathing impairment in unilateral vocal fold paralysis. Folia Phoniatr Logop. 63 (3), 142-146 (2011).
- Chandrasekhar, S. S., et al. Clinical practice guideline: improving voice outcomes after thyroid surgery. Otolaryngol Head Neck Surg. 148 (6 Suppl), S1-S37 (2013).
- Fang, T. J., et al. Quality of life measures and predictors for adults with unilateral vocal cord paralysis. Laryngoscope. 118 (10), 1837-1841 (2008).
- Wang, W., et al. Laryngeal reinnervation using ansa cervicalis for thyroid surgery-related unilateral vocal fold paralysis: a long-term outcome analysis of 237 cases. PLoS One. 6 (4), e19128 (2011).
- Cohen, S. M., et al. Association between dysphagia and inpatient outcomes across frailty level among patients >/= 50 years of age. Dysphagia. 35 (5), 787-797 (2020).
- Poulsen, S. H., et al. Signs of dysphagia and associated outcomes regarding mortality, length of hospital stay and readmissions in acute geriatric patients: Observational prospective study. Clin Nutr ESPEN. 45, 412-419 (2021).
- Lin, R. J., Smith, L. J., Munin, M. C., Sridharan, S., Rosen, C. A. Innervation status in chronic vocal fold paralysis and implications for laryngeal reinnervation. Laryngoscope. 128 (7), 1628-1633 (2018).
- Choi, J. S., et al. Functional regeneration of recurrent laryngeal nerve injury during thyroid surgery using an asymmetrically porous nerve guide conduit in an animal model. Thyroid. 24 (1), 52-59 (2014).
- Wang, B., et al. Neurotrophin expression and laryngeal muscle pathophysiology following recurrent laryngeal nerve transection. Mol Med Rep. 13 (2), 1234-1242 (2016).
- Woodson, G., Randolph, G. W. Pathophysiology of recurrent laryngeal nerve injury. Surgery of the Thyroid and Parathyroid Glands (Third Edition). , 404-409.e2 (2021).
- James, M., Palmer, O. Instrumentation and techniques for examination of the ear, nose, throat, and sinus. Oral Maxillofac Surg Clin North Am. 24 (2), 167-174 (2012).
- Patel, R. R., et al. Recommended protocols for instrumental assessment of voice: American Speech-Language-Hearing Association Expert Panel to develop a protocol for instrumental assessment of vocal function. Am J Speech Lang Pathol. 27 (3), 887-905 (2018).
- Kamarunas, E. E., McCullough, G. H., Guidry, T. J., Mennemeier, M., Schluterman, K. Effects of topical nasal anesthetic on fiberoptic endoscopic examination of swallowing with sensory testing (FEESST). Dysphagia. 29 (1), 33-43 (2014).
- Shock, L. A., et al. Improving the utility of laryngeal adductor reflex testing: a translational tale of mice and men. Otolaryngol Head Neck Surg. 153 (1), 94-101 (2015).
- Aviv, J. E., et al. Laryngopharyngeal sensory discrimination testing and the laryngeal adductor reflex. Ann Otol Rhinol Laryngol. 108 (8), 725-730 (1999).
- Farneti, D. The instrumental gold standard: fees. J Gastroenterol Hepatol Res. 3, 1281-1291 (2014).
- Hernandez-Morato, I., et al. Reorganization of laryngeal motoneurons after crush injury in the recurrent laryngeal nerve of the rat. J Anat. 222 (4), 451-461 (2013).
- Hernandez-Morato, I., Sharma, S., Pitman, M. J. Changes in neurotrophic factors of adult rat laryngeal muscles during nerve regeneration. Neuroscience. 333, 44-53 (2016).
- Tessema, B., et al. Evaluation of functional recovery of recurrent laryngeal nerve using transoral laryngeal bipolar electromyography: a rat model. Ann Otol Rhinol Laryngol. 117 (8), 604-608 (2008).
- Tessema, B., et al. Observations of recurrent laryngeal nerve injury and recovery using a rat model. Laryngoscope. 119 (8), 1644-1651 (2009).
- Monaco, G. N., et al. Electrical stimulation and testosterone enhance recovery from recurrent laryngeal nerve crush. Restor Neurol Neurosci. 33 (4), 571-578 (2015).
- Haney, M. M., Hamad, A., Leary, E., Bunyak, F., Lever, T. E. Automated quantification of vocal fold motion in a recurrent laryngeal nerve injury mouse model. Laryngoscope. 129 (7), E247-E254 (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Wang, B., et al. Functional regeneration of the transected recurrent laryngeal nerve using a collagen scaffold loaded with laminin and laminin-binding BDNF and GDNF. Sci Rep. 6, 32292 (2016).
- Hamad, A., Haney, M. M., Lever, T. E., Bunyak, F. Automated segmentation of the vocal folds in laryngeal endoscopy videos using deep convolutional regression networks. , 140-148 (2019).
- Wang, Y. Y., Hamad, A. S., Palaniappan, K., Lever, T. E., Bunyak, F. LARNet-STC: Spatio-temporal orthogonal region selection network for laryngeal closure detection in endoscopy videos. Comput Biol Med. 144, 105339 (2022).
- Lever, T. E., et al. Advancing laryngeal adductor reflex testing beyond sensory threshold detection. Dysphagia. 37 (5), 1151-1171 (2022).
- Wang, Y. Y., Hamad, A. S., Lever, T. E., Bunyak, F. Orthogonal region selection network for laryngeal closure detection in laryngoscopy videos. Annu Int Conf IEEE Eng Med Biol Soc. 2020, 2167-2172 (2020).
- Haney, M. M., et al. Recurrent laryngeal nerve transection in mice results in translational upper airway dysfunction. J Comp Neurol. 528 (4), 574-596 (2020).
- Mok, A., et al. A surgical mouse model for advancing laryngeal nerve regeneration strategies. Dysphagia. 35 (3), 419-437 (2020).
- Haney, M. M., Ericsson, A. C., Lever, T. E. Effects of intraoperative vagal nerve stimulation on the gastrointestinal microbiome in a mouse model of amyotrophic lateral sclerosis. Comp Med. 68 (6), 452-460 (2018).
- Lever, T. E., et al. A mouse model of pharyngeal dysphagia in amyotrophic lateral sclerosis. Dysphagia. 25 (2), 112-126 (2010).
- Struck, M. B., Andrutis, K. A., Ramirez, H. E., Battles, A. H. Effect of a short-term fast on ketamine-xylazine anesthesia in rats. J Am Assoc Lab Anim Sci. 50 (3), 344-348 (2011).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress. Altern Lab Anim. 33 (2), 119-127 (2005).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Welby, L., Maynard, T., Zohn, I., Lever, T. Fluoroscopic and endoscopic investigation of dysphagia in a mouse model of DiGeorge syndrome. Dysphagia. 34, 1003-1004 (2019).
- Mueller, M., et al. Impact of limb phenotype on tongue denervation atrophy, dysphagia penetrance, and survival time in a mouse model of ALS. Dysphagia. 37 (6), 1777-1795 (2022).
- Osman, K. L., et al. Optimizing the translational value of mouse models of ALS for dysphagia therapeutic discovery. Dysphagia. 35 (2), 343-359 (2020).
- Lever, T. E., et al. Videofluoroscopic validation of a translational murine model of presbyphagia. Dysphagia. 30, 328-342 (2015).
- Lever, T. E., et al. Adapting human videofluoroscopic swallow study methods to detect and characterize dysphagia in murine disease models. J Vis Exp. (97), 52319 (2015).
- Ballenger, B., et al. Targeted electrical stimulation of the superior laryngeal nerve - a potential treatment for dysphagia in ALS. FASEB J. 36 (S1), (2022).
- Kloepper, A., et al. An experimental swallow evoked potential protocol to investigate the neural substrates of swallowing. OTO Open. 4 (1), (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved