Method Article
Minimalinvasive murine Laryngoskopie zur Nahaufnahme der Kehlkopfbewegung beim Atmen und Schlucken
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine serielle transorale Laryngoskopie für Mäuse und Ratten, die eine ungehinderte Videodarstellung des Kehlkopfes während des Atmens und Schluckens aus nächster Nähe unter Verwendung eines optimierten Anästhesieregimes und fein abgestimmter endoskopischer Manipulationstechniken ermöglicht.
Zusammenfassung
Der Kehlkopf ist ein essentielles Organ bei Säugetieren mit drei Hauptfunktionen - Atmen, Schlucken und Vokalisieren. Es ist bekannt, dass eine Vielzahl von Erkrankungen die Kehlkopffunktion beeinträchtigt, was zu Atembeschwerden (Dyspnoe), Schluckstörungen (Dysphagie) und/oder Stimmstörungen (Dysphonie) führt. Insbesondere Dysphagie kann zu einer Aspirationspneumonie und der damit verbundenen Morbidität, wiederholten Krankenhausaufenthalten und einer frühen Mortalität führen. Trotz dieser schwerwiegenden Folgen zielen die bestehenden Behandlungen der Kehlkopfdysfunktion weitgehend auf chirurgische und verhaltensbezogene Eingriffe ab, die leider in der Regel nicht zur Wiederherstellung der normalen Kehlkopffunktion führen, was den dringenden Bedarf an innovativen Lösungen unterstreicht.
Um diese Lücke zu schließen, haben wir einen experimentellen endoskopischen Ansatz entwickelt, um die Kehlkopfdysfunktion in Mausmodellen (d.h. Maus und Ratte) zu untersuchen. Die Endoskopie bei Nagetieren ist jedoch aufgrund ihrer geringen Größe im Vergleich zur aktuellen Endoskoptechnologie, der anatomischen Unterschiede in den oberen Atemwegen und der Notwendigkeit einer Anästhesie, um den Kehlkopf optimal zu erreichen, eine ziemliche Herausforderung. In dieser Arbeit beschreiben wir einen neuartigen transoralen Laryngoskopie-Ansatz, der eine ungehinderte Videodarstellung der Kehlkopfbewegung bei Mäusen und Ratten aus nächster Nähe ermöglicht. Zu den kritischen Schritten im Protokoll gehören ein präzises Anästhesiemanagement (um eine Überdosierung zu verhindern, die das Schlucken überflüssig macht und/oder eine durch Atemnot verursachte Mortalität riskiert) und die Mikromanipulatorsteuerung des Endoskops (für eine stabile Videoaufzeichnung der Kehlkopfbewegung durch einen einzelnen Forscher zur anschließenden Quantifizierung).
Wichtig ist, dass das Protokoll im Laufe der Zeit an denselben Tieren durchgeführt werden kann, um die Auswirkungen verschiedener pathologischer Zustände speziell auf die Kehlkopffunktion zu untersuchen. Ein neuartiger Vorteil dieses Protokolls ist die Möglichkeit, den Atemwegsschutz während des Schluckens sichtbar zu machen, was beim Menschen aufgrund der epiglottischen Inversion über dem Kehlkopfeinlass, die die Sicht auf die Stimmritze behindert, nicht möglich ist. Nagetiere bieten daher eine einzigartige Gelegenheit, die Mechanismen des normalen und pathologischen Schutzes der Kehlkopf-Atemwege spezifisch zu untersuchen, um letztendlich Behandlungen zur effektiven Wiederherstellung der normalen Kehlkopffunktion zu finden.
Einleitung
Der Kehlkopf ist ein knorpeliges Organ, das sich an der Schnittstelle des Atmungs- und des Verdauungstrakts im Rachen befindet, wo es als Ventilmechanismus fungiert, um den Fluss und die Richtung von Luft (d. h. beim Atmen und Vokalisieren) gegenüber Nahrung und Flüssigkeit (d. h. beim Schlucken) präzise zu steuern. Es ist bekannt, dass eine Vielzahl von Erkrankungen den Kehlkopf betreffen, darunter angeborene (z. B. Laryngomalazie, subglottische Stenose), neoplastische (z. B. Kehlkopfpapillomatose, Plattenepithelkarzinom), neurologische (z. B. idiopathische Kehlkopflähmung, Schlaganfall, Parkinson-Krankheit, amyotrophe Lateralsklerose) und iatrogene (z. B. unbeabsichtigte Verletzung bei Kopf- oder Halsoperationen). Unabhängig von der Ätiologie führt eine Kehlkopfdysfunktion typischerweise zu einer Symptomtrias aus Dyspnoe (Atembeschwerden), Dysphonie (Stimmbehinderung) und Dysphagie (Schluckstörungen), die sich negativ auf das wirtschaftliche und soziale Wohlergehen einer Person auswirken 1,2,3,4.
Darüber hinaus kann Dysphagie, insbesondere bei medizinisch fragilen Personen, zu einer Aspirationspneumonie (aufgrund von Nahrung oder Flüssigkeit, die durch einen unvollständig verschlossenen Kehlkopf in die Lunge entweicht) und damit verbundener Morbidität, wiederholten Krankenhausaufenthalten und früher Mortalität führen 5,6. Trotz dieser schwerwiegenden Folgen zielen die bestehenden Behandlungen der Kehlkopfdysfunktion weitgehend auf chirurgische und verhaltensbezogene Eingriffe ab, die in der Regel nicht die normale Kehlkopffunktion wiederherstellen 1,2,7,8,9,10, was den dringenden Bedarf an innovativen Lösungen unterstreicht. Um dieses Ziel zu erreichen, haben wir einen experimentellen endoskopischen Ansatz entwickelt, um die Kehlkopfdysfunktion in Mausmodellen (d.h. Maus und Ratte) zu untersuchen.
In der Humanmedizin ist der Goldstandard für die Beurteilung der Kehlkopfdysfunktion die endoskopische Visualisierung, die sogenannte Laryngoskopie 11,12. Typischerweise wird ein flexibles Endoskop durch die Nase geführt, um den Kehlkopf zu untersuchen, insbesondere die Stimmlippen und die angrenzenden supraglottischen und subglottischen Kehlkopfstrukturen. Ein starres Endoskop kann auch verwendet werden, um den Kehlkopf über die Mundhöhle sichtbar zu machen. Beide Ansätze ermöglichen eine grobe Untersuchung der Kehlkopfanatomie und können zur Beurteilung der Beweglichkeit und Funktion des Kehlkopfes während der Atmung, der Phonation und einer Vielzahl von Atemwegsschutzreflexen wie Husten und dem Kehlkopfadduktorenreflex verwendet werden 13,14,15,16. Während des Schluckens wird der Kehlkopf jedoch vollständig von der Epiglottis verdeckt, da sie sich umdreht, um den Kehlkopfeingang zu bedecken und ihn vor dem Weg des Schluckens des Nahrungs-/Flüssigkeitsbolus zu schützen. Dies hat zur Folge, dass eine direkte Visualisierung der Kehlkopfbewegung während des Schluckens beim Menschen nicht möglich ist und daher indirekt mit anderen diagnostischen Ansätzen (z.B. Durchleuchtung, Elektromyographie, Elektroglottographie) abgeleitet werden muss.
In dieser Arbeit wird ein innovatives Laryngoskopie-Protokoll für Mäuse und Ratten beschrieben, das eine ungehinderte Nahaufnahme der Atmung und des Atemwegsschutzes beim Schlucken unter leichter Narkose ermöglicht. Das Protokoll ist mit einer Vielzahl von kommerziell erhältlichen Endoskopiesystemen in Kombination mit einer kundenspezifischen Plattform kompatibel, um das anästhesierte Nagetier während des gesamten Eingriffs zu immobilisieren. Wichtig ist, dass zahlreiche Designs/Konfigurationen von Endoskopie-Plattformen in der Tat möglich sind, abhängig von den verfügbaren Ressourcen und der Forschungsagenda des jeweiligen Labors. Unsere Absicht ist es, Forschern eine Orientierungshilfe zu geben, die sie im Rahmen ihrer Forschung berücksichtigen sollten. Darüber hinaus wollen wir zeigen, wie dieses Laryngoskopie-Protokoll zu einer Fülle objektiver Daten führen kann, die neue Einblicke in unser Verständnis der Kehlkopfdysfunktion und -regeneration ermöglichen können.
Die kombinierte Wirkung aller in diesem murinen Laryngoskopieprotokoll beschriebenen Schritte führt zu einer minimalinvasiven Untersuchung des adulten murinen Kehlkopfes, die bei denselben Tieren wiederholt werden kann, um eine Kehlkopfdysfunktion im Laufe der Zeit als Reaktion auf iatrogene Verletzung, Krankheitsprogression und/oder Behandlungsintervention in Bezug auf den Atemwegsschutz zu erkennen und zu charakterisieren. Bemerkenswert ist, dass dieses Protokoll die vokalisationsbezogene Kehlkopffunktion nicht bewertet.
Protokoll
Das murine Laryngoskopie-Protokoll folgt einem genehmigten Protokoll des Institutional Animal Care and Use Committee (IACUC) und den Richtlinien der National Institutes of Health (NIH). Es wurde für die Verwendung mit über 100 adulten C57BL/6J-Mäusen und über 50 erwachsenen Sprague Dawley-Ratten entwickelt, die ungefähr gleichen Geschlechts sind und für beide Spezies 6 Wochen bis 12 Monate alt sind. Für die Anpassung an jüngere/kleinere Nagetiere ist eine zusätzliche Protokollentwicklung erforderlich. Die Tiere wurden in Gruppen untergebracht (bis zu vier Mäuse oder zwei Ratten pro Käfig, je nach Geschlecht und Wurf). Zu den Standardbedingungen des Vivariums gehörten ein statischer Käfig mit strenger Regulierung der Umgebungstemperatur (20-26 °C), der Luftfeuchtigkeit (30 %-70 %) und ein standardmäßiger 12-Stunden-Lichtzyklus. Alle Tiere erhielten bei wöchentlichen Käfigwechseln frisches Anreicherungsmaterial (z. B. Hütte/Rohr, Zahnbehandlungen, Nestchen). Es wurde unbegrenzter Zugang zu Nahrung und Wasser gewährt, außer während einer kurzen (bis zu 4-6 Stunden) Nahrungseinschränkung vor der Narkose, wie unten beschrieben. Veterinär- und Forschungspersonal überwachte die Tiere täglich.
1. Tieranästhesie, die das Schlucken nicht abschafft
- Tragen Sie geeignete persönliche Schutzausrüstung (z. B. Handschuhe, Maske), um die Allergenexposition bei der Arbeit mit Nagetieren zu minimieren.
- Beschränken Sie jeden Nagetierkäfig bis zu 4-6 Stunden vor der Anästhesie, um die Rückhaltung von Nahrung in der Mundhöhle und im Rachen zu minimieren, was die endoskopische Visualisierung beeinträchtigen und/oder zu einer Nahrungsaspiration während des Eingriffs führen kann.
HINWEIS: Nahrungsretention in der Mundhöhle ist ein normaler Befund bei Nagetieren ohne Dysphagie, wenn sie nicht auf Nahrung beschränkt wurden. - Bereiten Sie eine "Wärmestation" für die Einweisung/Bergung der Tiere vor.
- Erwärmen Sie ein wasserzirkulierendes Heizkissen auf einer Tischplatte auf 37 °C.
- Auswahl von Induktions-/Rückgewinnungskäfigen in geeigneter Größe für die zu prüfende Tierart. Zum Beispiel sind Maus-Schuhkartonkäfige mit Filterdeckeln für die Induktion/Rückgewinnung von Mäusen und Ratten angemessen dimensioniert. Für jedes zu prüfende Tier ist ein frischer Induktions-/Auffangkäfig zu verwenden; Verwenden Sie einen einzelnen Käfig sowohl als Induktions- als auch als Auffangkäfig für dasselbe Tier.
- Legen Sie den Boden des Induktions-/Erholungskäfigs mit einer leichten Schicht aus saugfähigem Material (z. B. Eselsspäne, Papiertuch, Welpenpolster) aus, um Wärme und Absorption von Körpersekreten während der Anästhesieeinleitung und -erholung zu gewährleisten.
- Legen Sie die vorbereiteten Käfige (mit Filterdeckeln) vor der Narkoseeinleitung 30-60 Minuten lang vollständig auf das Heizkissen.
HINWEIS: Diese Mikroumgebung bietet ausreichend zusätzliche Wärme, um einen stabilen Anästhesiestoffwechsel während der Induktion und Genesung zu fördern.
- Stellen Sie den Heimkäfig des Tieres vor der Narkoseeinleitung etwa 30 Minuten lang halb auf das vorgeheizte 37 °C-Heizkissen.
HINWEIS: Die Bereitstellung von zusätzlicher Wärme vor dem Eingriff kann die Induktion der Anästhesie beschleunigen und eine versehentliche Überdosierung aufgrund eines verlangsamten/verzögerten Anästhesiestoffwechsels durch Unterkühlung verhindern. - Bereiten Sie eine Ketamin-Xylazin (KX)-Anästhesie basierend auf der Spezies und dem Körpergewicht vor.
- Für Mäuse: Eine Mischung aus 90 mg/kg Ketamin und 11 mg/kg Xylazin ist ausreichend für die transorale Laryngoskopie bei adulten C57BL/6-Hintergrundmäusen beiderlei Geschlechts. Passen Sie die Dosen für andere Mausstämme und Altersgruppen an.
- Für Ratten: Eine Mischung aus 60 mg/kg Ketamin und 6 mg/kg Xylazin ist ausreichend für die transorale Laryngoskopie bei erwachsenen Sprague Dawley-Ratten beiderlei Geschlechts. Passen Sie die Dosen für andere Rattenstämme und -alter an.
- Erwärmen Sie die mit Spritzen gefüllten Narkosemittel auf der 37 °C warmen Warmhaltestation, um Wärmeverluste bei den Tieren zu vermeiden, die bei der Injektion kalter Flüssigkeiten entstehen.
- Injizieren Sie dem Nagetier die berechnete KX-Dosis mit einer Spritze geeigneter Größe (z. B. 1 ml) und einer Nadel (z. B. 26 G1/2).
- Bei Mäusen: Verabreichen Sie eine einzelne subkutane (SC) Injektion.
HINWEIS: Nach unserer Erfahrung reduzieren/beseitigen SC-Injektionen bei Mäusen die anästhesiebedingte Mortalität im Vergleich zu intraperitonealen (IP) Injektionen. - Bei Ratten: Verabreichen Sie eine einzelne SC- oder IP-Injektion. Falls gewünscht, sedieren Sie Ratten mit Isofluran (ISO) (3-5%) in einer Induktionskammer unmittelbar vor der KX-Injektion.
HINWEIS: Spontane Körperbewegungen können für einen kurzen Zeitraum (in der Regel <1 min) wieder aufgenommen werden, bis der KX wirkt.
- Bei Mäusen: Verabreichen Sie eine einzelne subkutane (SC) Injektion.
- Verabreichen Sie Glycopyrrolat (Anticholinergikum) unmittelbar nach der KX-Injektion, um überschüssige Speichelsekrete zu reduzieren, die die Visualisierung des Kehlkopfes während der transoralen Endoskopie behindern und/oder die oberen Atemwege während der Anästhesieerholung mechanisch blockieren können.
HINWEIS: Die Dosierung und der Verabreichungsweg sind für Mäuse und Ratten identisch (0,01-0,02 mg/kg SC), und die Wirkung tritt nahezu sofort ein und hält mehrere Stunden an. - Nach der Glykopyrrolat-Injektion legen Sie das anästhesierte Nagetier in den vorgeheizten Induktionskäfig auf der Wärmestation und decken Sie den Käfig mit einem chirurgischen Abdecktuch ab, um eine abgedunkelte Umgebung zu schaffen, die die visuelle Stimulation für 10 Minuten ungestört minimiert.
- Beenden Sie das Verfahren, wenn das Nagetier 10 Minuten nach der anfänglichen KX-Dosis gehfähig bleibt.
HINWEIS: Versuche, eine zusätzliche Anästhesie (entweder KX- oder Ketamin-Erhaltung) durchzuführen, werden wahrscheinlich vergeblich sein.
- Beenden Sie das Verfahren, wenn das Nagetier 10 Minuten nach der anfänglichen KX-Dosis gehfähig bleibt.
- Nach 10 Minuten ist eine Erhaltungsdosis Ketamin zu verabreichen (1/4 der Anfangsdosis, wenn die Reflexe der Hintergliedmaßen vermindert sind, oder 1/2 der Anfangsdosis, wenn die Reflexe der Hintergliedmaßen lebhaft sind; SC für Mäuse und SC/IP für Ratten), um die Anästhesie aufrechtzuerhalten.
- Tragen Sie eine Augensalbe auf beide Augen auf, um eine Austrocknung der Hornhaut und ein damit verbundenes Trauma während der Laryngoskopie zu verhindern.
- Übertragen Sie das anästhesierte Nagetier auf eine benutzerdefinierte Endoskopieplattform, um mit der Laryngoskopie zu beginnen.
HINWEIS: Wir haben unsere Endoskopie-Plattform (Abbildung 1) so konzipiert, dass sie über mehrere Funktionen verfügt, die mit einer Vielzahl von chirurgischen und elektrophysiologischen Ansätzen für Nagetiere verwendet werden können, die nicht unbedingt eine Endoskopie erfordern. Als solches ist es für den rein endoskopischen Einsatz überdimensioniert. Gegebenenfalls werden wir Merkmale/Komponenten hervorheben, die für dieses Laryngoskopie-Protokoll unerlässlich sind. - Von diesem Zeitpunkt an überprüfen Sie die Reflexe der hinteren Gliedmaßen während des gesamten Eingriffs alle 15-20 Minuten und geben Sie bei Bedarf zusätzliche Ketamin-Erhaltungsdosen, die mindestens 20 Minuten voneinander entfernt sind. Da es sich um ein relativ kurzes Verfahren handelt (typischerweise <45 Minuten unter Narkose), ist nach der anfänglichen Erhaltungsdosis selten zusätzliches Ketamin erforderlich.
2. Transorale Passage des Endoskops zur Visualisierung des Kehlkopfes
- Bereiten Sie vor der Betäubung des Tieres ein Endoskop in geeigneter Größe mit Videoaufzeichnungsfunktion vor.
HINWEIS: Wir verwenden routinemäßig ein Null-Grad-Otoskop mit einem Schaftdurchmesser von 1,9 mm und einer Schaftlänge von 10 cm mit einer kundenspezifischen Metallhülle (Abbildung 2), das repräsentative Endoskop, das in diesem Protokoll verwendet wird.- Schließen Sie das Endoskop an eine Lichtquelle und ein Endoskopie-Aufzeichnungssystem an, um eine Echtzeitbetrachtung und Videoaufzeichnung mit mindestens 30 Bildern pro Sekunde (fps) zu ermöglichen.
- Fokussieren und Weißabgleich der Kamera für eine optimale Bildqualität.
- Befestigen Sie das Endoskop an einem Mikromanipulator.
HINWEIS: Für die Verfolgung der Kehlkopfbewegung befestigen wir das Endoskop an einem Mikromanipulator auf der Endoskopieplattform, um eine präzise Endoskopsteuerung für eine stabile Videoaufnahme zu ermöglichen.
- Sichern Sie den Nager in Rückenlage auf einer beheizten Plattform. Stabilisieren und fixieren Sie den Kopf, indem Sie ihn mit Ohrstangen sichern.
- Stellen Sie sicher, dass sich der Kopf des Nagetiers in den Ohrbügeln frei nach oben/unten drehen kann (aber nicht von einer Seite zur anderen), ohne herauszurutschen. Dieser Freiheitsgrad erleichtert das transorale Einführen und Vorschieben des Endoskops bis zum Kehlkopf.
- Wenn während der Endoskopie eine synchrone elektrophysiologische Aufzeichnung von Atmung, Schlucken und Schluckatmungskoordination gewünscht wird, setzen Sie hierfür geeignete Sensoren ein (Abbildung 3).
- Befestigen Sie einen Atemsensor mit chirurgischem Klebeband am Bauch in der Mittellinie, unmittelbar kaudal des Xyphoidfortsatzes.
- Rasieren und reinigen/desinfizieren Sie die Haut mit einem Alkoholtupfer, bevor Sie die Nadelelektroden einführen, um eine Infektion zu vermeiden.
- Verwenden Sie eine 22-G-Nadel, um eine kleine Öffnung durch die Haut zu stechen, bevor Sie die Nadelelektrode einführen, um eine Beschädigung der Elektromyographie (EMG) zu vermeiden.
- Führen Sie eine sterile konzentrische EMG-Nadelelektrode (z. B. 25 mm x 0,3 mm/30 G) durch die submentale Haut an der Mittellinie in den Zungenansatz ein (z. B. Musculus genioglossus oder Musculus geniohyoidus, abhängig von der Einstichtiefe der Nadel).
- Führen Sie eine Masseelektrode (z. B. 27 G Edelstahl) subkutan an der Hüfte (beidseitig) ein.
- Schließen Sie den Atemsensor und die EMG-Nadelelektroden an ein elektrophysiologisches Aufzeichnungssystem an (z. B. Bioverstärker und Datenerfassungssystem mit synchroner Videoaufnahme) an und überprüfen Sie saubere elektrophysiologische Signale in beiden Kanälen, bevor Sie fortfahren.
- Umwickeln Sie die Elektrodenverbindungsstellen mit Aluminiumfolie, um elektrisches Rauschen abzuschirmen und das Signal-Rausch-Verhältnis in den entsprechenden elektrophysiologischen Aufzeichnungen zu verbessern.
- Passen Sie die Position des Atemsensors und die Elektrodentiefe der EMG-Nadel nach Bedarf an, um saubere elektrophysiologische Signale in beiden Kanälen zu erhalten. Um diesem Protokoll zu folgen, verwenden Sie eine Abtastrate von 1 k für die Atmung und eine Abtastrate von 20 k und einen Bandpassfilter (z. B. 150-3.000 Hz) für EMG.
- Decken Sie den Oberkörper (und den Atemsensor) des Nagetiers mit einer transparenten Decke ab, um die Wärmeregulierung zu erleichtern und gleichzeitig die Visualisierung der Bauchbewegungen während der Atmung zu ermöglichen. Lassen Sie die Hinterbeine und den Unterbauch frei für den Zugang während der Reflexkontrollen und der erneuten Ketamin-Erhaltungsdosis. Stellen Sie sicher, dass die Decke die Bauchbewegung während der Atmung nicht einschränkt.
- Fahren Sie mit der transoralen Endoskopie fort (Abbildung 4).
- Öffnen Sie das Maul des Nagetiers, indem Sie einen spitz zulaufenden Applikator mit Wattespitze senkrecht zum Kiefer hinter die mittleren Schneidezähne einführen. Drehen Sie das Wattestäbchen auf der dorsalen Oberfläche der Zunge, so dass es leicht aus dem Mund herausragt.
- Ziehen Sie die Zunge mit einem leichten Fingergriff vorsichtig leicht aus dem Mund zu einer Seite der mittleren Schneidezähne, während Sie die Endoskopspitze in die Mundhöhle einführen (Abbildung 4A,B).
- Schalten Sie die Lichtquelle ein, nachdem Sie die Endoskopspitze in den Mund eingeführt haben, um eine mögliche Schädigung der Augen des Nagetiers zu vermeiden.
- Führen Sie das Endoskop seitlich der Schneidezähne auf der gleichen Seite wie die eingezogene Zunge ein. Die mittleren Schneidezähne verhindern das Einführen des Endoskops an der Mittellinie, so dass dieser laterale Einführzugang notwendig wird.
- Starten Sie die Endoskopie- (und Elektrophysiologie-) Aufzeichnungssysteme. Zeichnen Sie während des gesamten Verfahrens kontinuierlich auf, um genügend Daten für die Post-hoc-Analyse zu gewährleisten, oder zeichnen Sie je nach Bedarf der Studie zu ausgewählten Zeiten auf.
- Schieben Sie das Endoskop vorsichtig vor, um den Oropharynx sichtbar zu machen, und achten Sie darauf, nicht gegen den harten Gaumen zu kratzen oder übermäßigen Druck auf die Zunge auszuüben, der zu Verletzungen führen kann.
- Entfernen Sie sichtbare Speisereste und/oder überschüssige Speichelsekrete mit einem Tupfer in geeigneter Größe (z. B. einer 1,5-mm-Mikrobürste), um das Aspirationsrisiko im weiteren Verlauf des Eingriffs zu minimieren.
- Fahren Sie mit dem Verschieben/Einstellen der Endoskopposition fort, bis der Hypopharynx innerhalb des Sichtfelds auf dem Monitor zentriert ist und wichtige anatomische Strukturen erkennbar sind (Abbildung 4C). Zu diesem Zeitpunkt sollten alle Strukturen anatomisch ausgerichtet/symmetrisch im Sichtfeld der Kamera erscheinen; Andernfalls positionieren Sie das Endoskop nach Bedarf neu.
- Achten Sie auf evozierte Kiefer-/Zungenbewegungen während des Vorschiebens des Endoskops. Wenn nicht vorhanden, fahren Sie ohne weitere Ketamin-Neudosierung fort. Falls vorhanden, verabreichen Sie eine zweite Ketamin-Erhaltungsdosis (1/4 bis 1/2 der Anfangsdosis von Ketamin) und warten Sie etwa 5 Minuten, bis die Wirkung eintritt, bevor Sie fortfahren. Wiederholen Sie die Dosis nur, wenn seit der letzten Injektion mindestens 20 Minuten vergangen sind, um eine Übersedierung und Abschaffung des Schluckens zu vermeiden.
- Untersuchen Sie die Zunge des Nagetiers während des gesamten Eingriffs alle 5 Minuten auf dunkle Verfärbungen, die auf eine Ischämie hinweisen. Um dies zu vermeiden, positionieren Sie das Endoskop nach Bedarf neu.
- Üben Sie mit einer Mikrosonde (z. B. einem Metallspatel), die neben das Endoskop eingeführt wird, leichten Druck auf das Velum aus, um den weichen Gaumen und den Epiglottis zu entkoppeln und den Kehlkopf aus der Ferne sichtbar zu machen (Abbildung 4D). Vermeiden Sie es, die Endoskopspitze zum Entkoppeln zu verwenden, da der ausgeübte Druck das Weichgewebe schädigen oder den Endoskopschaft dauerhaft verbiegen/beschädigen kann.
HINWEIS: Im Gegensatz zum Menschen ist der murine Kehlkopf aus transoraler Perspektive nicht direkt sichtbar. Stattdessen wird die Epiglottis mechanisch unter einer Schleimhaut über dem Velum eingeklemmt, was zur Bildung eines hypopharyngealen Sackgassenraums führt. Durch leichten Druck auf das Velum wird die Epiglottis von der Velarmembran gelöst, so dass der Kehlkopf teilweise sichtbar wird. - Auf evozierte Schwalben während der Entkopplung von Velum/Epiglottis achten.
- Identifizieren Sie Schwalben als abrupte, kurze hintere Zungenverschiebungen in Richtung des harten Gaumens. Diese Bewegung tritt typischerweise synchron mit einer kurzen Unterkieferbewegung/-senkung auf und bietet somit ein Surrogat für die Identifizierung des Schluckens, wenn die hintere Zunge im Sichtfeld des Endoskops nicht ohne weiteres sichtbar ist.
- Identifizieren Sie auch Schlucken über die Zungen-EMG-Burst-Aktivität in Verbindung mit kurzen apnoischen Episoden in der elektrophysiologischen Aufzeichnung, die beide synchron mit den glottischen Verschlussereignissen im Endoskopievideo auftreten.
- Im Falle von schnellem, wiederholtem Schlucken, das auf eine unzureichende Anästhesie (d. h. zu leicht) hinweist, wiederholen Sie die Dosis und warten Sie ~5-10 Minuten, bevor Sie fortfahren. Warten Sie mindestens 20 Minuten nach der vorherigen Ketamin-Erhaltungsinjektion, um eine Übersedierung und Abschaffung des Schluckens zu vermeiden.
- Betrachten Sie die Narkosetiefe als optimal, wenn bei der velar-epiglottischen Entkopplung nur wenige Schlucke hervorgerufen werden.
- Wenn das Schlucken aufgehoben wird, ist die Anästhesie zu tief, um den Schutz der Kehlkopf-Atemwege zu beurteilen. Warten Sie in diesem Fall 5-10 Minuten, bis sich der Ketaminstoffwechsel eingestellt hat, bevor Sie mit der Nahdarstellung des Kehlkopfes fortfahren.
3. Ungehinderte Videoaufzeichnung der Kehlkopfbewegung während der Atmung und des evozierten Schluckens aus nächster Nähe
HINWEIS: Die synchrone elektrophysiologische Aufzeichnung von Atmung, Schlucken und Schluck-Atem-Koordination ist ebenfalls eine Option.
- Schieben Sie das Endoskop langsam zwischen Velum und Epiglottis vor, während Sie den Kehlkopf in der Mitte des Sichtfeldes halten (Abbildung 5A-C).
HINWEIS: Die Endoskopspitze lässt sich ohne Krafteinwirkung leicht durch die velar-epiglottische Öffnung führen. Andernfalls brechen Sie den Eingriff ab, um mögliche Schäden für das Tier zu vermeiden. Es ist möglich, den Kehlkopf aus der Ferne zu visualisieren, wobei sich die Endoskopspitze im Hypopharynx befindet. Dieser Ansatz erfordert jedoch in der Regel eine manuelle Retraktion der Epiglottis, des Velums und/oder der Zunge, um die Visualisierung des Kehlkopfes zu verbessern. Teile des Kehlkopfes bleiben jedoch in der Regel unsichtbar, und die Retraktionsvorrichtungen können die Kehlkopfbewegung einschränken, was als Funktionsstörung missverstanden werden kann. - Schieben Sie das Endoskop weiter vor, um eine ungehinderte Nahansicht der gesamten ventral-dorsalen und lateralen Abmessungen des Kehlkopfes in einem einzigen Sichtfeld zu erhalten (Abbildung 5C).
HINWEIS: Die ventrale Kommissur kann durch die Epiglottis blockiert sein, insbesondere bei jüngeren/kleineren Mäusen. In diesen Fällen kann der Versuch, die Endoskopspitze aggressiver zu manipulieren, um die ventrale Kommissur sichtbar zu machen, die Kehlkopfbewegung einschränken, was als Funktionsstörung missverstanden werden kann. Es kann auch den Kehlkopfluftstrom blockieren, was zum Ersticken führt. - Beobachten Sie die oszillatorische Bewegung des Kehlkopfes, während jedes Atemzyklus beim Einatmen (Glottumweitung) und Ausatmen (Glottumverengung).
HINWEIS: Die Geschwindigkeit und das Ausmaß der Kehlkopf-/Glottalbewegung können mit der Anästhesietiefe variieren. Bei gesunden Nagetieren bleibt jedoch typischerweise ein Glottusspalt (d. h. der Luftraum zwischen den linken/rechten Arytenoiden und den Stimmlippen) während des gesamten Atmungszyklus sichtbar.- Wenn eine ausgeprägte Glottenverengung festgestellt wird, passen Sie die Position des Endoskops an, um einen ungehinderten Luftstrom durch die oberen Atemwege zu gewährleisten. Vermeiden Sie zum Beispiel Druck auf das Velum, der zu einer Verstopfung der Nasenwege durch das Weichgewebe führen kann. Vermeiden Sie es auch, die Endoskopspitze in den Glottusraum einzuführen, da dies den Kehlkopfluftstrom blockieren und zum Ersticken führen kann. Wenn in seltenen Fällen die Atmung aussetzt, führen Sie nach dem Entfernen des Endoskops mehrere mittelsternale Thoraxkompressionen (mit einem Finger) oder eine Überdruckbeatmung (mit einem Miniatur-"Reanimationsbeutel") durch.
- Aufzeichnung der Atembewegung des Kehlkopfes für 30-60 s für Post-hoc-Auswertungszwecke.
- Während sich der Kehlkopf noch in Nahaufnahme befindet, passen Sie die Endoskopspitze im Kehlkopfeingang leicht an, um eine mechanische Stimulation auf die Schleimhaut über dem Velum und/oder der Epiglottis auszuüben und bei optimal betäubten Nagetieren das Schlucken hervorzurufen.
- Verwenden Sie Anpassungen der Endoskopspitze auf Mikroebene (d. h. ~1 mm in jede Richtung), um Schleimhautverletzungen und/oder Obstruktion der Atemwege zu vermeiden.
- Achten Sie auf evozierte Schlucken, die leicht als abrupte glottische Verschlussereignisse identifiziert werden können, die synchron mit der sichtbaren Kieferdepression, der EMG-Platzaktivität der Zunge und der kurzen (<1/2 s) Apnoe auftreten, die in der Atemwegsspur sichtbar ist.
HINWEIS: Glottische Verschlussereignisse ohne gleichzeitig auftretende Kieferbewegung können auftreten; In diesen Fällen ist der glottische Verschluss jedoch in der Regel unvollständig. Wir vermuten, dass es sich dabei um andere Atemwegsschutzreflexe (z. B. Kehlkopfadduktorenreflex) handeln könnte, die entstehen, wenn die Anästhesie nachlässt; Es handelt sich jedoch um seltene/inkonsistente Vorkommnisse, die weitere Untersuchungen erfordern. - Wiederholen Sie den Vorgang, bis 5-10 Schwalben pro Tier hervorgerufen und ein Video aufgezeichnet wurden. Wenn das Schlucken aufgehoben ist, entfernen Sie das Endoskop und warten Sie 5-10 Minuten, bis der Ketaminstoffwechsel eingetreten ist, bevor Sie fortfahren.
- Ziehen Sie das Endoskop vorsichtig in den Oropharynx ein, aber entfernen Sie es nicht und zentrieren Sie den Hypopharynx im Sichtfeld, um den Epiglottis und das Velum sichtbar zu machen.
- Koppeln Sie das Velum und die Epiglottis wieder an, um die Nasenatmung wieder aufzunehmen, indem Sie mit einem Mikrotupfer leichten Druck auf den Zungengrund ausüben, um das Schlucken und erneute Einklemmen der Epiglottis unter der Velarmembran hervorzurufen. Wenn die Rekopplung nicht innerhalb weniger Versuche erfolgt, fahren Sie mit der Anästhesiewiederherstellung ohne erneute Kopplung fort, um das Risiko einer Kehlkopfverletzung zu vermeiden.
- Stoppen Sie die Endoskopie (und Elektrophysiologie) Aufzeichnung.
- Verwenden Sie ein in Kochsalzlösung getränktes Wattestäbchen, um die Zunge und die mittleren Schneidezähne zu befeuchten und die Zunge wieder in ihre anatomische Position in der Mundhöhle zu bringen.
- Nehmen Sie die Ohrbügel ab und entfernen Sie den Temperaturfühler, den Atemsensor und die EMG-Elektroden vom Nagetier, um mit der Wiederherstellung der Anästhesie fortzufahren.
4. Wiederherstellung der Anästhesie
- Setzen Sie das Tier in einen vorgewärmten Auffangkäfig (d. h. den gleichen wie den Induktionskäfig) auf die "Wärmestation", um sich von der Narkose zu erholen.
- Tragen Sie erneut Augenschmiermittel auf, um ein Austrocknen zu verhindern.
- Verabreichen Sie erwärmte Kochsalzlösung SC zur Flüssigkeitshydratation: bis zu 5 ml für Ratten und bis zu 0,5 ml für Mäuse.
- Verabreichen Sie Atipamezol SC zur Umkehrung von Xylazin und zur Erhöhung des Atemantriebs: 1-2 mg/kg bei Ratten und Mäusen.
- Beginnen Sie mit 2 mg/kg Atipamezol, unmittelbar gefolgt von einer manuellen Stimulation entlang des Rückens und des Magens des Nagetiers, um die Genesung zu beschleunigen.
HINWEIS: Bei diesem Ansatz beginnt die spontane Kopfbewegung in der Regel innerhalb von 1-3 Minuten. Die Rückkehr in den ambulanten Status dauert jedoch aufgrund individueller Unterschiede in der Regel durchschnittlich 2 h (zwischen 1 und 5 h) nach einer Laryngoskopie unter KX-Anästhesie. - Geben Sie zusätzliches Atipamezol in einer Dosierung von 1 mg/kg (mindestens 15 Minuten nach der ersten Injektion), wenn die spontane Körperbewegung innerhalb der ersten 15-30 Minuten nach der Narkoseerholung abnimmt, anstatt zuzunehmen, trotz häufiger manueller Stimulation.
- Fahren Sie mit der Verabreichung von Doxapram (5 mg/kg IP für Ratten und Mäuse) fort, wenn die Spontanaktivität weiterhin abnimmt. Wiederholen Sie die Dosis mit diesem "Notfallrettungsmittel" in Abständen von 10-15 Minuten (bis zu fünf Dosen), bis eine spontane Bewegung auftritt. Wenn Nagetiere tot bleiben, schläfern Sie die Tiere mit zugelassenen Euthanasiemethoden ein (z. B. eine Überdosis Ketamin, gefolgt von einer sekundären Methode wie Enthauptung).
- Beginnen Sie mit 2 mg/kg Atipamezol, unmittelbar gefolgt von einer manuellen Stimulation entlang des Rückens und des Magens des Nagetiers, um die Genesung zu beschleunigen.
- Überwachen Sie sich erholende Nagetiere in Abständen von 15 bis 20 Minuten genau, um nachteilige Veränderungen des Atmungsstatus, der Beweglichkeit und der Thermoregulation zu erkennen und bei Bedarf einzugreifen (z. B. manuelle Stimulation, zusätzlicher Sauerstoff, Wärmedecke, Atipamezol oder Doxapram-Injektionen). Häufigere Überwachung von Nagetieren, die ein Eingreifen erfordern.
- Stellen Sie zusätzlichen Sauerstoff (z. B. 1-2 l/min in einer erwärmten Induktionskammer, ohne ISO) für 10-Minuten-Intervalle bereit, je nach Bedarf für Nagetiere mit langwierigen KX-Anästhesie-Erholungszeiten. Alternativ können Sie häufig entlang der dorsalen und ventralen Oberflächen des Tieres stimulieren, um den SpO2-Spiegel (>94%) zu normalisieren.
- Setzen Sie sich erholende Käfiggenossen in denselben Auffangkäfig (bis zu zwei Nagetiere pro Käfig), um eine erhöhte spontane Aktivität und eine schnellere Genesung zu fördern.
- Bringen Sie Nagetiere in ihren beheizten Käfig zurück, wenn sie sich spontan im Auffangkäfig bewegen können.
- Bringen Sie die Standard-Futter- und Wasserflasche in den Käfig zurück. Stellen Sie keine besonderen Vorkehrungen für den Zugang zu Nahrung/Wasser bereit, während die Anästhesie noch nachlässt, um das Erstickungs-/Aspirationsrisiko zu minimieren.
- Beobachten Sie die Aktivität im Käfig und entfernen Sie alle Hindernisse, die das Gehen behindern (z. B. Hütte, PVC-Rohr).
- Stellen Sie den Heimkäfig für die nächsten 12-16 Stunden (d. h. über Nacht) halb auf, halb außerhalb der Wärmestation.
HINWEIS: Ein früheres Absetzen der zusätzlichen Wärme kann aufgrund von Unterkühlung zum Tod führen.
- Führen Sie am nächsten Morgen standardmäßige Zustandsprüfungen durch. Bringen Sie die Tiere mit der Wiederaufnahme der normalen/Ausgangsaktivität, der Körperfunktionen (z. B. Thermoregulation, Fressen, Trinken, Urinieren, Stuhlgang) und des stabilen Gewichts (d. h. Halten oder Zunehmen) mit routinemäßiger täglicher Gesundheitsüberwachung auf die Standard-Vivariumbedingungen zurück. In dem seltenen Fall, dass Nagetiere ihre Aktivität, ihre Körperfunktionen oder ihr Körpergewicht vermindert haben, setzen Sie die zusätzliche Wärme für einen weiteren Tag fort.
HINWEIS: Bei Ratten ist es üblich, dass Porphyrin-Flecken um beide Augen herum ~3-6 Stunden nach Beginn der Anästhesie-Erholungsphase plötzlich auftreten. Die Verfärbung verschwindet in der Regel innerhalb von 24 Stunden.
5. Objektive Quantifizierung der Kehlkopfbewegung beim Atmen im Vergleich zum Schlucken
- Verwenden Sie eine Videobearbeitungssoftware mit einer Bild-für-Bild-Analysefunktion, um die Endoskopievideos anzusehen.
- Identifizieren Sie mindestens eine repräsentative 10-20 s Episode der Spontanatmung pro Tier.
- Identifizieren Sie 3-5 repräsentative Schluckereignisse pro Tier.
- Stellen Sie sicher, dass die ausgewählten Atem- und Schluckepisoden/-ereignisse die folgenden Analysekriterien erfüllen: der Kehlkopf zentriert im Sichtfeld der Kamera, wobei alle Kehlkopfstrukturen/-grenzen sichtbar sind (d. h. nicht durch das Velum, die Epiglottis oder überschüssige Speichelsekrete verdeckt sind), ausreichende Beleuchtung (d. h. in der Lage, alle Kehlkopfstrukturen/-grenzen zu sehen) und ohne Kamerabewegungsartefakt (d. h. das Endoskop bewegt sich nicht).
- Analysieren Sie die identifizierten Atem- und Schluckepisoden/-ereignisse mit subjektiven und/oder objektiven Ansätzen.
- Für die subjektive Analyse: Verwenden Sie eine Likert-Skala, um die Kehlkopfbewegung während der Echtzeit- und Bild-für-Bild-Betrachtung mit Hilfe einer Videobearbeitungssoftware subjektiv zu bewerten. Um diesem Protokoll zu folgen, verwenden Sie eine erweiterte Likert-Skala von -2 bis +2, wobei negative Werte eine Kehlkopfbewegung in die entgegengesetzte Richtung als erwartet anzeigen. Schätzen Sie den Schutz der Kehlkopf-Atemwege während des Schluckens, wobei 0 = keine Verringerung der Größe des Glottusspalts (d. h. kein Schutz der Kehlkopf-Atemwege), 1 = eine gewisse Verringerung des Glottusspalts (d. h. unvollständiger Atemwegsschutz) und 2 = vollständige Adduktion der Arytenoide mit nur einem kleinen ventralen Glottusspalt zwischen den Stimmlippen (d. h. vollständiger Atemwegsschutz), wobei negative Werte auf eine paradoxe Kehlkopfbewegung hinweisen.
HINWEIS: Eine Likert-Skala von 0 bis 2 wird häufig in Nagetierstudien verwendet, bei der 0 = keine Bewegung, 1 = etwas Bewegung und 2 = normale Bewegung 17,18,19,20,21,22 ist. Diese Skala berücksichtigt jedoch nicht die paradoxe Kehlkopfbewegung, die häufig nach einer rezidivierenden Verletzung des Kehlkopfnervs (RLN) auftritt10. - Für eine objektive Analyse: Identifizieren Sie vier Schlüsselbilder - 1) das Ruhebild, das der Initiierung der Kehlkopfadduktion unmittelbar vorausgeht (d. h. das Bild vor dem Stimmlippenaddukt), 2) das Bild, in dem die Stimmlippen die Adduktion abgeschlossen haben, 3) das Bild, das unmittelbar vor der Abduktion der Stimmlippen liegt (dies kann sich mit #2 überschneiden) und 4) das Bild, in dem die Stimmlippen vollständig abduziert sind und in eine Ruheposition zurückgebracht werden, um die Atmung wieder aufzunehmen. Verwenden Sie den Zeitstempel dieser vier Schlüsselbilder, um die Dauer der Stimmlippenadduktion (Bild 1 bis Bild 2), des glottischen Verschlusses (Bild 2 bis Bild 3), der Stimmlippenabduktion (Bild 3 bis Bild 4) und der Gesamtschluckdauer (Bild 1 bis Bild 4) zu berechnen. Alternativ kann eine andere vorhandene kommerzielle Software23 verwendet werden, um den Glottalwinkel (d. h. zwischen den Arytenoiden dorsal oder den Stimmlippen ventral) während der maximalen Abduktion und der maximalen Adduktion unter Verwendung von Standbildern17, 18, 24 zu messen. Lassen Sie mindestens zwei geschulte Gutachter diesen Prozess unabhängig voneinander und verblindet durchführen, identifizieren Sie Diskrepanzen zwischen den Gutachtern und erzielen Sie für jede Diskrepanz einen gemeinsamen Konsens.
HINWEIS: Wir haben diese manuelle Frame-by-Frame-Analyse von glottischen Verschlusszeitpunkten (d. h. während der Atemwegsschutzreflexe) zuvor mit kommerzieller Videobearbeitungssoftware bei Nagetieren und Menschen durchgeführt14. Dieser Ansatz ist jedoch ineffizient und ermöglicht nur eine begrenzte Quantifizierung der Kehlkopfbewegungsdynamik. Wir verwenden derzeit eine hauseigene Kehlkopf-Tracking-Software, um eine umfassendere objektive Quantifizierung der Kehlkopfbewegung während der Atmung und der Atemwegsschutzreflexedurchzuführen 22,25,26,27,28,29,30. Die Software verfügt über eine automatisierte Frame-by-Frame-Tracking-Funktion zur objektiven Quantifizierung der links- und rechtsseitigen Kehlkopfbewegung, des Abstands (Amplitude) und des Timings (Frequenz). Wir verwenden diese Parameter, um eine Vielzahl von bewegungsbasierten Messungen abzuleiten, um Kehlkopfdysfunktionen (z. B. Glottalwinkel Maximum/Minimum/Bereich, Kehlkopfbewegungssymmetrie und Synchronität) während der Atmung, des Schluckens und anderer Atemwegsschutzreflexe (z. B. Kehlkopfadduktorenreflex) zu erkennen/quantifizieren. Diese Software befindet sich noch in der Verfeinerung und ist noch nicht kommerziell/öffentlich verfügbar.
- Für die subjektive Analyse: Verwenden Sie eine Likert-Skala, um die Kehlkopfbewegung während der Echtzeit- und Bild-für-Bild-Betrachtung mit Hilfe einer Videobearbeitungssoftware subjektiv zu bewerten. Um diesem Protokoll zu folgen, verwenden Sie eine erweiterte Likert-Skala von -2 bis +2, wobei negative Werte eine Kehlkopfbewegung in die entgegengesetzte Richtung als erwartet anzeigen. Schätzen Sie den Schutz der Kehlkopf-Atemwege während des Schluckens, wobei 0 = keine Verringerung der Größe des Glottusspalts (d. h. kein Schutz der Kehlkopf-Atemwege), 1 = eine gewisse Verringerung des Glottusspalts (d. h. unvollständiger Atemwegsschutz) und 2 = vollständige Adduktion der Arytenoide mit nur einem kleinen ventralen Glottusspalt zwischen den Stimmlippen (d. h. vollständiger Atemwegsschutz), wobei negative Werte auf eine paradoxe Kehlkopfbewegung hinweisen.
Ergebnisse
Die erfolgreiche Anwendung dieses murinen Laryngoskopieprotokolls führt zu einer Nahsichtbarkeit des Kehlkopfes während der Spontanatmung und einem evozierten Schlucken unter gesunden und Krankheitsbedingungen, wie in Abbildung 6 gezeigt. Darüber hinaus kann dieses Protokoll mehrmals an denselben Nagetieren wiederholt werden, um die Kehlkopffunktion/-dysfunktion im Laufe der Zeit untersuchen zu können. Wie in Abbildung 7 gezeigt, haben wir dieses Laryngoskopie-Protokoll erfolgreich 6x über einen Zeitraum von 4 Monaten wiederholt, um das spontane Erholungsmuster in einem chirurgischen Modell der Ratte für RLN-Verletzungen zu untersuchen (Daten noch nicht veröffentlicht). Versuche, eine ISO-Anästhesie anstelle von KX zu verwenden, führten zu einer nahezu Abschaffung des Schluckens (Abbildung 8) bei Nagetieren, die sich einer direkten elektrischen Stimulation des rechten Nervus laryngeus superior unterzogen, um das Schlucken hervorzurufen, wie in unseren früheren Experimentenbeschrieben 31,32. Dies geschah bei einem ISO-Wert von nur 2 %; Die Reduzierung des ISO-Werts unter diesen Wert führte zur Rückkehr der spontanen Bewegung und wurde daher vermieden. Dieser verwirrende Effekt von ISO unterstreicht die Bedeutung der Anästhesieauswahl für die erfolgreiche Anwendung dieses Protokolls.
Bei guter endoskopischer Bildqualität können repräsentative Videoclips von Atmung und Schlucken mit Hilfe von Motion-Tracking-Software analysiert werden, wie in Abbildung 9 gezeigt. Repräsentative Ergebnismessungen, die automatisch von unserer benutzerdefinierten Kehlkopf-Tracking-Software generiert werden, sind in Tabelle 1 aufgeführt. Es ist zu beachten, dass sich mehrere atem- und schluckbezogene Endpunkte zwischen der Ausgangs- und der Post-RLN-Durchtrennung bei ein und derselben repräsentativen Ratte deutlich unterschieden. Während die Glottalwinkel während der Atmung zwischen der Ausgangs- und der Post-RLN-Durchtrennung ähnlich waren, waren die Verhältnisse der Bewegungsamplitude des rechten/linken Kehlkopfes (d. h. das mittlere Bewegungsbereichsverhältnis oder MMRR) und die Häufigkeit (Open-Close-Zyklus-Verhältnis oder OCCR) während der Atmung nach der Durchtrennung niedriger. In ähnlicher Weise war die Schluckdauer nach der RLN-Durchtrennung kürzer.
Wenn synchrone elektrophysiologische Aufzeichnungen (z. B. respiratorisches Pneumogramm und Genioglossus-EMG) erfasst werden, sind mehrere zusätzliche objektive Ergebnismaße für die Korrelation mit Laryngoskopiedaten quantifizierbar. Beispiele für elektrophysiologiebasierte Ergebnismessungen, die für unsere Forschung von Interesse sind, sind in Abbildung 10 zusammengefasst. Wir entwickeln derzeit Algorithmen zur automatisierten Quantifizierung dieser Ergebnismaße.

Abbildung 1: Maus-Endoskopie-Plattform. (A) Seiten- und (B) Draufsichten der kundenspezifischen Maus-Endoskopie-Plattform sind dargestellt, wobei die wesentlichen Komponenten beschriftet sind. Hinweis: Die Tischplatte unter dem Heizkissen ist größenverstellbar. Hier sind die Tischplatten- und Heizkissengrößen gezeigt, die bei Ratten verwendet werden, die leicht entfernt werden können, um eine mausgroße Tischplatte freizulegen, auf der ein kleineres Heizkissen (nicht abgebildet) Platz findet. Ein kundenspezifischer Adapter sichert ein Endoskop an einem Mikromanipulator, der an der Plattformbasis befestigt ist. Dieses strategische Design ermöglicht es, die gesamte Plattform während des Endoskopieverfahrens als Einheit zu bewegen, ohne das Risiko einer Verletzung des Tieres durch versehentliche/unkontrollierte Endoskopbewegungen einzugehen. Der Mikromanipulator ermöglicht Grob- und Mikroverstellungen der Endoskopspitze in mehrere Richtungen, einschließlich x (links/rechts), y (vorne/hinten), z (oben/unten) sowie Drehung um y (Pitch) und z (Gieren). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Otoskop und kundenspezifische Schleuse für die murine Laryngoskopie. (A) Demontierte Komponenten eines kommerziellen Otoskops und einer kundenspezifischen Edelstahlhülle mit Adapter für die murine Laryngoskopie. (B) Im zusammengebauten Zustand ragt die Otoskopspitze 1 mm über die Metallhülle hinaus, kann aber je nach Bedarf um bis zu 5 mm verstellbar werden. Dieses strategische Design erleichtert das Vorschieben der schmalen Otoskopspitze in den Kehlkopfeingang des Nagetiers, während die Metallhülle mit etwas größerem Durchmesser (2,4 mm) das Velum und die Epiglottis ausreichend offen hält, um eine optimale Visualisierung des gesamten Kehlkopfes während der Atmung und des Schluckens zu ermöglichen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
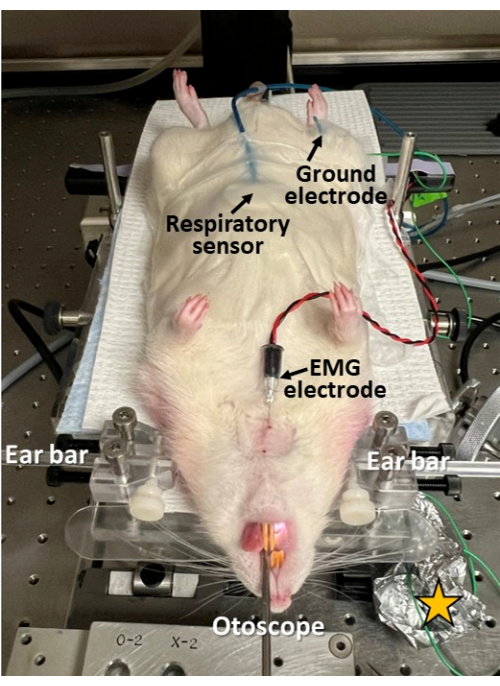
Abbildung 3: Minimalinvasive elektrophysiologische Aufzeichnung während der Endoskopie. Ein Atemsensor wird am Bauch des Nagetiers befestigt; eine EMG-Elektrode wird durch die Haut in den Genioglossus-Muskel der Zunge eingeführt; und eine Masseelektrode wird subkutan an der Hüfte eingeführt. Dieser Ansatz ermöglicht die Untersuchung des Schluckens, der Atmung und der Schluck-Atem-Koordination synchron mit der Endoskopie. Beachten Sie, dass die Haut an den Elektrodeneinführstellen rasiert und gereinigt/desinfiziert wird. Gelber Stern = Aluminiumfolie, die um die Verbindungsstellen der Elektrodenleitung gewickelt wird, um das Signal-Rausch-Verhältnis in den elektrophysiologischen Aufzeichnungen zu verbessern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Transorale Endoskopie zur Darstellung des Kehlkopfes aus der Ferne. (A) Nach dem sanften Zurückziehen der Zunge mit einem leichten Fingergriff wird das Endoskop zwischen Zunge und mittleren Schneidezähnen an der Position des roten Sterns eingeführt (d.h. auf der gleichen Seite wie die eingezogene Zunge, um die anatomische Ausrichtung mit dem Endoskopschaft beizubehalten). (B) Wenn das Endoskop am harten Gaumen vorbei vorgeschoben wird, (C) kommen die Epiglottis und das Velum in Sicht. (D) Um die Stimmritze sichtbar zu machen, müssen Velum und Epiglottis durch Druck auf die Oberfläche des Velums (an der Stelle des schwarz umrandeten Sterns in Bild C) "entkoppelt" werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
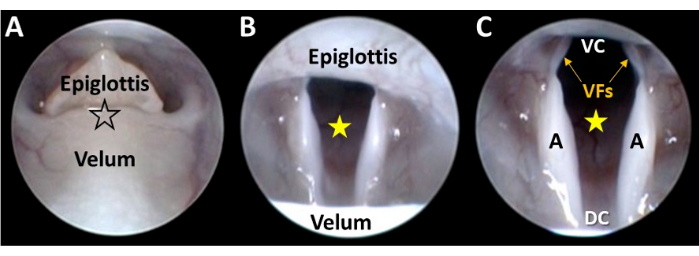
Abbildung 5: Endoskopische Nahdarstellung des Kehlkopfes. (A) Die Endoskopspitze wird über eine Mikromanipulatorsteuerung zwischen dem entkoppelten Velum und der Epiglottis (an der Stelle des schwarz umrandeten Sterns) sanft geführt. Wenn sich das Endoskop bewegt, kommt (B) der Kehlkopf in Sicht und der Glottusraum (gelber Stern) wird durch Mikromanipulator-Einstellungen im Sichtfeld der Kamera zentriert. (C) Die kontinuierliche Weiterentwicklung des Endoskops durch den Mikromanipulator führt zu einer Visualisierung der gesamten ventral-dorsalen und lateralen Dimensionen des Kehlkopfes. Abkürzungen: VC = ventrale Kommissur des Kehlkopfes (d.h. der ventrale Verbindungspunkt zwischen den Stimmlippen); DC = dorsale Kommissur des Kehlkopfes (d.h. der dorsale Verbindungspunkt zwischen den Arytenoiden); VFs = Stimmlippen; A = Arytenoid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Visualisierung des murinen Kehlkopfes beim Atmen und Schlucken. Repräsentative endoskopische Bilder, die die Kehlkopfbewegung während des Atmens und Schluckens bei einer adulten Sprague-Dawley-Ratte (A-C) vor und (D-F) nach chirurgischer Durchtrennung des rechten RLN zeigen. Es ist zu beachten, dass die Ruhehaltung des Kehlkopfes nach einer RLN-Verletzung im Vergleich zu (A) zu Studienbeginn unverändert erscheint (D). (B,E) Während der maximalen Inspiration wird die Kehlkopfasymmetrie nach einer RLN-Verletzung offensichtlich. Anstelle von beiden Arytenoiden, die abduzieren, um den Glottalraum zu vergrößern (gelber Stern), (B), wie zu Studienbeginn gezeigt, (E), erscheinen das ipsilaterale (rechte) Arytenoid (schwarzes Sternchen) und die Stimmlippe während des gesamten Atemzyklus nach einer RLN-Verletzung immobilisiert. Auch beim Schlucken zeigt sich eine rechtsseitige Asymmetrie. (C) Zu Studienbeginn nähern sich die Arytenoide während des Schluckens an der Mittellinie an und hinterlassen einen kleinen ventralen Glottusspalt zwischen den Stimmlippen. (F) Nach einer RLN-Verletzung bewegen sich das ipsilaterale Arytenoid und VF während des Schluckens paradoxerweise (d. h. in die gleiche Richtung wie die nicht betroffene Seite, roter Pfeil) und hinterlassen einen großen Glottusspalt (gelber Stern), der sich von der ventralen zur hinteren Kehlkopfkommissur erstreckt. (F) Dieses Bild liefert einen direkten Beweis für einen beeinträchtigten Schutz der laryngealen Atemwege in einem Rattenmodell für iatrogene RLN-Verletzungen. (C,F) Beachten Sie, dass sich der Kehlkopf während des Schluckens dem Endoskop annähert, was dadurch angezeigt wird, dass die Epiglottis und das Velum im Sichtfeld der Kamera nicht mehr sichtbar sind. Schwarze Pfeile zeigen die Richtung der normalen Kehlkopfbewegung an, während der rote Pfeil eine paradoxe Bewegung anzeigt; gelber Stern = Glottalraum. Abkürzungen: VFs = Stimmlippen; A = Arytenoid; RLN = Nervus laryngeus recurrens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Mit Hilfe der seriellen Laryngoskopie zur Untersuchung der Kehlkopfdysfunktion beim Atmen und Schlucken in einem Rattenmodell für iatrogene RLN-Verletzungen. Eine Likert-Skala von -2 bis +2 wurde verwendet, um die Entfernung und Richtung der Kehlkopfbewegung bei acht erwachsenen Sprague-Dawley-Ratten über einen Zeitraum von 4 Monaten zu schätzen. Nach der Baseline-Laryngoskopie wurden die Ratten einem chirurgischen Eingriff unterzogen, um das rechte RLN zu transektieren, gefolgt von einer seriellen Laryngoskopie 1 Woche nach der Operation und dann erneut in Abständen von 1 Monat von 1 bis 4 Monaten nach der Operation. Alle acht Ratten überlebten den Eingriff und zeigten damit die Wirksamkeit unseres Anästhesieschemas für die serielle Laryngoskopie. (A) Die Videos wurden in Echtzeit und Bild für Bild/Zeitlupe analysiert, um die Kehlkopfbewegung während der Atmung zu quantifizieren, wobei 0 = keine Bewegung, 1 = etwas Bewegung und 2 = normaler Bewegungsabstand der betroffenen (rechten) Seite im Vergleich zur intakten (linken) Seite. (B) Für das Schlucken wurde die Größe des Glottusspalts wie folgt geschätzt: 0 = keine Verringerung der Glottuslückengröße (d. h. kein Schutz der Kehlkopfatemwege), 1 = eine gewisse Verkleinerung des Glottusspalts (d. h. unvollständiger Atemwegsschutz) und 2 = vollständige Adduktion der Arytenoide, mit nur einem kleinen ventralen Glottusspalt zwischen den Stimmlippen (d. h. vollständiger Atemwegsschutz). Negative Werte für Atmung und Schlucken deuten auf eine Kehlkopfbewegung in die entgegengesetzte Richtung als erwartet hin (d. h. paradox). Es ist zu beachten, dass nach einer RLN-Verletzung sowohl die Atmung als auch das Schlucken negativ beeinflusst wurden. Interessanterweise war der Schutz der Kehlkopf-Atemwege zum Zeitpunkt von 1 WPS vollständig (wenn auch paradox), verschlechterte sich danach aber und reichte von keinem Schutz bis hin zu unvollständigem Schutz. Abkürzungen: WPS = Woche nach der Operation; MPS = Monate nach der Operation; RLN = Nervus laryngeus recurrens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Durch ISO gehemmtes Schlucken bei Nagetieren. (A) Bild eines Nagetiers, das sich einer Laryngoskopie unter ISO-Anästhesie unterzieht, mit markierten Komponenten des speziell für diesen Zweck entwickelten ISO-Verabreichungssystems. Ein wichtiger Nachteil dieses innovativen Ansatzes ist das Risiko, dass das Personal der ISO ausgesetzt ist. (B) Ein weiterer Nachteil dieses Ansatzes ist die ISO-Unterdrückung des Schluckens. Dieses nebeneinander liegende Boxplot und Scatterplot fasst unveröffentlichte Daten zusammen, die die Wirkung der ISO- und KX-Anästhesie bei Mäusen (9 pro Gruppe) vergleichen, die sich einer direkten elektrischen Stimulation des rechten Nervus laryngeus superior unterzogen, um das Schlucken hervorzurufen. Hier ist die Anzahl der Schwalben dargestellt, die während eines 5-minütigen Versuchs hervorgerufen wurden, der aus 20 s Zügen mit 20 Hz Stimulation und 10 s Pause bestand. Im Vergleich zu KX hatten Mäuse, die mit ISO (bis zu 2%) anästhesiert wurden, signifikant weniger Schlucken (p < 0,001, unabhängige Proben t-Test), und das Schlucken wurde sogar bei 4/9 Mäusen aufgehoben. Ähnliche Ergebnisse ergaben sich aus nicht-chirurgischen Experimenten mit Mäusen und Ratten (Daten nicht gezeigt). Abkürzungen: ISO = Isofluran; KX = Ketamin-Xylazin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 9: Objektive Quantifizierung der murinen Kehlkopfbewegung mittels Tracking-Software. Die gleichen Bilder aus Abbildung 6 , die das Atmen und Schlucken bei einer Ratte zu Studienbeginn im Vergleich zu einer RLN-Verletzung zeigen, sind hier zu sehen, wobei die Kehlkopfbewegungsverfolgungslinien von unserer speziellen Software hinzugefügt wurden. Tracking-Linien wurden dem ersten Video-Frame entlang des medialen Randes der Arytenoide manuell hinzugefügt, um die linke (blaue Linie) und rechte (rote Linie) Kehlkopfbewegung in den verbleibenden Video-Frames automatisch zu verfolgen. Entsprechende Kehlkopfbewegungsdiagramme, die von unserer benutzerdefinierten Software aus 2,5-s-Videoclips generiert wurden, zeigen die individuelle Links-/Rechtsbewegung im Vergleich zur abgeleiteten globalen Kehlkopfbewegung, mit Beschriftungen, die (A,D) der Kehlkopf-Ruhehaltung, (B,E) der maximalen Glottuslücke während der Inspiration und (C,F) dem glottischen Verschluss während des Schluckens entsprechen. Beachten Sie die paradoxe Bewegung der rechten Seite (rote Pfeile) nach einer RLN-Verletzung sowie die große Glottallücke, die in der entsprechenden abgeleiteten globalen Bewegungskurve gezeigt wird. Repräsentative Ergebnismaße sind in Tabelle 1 enthalten. Abkürzung: RLN = Nervus laryngeus recurrens. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 10: Elektrophysiologie-basierte Ergebnismaße zur Korrelation mit Laryngoskopie-Daten. (A) Elektrophysiologische Aufzeichnungen während des Atmens und Schluckens sind für eine gesunde Ratte dargestellt. Das obere Fenster zeigt eine Atemspur (von einem Atemsensor, der an den Bauch des Nagetiers geklebt wurde), das mittlere Fenster zeigt die EMG-Aktivität im Musculus genioglossus und das untere Fenster zeigt die gefilterte EMG-Aktivität. Beachten Sie das rhythmische Atmungs- und EMG-Muster während der Atmung, das während des Schluckens unterbrochen wird. Schluckereignisse lassen sich leicht durch eine gezackte Bewegung in der Atmungsspur (schwarze Pfeile) erkennen, auf die unmittelbar eine kurze Apnoe folgt (rotes Sternchen). (B) Ein erweitertes Fenster des gestrichelten rechteckigen Kästchens in A zeigt, wie mehrere Ergebnismaße aus den elektrophysiologischen Aufzeichnungen quantifiziert werden. (A) Beachten Sie, dass während der Inspiration (gelbe Felder) die Atmungsspur (oberes Fenster) im Vergleich zur EMG-Bursting-Aktivität um ~150 ms verzögert ist (blauer Doppelpfeil), was die zeitlichen Unterschiede zwischen den beiden elektrophysiologischen Methoden hervorhebt. Zu den repräsentativen elektrophysiologisch basierten Ergebnismaßen gehören: 1) die Dauer der inspiratorischen Phase (i); 2) interrespiratorisches Intervall (ii, berechnet über die respiratorischen und gefilterten EMG-Kanäle); Schluckfläche unter der Kurve (iii); und Schluckapnoe (iv; berechnet über die respiratorischen und gefilterten EMG-Kanäle). Abkürzung: EMG = Elektromyographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Ergebnis-Messgrößen | Grundlinie | Verletzung nach RLN | |
| Atmung | Minimaler Glottalwinkel (Grad) | 34.5 | 34.6 |
| Maximaler Glottalwinkel (Grad) | 52.9 | 49.9 | |
| Durchschnittlicher Glottalwinkel (Grad) | 43.7 | 42.2 | |
| Mittleres Bewegungsbereichsverhältnis (MMRR) | 1.26 | 0.29 | |
| Öffnungs-Schließ-Zyklus-Verhältnis (OCCR) | 1 | 0.11 | |
| Hinunterschluckend | Adduktion des Kehlkopfes (ms) | 200 | 233 |
| Dauer des Glottenverschlusses (ms) | 67 | 0 | |
| Kehlkopfabduktion (ms) | 233 | 67 | |
| Gesamtschluckdauer (ms) | 500 | 300 | |
Tabelle 1: Repräsentative Ergebnismaße, die automatisch von einer benutzerdefinierten Kehlkopf-Tracking-Software generiert werden. Abkürzung: RLN = Nervus laryngeus recurrens.
Ergänzender Text über die Laryngoskopie-Plattform. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Wir haben erfolgreich ein replizierbares murinspezifisches Laryngoskopieprotokoll entwickelt, das eine Nahaufnahme der Kehlkopfbewegung beim Atmen und Schlucken ermöglicht. Wichtig ist, dass das Protokoll im Laufe der Zeit an denselben Tieren durchgeführt werden kann, um die Auswirkungen verschiedener pathologischer Zustände speziell auf die Kehlkopffunktion zu untersuchen. Dieses Protokoll wurde in den letzten zehn Jahren entwickelt und im Laufe der Zeit erheblich modifiziert und Fehlerbehebungen unterzogen. Die Optimierung der Anästhesie war die größte Herausforderung, die es zu bewältigen galt, um eine Überdosierung zu verhindern, die das Schlucken überflüssig macht und/oder die durch Atemnot verursachte Mortalität gefährdet. Wir verwendeten zunächst ISO, was zur Abschaffung des Schluckens, der übermäßigen Speichelproduktion (die die endoskopische Visualisierung behindert) und des Risikos einer Exposition des Personals führte, was als ernsthafte Kontraindikationen gegen die Verwendung von ISO für dieses Verfahren gilt. Wir haben uns daher auf KX konzentriert, da es ein häufig verwendetes Nagetieranästhetikumist 33,34,35.
Wir begannen unsere Protokollentwicklung mit Mäusen 14,22,29,30,36 unter Verwendung eines Sialendoskops, da es im Vergleich zu anderen potenziell geeigneten Endoskopen (1,1 mm) einen kleineren Schaftdurchmesser (1,1 mm) hatte. Wichtig ist, dass das Sialendoskop über einen Arbeitskanal verfügt, den wir zunächst zur Abgabe von Luftimpulsen zur Evokation/Untersuchung des Kehlkopfadduktorenreflexes14 verwendet haben. Wir fanden jedoch, dass der Kehlkopfadduktorenreflex bei Mäusen und Ratten oft vermindert/aufgehoben war, höchstwahrscheinlich aufgrund einer Vollnarkose und/oder einer Inaktivierung von Kehlkopf-/Pharynxrezeptoren als Folge der Schleimhauttrocknung durch wiederholte Luftimpulsabgabe. Obwohl der Kehlkopfadduktorenreflex in unseren Studien nicht zuverlässig hervorgerufen werden konnte, blieb das Schlucken überraschenderweise bestehen und wurde durch mechanische Stimulation am/in der Nähe des Kehlkopfeingangs leicht evoziert. Aus diesem Grund haben wir unseren Fokus auf die endoskopische Analyse des mechanisch evozierten Schluckens verlagert.
Dabei verzichteten wir auf das halbstarre Sialendoskop, das anfällig für Brüche war und eine unzureichende Beleuchtung und Bildauflösung aufwies, um die Kehlkopfbewegung zuverlässig zu visualisieren und zu analysieren. Bei der Erforschung zahlreicher alternativer Endoskope haben wir uns schließlich für ein spezifisches Otoskop entschieden, das sowohl für die Laryngoskopie bei Mäusen als auch bei Ratten geeignet ist. Basierend auf unserer Erfahrung ist das wichtigste Merkmal bei der Auswahl eines geeigneten Endoskops für die murine Laryngoskopie ein Schaftdurchmesser von weniger als 2 mm , der ausreichend helles Licht für eine qualitativ hochwertige Videoaufnahme durchlassen kann. Endoskope mit größerem Durchmesser können bei Mäusen und Ratten nicht ohne weiteres durch den Kehlkopfeingang gelangen, um die Kehlkopfbewegung aus der Nähe sichtbar zu machen. Otoskope eignen sich aufgrund ihrer hervorragenden Lichtdurchlässigkeit, ihres steifen/langlebigen Designs und ihrer relativ geringen Kosten im Vergleich zu anderen Arten von Endoskopen (z. B. Sialendoskop, flexibles Endoskop) besonders gut für diesen Zweck. Während die manuelle Steuerung des Endoskops in stabilen Händen eine Option ist, betrachten wir die Steuerung des Mikromanipulators als ein wesentliches Merkmal dieses Laryngoskopie-Protokolls. Wichtig ist, dass die Mikromanipulatorsteuerung des Endoskops eine stabile Videoaufzeichnung der Kehlkopfbewegung durch einen einzelnen Forscher für die anschließende Quantifizierung ermöglicht. Bisher haben wir dieses otoskopbasierte Protokoll erfolgreich bei erwachsenen Mäusen und Ratten eingesetzt. Wir vermuten, dass Endoskope mit kleinerem Durchmesser für die Durchführung von Laryngoskopien bei jüngeren/kleineren Nagetieren unerlässlich sein werden.
Ein neuartiger Vorteil unseres Laryngoskopie-Protokolls ist die Möglichkeit, den Atemwegsschutz während des Schluckens bei Nagetieren sichtbar zu machen, was beim Menschen aufgrund der epiglottischen Inversion über dem Kehlkopfeinlass, die die Sicht auf die Stimmritze behindert, nicht möglich ist. Nagetiere bieten daher eine einzigartige Gelegenheit, die Mechanismen des normalen und pathologischen Schutzes der Kehlkopf-Atemwege spezifisch zu untersuchen, um letztendlich Behandlungen zur effektiven Wiederherstellung der normalen Kehlkopffunktion zu finden. Diese einzigartige Fähigkeit dieses murinen Laryngoskopie-Protokolls ist ein großer Vorteil gegenüber der Videofluoroskopie (d. h. dem anderen "Goldstandard"-Test für Dysphagie), die in den zahlreichen Nagetiermodellen der Dysphagie, die wir bisher entwickelt/identifiziert haben, keine Aspiration erkennen konnte 30,36,37,38,39,40. Dieser negative VFSS-basierte Befund kann auf mehrere anatomische Unterschiede in den oberen Atemwegen von Nagetieren zurückgeführt werden, die durch unseren transoralen endoskopierischen Ansatz sichtbar werden. Zunächst wird der Kehlkopf des Nagetiers hoch im Nasopharynx positioniert, wo er von einer eng gekoppelten Epiglottis und einem Velum verdeckt wird, die eine Sackgasse in der Mundhöhle bilden. Zusätzlich ist die Epiglottis im Ruhezustand unter einer Schleimhautscheide eingeklemmt, die über dem Velum liegt. Diese anatomische Konfiguration führt dazu, dass Nagetiere obligate Nasenatmer sind; Daher ist die Mundatmung bei wachen Nagetieren ein Zeichen für Atemwegsmorbidität. Beim Schlucken bei gesunden Nagetieren rutscht die Epiglottis jedoch aus der Schleimhautscheide heraus und dreht sich über den Kehlkopfeinlass, während sich der Kehlkopf weiter in den Nasopharynx erhebt, aus dem Weg des Bolus. Diese dynamischen Ereignisse der oberen Atemwege können mittels Laryngoskopie bei gesunden Nagetieren und Modellen der Kehlkopfdysfunktion direkt visualisiert/beurteilt werden.
Wichtig ist, dass wir gezeigt haben, dass Nagetiermodelle, obwohl sie während des VFSS-Tests nicht aspiriert wurden, tatsächlich Hinweise auf einen beeinträchtigten laryngealen Atemwegsschutz (d. h. einen unvollständigen Glottusverschluss) durch Laryngoskopie zeigen, der für menschliche Patienten mit Dysphagie-bedingter Aspiration translational ist. Somit bietet dieses murine Laryngoskopie-Protokoll eine nützliche translationale Plattform, um speziell Mechanismen des Atemwegsschutzes und gezielter Behandlungen zu untersuchen, die derzeit noch schwer fassbar sind. Um dieses Ziel zu erreichen, ist eine weitere Entwicklung/Optimierung unserer aktuellen Methode erforderlich, bei der die Endoskopspitze eine unkalibrierte mechanische Stimulation der Kehlkopf-/Rachenschleimhaut ermöglicht, um das Schlucken hervorzurufen. Strengere, präzise kontrollierte Verfahren zur Evokation des Schluckens werden derzeit in unserem Labor erforscht, darunter die direkte elektrische Stimulation des Nervus laryngeus superior32,41 und die chemische (z. B. Zitronensäure42) Stimulation der Kehlkopf-/Rachenschleimhaut. Eine zusätzliche Einschränkung dieses Protokolls ist die Rückenlage der Nager, die kein waches und natürliches Fressverhalten nachahmt. Die anfängliche Protokollentwicklung beinhaltete eine Bauchlagerung, die zu einer eingeschränkten Unterkieferbewegung führte und gleichzeitig die Sicht auf die Mundhöhle einschränkte, was die Endoskoppassage deutlich behinderte. Es ist möglich, den Kehlkopf mit der Endoskopspitze im Hypopharynx aus der Ferne zu visualisieren; Dieser Ansatz erfordert jedoch in der Regel eine manuelle Retraktion der Epiglottis, des Velums und/oder der Zunge, um eine verbesserte Visualisierung des Kehlkopfes zu ermöglichen. Zu diesem Zweck haben wir eine Vielzahl von kundenspezifischen manuellen Retraktionsgeräten hergestellt (z. B. modifizierte Otoskop-Spekula, modifizierte Pipettenspitzen). Teile des Kehlkopfes bleiben jedoch in der Regel unsichtbar, und die Retraktionsvorrichtungen können die Kehlkopfbewegung einschränken, was als Funktionsstörung missverstanden werden kann. Darüber hinaus können neuere zusätzliche Funktionen der Endoskopieplattform (z. B. Trendelenburg-Neigung und ein Ausschnitt zwischen den Ohrbügeln zur Aufnahme von Kieferbewegungen) das Testen von Nagetieren in Bauchlage erleichtern. Ohrbügel und zusätzliche Wärme sind notwendige Bestandteile des Laryngoskopie-Protokolls. Ohrbügel verhindern, dass sich der Kopf während der transoralen Manipulation des Endoskops bewegt. Ein homöothermisches Heizsystem hält die Körpertemperatur zwischen 36 °C und 38 °C, um eine stabile Anästhesie zu fördern und eine Unterkühlung während des gesamten Eingriffs zu verhindern.
Jetzt, da es eine Methode gibt, mit der die Kehlkopfbewegung während des Atmens und Schluckens bei Nagetieren zuverlässig per Video aufgezeichnet werden kann, ist die Hochdurchsatz-Quantifizierung ein wesentlicher nächster Schritt. Aus diesem Grund arbeiten wir kontinuierlich an der Videoanalyse, um festzustellen, welches von unserer benutzerdefinierten Software generierte Ergebnismaß am besten zwischen gesunden und kranken Zuständen unterscheiden kann, und um Veränderungen im Laufe der Zeit als Reaktion auf das natürliche Fortschreiten der Krankheit oder Behandlungsmaßnahmen zu erkennen. Die Top-Kandidaten werden im Mittelpunkt nachfolgender Ansätze des maschinellen Lernens stehen, um die Analyse von Videobildern zu beschleunigen. Wichtig ist, dass Fälle von suboptimaler Bildqualität (z. B. unzureichende Beleuchtung, anatomische Strukturen außerhalb des Sichtfelds, überschüssige Sekrete, die die Kehlkopfstrukturen verdecken usw.) derzeit nicht für die Kehlkopfverfolgung geeignet sind. Diese Barriere kann jedoch in Zukunft durch Tools des maschinellen Lernens überwunden werden. Bis dahin bleibt die sorgfältige Auswahl von Videobildsequenzen, die die Kriterien für die Kehlkopf-Tracking-Analyse erfüllen (wie in Protokollabschnitt 5 beschrieben), von größter Bedeutung.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Diese Arbeit wurde teilweise durch zwei NIH-Zuschüsse finanziert: 1) ein Multi-PI (TL und NN) R01 Stipendium (HL153612) des National Heart, Lung, and Blood Institute (NHLBI) und 2) ein R03-Stipendium (TL, DC0110895) des National Institute on Deafness and Other Communication Disorders (NIDCD). Die Entwicklung unserer kundenspezifischen Kehlkopfbewegungsverfolgungssoftware wurde teilweise durch einen Zuschuss der Coulter Foundation (TL & Filiz Bunyak) finanziert. Wir danken Kate Osman, Chloe Baker, Kennedy Hoelscher und Zola Stephenson für die hervorragende Pflege unserer Labornagetiere. Wir danken auch Roderic Schlotzhauer und Cheston Callais von der MU Physics Machine Shop für ihr Design, ihren Beitrag und die Herstellung unserer kundenspezifischen Endoskopie-Plattform sowie für strategische Modifikationen an kommerziellen Endoskopen und Mikromanipulatoren, um unseren Forschungsanforderungen gerecht zu werden. Unsere maßgeschneiderte Software zur Verfolgung von Kehlkopfbewegungen wurde in Zusammenarbeit mit Dr. Filiz Bunyak und Dr. Ali Hamad (MU Electrical Engineering and Computer Science Department) entwickelt. Wir danken auch Jim Marnatti von Karl Storz Endoscopy für die Beratung bei der Auswahl des Otoskops. Abschließend möchten wir zahlreichen ehemaligen Studenten/Auszubildenden im Lever Lab danken, deren Beiträge die Entwicklung unseres aktuellen murinen Laryngoskopie-Protokolls beeinflusst haben: Marlena Szewczyk, Cameron Hinkel, Abigail Rovnak, Bridget Hopewell, Leslie Shock, Ian Deninger, Chandler Haxton, Murphy Mastin und Daniel Shu.
Materialien
| Name | Company | Catalog Number | Comments |
| Atipamezole | Zoetis | Antisedan; 5 mg/mL | Parsippany-Troy Hills, NJ |
| Bioamplifier | Warner Instrument Corp. | DP-304 | Hamden, CT |
| Concentric EMG needle electrode | Chalgren Enterprises, Inc. | 231-025-24TP; 25 mm x 0.3 mm/30 G | Gilroy, CA |
| Cotton tipped applicator (tapered) | Puritan Medical Products | REF 25-826 5W | Guilford, ME |
| Data Acquisition System | ADInstruments | PowerLab 8/30 | Colorado Springs, CO |
| DC Temperature Control System - for endoscopy platform | FHC, Inc. | 40-90-8D | Bowdoin, ME |
| Electrophysiology recording software | ADInstruments | LabChart 8 with video capture module | Colorado Springs, CO |
| Endoscope monitor | Karl Storz Endoscopy-America | Storz Tele Pack X monitor | El Segundo, CA |
| Glycopyrrolate | Piramal Critical Care | NDC 66794-204-02; 0.2 mg/mL | Bethlehem, PA |
| Ground electrode | Consolidated Neuro Supply, Inc. | 27 gauge stainless steel, #S43-438 | Loveland, OH |
| Isoflurane induction chamber | Braintree Scientific, Inc. | Gas Anesthetizing Box - Red | Braintree, MA |
| Ketamine hydrochloride | Covetrus North America | NDC 11695-0703-1, 100 mg/mL | Dublin, OH |
| Metal spatula to decouple epiglottis and velum | Fine Science Tools | Item No. 10091-12; | Foster City, CA |
| Micro-brush to remove food/secretions from oral cavity | Safeco Dental Supply | REF 285-0023, 1.5 mm | Buffalo Grove, IL |
| Mouse-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2-07 – 5 x 12.5 cm Heating Pad | Bowdoin, ME |
| Ophthalmic ointment (sterile) | Allergan, Inc. | Refresh Lacri-lube | Irvine, CA |
| Otoscope | Karl Storz | REF 1232AA | El Segundo, CA |
| Pneumogram Sensor | BIOPAC Systems, Inc. | RX110 | Goleta, CA |
| Pulse oximetry - Vetcorder Pro Veterinary Monitor | Sentier HC, LLC | Part No. 710-1750 | Waukesha, WI |
| Rat-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2 – 12.5X25cm Heating Pad | Bowdoin, ME |
| Sterile needles for drug injections | Becton, Dickinson and Company | REF 305110, 26 G x 3/8 inch, PrecisionGlide | Franklin Lakes, NJ |
| Sterile syringes for drug injections | Becton, Dickinson and Company | REF 309628; 1 mL, Luer-Lok tip | Franklin Lakes, NJ |
| Surgical drape to cover induction cage for dark environment | Covidien LP | Argyle Surgical Drape Material, Single Ply | Minneapolis, MN |
| Surgical tape to secure pneumograph sensor to abdomen | 3M Health Care | #1527-0, 1/2 inch | St. Paul, MN |
| Transparent blanket for thermoregulation | The Glad Products Company | Press’n Seal Cling Film | Oakland, CA |
| Video editing software | Pinnacle Systems, Inc. | Pinnacle Studio, v24 | Mountain View, CA |
| Water circulating heating pad - for anesthesia induction/recovery station | Adroit Medical Systems | HTP-1500 Heat Therapy Pump | Loudon, TN |
| Xylazine | Vet One | NDC 13985-701-10; Anased, 100 mg/mL | Boise, ID |
Referenzen
- Brunner, E., Friedrich, G., Kiesler, K., Chibidziura-Priesching, J., Gugatschka, M. Subjective breathing impairment in unilateral vocal fold paralysis. Folia Phoniatr Logop. 63 (3), 142-146 (2011).
- Chandrasekhar, S. S., et al. Clinical practice guideline: improving voice outcomes after thyroid surgery. Otolaryngol Head Neck Surg. 148 (6 Suppl), S1-S37 (2013).
- Fang, T. J., et al. Quality of life measures and predictors for adults with unilateral vocal cord paralysis. Laryngoscope. 118 (10), 1837-1841 (2008).
- Wang, W., et al. Laryngeal reinnervation using ansa cervicalis for thyroid surgery-related unilateral vocal fold paralysis: a long-term outcome analysis of 237 cases. PLoS One. 6 (4), e19128 (2011).
- Cohen, S. M., et al. Association between dysphagia and inpatient outcomes across frailty level among patients >/= 50 years of age. Dysphagia. 35 (5), 787-797 (2020).
- Poulsen, S. H., et al. Signs of dysphagia and associated outcomes regarding mortality, length of hospital stay and readmissions in acute geriatric patients: Observational prospective study. Clin Nutr ESPEN. 45, 412-419 (2021).
- Lin, R. J., Smith, L. J., Munin, M. C., Sridharan, S., Rosen, C. A. Innervation status in chronic vocal fold paralysis and implications for laryngeal reinnervation. Laryngoscope. 128 (7), 1628-1633 (2018).
- Choi, J. S., et al. Functional regeneration of recurrent laryngeal nerve injury during thyroid surgery using an asymmetrically porous nerve guide conduit in an animal model. Thyroid. 24 (1), 52-59 (2014).
- Wang, B., et al. Neurotrophin expression and laryngeal muscle pathophysiology following recurrent laryngeal nerve transection. Mol Med Rep. 13 (2), 1234-1242 (2016).
- Woodson, G., Randolph, G. W. Pathophysiology of recurrent laryngeal nerve injury. Surgery of the Thyroid and Parathyroid Glands (Third Edition). , 404-409.e2 (2021).
- James, M., Palmer, O. Instrumentation and techniques for examination of the ear, nose, throat, and sinus. Oral Maxillofac Surg Clin North Am. 24 (2), 167-174 (2012).
- Patel, R. R., et al. Recommended protocols for instrumental assessment of voice: American Speech-Language-Hearing Association Expert Panel to develop a protocol for instrumental assessment of vocal function. Am J Speech Lang Pathol. 27 (3), 887-905 (2018).
- Kamarunas, E. E., McCullough, G. H., Guidry, T. J., Mennemeier, M., Schluterman, K. Effects of topical nasal anesthetic on fiberoptic endoscopic examination of swallowing with sensory testing (FEESST). Dysphagia. 29 (1), 33-43 (2014).
- Shock, L. A., et al. Improving the utility of laryngeal adductor reflex testing: a translational tale of mice and men. Otolaryngol Head Neck Surg. 153 (1), 94-101 (2015).
- Aviv, J. E., et al. Laryngopharyngeal sensory discrimination testing and the laryngeal adductor reflex. Ann Otol Rhinol Laryngol. 108 (8), 725-730 (1999).
- Farneti, D. The instrumental gold standard: fees. J Gastroenterol Hepatol Res. 3, 1281-1291 (2014).
- Hernandez-Morato, I., et al. Reorganization of laryngeal motoneurons after crush injury in the recurrent laryngeal nerve of the rat. J Anat. 222 (4), 451-461 (2013).
- Hernandez-Morato, I., Sharma, S., Pitman, M. J. Changes in neurotrophic factors of adult rat laryngeal muscles during nerve regeneration. Neuroscience. 333, 44-53 (2016).
- Tessema, B., et al. Evaluation of functional recovery of recurrent laryngeal nerve using transoral laryngeal bipolar electromyography: a rat model. Ann Otol Rhinol Laryngol. 117 (8), 604-608 (2008).
- Tessema, B., et al. Observations of recurrent laryngeal nerve injury and recovery using a rat model. Laryngoscope. 119 (8), 1644-1651 (2009).
- Monaco, G. N., et al. Electrical stimulation and testosterone enhance recovery from recurrent laryngeal nerve crush. Restor Neurol Neurosci. 33 (4), 571-578 (2015).
- Haney, M. M., Hamad, A., Leary, E., Bunyak, F., Lever, T. E. Automated quantification of vocal fold motion in a recurrent laryngeal nerve injury mouse model. Laryngoscope. 129 (7), E247-E254 (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Wang, B., et al. Functional regeneration of the transected recurrent laryngeal nerve using a collagen scaffold loaded with laminin and laminin-binding BDNF and GDNF. Sci Rep. 6, 32292 (2016).
- Hamad, A., Haney, M. M., Lever, T. E., Bunyak, F. Automated segmentation of the vocal folds in laryngeal endoscopy videos using deep convolutional regression networks. , 140-148 (2019).
- Wang, Y. Y., Hamad, A. S., Palaniappan, K., Lever, T. E., Bunyak, F. LARNet-STC: Spatio-temporal orthogonal region selection network for laryngeal closure detection in endoscopy videos. Comput Biol Med. 144, 105339 (2022).
- Lever, T. E., et al. Advancing laryngeal adductor reflex testing beyond sensory threshold detection. Dysphagia. 37 (5), 1151-1171 (2022).
- Wang, Y. Y., Hamad, A. S., Lever, T. E., Bunyak, F. Orthogonal region selection network for laryngeal closure detection in laryngoscopy videos. Annu Int Conf IEEE Eng Med Biol Soc. 2020, 2167-2172 (2020).
- Haney, M. M., et al. Recurrent laryngeal nerve transection in mice results in translational upper airway dysfunction. J Comp Neurol. 528 (4), 574-596 (2020).
- Mok, A., et al. A surgical mouse model for advancing laryngeal nerve regeneration strategies. Dysphagia. 35 (3), 419-437 (2020).
- Haney, M. M., Ericsson, A. C., Lever, T. E. Effects of intraoperative vagal nerve stimulation on the gastrointestinal microbiome in a mouse model of amyotrophic lateral sclerosis. Comp Med. 68 (6), 452-460 (2018).
- Lever, T. E., et al. A mouse model of pharyngeal dysphagia in amyotrophic lateral sclerosis. Dysphagia. 25 (2), 112-126 (2010).
- Struck, M. B., Andrutis, K. A., Ramirez, H. E., Battles, A. H. Effect of a short-term fast on ketamine-xylazine anesthesia in rats. J Am Assoc Lab Anim Sci. 50 (3), 344-348 (2011).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress. Altern Lab Anim. 33 (2), 119-127 (2005).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Welby, L., Maynard, T., Zohn, I., Lever, T. Fluoroscopic and endoscopic investigation of dysphagia in a mouse model of DiGeorge syndrome. Dysphagia. 34, 1003-1004 (2019).
- Mueller, M., et al. Impact of limb phenotype on tongue denervation atrophy, dysphagia penetrance, and survival time in a mouse model of ALS. Dysphagia. 37 (6), 1777-1795 (2022).
- Osman, K. L., et al. Optimizing the translational value of mouse models of ALS for dysphagia therapeutic discovery. Dysphagia. 35 (2), 343-359 (2020).
- Lever, T. E., et al. Videofluoroscopic validation of a translational murine model of presbyphagia. Dysphagia. 30, 328-342 (2015).
- Lever, T. E., et al. Adapting human videofluoroscopic swallow study methods to detect and characterize dysphagia in murine disease models. J Vis Exp. (97), 52319 (2015).
- Ballenger, B., et al. Targeted electrical stimulation of the superior laryngeal nerve - a potential treatment for dysphagia in ALS. FASEB J. 36 (S1), (2022).
- Kloepper, A., et al. An experimental swallow evoked potential protocol to investigate the neural substrates of swallowing. OTO Open. 4 (1), (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten