Method Article
微创小鼠喉镜检查用于呼吸和吞咽时喉部运动的特写成像
摘要
该方案描述了一种针对小鼠和大鼠的系列经口喉镜方法,该方法允许使用优化的麻醉方案和微调的内窥镜作技术在呼吸和吞咽过程中对喉部进行特写、无障碍的视频成像。
摘要
喉部是哺乳动物的重要器官,具有三个主要功能——呼吸、吞咽和发声。已知多种疾病会损害喉功能,导致呼吸困难(呼吸困难)、吞咽障碍(吞咽困难)和/或声音障碍(发音困难)。尤其是吞咽困难,可导致吸入性肺炎和相关并发症、反复住院和早期死亡。尽管有这些严重后果,但现有的喉功能障碍治疗方法主要针对手术和行为干预,不幸的是,这些干预通常无法恢复正常的喉功能,因此凸显了对创新解决方案的迫切需求。
为了弥合这一差距,我们一直在开发一种实验性内窥镜方法来研究小鼠(即小鼠和大鼠)模型中的喉功能障碍。然而,啮齿动物的内窥镜检查非常具有挑战性,因为相对于目前的内窥镜技术来说,它们的尺寸很小,上气道的解剖学差异,以及需要麻醉才能最佳地进入喉部。在这里,我们描述了一种新颖的经口喉镜方法,该方法允许对小鼠和大鼠的喉部运动进行近距离、无障碍的视频成像。该方案中的关键步骤包括精确的麻醉管理(以防止过量服用导致吞咽和/或冒着与呼吸窘迫相关的死亡风险)和内窥镜的显微作器控制(用于由单个研究人员稳定地记录喉部运动以进行后续量化)。
重要的是,该方案可以随着时间的推移在同一只动物中执行,以研究各种病理状况对喉功能的影响。该协议的一个新优点是能够在吞咽过程中可视化气道保护,这在人类中是不可能的,因为喉入口的会厌倒置阻碍了声门的视线。因此,啮齿动物提供了一个独特的机会来专门研究正常与病理喉气道保护的机制,以最终发现有效恢复正常喉功能的治疗方法。
引言
喉部是一个软骨器官,位于喉咙呼吸道和消化道的交汇处,在那里它起着阀门机制的作用,精确控制空气的流动和方向(即呼吸和发声期间)与食物和液体的流动和方向(即吞咽期间)。已知影响喉部的疾病多种多样,包括先天性疾病(例如喉软化症、声门下狭窄)、肿瘤性疾病(例如喉状瘤病、鳞状细胞癌)、神经系统疾病(例如特发性喉麻痹、卒中、帕金森病、肌萎缩侧索硬化症)和医源性疾病(例如头部或颈部手术中的意外损伤)。无论病因如何,喉功能障碍通常会导致呼吸困难(呼吸困难)、发音困难(语音障碍)和吞咽困难(吞咽障碍)三联征症状,从而对一个人的经济和社会福利产生负面影响 1,2,3,4。
此外,吞咽困难,尤其是在身体虚弱的个体中,可导致吸入性肺炎(由于食物或液体通过未完全闭合的喉部逸出进入肺部)和相关并发症、反复住院和早期死亡 5,6。尽管有这些严重后果,但现有的喉功能障碍治疗方法主要针对手术和行为干预,这些干预通常不能恢复正常的喉功能 1,2,7,8,9,10,因此凸显了对创新解决方案的迫切需求。为了实现这一目标,我们一直在开发一种实验性内窥镜方法来研究小鼠(即小鼠和大鼠)模型中的喉功能障碍。
在人类医学中,评估喉功能障碍的金标准是内窥镜可视化,称为喉镜检查11,12。通常,将可弯曲的内窥镜穿过鼻子以检查喉部,尤其是声带和邻近的声门上和声门下喉结构。硬质内窥镜也可用于通过口腔观察喉部。这两种方法都允许对喉部解剖结构进行粗略检查,并可用于评估呼吸、发声和各种气道保护性反射(如咳嗽和喉内收肌反射)期间的喉活动度和功能 13,14,15,16。然而,在吞咽过程中,喉部完全被会厌遮挡,因为它倒置以覆盖喉部入口,保护它免受食物/液体团块被吞咽的路径。因此,人类无法直接观察吞咽过程中的喉部运动,因此必须使用其他诊断方法(例如透视、肌电图、声门电图)间接推断。
本文介绍了一种针对小鼠和大鼠的创新喉镜方案,该方案允许在轻度麻醉下吞咽期间对呼吸和气道保护进行近距离、无阻碍的成像。该协议与各种市售内窥镜系统兼容,并结合定制平台,以在整个手术过程中固定麻醉的啮齿动物。重要的是,内窥镜平台的众多设计/配置确实是可能的,具体取决于每个实验室的可用资源和研究议程。我们的目的是为研究人员提供指导,供他们在研究环境中考虑。此外,我们的目标是展示这种喉镜检查方案如何产生大量客观数据,这些数据可能会激发我们对喉功能障碍和再生的理解的新见解。
该小鼠喉镜检查方案中概述的所有步骤的综合作用导致对成年鼠喉进行微创检查,可以在同一只动物中重复进行,以检测和表征随着时间的推移响应医源性损伤、疾病进展和/或相对于气道保护的治疗干预的喉功能障碍。值得注意的是,该协议不评估与发声相关的喉功能。
研究方案
鼠喉镜检查方案遵循经批准的机构动物护理和使用委员会 (IACUC) 方案和美国国立卫生研究院 (NIH) 指南。它被开发用于 100 多只成年 C57BL/6J 小鼠和 50 多只成年 Sprague Dawley 大鼠,两个物种的性别大致相等,年龄为 6 周至 12 个月大。额外的协议开发对于适应年轻/较小的啮齿动物是必要的。动物被分组饲养(根据性别和窝产,每个笼子最多四只老鼠或两只老鼠)。标准动物饲养条件包括严格调节环境温度 (20-26 °C)、湿度 (30%-70%) 和标准 12 h 光照周期的静态笼养。所有动物在每周更换笼子时都接受新鲜的强化材料(例如,小屋/管道、牙科零食、巢箱)。提供无限制的食物和水,但麻醉前的短时间(最多 4-6 小时)食物限制除外,如下所述。兽医和研究人员每天都会监测这些动物。
1. 不消除吞咽的动物麻醉
- 在与啮齿动物打交道时,佩戴适当的个人防护装备(例如手套、口罩),以尽量减少过敏原暴露。
- 麻醉前 4-6 小时限制每个啮齿动物笼的食物,以尽量减少食物在口腔和咽部的滞留,这可能会干扰内窥镜可视化和/或导致手术过程中的食物误吸。
注意:如果啮齿动物没有限制食物,则口腔中的食物滞留是没有吞咽困难的正常发现。 - 为动物的诱导/恢复准备一个“加热站”。
- 在工作台面上将水循环加热垫预热至 37 °C。
- 为被测物种选择合适尺寸的诱导/恢复笼。例如,带有过滤器顶盖的小鼠鞋盒笼的尺寸适合小鼠和大鼠的诱导/恢复。为每只接受测试的动物使用新的诱导/恢复笼;使用单个笼子作为同一动物的诱导笼和恢复笼。
- 在诱导/恢复笼地板上铺上一层薄薄的吸收材料(例如,白杨屑、纸巾、小狗垫),以便在麻醉诱导和恢复期间保暖和吸收身体分泌物。
- 麻醉诱导前,将准备好的笼子(带过滤器顶盖)完全放在加热垫上 30-60 分钟。
注意:这种微环境提供足够的补充热量,以促进诱导和恢复过程中稳定的麻醉代谢。
- 在麻醉诱导前,将动物的家笼放在预热的 37 °C 加热垫上约 30 分钟。
注意:在手术前提供补充热量可能会加速麻醉诱导并防止由于体温过低引起的麻醉代谢减慢/延迟而导致的意外过量。 - 根据物种和体重准备氯胺酮-甲苯噻嗪 (KX) 麻醉剂。
- 对于小鼠:90 mg/kg 氯胺酮和 11 mg/kg 甲苯噻嗪的混合物足以用于任一性别的成年 C57BL/6 背景小鼠的经口喉镜检查。根据其他小鼠品系和年龄调整剂量。
- 对于大鼠:60 mg/kg 氯胺酮和 6 mg/kg 甲苯噻嗪的混合物足以用于任一性别的成年 Sprague Dawley 大鼠的经口喉镜检查。根据其他大鼠品系和年龄调整剂量。
- 在 37 °C 加热站上预热注射器填充的麻醉剂,以防止注射冷液体时动物发生热量损失。
- 使用适当大小的注射器(例如 1 mL)和针头(例如 26 G1/2)用计算的 KX 剂量注射啮齿动物。
- 对于小鼠:进行单次皮下 (SC) 注射。
注意:根据我们的经验,与腹膜内 (IP) 注射相比,小鼠 SC 注射可降低/消除与麻醉相关的死亡率。 - 对于大鼠:进行单次 SC 或 IP 注射。如果愿意,在 KX 注射前立即在诱导室中用异氟醚 (ISO) (3-5%) 镇静大鼠。
注意:自发的身体运动可能会恢复一小段时间(通常为 <1 分钟),直到 KX 生效。
- 对于小鼠:进行单次皮下 (SC) 注射。
- 在 KX 注射后立即施用格隆溴铵(抗胆碱能药物),以减少过多的唾液分泌物,这些分泌物可能会在经口内窥镜检查期间阻碍喉部的可视化和/或在麻醉恢复期间机械地阻塞上气道。
注:小鼠和大鼠的剂量和给药途径相同 (0.01-0.02 mg/kg SC),效果几乎立竿见影,持续数小时。 - 格隆溴铵注射后,将麻醉的啮齿动物放入加热站上预热的感应笼中,并用手术单覆盖笼子,以提供一个黑暗的环境,在 10 分钟内不受干扰地最大限度地减少视觉刺激。
- 如果啮齿动物在初始 KX 剂量后 10 分钟仍能走动,则终止该程序。
注意:尝试提供额外的麻醉(KX 或氯胺酮维持)可能是徒劳的。
- 如果啮齿动物在初始 KX 剂量后 10 分钟仍能走动,则终止该程序。
- 10 分钟后,给予维持剂量的氯胺酮(如果后肢反射减弱,则为初始剂量的 1/4,如果后肢反射活跃,则为初始剂量的 1/2;小鼠 SC 和大鼠 SC/IP)维持麻醉。
- 在喉镜检查过程中,将眼药膏涂抹在双眼上,以防止角膜干燥和相关创伤。
- 将麻醉的啮齿动物转移到定制的内窥镜平台,开始喉镜检查程序。
注意:我们设计的内窥镜检查平台(图 1)具有多种功能,可用于各种不一定需要内窥镜检查的啮齿动物手术和电生理学方法。因此,它被过度构建为纯粹的内窥镜使用。在相关的情况下,我们将重点介绍对本喉镜实验方案至关重要的功能/组件。 - 从这一点开始,在整个过程中每 15-20 分钟检查一次后肢反射,并根据需要提供额外的氯胺酮维持剂量,间隔至少 20 分钟。由于这是一个相对较短的手术(通常在麻醉下 <45 分钟),因此在初始维持剂量后很少需要额外的氯胺酮。
2. 内窥镜经口通道以观察喉部
- 在麻醉动物之前,准备一个尺寸合适且具有视频录制功能的内窥镜。
注意:我们通常使用轴直径为 1.9 毫米、轴长为 10 厘米的零度耳镜,并带有定制的金属护套(图 2),这是整个协议中使用的代表性内窥镜。- 将内窥镜连接到光源和内窥镜记录系统,以最低 30 帧/秒 (fps) 的速度实时查看和录制视频。
- 对焦和白平衡相机以获得最佳图像质量。
- 将内窥镜连接到显微作器上。
注意:对于喉部运动跟踪,我们将内窥镜固定在内窥镜平台上的显微作器上,以允许精确的内窥镜控制以实现稳定的视频捕获。
- 将啮齿动物固定在加热平台上的背卧式中。用耳杆固定头部,使其稳定和固定。
- 确保啮齿动物的头部可以在耳杆中自由地上下旋转(但不能左右旋转)而不会滑出。这种自由度有助于经口插入和推进内窥镜以到达喉部。
- 如果在内窥镜检查期间需要同步记录呼吸、吞咽和吞咽呼吸协调的电生理学,请继续为此目的应用适当的传感器(图 3)。
- 使用手术胶带将呼吸传感器固定在腹部的中线,紧邻剑突尾部。
- 在插入针状电极之前,用酒精湿巾剃须并清洁/消毒皮肤,以防止感染。
- 在插入针电极之前,使用 22 G 针头在皮肤上刺穿一个小开口,以防止肌电图 (EMG) 针损伤。
- 将无菌同心 EMG 针电极(例如,25 mm x 0.3 mm/30 G)穿过中线的颏下皮肤插入舌根(例如,颏舌肌或颏舌肌,取决于针插入深度)。
- 将接地电极(例如 27 G 不锈钢)皮下插入臀部(任一侧)。
- 将呼吸传感器和 EMG 针电极连接到电生理记录系统(例如,具有同步视频捕获功能的生物放大器和数据采集系统),并在继续之前验证两个通道中干净的电生理信号。
- 用铝箔包裹电极连接位点,以屏蔽电噪声并提高相应电生理记录中的信噪比。
- 根据需要调整呼吸传感器位置和 EMG 针电极深度,以在两个通道中获得清晰的电生理信号。要遵循此协议,请使用 1k 采样率进行呼吸 ,使用 20k 采样率 和 带通滤波器 (例如, 150-3,000 Hz)进行 EMG。
- 用透明毯子盖住啮齿动物的躯干(和呼吸传感器),以促进体温调节,同时允许在呼吸过程中看到腹部运动。在反射检查期间,将后肢和下腹部自由暴露在外,并重新使用氯胺酮维持治疗。确保毯子在呼吸时不会限制腹部运动。
- 继续进行经口内窥镜检查(图4)。
- 通过在中门牙后面垂直于下巴插入锥形棉签涂抹器来张开啮齿动物的嘴巴。旋转舌头背侧的棉签,使其从嘴中略微突出。
- 用手指轻轻握住,轻轻地将舌头从嘴中轻轻拉出到中切牙的一侧,同时将内窥镜尖端插入口腔(图 4A、B)。
- 将内窥镜尖端插入嘴里后打开光源,以避免可能伤害啮齿动物的眼睛。
- 将内窥镜插入门牙外侧,与回缩的舌头位于同一侧。中切牙阻止内窥镜在中线插入,因此需要这种侧向插入方法。
- 启动内窥镜检查(和电生理学)记录系统。在整个过程中持续记录,以确保有足够的数据用于事后分析或在选定时间记录,具体取决于研究的需要。
- 小心地推进内窥镜以观察口咽部,小心不要刮擦硬腭或对舌头施加过大的压力,这可能会导致受伤。
- 使用适当大小的拭子(例如 1.5 毫米微刷)清除任何可见的食物残渣和/或多余的唾液分泌物,以最大限度地降低手术过程中的误吸风险。
- 继续推进/调整内窥镜位置,直到下咽部位于监视器上的视野内中心并且可以识别关键的解剖结构(图 4C)。此时,所有结构在相机视野内都应显得解剖学对齐/对称;否则,请根据需要重新定位内窥镜。
- 在内窥镜推进过程中观察诱发的下巴/舌头运动。如果没有,则继续进行,不要进一步重新使用氯胺酮。如果存在,则给予第二剂氯胺酮维持剂量(氯胺酮初始剂量的 1/4 至 1/2)并等待大约 5 分钟使其生效后再继续。只有在上次注射后至少 20 分钟后才重新给药,以避免过度镇静和消除吞咽。
- 在整个手术过程中,每 5 分钟检查一次啮齿动物的舌头是否有变暗,这表明缺血。为避免这种情况,请根据需要重新定位内窥镜。
- 用插入内窥镜旁边的微探针(例如金属刮刀)对 velum 施加轻微的压力,以解开软腭和会厌的耦合,从而从远处观察喉部(图 4D)。避免使用内窥镜尖端进行去耦,因为施加的压力可能会导致软组织损伤或永久弯曲/损坏内窥镜轴。
注意:与人类不同,小鼠喉部不能从经口角度直接看到。相反,会厌被机械地困在覆盖 velum 的粘膜下方,这导致形成一个死胡同下咽间隙。对 velum 施加轻微的压力将会厌从 velar 膜中释放出来,以提供喉部的部分视图。 - 观察 velum/会厌分离期间的诱发吞咽。
- 将吞咽识别为突然、短暂的舌后向硬腭移位。这种运动通常与短暂的下颌运动/压低同步发生,因此当后舌在内窥镜视野中不易看到时,为识别吞咽提供了替代方法。
- 还可以通过舌 EMG 爆发活动以及电生理学记录中的短暂呼吸暂停发作来识别吞咽,这两者都与内窥镜视频中的声门闭合事件同步发生。
- 如果快速重复吞咽表明麻醉不足(即太轻),请重新给药并等待 ~5-10 分钟后再进行。在先前的氯胺酮维持注射后至少等待 20 分钟,以避免过度镇静和消除吞咽。
- 当在 velar-inputtic 分离过程中仅诱发少量吞咽时,考虑麻醉深度是最佳的。
- 如果取消吞咽,则麻醉太深,无法评估喉气道保护。在这种情况下,等待 5-10 分钟让氯胺酮代谢,然后再进行喉部的特写可视化。
3. 呼吸和诱发吞咽时喉部运动的特写、无障碍视频记录
注:呼吸、吞咽和吞咽呼吸协调的同步电生理记录也是一种选择。
- 在 velum 和 Consultylottis 之间缓慢推进内窥镜,同时保持喉部位于视野中心(图 5A-C)。
注意: 内窥镜尖端可以很容易地穿过 velar-senittic 开口,无需用力。否则,请中止手术以避免对动物造成潜在伤害。可以从远处观察喉部,内窥镜尖端位于下咽部。然而,这种方法通常需要手动回缩会厌、唇膜和/或舌,以增强喉部的可视化。然而,喉部的某些部分通常仍然被遮挡,并且回缩装置会限制喉部运动,这可能会被误认为功能障碍。 - 继续推进内窥镜,以在单个视野中获得喉部整个腹侧、背侧和侧侧尺寸的无障碍特写视图(图 5C)。
注意:腹侧连合可能被会厌阻塞,尤其是在年轻/较小的小鼠中。在这些情况下,试图更积极地作内窥镜尖端以观察腹侧连合会限制喉部运动,这可能会被误诊为功能障碍。它还可能阻塞喉气流,导致窒息。 - 在每个呼吸周期中,当啮齿动物吸气(声门增宽)和呼气(声门狭窄)时,观察喉部的振荡运动。
注意:喉/声门运动的速率和幅度可能因麻醉深度而异;然而,在健康的啮齿动物中,声门间隙(即左/右杓状软骨和声带之间的空气空间)通常在整个呼吸周期中仍然可见。- 如果发现明显的声门狭窄,请调整内窥镜位置以确保气流通过上气道畅通无阻。例如,避免对 velum 施加压力,这会导致鼻气道的软组织阻塞。还要避免将内窥镜尖端插入声门腔,这可能会阻塞喉气流,导致窒息。如果在极少数情况下呼吸停止,请在取下内窥镜后进行几次胸骨中部胸外按压(使用一根手指)或正压通气(使用微型“复苏袋”)。
- 视频记录喉部呼吸运动 30-60 秒,用于事后评估。
- 在喉部仍处于特写视图中的情况下,稍微调整喉入口内的内窥镜尖端,以对覆盖 velum 和/或 epiglung 的粘膜施加机械刺激,并诱发最佳麻醉啮齿动物的吞咽。
- 对内窥镜尖端进行微调(即向任何方向调整 ~1 mm)以防止粘膜损伤和/或气道阻塞。
- 观察诱发的吞咽,这可以很容易地识别为与可见的下巴凹陷、舌 EMG 爆发活动和呼吸痕迹中可见的短暂 (<1/2 s) 呼吸暂停同步发生的声门突然闭合事件。
注意:可能会发生声门闭合事件,但不会同时发生下颌运动;然而,对于这些病例,声门闭合通常是不完全的。我们怀疑这些可能是麻醉开始消失时出现的其他气道保护性反射(例如喉内收肌反射);但是,它们是罕见/不一致的事件,需要进一步调查。 - 重复直到诱发 5-10 只燕子并为每个动物录制视频。如果吞咽被取消,请取出内窥镜并等待 5-10 分钟,让氯胺酮代谢发生后再继续。
- 小心地将内窥镜缩回口咽部,但不要将其移开,并将下咽部置于视野中心,以观察会厌和瓣膜。
- 通过使用微拭子对舌根施加轻微的压力,以引起吞咽和会厌重新卡在舌膜下,从而将 velum 和会厌重新耦合以恢复鼻呼吸。如果在几次尝试内没有发生再耦合,请在不再耦合的情况下进行麻醉恢复,以避免喉部损伤的风险。
- 停止内窥镜检查(和电生理学)记录。
- 使用浸有盐水的棉签润湿舌头和中切牙,并将舌头恢复到口腔内的解剖位置。
- 拆下耳杆并从啮齿动物身上取下温度探头、呼吸传感器和 EMG 电极,以进行麻醉恢复。
4. 麻醉恢复
- 将动物放在“加热站”上的预热恢复笼(即与感应笼相同)中,以从麻醉中恢复。
- 重新涂抹眼部润滑剂以防止干燥。
- 施用温盐水 SC 进行液体水合:大鼠高达 5 mL,小鼠高达 0.5 mL。
- 施用阿替美唑 SC 用于甲苯噻嗪逆转并增加呼吸驱动:大鼠和小鼠 1-2 mg/kg。
- 从 2 mg/kg 阿替美唑开始,然后立即沿啮齿动物的背部和胃进行手动刺激以加速恢复。
注意:使用这种方法,自发的头部运动通常在 1-3 分钟内开始。然而,由于个体差异,在 KX 麻醉下喉镜检查后,恢复动态状态通常需要平均 2 小时 (范围从 1 小时到 5 小时)。 - 如果在麻醉恢复的前 15-30 分钟内自发的身体运动减少而不是增加,则提供额外的阿替美唑剂量为 1 mg/kg(第一次注射后至少 15 分钟),尽管提供了频繁的手动刺激。
- 如果自发活动继续减少,则继续施用多沙普兰(大鼠和小鼠为 5 mg/kg IP)。每隔 10-15 分钟(最多 5 剂)重新服用这种“紧急救援”药物,直到出现自发运动。如果啮齿动物仍然垂死,请使用经批准的安乐死方法(例如,过量服用氯胺酮,然后采用斩首等次要方法)对动物实施安乐死。
- 从 2 mg/kg 阿替美唑开始,然后立即沿啮齿动物的背部和胃进行手动刺激以加速恢复。
- 每隔 15-20 分钟密切监测恢复中的啮齿动物,以检测呼吸状态、活动能力和体温调节的不良变化,并根据需要提供干预(例如,手动刺激、补充氧气、热毯、阿替美唑或多沙普兰注射)。对需要干预的啮齿动物进行更频繁的监测。
- 根据需要为 KX 麻醉恢复时间较长的啮齿动物提供 10 分钟间隔的补充氧气(例如,在加热的诱导室中以 1-2 L/min,无 ISO)。或者,沿动物的背侧和腹侧表面进行频繁刺激,以使 SpO2 水平正常化 (>94%)。
- 将恢复笼伙伴放在同一个恢复笼中(每个笼子最多两只啮齿动物),以促进增加自发活动和加快恢复。
- 当啮齿动物能够自发地在恢复笼周围移动时,将啮齿动物放回温暖的家笼中。
- 将标准的食物和水瓶放回笼子里。在麻醉仍在消失时,不要为食物/水的获取提供特殊住宿,以尽量减少窒息/误吸风险。
- 观察家笼活动并清除任何阻碍行走的障碍物(例如小屋、PVC 管)。
- 在接下来的 12-16 小时内(即过夜),将家笼一半放在加热站上,一半离开加热站。
注意:提前停止补充热量可能会因体温过低而导致死亡。
- 第二天早上执行标准运行状况检查。恢复正常/基线活动、身体功能(例如体温调节、进食、饮水、排尿、排便)和稳定体重(即维持或增加)的动物回到标准动物饲养箱条件,并进行常规日常健康监测。在啮齿类动物活动、身体功能或体重下降的罕见情况下,请继续补充热量一天。
注意:对于大鼠,在麻醉恢复期 ~3-6 小时,双眼周围突然出现卟啉染色是很常见的。染色通常在 24 小时内消退。
5. 呼吸与吞咽时喉部运动的客观量化
- 使用具有逐帧分析功能的视频编辑软件查看内窥镜视频。
- 确定每只动物至少一次具有代表性的 10-20 秒自主呼吸发作。
- 确定每只动物 3-5 个具有代表性的吞咽事件。
- 确保所选的呼吸和吞咽事件/事件符合以下分析标准:喉部以相机视野为中心,所有喉部结构/边界可见(即,未被喉膜、会厌或过多的唾液分泌物遮挡),充足的照明(即,能够看到所有喉部结构/边界),并且没有相机运动伪影(即,内窥镜不移动)。
- 使用主观和/或客观方法分析已识别的呼吸和吞咽事件/事件。
- 对于主观分析:使用李克特量表,使用视频编辑软件在实时和逐帧观看期间对喉部运动进行主观评分。要遵循此协议,请使用从 -2 到 +2 的扩展李克特量表,其中负值表示喉部运动方向与预期相反。估计吞咽过程中喉气道保护作用,其中 0 = 声门间隙大小没有减少(即没有喉气道保护),1 = 声门间隙减少一些(即气道保护不完全),2 = 杓状软骨完全内收,声带之间只有一个小的声门腹间隙(即完全气道保护),负值表示喉部反常运动。
注意:啮齿动物研究中常用 0 到 2 的李克特量表,其中 0 = 无运动,1 = 有运动,2 = 正常运动 17,18,19,20,21,22。然而,该量表没有考虑到喉返神经 (RLN) 损伤后经常发生的反常喉部运动10。 - 客观分析:确定四个关键视频帧 - 1) 喉内收开始之前的静止帧(即声带内收之前的帧),2) 声带完成内收的帧,3) 声带外展之前的帧(可能与 #2 重叠),以及 4) 声带完全外展并返回到静止位置以恢复呼吸的帧。使用这四个关键帧的时间戳来计算声带内收(第 1 帧到第 2 帧)、声门闭合(第 2 帧到第 3 帧)、声带外展(第 3 帧到第 4 帧)和总吞咽持续时间(第 1 帧到第 4 帧)的持续时间。或者,使用其他现有的商业软件23 使用静止帧图像 17,18,24 测量最大外展和最大内收期间的声门角(即,背侧杓状软骨之间或腹侧声带之间)。让至少两名训练有素的审稿人以盲法方式独立执行此过程,识别审稿人之间的差异,并就每个差异达成共同共识。
注意:我们之前使用啮齿动物和人类的商业视频编辑软件对声门闭合时间事件(即气道保护反射期间)进行了手动逐帧分析14。然而,这种方法效率低下,并且只能提供有限的喉部运动动力学量化。我们目前使用内部构建的喉部跟踪软件对呼吸过程中的喉部运动和气道保护性反射进行更广泛的客观量化22、25、26、27、28、29、30。该软件具有自动逐帧跟踪功能,可客观量化左喉与右喉的运动距离(振幅)和定时(频率)。我们使用这些参数来得出各种基于运动的测量值,以检测/量化呼吸、吞咽和其他气道保护性反射(例如喉内收肌反射)期间的喉功能障碍(例如,声门角最大值/最小值/范围、喉部运动对称性和同步性)。该软件仍在完善中,尚未上市/公开。
- 对于主观分析:使用李克特量表,使用视频编辑软件在实时和逐帧观看期间对喉部运动进行主观评分。要遵循此协议,请使用从 -2 到 +2 的扩展李克特量表,其中负值表示喉部运动方向与预期相反。估计吞咽过程中喉气道保护作用,其中 0 = 声门间隙大小没有减少(即没有喉气道保护),1 = 声门间隙减少一些(即气道保护不完全),2 = 杓状软骨完全内收,声带之间只有一个小的声门腹间隙(即完全气道保护),负值表示喉部反常运动。
结果
成功使用这种小鼠喉镜方案可在健康和疾病条件下实现自主呼吸和诱发吞咽期间喉部的特写可视化,如图 6 所示。此外,该方案可以在同一只啮齿动物中多次重复,以允许随着时间的推移检查喉功能/功能障碍。如图 7 所示,我们在 4 个月的时间跨度内成功地重复了该喉镜检查方案 6 次,以研究 RLN 损伤大鼠手术模型中的自发恢复模式(数据尚未发表)。正如我们之前的实验中所述,尝试使用 ISO 麻醉而不是 KX 导致啮齿动物在接受右喉上神经直接电刺激以诱发吞咽的情况下几乎消除了吞咽(图 8),31,32。这发生在 ISO 低至 2% 的情况下;将 ISO 降低到此水平以下会导致自发运动的回归,因此被避免了。ISO 的这种混杂效应突出了麻醉选择对于成功使用该方案的重要性。
当内窥镜图像质量良好时,可以使用运动跟踪软件分析呼吸和吞咽的代表性视频剪辑,如图 9 所示。 表1列出了由我们的定制喉跟踪软件自动生成的代表性结果测量。请注意,在同一代表性大鼠中,基线和 RLN 后横断面之间的几种呼吸和吞咽相关结果指标明显不同。虽然基线和 RLN 后横断面之间呼吸时的声门角相似,但横断后呼吸期间右/左喉运动幅度的比率 (即平均运动范围比或 MMRR) 和频率 (开闭循环比或 OCCR) 较低。同样,RLN 横断后吞咽持续时间较短。
如果获得同步电生理记录(例如,呼吸气垫图和颏舌肌电图),则可以量化几个额外的客观结局指标,以便与喉镜数据相关。 图 10 总结了我们研究感兴趣的基于电生理学的结果测量的示例。我们目前正在开发用于自动量化这些结果测量的算法。

图 1:小鼠内窥镜平台。显示了定制小鼠内窥镜平台的侧面和 (B) 俯视图,并标记了基本组件。请注意,加热垫下方的桌面是可调节的。这里显示的是用于大鼠的桌面和加热垫尺寸,它们很容易被移除,露出一个老鼠大小的桌面,可以容纳一个较小的加热垫(未显示)。定制适配器将内窥镜固定到连接到平台底座的显微作器上。这种战略设计允许在内窥镜检查过程中将整个平台作为一个单元移动,而不会因内窥镜意外/不受控制的运动而对动物造成伤害。显微作器允许在多个方向上对内窥镜尖端进行粗略和微观调整,包括 x(左/右)、y(前/后)、z(上/下)以及围绕 y(俯仰)和 z(偏航)的旋转。请单击此处查看此图的较大版本。

图 2:用于鼠喉镜检查的耳镜和定制护套。 (A) 商用耳镜的拆卸组件和带有鼠喉镜适配器的定制不锈钢护套。(B) 组装后,耳镜尖端伸出金属护套 1 mm,但可根据需要调节至 5 mm。这种战略性设计有助于将狭窄的耳镜尖端推进到啮齿动物的喉部入口,而直径稍大 (2.4 mm) 的金属护套足以保持 velum 和 severyl 打开,以便在呼吸和吞咽过程中对整个喉部进行最佳可视化。 请单击此处查看此图的较大版本。
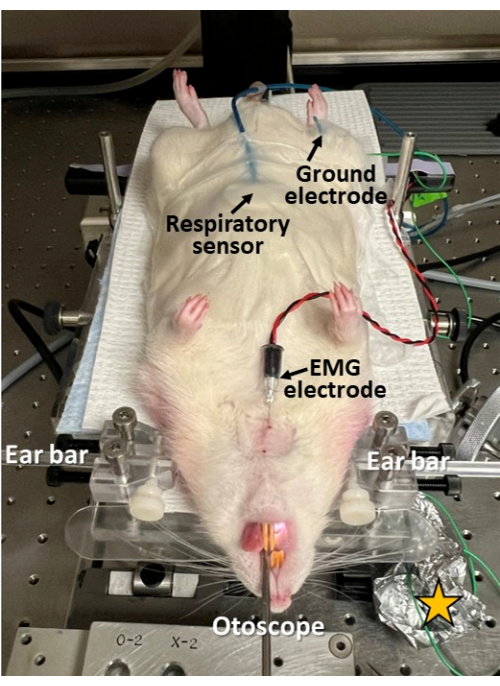
图 3:内窥镜检查期间的微创电生理记录。 呼吸传感器贴在啮齿动物的腹部;将 EMG 电极通过皮肤插入舌的颏舌肌;并将接地电极皮下插入髋部。这种方法允许与内窥镜检查同步研究吞咽、呼吸和吞咽呼吸协调。请注意,在电极插入部位剃除皮肤并进行清洁/消毒。黄色星号 = 包裹在电极引线连接部位的铝箔,以提高电生理记录中的信噪比。 请单击此处查看此图的较大版本。

图 4:经口内窥镜检查,从远处观察喉部。 (A) 用手指轻轻握住舌头后,将内窥镜插入舌头和中切牙之间的红星位置(即,与缩回的舌头在同一侧,以保持与内窥镜轴的解剖对齐)。(B) 当内窥镜穿过硬腭时,(C) 会厌和瓣膜进入视野。(D) 为了可视化声门,必须通过对 velum 表面施加压力(在图 C 中黑色轮廓星的位置)来“解耦”velum 和 stunlotis。 请单击此处查看此图的较大版本。
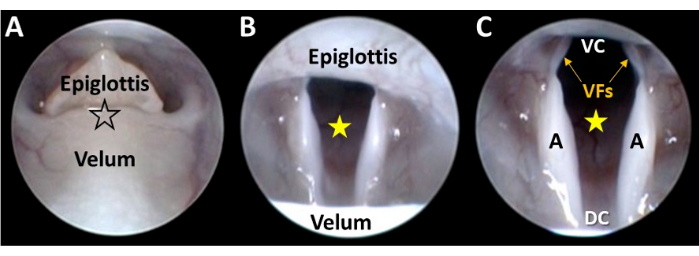
图 5:喉部的特写内窥镜可视化。 (A) 通过显微作器控制在分离的 velum 和会厌之间(在黑色轮廓的星形位置)之间轻轻引导内窥镜尖端。随着内窥镜的推进,(B) 喉进入视野,声门空间(黄色星星)通过显微作器调整在相机视野中居中。(C) 内窥镜的显微作器的持续推进导致喉部整个腹背和侧侧尺寸的可视化。缩写:VC = 喉腹侧连合处(即声带之间的腹侧交界点);DC = 喉背连合(即杓状软骨之间的背侧交界点);VFs = 声带;A = 杓状软骨。 请单击此处查看此图的较大版本。

图 6:呼吸和吞咽时小鼠喉部的可视化。代表性内窥镜图像描绘了成年 Sprague Dawley 大鼠 (A-C) 在右侧 RLN 手术横断术之前和 (D-F) 呼吸和吞咽过程中的喉部运动。请注意,与 (A) 基线相比,RLN 损伤后喉部的静息姿势似乎没有变化 (D)。(B,E)在最大吸气期间,RLN 损伤后喉部不对称变得明显。 (B) 如基线所示,(B) 不是两个杓状软骨外展以扩大声门间隙(黄色星号),(E) 同侧(右)杓状软骨(黑色星号)和声带在 RLN 损伤后的整个呼吸周期中似乎固定。吞咽过程中右侧不对称也很明显。(C) 在基线时,杓状软骨在吞咽过程中接近中线,在声带之间留下一个小的腹侧声门间隙。(F) RLN 损伤后,同侧杓状软骨和 VF 在吞咽过程中反常移动(即,与未受影响的一侧方向相同,红色箭头),留下一个从腹侧延伸到喉后连合的大声门间隙(黄色星星)。(F) 该图像提供了医源性 RLN 损伤大鼠模型中喉气道保护受损的直接证据。(C,F)请注意,在吞咽过程中,喉部会靠近内窥镜,如会厌和外膜在相机视野中不再可见所示。黑色箭头表示正常喉部运动的方向,而红色箭头表示反常运动;黄色星星 = 声门间隙。缩写:VFs = 声带;A = 杓状软骨;RLN = 喉返神经。请单击此处查看此图的较大版本。

图 7:使用连续喉镜检查医源性 RLN 损伤大鼠模型中呼吸和吞咽期间的喉功能障碍。 使用 -2 到 +2 的李克特量表估计 8 只成年 Sprague-Dawley 大鼠在 4 个月内的喉部运动距离和方向。基线喉镜检查后,大鼠接受外科手术横切右侧 RLN,然后在术后 1 周进行连续喉镜检查,然后在术后 1 至 4 个月间隔 1 个月再次进行连续喉镜检查。所有 8 只大鼠均在手术中幸存下来,从而证明了我们的麻醉方案对连续喉镜检查的有效性。(A) 实时分析和逐帧/慢动作分析视频,以量化呼吸过程中的喉部运动,其中 0 = 无运动,1 = 有运动,2 = 患侧(右)与完整(左)侧相比的正常运动距离。(B) 对于吞咽,声门间隙大小估计如下:0 = 声门间隙大小没有减少(即没有喉气道保护),1 = 声门间隙减少一些(即气道保护不完全),2 = 杓状软骨完全内收,声带之间只有一个小的声门间隙(即,完全气道保护)。呼吸和吞咽的负值表示喉部运动的方向与预期相反(即,反常)。请注意,在 RLN 损伤后,呼吸和吞咽都受到了负面影响。有趣的是,喉气道保护在 1 WPS 时间点是完全的(尽管自相矛盾),但此后恶化,从无保护到不完全保护不等。缩写: WPS = 手术后一周;MPS = 手术后几个月;RLN = 喉返神经。 请单击此处查看此图的较大版本。

图 8:啮齿动物受 ISO 抑制的吞咽。 (A) 在 ISO 麻醉下接受喉镜检查的啮齿动物的图像,带有为此目的设计的定制 ISO 输送系统的标记组件。这种创新方法的一个主要警告是人员暴露于 ISO 的风险。(B) 这种方法的另一个缺点是 ISO 抑制吞咽。这个并排的箱线图和散点图总结了未发表的数据,比较了 ISO 与 KX 麻醉对接受右喉上神经直接电刺激以诱发吞咽的小鼠(每组 9 只)的效果。此处显示的是 5 分钟试验期间诱发的吞咽次数,包括 20 秒的 20 Hz 刺激序列,然后是 10 秒的休息。与 KX 相比,用 ISO 麻醉(低至 2%)的小鼠吞咽次数显着减少 (p < 0.001,独立样本 t 检验),甚至在 4/9 小鼠中消除了吞咽。小鼠和大鼠的非手术实验也出现了类似的发现(数据未显示)。缩写: ISO = isoflurane;KX = 氯胺酮-甲苯噻嗪。 请单击此处查看此图的较大版本。

图 9:使用跟踪软件客观量化小鼠喉部运动。 图 6 中的相同图像显示了大鼠在基线时与 RLN 损伤后呼吸与吞咽的对比,并通过我们的定制软件添加了喉部运动跟踪线。沿杓状软骨的内侧边界手动将跟踪线添加到第一个视频帧中,以自动跟踪其余视频帧中的左(蓝线)和右(红线)喉部运动。我们的定制软件从 2.5 秒视频剪辑中生成的相应喉部运动图显示了单个左/右运动与衍生的整体喉部运动,其标签对应于 (A,D) 喉部静息姿势,(B,E) 吸气时的最大声门间隙,以及 (C,F) 吞咽时声门闭合。请注意 RLN 损伤后右侧(红色箭头)的矛盾运动,以及相应派生的全局运动图中显示的大声门间隙。代表性结果指标见 表 1。缩写:RLN = 喉返神经。 请单击此处查看此图的较大版本。

图 10:与喉镜数据相关性的基于电生理学的结果测量。 (A) 显示了健康大鼠呼吸和吞咽过程中的电生理学记录。顶部窗口显示呼吸轨迹(从贴在啮齿动物腹部的呼吸传感器开始),中间窗口显示颏舌肌的 EMG 活动,底部窗口显示过滤后的 EMG 活动。注意呼吸过程中有节奏的呼吸和 EMG 模式,在吞咽事件期间被打断。吞咽事件很容易通过呼吸轨迹中的锯齿状运动(黑色箭头)检测到,紧接着是短暂的呼吸暂停(红色星号)。(B) A 中虚线矩形框的扩展窗口显示了如何从电生理记录中量化几个结果测量。(A) 请注意,在吸气期间(黄色面板),与 EMG 爆发活动相比,呼吸轨迹(顶部窗口)延迟 ~150 毫秒(蓝色双箭头),这突出了两种电生理学方法之间的时间差异。代表性的基于电生理学的结果测量包括 1) 吸气期持续时间 (i);2) 呼吸间隔(ii,通过呼吸和过滤的 EMG 通道计算);曲线下吞咽面积 (iii);和吞咽呼吸暂停 (iv;通过呼吸和滤过的 EMG 通道计算)。缩写:EMG = 肌电图。 请单击此处查看此图的较大版本。
| 结果测量 | 基线 | RLN 受伤后 | |
| 呼吸 | 最小声门角(度) | 34.5 | 34.6 |
| 最大声门角(度) | 52.9 | 49.9 | |
| 平均声门角(度) | 43.7 | 42.2 | |
| 平均运动距离比 (MMRR) | 1.26 | 0.29 | |
| 开盘关闭周期比率 (OCCR) | 1 | 0.11 | |
| 吞咽 | 喉内收 (ms) | 200 | 233 |
| 声门闭合持续时间 (ms) | 67 | 0 | |
| 喉外展 (ms) | 233 | 67 | |
| 总吞咽持续时间 (ms) | 500 | 300 | |
表 1:自定义喉部跟踪软件自动生成的代表性结果测量。 缩写:RLN = 喉返神经。
关于喉镜平台的补充文本。请点击此处下载此文件。
讨论
我们成功开发了一种可复制的小鼠特异性喉镜方案,允许在呼吸和吞咽过程中近距离观察喉部运动。重要的是,该方案可以随着时间的推移在同一只动物中执行,以研究各种病理状况对喉功能的影响。该协议是在过去十年中开发的,并在此过程中经历了大量修改和故障排除。麻醉优化是需要克服的最大挑战,以防止过量给药导致吞咽无效和/或面临呼吸窘迫相关死亡的风险。我们最初使用 ISO,这导致消除了吞咽、唾液分泌过多(阻碍内窥镜可视化)和人员暴露风险,这些被认为是使用 ISO 进行该程序的严重禁忌症。因此,我们专注于 KX,因为它是一种常用的啮齿动物麻醉剂 33,34,35。
我们在使用唾液内窥镜时从小鼠14、22、29、30、36 开始我们的方案开发,因为与其他可能适合此目的的内窥镜相比,它的轴直径较小 (1.1 mm)。重要的是,唾液内窥镜有一个工作通道,我们最初使用它来传递空气脉冲以唤起/研究喉内收肌反射14。然而,我们发现小鼠和大鼠的喉内收肌反射经常减弱/消除,这很可能是由于全身麻醉和/或继发于重复空气脉冲输送引起的粘膜干燥的喉/咽感觉受体失活。尽管在我们的研究中无法可靠地诱发喉内收肌反射,但吞咽令人惊讶地持续存在,并且很容易被喉入口/附近的机械刺激诱发。出于这个原因,我们将重点转移到机械诱发吞咽的内窥镜分析上。
在此过程中,我们放弃了半硬质唾液内窥镜,该内窥镜容易破裂,并且照明和图像分辨率不足,无法可靠地可视化和分析喉部运动。在探索众多替代内窥镜时,我们最终确定了一种适用于小鼠和大鼠喉镜检查的特定耳镜。根据我们的经验,在为鼠喉镜选择合适的内窥镜时,最基本的特征是轴 直径小于 2 毫米 ,可以传输足够亮的光线以进行高质量的视频捕获。较大直径的内窥镜不能轻易穿过小鼠和大鼠的喉部入口,无法近距离观察喉部运动。耳镜特别适合此目的,因为与其他类型的内窥镜(例如唾液内窥镜、软性内窥镜)相比,耳镜具有出色的透光率、刚性/耐用设计以及相对较低的成本。此外,虽然手动控制内窥镜是稳定手中的一种选择,但我们认为显微作器控制是该喉镜方案的基本特征。重要的是,内窥镜的显微作器控制允许单个研究人员对喉部运动进行稳定的视频记录,以便随后进行定量。迄今为止,我们已经成功地将这种基于耳镜的方案用于成年小鼠和大鼠。我们怀疑较小直径的内窥镜选项对于对年轻/较小的啮齿动物进行喉镜检查至关重要。
我们的喉镜检查方案的一个新优势是能够在啮齿动物吞咽过程中可视化气道保护,这在人类中是不可能的,因为喉入口上的会厌倒置阻碍了声门的视线。因此,啮齿动物提供了一个独特的机会来专门研究正常与病理喉气道保护的机制,以最终发现有效恢复正常喉功能的治疗方法。这种鼠喉镜方案的这种独特能力是视频透视(即吞咽困难的另一个“金标准”测试)的主要优势,视频透视未能在我们迄今为止开发/鉴定的众多吞咽困难啮齿动物模型中检测到误吸 30,36,37,38,39,40.这种基于 VFSS 的阴性发现可归因于啮齿动物上气道的几个解剖差异,这些差异通过我们的经口内窥镜检查方法很明显。首先,啮齿动物的喉部位于鼻咽部的高处,在那里它被紧密耦合的会厌和唇膜隐藏,形成一个死胡同的口腔。此外,静止时的会厌被困在覆盖 velum 的粘膜鞘下方。这种解剖结构导致啮齿动物是专性鼻呼吸器;因此,清醒的啮齿动物经口呼吸是呼吸道疾病的征兆。然而,在健康的啮齿动物吞咽过程中,随着喉部进一步抬升到鼻咽部,脱离推注路径,会厌会厌从粘膜鞘中滑出并在喉部入口处倒置。这些动态上气道事件可以通过喉镜检查在健康的啮齿动物和喉功能障碍模型中直接可视化/评估。
重要的是,我们已经表明,尽管在 VFSS 测试期间没有抽吸,但啮齿动物模型(例如医源性 RLN 损伤)确实显示出通过喉镜检查喉气道保护受损(即声门闭合不完全)的证据,这对于吞咽困难相关误吸的人类患者是可翻译的。因此,这种小鼠喉镜方案提供了一个有用的转化平台,专门用于研究目前仍然难以捉摸的气道保护和靶向治疗的机制。实现这一目标需要进一步开发/优化我们目前的方法,该方法利用内窥镜尖端对喉/咽粘膜提供未经校准的机械刺激以诱发吞咽。我们的实验室目前正在探索更严格、精确控制的吞咽诱发方法,包括喉上神经32,41 的直接电刺激和喉/咽粘膜的化学(例如柠檬酸42)刺激。该协议的另一个限制是啮齿动物的仰卧位,这不能模拟清醒和自然的摄食行为。最初的方案制定包括俯卧位,这导致下颌运动受限,同时也限制了口腔的能见度,显着阻碍了内窥镜的通过。可以用下咽部的内窥镜尖端从远处观察喉部;然而,这种方法通常需要手动回缩会厌、瓣膜和/或舌,以增强喉部的可视化。为此,我们制造了各种定制的手动回缩装置(例如,改良的耳镜窥器、改良的移液器吸头)。然而,喉部的某些部分通常仍然被遮挡,并且回缩装置会限制喉部运动,这可能会被误认为功能障碍。此外,内窥镜平台最近的附加功能(例如,特伦德伦伯卧位倾斜和耳杆之间的切口以适应下颌运动)可能有助于在俯卧位测试啮齿动物。耳杆和补充热量是喉镜方案的必要特征。耳杆可防止在经口作内窥镜时头部移动。恒温加热系统将体温保持在 36 °C 至 38 °C 之间,以促进稳定的麻醉并防止整个手术过程中出现体温过低。
既然存在能够可靠地记录啮齿动物呼吸和吞咽过程中喉部运动的方法,那么高通量定量是必不可少的下一步。因此,我们的视频分析工作正在进行中,以确定我们的定制软件生成的哪种结果测量可以最好地区分健康状况和疾病状况,并检测响应自然疾病进展或治疗干预随时间的变化。最佳候选者将成为后续机器学习方法的重点,以加速视频成像分析。重要的是,图像质量不佳的情况(例如,光线不足、解剖结构超出视野、分泌物过多遮挡喉结构等)目前不适合喉部跟踪;然而,未来可能会通过机器学习工具克服这一障碍。在此之前,仔细选择符合喉跟踪分析标准的视频帧序列(如协议第 5 节所述)仍然至关重要。
披露声明
作者没有需要声明的利益冲突。
致谢
这项工作部分由两项 NIH 赠款资助:1) 来自美国国家心肺血液研究所 (NHLBI) 的多 PI(TL 和 NN)R01 赠款 (HL153612),以及 2) 来自国家耳聋和其他沟通障碍研究所 (NIDCD) 的 R03 赠款 (TL, DC0110895)。我们的定制喉部运动跟踪软件开发部分由库尔特基金会资助(TL & Filiz Bunyak)资助。我们感谢 Kate Osman、Chloe Baker、Kennedy Hoelscher 和 Zola Stephenson 为我们的实验室啮齿动物提供了出色的照顾。我们还感谢 MU Physics Machine Shop 的 Roderic Schlotzhauer 和 Cheston Callais 设计、输入和制造我们的定制内窥镜平台,并对商用内窥镜和显微作器进行战略修改,以满足我们的研究需求。我们的定制喉部运动跟踪软件是与 Filiz Bunyak 博士和 Ali Hamad 博士(MU 电气工程和计算机科学系)合作开发的。我们还感谢 Karl Storz Endoscopy 的 Jim Marnatti 为耳镜选择提供指导。最后,我们要感谢 Lever 实验室的许多以前的学生/实习生,他们的贡献为我们目前的小鼠喉镜方案的发展提供了信息:Marlena Szewczyk、Cameron Hinkel、Abigail Rovnak、Bridget Hopewell、Leslie Shock、Ian Deninger、Chandler Haxton、Murphy Mastin和Daniel Shu。
材料
| Name | Company | Catalog Number | Comments |
| Atipamezole | Zoetis | Antisedan; 5 mg/mL | Parsippany-Troy Hills, NJ |
| Bioamplifier | Warner Instrument Corp. | DP-304 | Hamden, CT |
| Concentric EMG needle electrode | Chalgren Enterprises, Inc. | 231-025-24TP; 25 mm x 0.3 mm/30 G | Gilroy, CA |
| Cotton tipped applicator (tapered) | Puritan Medical Products | REF 25-826 5W | Guilford, ME |
| Data Acquisition System | ADInstruments | PowerLab 8/30 | Colorado Springs, CO |
| DC Temperature Control System - for endoscopy platform | FHC, Inc. | 40-90-8D | Bowdoin, ME |
| Electrophysiology recording software | ADInstruments | LabChart 8 with video capture module | Colorado Springs, CO |
| Endoscope monitor | Karl Storz Endoscopy-America | Storz Tele Pack X monitor | El Segundo, CA |
| Glycopyrrolate | Piramal Critical Care | NDC 66794-204-02; 0.2 mg/mL | Bethlehem, PA |
| Ground electrode | Consolidated Neuro Supply, Inc. | 27 gauge stainless steel, #S43-438 | Loveland, OH |
| Isoflurane induction chamber | Braintree Scientific, Inc. | Gas Anesthetizing Box - Red | Braintree, MA |
| Ketamine hydrochloride | Covetrus North America | NDC 11695-0703-1, 100 mg/mL | Dublin, OH |
| Metal spatula to decouple epiglottis and velum | Fine Science Tools | Item No. 10091-12; | Foster City, CA |
| Micro-brush to remove food/secretions from oral cavity | Safeco Dental Supply | REF 285-0023, 1.5 mm | Buffalo Grove, IL |
| Mouse-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2-07 – 5 x 12.5 cm Heating Pad | Bowdoin, ME |
| Ophthalmic ointment (sterile) | Allergan, Inc. | Refresh Lacri-lube | Irvine, CA |
| Otoscope | Karl Storz | REF 1232AA | El Segundo, CA |
| Pneumogram Sensor | BIOPAC Systems, Inc. | RX110 | Goleta, CA |
| Pulse oximetry - Vetcorder Pro Veterinary Monitor | Sentier HC, LLC | Part No. 710-1750 | Waukesha, WI |
| Rat-size heating pad for endoscopy platform | FHC, Inc. | 40-90-2 – 12.5X25cm Heating Pad | Bowdoin, ME |
| Sterile needles for drug injections | Becton, Dickinson and Company | REF 305110, 26 G x 3/8 inch, PrecisionGlide | Franklin Lakes, NJ |
| Sterile syringes for drug injections | Becton, Dickinson and Company | REF 309628; 1 mL, Luer-Lok tip | Franklin Lakes, NJ |
| Surgical drape to cover induction cage for dark environment | Covidien LP | Argyle Surgical Drape Material, Single Ply | Minneapolis, MN |
| Surgical tape to secure pneumograph sensor to abdomen | 3M Health Care | #1527-0, 1/2 inch | St. Paul, MN |
| Transparent blanket for thermoregulation | The Glad Products Company | Press’n Seal Cling Film | Oakland, CA |
| Video editing software | Pinnacle Systems, Inc. | Pinnacle Studio, v24 | Mountain View, CA |
| Water circulating heating pad - for anesthesia induction/recovery station | Adroit Medical Systems | HTP-1500 Heat Therapy Pump | Loudon, TN |
| Xylazine | Vet One | NDC 13985-701-10; Anased, 100 mg/mL | Boise, ID |
参考文献
- Brunner, E., Friedrich, G., Kiesler, K., Chibidziura-Priesching, J., Gugatschka, M. Subjective breathing impairment in unilateral vocal fold paralysis. Folia Phoniatr Logop. 63 (3), 142-146 (2011).
- Chandrasekhar, S. S., et al. Clinical practice guideline: improving voice outcomes after thyroid surgery. Otolaryngol Head Neck Surg. 148 (6 Suppl), S1-S37 (2013).
- Fang, T. J., et al. Quality of life measures and predictors for adults with unilateral vocal cord paralysis. Laryngoscope. 118 (10), 1837-1841 (2008).
- Wang, W., et al. Laryngeal reinnervation using ansa cervicalis for thyroid surgery-related unilateral vocal fold paralysis: a long-term outcome analysis of 237 cases. PLoS One. 6 (4), e19128 (2011).
- Cohen, S. M., et al. Association between dysphagia and inpatient outcomes across frailty level among patients >/= 50 years of age. Dysphagia. 35 (5), 787-797 (2020).
- Poulsen, S. H., et al. Signs of dysphagia and associated outcomes regarding mortality, length of hospital stay and readmissions in acute geriatric patients: Observational prospective study. Clin Nutr ESPEN. 45, 412-419 (2021).
- Lin, R. J., Smith, L. J., Munin, M. C., Sridharan, S., Rosen, C. A. Innervation status in chronic vocal fold paralysis and implications for laryngeal reinnervation. Laryngoscope. 128 (7), 1628-1633 (2018).
- Choi, J. S., et al. Functional regeneration of recurrent laryngeal nerve injury during thyroid surgery using an asymmetrically porous nerve guide conduit in an animal model. Thyroid. 24 (1), 52-59 (2014).
- Wang, B., et al. Neurotrophin expression and laryngeal muscle pathophysiology following recurrent laryngeal nerve transection. Mol Med Rep. 13 (2), 1234-1242 (2016).
- Woodson, G., Randolph, G. W. Pathophysiology of recurrent laryngeal nerve injury. Surgery of the Thyroid and Parathyroid Glands (Third Edition). , 404-409.e2 (2021).
- James, M., Palmer, O. Instrumentation and techniques for examination of the ear, nose, throat, and sinus. Oral Maxillofac Surg Clin North Am. 24 (2), 167-174 (2012).
- Patel, R. R., et al. Recommended protocols for instrumental assessment of voice: American Speech-Language-Hearing Association Expert Panel to develop a protocol for instrumental assessment of vocal function. Am J Speech Lang Pathol. 27 (3), 887-905 (2018).
- Kamarunas, E. E., McCullough, G. H., Guidry, T. J., Mennemeier, M., Schluterman, K. Effects of topical nasal anesthetic on fiberoptic endoscopic examination of swallowing with sensory testing (FEESST). Dysphagia. 29 (1), 33-43 (2014).
- Shock, L. A., et al. Improving the utility of laryngeal adductor reflex testing: a translational tale of mice and men. Otolaryngol Head Neck Surg. 153 (1), 94-101 (2015).
- Aviv, J. E., et al. Laryngopharyngeal sensory discrimination testing and the laryngeal adductor reflex. Ann Otol Rhinol Laryngol. 108 (8), 725-730 (1999).
- Farneti, D. The instrumental gold standard: fees. J Gastroenterol Hepatol Res. 3, 1281-1291 (2014).
- Hernandez-Morato, I., et al. Reorganization of laryngeal motoneurons after crush injury in the recurrent laryngeal nerve of the rat. J Anat. 222 (4), 451-461 (2013).
- Hernandez-Morato, I., Sharma, S., Pitman, M. J. Changes in neurotrophic factors of adult rat laryngeal muscles during nerve regeneration. Neuroscience. 333, 44-53 (2016).
- Tessema, B., et al. Evaluation of functional recovery of recurrent laryngeal nerve using transoral laryngeal bipolar electromyography: a rat model. Ann Otol Rhinol Laryngol. 117 (8), 604-608 (2008).
- Tessema, B., et al. Observations of recurrent laryngeal nerve injury and recovery using a rat model. Laryngoscope. 119 (8), 1644-1651 (2009).
- Monaco, G. N., et al. Electrical stimulation and testosterone enhance recovery from recurrent laryngeal nerve crush. Restor Neurol Neurosci. 33 (4), 571-578 (2015).
- Haney, M. M., Hamad, A., Leary, E., Bunyak, F., Lever, T. E. Automated quantification of vocal fold motion in a recurrent laryngeal nerve injury mouse model. Laryngoscope. 129 (7), E247-E254 (2019).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Wang, B., et al. Functional regeneration of the transected recurrent laryngeal nerve using a collagen scaffold loaded with laminin and laminin-binding BDNF and GDNF. Sci Rep. 6, 32292 (2016).
- Hamad, A., Haney, M. M., Lever, T. E., Bunyak, F. Automated segmentation of the vocal folds in laryngeal endoscopy videos using deep convolutional regression networks. , 140-148 (2019).
- Wang, Y. Y., Hamad, A. S., Palaniappan, K., Lever, T. E., Bunyak, F. LARNet-STC: Spatio-temporal orthogonal region selection network for laryngeal closure detection in endoscopy videos. Comput Biol Med. 144, 105339 (2022).
- Lever, T. E., et al. Advancing laryngeal adductor reflex testing beyond sensory threshold detection. Dysphagia. 37 (5), 1151-1171 (2022).
- Wang, Y. Y., Hamad, A. S., Lever, T. E., Bunyak, F. Orthogonal region selection network for laryngeal closure detection in laryngoscopy videos. Annu Int Conf IEEE Eng Med Biol Soc. 2020, 2167-2172 (2020).
- Haney, M. M., et al. Recurrent laryngeal nerve transection in mice results in translational upper airway dysfunction. J Comp Neurol. 528 (4), 574-596 (2020).
- Mok, A., et al. A surgical mouse model for advancing laryngeal nerve regeneration strategies. Dysphagia. 35 (3), 419-437 (2020).
- Haney, M. M., Ericsson, A. C., Lever, T. E. Effects of intraoperative vagal nerve stimulation on the gastrointestinal microbiome in a mouse model of amyotrophic lateral sclerosis. Comp Med. 68 (6), 452-460 (2018).
- Lever, T. E., et al. A mouse model of pharyngeal dysphagia in amyotrophic lateral sclerosis. Dysphagia. 25 (2), 112-126 (2010).
- Struck, M. B., Andrutis, K. A., Ramirez, H. E., Battles, A. H. Effect of a short-term fast on ketamine-xylazine anesthesia in rats. J Am Assoc Lab Anim Sci. 50 (3), 344-348 (2011).
- Richardson, C. A., Flecknell, P. A. Anaesthesia and post-operative analgesia following experimental surgery in laboratory rodents: are we making progress. Altern Lab Anim. 33 (2), 119-127 (2005).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Welby, L., Maynard, T., Zohn, I., Lever, T. Fluoroscopic and endoscopic investigation of dysphagia in a mouse model of DiGeorge syndrome. Dysphagia. 34, 1003-1004 (2019).
- Mueller, M., et al. Impact of limb phenotype on tongue denervation atrophy, dysphagia penetrance, and survival time in a mouse model of ALS. Dysphagia. 37 (6), 1777-1795 (2022).
- Osman, K. L., et al. Optimizing the translational value of mouse models of ALS for dysphagia therapeutic discovery. Dysphagia. 35 (2), 343-359 (2020).
- Lever, T. E., et al. Videofluoroscopic validation of a translational murine model of presbyphagia. Dysphagia. 30, 328-342 (2015).
- Lever, T. E., et al. Adapting human videofluoroscopic swallow study methods to detect and characterize dysphagia in murine disease models. J Vis Exp. (97), 52319 (2015).
- Ballenger, B., et al. Targeted electrical stimulation of the superior laryngeal nerve - a potential treatment for dysphagia in ALS. FASEB J. 36 (S1), (2022).
- Kloepper, A., et al. An experimental swallow evoked potential protocol to investigate the neural substrates of swallowing. OTO Open. 4 (1), (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。