Method Article
Установка, обслуживание и удаление чрескожного двухпросветного канюлевого вспомогательного устройства для правого желудочка
В этой статье
Резюме
Настоящий протокол содержит подробное описание чрескожного двухпросветного вспомогательного устройства правого желудочка и иллюстрирует пошаговые инструкции по безопасной имплантации, управлению и удалению устройства. Также включены рекомендации по его использованию и устранению осложнений, связанных с одним из самых значительных опытов работы с одним центром.
Аннотация
Шок правого желудочка (ПЖ), классически характеризующийся повышенным центральным венозным давлением (ЦВД) с нормальным или низким давлением в легочной артерии (ПА) и давлением в легочном капиллярном клине (ПЦВП), остается значимой причиной заболеваемости и смертности во всем мире, если его не лечить. Методы лечения шока ПЖ варьируются от медикаментозного лечения до длительной или чрескожной механической поддержки кровообращения (MCS). Уникальное устройство MCS, чрескожное вспомогательное устройство правого желудочка (pRVAD), одобренное для использования Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в 2014 году, работает путем временной разгрузки RV через один двухпросветный катетер с экстракорпоральной механической поддержкой и способно шунтировать кровь из правого предсердия (RA) к основному PA. Несмотря на то, что первоначально он был одобрен как устройство венозно-венозной экстракорпоральной мембранной оксигенации (ВВ-ЭКМО), эта работа будет сосредоточена на использовании поддержки ПЖ, поскольку амбулаторные стратегии ВВ-ЭКМО были описаны ранее. Катетер чаще всего вводится через правую внутреннюю яремную вену (IJ) в PA и подключается к внешнему насосу, обеспечивая поток до 5 л/мин. Это устройство может быть привлекательным выбором для лечения шока ПЖ из-за его чрескожного, минимально инвазивного введения и удаления, а также его способности позволять пациенту передвигаться, пока устройство находится на месте. В этом протоколе подробно обсуждается оборудование, гемодинамические эффекты, показания, противопоказания, осложнения, имеющиеся в настоящее время исследования в литературе и пошаговые инструкции по имплантации, управлению и извлечению устройства, а также рекомендации по использованию и устранению осложнений в одном из крупнейших одноцентровых опытов работы с устройством.
Введение
Кардиогенный шок (КС) от недостаточности правого желудочка (ПЖ) остается одной из самых сложных для лечения кардиологических патологий и предвещает высокую смертность и заболеваемость1. Существует три основных патологических состояния, которые могут привести к недостаточности ПЖ: потеря сократительной способности миокарда, объемная перегрузка и перегрузкадавлением2. После трансплантации сердца потеря сократимости ПЖ может быть вторичной по отношению к ишемии, инфаркту или воспалению миокарда, вызванному миокардитом или первичной дисфункцией трансплантата3. Объемная перегрузка ПЖ может быть вторичной по отношению к правосторонней клапанной недостаточности, шунтированию или недостаточной выведению объема (например, почечной недостаточности) по сравнению с энтеральным или внутривенным приемом4. Перегрузка давлением ПЖ может быть результатом ухудшения легочной гипертензии (пГТН), стеноза легочной артерии, острой тромбоэмболии легочной артерии или декомпенсированной левосторонней сердечной недостаточности, которая является наиболее распространенной причиной недостаточности ПЖ5. Чрескожные методы лечения стали одним из основных методов лечения ХС на автофургоне. Помимо медикаментозной терапии, существует множество устройств для лечения недостаточности ПЖ, в том числе венозно-артериальная экстракорпоральная мембранная оксигенация (VA-ECMO), открытое/центральное вспомогательное устройство правого желудочка (RVAD), Impella RP, вспомогательное устройство TandemHeart RV и Protek Duo2.
Protek Duo является единственным минимально инвазивным чрескожным RVAD (pRVAD) с двухпросветной канюлей, который позволяет передвигаться, пока устройство находится на месте6, и все чаще используется в RV CS для разгрузки RV. Несмотря на то, что первоначально он был одобрен в качестве устройства венозно-венозной экстракорпоральной мембранной оксигенации (ВВ-ЭКМО), эта работа будет сосредоточена на его использовании для поддержки ПЖ, поскольку амбулаторные стратегии ВВ-ЭКМО были описаны ранее7. Он разгружает ПЖ путем шунтирования крови от РА к легочной артерии (ЛП) и позволяет подключать центробежный экстракорпоральный насос непрерывного действия с оксигенатором или без него, чтобы обеспечить оптимальную поддержку ПЖ. Устройство было одобрено для использования в 2014 году Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA)8. Он может обеспечить расход до 4,5-5 л/мин 9,10. Его двухпросветная конструкция катетера втягивает кровь через проксимальную входную канюлю в РА и выводит ее через центральную ПА, по сути, минуя ПЖ.
Канюля имеет два четко выраженных просвета с корпусом, усиленным проволокой. Два концентрических канала для двунаправленного потока в одной канюле позволяют одновременно осуществлять венозный дренаж и реинфузию крови во время экстракорпоральной поддержки. Проксимальная часть устройства отделена и не подключена проводами, что позволяет использовать внешний зажим для предотвращения кровотока во время имплантации и извлечения канюльного устройства. Для точного позиционирования устройства канюля маркируется дистальными и проксимальными маркерами для определения глубины введения. Дистальные маркеры являются рентгеноконтрастными, что позволяет визуализировать устройство на рентгенографической визуализации для определения положения катетера в правом предсердии (РА). Наряду с маркировкой имеются фенестрации или отверстия на дистальном конце и в средней части катетера. Шесть боковых отверстий на дистальном конце позволяют крови вытекать из катетера в ПА. Отверстия в середине ствола позволяют дезоксигенированной крови поступать в катетер из РА (Рисунок 1). Такая конструкция позволяет использовать устройство до, интра- и послеоперационно на протяжении всего спектра процедур, требующих сердечно-легочного шунтирования (ХЛБ). Например, устройство использовалось нами изолированно или в составе бивентрикулярной временной поддержки перед прочным вспомогательным устройством левого желудочка (LVAD). Затем он был преобразован в венозную дренажную канюлю для искусственного дыхания во время процедуры (путем соединения двух конечностей с венозной дренажной ветвью контура), а затем возвращен к шунтированию RA/PA для поддержки RVAD после операции. Кроме того, канюля также использовалась в качестве вентиляционного отверстия для разгрузки/вентиляции левого желудочка (ЛЖ) в условиях ВА-ЭКМО с растяжением ЛЖ путем наложения венозного дренажа на порты РА и ПА, опять же в условиях подготовки к процедурам ИВЛ и последующей конверсии в поддержку RVAD.
В настоящее время доступны два размера: 29 Fr или 31 Fr (Рисунок 2). Эти катетеры разработаны для оптимизации простоты введения и, следовательно, имеют коническую конструкцию, позволяющую дистальной части устройства безопасно проходить через все сердечные структуры. В частности, 29 Fr сужается к 16 Fr, а 31 Fr сужается к 18 Fr. Оба размера изготовлены из одних и тех же материалов. По данным FDA, оба размера идентичны по прочности на разрыв, целостности пути, радиусу излома и скорости гемолиза. Они различаются по жесткости канюли и свойствам напора-потока, что ожидается при изменении диаметра канюли. Несмотря на различия, они признаны равноценными по функциональным возможностям. Более крупные размеры Fr обычно используются для тех, кому требуется больший кровоток для достижения оптимальной гемодинамическойподдержки.
Существенным показанием для использования pRVAD является отказ рефрактерного ПЖ. Это включает в себя статус недостаточности ПЖ после установки LVAD, статус после кардиотомии, постострый инфаркт миокарда или статус после трансплантации сердца12. Это устройство часто используется в сочетании с другими методами лечения, такими как диуретики, инотропные препараты, вазопрессоры и легочные вазодилататоры, чтобы обеспечить индивидуальную оптимальную гемодинамическую поддержку и дать время для ремоделирования нативного ПЖ. Также было документально подтверждено, что устройство использовалось при тяжелой пГТН, как упоминалось в приведенном выше примере, и остром миокардите13. По нашему опыту, у нас было успешное отлучение от поддержки и выписка из больницы с использованием pRVADin в тяжелой pHTN; тем не менее, такие случаи редки, и в целом, поддержка RVAD избегается в условиях тяжелой гипертензии при повышенном давлении в ПА, и поэтому предпочтение отдается декомпрессии ПА с помощью ВА-ЭКМО (амбулаторные стратегии при необходимости длительной поддержки) или РА для обхода левого предсердия, когда это возможно.
Индекс пульсации легочной артерии (PAPI) обычно используется при общей клинической оценке для выявления пациентов, которым может быть полезна минимально инвазивное лечение с помощью этого устройства. PAPI — это валидированный гемодинамический показатель для оценки степени и наличия отказа ПЖ. Он рассчитывается с помощью систолического давления ПА за вычетом диастолического легочного давления, деленного на центральное венозное давление (ЦВД). Пациенты с PAPI менее 0,9 должны рассматриваться для поддержки ПЖ13. Выходная сердечная мощность (CPO) может быть рассчитана с помощью PAPI для дифференциации пациентов, которым может быть полезна поддерживающая терапия ПЖ. Он рассчитывается путем умножения среднего артериального давления на сердечный выброс и деления его на 451. Если CPO меньше 0,6, лечение отказа ПЖ может быть оправдано. Если CPO больше 0,6, есть место для интерпретации и обсуждения возможных других методов лечения14. Тем не менее, большинство данных рекомендуют терапию ПЖ, если PAPI меньше 0,9, как указано выше. В конечном счете, решение о механической поддержке основано на клинической оценке, в которой эти количественные показатели являются ценными дополнениями при принятии решений.
Противопоказаниями к использованию данного устройства механической поддержки кровообращения (МКС) являются любая тяжелая обструктивная патология сосудов или правых отделов сердца, включая существующий стеноз или тромбоз внутренней яремной вены (IJ), тяжелый стеноз легочной артерии и предшествующую замену трикуспидального клапана, что исключает безопасное размещение устройства11. В случае острого синдрома верхней полой вены (ВПВ) после установки подходящего IJ Protek Duo потребовалась срочная реконфигурация на альтернативную стратегию поддержки. При отсутствии выраженного стеноза трехстворчатого клапана восстановление трехстворчатого клапана не является противопоказанием к применению устройства. Замена легочного клапана (ПВР) не является противопоказанием, и в литературе есть несколько сообщений об использовании этого устройства в рамках ПВР15. Относительным противопоказанием к использованию pRVAD является пневмонэктомия в анамнезе из-за лигирования одной из проксимальных ветвей PA при этой процедуре и опасение повреждения культи проволокой или канюлей или чрезмерного давления на культю потоком RVAD. Кроме того, в случаях обширного облучения грудной клетки ткань может не позволять дилатировать и размещать канюлю, что исключает установку pRVAD.
С использованием этого устройства MCS связано несколько сложностей. Одним из потенциальных рисков при лечении шока ПЖ с помощью устройства является раскрытие дисфункции ЛЖ или ранее нераспознанной бивентрикулярной дисфункции. Например, иногда при выходе из строя РЖ ЛЖ выглядит псевдонормальным из-за значительного недонаполнения ЛЖ. Тем не менее, при наличии RVAD оптимизируется прямой поток, а повышенное заполнение ЛЖ может выявить дисфункцию ЛЖ. Во многих случаях таким пациентам может потребоваться перевод на ВА-ЭКМО. Кроме того, протромбогенная природа канюли подвергает пациента риску тромбоэмболических событий. Для борьбы с этой проблемой стандартной терапией всем пациентам предлагается одновременное лечение антикоагулянтами. Тем не менее, добавление антикоагулянтной терапии имеет свой собственный риск осложнений кровотечения, таких как кровотечение в месте доступа, кровотечение из желудочно-кишечного тракта, геморрагический инсульт и риск гепарин-индуцированной тромбоцитопении (ГИТТ)16. Перерывы в антикоагулянтной терапии из-за осложнений кровотечения могут вызвать тромбоз насоса. В этой настройке устройство необходимо заменять в срочном порядке. Диагноз должен быть быстро выяснен среди других причин острого ухудшения гемодинамики и низкого потока устройств, включая сепсис или гиповолемию/кровотечение.
Несмотря на все возможные осложнения, этот pRVAD становится все более распространенным во многих больницах по всей территории Соединенных Штатов для неинвазивного лечения неудачи ПЖ. Его портативная конструкция позволяет пациентам свободно сидеть, стоять и даже передвигаться, если они расположены и закреплены соответствующим образом. Его даже можно легко снять у постели больного после того, как устройство было отлучено от руки. Устройство одобрено FDA для использования в течение 6 дней, но были сообщения об использовании от нескольких недель до17 месяцев. Устройство может быть использовано для поддержки ВВ-ЭКМО путем добавления оксигенатора в цепь в любой момент использования устройства18. Устройство 31 Fr также имеет версию с быстрым развертыванием (RD), показанную на рисунке 3. ПД в основном упоминается в литературе как временное поддерживающее устройство левого желудочка, используемое в качестве моста к другим поддерживающим устройствам с размещением апикальным доступом для обеспечения минимально инвазивной поддержки ЛЖ19.
В отличие от Protek Duo, Impella RP представляет собой чрескожное устройство, используемое для поддержки ПЖ, которое вводится в бедренную вену, требует строгого постельного режима и не позволяет передвигаться. Он также обеспечивает осевой поток по сравнению с Protek Duo, который обеспечивает центробежный поток. Устройства с центробежным потоком имеют более низкие показатели кровотечений, связанных с желудочно-кишечным трактом, при сопоставимой частоте инсультов17. Часто регистрируемые осложнения Impella RP включают кровотечение (42,9%), сосудистые проблемы (22,8%), фрагментацию устройства (34,2%), свертывание системы (17,1%) и отсоединение устройства (8,6%)20. В настоящее время изучаются несколько других устройств поддержки РВ2 . Они могут появиться на рынке в будущем, но на данный момент это устройство с двойной канюлей остается привлекательным выбором в качестве неинвазивного чрескожного устройства для краткосрочного лечения недостаточности ПЖ.
протокол
Настоящий протокол одобрен комитетом по этике исследований на людях Медицинского центра Университета Небраски. Протокол составлен в соответствии с руководящими принципами комитета по этике исследований человека того же университета.
1. Установка устройства
ПРИМЕЧАНИЕ: Эта процедура должна быть идеально выполнена в рентгеноскопическом кабинете, чтобы обеспечить точное размещение устройства.
- Подготовьте пациента.
ПРИМЕЧАНИЕ: Любой пациент в возрасте >18 лет, мужчина или женщина, имеет право на эту терапию, если анатомия подходит для соответствующего доступа и доставки устройства. Лица в возрасте <18 лет также могут быть рассмотрены для использования устройства, если анатомия подходит.- Определите и предоставьте доступ к сайту.
ПРИМЕЧАНИЕ: Существует четыре варианта введения этого канюльного устройства. Он может быть установлен через правую IJ (предпочтительно), левую IJ, левую подключичную или правую подключичную вену. - Используя раствор препарата на основе хлоргексидина или йода (см. Таблицу материалов), тщательно очистите место доступа и прилегающие территории. Наложите стерильную простыню, чтобы создать стерильное поле стандартным образом.
- Определите и предоставьте доступ к сайту.
- Самостерилизуется. Скраб, халат и перчатки в соответствии со стерильной техникой.
- Простерилизуйте ультразвуковой аппарат. Наденьте на ультразвуковой датчик стерильную крышку ультразвукового зонда (см. Таблицу материалов).
- С помощью ультразвукового контроля выявить венозный доступ.
ПРИМЕЧАНИЕ: Исключите любые препятствия для венозного кровотока внутри целевого сосуда, сканируя сосуд вверх и вниз с помощью ультразвукового зонда. - Используя модифицированную технику Сельдингера21, получите доступ к вене.
- Обезболивание путем введения до 10 мл 1% лидокаина в подкожную клетчатку в месте доступа.
- Под ультразвуковым контролем канюляют вену с помощью иглы для микропрокола 5 Fr.
- Под контролем рентгеноскопии или чреспищеводной эхокардиографии (ЧПЭ) введите микропунктурную проволоку через иглу ~8-10 см в вену. Снимите иглу, оставив проволоку на месте.
ПРИМЕЧАНИЕ: Всегда держитесь за проволоку, чтобы предотвратить эмболизацию. - Увеличьте место прокола с помощью 10-ти лезвия, сделав небольшой разрез 0,5 см непосредственно над проволокой перпендикулярно проволоке.
ПРИМЕЧАНИЕ: Пациенты имеют тенденцию к кровотечению сразу после этого шага. Хорошо иметь под рукой оборудование, чтобы предотвратить чрезмерное кровотечение. Кроме того, может потребоваться наложение стерильной марли 4 x 4 на место разреза для удаления избытка крови. - Наденьте на проволоку оболочку 5 Fr. Снимите провод, оставив оболочку на месте.
- Затем пропустите провод 0,035 дюйма через оболочку 5 Fr и увеличьте ее до 9-дюймового катетера многопросветного доступа (MAC). После увеличения до 9 MAC отсоедините провод.
- После установки тубуса стандартным образом проведите катетер Swan Ganz через 9 Fr MAC (см. Таблицу материалов) с помощью рентгеноскопии или ЧТРЭ.
- Продвиньте катетер с баллонным наконечником (см. Таблицу материалов) через оболочку ~10-20 мм, а затем надуйте баллон 1-2 куб. см воздуха.
- Под рентгеноскопией введите надутый катетер с баллонным наконечником в РА через трехстворчатый клапан и основной ПА.
- Вставьте жесткую проволоку диаметром 0,035 дюйма (см. Таблицу материалов) через катетер с баллонным наконечником в правый PA.
- После сдувания катетера с баллонным наконечником извлеките лебедя, оставив жесткую проволоку на месте.
- Последовательно расширяйте место доступа с помощью последовательно больших расширителей (Рисунок 3), размещая расширители один за другим над жесткой проволокой от наименьшей до самой большой до 26 Fr с помощью расширителей устройства. При использовании канюли на 31 Фр расширьте до 30 Фр.
- Одновременно удерживайте проволоку на уровне кожи и периодически поддерживайте давление, чтобы предотвратить кровотечение, левой рукой и перемещайтесь по расширителям другой рукой.
ПРИМЕЧАНИЕ: Этот pRVAD не поставляется с расширителем на 30 Fr. Здесь заменяется расширитель трахеи на 30 Fr (см. Таблицу материалов). Кроме того, обратите внимание, что каждая последующая дилатация увеличивает размер участка доступа, и поэтому каждый шаг расширения может вызвать повышенный риск кровотечения.
- Одновременно удерживайте проволоку на уровне кожи и периодически поддерживайте давление, чтобы предотвратить кровотечение, левой рукой и перемещайтесь по расширителям другой рукой.
- Вводите внутривенно (ВВ) нефракционированные болюсы гепарина для достижения активированного времени свертывания крови (ACT) ~250, в зависимости от риска кровотечения у пациента.
ПРИМЕЧАНИЕ: Для пациентов с более высоким риском кровотечения может потребоваться скорректировать цель ACT в сторону понижения (например, при свежей стернотомии). Для перечисленной выше цели ACT используется устройство Hemochron (см. Таблицу материалов). Для достижения рекомендуемой цели ACT следует вводить 70-100 ЕД/кг нефракционированного гепарина внутривенно. В случае, если терапевтический уровень ACT не достигнут при начальном болюсе, могут быть введены дополнительные болюсы на основе достигнутого уровня ACT, но точные рекомендации по дозировке в руководствах не приведены. - После достижения терапевтической ACT введите устройство pRVAD.
- Переместите интродьюсер и канюлю устройства в сборе на направляющую проволоку.
ПРИМЕЧАНИЕ: Размер канюли варьируется от пациента к пациенту. Следовательно, размер канюли в сборе зависит от выбранной канюли. - Прежде чем проталкивать устройство через кожу над проводом, протолкните провод ретроградно через устройство до тех пор, пока не будет наблюдаться, как провод выходит из дистального конца.
- После того, как проволока будет замечена и закреплена, проведите канюлю интродьюсера через кожу над проволокой.
- Продвиньте устройство мимо трехстворчатого и легочного клапанов через главный ПА в правый ПА.
ПРИМЕЧАНИЕ: Правильное позиционирование подтверждается эхокардиографией, трансдукцией внутрисердечного давления на катетер PA и/или рентгеноскопией. Рекомендуется развернуть устройство глубоко в правый ПА, а затем вернуть его в соответствующее положение, расположенное дистальнее бифуркации, чтобы избежать слишком мелкого развертывания канюли и предотвращения выпадения устройства в дом на колесах, что может привести к катастрофе. Устройство также может быть развернуто в левом ПА, но, как правило, имеет более плавный изгиб в РРА.
- Переместите интродьюсер и канюлю устройства в сборе на направляющую проволоку.
- Снимите интродьюсер и жесткий провод, когда устройство окажется в нужном месте (рисунок 4).
- Сохраняя положение устройства при визуализации с помощью рентгеноскопии, сначала снимите интродьюсер, а затем осторожно потяните за жесткий провод, пока весь провод не будет удален.
- Зажмите канюлю на проксимальном и дистальном портах (рисунок 2).
- Повторите оценку положения канюли с помощью ЧПЭ и/или рентгеноскопии.
ПРИМЕЧАНИЕ: Как правило, устройство первоначально намеренно помещают наконечником в правый ПА, а затем, вытащив провод и интродьюсер наружу, устройство осторожно втягивают до тех пор, пока наконечник не окажется прямо проксимальнее бифуркации ПА на ЧПЭ и рентгеноскопической визуализации и не менее чем на 3-4 см позади легочного клапана.
- Закрепите канюлю устройства на месте.
2. Подключение, активация и обслуживание устройства
- Снимите воздух и подсоедините стандартную трубку, входящую в комплект устройства.
- Перед подсоединением трубок убедитесь, что контур загрунтован и очищен от воздуха.
- Подсоедините трубку оттока, отмеченную красной полосой, с помощью контакта жидкость-жидкость с портом канюли для обратного дренажа крови (от насоса к пациенту).
- Подсоедините входную трубку насоса, отмеченную синей полосой, с помощью контакта жидкость-жидкость с портом канюли для дренажа крови (от пациента к насосу).
- Отпустите зажимы.
- Включите центробежный насос, начиная с 5 500 оборотов в минуту (об/мин).
- Постепенно увеличивайте обороты насоса до тех пор, пока не будет достигнут желаемый уровень расхода.
- Еще раз проверьте положение насоса.
ПРИМЕЧАНИЕ: Проверка положения наконечника канюли может быть облегчена на этом этапе, учитывая цветной поток на выходных отверстиях на ЧПЭ. - Закрепите насос.
- Закрепите насос с помощью жилета voyager (см. Таблицу материалов) или бинта (Рисунок 5), чтобы сохранить устойчивость устройства и обеспечить комфорт пациента при передвижении.
- Выполняйте техническое обслуживание устройства.
- Контролируйте позиционирование устройства с помощью ежедневных рентгенограмм грудной клетки. Внимательно контролируйте гемодинамику пациента во время установки устройства, чтобы обеспечить адекватную гемодинамическую поддержку.
- Контролируйте лабораторные анализы каждые 6 часов, включая общий анализ крови, комплексную метаболическую панель, электролиты, молочную кислоту и централизованное насыщение смешанных вен.
3. Снятие устройства
- Отлучите устройство от сети, выполнив следующие действия.
- Постепенно снижайте скорость устройства, контролируя реакцию гемодинамики и сердечной функции.
ПРИМЕЧАНИЕ: Как правило, это выполняется при проведении эхокардиограммы с акцентом на сердечную функцию с более низким потоком на устройстве. Необходимо часто контролировать молочную кислоту, насыщение смешанных вен и функцию печени/почек. Если в какой-либо момент наблюдается ухудшение функции ПЖ или наблюдаемая дисфункция органов-мишеней по данным аномальных лабораторий, пациент не смог отлучить ПЖ и должен продолжить поддержку.
- Постепенно снижайте скорость устройства, контролируя реакцию гемодинамики и сердечной функции.
- Если функция RV кажется подходящей для снятия устройства, а пациент хорошо насыщается кислородом и хорошо проходит вентиляцию, уменьшите скорость и снимите канюлю.
- Перед удалением канюли зажмите проксимальный и дистальный порты, чтобы предотвратить утечку крови.
- Снимите канюлю.
ПРИМЕЧАНИЕ: Как только канюля будет втянута в то место, где обнажены порты со стороны предсердий, эти участки будут кровоточить, и поэтому канюлю необходимо тянуть плавно, но быстро. Рассасывающийся шов в форме восьмерки 2-0 накладывается через кожу или подкожную клетчатку для гемостаза в месте входа.
Результаты
Устройство первоначально получило разрешение FDA в Соединенных Штатах после большого рандомизированного контрольного испытания, которое показало улучшение выживаемости при лечении острого респираторного дистресс-синдрома на 31% с помощью устройства, используемого в качестве VV_ECMO22. В конце концов, он был одобрен в качестве обхода RA в PA. Тем не менее, устройство еще не одобрено для использования в качестве RVAD, хотя во многих крупных центрах устройство уже используется в качестве замены RVAD во многих случаях. В настоящее время проводятся многоцентровые обсервационные исследования, в ходе которых проводится дальнейшая оценка этого устройства в условиях ударной нагрузки. Путь чрескожной поддержки КС был долгим и постоянно развивающимся. Оригинальное испытание SHOCK Trial заложило основу для чрескожных поддерживающих устройств при ударе. В крупном рандомизированном контролируемом исследовании оценивали внутриаортальный баллонный насос (IABP) как чрескожную форму сердечно-легочной поддержки23. С момента дебюта пробной версии SHOCK на рынке появилось несколько устройств для лечения КС, в том числе и описанное устройство.
Тем не менее, до сих пор практически нет рекомендаций по использованию этих устройств при ударе по автофургонам. Например, в последнем заявлении экспертов Общества сердечно-сосудистой ангиографии и интервенций (SCAI) от 2019 года шок ПЖ упоминается лишь вскользь. В нем говорится, что это уникальная форма КС с высокой ассоциированной смертностью, и предлагается оценка и мониторинг гемодинамических катетеров ПАдля дальнейшего лечения.
Несмотря на отсутствие консенсуса экспертов, серьезная неудача ПЖ становится все более распространенной. Несмотря на возможное увеличение нашей способности диагностировать неудачу ПЖ и/или увеличение количества имплантатов вспомогательных устройств ЛЖ и трансплантаций сердца, которые предрасполагают к неудаче ПЖ, у человека с этим диагнозом уровень смертности составляет ~50% в 1 год25. Большинство пациентов, оцениваемых по этому типу MCS, находятся в стадии D/E CS SCAI, то есть являются пациентами с ухудшающимся состоянием и пациентами с экстремальными состояниями, соответственно.
Было показано, что описанное устройство, временное минимально инвазивное pRVAD, значительно снижает уровень смертности в течение 1 года в этой популяции пациентов до 15%-19%13,14. Считается, что устройство достигает этого за счет улучшения нескольких гемодинамических параметров, таких как среднее артериальное давление, CVP, давление РА, работа при инсульте RV, насыщение смешанных вен, общий сердечный выброс, а также позволяет снизить общую потребность в прессоре; следовательно, с учетом времени для ремоделирования дома на колесах, показанного в одном центрированном исследовании26. Несмотря на то, что ПЖ является хрупким, он также имеет тенденцию быть довольно устойчивым и способным к восстановлению при соответствующем лечении, о чем свидетельствует популяция ХТЭЛГ после тромбэндартерэктомии27.
Задокументированная частота осложнений при использовании этого устройства варьируется в литературе. Частота инфекций, кровотечения и эмболические события могут наблюдаться в 40% случаев или всего в 10% случаев28. Тромбоз глубоких вен и тромбоэмболия легочной артерии после применения также распространены. Тем не менее, в настоящее время нет рекомендаций по контролю за тромбами после использования или рекомендаций по профилактике. Остаточный ТР средней и тяжелой степени может наблюдаться в ~36% случаев, аппаратный гемолиз в ~14% случаев и миграция канюли в ~7% случаев. Исследования показали, что успешное отлучение от устройства может быть достигнуто у 85%-90% пациентов29. Конверсия в хирургическую РВАД может потребоваться в ~11% случаев3. Около ~10% пациентов умирают на поддержке29. Уровень внутрибольничной смертности от всех причин составляет 15%, а выживаемость в течение одного года составляет 81% (Таблица 1)11,26,30,31.

Рисунок 1: Канюля с маркировкой устройства. Канюля RVAD с интродьюсером и деталями с маркировкой. Этот рисунок воспроизводится с разрешения Ссылки32. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Канюли устройства. Канюли 29 Fr, 31 Fr и RD RVAD. Этот рисунок воспроизводится с разрешения Ссылки32. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Расширители устройства. Они используются для серийного расширения места доступа. Этот рисунок воспроизводится с разрешения Ссылки32. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
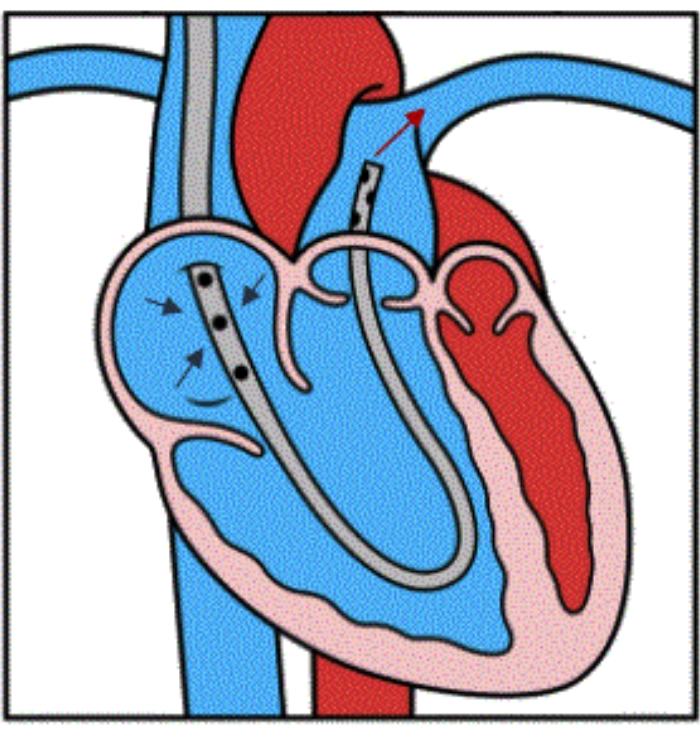
Рисунок 4: Иллюстрация потока устройства. Иллюстрация, демонстрирующая правильное размещение устройства внутри дистального отдела главного ПА. Три синие стрелки указывают на венозный отток из РА в боковые отверстия канюли. Красная стрелка демонстрирует реинфузию крови в основную ПА в обход ЛВ. Этот рисунок воспроизводится с разрешения Ссылки32. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
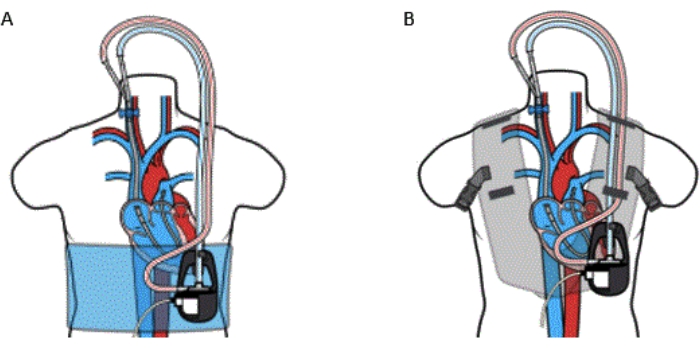
Иллюстрация 5: Чрескожное устройство канюли от РА до ПА Шунтирование с (А) обертыванием и (В) жилетом. Набор VoyagerVest не следует использовать у пациентов с известной аллергией на неопрен. Этот рисунок воспроизводится с разрешения Ссылки32. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| А. Осложнения | |
| Частота инфекций, кровотечения и эмболические события | 10%-40% |
| Остаточный ТР средней и тяжелой степени тяжести | ~36% |
| Аппаратный гемолиз | ~14% |
| Миграция канюль | ~7% |
| B. Исход, связанный с устройством | |
| Успешное отлучение от устройства | ~85%-90% |
| Конверсия в хирургическую RVAD | ~11% |
| Пациенты умерли при поддержке | ~10% |
| Внутрибольничная летальность | 15% |
| Выживаемость за один год | ~81% |
Таблица 1: А. Осложнения МКС «Протек Дуо»; B. Исходы, связанные с устройством
Обсуждение
Шок ПЖ предвещает исключительно высокую смертность. Его следует распознать на ранних стадиях заболевания и агрессивно лечить. Protek Duo - это передовая система MCS для лечения шока RV, которая может быть установлена во время любой из стадий шока SCAI. Несколько критических этапов при размещении устройства включают: получение доступа с помощью модифицированной методики21 Сельдингера, последовательное расширение места доступа до соответствующего размера Fr оболочки, введение катетера с баллонным наконечником в основную PA, введение жесткого проводника через катетер с баллонным наконечником в основную PA, удаление катетера с баллонным наконечником, внутривенное введение гепарина, и, наконец, перемещение устройства по жесткой проволоке после достижения терапевтического уровня ACT. После того, как устройство будет подтверждено в правильном положении с помощью рентгеноскопии или эхокардиографии с анализом волны давления или без него через катетер PA, провод и проводник могут быть удалены, а устройство может быть закреплено на месте. В редких чрезвычайных ситуациях это устройство может быть размещено рядом с помощью ТЭЭ для визуализации и/или с использованием формы сигнала давления ЧП для подтверждения правильного позиционирования устройства; однако, если состояние пациента резко ухудшается и ему необходимо поддерживающее устройство у постели больного, может быть более целесообразным перейти на венозно-артериальную ЭКМО или какую-либо другую поддерживающую стратегию. В противном случае эту процедуру необходимо проводить в рентгеноскопическом кабинете или в операционной.
В литературе задокументировано несколько вариантов этой процедуры. Протокол, представленный в этой статье, основан на нашем опыте работы с одним центром. Важно признать несколько возможных модификаций изложенного протокола. Одним из изменений будет выбор места доступа. Рекомендуемым местом доступа для этой процедуры является правая IJ вены10. Этот доступ обеспечивает прямой доступ к правым отделам сердца и оказался наименее хлопотным для имплантации. Тем не менее, процедуралисты могут имплантировать это устройство через левую подключичную, левую IJ или правую подключичную вену33. Он указан в порядке предпочтения, за исключением подхода, основанного на правом подключичном подходе, который в настоящее время не используется в качестве варианта, но успешно зарекомендовал себя в других учреждениях. Один из этих альтернативных участков доступа может быть предпочтительным у пациентов с окклюзией места доступа. При подозрении на окклюзию места доступа рекомендуется визуализировать как левый IJ, так и подключичный участки доступа с помощью ультразвуковой допплерографии для оценки проходимости перед развертыванием устройства. Для оценки доступа также может быть выполнена венограмма.
Есть несколько предостережений при использовании альтернативного доступа. Одной из проблем при использовании левоподключичного подхода является нетривиальная заболеваемость подключичным тромбозом34. Поскольку это может препятствовать будущему доступу к диализу с использованием подключичной вены, подключичная система была осторожно использована у пациентов, которым должен был потребоваться диализ. Как правило, при использовании левоподключичного доступа канюля размером 31 Fr должна иметь достаточную длину. Подход с левым IJ более сложен в использовании, учитывая очень извилистый ход в правый PA. От левой вены IJ происходит резкий поворот на 90°, чтобы войти в безымянную вену, а затем пройти в верхнюю полую вену (SVC), которая ведет в РА. Этот первоначально добавленный поворот с этим доступом может затруднить процедуралисту выполнение второго поворота вниз в RA, а затем третьего поворота из RA через RV в основной PA.
Точно так же, как может быть трудно расположить кончик канюли устройства внутри основного ПА с использованием этих отдельных участков доступа, процедуролог может столкнуться с проблемами при том, чтобы катетер с баллонным наконечником плавал в правильном положении. Для этого может потребоваться несколько попыток плавающей операции. Примечательно, что два основных момента затрудняют всплытие в позицию. Один из них — от дома на колесах в правый PA. Если возникли проблемы, попробуйте продвинуть катетер во время систолы и использовать толчок желудочка и поток крови для помощи в перемещении лебедя в нужное положение. Второе место – от СВЦ к РА. Это обычное явление при пересаженных сердцах. Иногда на линии шовной нити СВК и линии шовной нити ПА образуется гребень, который может препятствовать прохождению катетера с баллонным наконечником. Если это произойдет, замените оболочку над проволокой на более длинную оболочку, которая проходит мимо этого гребня в РА. Это гарантирует, что катетер с баллонным наконечником получит доступ к правому отделу сердца. Кроме того, при установке устройства во время трансплантации это часто делалось, когда грудная клетка еще открыта, что может обеспечить целостность линий шва анастомоза при прохождении устройства и сохранить открытые варианты RVAD, если устройство не может быть успешно развернуто.
Перед выполнением этой процедуры необходимо знать несколько советов по устранению неполадок. Например, иногда жесткость канюли может привести к тому, что она преимущественно пойдет вниз по нижней полой вене (НПВ) вместо того, чтобы следовать изгибу провода внутрь и поперек трехстворчатого клапана. Если это не устраняется с помощью жесткой проволоки, подумайте о том, чтобы оставить канюлю in vivo на некоторое время. Это позволит канюле размягчиться от тепла внутри тела, а затем постепенно стать более податливой, что позволит легко манипулировать устройством в соответствии с изгибом провода. Различия в анатомии также могут оказаться сложными для операторов. Будьте осторожны с меньшей анатомией СВЦ, что увеличивает риск развития синдрома СВЦ. Кровотечение во время процедуры также может стать еще одним осложнением. Хотя это реже является значительным осложнением, так как в этом протоколе используется венозный доступ с низким давлением. Следует ожидать некоторого кровотечения; Тем не менее, как правило, можно избежать большого количества кровотечений. Это может быть достигнуто за счет тщательного последовательного расширения сосуда доступа. Наложите компрессию на кожу проксимальнее места доступа для тампонады сосуда во время удаления каждого расширителя. Должен быть альтернативный вариант поддержки, если устройство не может быть развернуто. В конце процедуры также важно убедиться в правильном положении устройства, в том, что устройство надежно закреплено, и нанести прокладку на внешние части канюли рядом с телом, чтобы избежать пролежней головы, кожи головы, ушей и других частей тела в непосредственной близости. Само устройство является тромбогенным и требует непрерывной антикоагулянтной терапии во время использования35. Любое противопоказание к антикоагулянтам будет относительным противопоказанием к использованию этого устройства. Также может произойти тромб после удаления. Большой слепок тромба обнаруживается от канюли от РА до РВОТ, и с минимальным опытом удалось справиться с этим с помощью антикоагулянтов.
Трикуспидальная регургитация (ТР) является возможным осложнением2, связанным с использованием этого pRVAD. Когда канюля проходит через трехстворчатый клапан (ТВ), она препятствует створке ТВ и препятствует правильной коаптации створки. Как правило, это не является проблемой, пока канюля на месте. Однако при наличии остаточных повреждений телевизора могут быть выявлены гемодинамически значимые ТР при извлечении устройства. Менее распространенным осложнением, но, возможно, более тяжелым является развитие тромбоцитопении и гемолиза, связанных с устройством. Иногда его можно спутать с HITT16, который также распространен в этой популяции пациентов. Наконец, может произойти миграция канюли. Это место, где канюля либо выпадает в дом на колесах, либо продвигается в правую или левую ПА. Хотя, если канюля благоприятствует правой или левой ПА, это обычно не вредно, в зависимости от требуемого потока и других анатомических соображений. И наоборот, слишком мелкая канюля может привести к пролапсу ниже легочного клапана, что может привести к гемодинамическим катастрофам. Поэтому дистальный кончик устройства должен находиться на расстоянии не менее 3-4 см дистальнее легочного клапана (о чем подробнее ниже). Канюля должна быть закреплена с осторожностью во время транспортировки и движения пациента, чтобы избежать смещения положения канюли.
Как и любой внутрисосудистый объект или имплантат, устройство подвержено риску инфицирования, особенно при длительном использовании. Если заражение устройства подтвердится, это может потребовать обмена или преобразования на альтернативную стратегию поддержки (например, VA-ECMO). В тяжелых ситуациях с инфицированным устройством, когда пациент не переносил прерывание поддержки, а ВА-ЭКМО не была жизнеспособным вариантом, перед удалением инфицированного правого устройства IJ устанавливали левоподключичное устройство с двойной канюлей, и оба устройства ненадолго оставались в сердце одновременно. Таким образом, никаких перебоев в поддержке не было.
В заключение следует отметить, что описываемое устройство в настоящее время является одобренным FDA устройством для лечения недостаточности ПЖ. Кроме того, его основным преимуществом является возможность передвижения в тандеме, более высокий комфорт пациента и более низкий уровень инфекций благодаря способности избегать доступа в пах. Ожидается, что будущие исследования и клинические испытания еще больше подчеркнут преимущества и результаты этого устройства в клинической практике.
Раскрытие информации
Пунам Велагапуди раскрывает следующие отношения с промышленностью: Бюро спикеров - Abiomed, Opsens; консультативный совет - Abiomed, Sanofi; питание/транспортные расходы - Abiomed, Boston Scientific, Medtronic, Chiesi, Phillps.
Благодарности
Эта рукопись была бы невозможна без исключительной поддержки моих наставников, доктора Пунам Велагапуди и доктора Энтони Каслберри, а также без поддержки всех сердечно-сосудистых и кардиоторакальных отделений Медицинского центра Университета Небраски. На создание этой статьи не было потрачено никаких средств.
Материалы
| Name | Company | Catalog Number | Comments |
| Amplatzer Super Stiff Wire 0.035' x 145 cm | Boston Scientific | M001465631 | If not in stock, may use any stiff 0.035" wire. |
| Avalon Tracheal Dilator | Avalon Laboratories Inc., Rancho Dominguez, CA | 12210 | This comes in a set. The 30 Fr dilator is the only part used. |
| Full 29 Protek Duo Kit | LivaNova/ Tandem Life | 5820-2916 | Cannula, pump, holster, wrap |
| Full 31 Protek Duo | LivaNova/Tandem Life | 5820-3118 | Cannula, pump, holster, wrap |
| Hemochron Signature Elite ACT Testing Device and Supplies | Werfen North America | DCJACT-A and DCJACT-N | |
| Lidocaine | Pharmaceutical | Pfizer | |
| LifeSPARC Centrifugal Pump | LivaNova/ Tandem Life | 5840-2417 | |
| Micropuncture needle | Cook Medical | G56202 | 5 Fr |
| Multi-Lumen Access Catheter | Arrow/Teleflex | AK-21242-CDC | 9 Fr |
| Preparation solution | Pharmaceutical | NA | Chlorohexidine-based or iodine-based |
| Protek Duo Cannula 29Fr | LivaNova/ Tandem Life | 5140-4629 | Components: One 29 Fr ProtekDuo Veno-Venous Wire Reinforced Cannula with radiopaque tip markers, One 13 Fr Introducer |
| Protek Duo Cannula 31Fr | LivaNova/Tandem Life | 5140-5131 | - 31 Fr x 51 cm Veno-Venous Dual Lumen Cannula with Introducer |
| Protek Duo Insertion Kit | LivaNova/ Tandem Life | 5100-0014 | Components: balloon tipped PA catheter, one 0.035 stiff guidewire |
| Protek Duo RD Cannula | LivaNova/Tandem Life | 5820-3631 | Cannula, introducer |
| Swan Ganz Catheter | Edwards Lifesciences | 774F75 or 777F8 | |
| Ultrasound | Standard vascular ultrasound. | GE | |
| Ultrasound probe cover over the ultrasound transducer | Standard probe cover to match vascular ultrasound transducer | GE | |
| Voyager Vest Kit | LivaNova/Tandem Life | Contact LivaNova | Includes vest and wrap. Should not be used on patients with a known allergy to neoprene. |
Ссылки
- Saxena, A., et al. Value of hemodynamic monitoring in patients with cardiogenic shock undergoing mechanical circulatory support. Circulation. 141 (14), 1184-1197 (2020).
- Arrigo, M., et al. Right ventricular failure: Pathophysiology, diagnosis and treatment. Cardiac Failure Review. 5 (3), 140-146 (2019).
- Jacob, M., et al. Right ventricular dysfunction post-heart transplantation. Right Ventricular Physiology, Adaptation and Failure in Congenital and Acquired Heart Disease. , 193-216 (2018).
- Haddad, F., et al. Right ventricular function in cardiovascular disease, part II. Circulation. 117 (13), 1717-1731 (2008).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Patel, N., et al. Percutaneous biventricular mechanical circulatory support with impella CP and Protek Duo Plus. Journal of Invasive Cardiology. 31 (2), 46(2019).
- Banfi, C., et al. Veno-venous extracorporeal membrane oxygenation: cannulation techniques. Journal of Thoracic Disease. 8 (12), 3762-3773 (2016).
- Jayaraman, A. L., Cormina, D., Shah, P., Ramakrishma, H. Cannulation strategies in adult veno-arterial and veno-venous extracorporeal membrane oxygenation: Techniques, limitations, and special considerations. Annals of Cardiac Anaethesia. 20 (1), 11-18 (2017).
- Nicolias, C. D., et al. Use of Protek duo tandem heart for percutaneous right ventricular support in various clinical settings: A case series. Journal of the American College of Cardiology. 71 (11), 1314(2018).
- Kang, G., Ha, R., Banerjee, D. Pulmonary artery pulsatility Index Predicts Right Ventricular Failure After Left Ventricular Assist Device Implantation. The Journal of Heart and Lung Transplantation. 35 (1), 67-73 (2016).
- Johnson, G. Protek Duo Veno-venous cannula. Food and Drug Administration. , Section 5 (2017).
- Carrozzini, M., et al. Percutaneous RVAD with the Protek Duo for severe right ventricular primary graft dysfunction after heart transplant. The Journal of Heart and Lung Transplantation. 40 (7), 580-583 (2021).
- Salna, M., et al. Novel percutaneous dual-lumen cannula-based right ventricular assist device provides effective support for refractory right ventricular failure after left ventricular assist device implantation. Interactive Cardiovascular and Thoracic Surgery. 30 (4), 499-506 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit Cardiogenic Shock Initiative. Catheter Cardiovascular Intervention. 91 (3), 454-461 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2021).
- Memon, H. A., et al. Extracorporeal membrane oxygenation support through Protek Duo cannula: A case series. The American Journal of Respiratory and Critical Care Medicine. 201, 5115(2020).
- Ravichandran, A. K., Baran, D. A., Stelling, K., Cowger, J. A., Salerno, C. T. Outcomes with the tandem Protek Duo dual lumen percutaneous right ventricular assist device. ASAIO Journal. 64 (4), 570-572 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2020).
- Belani, K., et al. Transapical Protek Duo rapid deployment cannula as temporary left ventricular assist device in a Jehovah's Witness. Journal of Cardiothoracic and Vascular Anesthesia. 35 (12), 3735-3742 (2020).
- Khalid, N., et al. Adverse events and modes of failure related to impella RP: Insights from the Manufacturer and User Facility Device Experience (MAUDE) database. Cardiovascular Revascularization Medicine. 20 (6), 503-506 (2019).
- Ramos, F., et al. Técnica modificada de Seldinger. Canalización de catéteres venosos centrales a través de catéteres venosos periféricos [Seldinger modified technique]. Revista de Enfermeria. 31 (12), 14-16 (2008).
- Peek, J., et al. Efficacy and economic assessment of conventional ventilator support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicenter randomized controlled trial. Lancet. 374 (9698), 1351-1363 (2009).
- Menon, V., et al. Cardiogenic shock: A summary of the randomized SHOCK trial. Congestive Heart Failure. 9 (1), 35-39 (2003).
- Baran, A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Santas, E., et al. Right ventricular dysfunction staging system for mortality risk stratification in heart failure with preserved ejection fraction. Journal of Clinical Medicine. 9 (3), 831(2020).
- Kapur, N. K., et al. Effects of a percutaneous mechanical circulatory support device for medically refractory right ventricular failure. The Journal of Heart and Lung Transplant. 30 (12), 1360-1367 (2011).
- Murata, M., et al. Clinical significance of Guanylate Cyclase stimulator, riociguat, on right ventricular functional improvement in patients with pulmonary hypertension. Cardiology. 146 (1), 130-136 (2021).
- Aggarwal, V., et al. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheter Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Schmack, B., et al. Results of concomitant groin-free percutaneous temporary RVAD support using a centrifugal pump with a double-lumen jugular venous cannula in LVAD patients. Journal of Thoracic Disease. 11 (6), 913-920 (2019).
- Cheung, A. W., White, C. W., Davis, M. K., Freed, D. H. Short-term mechanical circulatory support for recovery from acute right ventricular failure: Clinical Outcomes. The Journal of Heart and Lung Transplantation. 33 (8), 794-799 (2014).
- Takayama, H., et al. A novel approach to percutaneous right-ventricular mechanical support. European Journal of Cardiothoracic Surgery. 41 (2), 423-426 (2011).
- Cardiac Assist Inc. (n.d.). Tandem Life/LivaNova - Advanced Circulatory Support/ Protek Duo. , Available from: http://www.livanova.com/advanced-circulatory-support/en-us (2021).
- D'Angelo, F., et al. Alternative insertion sites for permanent central venous access devices. European Journal of Surgical Oncology. 23 (6), 547-549 (1997).
- Hill, S., et al. Subclavian vein thrombosis: a continuing challenge. Surgery. 108 (1), 1-9 (1990).
- Silva, E., et al. Management of RVAD thrombosis in biventricular HVAD supported patients: Case series. ASAIO Journal. 65 (4), 36-41 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены