Method Article
Inserción, mantenimiento y extracción del dispositivo de asistencia ventricular derecha con cánula percutánea de doble luz
En este artículo
Resumen
El presente protocolo proporciona una descripción detallada de un dispositivo percutáneo de asistencia ventricular derecha de doble lumen e ilustra instrucciones paso a paso sobre la implantación, el manejo y la extracción seguros del dispositivo. También se incluye orientación sobre su uso y solución de problemas de complicaciones de una de las experiencias más significativas de un solo centro.
Resumen
El shock del ventrículo derecho (VD), caracterizado clásicamente por una presión venosa central (PVC) elevada con presión de la arteria pulmonar (AP) y presión en cuña capilar pulmonar (PCWP) de normal a baja, sigue siendo una causa importante de morbilidad y mortalidad en todo el mundo si no se trata. Las terapias para el tratamiento del choque del VD van desde el tratamiento médico hasta el soporte circulatorio mecánico (SQM) duradero o percutáneo. Un dispositivo único de MCS, un dispositivo de asistencia ventricular derecha percutánea (pRVAD), aprobado para su uso por la Administración de Alimentos y Medicamentos (FDA) en 2014, funciona descargando temporalmente el VD a través de un catéter de doble lumen con soporte mecánico extracorpóreo y es capaz de desviar la sangre desde la aurícula derecha (AR) hasta la PA principal. Aunque inicialmente se aprobó como dispositivo de oxigenación por membrana extracorpórea venosa-venosa (VV-ECMO), este trabajo se centrará en el uso del soporte VV-ECMO, ya que las estrategias ambulatorias de VV-ECMO se han descrito anteriormente. Lo más habitual es que el catéter se inserte a través de la vena yugular interna derecha (IJ) en la PA y se conecte a una bomba externa, lo que permite un caudal de hasta 5 L/min. Este dispositivo puede ser una opción atractiva para el tratamiento del choque del VD debido a su inserción y extracción percutánea y mínimamente invasiva y su capacidad para permitir la deambulación del paciente mientras el dispositivo está en su lugar. Este protocolo analiza en detalle el equipo, los efectos hemodinámicos, las indicaciones, las contraindicaciones, las complicaciones, la investigación actualmente disponible en la literatura y las instrucciones paso a paso sobre cómo implantar, manejar y extraer el dispositivo, junto con la orientación sobre el uso y la solución de problemas de complicaciones de una de las experiencias más grandes de un solo centro con el dispositivo.
Introducción
El shock cardiogénico (SC) por insuficiencia ventricular derecha (VD) sigue siendo una de las patologías cardíacas más difíciles de manejar y presagia una alta mortalidad y morbilidad1. Existen tres estados patológicos primarios que pueden dar lugar al fracaso del VD: pérdida de la contractilidad miocárdica, sobrecarga de volumen y sobrecarga de presión2. Después de un trasplante de corazón, la pérdida de la contractilidad del VD puede ser secundaria a isquemia miocárdica, infarto o inflamación causada por miocarditis o disfunción primaria del injerto3. La sobrecarga de volumen del VD puede ser secundaria a una insuficiencia valvular derecha, a una derivación o a una eliminación inadecuada del volumen (p. ej., insuficiencia renal) en relación con la ingesta enteral o intravenosa4. La sobrecarga de presión del VD puede ser el resultado de un empeoramiento de la hipertensión pulmonar (HTAp), estenosis pulmonar, embolia pulmonar aguda o insuficiencia cardíaca izquierda descompensada, la causa más común de insuficiencia del VD5. Las opciones de tratamiento percutáneo se han convertido en uno de los pilares para el tratamiento del SC del RV. Además de la terapia médica, hay múltiples dispositivos disponibles para tratar la insuficiencia del VD, incluida la oxigenación por membrana extracorpórea venoso-arterial (VA-ECMO), el dispositivo de asistencia ventricular derecha, el Impella RP, el dispositivo de asistencia RV TandemHeart y el Protek Duo2.
El Protek Duo es el único RVAD percutáneo mínimamente invasivo (pRVAD) con una cánula de doble lumen que permite la deambulación mientras el dispositivo está en su lugar6 y se utiliza cada vez más en RV CS para descargar el RV. A pesar de haber sido inicialmente aprobado como un dispositivo de oxigenación por membrana extracorpórea venoso-venosa (VV-ECMO), este trabajo se centrará en su uso para el soporte del VV-ECMO, ya que las estrategias ambulatorias de VV-ECMO han sido descritas previamente7. Descarga el VD derivando la sangre de la AR a la arteria pulmonar (AP) y permite la opción de conectar una bomba de flujo continuo extracorpóreo de flujo centrífugo con o sin un oxigenador para permitir un soporte óptimo del VD. El dispositivo fue aprobado para su uso en 2014 por la Administración de Alimentos y Medicamentos (FDA)8. Puede proporcionar caudales de hasta 4,5-5 L/min 9,10. Su diseño de catéter de doble lumen extrae la sangre a través de la cánula de entrada proximal en la AR y la canaliza a través de la PA central, esencialmente sin pasar por el VD.
La cánula tiene dos lúmenes distintos con un cuerpo reforzado con alambre. Dos canales concéntricos para el flujo bidireccional dentro de una sola cánula permiten el drenaje venoso simultáneo y la reinfusión de sangre durante el soporte extracorpóreo. La parte proximal del dispositivo está separada y no cableada, lo que permite un pinzamiento externo para evitar el flujo sanguíneo durante la implantación y extracción del dispositivo de cánula. Para un posicionamiento preciso del dispositivo, la cánula está marcada con marcadores distales y proximales para identificar la profundidad de inserción. Los marcadores distales son radiopacos, lo que permite la visualización del dispositivo en imágenes radiográficas para determinar la posición del catéter dentro de la aurícula derecha (AR). Junto con las marcas, hay fenestraciones u orificios en la punta distal y la porción media del catéter. Los seis orificios laterales en la punta distal permiten que la sangre fluya desde el catéter hacia el PA. Los orificios del eje medio permiten que la sangre desoxigenada fluya hacia el catéter desde la AR (Figura 1). Este diseño permite el uso del dispositivo antes, durante y después de la operación a lo largo de la serie de procedimientos que requieren derivación cardiopulmonar (CEC). Por ejemplo, el dispositivo fue utilizado por nosotros de forma aislada o como parte de un soporte temporal biventricular antes de un dispositivo de asistencia ventricular izquierda (LVAD) duradero. Luego se convirtió en una cánula de drenaje venoso para CPB durante el procedimiento (mediante "Y" conectando las dos extremidades a la rama de drenaje venoso del circuito) y luego volvió a la derivación de AR/PA para el soporte de RVAD en el postoperatorio. Además, la cánula también se utilizó como ventilación de PA para la descarga/ventilación del ventrículo izquierdo (VI) en el entorno de VA-ECMO con distensión del VI mediante la aplicación de drenaje venoso en los puertos de AR y PA, de nuevo en el entorno de preparación para los procedimientos de CPB y la posterior conversión a soporte de RVAD.
Actualmente, hay dos tamaños disponibles, el de 29 Fr o el de 31 Fr (Figura 2). Estos catéteres están diseñados para optimizar la facilidad de inserción y, por lo tanto, tienen un diseño cónico para permitir que la porción distal del dispositivo atraviese todas las estructuras cardíacas de forma segura. En concreto, el 29 Fr se estrecha a 16 Fr y el 31 Fr se estrecha a 18 Fr. Ambos tamaños están hechos de los mismos materiales. Según la FDA, ambos tamaños son idénticos en resistencia a la tracción, integridad de la vía, radio de torsión y tasas de hemólisis. Difieren en cuanto a la rigidez de la cánula y las propiedades de presión-flujo, que se espera con un cambio en el diámetro de la cánula. A pesar de sus diferencias, se ha determinado que son equivalentes en capacidades funcionales. Los tamaños de Fr más grandes se utilizan típicamente para aquellos que requieren más flujo sanguíneo para lograr un soporte hemodinámico óptimo11.
Una indicación esencial para el uso del pRVAD es la falla refractaria del RV. Esto incluye el estado de fracaso del VD después de la colocación del DAVI, el estado posterior a la cardiotomía, el estado posterior al infarto agudo de miocardio o el estado posterior al trasplante cardíaco12. Este dispositivo se utiliza a menudo junto con otras terapias como diuréticos, agentes inotrópicos, vasopresores y vasodilatadores pulmonares para proporcionar un soporte hemodinámico óptimo individual y al mismo tiempo dar tiempo para la remodelación del VD nativo. También se ha documentado que el dispositivo se ha utilizado en la HTAp grave, como se menciona en el ejemplo anterior, y en la miocarditis aguda13. En nuestra experiencia, hemos tenido un destete exitoso del soporte y el alta hospitalaria utilizando la pRVADin pHTN grave; sin embargo, estos casos son raros y, en general, se evita el soporte de RVAD en el contexto de hipertensión grave debido al aumento de la presión dentro de los AP y, por lo tanto, favorecería la descompresión de los AP con configuraciones de VA-ECMO (estrategias de ambulación si es necesario un soporte prolongado) o AR a las configuraciones de derivación de la aurícula izquierda cuando sea posible.
El índice de pulsatilidad de la arteria pulmonar (PAPI, por sus siglas en inglés) se usa comúnmente con la evaluación clínica general para identificar a los pacientes que podrían beneficiarse de un tratamiento mínimamente invasivo con este dispositivo. El PAPI es una métrica hemodinámica validada para evaluar el grado y la presencia de fracaso del VD. Se calcula utilizando la presión sistólica de la AP menos la presión pulmonar diastólica dividida por la presión venosa central (CVP). Los pacientes con un PAPI de menos de 0,9 deben ser considerados para el soporte del VD13. La potencia cardíaca de salida (CPO) se puede calcular con el PAPI para diferenciar a los pacientes que pueden beneficiarse de la terapia de soporte del VD. Se calcula multiplicando la presión arterial media por el gasto cardíaco y dividiéndola por 451. Si el CPO es inferior a 0.6, puede estar justificado el tratamiento para la falla del RV. Si el CPO es mayor de 0,6, hay espacio para la interpretación y discusión de posibles otras terapias14. Sin embargo, la mayoría de la evidencia recomienda terapias con VD si el PAPI es inferior a 0,9, como se indicó anteriormente. En última instancia, la decisión de soporte mecánico se basa en la evaluación clínica con estas métricas cuantitativas como complementos valiosos en la toma de decisiones.
Las contraindicaciones para el uso de este dispositivo de soporte circulatorio mecánico (SQM) incluyen cualquier patología vascular o obstructiva del corazón derecho, incluida la estenosis o trombosis de la vena yugular interna (IJ) existente, la estenosis pulmonar grave y el reemplazo previo de la válvula tricúspide, lo que impide la colocación segura del dispositivo11. Un caso de síndrome agudo de la vena cava superior (VCS) después de la colocación de un IJ Protek Duo adecuado requirió una reconfiguración emergente a una estrategia de soporte alternativa. En ausencia de estenosis grave de la válvula tricúspide, la reparación de la válvula tricúspide no es una contraindicación para el uso del dispositivo. El reemplazo de la válvula pulmonar (RVP) no es una contraindicación, y existen varios reportes en la literatura sobre el uso de este dispositivo dentro de una RVP15. Una contraindicación relativa para el uso del PRVAD es el antecedente de una neumonectomía debida a la ligadura de una de las PA de la rama proximal con este procedimiento y la preocupación por la lesión del alambre o la cánula en el muñón del PA o la presión excesiva sobre el muñón por el flujo de RVAD. Además, en los casos con radiación torácica extensa, es posible que el tejido no permita la dilatación y la colocación de la cánula, lo que impide la colocación de la canula.
Varias complicaciones están asociadas con el uso de este dispositivo MCS. Un riesgo potencial con el tratamiento del choque del ventrículo reventar con el dispositivo es desenmascarar la disfunción del ventrículo izquierdo o la disfunción biventricular no reconocida previamente. Por ejemplo, a veces, con la falla del VD, el VI parece pseudonormal debido a un subllenado significativo del VI. Sin embargo, con un RVAD en su lugar, el flujo directo se optimiza y un mayor llenado del VI puede desenmascarar la disfunción del VI. Muchas veces, es posible que estos pacientes deban ser convertidos a VA-ECMO. Además, la naturaleza protrombogénica de la cánula pone al paciente en riesgo de eventos tromboembólicos. Para combatir este problema, la terapia estándar es que todos los pacientes sean tratados concomitantemente con anticoagulación. Sin embargo, la adición de terapia anticoagulante tiene su propio riesgo de complicaciones hemorrágicas, como hemorragia en el sitio de acceso, hemorragia del tracto gastrointestinal, accidente cerebrovascular hemorrágico y riesgo de trombocitopenia inducida por heparina (HITT)16. Las interrupciones en la anticoagulación debido a complicaciones hemorrágicas pueden causar trombosis en bomba. El dispositivo debe cambiarse de forma urgente en este entorno. El diagnóstico debe dilucidarse rápidamente, entre otras causas de deterioro hemodinámico agudo y bajo flujo del dispositivo, incluida la sepsis o la hipovolemia/hemorragia.
A pesar de todas sus posibles complicaciones, este pRVAD se está volviendo más común en muchos hospitales de los Estados Unidos para el tratamiento no invasivo de la insuficiencia del VD. Su diseño portátil permite a los pacientes sentarse, pararse e incluso deambular libremente si se colocan y aseguran adecuadamente. Incluso se puede quitar fácilmente al lado de la cama después de que el dispositivo se haya destetado. El dispositivo está aprobado por la FDA para su uso hasta 6 días, pero ha habido informes de uso durante semanas o meses17. El dispositivo se puede utilizar para el soporte VV-ECMO añadiendo un oxigenador al circuito en cualquier punto mientras se utiliza el dispositivo18. El dispositivo de 31 Fr también tiene una versión de implementación rápida (RD) que se ve en la Figura 3. El RD ha sido referenciado principalmente en la literatura como un dispositivo de soporte ventricular izquierdo temporal utilizado como puente hacia otros dispositivos de soporte con colocación a través de un abordaje apical para proporcionar soporte del VI mínimamente invasivo19.
A diferencia del Protek Duo, el Impella RP es un dispositivo percutáneo utilizado para el soporte del VD que se inserta en la vena femoral, requiere un reposo estricto en cama y no permite la deambulación. También proporciona un flujo axial en comparación con el Protek Duo, que proporciona un flujo centrífugo. Los dispositivos de flujo centrífugo tienen menos eventos de sangrado relacionados con el tracto gastrointestinal con tasas de accidente cerebrovascular comparables17. Las complicaciones comúnmente reportadas de la RP de Impella incluyen hemorragia (42,9%), problemas vasculares (22,8%), fragmentación del dispositivo (34,2%), coagulación del sistema (17,1%) y desconexión del dispositivo (8,6%)20. Actualmente se están estudiando otros dispositivos de soporte para vehículos recreativos2 . Es posible que lleguen al mercado en el futuro, pero por ahora, este dispositivo de doble cánula sigue siendo una opción atractiva como dispositivo percutáneo no invasivo para el tratamiento a corto plazo de la insuficiencia del VD.
Protocolo
El presente protocolo está aprobado por el comité de ética de investigación en seres humanos del Centro Médico de la Universidad de Nebraska. El protocolo sigue las directrices del comité de ética en investigación en humanos de la misma universidad.
1. Inserción del dispositivo
NOTA: Lo ideal es que este procedimiento se realice en una sala de fluoroscopia para garantizar la colocación precisa del dispositivo.
- Preparar al paciente.
NOTA: Cualquier paciente > 18 años de edad, hombre o mujer, es elegible para esta terapia si la anatomía es adecuada para el acceso y la administración adecuados del dispositivo. Las personas < 18 años también pueden ser consideradas para el dispositivo si la anatomía es adecuada.- Identifique y exponga el sitio de acceso.
NOTA: Hay cuatro opciones para insertar este dispositivo de cánula. Se puede colocar a través de la vena IJ derecha (preferida), IJ izquierda, subclavia izquierda o subclavia derecha. - Usando una solución de preparación a base de clorohexidina o yodo (consulte la Tabla de materiales), limpie a fondo el sitio de acceso y las áreas circundantes. Aplique un paño estéril para establecer un campo estéril de manera estándar.
- Identifique y exponga el sitio de acceso.
- Autoesterilización. Frote, bata y guante siguiendo la técnica estéril.
- Esterilizar la máquina de ultrasonido. Coloque una cubierta estéril para la sonda de ultrasonido sobre el transductor de ultrasonido (consulte la Tabla de materiales).
- Usando la guía de ultrasonido, identifique el acceso venoso.
NOTA: Excluya cualquier obstrucción al flujo venoso dentro del vaso objetivo escaneando hacia arriba y hacia abajo el vaso con la sonda de ultrasonido. - Usando la técnica de Seldingermodificada 21, obtenga acceso a la vena.
- Anestesiar inyectando hasta 10 mL de lidocaína al 1% en el tejido subcutáneo en el sitio de acceso.
- Bajo guía ecográfica, canular la vena con una aguja de micropunción de 5 Fr.
- Bajo fluoroscopia o ecocardiograma transesofágico (ETE), inserte un alambre de micropuntura a través de la aguja ~ 8-10 cm en la vena. Retire la aguja, dejando el alambre en su lugar.
NOTA: Asegúrese de sujetar siempre el alambre para evitar la embolización. - Amplíe el sitio de punción con una cuchilla de 10 hojas, haciendo una pequeña incisión de 0,5 cm directamente sobre el alambre perpendicular al alambre.
NOTA: Los pacientes tienden a sangrar directamente después de este paso. Es bueno tener el equipo a mano para evitar el sangrado excesivo. Además, es posible que se requiera aplicar una gasa estéril de 4 x 4 en el sitio de la incisión para eliminar el exceso de sangre. - Coloque una funda de 5 Fr sobre el alambre. Retire el alambre dejando la funda en su lugar.
- Luego, coloque un cable de 0.035" a través de la vaina de 5 Fr y aumente su tamaño a un catéter de acceso (MAC) de 9 lúmenes múltiples. Una vez aumentado a 9 MAC, retire el cable.
- Después de la colocación de la vaina, flote un catéter Swan Ganz de manera estándar a través del MAC de 9 Fr (consulte la Tabla de materiales) utilizando fluoroscopia o guía de ETE.
- Avance un catéter con punta de globo (ver Tabla de materiales) a través de la vaina ~ 10-20 mm, y luego infle el globo con 1-2 cc de aire.
- Bajo fluoroscopia, avance el catéter inflado con punta de balón hacia la AR a través de la válvula tricúspide y la PA principal.
- Inserte un alambre rígido de 0.035 pulgadas de diámetro (consulte la Tabla de materiales) a través del catéter con punta de globo en el PA derecho.
- Después de desinflar el catéter con punta de globo, retire el cisne mientras deja el alambre rígido en su lugar.
- Dilatar en serie el sitio de acceso usando dilatadores secuencialmente más grandes (Figura 3) colocando los dilatadores uno por uno sobre el alambre rígido de menor a mayor hasta 26 Fr usando los dilatadores del dispositivo. Si utiliza una cánula de 31 Fr, dilatar hasta 30 Fr.
- Simultáneamente sostenga el alambre a nivel de la piel y mantenga la presión de forma intermitente para evitar el sangrado, según corresponda, con la mano izquierda y navegue por los dilatadores con la otra mano.
NOTA: Este pRVAD no viene con un dilatador de 30 Fr. Aquí se sustituye por un dilatador traqueal de 30 Fr (ver Tabla de Materiales). Además, tenga en cuenta que cada dilatación subsiguiente aumenta el tamaño del sitio de acceso y, por lo tanto, cada paso en la dilatación puede causar un mayor riesgo de sangrado.
- Simultáneamente sostenga el alambre a nivel de la piel y mantenga la presión de forma intermitente para evitar el sangrado, según corresponda, con la mano izquierda y navegue por los dilatadores con la otra mano.
- Administrar bolos de heparina no fraccionada por vía intravenosa (IV) para lograr un tiempo de coagulación activado (ACT) de ~250, dependiendo del riesgo de sangrado del paciente.
NOTA: Es posible que sea necesario ajustar el objetivo de ACT a la baja para los pacientes con un mayor riesgo de sangrado (p. ej., esternotomía reciente). El objetivo ACT mencionado anteriormente utiliza un dispositivo Hemochron (ver Tabla de Materiales). Para alcanzar el objetivo recomendado de TCA, administrar 70-100 unidades/kg de heparina no fraccionada IV. En caso de que no se alcance el nivel terapéutico de ACT con el bolo inicial, se pueden administrar bolos adicionales en función del nivel de ACT alcanzado, pero las directrices no proporcionan recomendaciones de dosificación exactas. - Una vez que se logra un ACT terapéutico, inserte el dispositivo pRVAD.
- Avance el introductor del dispositivo y el conjunto de la cánula sobre la guía.
NOTA: El tamaño de la cánula varía de un paciente a otro. Por lo tanto, el tamaño del conjunto de la cánula depende de la cánula seleccionada. - Antes de empujar el dispositivo a través de la piel sobre el cable, empuje el cable retrógrado a través del dispositivo hasta que se observe que el cable sale de la punta distal.
- Una vez que el alambre esté observado y asegurado, avance la cánula introductora a través de la piel sobre el alambre.
- Haga avanzar el dispositivo más allá de las válvulas tricúspide y pulmonar a través de la PA principal y hacia la PA derecha.
NOTA: La posición correcta se confirma con ecocardiografía, transducción de presiones intracardíacas en el catéter PA y/o fluoroscopia. Se recomienda desplegar el dispositivo profundamente en el PA derecho y luego tirar de él hacia atrás a la posición adecuada justo distal a la bifurcación para evitar desplegar la cánula demasiado superficial y evitar que el dispositivo se prolapse en el RV, lo que puede ser catastrófico. El dispositivo también se puede implementar en el PA izquierdo, pero tiende a tener una curva más suave en el RPA.
- Avance el introductor del dispositivo y el conjunto de la cánula sobre la guía.
- Retire el introductor y el cable rígido cuando el dispositivo esté en la ubicación deseada (Figura 4).
- Mientras mantiene la posición del dispositivo bajo visualización con fluoroscopia, primero retire el introductor y luego tire suavemente del cable rígido hasta que se retire todo el cable.
- Sujete la cánula en los puertos proximal y distal (Figura 2).
- Reevalúe la posición de la cánula mediante ETE y/o fluoroscopia.
NOTA: Por lo general, el dispositivo se coloca inicialmente intencionalmente con la punta en el PA derecho, y luego con el cable y el introductor fuera, el dispositivo se retrae suavemente hasta que la punta esté justo proximal a la bifurcación del PA en las imágenes ETE y fluoroscópicas y al menos 3-4 cm más allá de la válvula pulmonar.
- Asegure la cánula del dispositivo en su lugar.
2. Conexión, activación y mantenimiento del dispositivo
- Desairee y conecte el tubo estándar provisto en el kit del dispositivo.
- Asegúrese de que el circuito esté cebado y desaireado antes de conectar la tubería.
- Conecte el tubo de salida marcado con una franja roja mediante el contacto de líquido con líquido al puerto de la cánula para el drenaje de sangre de retorno (de la bomba al paciente).
- Conecte el tubo de entrada de la bomba marcado con una raya azul mediante un contacto de fluido a fluido al puerto de la cánula para el drenaje de sangre (del paciente a la bomba).
- Suelte las abrazaderas.
- Encienda la bomba centrífuga a partir de 5.500 revoluciones por minuto (RPM).
- Aumente gradualmente las RPM de la bomba hasta alcanzar el nivel deseado de flujo.
- Vuelva a comprobar la posición de la bomba.
NOTA: La verificación de la posición de la punta de la cánula puede facilitarse en esta etapa, dado el flujo de color en los puertos de salida en TEE. - Asegure la bomba.
- Asegure la bomba usando el chaleco voyager (consulte la Tabla de materiales) o la envoltura (Figura 5) para mantener la estabilidad del dispositivo y permitir la comodidad y la deambulación del paciente.
- Realice el mantenimiento del dispositivo.
- Controle la posición del dispositivo con radiografías de tórax diarias. Monitoree de cerca la hemodinámica del paciente mientras el dispositivo está colocado para garantizar un soporte hemodinámico adecuado.
- Monitoree los laboratorios cada 6 h, incluido el hemograma completo, el panel metabólico completo, los electrolitos, el ácido láctico y la saturación venosa mixta extraída centralmente.
3. Extracción del dispositivo
- Desconecte el dispositivo siguiendo los pasos a continuación.
- Disminuya gradualmente la velocidad del dispositivo mientras monitorea la respuesta hemodinámica y de la función cardíaca.
NOTA: Por lo general, esto se realiza mientras se obtiene un estudio de rechazo del ecocardiograma que se centra en la función cardíaca con flujos más bajos en el dispositivo. El ácido láctico, la saturación venosa mixta y la función hepática/renal deben controlarse con frecuencia. Si en algún momento se observa un empeoramiento de la función del VD o una disfunción de los órganos terminales observada por laboratorios anormales, el paciente ha fracasado en el destete del VD y debe continuar con el apoyo.
- Disminuya gradualmente la velocidad del dispositivo mientras monitorea la respuesta hemodinámica y de la función cardíaca.
- Si la función RV parece adecuada para retirar el dispositivo y el paciente se oxigena y ventila bien, reduzca la velocidad y retire la cánula.
- Antes de retirar la cánula, pinje los puertos proximal y distal para evitar fugas de sangre.
- Retire la cánula.
NOTA: Una vez que la cánula se retrae hasta donde están expuestos los puertos del lado auricular, estos sitios sangrarán y, por lo tanto, la cánula debe tirarse suave pero rápidamente. Se coloca una sutura reabsorbible 2-0 en forma de ocho a través de la piel o el tejido subcutáneo para la hemostasia en el sitio de entrada.
Resultados
El dispositivo obtuvo inicialmente la aprobación de la FDA en los Estados Unidos después de un gran ensayo de control aleatorio, que reveló una mejora del 31% en la supervivencia en el tratamiento del síndrome de dificultad respiratoria aguda con el dispositivo utilizado comoVV_ECMO 22. Finalmente, fue aprobado como un desvío de RA a PA. Sin embargo, el dispositivo aún no ha sido aprobado para su uso como RVAD, aunque en muchos centros importantes, el dispositivo ya se está utilizando como sustituto de RVAD en muchos casos. Actualmente se están llevando a cabo estudios observacionales multicéntricos que evalúan aún más este dispositivo en el entorno de choque. El camino del soporte percutáneo para la cesárea ha sido largo y en constante evolución. El ensayo SHOCK original allanó la frontera para los dispositivos de soporte percutáneo en shock. Un gran ensayo controlado aleatorizado evaluó la bomba de balón intraaórtica (BIA) como una forma percutánea de soporte cardiopulmonar23. Desde el debut del ensayo SHOCK, varios dispositivos han llegado al mercado para el tratamiento del SC, incluido el dispositivo descrito.
Sin embargo, sigue habiendo poca o ninguna orientación sobre el uso de estos dispositivos en el choque de vehículos recreativos. Por ejemplo, la declaración de consenso de expertos más reciente de la Sociedad de Angiografía e Intervenciones Cardiovasculares (SCAI) de 2019 solo menciona brevemente el choque del VD. Afirma que es una forma única de SC con alta mortalidad asociada y sugiere evaluar y monitorear los catéteres hemodinámicos de PA para guiar el manejo adicional24.
A pesar de la falta de orientación consensuada por los expertos, la insuficiencia grave del VD está aumentando en prevalencia. Si bien estamos confundidos por el posible crecimiento en nuestra capacidad para diagnosticar el fracaso del VD y / o el aumento de los implantes de dispositivos de asistencia del VI y los trasplantes de corazón, que predisponen al fracaso del VD, un individuo con este diagnóstico tiene una tasa de mortalidad asociada de ~ 50% en 1 año25. La mayoría de los pacientes que se evalúan para este tipo de SQM se encuentran en el estadio D/E CS de SCAI, que son pacientes en deterioro y extremis, respectivamente.
Se ha demostrado que el dispositivo descrito, un pRVAD temporal mínimamente invasivo, reduce drásticamente la tasa de mortalidad a 1 año en esta población de pacientes a 15-19%13,14. Se cree que el dispositivo logra esto a través de la mejora en múltiples parámetros hemodinámicos, como la presión arterial media, la CVP, la presión de la AR, el trabajo del accidente cerebrovascular del VD, la saturación venosa mixta, el gasto cardíaco general, y permite una disminución en los requisitos generales del presor; por lo tanto, dando tiempo para la remodelación de la VD mostrada en un solo estudio centrado26. A pesar de que el VD es frágil, también tiende a ser bastante resistente y capaz de recuperarse con el tratamiento adecuado, como lo demuestra la población de HPTEC después de la tromboendarterectomía27.
Las tasas de complicaciones documentadas con este dispositivo varían en la literatura. Las tasas de infección, hemorragia y eventos embólicos pueden observarse hasta en el 40% de los casos o en tan solo el 10% de los casos28. La trombosis venosa profunda y la embolia pulmonar después del uso también son comunes. Sin embargo, no existen recomendaciones actuales para la vigilancia de coágulos después del uso ni recomendaciones para la profilaxis. La TR residual de moderada a grave se puede observar en ~36% de los casos, hemólisis relacionada con el dispositivo en ~14% de los casos y migración de la cánula en ~7% de los casos. Los estudios han demostrado que el destete exitoso del dispositivo se puede lograr en el 85%-90% de los pacientes29. La conversión a RVAD quirúrgico puede ser necesaria en ~11% de los casos3. Alrededor de ~ 10% de los pacientes mueren con soporte29. Existe una tasa de mortalidad intrahospitalaria por todas las causas del 15% y una asombrosa tasa de supervivencia del 81% al año (Tabla 1)11,26,30,31.

Figura 1: Cánula del dispositivo etiquetada. Cánula RVAD con introductor y piezas etiquetadas. Esta figura se reproduce con permiso de la Referencia32. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cánulas del dispositivo. Las cánulas RVAD de 29 Fr, 31 Fr y RD. Esta figura se reproduce con permiso de la Referencia32. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Dilatadores de dispositivos. Se utilizan para la dilatación en serie del sitio de acceso. Esta figura se reproduce con permiso de la Referencia32. Haga clic aquí para ver una versión más grande de esta figura.
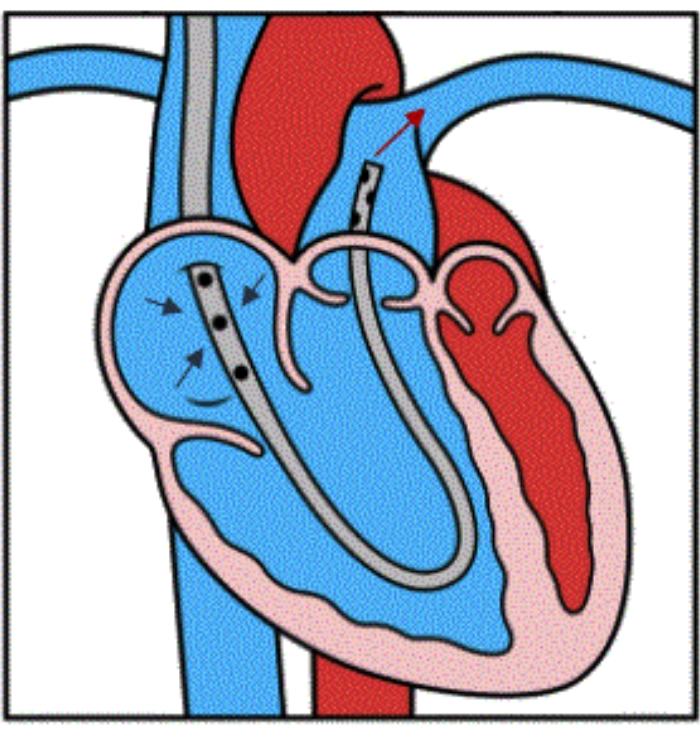
Figura 4: Ilustración del flujo del dispositivo. Ilustración que muestra la colocación adecuada del dispositivo dentro de la PA principal distal. Las tres flechas azules indican el drenaje venoso de la AR hacia los orificios laterales de la cánula. La flecha roja muestra la reinfusión de sangre en el PA principal, sin pasar por el VD. Esta figura se reproduce con permiso de la Referencia32. Haga clic aquí para ver una versión más grande de esta figura.
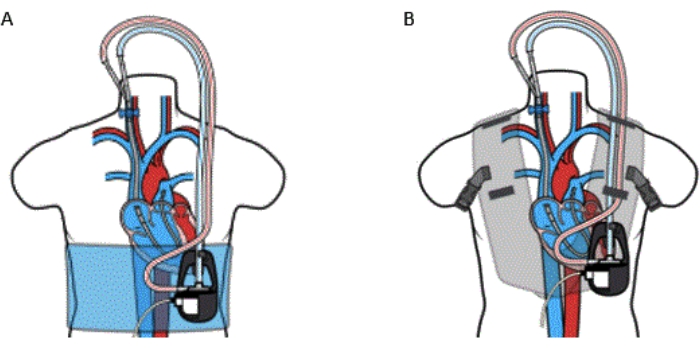
Figura 5: Cánula de dispositivo percutáneo RA a PA Bypass con (A) envoltura y (B) chaleco. El kit VoyagerVest no debe usarse en pacientes con una alergia conocida al neopreno. Esta figura se reproduce con permiso de la Referencia32. Haga clic aquí para ver una versión más grande de esta figura.
| A. Complicaciones | |
| Tasas de infección, hemorragia y eventos embólicos | 10%-40% |
| TR residual de moderada a grave | ~36% |
| Hemólisis relacionada con el dispositivo | ~14% |
| Migración de cánulas | ~7% |
| B. Resultado relacionado con el dispositivo | |
| Destete exitoso del dispositivo | ~85%-90% |
| Conversión a RVAD quirúrgico | ~11% |
| Los pacientes fallecieron con apoyo | ~10% |
| Mortalidad intrahospitalaria | 15% |
| Tasa de supervivencia en un año | ~81% |
Tabla 1: A. Complicaciones de la SQM Protek Duo; B. Resultados relacionados con el dispositivo
Discusión
El choque de RV presagia una mortalidad excepcionalmente alta. Debe reconocerse temprano en el curso de la enfermedad y tratarse de manera agresiva. El Protek Duo es un MCS de última generación para el tratamiento del choque RV que se puede colocar durante cualquiera de las etapas del choque SCAI. Algunos pasos críticos en la colocación del dispositivo incluyen: obtener acceso utilizando la técnica de Seldinger modificada21, dilatación secuencial del sitio de acceso a una vaina Fr de tamaño apropiado, flotar un catéter con punta de globo en la PA principal, introducir una guía rígida a través del catéter con punta de globo en la PA principal, retirar el catéter con punta de globo, administrar heparina intravenosa, y, finalmente, hacer avanzar el dispositivo sobre el alambre rígido después de alcanzar un nivel terapéutico de ACT. Una vez que se confirma que el dispositivo se encuentra en la posición correcta mediante fluoroscopia o ecocardiografía con o sin análisis de ondas de presión a través del catéter PA, se pueden quitar el cable y el introductor, y el dispositivo se puede asegurar en su lugar. En raras situaciones emergentes, este dispositivo se puede colocar junto al uso de TEE para la visualización y / o utilizando la forma de onda de presión PA para confirmar el posicionamiento correcto del dispositivo; sin embargo, si un paciente se está deteriorando agudamente y se necesita un dispositivo de soporte al lado de la cama, puede ser más apropiado pasar a la ECMO venoso-arterial o alguna otra estrategia de soporte. De lo contrario, este procedimiento debe realizarse en una sala de fluoroscopia o dentro de un quirófano.
Existen varias variaciones de este procedimiento documentadas en la literatura. El protocolo presentado en este artículo proviene de nuestra experiencia en un solo centro. Es importante reconocer varias posibles modificaciones al protocolo descrito. Una modificación sería la elección del sitio de acceso. El sitio de acceso recomendado para este procedimiento es la vena IJ10 derecha. Este acceso proporciona un acceso directo al corazón derecho y ha demostrado ser el menos problemático de implantar. Sin embargo, los procedimentales pueden implantar este dispositivo a través de la vena subclavia izquierda, IJ izquierda o subclavia derecha33. Se enumera en orden de preferencia, excepto en el caso del enfoque subclavio derecho, que actualmente no se utiliza como opción, pero ha tenido éxito en otras instituciones. Uno de estos sitios de acceso alternativos puede ser preferido en pacientes con oclusión del sitio de acceso. Si se sospecha de oclusión en el sitio de acceso, se recomienda visualizar tanto el IJ izquierdo como los sitios de acceso subclavio mediante una ecografía Doppler para evaluar la permeabilidad antes del despliegue del dispositivo. También se puede realizar un venograma para evaluar el acceso.
Hay algunas advertencias al usar el acceso alternativo. Un problema con el uso del abordaje subclavio izquierdo es una incidencia no trivial de trombosis subclavia34. Dado que esto puede impedir el acceso a la diálisis futura mediante la vena subclavia, el sistema subclavio se utilizó con precaución en los pacientes que se esperaba que requirieran diálisis. Por lo general, cuando se utiliza el abordaje subclavio izquierdo, una cánula de 31 Fr debe tener una longitud suficiente. El enfoque IJ izquierdo es más difícil de usar dado el curso altamente tortuoso hacia el PA derecho. Desde la vena IJ izquierda, hay un giro brusco de 90° para ingresar a la vena innominada y luego pasar a la vena cava superior (SVC), que conduce a la AR. Este giro inicialmente agregado con este acceso podría dificultar que el procesalista realice el segundo giro hacia el RA y, posteriormente, el tercer giro desde el RA a través del RV hacia el PA principal.
Al igual que puede ser difícil colocar la punta de la cánula del dispositivo dentro de la PA principal utilizando estos sitios de acceso separados, el procesador puede tener problemas para lograr que el catéter con punta de balón flote en la posición correcta. Esto puede requerir varios intentos de flotación. En particular, dos puntos principales dificultan la flotación en posición. Una es desde la casa rodante hacia la derecha. Si hay problemas, intente avanzar el catéter durante la sístole y use el empuje del ventrículo y el flujo de sangre para ayudar a que el cisne flote en su posición. El desafío del segundo lugar es del SVC al RA. Esto es común en los corazones trasplantados. A veces, se desarrolla una cresta en la línea de sutura de SVC y la línea de sutura de PA que puede obstruir el paso del catéter con punta de balón. Si esto sucede, cambie su funda sobre el alambre por una funda más larga que pase más allá de esta cresta hacia el RA. Esto asegurará que el catéter con punta de balón tenga acceso al corazón derecho. Además, con la colocación de un dispositivo en el momento del trasplante, esto a menudo se hizo mientras el tórax aún está abierto, lo que puede garantizar la integridad de las líneas de sutura anastomóticas con el paso del dispositivo y preservar las opciones de RVAD abiertas si el dispositivo no se puede implementar con éxito.
Es necesario conocer algunos consejos para la solución de problemas antes de realizar este procedimiento. Por ejemplo, a veces, la rigidez de la cánula puede hacer que baje preferentemente por la vena cava inferior (VCI) en lugar de seguir la curva del alambre hacia y a través de la válvula tricúspide. Si esto no se remedia con un cable rígido, considere dejar la cánula in vivo por un tiempo. Esto permitirá que la cánula se ablande por el calor dentro del cuerpo y luego se vuelva gradualmente más maleable, lo que facilita la manipulación del dispositivo para seguir la curva del cable. Las variaciones en la anatomía también pueden resultar desafiantes para los operadores. Tenga cuidado con la anatomía más pequeña de la VCS, lo que aumenta el riesgo de síndrome de la VCS. El sangrado durante el procedimiento también puede ser otra complicación. Aunque es menos frecuente que sea una complicación importante ya que este protocolo utiliza el acceso venoso de baja presión. Se debe esperar algo de sangrado; Sin embargo, por lo general se pueden evitar grandes cantidades de sangrado. Esto se puede lograr a través de una dilatación secuencial cuidadosa del recipiente de acceso. Aplique compresión a la piel proximal al sitio de acceso para taponar el vaso durante la extracción de cada dilatador. Debe haber una opción alternativa de soporte si el dispositivo no se puede implementar. Al final del procedimiento, también es esencial asegurarse de que el dispositivo esté colocado correctamente, que el dispositivo esté seguro y aplicar almohadillas en las partes externas de la cánula cerca del cuerpo para evitar úlceras por presión en la cabeza, el cuero cabelludo, las orejas y otras partes del cuerpo en las proximidades. El dispositivo en sí es trombogénico y requiere anticoagulación continua mientras está en uso35. Cualquier contraindicación para la anticoagulación sería una contraindicación relativa para el uso de este dispositivo. También puede producirse un trombo después de la extracción. Se encuentra un gran molde de trombo desde la cánula desde la AR hasta el TSVD, y en una experiencia mínima, han sido capaces de manejar esto con anticoagulación.
La regurgitación tricuspídea (TR) es una posible complicación2 asociada con el uso de este pRVAD. A medida que la cánula pasa a través de la válvula tricúspide (TV), obstruye las valvas e inhibe la coaptación adecuada de las valvas. Por lo general, esto no es un problema mientras la cánula está en su lugar. Sin embargo, si hay daño residual en el televisor, puede haber TR hemodinámicamente significativo revelado con la extracción del dispositivo. Una complicación menos frecuente, pero posiblemente más grave, es el desarrollo de trombocitopenia y hemólisis relacionadas con el dispositivo. Esto a veces se puede confundir con HITT16, que también es común en esta población de pacientes. Por último, puede producirse la migración de la cánula. Aquí es donde la cánula prolapsa en el VD o avanza hacia los PA derecho o izquierdo. Aunque, si la cánula favorece la PA derecha o izquierda, no suele ser perjudicial dependiendo del caudal requerido y otras consideraciones anatómicas. Por el contrario, tener la cánula demasiado superficial puede correr el riesgo de prolapso por debajo de la válvula pulmonar, lo que puede ser hemodinámicamente catastrófico. Por lo tanto, la punta distal del dispositivo debe estar al menos a 3-4 cm distal de la válvula pulmonar (se explica más adelante). La cánula debe asegurarse con cuidado durante el transporte y el movimiento del paciente para evitar el desplazamiento de la posición de la cánula.
Al igual que con cualquier objeto o implante intravascular, el dispositivo corre el riesgo de infección, especialmente el uso prolongado. Si se confirma la infección del dispositivo, esto puede requerir el cambio o la conversión a una estrategia de soporte alternativa (p. ej., VA-ECMO). En situaciones extremas de un dispositivo infectado en las que el paciente no toleraría la interrupción del soporte, y la VA-ECMO no era una opción viable, se colocó un dispositivo de doble cánula subclavia izquierda antes de retirar un dispositivo IJ derecho infectado y ambos dispositivos permanecieron brevemente en el corazón al mismo tiempo. Por lo tanto, no hubo interrupción en el soporte.
En conclusión, el dispositivo descrito es actualmente un dispositivo aprobado por la FDA para tratar la falla del RV. Además, su principal ventaja es que permite la deambulación en tándem, una mayor comodidad para el paciente y menores tasas de infección debido a su capacidad para evitar el acceso a la ingle. Se espera que futuros estudios y ensayos clínicos destaquen aún más los beneficios y resultados de este dispositivo en la práctica clínica.
Divulgaciones
Poonam Velagapudi divulga las siguientes relaciones con la industria: Speaker's bureau- Abiomed, Opsens; consejo asesor- Abiomed, Sanofi; comidas/gastos de viaje: Abiomed, Boston Scientific, Medtronic, Chiesi, Phillps.
Agradecimientos
Este manuscrito no habría sido posible sin el apoyo excepcional de mis mentores, el Dr. Poonam Velagapudi y el Dr. Anthony Castleberry, y el apoyo de todos los Departamentos Cardiovascular y Cardiotorácico del Centro Médico de la Universidad de Nebraska. No se utilizaron fondos para la elaboración de este documento.
Materiales
| Name | Company | Catalog Number | Comments |
| Amplatzer Super Stiff Wire 0.035' x 145 cm | Boston Scientific | M001465631 | If not in stock, may use any stiff 0.035" wire. |
| Avalon Tracheal Dilator | Avalon Laboratories Inc., Rancho Dominguez, CA | 12210 | This comes in a set. The 30 Fr dilator is the only part used. |
| Full 29 Protek Duo Kit | LivaNova/ Tandem Life | 5820-2916 | Cannula, pump, holster, wrap |
| Full 31 Protek Duo | LivaNova/Tandem Life | 5820-3118 | Cannula, pump, holster, wrap |
| Hemochron Signature Elite ACT Testing Device and Supplies | Werfen North America | DCJACT-A and DCJACT-N | |
| Lidocaine | Pharmaceutical | Pfizer | |
| LifeSPARC Centrifugal Pump | LivaNova/ Tandem Life | 5840-2417 | |
| Micropuncture needle | Cook Medical | G56202 | 5 Fr |
| Multi-Lumen Access Catheter | Arrow/Teleflex | AK-21242-CDC | 9 Fr |
| Preparation solution | Pharmaceutical | NA | Chlorohexidine-based or iodine-based |
| Protek Duo Cannula 29Fr | LivaNova/ Tandem Life | 5140-4629 | Components: One 29 Fr ProtekDuo Veno-Venous Wire Reinforced Cannula with radiopaque tip markers, One 13 Fr Introducer |
| Protek Duo Cannula 31Fr | LivaNova/Tandem Life | 5140-5131 | - 31 Fr x 51 cm Veno-Venous Dual Lumen Cannula with Introducer |
| Protek Duo Insertion Kit | LivaNova/ Tandem Life | 5100-0014 | Components: balloon tipped PA catheter, one 0.035 stiff guidewire |
| Protek Duo RD Cannula | LivaNova/Tandem Life | 5820-3631 | Cannula, introducer |
| Swan Ganz Catheter | Edwards Lifesciences | 774F75 or 777F8 | |
| Ultrasound | Standard vascular ultrasound. | GE | |
| Ultrasound probe cover over the ultrasound transducer | Standard probe cover to match vascular ultrasound transducer | GE | |
| Voyager Vest Kit | LivaNova/Tandem Life | Contact LivaNova | Includes vest and wrap. Should not be used on patients with a known allergy to neoprene. |
Referencias
- Saxena, A., et al. Value of hemodynamic monitoring in patients with cardiogenic shock undergoing mechanical circulatory support. Circulation. 141 (14), 1184-1197 (2020).
- Arrigo, M., et al. Right ventricular failure: Pathophysiology, diagnosis and treatment. Cardiac Failure Review. 5 (3), 140-146 (2019).
- Jacob, M., et al. Right ventricular dysfunction post-heart transplantation. Right Ventricular Physiology, Adaptation and Failure in Congenital and Acquired Heart Disease. , 193-216 (2018).
- Haddad, F., et al. Right ventricular function in cardiovascular disease, part II. Circulation. 117 (13), 1717-1731 (2008).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Patel, N., et al. Percutaneous biventricular mechanical circulatory support with impella CP and Protek Duo Plus. Journal of Invasive Cardiology. 31 (2), 46 (2019).
- Banfi, C., et al. Veno-venous extracorporeal membrane oxygenation: cannulation techniques. Journal of Thoracic Disease. 8 (12), 3762-3773 (2016).
- Jayaraman, A. L., Cormina, D., Shah, P., Ramakrishma, H. Cannulation strategies in adult veno-arterial and veno-venous extracorporeal membrane oxygenation: Techniques, limitations, and special considerations. Annals of Cardiac Anaethesia. 20 (1), 11-18 (2017).
- Nicolias, C. D., et al. Use of Protek duo tandem heart for percutaneous right ventricular support in various clinical settings: A case series. Journal of the American College of Cardiology. 71 (11), 1314 (2018).
- Kang, G., Ha, R., Banerjee, D. Pulmonary artery pulsatility Index Predicts Right Ventricular Failure After Left Ventricular Assist Device Implantation. The Journal of Heart and Lung Transplantation. 35 (1), 67-73 (2016).
- Johnson, G. Protek Duo Veno-venous cannula. Food and Drug Administration. , (2017).
- Carrozzini, M., et al. Percutaneous RVAD with the Protek Duo for severe right ventricular primary graft dysfunction after heart transplant. The Journal of Heart and Lung Transplantation. 40 (7), 580-583 (2021).
- Salna, M., et al. Novel percutaneous dual-lumen cannula-based right ventricular assist device provides effective support for refractory right ventricular failure after left ventricular assist device implantation. Interactive Cardiovascular and Thoracic Surgery. 30 (4), 499-506 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit Cardiogenic Shock Initiative. Catheter Cardiovascular Intervention. 91 (3), 454-461 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2021).
- Memon, H. A., et al. Extracorporeal membrane oxygenation support through Protek Duo cannula: A case series. The American Journal of Respiratory and Critical Care Medicine. 201, 5115 (2020).
- Ravichandran, A. K., Baran, D. A., Stelling, K., Cowger, J. A., Salerno, C. T. Outcomes with the tandem Protek Duo dual lumen percutaneous right ventricular assist device. ASAIO Journal. 64 (4), 570-572 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2020).
- Belani, K., et al. Transapical Protek Duo rapid deployment cannula as temporary left ventricular assist device in a Jehovah's Witness. Journal of Cardiothoracic and Vascular Anesthesia. 35 (12), 3735-3742 (2020).
- Khalid, N., et al. Adverse events and modes of failure related to impella RP: Insights from the Manufacturer and User Facility Device Experience (MAUDE) database. Cardiovascular Revascularization Medicine. 20 (6), 503-506 (2019).
- Ramos, F., et al. Técnica modificada de Seldinger. Canalización de catéteres venosos centrales a través de catéteres venosos periféricos [Seldinger modified technique]. Revista de Enfermeria. 31 (12), 14-16 (2008).
- Peek, J., et al. Efficacy and economic assessment of conventional ventilator support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicenter randomized controlled trial. Lancet. 374 (9698), 1351-1363 (2009).
- Menon, V., et al. Cardiogenic shock: A summary of the randomized SHOCK trial. Congestive Heart Failure. 9 (1), 35-39 (2003).
- Baran, A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Santas, E., et al. Right ventricular dysfunction staging system for mortality risk stratification in heart failure with preserved ejection fraction. Journal of Clinical Medicine. 9 (3), 831 (2020).
- Kapur, N. K., et al. Effects of a percutaneous mechanical circulatory support device for medically refractory right ventricular failure. The Journal of Heart and Lung Transplant. 30 (12), 1360-1367 (2011).
- Murata, M., et al. Clinical significance of Guanylate Cyclase stimulator, riociguat, on right ventricular functional improvement in patients with pulmonary hypertension. Cardiology. 146 (1), 130-136 (2021).
- Aggarwal, V., et al. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheter Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Schmack, B., et al. Results of concomitant groin-free percutaneous temporary RVAD support using a centrifugal pump with a double-lumen jugular venous cannula in LVAD patients. Journal of Thoracic Disease. 11 (6), 913-920 (2019).
- Cheung, A. W., White, C. W., Davis, M. K., Freed, D. H. Short-term mechanical circulatory support for recovery from acute right ventricular failure: Clinical Outcomes. The Journal of Heart and Lung Transplantation. 33 (8), 794-799 (2014).
- Takayama, H., et al. A novel approach to percutaneous right-ventricular mechanical support. European Journal of Cardiothoracic Surgery. 41 (2), 423-426 (2011).
- D'Angelo, F., et al. Alternative insertion sites for permanent central venous access devices. European Journal of Surgical Oncology. 23 (6), 547-549 (1997).
- Hill, S., et al. Subclavian vein thrombosis: a continuing challenge. Surgery. 108 (1), 1-9 (1990).
- Silva, E., et al. Management of RVAD thrombosis in biventricular HVAD supported patients: Case series. ASAIO Journal. 65 (4), 36-41 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados