Method Article
إدخال وصيانة وإزالة جهاز مساعدة البطين الأيمن للقنية ثنائية التجويف عن طريق الجلد
In This Article
Summary
يوفر البروتوكول الحالي وصفا تفصيليا لجهاز مساعدة البطين الأيمن ثنائي التجويف عن طريق الجلد ويوضح إرشادات خطوة بخطوة حول الزرع الآمن للجهاز وإدارته وإزالته. يتم أيضا تضمين إرشادات حول استخدامه واستكشاف المضاعفات وإصلاحها من واحدة من أهم تجارب المركز الفردي.
Abstract
لا تزال صدمة البطين الأيمن (RV) ، التي تتميز تقليديا بارتفاع الضغط الوريدي المركزي (CVP) مع الضغط الطبيعي إلى المنخفض للشريان الرئوي (PA) والضغط الوتفيد الشعري الرئوي (PCWP) ، سببا مهما للمراضة والوفيات في جميع أنحاء العالم إذا تركت دون علاج. تتراوح علاجات علاج صدمة RV من الإدارة الطبية إلى دعم الدورة الدموية الميكانيكية المتينة أو عن طريق الجلد (MCS). يعمل جهاز MCS الفريد ، وهو جهاز مساعدة البطين الأيمن عن طريق الجلد (pRVAD) ، تمت الموافقة عليه للاستخدام من قبل إدارة الغذاء والدواء (FDA) في عام 2014 ، عن طريق تفريغ عربة سكن متنقلة مؤقتا من خلال قسطرة واحدة مزدوجة التجويف مع دعم ميكانيكي خارج الجسم وقادر على تحويل الدم من الأذين الأيمن (RA) إلى PA الرئيسي. على الرغم من الموافقة عليه في البداية كجهاز أكسجة غشاء وريدي خارج الجسم (VV-ECMO) ، إلا أن هذا العمل سيركز على استخدام دعم RV ، حيث تم وصف استراتيجيات VV-ECMO المتنقلة سابقا. يتم إدخال القسطرة بشكل شائع من خلال الوريد الوداجي الداخلي الأيمن (IJ) في PA وتوصيلها بمضخة خارجية ، مما يسمح بتدفق يصل إلى 5 لتر / دقيقة. قد يكون هذا الجهاز خيارا جذابا لعلاج صدمة RV نظرا لإدخاله وإزالته عن طريق الجلد والحد الأدنى من التوغل وقدرته على السماح للمريض بالتنقل أثناء وجود الجهاز في مكانه. يناقش هذا البروتوكول بالتفصيل المعدات ، والتأثيرات الديناميكية الدموية ، والمؤشرات ، وموانع الاستعمال ، والمضاعفات ، والأبحاث المتاحة حاليا في الأدبيات ، والإرشادات خطوة بخطوة حول كيفية زرع الجهاز وإدارته واستخراجه ، جنبا إلى جنب مع إرشادات حول الاستخدام واستكشاف المضاعفات وإصلاحها من واحدة من أكبر تجارب المركز الفردي مع الجهاز.
Introduction
لا تزال الصدمة القلبية (CS) من فشل البطين الأيمن (RV) واحدة من أصعب أمراض القلب في إدارتها وتنذر بارتفاع معدل الوفيات والمراضة1. هناك ثلاث حالات مرضية أولية قد تؤدي إلى فشل عربة سكن متنقلة: فقدان انقباض عضلة القلب ، والحمل الزائد للحجم ، والحمل الزائد للضغط2. بعد زراعة القلب ، يمكن أن يكون فقدان انقباض RV ثانويا لنقص تروية عضلة القلب أو الاحتشاء أو الالتهاب الناجم عن التهاب عضلة القلب أو الخلل الوظيفي الأوليفي الكسب غير المشروع 3. قد يكون الحمل الزائد لحجم RV ثانويا لعدم كفاية الصمامات في الجانب الأيمن, تحويلة, أو التخلص غير الكافي من الحجم (على سبيل المثال, الفشل الكلوي) بالنسبة إلى المدخول المعوي أو الوريدي4. قد ينتج الحمل الزائد لضغط RV عن تفاقم ارتفاع ضغط الدم الرئوي (pHTN) ، أو التضيق الرئوي ، أو الصمة الرئوية الحادة ، أو قصور القلب الأيسر الذي لا يعوضه ، وهو السبب الأكثر شيوعا لفشل RV5. أصبحت خيارات العلاج عن طريق الجلد واحدة من الدعائم الأساسية لعلاج RV CS. إلى جانب العلاج الطبي ، تتوفر أجهزة متعددة لعلاج فشل RV ، بما في ذلك الأكسجة الغشائية الوريدية خارج الجسم (VA-ECMO) ، وجهاز مساعدة البطين الأيمن المفتوح / المركزي (RVAD) ، و Impella RP ، وجهاز مساعدة TandemHeart RV ، و Protek Duo2.
Protek Duo هو RVAD طفيف التوغل عن طريق الجلد (pRVAD) مع قنية مزدوجة التجويف تسمح بالتنقل أثناء وجود الجهاز في مكانه6 ويتم استخدامه بشكل متزايد في RV CS لتفريغ عربة سكن متنقلة. على الرغم من الموافقة عليه في البداية كجهاز أكسجة غشاء وريدي خارج الجسم (VV-ECMO) ، إلا أن هذا العمل سيركز على استخدامه لدعم RV ، حيث تم وصف استراتيجيات VV-ECMO المتنقلة سابقا7. يقوم بتفريغ عربة سكن متنقلة عن طريق تحويل الدم من RA إلى الشريان الرئوي (PA) ويسمح بخيار توصيل مضخة تدفق مستمر خارج الجسم بالطرد المركزي مع أو بدون مؤكسج للسماح بدعم RV الأمثل. تمت الموافقة على استخدام الجهاز في عام 2014 من قبل إدارة الغذاء والدواء (FDA)8. يمكن أن توفر تدفقات تصل إلى 4.5-5 لتر / دقيقة 9,10. يسحب تصميم القسطرة ثنائي التجويف الدم عبر قنية التدفق القريب في RA ويوجهها عبر PA المركزي ، متجاوزا عربة سكن متنقلة بشكل أساسي.
تحتوي القنية على لومن مميز بجسم مقوى بالأسلاك. تسمح قناتان متحدتان المركز للتدفق ثنائي الاتجاه داخل قنية واحدة بالتصريف الوريدي المتزامن وإعادة ضخ الدم أثناء الدعم خارج الجسم. الجزء القريب من الجهاز مفصول وغير سلكي مما يسمح بالتثبيت الخارجي لمنع تدفق الدم أثناء زرع واستخراج جهاز القنية. لتحديد موقع الجهاز بدقة ، يتم تمييز القنية بعلامات بعيدة وقريبة لتحديد عمق الإدخال. العلامات البعيدة هي ظليل للأشعة ، مما يسمح بتصور الجهاز في التصوير الشعاعي لتحديد موضع القسطرة داخل الأذين الأيمن (RA). إلى جانب العلامات ، توجد فتحات أو ثقوب في الطرف البعيد والجزء الأوسط من القسطرة. تسمح الثقوب الجانبية الستة الموجودة في الطرف البعيد للدم بالتدفق من القسطرة إلى PA. تسمح فتحات العمود الأوسط للدم غير المؤكسج بالتدفق إلى القسطرة من التهاب المفاصل الروماتويدي (الشكل 1). يتيح هذا التصميم استخدام الجهاز قبل الجراحة وأثناءها وبعدها طوال سلسلة الإجراءات التي تتطلب المجازة القلبية الرئوية (CPB). على سبيل المثال ، تم استخدام الجهاز من قبلنا بمعزل عن الآخرين أو كجزء من الدعم المؤقت ثنائي البطين قبل جهاز مساعدة البطين الأيسر المتين (LVAD). ثم تم تحويله إلى قنية تصريف وريدية ل CPB أثناء الإجراء (عن طريق "Y" لربط الطرفين بطرف التصريف الوريدي للدائرة) ثم العودة إلى مجازة RA / PA لدعم RVAD بعد الجراحة. بالإضافة إلى ذلك ، تم استخدام القنية أيضا كفتحة تهوية PA لتفريغ / تنفيس البطين الأيسر (LV) في إعداد VA-ECMO مع انتفاخ LV عن طريق تطبيق التصريف الوريدي على كل من منافذ RA و PA ، مرة أخرى في إعداد التحضير لإجراءات CPB والتحويل اللاحق إلى دعم RVAD.
حاليا ، يتوفر حجمان ، 29 فرنكا أو 31 فرنكا (الشكل 2). تم تصميم هذه القسطرة لتحسين سهولة الإدخال ، وبالتالي ، لها تصميم مدبب للسماح للجزء البعيد من الجهاز بالمرور عبر جميع هياكل القلب بأمان. على وجه التحديد ، يتناقص 29 Fr إلى 16 Fr ، و 31 Fr يتناقص تدريجيا إلى 18 Fr. كلا الحجمين مصنوعان من نفس المواد. وفقا لإدارة الغذاء والدواء الأمريكية (FDA) ، فإن كلا الحجمين متطابقان في قوة الشد وسلامة المسار ونصف قطر الشبك ومعدلات انحلال الدم. وهي تختلف فيما يتعلق بصلابة القنية وخصائص تدفق الضغط ، وهو أمر متوقع مع تغيير في قطر القنية. على الرغم من اختلافاتهم ، إلا أنهم مصممون على أن يكونوا متكافئين في القدرات الوظيفية. عادة ما تستخدم أحجام Fr الأكبر لأولئك الذين يحتاجون إلى المزيد من تدفق الدم لتحقيق الدعم الديناميكي الدموي الأمثل11.
مؤشر أساسي لاستخدام pRVAD هو فشل RV المقاوم للحرارة. يتضمن ذلك حالة فشل RV بعد وضع LVAD ، أو حالة ما بعد بضع القلب ، أو احتشاء عضلة القلب الحاد ، أو حالة ما بعد زراعة القلب12. غالبا ما يستخدم هذا الجهاز جنبا إلى جنب مع علاجات أخرى مثل مدرات البول ، والعوامل التقلية العضلية ، ومثبطات الأوعية الدموية ، وموسعات الأوعية الرئوية لتوفير دعم ديناميكي الدم الأمثل الفردي مع إتاحة الوقت لإعادة تشكيل عربة سكن متنقلة أصلية. كما تم توثيق استخدام الجهاز في pHTN الحاد ، كما هو مذكور في المثال أعلاه ، والتهاب عضلة القلب الحاد13. في تجربتنا ، كان لدينا فطام ناجح من الدعم والخروج من المستشفى باستخدام pRVADin pHTN الشديد. ومع ذلك ، فإن مثل هذه الحالات نادرة ، وبشكل عام ، يتم تجنب دعم RVAD في وضع ارتفاع ضغط الدم الشديد نظرا للضغط المتزايد داخل PAs ، وبالتالي يفضل فك ضغط PAs باستخدام VA-ECMO (استراتيجيات الإسعاف إذا كان الدعم المطول ضروريا) أو RA لتكوينات تجاوز الأذين الأيسر عندما يكون ذلك ممكنا.
يستخدم مؤشر نبض الشريان الرئوي (PAPI) بشكل شائع مع التقييم السريري الشامل لتحديد المرضى الذين قد يستفيدون من الإدارة طفيفة التوغل باستخدام هذا الجهاز. PAPI هو مقياس ديناميكي دموي تم التحقق من صحته لتقييم درجة ووجود فشل RV. يتم حسابه باستخدام ضغط PA الانقباضي مطروحا منه الضغط الرئوي الانبساطي مقسوما على الضغط الوريدي المركزي (CVP). يجب النظر في المرضى الذين لديهم PAPI أقل من 0.9 لدعم عربة سكنمتنقلة 13. يمكن حساب ناتج الطاقة القلبية (CPO) باستخدام PAPI للتمييز بين المرضى الذين قد يستفيدون من علاج دعم RV. يتم حسابه بضرب متوسط الضغط الشرياني في النتاج القلبي وقسمته على 451. إذا كان CPO أقل من 0.6 ، فقد يكون هناك ما يبرر علاج فشل عربة سكن متنقلة. إذا كان CPO أكبر من 0.6 ، فهناك مجال لتفسير ومناقشة العلاجات الأخرى الممكنة14. ومع ذلك ، توصي معظم الأدلة بعلاجات RV إذا كان PAPI أقل من 0.9 ، كما هو مذكور أعلاه. في النهاية ، يعتمد قرار الدعم الميكانيكي على التقييم السريري مع هذه المقاييس الكمية كمساعدات قيمة في صنع القرار.
تشمل موانع استخدام جهاز دعم الدورة الدموية الميكانيكية (MCS) أي أمراض حادة في انسداد الأوعية الدموية أو القلب الأيمن ، بما في ذلك تضيق الوريد الوداجي الداخلي (IJ) أو تجلط الدم ، والتضيق الرئوي الشديد ، واستبدال الصمام ثلاثي الشرف السابق ، مما يمنع الوضع الآمن للجهاز11. تتطلب حالة متلازمة الوريد الأجوف العلوي الحاد (SVC) بعد وضع IJ Protek Duo المناسب إعادة تشكيل طارئة لاستراتيجية دعم بديلة. في حالة عدم وجود تضيق شديد في الصمام ثلاثي الشرف ، فإن إصلاح الصمام ثلاثي الشرف ليس موانع لاستخدام الجهاز. استبدال الصمام الرئوي (PVR) ليس موانع ، وهناك العديد من التقارير في الأدبيات حول استخدام هذا الجهاز داخل PVR15. موانع نسبية لاستخدام pRVADهو تاريخ من استئصال الالتهاب الرئوي بسبب ربط أحد PAs الفرع القريب مع هذا الإجراء والقلق من إصابة الأسلاك أو القنية في جذع PA أو الضغط المفرط على الجذع عن طريق تدفق RVAD. بالإضافة إلى ذلك ، في الحالات التي تحتوي على إشعاع واسع النطاق على الصدر ، قد لا تسمح الأنسجة بتوسيع ووضع القنية ، مما يحول دون وضع جهاز المساعدة الملازمة.
ترتبط العديد من المضاعفات باستخدام جهاز MCS هذا. يتمثل أحد المخاطر المحتملة في علاج صدمة RV بالجهاز في الكشف عن خلل LV أو الخلل الوظيفي ثنائي البطين الذي لم يتم التعرف عليه سابقا. على سبيل المثال ، في بعض الأحيان ، مع فشل RV ، يبدو LV طبيعيا زائفا بسبب نقص كبير في LV. ومع ذلك ، مع وجود RVAD في مكانه ، يتم تحسين التدفق الأمامي ، وقد يؤدي الملء المتزايد ل LV إلى الكشف عن خلل LV. في كثير من الأحيان ، قد يحتاج هؤلاء المرضى إلى التحويل إلى VA-ECMO. علاوة على ذلك ، فإن الطبيعة التخثرية للقنية تعرض المريض لخطر الإصابة بأحداث الانصمام الخثاري. لمكافحة هذه المشكلة ، من العلاج القياسي أن يتم علاج جميع المرضى بالتزامن مع مضادات التخثر. ومع ذلك ، فإن إضافة العلاج المضاد للتخثر له خطورة خاصة به لمضاعفات النزيف مثل نزيف موقع الوصول ، ونزيف الجهاز الهضمي ، والسكتة الدماغية النزفية ، وخطر نقص الصفيحات الناجم عن الهيبارين (HITT) 16. يمكن أن يتسبب انقطاع منع التخثر بسبب مضاعفات النزيف في تجلط المضخة. يجب استبدال الجهاز بشكل عاجل في هذا الإعداد. يجب توضيح التشخيص بسرعة من بين الأسباب الأخرى للتدهور الديناميكي الدموي الحاد وانخفاض تدفق الجهاز ، بما في ذلك الإنتان أو نقص حجم الدم / النزيف.
على الرغم من كل مضاعفاته المحتملة ، أصبح هذا pRVAD أكثر شيوعا في العديد من المستشفيات في جميع أنحاء الولايات المتحدة للإدارة غير الغازية لفشل RV. يسمح تصميمه المحمول للمرضى بالجلوس والوقوف وحتى التجول بحرية إذا تم وضعه وتأمينه بشكل مناسب. يمكن إزالته بسهولة بجانب السرير بعد فطام الجهاز. الجهاز معتمد من إدارة الغذاء والدواء الأمريكية للاستخدام لمدة تصل إلى 6 أيام ، ولكن كانت هناك تقارير عن الاستخدام لمدة تتراوح من أسابيع إلىأشهر 17. يمكن استخدام الجهاز لدعم VV-ECMO عن طريق إضافة جهاز أكسجين إلى الدائرة في أي وقت أثناء استخدام الجهاز18. يحتوي الجهاز 31 Fr أيضا على إصدار النشر السريع (RD) كما هو موضح في الشكل 3. تمت الإشارة إلى RD بشكل رئيسي في الأدبيات كجهاز دعم مؤقت للبطين الأيسر يستخدم كجسر لأجهزة الدعم الأخرى مع التنسيب عبر نهج قمي لتوفير دعم LV طفيف التوغل19.
على عكس Protek Duo ، فإن Impella RP هو جهاز عن طريق الجلد يستخدم لدعم RV يتم إدخاله في الوريد الفخذي ، ويتطلب راحة صارمة في الفراش ، ولا يسمح بالتجوال. كما أنه يوفر تدفقا محوريا مقارنة ب Protek Duo ، الذي يوفر تدفقا بالطرد المركزي. أجهزة تدفق الطرد المركزي لديها أحداث نزيف أقل مرتبطة بالجهاز الهضمي مع معدلات سكتة دماغية مماثلة17. تشمل المضاعفات الشائعة للإصابة ب Impella RP النزيف (42.9٪) ، ومشاكل الأوعية الدموية (22.8٪) ، وتجزئة الجهاز (34.2٪) ، وتخثر النظام (17.1٪) ، وفصل الجهاز (8.6٪) 20. تتم حاليا دراسة العديد من أجهزة دعم RVالأخرى 2 . قد تصل إلى السوق في المستقبل ، ولكن في الوقت الحالي ، يظل جهاز القنية المزدوج هذا خيارا جذابا كجهاز غير جراحي عن طريق الجلد للعلاج قصير المدى لفشل RV.
Protocol
تمت الموافقة على البروتوكول الحالي من قبل لجنة أخلاقيات البحث البشري في المركز الطبي بجامعة نبراسكا. يتبع البروتوكول إرشادات لجنة أخلاقيات البحث البشري في نفس الجامعة.
1. إدخال الجهاز
ملاحظة: يجب تنفيذ هذا الإجراء بشكل مثالي في مجموعة التنظير الفلوري لضمان وضع الجهاز بدقة.
- جهز المريض.
ملاحظة: أي مريض يبلغ من العمر >18 عاما ، ذكرا كان أم أنثى ، مؤهلا لهذا العلاج إذا كان التشريح مناسبا للوصول المناسب إلى الجهاز وتسليمه. يمكن أيضا اعتبار الأفراد الذين تبلغ أعمارهم < 18 عاما للجهاز إذا كان التشريح مناسبا.- تحديد موقع الوصول وفضحه.
ملاحظة: هناك أربعة خيارات لإدخال جهاز القنية هذا. يمكن وضعه عبر IJ الأيمن (المفضل) ، أو IJ الأيسر ، أو تحت الترقوة الأيسر ، أو الوريد تحت الترقوة الأيمن. - باستخدام محلول تحضير قائم على الكلوروهيكسيدين أو اليود (انظر جدول المواد) ، قم بتنظيف موقع الوصول والمناطق المحيطة به تماما. ضع ستارة معقمة لإنشاء حقل معقم بطريقة قياسية.
- تحديد موقع الوصول وفضحه.
- التعقيم الذاتي. فرك والعباء والقفازات باتباع التقنية المعقمة.
- تعقيم جهاز الموجات فوق الصوتية. ضع غطاء مسبار معقم بالموجات فوق الصوتية فوق محول الطاقة بالموجات فوق الصوتية (انظر جدول المواد).
- باستخدام التوجيه بالموجات فوق الصوتية ، حدد الوصول الوريدي.
ملاحظة: استبعد أي عوائق للتدفق الوريدي داخل الوعاء المستهدف عن طريق مسح الوعاء لأعلى ولأسفل باستخدام مسبار الموجات فوق الصوتية. - باستخدام تقنية Seldingerالمعدلة 21 ، احصل على إمكانية الوصول إلى الوريد.
- التخدير عن طريق حقن ما يصل إلى 10 مل من الليدوكائين 1٪ في الأنسجة تحت الجلد في موقع الوصول.
- تحت إشراف الموجات فوق الصوتية ، قم بتقطيع الوريد باستخدام إبرة بزل دقيق 5 فر.
- تحت توجيه التنظير الفلوري أو تخطيط صدى القلب عبر المريء (TEE) ، أدخل سلكا دقيقا من خلال الإبرة ~ 8-10 سم في الوريد. قم بإزالة الإبرة ، واترك السلك في مكانه.
ملاحظة: تأكد من التمسك دائما بالسلك لمنع الانصمام. - قم بتكبير موقع الثقب باستخدام 10 شفرات ، مما يجعل شقا صغيرا بطول 0.5 سم مباشرة فوق السلك عموديا على السلك.
ملاحظة: يميل المرضى إلى النزيف مباشرة بعد هذه الخطوة. من الجيد أن تكون المعدات متاحة بسهولة لمنع النزيف الزائد. أيضا ، قد تكون هناك حاجة إلى شاش معقم 4 × 4 لتطبيقه في موقع الشق لتنظيف الدم الزائد. - ضع غمدا 5 Fr فوق السلك. قم بإزالة السلك مع ترك الغمد في مكانه.
- بعد ذلك ، ضع سلكا مقاس 0.035 بوصة من خلال غمد 5 Fr وقم بتغيير حجمه إلى قسطرة وصول متعددة التجويف 9 (MAC). بمجرد تكبير الحجم إلى 9 MAC ، قم بإزالة السلك.
- بعد وضع الغمد ، قم بتعويم قسطرة Swan Ganz بالطريقة القياسية من خلال 9 Fr MAC (انظر جدول المواد) باستخدام التنظير الفلوري أو توجيه TEE.
- قم بدفع قسطرة ذات رأس بالون (انظر جدول المواد) عبر الغمد ~ 10-20 مم ، ثم قم بنفخ البالون ب 1-2 سم مكعب من الهواء.
- تحت التنظير الفلوري ، قم بدفع القسطرة المنتفخة ذات الرؤوس البالوني إلى RA من خلال الصمام ثلاثي الشرف و PA الرئيسي.
- أدخل سلكا صلبا بقطر 0.035 بوصة (انظر جدول المواد) من خلال القسطرة ذات الرأس البالون في PA الأيمن.
- بعد تفريغ القسطرة ذات الرأس البالوني ، قم بإزالة البجعة مع ترك السلك الصلب في مكانه.
- قم بتوسيع موقع الوصول بشكل متسلسل باستخدام موسعات أكبر بالتتابع (الشكل 3) عن طريق وضع الموسعات واحدة تلو الأخرى فوق السلك الصلب الأصغر إلى الأكبر حتى 26 فرها باستخدام موسعات الجهاز. في حالة استخدام قنية 31 Fr ، قم بتوسيع ما يصل إلى 30 Fr.
- أمسك السلك في نفس الوقت على مستوى الجلد وحافظ على الضغط بشكل متقطع لمنع النزيف حسب الاقتضاء باليد اليسرى والتنقل في الموسعات باليد الأخرى.
ملاحظة: لا يأتي هذا pRVAD مع موسع 30 فر. يتم استبدال موسع القصبة الهوائية 30 Fr (انظر جدول المواد) هنا. لاحظ أيضا أن كل توسع لاحق يزيد من حجم موقع الوصول ، وبالتالي فإن كل خطوة في التمدد قد تسبب زيادة خطر النزيف.
- أمسك السلك في نفس الوقت على مستوى الجلد وحافظ على الضغط بشكل متقطع لمنع النزيف حسب الاقتضاء باليد اليسرى والتنقل في الموسعات باليد الأخرى.
- قم بإعطاء جرعات الهيبارين غير المجزأة عن طريق الوريد (IV) لتحقيق وقت تخثر نشط (ACT) يبلغ ~ 250 ، اعتمادا على خطر نزيف المريض.
ملاحظة: قد يحتاج هدف ACT إلى تعديل أقل للمرضى الذين لديهم خطر نزيف أعلى (على سبيل المثال ، بضع القص الجديد). يستخدم هدف ACT المذكور أعلاه جهاز Hemochron (انظر جدول المواد). لتحقيق هدف ACT الموصى به، قم بإعطاء 70-100 وحدة/كجم من الهيبارين الوريدي غير المجزأ. في حالة عدم تحقيق مستوى ACT العلاجي باستخدام البلعة الأولية ، يمكن إعطاء جرعات إضافية بناء على مستوى ACT الذي تم تحقيقه ، ولكن لا يتم توفير توصيات الجرعات الدقيقة في الإرشادات - بمجرد تحقيق العلاج الفعال ، أدخل جهاز pRVAD.
- قم بتطوير مقدمة الجهاز وتجميع القنية عبر السلك التوجيهي.
ملاحظة: يختلف حجم القنية من مريض لآخر. ومن ثم ، فإن حجم مجموعة القنية يعتمد على القنية المختارة. - قبل دفع الجهاز عبر الجلد فوق السلك ، ادفع السلك للخلف عبر الجهاز حتى يلاحظ خروج السلك من الطرف البعيد.
- بمجرد ملاحظة السلك وتأمينه، قم بدفع قنية الإدخال عبر الجلد فوق السلك.
- قم بدفع الجهاز عبر الصمامات ثلاثية الشرف والصمام الرئوي عبر PA الرئيسي وإلى PA الأيمن.
ملاحظة: يتم تأكيد الوضع الصحيح من خلال تخطيط صدى القلب ، ونقل الضغوط داخل القلب على قسطرة PA ، و / أو التنظير الفلوري. يوصى بنشر الجهاز في عمق السلطة الفلسطينية اليمنى ثم سحبه مرة أخرى إلى الموضع المناسب البعيد عن التشعب لتجنب نشر القنية الضحلة جدا ومنع الجهاز من التدلي في عربة سكن متنقلة ، مما قد يكون كارثيا. يمكن أيضا نشر الجهاز في PA الأيسر ولكنه يميل إلى الحصول على منحنى أكثر سلاسة في RPA.
- قم بتطوير مقدمة الجهاز وتجميع القنية عبر السلك التوجيهي.
- قم بإزالة المدخل والسلك الصلب عندما يكون الجهاز في الموقع المطلوب (الشكل 4).
- أثناء الحفاظ على موضع الجهاز تحت التصور باستخدام التنظير الفلوري ، قم أولا بإزالة المدخل ثم اسحب السلك الصلب برفق حتى تتم إزالة السلك بالكامل.
- قم بتثبيت القنية على المنافذ القريبة والبعيدة (الشكل 2).
- أعد تقييم وضع القنية عبر TEE و / أو التنظير الفلوري.
ملاحظة: عادة ، يتم وضع الجهاز في البداية عن قصد مع وجود الطرف في PA الأيمن ، ثم مع خروج السلك والمدخل ، يتم سحب الجهاز برفق حتى يصبح الطرف قريبا من تشعب PA في TEE والتصوير التنظيري الفلوري وعلى الأقل 3-4 سم بعد الصمام الرئوي.
- قم بتأمين قنية الجهاز في مكانها.
2. توصيل الجهاز وتنشيطه وصيانته
- قم بإزالة الهواء وتوصيل الأنابيب القياسية المتوفرة في مجموعة الجهاز.
- تأكد من تجهيز الدائرة وإلغاء تهويتها قبل توصيل الأنبوب.
- قم بتوصيل أنبوب التدفق الخارجي، المميز بشريط أحمر باستخدام ملامسة السائل إلى السائل بمنفذ القنية لتصريف الدم العائد (من المضخة إلى المريض).
- قم بتوصيل أنبوب تدفق المضخة المميز بشريط أزرق باستخدام ملامسة من سائل إلى سائل بمنفذ القنية لتصريف الدم (من المريض إلى المضخة).
- حرر المشابك.
- قم بتشغيل مضخة الطرد المركزي بدءا من 5,500 دورة في الدقيقة (RPM).
- قم بزيادة عدد دورات المضخة في الدقيقة تدريجيا حتى يتم تحقيق المستوى المطلوب من التدفق.
- أعد التحقق من موضع المضخة.
ملاحظة: قد يتم تسهيل التحقق من وضع طرف القنية في هذه المرحلة ، نظرا لتدفق اللون في منافذ المخرج على TEE. - قم بتأمين المضخة.
- قم بتأمين المضخة باستخدام سترة المسافر (انظر جدول المواد) أو الغلاف (الشكل 5) للحفاظ على استقرار الجهاز والسماح براحة المريض والتنشي.
- إجراء صيانة الجهاز.
- راقب وضع الجهاز من خلال الصور الشعاعية اليومية للصدر. راقب ديناميكا الدم للمريض عن كثب أثناء وجود الجهاز لضمان الدعم الديناميكي الدموي الكافي.
- راقب المختبرات كل 6 ساعات ، بما في ذلك تعداد الدم الكامل ، ولوحة التمثيل الغذائي الشاملة ، والإلكتروليتات ، وحمض اللاكتيك ، والتشبع الوريدي المختلط المسحوب مركزيا.
3. إزالة الجهاز
- فطم الجهاز باتباع الخطوات أدناه.
- قم بخفض سرعة الجهاز تدريجيا أثناء مراقبة استجابة ديناميكية الدم ووظائف القلب.
ملاحظة: عادة ما يتم إجراء ذلك أثناء الحصول على دراسة تخطيط صدى القلب التي تركز على وظيفة القلب مع تدفقات أقل على الجهاز. يجب مراقبة حمض اللاكتيك والتشبع الوريدي المختلط ووظائف الكبد / الكلى بشكل متكرر. إذا لوحظ تدهور وظيفة RV أو ملاحظة خلل وظيفي في الجهاز النهائي بواسطة مختبرات غير طبيعية في أي وقت ، فشل المريض في فطام RV ويجب أن يستمر في الدعم.
- قم بخفض سرعة الجهاز تدريجيا أثناء مراقبة استجابة ديناميكية الدم ووظائف القلب.
- إذا بدت وظيفة عربة سكن متنقلة مناسبة لإزالة الجهاز وكان المريض يقوم بالأكسجين والتهوية جيدا ، فقم بفطام السرعة وإزالة القنية.
- قبل إزالة القنية ، قم بتثبيت المنافذ القريبة والبعيدة لمنع تسرب الدم.
- قم بإزالة القنية.
ملاحظة: بمجرد سحب القنية إلى حيث تتعرض المنافذ الجانبية الأذينية ، ستنزف هذه المواقع ، وبالتالي يجب سحب القنية بسلاسة ولكن بسرعة. يتم وضع خياطة قابلة للامتصاص 2-0 على شكل ثمانية عبر الجلد أو الأنسجة تحت الجلد للإرقاء في موقع الدخول.
النتائج
حصل الجهاز في البداية على تصريح إدارة الغذاء والدواء الأمريكية في الولايات المتحدة بعد تجربة تحكم عشوائية كبيرة ، والتي كشفت عن تحسن بنسبة 31٪ في البقاء على قيد الحياة في علاج متلازمة الضائقة التنفسية الحادة باستخدام الجهاز المستخدم في عامVV_ECMO 22. في النهاية ، تمت الموافقة عليه كتجاوز RA إلى PA. ومع ذلك ، لم تتم الموافقة على الجهاز بعد للاستخدام كجهاز RVAD على الرغم من أنه في العديد من المراكز الرئيسية ، يتم استخدام الجهاز بالفعل كبديل ل RVAD في كثير من الحالات. توجد حاليا دراسات رصدية متعددة المراكز جارية لتقييم هذا الجهاز في بيئة الصدمة. كان مسار الدعم عن طريق الجلد ل CS طويلا ومتطورا باستمرار. مهدت تجربة SHOCK الأصلية الحدود لأجهزة الدعم عن طريق الجلد في حالة الصدمة. قامت تجربة كبيرة عشوائية للتحكم بتقييم مضخة البالون داخل الأبهر (IABP) كشكل من أشكال الدعم القلبي الرئوي عن طريق الجلد23. منذ ظهور تجربة SHOCK لأول مرة ، وصلت العديد من الأجهزة إلى السوق لعلاج CS ، بما في ذلك الجهاز الموصوف.
ومع ذلك ، لا يزال هناك القليل من الإرشادات حول استخدام هذه الأجهزة في صدمة عربة سكن متنقلة. على سبيل المثال ، أحدث بيان إجماع لخبراء جمعية تصوير الأوعية الدموية والتدخلات القلبية الوعائية (SCAI) من عام 2019 يذكر بإيجاز فقط صدمة RV. تنص على أنه شكل فريد من CS مع ارتفاع معدل الوفيات المرتبط ويقترح تقييم ومراقبة القسطرة الديناميكية الدموية PA لتوجيه الإدارة24.
على الرغم من عدم وجود إرشادات إجماع الخبراء ، إلا أن الفشل الحاد في عربة سكن متنقلة آخذ في الازدياد في الانتشار. في حين أن الفرد المصاب بهذا التشخيص لديه معدل معدل الوفيات ~ 50٪ في معدل الوفيات في 1 سنة25. معظم المرضى الذين يتم تقييمهم لهذا النوع من MCS هم في مرحلة SCAI D / E CS ، والتي تتدهور والمرضى المتطرفين ، على التوالي.
لقد ثبت أن الجهاز الموصوف ، وهو عبارة عن pRVAD مؤقت طفيف التوغل ، يقلل بشكل كبير من معدل الوفيات لمدة عام واحد في هذه المجموعة من المرضى إلى 15٪ -19٪ 13،14. يعتقد أن الجهاز يحقق ذلك من خلال تحسين المعلمات الديناميكية الدموية المتعددة مثل متوسط الضغط الشرياني ، CVP ، ضغط RA ، عمل السكتة الدماغية RV ، التشبع الوريدي المختلط ، النتاج القلبي الكلي ، والسماح بانخفاض متطلبات الضغط الإجمالية ؛ لذلك ، مما يتيح الوقت لإعادة عرض عربة سكن متنقلة كما هو موضح في دراسة مركزيةواحدة 26. على الرغم من أن عربة سكن متنقلة هشة ، إلا أنها تميل أيضا إلى أن تكون مرنة تماما وقادرة على التعافي بالعلاج المناسب ، كما يتضح من CTEPH السكانية بعد استئصال الخثار27.
تختلف معدلات المضاعفات الموثقة مع هذا الجهاز في الأدبيات. يمكن رؤية معدلات العدوى والنزيف وأحداث الصمة في ما يصل إلى 40٪ من الحالات أو أقل من 10٪ من الحالات28. كما أن تجلط الأوردة العميقة بعد الاستخدام والانسداد الرئوي شائعان أيضا. ومع ذلك، لا توجد توصيات حالية لترصد الجلطات بعد الاستخدام أو توصيات للوقاية. يمكن رؤية TR المتبقي المتوسط إلى الشديد في ~ 36٪ من الحالات ، وانحلال الدم المرتبط بالجهاز في ~ 14٪ من الحالات ، وهجرة القنية في ~ 7٪ من الحالات. أظهرت الدراسات أن الفطام الناجح للجهاز يمكن تحقيقه في 85٪ -90٪ من المرضى29. قد يكون التحويل إلى RVAD الجراحي مطلوبا في ~ 11٪ من الحالات3. يموت حوالي ~ 10٪ من المرضى على الدعم29. هناك معدل وفيات لجميع الأسباب في المستشفى بنسبة 15٪ ومعدل بقاء مذهل بنسبة 81٪ في عام واحد (الجدول 1) 11،26،30،31.

الشكل 1: قنية الجهاز المسمى. قنية RVAD مع مقدمة وأجزاء مسمى. تم استنساخ هذا الشكل بإذن من المرجع32. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: قنيات الجهاز. 29 فرنسا و 31 فرنسا و RD RVAD. تم استنساخ هذا الشكل بإذن من المرجع32. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: موسعات الجهاز. يتم استخدامها للتمدد التسلسلي لموقع الوصول. تم استنساخ هذا الشكل بإذن من المرجع32. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
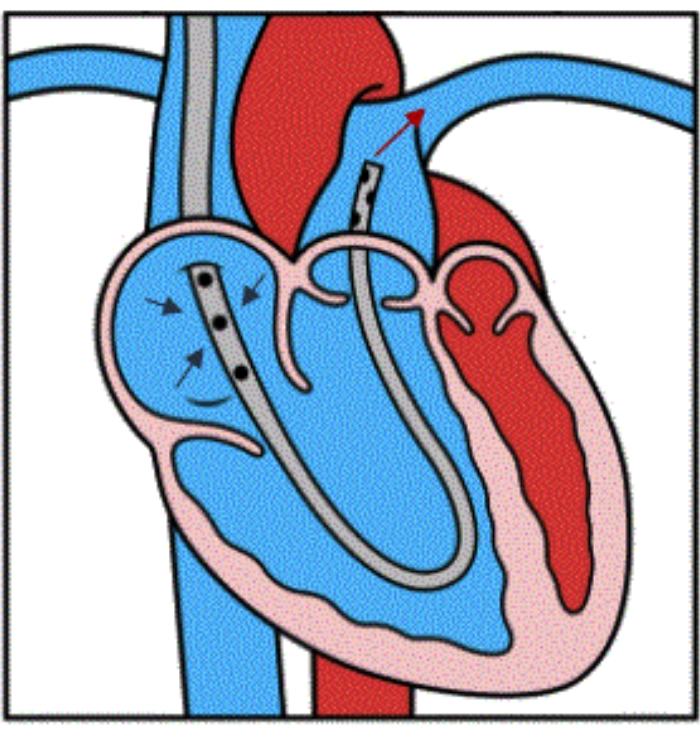
الشكل 4: رسم توضيحي لتدفق الجهاز. رسم توضيحي يوضح الوضع المناسب للجهاز داخل PA الرئيسي البعيد. تشير الأسهم الزرقاء الثلاثة إلى التصريف الوريدي من RA إلى الثقوب الجانبية للقنية. يوضح السهم الأحمر إعادة ضخ الدم في السلطة الفلسطينية الرئيسية ، متجاوزا عربة سكن متنقلة. تم استنساخ هذا الشكل بإذن من المرجع32. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
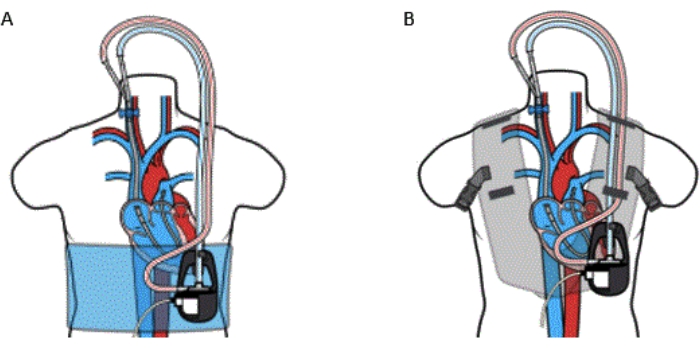
الشكل 5: قنية الجهاز عن طريق الجلد RA إلى PA Bypass مع (A) التفاف و (B) سترة. لا ينبغي استخدام مجموعة VoyagerVest على المرضى الذين يعانون من حساسية معروفة من النيوبرين. تم استنساخ هذا الشكل بإذن من المرجع32. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| أ. المضاعفات | |
| معدلات العدوى والنزيف وأحداث الصم | 10%-40% |
| TR المتبقي المتوسط إلى الشديد | ~ 36٪ |
| انحلال الدم المرتبط بالجهاز | ~ 14٪ |
| هجرة القنية | ~ 7٪ |
| ب. النتائج المتعلقة بالجهاز | |
| الفطام الناجح للجهاز | ~ 85٪ -90٪ |
| التحويل إلى RVAD الجراحي | ~ 11٪ |
| مات المرضى على الدعم | ~ 10٪ |
| الوفيات في المستشفى | 15% |
| معدل البقاء على قيد الحياة في عام واحد | ~ 81٪ |
الجدول 1: أ. مضاعفات Protek Duo MCS. ب. النتائج المتعلقة بالجهاز
Discussion
تنذر صدمة عربة سكن متنقلة بمعدل وفيات مرتفع بشكل استثنائي. يجب التعرف عليه في وقت مبكر من مسار المرض وعلاجه بقوة. Protek Duo هو MCS متطور لعلاج صدمة RV التي يمكن وضعها خلال أي من مراحل الصدمة SCAI. تتضمن بعض الخطوات الحاسمة في وضع الجهاز: الحصول على الوصول باستخدام تقنية Seldingerالمعدلة 21 ، والتوسع المتسلسل لموقع الوصول إلى حجم مناسب غمد Fr ، وطفو قسطرة ذات رأس بالون في PA الرئيسي ، وإدخال سلك توجيه صلب من خلال القسطرة ذات الرأس البالون في PA الرئيسي ، وإزالة القسطرة ذات الرأس البالون ، وإعطاء الهيبارين الوريدي ، وأخيرا تقدم الجهاز فوق السلك الصلب بعد تحقيق مستوى ACT العلاجي. بمجرد التأكد من أن الجهاز في الموضع الصحيح عن طريق التنظير الفلوري أو تخطيط صدى القلب مع أو بدون تحليل موجة الضغط عبر قسطرة PA ، يمكن إزالة السلك والمدخل ، ويمكن تثبيت الجهاز في مكانه. في حالات الطوارئ النادرة ، يمكن وضع هذا الجهاز بجانب استخدام TEE للتصور و / أو استخدام شكل موجة ضغط PA لتأكيد الوضع الصحيح للجهاز ؛ ومع ذلك ، إذا كان المريض في حالة تدهور حاد وكانت هناك حاجة إلى جهاز دعم بجانب السرير ، فقد يكون من الأنسب التحول إلى ECMO الشرياني الوريدي أو بعض استراتيجيات الدعم الأخرى. خلاف ذلك ، يجب تنفيذ هذا الإجراء في جناح التنظير الفلوري أو داخل غرفة العمليات.
هناك العديد من الاختلافات في هذا الإجراء الموثقة في الأدبيات. البروتوكول المقدم في هذه المقالة مأخوذ من تجربتنا في المركز الواحد. من المهم التعرف على العديد من التعديلات المحتملة على البروتوكول المحدد. سيكون أحد التعديلات هو اختيار موقع الوصول. موقع الوصول الموصى به لهذا الإجراء هو الوريد IJالأيمن 10. يوفر هذا الوصول وصولا مباشرا إلى القلب الأيمن وقد أثبت أنه الأقل إزعاجا في الزرع. ومع ذلك ، قد يقوم الإجراءيون بزرع هذا الجهاز من خلال الوريد تحت الترقوة الأيسر أو اليسار أو الوريد تحت الترقوةالأيمن 33. وهي مدرجة بالترتيب حسب الأفضلية باستثناء النهج الصحيح تحت الترقوة ، الذي لا يستخدم حاليا كخيار ولكنه كان ناجحا في مؤسسات أخرى. قد يفضل أحد مواقع الوصول البديلة هذه في المرضى الذين يعانون من انسداد موقع الوصول. في حالة الاشتباه في انسداد موقع الوصول ، يوصى بتصور كل من مواقع الوصول IJ والجنوب اليسرى باستخدام الموجات فوق الصوتية دوبلر لتقييم المباح قبل نشر الجهاز. يمكن أيضا إجراء مخطط الوريد لتقييم الوصول.
هناك بعض المحاذير التي تستخدم الوصول البديل. هناك مشكلة تواجه استخدام نهج تحت الترقوة الأيسر وهي حدوث غير تافه لتجلط تحت الترقوة34. نظرا لأن هذا قد يعيق الوصول إلى غسيل الكلى في المستقبل باستخدام الوريد تحت الترقوة ، فقد تم استخدام نظام تحت الترقوة بحذر في المرضى الذين يتوقع أن يحتاجون إلى غسيل الكلى. عادة ، عند استخدام نهج تحت الترقوة الأيسر ، يجب أن يكون للقنية بحجم 31 Fr طول كاف. يصعب استخدام نهج IJ الأيسر نظرا للمسار المتعرج للغاية في السلطة الفلسطينية اليمنى. من الوريد الأيسر IJ ، هناك منعطف حاد بزاوية 90 درجة لدخول الوريد غير المسمى ثم المرور إلى الوريد الأجوف العلوي (SVC) ، والذي يؤدي إلى التهاب المفاصل الروماتويدي. قد يؤدي هذا التحول المضاف في البداية مع هذا الوصول إلى صعوبة قيام الإجرائي بتحويل المسار الثاني إلى RA وبالتالي المنعطف الثالث من RA عبر عربة سكن متنقلة إلى PA الرئيسي.
مثلما قد يكون من الصعب وضع طرف قنية الجهاز داخل السلطة الفلسطينية الرئيسية باستخدام مواقع الوصول المنفصلة هذه ، قد يواجه الإجراء مشكلة في جعل القسطرة ذات الرأس البالون تطفو في الوضع الصحيح. قد يتطلب ذلك محاولات عائمة متعددة. والجدير بالذكر أن نقطتين رئيسيتين تجعلان من الصعب التعويم في موضعه. واحد من عربة سكن متنقلة إلى اليمينPA. إذا كانت هناك مشكلة ، فحاول دفع القسطرة أثناء الانقباض واستخدام دفع البطين وتدفق الدم للمساعدة في تعويم البجعة في موضعها. تحدي المركز الثاني هو من SVC إلى RA. هذا شائع في القلوب المزروعة. في بعض الأحيان تتطور سلسلة من التلال عند خط خياطة SVC وخط خياطة PA التي قد تعيق مرور القسطرة ذات الرأس البالوني. إذا حدث هذا ، فاستبدل غمده فوق السلك بغمد أطول يمر عبر هذه التلال إلى RA. سيضمن ذلك وصول القسطرة ذات الرؤوس البالونية إلى القلب الأيمن. بالإضافة إلى ذلك ، مع وضع جهاز في وقت الزرع ، غالبا ما يتم ذلك بينما لا يزال الصدر مفتوحا ، مما يضمن سلامة خطوط الخياطة المفاغرة مع مرور الجهاز والحفاظ على خيارات RVAD المفتوحة إذا تعذر نشر الجهاز بنجاح.
يحتاج المرء إلى معرفة بعض نصائح استكشاف الأخطاء وإصلاحها قبل تنفيذ هذا الإجراء. على سبيل المثال ، في بعض الأحيان ، يمكن أن تتسبب صلابة القنية في نزول الوريد الأجوف السفلي (IVC) بدلا من اتباع منحنى السلك داخل الصمام ثلاثي الشرف وعبره. إذا لم يتم علاج ذلك بسلك صلب ، ففكر في ترك القنية في الجسم الحي لفترة من الوقت. سيسمح ذلك للقنية بالنعومة من الدفء داخل الجسم ثم تصبح تدريجيا أكثر مرونة ، مما يسمح بسهولة التلاعب بالجهاز لمتابعة منحنى السلك. قد تكون الاختلافات في علم التشريح أيضا صعبة للمشغلين. كن حذرا مع تشريح SVC الأصغر ، مما يزيد من خطر الإصابة بمتلازمة SVC. يمكن أن يكون النزيف أثناء العملية أيضا من المضاعفات الأخرى. على الرغم من أنه من غير الشائع أن يكون من المضاعفات الكبيرة لأن هذا البروتوكول يستخدم الوصول الوريدي منخفض الضغط. يجب توقع بعض النزيف. ومع ذلك ، يمكن عادة تجنب كميات كبيرة من النزيف. يمكن تحقيق ذلك من خلال التوسع المتسلسل الدقيق لوعاء الوصول. ضع ضغطا على الجلد القريب من موقع الوصول لسدادة الوعاء أثناء إزالة كل موسع. يجب أن يكون هناك خيار بديل للدعم إذا تعذر نشر الجهاز. في نهاية الإجراء ، من الضروري أيضا التأكد من الوضع المناسب للجهاز ، وأن يكون الجهاز آمنا ، وتطبيق الحشو على الأجزاء الخارجية من القنية بالقرب من الجسم لتجنب تقرحات الضغط في الرأس وفروة الرأس والأذنين وأجزاء الجسم الأخرى على مقربة. الجهاز نفسه هو التخثر ويتطلب مضادات التخثر المستمر أثناء الاستخدام35. أي موانع لمضادات التخثر ستكون موانع نسبية لاستخدام هذا الجهاز. يمكن أن يحدث أيضا الجلطة بعد الاستخراج. تتم مصادفة قالب خثرة كبير من القنية من RA إلى RVOT ، وفي الحد الأدنى من الخبرة ، تمكنت من إدارة ذلك باستخدام مضادات التخثر.
قلس ثلاثي الشرف (TR) هو أحد المضاعفاتالمحتملة 2 المرتبطة باستخدام هذا pRVAD. عندما تمر القنية عبر الصمام ثلاثي الشرف (TV) ، فإنها تعيق المنشورات التلفزيونية وتمنع المنشورات المناسبة. عادة ، هذه ليست مشكلة أثناء وجود القنية في مكانها. ومع ذلك ، إذا كان هناك تلف متبقي للتلفزيون ، فقد يكون هناك TR مهم من الناحية الديناميكية الدموية مع استخراج الجهاز. من المضاعفات الأقل شيوعا ولكن ربما الأكثر حدة تطور قلة الصفيحات وانحلال الدم المرتبط بالجهاز. يمكن الخلط بين هذا أحيانا وبين HITT16 ، وهو أمر شائع أيضا في هذه المجموعة من المرضى. أخيرا ، قد تحدث هجرة قنية. هذا هو المكان الذي تنتقل فيه القنية إلى عربة سكن متنقلة أو تتقدم إلى المحطات المحمية اليمنى أو اليسرى. على الرغم من أنه إذا كانت القنية تفضل السلطة الفلسطينية اليمنى أو اليسرى ، فإنها عادة لا تكون ضارة اعتمادا على التدفق المطلوب والاعتبارات التشريحية الأخرى. على العكس من ذلك ، فإن وجود القنية ضحلة جدا يمكن أن يخاطر بالتدلي أسفل الصمام الرئوي ، والذي يمكن أن يكون كارثيا من الناحية الديناميكية. لذلك ، يجب أن يكون الطرف البعيد للجهاز على الأقل 3-4 سم بعيدا عن الصمام الرئوي (تمت مناقشته بمزيد من التفصيل أدناه). يجب تأمين القنية مع توخي الحذر أثناء نقل المريض وحركته لتجنب إزاحة موضع القنية.
كما هو الحال مع أي جسم أو غرسة داخل الأوعية الدموية ، فإن الجهاز معرض لخطر الإصابة ، خاصة الاستخدام المطول. إذا تم تأكيد إصابة الجهاز ، فقد يتطلب ذلك الاستبدال أو التحويل إلى استراتيجية دعم بديلة (على سبيل المثال ، VA-ECMO). في الحالات العصيبة للجهاز المصاب حيث لا يتسامح المريض مع انقطاع الدعم ، ولم يكن VA-ECMO خيارا قابلا للتطبيق ، تم وضع جهاز قنية مزدوجة تحت الترقوة اليسرى قبل إزالة جهاز IJ الأيمن المصاب وظل كلا الجهازين لفترة وجيزة في القلب في نفس الوقت. لذلك ، لم يكن هناك انقطاع في الدعم.
في الختام ، الجهاز الموصوف هو حاليا جهاز معتمد من إدارة الغذاء والدواء الأمريكية لعلاج فشل RV. علاوة على ذلك ، فإن ميزته الرئيسية هي السماح بالتجول الترادفي ، وراحة المريض المرتفعة ، وانخفاض معدلات الإصابة نظرا لقدرته على تجنب الوصول إلى الفخذ. من المتوقع أن تسلط الدراسات والتجارب السريرية المستقبلية الضوء على فوائد ونتائج هذا الجهاز في الممارسة السريرية.
Disclosures
يكشف بونام فيلاجابودي عن العلاقات التالية مع الصناعة: مكتب رئيس مجلس النواب - أبيوميد ، أوبسن. المجلس الاستشاري - أبيوميد ، سانوفي ؛ الوجبات / نفقات السفر- أبيوميد ، بوسطن ساينتفيك ، ميدترونيك ، تشيزي ، فيلبس.
Acknowledgements
لم تكن هذه المخطوطة ممكنة لولا الدعم الاستثنائي من مرشدي ، الدكتور بونام فيلاجابودي والدكتور أنتوني كاسلبيري والدعم من أقسام القلب والأوعية الدموية والقلب والصدر بأكملها في المركز الطبي بجامعة نبراسكا. لم يتم استخدام أي أموال لإعداد هذه الورقة.
Materials
| Name | Company | Catalog Number | Comments |
| Amplatzer Super Stiff Wire 0.035' x 145 cm | Boston Scientific | M001465631 | If not in stock, may use any stiff 0.035" wire. |
| Avalon Tracheal Dilator | Avalon Laboratories Inc., Rancho Dominguez, CA | 12210 | This comes in a set. The 30 Fr dilator is the only part used. |
| Full 29 Protek Duo Kit | LivaNova/ Tandem Life | 5820-2916 | Cannula, pump, holster, wrap |
| Full 31 Protek Duo | LivaNova/Tandem Life | 5820-3118 | Cannula, pump, holster, wrap |
| Hemochron Signature Elite ACT Testing Device and Supplies | Werfen North America | DCJACT-A and DCJACT-N | |
| Lidocaine | Pharmaceutical | Pfizer | |
| LifeSPARC Centrifugal Pump | LivaNova/ Tandem Life | 5840-2417 | |
| Micropuncture needle | Cook Medical | G56202 | 5 Fr |
| Multi-Lumen Access Catheter | Arrow/Teleflex | AK-21242-CDC | 9 Fr |
| Preparation solution | Pharmaceutical | NA | Chlorohexidine-based or iodine-based |
| Protek Duo Cannula 29Fr | LivaNova/ Tandem Life | 5140-4629 | Components: One 29 Fr ProtekDuo Veno-Venous Wire Reinforced Cannula with radiopaque tip markers, One 13 Fr Introducer |
| Protek Duo Cannula 31Fr | LivaNova/Tandem Life | 5140-5131 | - 31 Fr x 51 cm Veno-Venous Dual Lumen Cannula with Introducer |
| Protek Duo Insertion Kit | LivaNova/ Tandem Life | 5100-0014 | Components: balloon tipped PA catheter, one 0.035 stiff guidewire |
| Protek Duo RD Cannula | LivaNova/Tandem Life | 5820-3631 | Cannula, introducer |
| Swan Ganz Catheter | Edwards Lifesciences | 774F75 or 777F8 | |
| Ultrasound | Standard vascular ultrasound. | GE | |
| Ultrasound probe cover over the ultrasound transducer | Standard probe cover to match vascular ultrasound transducer | GE | |
| Voyager Vest Kit | LivaNova/Tandem Life | Contact LivaNova | Includes vest and wrap. Should not be used on patients with a known allergy to neoprene. |
References
- Saxena, A., et al. Value of hemodynamic monitoring in patients with cardiogenic shock undergoing mechanical circulatory support. Circulation. 141 (14), 1184-1197 (2020).
- Arrigo, M., et al. Right ventricular failure: Pathophysiology, diagnosis and treatment. Cardiac Failure Review. 5 (3), 140-146 (2019).
- Jacob, M., et al. Right ventricular dysfunction post-heart transplantation. Right Ventricular Physiology, Adaptation and Failure in Congenital and Acquired Heart Disease. , 193-216 (2018).
- Haddad, F., et al. Right ventricular function in cardiovascular disease, part II. Circulation. 117 (13), 1717-1731 (2008).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Patel, N., et al. Percutaneous biventricular mechanical circulatory support with impella CP and Protek Duo Plus. Journal of Invasive Cardiology. 31 (2), 46 (2019).
- Banfi, C., et al. Veno-venous extracorporeal membrane oxygenation: cannulation techniques. Journal of Thoracic Disease. 8 (12), 3762-3773 (2016).
- Jayaraman, A. L., Cormina, D., Shah, P., Ramakrishma, H. Cannulation strategies in adult veno-arterial and veno-venous extracorporeal membrane oxygenation: Techniques, limitations, and special considerations. Annals of Cardiac Anaethesia. 20 (1), 11-18 (2017).
- Nicolias, C. D., et al. Use of Protek duo tandem heart for percutaneous right ventricular support in various clinical settings: A case series. Journal of the American College of Cardiology. 71 (11), 1314 (2018).
- Kang, G., Ha, R., Banerjee, D. Pulmonary artery pulsatility Index Predicts Right Ventricular Failure After Left Ventricular Assist Device Implantation. The Journal of Heart and Lung Transplantation. 35 (1), 67-73 (2016).
- Johnson, G. Protek Duo Veno-venous cannula. Food and Drug Administration. , (2017).
- Carrozzini, M., et al. Percutaneous RVAD with the Protek Duo for severe right ventricular primary graft dysfunction after heart transplant. The Journal of Heart and Lung Transplantation. 40 (7), 580-583 (2021).
- Salna, M., et al. Novel percutaneous dual-lumen cannula-based right ventricular assist device provides effective support for refractory right ventricular failure after left ventricular assist device implantation. Interactive Cardiovascular and Thoracic Surgery. 30 (4), 499-506 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit Cardiogenic Shock Initiative. Catheter Cardiovascular Intervention. 91 (3), 454-461 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2021).
- Memon, H. A., et al. Extracorporeal membrane oxygenation support through Protek Duo cannula: A case series. The American Journal of Respiratory and Critical Care Medicine. 201, 5115 (2020).
- Ravichandran, A. K., Baran, D. A., Stelling, K., Cowger, J. A., Salerno, C. T. Outcomes with the tandem Protek Duo dual lumen percutaneous right ventricular assist device. ASAIO Journal. 64 (4), 570-572 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2020).
- Belani, K., et al. Transapical Protek Duo rapid deployment cannula as temporary left ventricular assist device in a Jehovah's Witness. Journal of Cardiothoracic and Vascular Anesthesia. 35 (12), 3735-3742 (2020).
- Khalid, N., et al. Adverse events and modes of failure related to impella RP: Insights from the Manufacturer and User Facility Device Experience (MAUDE) database. Cardiovascular Revascularization Medicine. 20 (6), 503-506 (2019).
- Ramos, F., et al. Técnica modificada de Seldinger. Canalización de catéteres venosos centrales a través de catéteres venosos periféricos [Seldinger modified technique]. Revista de Enfermeria. 31 (12), 14-16 (2008).
- Peek, J., et al. Efficacy and economic assessment of conventional ventilator support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicenter randomized controlled trial. Lancet. 374 (9698), 1351-1363 (2009).
- Menon, V., et al. Cardiogenic shock: A summary of the randomized SHOCK trial. Congestive Heart Failure. 9 (1), 35-39 (2003).
- Baran, A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Santas, E., et al. Right ventricular dysfunction staging system for mortality risk stratification in heart failure with preserved ejection fraction. Journal of Clinical Medicine. 9 (3), 831 (2020).
- Kapur, N. K., et al. Effects of a percutaneous mechanical circulatory support device for medically refractory right ventricular failure. The Journal of Heart and Lung Transplant. 30 (12), 1360-1367 (2011).
- Murata, M., et al. Clinical significance of Guanylate Cyclase stimulator, riociguat, on right ventricular functional improvement in patients with pulmonary hypertension. Cardiology. 146 (1), 130-136 (2021).
- Aggarwal, V., et al. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheter Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Schmack, B., et al. Results of concomitant groin-free percutaneous temporary RVAD support using a centrifugal pump with a double-lumen jugular venous cannula in LVAD patients. Journal of Thoracic Disease. 11 (6), 913-920 (2019).
- Cheung, A. W., White, C. W., Davis, M. K., Freed, D. H. Short-term mechanical circulatory support for recovery from acute right ventricular failure: Clinical Outcomes. The Journal of Heart and Lung Transplantation. 33 (8), 794-799 (2014).
- Takayama, H., et al. A novel approach to percutaneous right-ventricular mechanical support. European Journal of Cardiothoracic Surgery. 41 (2), 423-426 (2011).
- D'Angelo, F., et al. Alternative insertion sites for permanent central venous access devices. European Journal of Surgical Oncology. 23 (6), 547-549 (1997).
- Hill, S., et al. Subclavian vein thrombosis: a continuing challenge. Surgery. 108 (1), 1-9 (1990).
- Silva, E., et al. Management of RVAD thrombosis in biventricular HVAD supported patients: Case series. ASAIO Journal. 65 (4), 36-41 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved