Method Article
Insertion, entretien et retrait du dispositif d’assistance ventriculaire droite par canule percutanée à double lumière
Dans cet article
Résumé
Le présent protocole fournit une description détaillée d’un dispositif d’assistance ventriculaire droite percutanée à double lumière et illustre des instructions étape par étape sur l’implantation, la gestion et le retrait en toute sécurité du dispositif. Des conseils sur son utilisation et le dépannage des complications de l’une des expériences monocentriques les plus importantes sont également inclus.
Résumé
Le choc ventriculaire droit (RV), classiquement caractérisé par une pression veineuse centrale (PVC) élevée avec une pression artérielle pulmonaire (PA) normale à faible et une pression capillaire pulmonaire (PCWP), reste une cause importante de morbidité et de mortalité dans le monde s’il n’est pas traité. Les thérapies pour le traitement du choc du VD vont de la prise en charge médicale à l’assistance circulatoire mécanique (MCS) durable ou percutanée. Un dispositif MCS unique, un dispositif d’assistance ventriculaire droit percutanée (pRVAD), approuvé pour utilisation par la Food and Drug Administration (FDA) en 2014, fonctionne en déchargeant temporairement le VD à travers un cathéter à lumière unique et double avec support mécanique extracorporel et est capable de dévier le sang de l’oreillette droite (PR) vers l’AP principale. Bien qu’initialement approuvé en tant que dispositif d’oxygénation par membrane extracorporelle veineuse-veineuse (VV-ECMO), ce travail se concentrera sur l’utilisation du soutien du VR, car les stratégies VV-ECMO ambulatoires ont été décrites précédemment. Le cathéter est le plus souvent inséré par la veine jugulaire interne droite (IJ) dans l’AP et relié à une pompe externe, permettant un débit allant jusqu’à 5 L/min. Ce dispositif peut être un choix intéressant pour le traitement du choc du VD en raison de son insertion et de son retrait percutanés et peu invasifs et de sa capacité à permettre la déambulation du patient pendant que le dispositif est en place. Ce protocole traite en détail de l’équipement, des effets hémodynamiques, des indications, des contre-indications, des complications, des recherches actuellement disponibles dans la littérature et des instructions étape par étape sur la façon d’implanter, de gérer et d’extraire le dispositif, ainsi que des conseils sur l’utilisation et le dépannage des complications issus de l’une des plus grandes expériences monocentriques avec le dispositif.
Introduction
Le choc cardiogénique (CS) dû à une insuffisance ventriculaire droite (VD) reste l’une des pathologies cardiaques les plus difficiles à gérer et laisse présager une mortalité et une morbidité élevées1. Il existe trois états pathologiques primaires qui peuvent entraîner une défaillance du VD : la perte de contractilité myocardique, la surcharge volumique et la surcharge de pression2. Après une transplantation cardiaque, la perte de contractilité du VD peut être secondaire à une ischémie myocardique, à un infarctus ou à une inflammation causée par une myocardite ou un dysfonctionnement primaire du greffon3. La surcharge volumique du VD peut être secondaire à une insuffisance valvulaire droite, à une dérivation ou à une élimination inadéquate du volume (p. ex., insuffisance rénale) par rapport à l’absorption entérale ou intraveineuse4. La surcharge de pression du rotavirus peut résulter d’une aggravation de l’hypertension pulmonaire (HTN), d’une sténose pulmonaire, d’une embolie pulmonaire aiguë ou d’une insuffisance cardiaque gauche décompensée, la cause la plus fréquente d’échec du rotavirus5. Les options de traitement percutané sont devenues l’un des piliers du traitement de la césarienne du rotavirus. Outre le traitement médical, plusieurs dispositifs sont disponibles pour traiter l’échec du VR, notamment l’oxygénation par membrane extracorporelle veineuse-artérielle (VA-ECMO), le dispositif d’assistance ventriculaire droite ouvert/central (RVAD), l’Impella RP, le dispositif d’assistance RV TandemHeart et le Protek Duo2.
Le Protek Duo est le seul RVAD percutané mini-invasif (pRVAD) avec une canule à double lumière qui permet la déambulation pendant que l’appareil est en place6 et est de plus en plus utilisé dans les RC CS pour décharger le VR. Bien qu’initialement approuvé en tant que dispositif d’oxygénation par membrane extracorporelle veineuse-veineuse (VV-ECMO), ce travail se concentrera sur son utilisation pour le soutien du VR, car les stratégies VV-ECMO ambulatoires ont été décrites précédemment7. Il décharge le VD en déviant le sang de l’AR vers l’artère pulmonaire (AP) et permet de fixer une pompe extracorporelle à débit continu à flux centrifuge avec ou sans oxygénateur pour permettre un soutien optimal du VR. L’utilisation de l’appareil a été approuvée en 2014 par la Food and Drug Administration (FDA)8. Il peut fournir des débits allant jusqu’à 4,5-5 L/min 9,10. Sa conception de cathéter à double lumière aspire le sang via la canule d’entrée proximale dans la PR et le canalise vers l’extérieur via l’AP centrale, en contournant essentiellement le VD.
La canule a deux lumières distinctes avec un corps renforcé de fil. Deux canaux concentriques pour un écoulement bidirectionnel dans une seule canule permettent un drainage veineux et une réinjection de sang simultanés lors d’un soutien extracorporel. La partie proximale du dispositif est séparée et non câblée, ce qui permet un clampage externe pour empêcher la circulation sanguine lors de l’implantation et de l’extraction du dispositif de canule. Pour un positionnement précis de l’appareil, la canule est marquée de marqueurs distaux et proximaux afin d’identifier la profondeur d’insertion. Les marqueurs distaux sont radio-opaques, ce qui permet de visualiser l’appareil sur l’imagerie radiographique afin de déterminer la position du cathéter dans l’oreillette droite (AR). En plus des marques, il y a des fenêtres ou des trous à l’extrémité distale et à la partie médiane du cathéter. Les six trous latéraux à l’extrémité distale permettent au sang de s’écouler du cathéter vers l’AP. Les trous au milieu de la tige permettent au sang désoxygéné de s’écouler dans le cathéter à partir de l’AR (Figure 1). Cette conception permet l’utilisation du dispositif pré-, per-opératoire et postopératoire tout au long du continuum des procédures nécessitant un pontage cardiorespiratoire (CPB). Par exemple, nous avons utilisé l’appareil de manière isolée ou dans le cadre d’un support temporaire bi-ventriculaire avant un dispositif d’assistance ventriculaire gauche (DAVG) durable. Il a ensuite été converti en canule de drainage veineux pour le CPB pendant la procédure (par « Y » reliant les deux membres au membre de drainage veineux du circuit), puis en revenant au pontage RA/PA pour le soutien RVAD postopératoire. De plus, la canule a également été utilisée comme évent PA pour le déchargement et la ventilation du ventricule gauche (VG) dans le cadre d’une VA-ECMO avec distension VG en appliquant un drainage veineux aux ports RA et PA, encore une fois dans le cadre de la préparation des procédures CPB et de la conversion ultérieure en support RVAD.
Actuellement, deux tailles sont disponibles, le 29 Fr ou le 31 Fr (Figure 2). Ces cathéters sont conçus pour optimiser la facilité d’insertion et, par conséquent, ont une conception effilée pour permettre à la partie distale du dispositif de traverser toutes les structures cardiaques en toute sécurité. Plus précisément, le 29 Fr se rétrécit à 16 Fr, et le 31 Fr se rétrécit à 18 Fr. Les deux tailles sont fabriquées dans les mêmes matériaux. Selon la FDA, les deux tailles sont identiques en termes de résistance à la traction, d’intégrité de la voie, de rayon de pliage et de taux d’hémolyse. Ils diffèrent en ce qui concerne la rigidité de la canule et les propriétés de pression-débit, ce qui est attendu avec un changement de diamètre de la canule. Malgré leurs différences, ils sont jugés équivalents en termes de capacités fonctionnelles. Les tailles Fr plus grandes sont généralement utilisées pour ceux qui ont besoin d’un flux sanguin plus important pour obtenir un soutien hémodynamique optimal11.
Une indication essentielle pour l’utilisation du pRVAD est la défaillance du RV réfractaire. Cela comprend l’état d’échec du VD après la mise en place d’un DAVG, l’état post-cardiotomie, l’état post-infarctus aigu du myocarde ou l’état post-transplantation cardiaque12. Ce dispositif est souvent utilisé en conjonction avec d’autres thérapies telles que les diurétiques, les agents inotropes, les vasopresseurs et les vasodilatateurs pulmonaires pour fournir un soutien hémodynamique optimal individuel tout en laissant le temps pour le remodelage du VD natif. Il a également été documenté que le dispositif a été utilisé dans le traitement de la pHTN sévère, comme mentionné dans l’exemple ci-dessus, et de la myocardite aiguë13. D’après notre expérience, nous avons réussi le sevrage du soutien et la sortie de l’hôpital en utilisant le pRVADin pHTN sévère ; cependant, de tels cas sont rares, et en général, le soutien RVAD est évité dans le cadre d’une hypertension sévère compte tenu de l’augmentation de la pression dans les AP, et favoriserait donc la décompression des AP avec VA-ECMO (stratégies ambulatoires si un soutien prolongé est nécessaire) ou RA vers les configurations de pontage de l’oreillette gauche lorsque cela est possible.
L’indice de pulsatilité de l’artère pulmonaire (PAPI) est couramment utilisé dans le cadre de l’évaluation clinique globale pour identifier les patients qui pourraient bénéficier d’une prise en charge mini-invasive avec ce dispositif. Le PAPI est une mesure hémodynamique validée pour évaluer le degré et la présence d’une défaillance du VD. Elle est calculée en utilisant la pression AP systolique moins la pression pulmonaire diastolique divisée par la pression veineuse centrale (PVC). Les patients ayant un PAPI inférieur à 0,9 doivent être pris en compte pour un soutien VD13. La puissance cardiaque (CPO) peut être calculée avec le PAPI pour différencier les patients qui pourraient bénéficier d’un traitement de soutien par rotavirus. Il est calculé en multipliant la pression artérielle moyenne par le débit cardiaque et en le divisant par 451. Si la CPO est inférieure à 0,6, un traitement pour l’échec du VD peut être justifié. Si l’OPC est supérieure à 0,6, il y a place pour l’interprétation et la discussion d’autres thérapies possibles14. Cependant, la plupart des preuves recommandent des thérapies par rotavirus si le PAPI est inférieur à 0,9, comme indiqué ci-dessus. En fin de compte, la décision d’un support mécanique est basée sur l’évaluation clinique, ces paramètres quantitatifs étant des compléments précieux dans la prise de décision.
Les contre-indications à l’utilisation de ce dispositif d’assistance circulatoire mécanique (MCS) comprennent toute pathologie vasculaire ou obstructive cardiaque droite sévère, y compris la sténose ou la thrombose de la veine jugulaire interne (IJ) existante, la sténose pulmonaire sévère et le remplacement antérieur de la valve tricuspide, ce qui empêche la mise en place sûre du dispositif11. Un cas de syndrome aigu de la veine cave supérieure (SVC) après la mise en place d’un IJ Protek Duo approprié a nécessité une reconfiguration urgente vers une stratégie de soutien alternative. En l’absence de sténose sévère de la valve tricuspide, la réparation de la valve tricuspide n’est pas une contre-indication à l’utilisation du dispositif. Le remplacement valvulaire pulmonaire (PVR) n’est pas une contre-indication, et il existe plusieurs rapports dans la littérature sur l’utilisation de ce dispositif dans le cadre d’un PVR15. Une contre-indication relative à l’utilisation du pRVADest des antécédents de pneumonectomie due à la ligature de l’une des AP de la branche proximale avec cette procédure et la crainte d’une lésion du fil ou de la canule au moignon PA ou d’une pression excessive sur le moignon par l’écoulement RVAD. De plus, dans les cas de radiothérapie thoracique étendue, le tissu peut ne pas permettre la dilatation et la mise en place de la canule, ce qui exclut la mise en place d’une RVAD.
Plusieurs complications sont associées à l’utilisation de cet appareil MCS. Un risque potentiel avec le traitement du choc RV avec l’appareil est de démasquer le dysfonctionnement VG ou un dysfonctionnement bi-ventriculaire jusqu’alors non reconnu. Par exemple, parfois, avec une défaillance du VD, le VG semble pseudonormal en raison d’un sous-remplissage important du VG. Cependant, avec un RVAD en place, le flux vers l’avant est optimisé et un remplissage accru du VG peut démasquer le dysfonctionnement du VG. Souvent, ces patients peuvent avoir besoin d’être convertis en VA-ECMO. De plus, la nature prothrombogène de la canule expose le patient à un risque d’événements thromboemboliques. Pour lutter contre ce problème, le traitement standard consiste à traiter tous les patients en même temps que l’anticoagulation. Cependant, l’ajout d’un traitement anticoagulant comporte son propre risque de complications hémorragiques telles que l’hémorragie au site d’accès, l’hémorragie du tractus gastro-intestinal, l’accident vasculaire cérébral hémorragique et le risque de thrombocytopénie induite par l’héparine (HITT)16. Les interruptions de l’anticoagulation dues à des complications hémorragiques peuvent provoquer une thrombose de la pompe. Dans ce cas, l’appareil doit être remplacé d’urgence. Le diagnostic doit être rapidement élucidé parmi d’autres causes de détérioration hémodynamique aiguë et de faible débit du dispositif, notamment la septicémie ou l’hypovolémie/hémorragie.
Malgré toutes ses complications possibles, ce pRVAD est de plus en plus courant dans de nombreux hôpitaux à travers les États-Unis pour la gestion non invasive de l’échec du rotavirus. Sa conception portable permet aux patients de s’asseoir, de se tenir debout et même de se déplacer librement s’ils sont positionnés et sécurisés de manière appropriée. Il peut même être facilement retiré au chevet du patient après le sevrage de l’appareil. L’appareil est approuvé par la FDA pour une utilisation allant jusqu’à 6 jours, mais il y a eu des rapports d’utilisation allant de quelques semaines à17 mois. L’appareil peut être utilisé pour la prise en charge VV-ECMO en ajoutant un oxygénateur au circuit à tout moment pendant l’utilisation de l’appareil18. Le dispositif 31 Fr dispose également d’une version à déploiement rapide (RD) illustrée à la figure 3. La DR a été principalement référencée dans la littérature comme un dispositif de soutien ventriculaire gauche temporaire utilisé comme pont vers d’autres dispositifs de soutien avec mise en place via une approche apicale pour fournir un soutien mini-invasif du VG19.
Contrairement au Protek Duo, l’Impella RP est un dispositif percutané utilisé pour le soutien du VD qui est inséré dans la veine fémorale, nécessite un repos strict au lit et ne permet pas la marche. Il fournit également un flux axial par rapport au Protek Duo, qui fournit un flux centrifuge. Les dispositifs à flux centrifuge ont moins d’événements hémorragiques liés au système digestif avec des taux d’AVC comparables17. Les complications fréquemment signalées de l’Impella RP comprennent l’hémorragie (42,9 %), les problèmes vasculaires (22,8 %), la fragmentation du dispositif (34,2 %), la coagulation du système (17,1 %) et la déconnexion du dispositif (8,6 %)20. Plusieurs autres dispositifs de support de VR2 sont actuellement à l’étude. Ils pourraient arriver sur le marché à l’avenir, mais pour l’instant, ce dispositif à double canule reste un choix attrayant en tant que dispositif percutané non invasif pour le traitement à court terme de l’échec du rotavirus.
Protocole
Le présent protocole est approuvé par le comité d’éthique de la recherche humaine du centre médical de l’Université du Nebraska. Le protocole suit les lignes directrices du comité d’éthique de la recherche humaine de la même université.
1. Insertion de l’appareil
REMARQUE : Cette procédure doit être idéalement effectuée dans une salle de fluoroscopie pour assurer un placement précis de l’appareil.
- Préparez le patient.
REMARQUE : Tout patient âgé de > 18 ans, homme ou femme, est éligible à ce traitement si l’anatomie est adaptée à un accès et à une administration appropriés de l’appareil. Les personnes de < 18 ans peuvent également être prises en compte pour l’appareil si l’anatomie convient.- Identifiez et exposez le site d’accès.
REMARQUE : Il existe quatre options pour insérer ce dispositif de canule. Il peut être placé via l’IJ droit (de préférence), l’IJ gauche, la sous-clavière gauche ou la veine sous-clavière droite. - À l’aide d’une solution de préparation à base de chlorohexidine ou d’iode (voir le tableau des matériaux), nettoyez soigneusement le site d’accès et les zones environnantes. Appliquez un champ stérile pour établir un champ stérile de manière standard.
- Identifiez et exposez le site d’accès.
- Auto-stérilisation. Frotter, blouse et gant en suivant la technique stérile.
- Stérilisez l’appareil à ultrasons. Placez un couvercle de sonde à ultrasons stérile sur le transducteur à ultrasons (voir le tableau des matériaux).
- À l’aide du guidage par échographie, identifiez l’accès veineux.
REMARQUE : Excluez toute obstruction de l’écoulement veineux dans le vaisseau cible en balayant le vaisseau de haut en bas avec la sonde à ultrasons. - En utilisant la technique Seldinger modifiée21, accédez à la veine.
- Anesthésier en injectant jusqu’à 10 ml de lidocaïne à 1 % dans le tissu sous-cutané au site d’accès.
- Sous guidage échographique, canulez la veine à l’aide d’une aiguille de micropuncture 5 Fr.
- Sous guidage par fluoroscopie ou échocardiographie transœsophagienne (TEE), insérez un fil de micropunture à travers l’aiguille à ~8-10 cm dans la veine. Retirez l’aiguille en laissant le fil en place.
REMARQUE : Assurez-vous de toujours tenir le fil pour éviter l’embolisation. - Agrandissez le site de ponction à l’aide d’une lame de 10 pieds, en faisant une petite incision de 0,5 cm directement sur le fil perpendiculairement au fil.
REMARQUE : Les patients ont tendance à saigner directement après cette étape. Il est bon d’avoir l’équipement à portée de main pour éviter les saignements excessifs. De plus, une gaze stérile 4 x 4 peut être nécessaire à appliquer au site d’incision pour éliminer l’excès de sang. - Placez une gaine 5 Fr sur le fil. Retirez le fil en laissant la gaine en place.
- Ensuite, placez un fil de 0,035" dans la gaine 5 Fr et passez-le à un cathéter d’accès multi-lumières (MAC) de 9 lumières. Une fois passé au 9 MAC, retirez le fil.
- Après la mise en place de la gaine, faites flotter un cathéter Swan Ganz de manière standard à travers le MAC 9 Fr (voir le tableau des matériaux) à l’aide d’une fluoroscopie ou d’un guidage TEE.
- Faites passer un cathéter à bout de ballonnet (voir Tableau des matériaux) à travers la gaine de ~10 à 20 mm, puis gonflez le ballon avec 1 à 2 cc d’air.
- Sous fluoroscopie, faites avancer le cathéter à ballonnet gonflé dans l’AR à travers la valve tricuspide et l’AP principal.
- Insérez un fil rigide de 0,035 pouce de diamètre (voir le tableau des matériaux) à travers le cathéter à ballonnet dans l’AP droit.
- Après avoir dégonflé le cathéter à bout de ballonnet, retirez le cygne tout en laissant le fil rigide en place.
- Dilater en série le site d’accès à l’aide de dilatateurs séquentiellement plus grands (Figure 3) en plaçant les dilatateurs un par un sur le fil rigide du plus petit au plus grand jusqu’à 26 Fr à l’aide des dilatateurs de l’appareil. Si vous utilisez une canule de 31 Fr, dilater jusqu’à 30 Fr.
- Tenez simultanément le fil au niveau de la peau et maintenez une pression intermittente pour éviter les saignements le cas échéant avec la main gauche et naviguez dans les dilatateurs avec l’autre main.
REMARQUE : Ce pRVAD n’est pas livré avec un dilatateur de 30 Fr. Un dilatateur trachéal de 30 Fr (voir tableau des matériaux) est remplacé ici. Notez également que chaque dilatation ultérieure augmente la taille du site d’accès et, par conséquent, chaque augmentation de la dilatation peut entraîner une augmentation du risque de saignement.
- Tenez simultanément le fil au niveau de la peau et maintenez une pression intermittente pour éviter les saignements le cas échéant avec la main gauche et naviguez dans les dilatateurs avec l’autre main.
- Administrer des bolus d’héparine non fractionnés par voie intraveineuse (IV) pour obtenir un temps de coagulation activé (ACT) de ~250, en fonction du risque d’hémorragie du patient.
REMARQUE : Il peut être nécessaire de réduire l’objectif de l’ACT pour les patients présentant un risque hémorragique plus élevé (p. ex., sternotomie fraîche). L’objectif ACT indiqué ci-dessus utilise un appareil Hemochron (voir le tableau des matériaux). Pour atteindre l’objectif recommandé de l’ACT, administrer 70 à 100 unités/kg d’héparine IV non fractionnée. Dans le cas où le niveau thérapeutique d’ACT n’est pas atteint avec le bolus initial, des bolus supplémentaires peuvent être administrés en fonction du niveau d’ACT atteint, mais les recommandations posologiques exactes ne sont pas fournies par les directives. - Une fois qu’un ACT thérapeutique est obtenu, insérez le dispositif pRVAD.
- Faites avancer l’introducteur et la canule de l’appareil sur le fil-guide.
REMARQUE : La taille de la canule varie d’un patient à l’autre. Par conséquent, la taille de l’ensemble de la canule dépend de la canule sélectionnée. - Avant de pousser l’appareil à travers la peau sur le fil, poussez le fil rétrograde à travers l’appareil jusqu’à ce que le fil sorte de l’extrémité distale.
- Une fois le fil observé et fixé, faites avancer la canule d’introduction à travers la peau sur le fil.
- Faites avancer l’appareil au-delà des valves tricuspide et pulmonaire à travers le PA principal et dans le PA droit.
REMARQUE : Le positionnement correct est confirmé par échocardiographie, transduction des pressions intracardiaques sur le cathéter PA et/ou fluoroscopie. Il est recommandé de déployer l’appareil profondément dans le PA droit, puis de le ramener dans la position appropriée juste à côté de la bifurcation pour éviter de déployer la canule trop peu profonde et d’empêcher l’appareil de prolapser dans le VR, ce qui peut être catastrophique. L’appareil peut également être déployé dans le système de sonorisation gauche, mais a tendance à avoir une courbe plus douce dans le RPA.
- Faites avancer l’introducteur et la canule de l’appareil sur le fil-guide.
- Retirez l’introducteur et le fil rigide lorsque l’appareil se trouve à l’emplacement souhaité (Figure 4).
- Tout en maintenant la position de l’appareil sous visualisation avec la fluoroscopie, retirez d’abord l’introducteur, puis tirez doucement sur le fil rigide jusqu’à ce que tout le fil soit retiré.
- Clamper la canule sur les ports proximaux et distaux (Figure 2).
- Réévaluer le positionnement de la canule par TEE et/ou fluoroscopie.
REMARQUE : En règle générale, l’appareil est d’abord placé intentionnellement avec l’embout dans le PA droit, puis avec le fil et l’introducteur sortis, le dispositif est doucement rétracté jusqu’à ce que l’embout soit juste à proximité de la bifurcation du PA sur l’imagerie TEE et fluoroscopique et à au moins 3-4 cm au-delà de la valve pulmonaire.
- Fixez la canule de l’appareil en place.
2. Connexion, activation et maintenance de l’appareil
- Désaérez et connectez le tube standard fourni dans le kit de l’appareil.
- Assurez-vous que le circuit est amorcé et désaéré avant de connecter le tube.
- Connectez la tubulure de sortie marquée d’une bande rouge en utilisant un contact de fluide à liquide à l’orifice de la canule pour le drainage du sang de retour (de la pompe au patient).
- Connectez la tubulure d’entrée de la pompe marquée d’une bande bleue à l’aide d’un contact fluide-fluide à l’orifice de la canule pour le drainage sanguin (du patient à la pompe).
- Relâchez les pinces.
- Allumez la pompe centrifuge à partir de 5 500 tours par minute (RPM).
- Augmentez progressivement le régime de la pompe jusqu’à ce que le niveau de débit souhaité soit atteint.
- Vérifiez à nouveau le positionnement de la pompe.
REMARQUE : La vérification du positionnement de l’extrémité de la canule peut être facilitée à ce stade, compte tenu du flux de couleur aux orifices de sortie sur TEE. - Fixez la pompe.
- Fixez la pompe à l’aide du gilet Voyager (voir le tableau des matériaux) ou de l’enveloppe (Figure 5) pour maintenir la stabilité de l’appareil et permettre au patient de se déplacer confortablement.
- Effectuez l’entretien de l’appareil.
- Surveillez le positionnement de l’appareil à l’aide de radiographies thoraciques quotidiennes. Surveillez de près l’hémodynamique du patient pendant que le dispositif est en place pour assurer un soutien hémodynamique adéquat.
- Surveillez les analyses de laboratoire toutes les 6 heures, y compris la formule sanguine complète, le panel métabolique complet, les électrolytes, l’acide lactique et la saturation veineuse mixte calculée au centre.
3. Retrait de l’appareil
- Sevrez l’appareil en suivant les étapes ci-dessous.
- Baissez progressivement la vitesse de l’appareil tout en surveillant la réponse hémodynamique et la fonction cardiaque.
REMARQUE : En règle générale, cela est effectué lors de l’obtention d’une étude d’échocardiogramme axée sur la fonction cardiaque avec des débits plus faibles sur l’appareil. L’acide lactique, la saturation veineuse mixte et la fonction hépatique/rénale doivent être surveillés fréquemment. Si une aggravation de la fonction du rotaryn ou un dysfonctionnement des organes cibles observé par des laboratoires anormaux est observé à un moment donné, le patient a échoué au sevrage du rotavirus et doit continuer le soutien.
- Baissez progressivement la vitesse de l’appareil tout en surveillant la réponse hémodynamique et la fonction cardiaque.
- Si la fonction RV semble convenir pour retirer l’appareil et que le patient s’oxygéne et ventile bien, sevrez la vitesse et retirez la canule.
- Avant de retirer la canule, clampez les ports proximal et distal pour éviter les fuites de sang.
- Retirez la canule.
REMARQUE : Une fois que la canule est rétractée à l’endroit où les ports latéraux auriculaires sont exposés, ces sites saignent, et donc la canule doit être tirée en douceur mais rapidement. Une suture résorbable en forme de huit 2-0 est placée à travers la peau ou le tissu sous-cutané pour l’hémostase au site d’entrée.
Résultats
Le dispositif a initialement obtenu l’autorisation de la FDA aux États-Unis après un vaste essai contrôlé randomisé, qui a révélé une amélioration de 31 % de la survie dans le traitement du syndrome de détresse respiratoire aiguë avec le dispositif utilisé comme VV_ECMO22. Finalement, il a été approuvé comme contournement RA à PA. Cependant, l’appareil n’a pas encore été approuvé pour une utilisation en tant que RVAD, bien que dans de nombreux grands centres, l’appareil soit déjà utilisé comme substitut de RVAD dans de nombreux cas. Des études observationnelles multicentriques sont actuellement en cours pour évaluer davantage ce dispositif dans le cadre d’un choc. Le chemin du soutien percutané pour les CS a été long et en constante évolution. L’essai SHOCK original a ouvert la voie aux dispositifs de soutien percutané en cas de choc. Un vaste essai contrôlé randomisé a évalué la pompe à ballonnet intra-aortique (IABP) comme une forme percutanée de soutien cardiopulmonaire23. Depuis le début de l’essai SHOCK, plusieurs dispositifs ont été mis sur le marché pour le traitement du CS, y compris le dispositif décrit.
Cependant, il reste peu ou pas de conseils sur l’utilisation de ces appareils en cas de choc VR. Par exemple, la plus récente déclaration de consensus d’experts de la Society of Cardiovascular Angiography and Interventions (SCAI) de 2019 ne mentionne que brièvement le choc du rotavirus. Il indique qu’il s’agit d’une forme unique de CS avec une mortalité associée élevée et suggère d’évaluer et de surveiller les cathéters hémodynamiques de l’AP pour guider davantage la prise en charge24.
Malgré l’absence de conseils consensuels d’experts, la prévalence des échecs graves du rotavirus augmente. Bien que confondu par la croissance possible de notre capacité à diagnostiquer l’échec du VD et/ou l’augmentation des implants de dispositifs d’assistance LV et des transplantations cardiaques qui prédisposent tous deux à l’échec du VD, une personne avec ce diagnostic a un taux de mortalité associé de ~50 % en 1 an25. La plupart des patients évalués pour ce type de MCS sont bien avancés dans le stade SCA, D/E CS, qui sont respectivement des patients en détérioration et extremis.
Il a été démontré que le dispositif décrit, un pRVAD temporaire mini-invasif, réduit considérablement le taux de mortalité à 1 an dans cette population de patients à 15 %-19 %13,14. On pense que l’appareil y parvient grâce à l’amélioration de plusieurs paramètres hémodynamiques tels que la pression artérielle moyenne, le CVP, la pression RA, le travail sur l’AVC du VD, la saturation veineuse mixte, le débit cardiaque global, et permet une diminution des besoins globaux en presseur ; par conséquent, en laissant le temps pour le remodelage du RV montré dans une seule étude centrée26. Bien que le rotavirus soit fragile, il a également tendance à être assez résilient et capable de se rétablir avec le traitement approprié, comme le démontre la population de l’HPTEC après une thromboendartériectomie27.
Les taux de complications documentés avec cet appareil varient dans la littérature. Les taux d’infection, d’hémorragie et d’embolie peuvent être observés dans jusqu’à 40 % des cas ou aussi peu que 10 % des cas28. La thrombose veineuse profonde et l’embolie pulmonaire post-utilisation sont également courantes. Cependant, il n’existe actuellement aucune recommandation pour la surveillance des caillots après l’utilisation ou pour la prophylaxie. Une TR résiduelle modérée à sévère peut être observée dans ~36 % des cas, une hémolyse liée au dispositif dans ~14 % des cas et une migration de la canule dans ~7 % des cas. Des études ont montré qu’un sevrage réussi de l’appareil peut être obtenu chez 85 à 90 % des patients29. Une conversion en RVAD chirurgicale peut être nécessaire dans ~11 % des cas3. Environ ~10 % des patients meurent sur support29. Le taux de mortalité toutes causes confondues à l’hôpital est de 15 % et le taux de survie étonnant est de 81 % à un an (tableau 1)11,26,30,31.

Figure 1 : Canule de dispositif étiquetée. Canule RVAD avec introducteur et pièces étiquetées. Cette figure est reproduite avec la permission de la référence32. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Canules de l’appareil. Les canules RVAD 29 Fr, 31 Fr, et RD. Cette figure est reproduite avec la permission de la référence32. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Dilatateurs de l’appareil. Ils sont utilisés pour la dilatation en série du site d’accès. Cette figure est reproduite avec la permission de la référence32. Veuillez cliquer ici pour voir une version agrandie de cette figure.
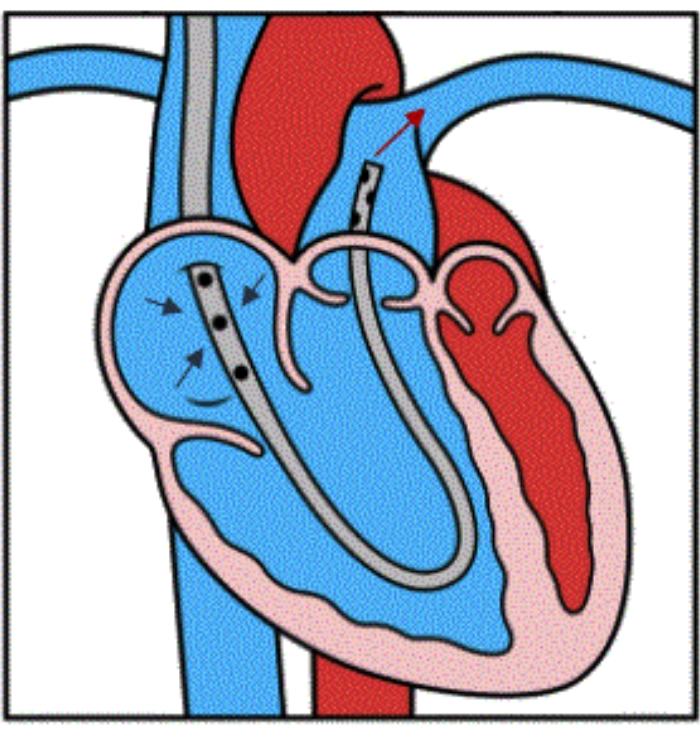
Figure 4 : Illustration du flux de l’appareil. Illustration montrant le bon positionnement du dispositif à l’intérieur du PA principal distal. Les trois flèches bleues indiquent le drainage veineux de l’AR dans les trous latéraux de la canule. La flèche rouge montre la réinjection du sang dans l’AP principal, en contournant le VD. Cette figure est reproduite avec la permission de la référence32. Veuillez cliquer ici pour voir une version agrandie de cette figure.
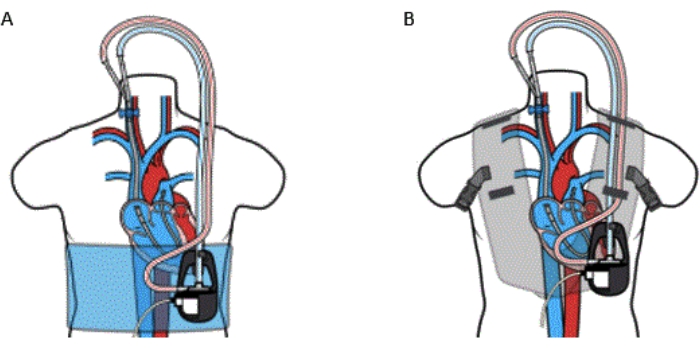
Figure 5 : Canule de dispositif percutané RA à PA Bypass avec (A) enveloppe et (B) gilet. Le kit VoyagerVest ne doit pas être utilisé sur des patients présentant une allergie connue au néoprène. Cette figure est reproduite avec la permission de la référence32. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| A. Complications | |
| Taux d’infection, d’hémorragies et d’événements emboliques | 10%-40% |
| TR résiduel modéré à sévère | ~36 % |
| Hémolyse liée au dispositif | ~14 % |
| Migration de la canule | ~7 % |
| B. Résultat lié à l’appareil | |
| Sevrage réussi de l’appareil | ~85 % à 90 % |
| Conversion en RVAD chirurgical | ~11 % |
| Des patients sont morts sur le support | ~10 % |
| Mortalité à l’hôpital | 15% |
| Taux de survie en un an | ~81 % |
Tableau 1 : A. Complications de Protek Duo MCS ; B. Résultats liés à l’instrument
Discussion
Le choc du VR laisse présager une mortalité exceptionnellement élevée. Il doit être reconnu tôt dans l’évolution de la maladie et traité de manière agressive. Le Protek Duo est un MCS de pointe pour le traitement des chocs RV qui peut être placé pendant n’importe laquelle des étapes SCAI du choc. Quelques étapes critiques dans la mise en place du dispositif comprennent : l’obtention de l’accès à l’aide de la technique Seldingermodifiée 21, la dilatation séquentielle du site d’accès à la gaine Fr de taille appropriée, la flottaison d’un cathéter à ballonnet dans l’AP principal, l’introduction d’un fil-guide rigide à travers le cathéter à embout à ballonnet dans l’AP principal, le retrait du cathéter à embout de ballonnet, l’administration d’héparine IV, et enfin en faisant avancer l’appareil sur le fil rigide après qu’un niveau ACT thérapeutique est atteint. Une fois que l’appareil est confirmé dans la bonne position par fluoroscopie ou échocardiographie avec ou sans analyse des ondes de pression via le cathéter PA, le fil et l’introducteur peuvent être retirés et l’appareil peut être fixé en place. Dans de rares situations d’urgence, cet appareil peut être placé à côté de l’utilisation de TEE pour la visualisation et/ou en utilisant la forme d’onde de pression PA pour confirmer le positionnement correct de l’appareil ; cependant, si l’état d’un patient se détériore gravement et qu’un dispositif de soutien est nécessaire au chevet du patient, il peut être plus approprié de passer à l’ECMO veineuse-artérielle ou à une autre stratégie de soutien. Sinon, cette procédure doit être effectuée dans une salle de fluoroscopie ou à l’intérieur d’une salle d’opération.
Il existe plusieurs variantes de cette procédure documentées dans la littérature. Le protocole présenté dans cet article est issu de notre expérience monocentrique. Il est important de reconnaître plusieurs modifications possibles au protocole décrit. Une modification serait le choix du site d’accès. Le site d’accès recommandé pour cette procédure est la veine IJdroite 10. Cet accès permet d’accéder directement au cœur droit et s’est avéré être le moins gênant à implanter. Cependant, les procéduriers peuvent implanter ce dispositif à travers la veine sous-clavière gauche, l’IJ gauche ou la veine sous-clavière droite33. Elle est répertoriée par ordre de préférence, à l’exception de l’approche sous-clavière droite, qui n’est pas actuellement utilisée comme une option, mais qui a été couronnée de succès dans d’autres établissements. L’un de ces sites d’accès alternatifs peut être préféré chez les patients présentant une occlusion du site d’accès. Si une occlusion du site d’accès est suspectée, il est recommandé de visualiser à l’aide d’une échographie Doppler pour évaluer la perméabilité avant le déploiement du dispositif. Un vénogramme peut également être effectué pour évaluer l’accès.
Il y a quelques mises en garde concernant l’utilisation d’un accès alternatif. Un problème rencontré lors de l’utilisation de l’approche sous-clavière gauche est une incidence non triviale de thrombose sous-clavière34. Comme cela pourrait entraver l’accès futur à la dialyse à l’aide de la veine sous-clavière, le système sous-clavier a été utilisé avec prudence chez les patients susceptibles de nécessiter une dialyse. En règle générale, lors de l’utilisation de l’approche sous-clavière gauche, une canule de taille 31 Fr doit avoir une longueur suffisante. L’approche IJ gauche est plus difficile à utiliser étant donné la trajectoire très tortueuse vers l’AP droite. À partir de la veine IJ gauche, il y a un virage brusque à 90° pour entrer dans la veine innominée, puis passer dans la veine cave supérieure (SVC), qui mène à la RA. Ce virage initialement ajouté avec cet accès pourrait rendre difficile pour le procéduraliste de faire le deuxième virage vers le bas dans la RA et par la suite le troisième virage de la RA à travers le RV dans la PA principale.
Tout comme il peut être difficile de positionner l’extrémité de la canule du dispositif dans l’AP principal à l’aide de ces sites d’accès séparés, le procédurier peut rencontrer des difficultés pour faire flotter le cathéter à l’extrémité du ballonnet dans la bonne position. Cela peut nécessiter plusieurs tentatives de flottement. Notamment, deux points principaux rendent difficile la flottaison en position. L’une est du camping-car dans le système de sonorisation droit. S’il y a un problème, essayez de faire avancer le cathéter pendant la systole et d’utiliser la poussée du ventricule et le flux sanguin pour aider à faire flotter le cygne en position. Le défi de la deuxième place est celui de la SVC à l’AR. Ceci est courant chez les cœurs transplantés. Parfois, une crête au niveau de la ligne de suture SVC et de la ligne de suture PA se développe, ce qui peut obstruer le passage du cathéter à bout ballonnet. Si cela se produit, remplacez votre gaine par-dessus le fil par une gaine plus longue qui passe au-delà de cette crête dans l’AR. Cela garantira que le cathéter à bout de ballonnet accède au cœur droit. De plus, avec la mise en place d’un dispositif au moment de la greffe, cela a souvent été fait alors que le thorax est encore ouvert, ce qui peut garantir l’intégrité des lignes de suture anastomotiques avec le passage du dispositif et préserver les options RVAD ouvertes si le dispositif ne peut pas être déployé avec succès.
Il est nécessaire de connaître quelques conseils de dépannage avant d’effectuer cette procédure. Par exemple, parfois, la rigidité de la canule peut l’amener à descendre préférentiellement dans la veine cave inférieure (CVI) au lieu de suivre la courbe du fil dans et à travers la valve tricuspide. Si l’on n’y remédie pas avec un fil rigide, envisagez de laisser la canule in vivo pendant un certain temps. Cela permettra à la canule de se ramollir à cause de la chaleur à l’intérieur du corps, puis de devenir progressivement plus malléable, ce qui facilitera la manipulation de l’appareil pour suivre la courbe du fil. Les variations anatomiques peuvent également s’avérer difficiles pour les opérateurs. Soyez prudent avec une anatomie SVC plus petite, ce qui augmente le risque de syndrome SVC. Les saignements pendant la procédure peuvent également être une autre complication. Bien qu’il soit moins fréquent d’être une complication importante car ce protocole utilise un accès veineux à basse pression. Il faut s’attendre à des saignements ; Cependant, de grandes quantités de saignements peuvent généralement être évitées. Cela peut être réalisé par une dilatation séquentielle soigneuse du récipient d’accès. Appliquez une compression sur la peau proximale au site d’accès pour tamponner le vaisseau lors du retrait de chaque dilatateur. Il doit exister une autre option d’assistance si l’appareil ne peut pas être déployé. À la fin de la procédure, il est également essentiel d’assurer un positionnement approprié de l’appareil, que l’appareil est sécurisé et d’appliquer un rembourrage sur les parties externes de la canule près du corps pour éviter les escarres de la tête, du cuir chevelu, des oreilles et d’autres parties du corps à proximité. L’appareil lui-même est thrombogène et nécessite une anticoagulation continue pendant son utilisation35. Toute contre-indication à l’anticoagulation serait une contre-indication relative à l’utilisation de ce dispositif. Un thrombus après l’extraction peut également survenir. Un gros plâtre thrombus est rencontré à partir de la canule de la PR et dans le RVOT, et avec une expérience minimale, ils ont été en mesure de gérer cela avec une anticoagulation.
La régurgitation tricuspide (TR) est une complication possible2 associée à l’utilisation de ce pRVAD. Lorsque la canule passe à travers la valve tricuspide (TV), elle obstrue les feuillets TV et inhibe la bonne coaptation des feuillets. En règle générale, ce n’est pas un problème lorsque la canule est en place. Cependant, s’il y a des dommages résiduels sur le téléviseur, il peut y avoir un TR hémodynamiquement significatif révélé avec l’extraction du dispositif. Une complication moins fréquente mais peut-être plus grave est le développement d’une thrombocytopénie et d’une hémolyse liées au dispositif. Cela peut parfois être confondu avec HITT16, qui est également courant dans cette population de patients. Enfin, une migration de la canule peut se produire. C’est là que la canule prolapsus dans le VD ou avance dans les AP droit ou gauche. Cependant, si la canule favorise l’AP droite ou gauche, cela n’est généralement pas préjudiciable en fonction du débit requis et d’autres considérations anatomiques. À l’inverse, avoir la canule trop peu profonde peut risquer de prolapsus sous la valve pulmonaire, ce qui peut être hémodynamiquement catastrophique. Par conséquent, l’extrémité distale de l’appareil doit être distale d’au moins 3 à 4 cm par rapport à la valve pulmonaire (voir ci-dessous). La canule doit être sécurisée avec soin pendant le transport et le déplacement du patient pour éviter de déloger la position de la canule.
Comme pour tout objet intravasculaire ou implant, le dispositif est exposé à un risque d’infection, en particulier à une utilisation prolongée. Si l’infection de l’appareil est confirmée, cela peut nécessiter un échange ou une conversion vers une autre stratégie d’assistance (par exemple, VA-ECMO). Dans les situations désespérées d’un dispositif infecté où le patient ne tolérerait pas l’interruption du support, et où la VA-ECMO n’était pas une option viable, un dispositif à double canule sous-clavière gauche a été placé avant de retirer un dispositif IJ droit infecté et les deux dispositifs sont brièvement restés dans le cœur en même temps. Il n’y a donc pas eu d’interruption du soutien.
En conclusion, le dispositif décrit est actuellement un dispositif approuvé par la FDA pour traiter l’échec du VR. De plus, son principal avantage est de permettre une marche en tandem, un plus grand confort pour le patient et des taux d’infection plus faibles en raison de sa capacité à éviter l’accès à l’aine. De futures études et essais cliniques devraient mettre en évidence les avantages et les résultats de ce dispositif dans la pratique clinique.
Déclarations de divulgation
Poonam Velagapudi fait état des relations suivantes avec l’industrie : Bureau du conférencier - Abiomed, Opsens ; conseil consultatif - Abiomed, Sanofi ; les frais de repas et de déplacement - Abiomed, Boston Scientific, Medtronic, Chiesi, Phillps.
Remerciements
Ce manuscrit n’aurait pas été possible sans le soutien exceptionnel de mes mentors, le Dr Poonam Velagapudi et le Dr Anthony Castleberry, et le soutien de l’ensemble des départements cardiovasculaires et cardiothoraciques du centre médical de l’Université du Nebraska. Aucun fonds n’a été utilisé pour la réalisation de cet article.
matériels
| Name | Company | Catalog Number | Comments |
| Amplatzer Super Stiff Wire 0.035' x 145 cm | Boston Scientific | M001465631 | If not in stock, may use any stiff 0.035" wire. |
| Avalon Tracheal Dilator | Avalon Laboratories Inc., Rancho Dominguez, CA | 12210 | This comes in a set. The 30 Fr dilator is the only part used. |
| Full 29 Protek Duo Kit | LivaNova/ Tandem Life | 5820-2916 | Cannula, pump, holster, wrap |
| Full 31 Protek Duo | LivaNova/Tandem Life | 5820-3118 | Cannula, pump, holster, wrap |
| Hemochron Signature Elite ACT Testing Device and Supplies | Werfen North America | DCJACT-A and DCJACT-N | |
| Lidocaine | Pharmaceutical | Pfizer | |
| LifeSPARC Centrifugal Pump | LivaNova/ Tandem Life | 5840-2417 | |
| Micropuncture needle | Cook Medical | G56202 | 5 Fr |
| Multi-Lumen Access Catheter | Arrow/Teleflex | AK-21242-CDC | 9 Fr |
| Preparation solution | Pharmaceutical | NA | Chlorohexidine-based or iodine-based |
| Protek Duo Cannula 29Fr | LivaNova/ Tandem Life | 5140-4629 | Components: One 29 Fr ProtekDuo Veno-Venous Wire Reinforced Cannula with radiopaque tip markers, One 13 Fr Introducer |
| Protek Duo Cannula 31Fr | LivaNova/Tandem Life | 5140-5131 | - 31 Fr x 51 cm Veno-Venous Dual Lumen Cannula with Introducer |
| Protek Duo Insertion Kit | LivaNova/ Tandem Life | 5100-0014 | Components: balloon tipped PA catheter, one 0.035 stiff guidewire |
| Protek Duo RD Cannula | LivaNova/Tandem Life | 5820-3631 | Cannula, introducer |
| Swan Ganz Catheter | Edwards Lifesciences | 774F75 or 777F8 | |
| Ultrasound | Standard vascular ultrasound. | GE | |
| Ultrasound probe cover over the ultrasound transducer | Standard probe cover to match vascular ultrasound transducer | GE | |
| Voyager Vest Kit | LivaNova/Tandem Life | Contact LivaNova | Includes vest and wrap. Should not be used on patients with a known allergy to neoprene. |
Références
- Saxena, A., et al. Value of hemodynamic monitoring in patients with cardiogenic shock undergoing mechanical circulatory support. Circulation. 141 (14), 1184-1197 (2020).
- Arrigo, M., et al. Right ventricular failure: Pathophysiology, diagnosis and treatment. Cardiac Failure Review. 5 (3), 140-146 (2019).
- Jacob, M., et al. Right ventricular dysfunction post-heart transplantation. Right Ventricular Physiology, Adaptation and Failure in Congenital and Acquired Heart Disease. , 193-216 (2018).
- Haddad, F., et al. Right ventricular function in cardiovascular disease, part II. Circulation. 117 (13), 1717-1731 (2008).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Patel, N., et al. Percutaneous biventricular mechanical circulatory support with impella CP and Protek Duo Plus. Journal of Invasive Cardiology. 31 (2), 46 (2019).
- Banfi, C., et al. Veno-venous extracorporeal membrane oxygenation: cannulation techniques. Journal of Thoracic Disease. 8 (12), 3762-3773 (2016).
- Jayaraman, A. L., Cormina, D., Shah, P., Ramakrishma, H. Cannulation strategies in adult veno-arterial and veno-venous extracorporeal membrane oxygenation: Techniques, limitations, and special considerations. Annals of Cardiac Anaethesia. 20 (1), 11-18 (2017).
- Nicolias, C. D., et al. Use of Protek duo tandem heart for percutaneous right ventricular support in various clinical settings: A case series. Journal of the American College of Cardiology. 71 (11), 1314 (2018).
- Kang, G., Ha, R., Banerjee, D. Pulmonary artery pulsatility Index Predicts Right Ventricular Failure After Left Ventricular Assist Device Implantation. The Journal of Heart and Lung Transplantation. 35 (1), 67-73 (2016).
- Johnson, G. Protek Duo Veno-venous cannula. Food and Drug Administration. , (2017).
- Carrozzini, M., et al. Percutaneous RVAD with the Protek Duo for severe right ventricular primary graft dysfunction after heart transplant. The Journal of Heart and Lung Transplantation. 40 (7), 580-583 (2021).
- Salna, M., et al. Novel percutaneous dual-lumen cannula-based right ventricular assist device provides effective support for refractory right ventricular failure after left ventricular assist device implantation. Interactive Cardiovascular and Thoracic Surgery. 30 (4), 499-506 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit Cardiogenic Shock Initiative. Catheter Cardiovascular Intervention. 91 (3), 454-461 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2021).
- Memon, H. A., et al. Extracorporeal membrane oxygenation support through Protek Duo cannula: A case series. The American Journal of Respiratory and Critical Care Medicine. 201, 5115 (2020).
- Ravichandran, A. K., Baran, D. A., Stelling, K., Cowger, J. A., Salerno, C. T. Outcomes with the tandem Protek Duo dual lumen percutaneous right ventricular assist device. ASAIO Journal. 64 (4), 570-572 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2020).
- Belani, K., et al. Transapical Protek Duo rapid deployment cannula as temporary left ventricular assist device in a Jehovah's Witness. Journal of Cardiothoracic and Vascular Anesthesia. 35 (12), 3735-3742 (2020).
- Khalid, N., et al. Adverse events and modes of failure related to impella RP: Insights from the Manufacturer and User Facility Device Experience (MAUDE) database. Cardiovascular Revascularization Medicine. 20 (6), 503-506 (2019).
- Ramos, F., et al. Técnica modificada de Seldinger. Canalización de catéteres venosos centrales a través de catéteres venosos periféricos [Seldinger modified technique]. Revista de Enfermeria. 31 (12), 14-16 (2008).
- Peek, J., et al. Efficacy and economic assessment of conventional ventilator support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicenter randomized controlled trial. Lancet. 374 (9698), 1351-1363 (2009).
- Menon, V., et al. Cardiogenic shock: A summary of the randomized SHOCK trial. Congestive Heart Failure. 9 (1), 35-39 (2003).
- Baran, A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Santas, E., et al. Right ventricular dysfunction staging system for mortality risk stratification in heart failure with preserved ejection fraction. Journal of Clinical Medicine. 9 (3), 831 (2020).
- Kapur, N. K., et al. Effects of a percutaneous mechanical circulatory support device for medically refractory right ventricular failure. The Journal of Heart and Lung Transplant. 30 (12), 1360-1367 (2011).
- Murata, M., et al. Clinical significance of Guanylate Cyclase stimulator, riociguat, on right ventricular functional improvement in patients with pulmonary hypertension. Cardiology. 146 (1), 130-136 (2021).
- Aggarwal, V., et al. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheter Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Schmack, B., et al. Results of concomitant groin-free percutaneous temporary RVAD support using a centrifugal pump with a double-lumen jugular venous cannula in LVAD patients. Journal of Thoracic Disease. 11 (6), 913-920 (2019).
- Cheung, A. W., White, C. W., Davis, M. K., Freed, D. H. Short-term mechanical circulatory support for recovery from acute right ventricular failure: Clinical Outcomes. The Journal of Heart and Lung Transplantation. 33 (8), 794-799 (2014).
- Takayama, H., et al. A novel approach to percutaneous right-ventricular mechanical support. European Journal of Cardiothoracic Surgery. 41 (2), 423-426 (2011).
- D'Angelo, F., et al. Alternative insertion sites for permanent central venous access devices. European Journal of Surgical Oncology. 23 (6), 547-549 (1997).
- Hill, S., et al. Subclavian vein thrombosis: a continuing challenge. Surgery. 108 (1), 1-9 (1990).
- Silva, E., et al. Management of RVAD thrombosis in biventricular HVAD supported patients: Case series. ASAIO Journal. 65 (4), 36-41 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon