Method Article
Inserimento, manutenzione e rimozione del dispositivo di assistenza ventricolare destra con cannula percutanea a doppio lume
In questo articolo
Riepilogo
Il presente protocollo fornisce una descrizione dettagliata di un dispositivo di assistenza ventricolare destra a doppio lume percutaneo e illustra istruzioni dettagliate sull'impianto, la gestione e la rimozione sicuri del dispositivo. È inclusa anche una guida sul suo utilizzo e sulla risoluzione delle complicazioni derivanti da una delle esperienze monocentriche più significative.
Abstract
Lo shock ventricolare destro (RV), classicamente caratterizzato da un'elevata pressione venosa centrale (CVP) con pressioni dell'arteria polmonare (PA) e dell'incuneamento capillare polmonare (PCWP) da normali a basse, rimane una causa significativa di morbilità e mortalità in tutto il mondo se non trattata. Le terapie per il trattamento dello shock del ventricolo destro vanno dalla gestione medica al supporto circolatorio meccanico (MCS) duraturo o percutaneo. Un dispositivo MCS unico nel suo genere, un dispositivo di assistenza ventricolare destra percutanea (pRVAD), approvato per l'uso dalla Food and Drug Administration (FDA) nel 2014, funziona scaricando temporaneamente il ventricolo destro attraverso un catetere a lume singolo e doppio con supporto meccanico extracorporeo ed è in grado di deviare il sangue dall'atrio destro (RA) al PA principale. Sebbene inizialmente approvato come dispositivo di ossigenazione extracorporea a membrana venoso-venosa (VV-ECMO), questo lavoro si concentrerà sull'uso del supporto RV, poiché le strategie ambulatoriali VV-ECMO sono state descritte in precedenza. Il catetere viene più comunemente inserito attraverso la vena giugulare interna destra (IJ) nel PA e collegato a una pompa esterna, consentendo un flusso fino a 5 L/min. Questo dispositivo può essere una scelta interessante per il trattamento dello shock del ventricolo destro grazie al suo inserimento e rimozione percutaneo e minimamente invasivo e alla sua capacità di consentire la deambulazione del paziente mentre il dispositivo è in posizione. Questo protocollo discute in dettaglio l'apparecchiatura, gli effetti emodinamici, le indicazioni, le controindicazioni, le complicanze, le ricerche attualmente disponibili in letteratura e le istruzioni dettagliate su come impiantare, gestire ed estrarre il dispositivo, insieme alle indicazioni sull'uso e sulla risoluzione dei problemi delle complicanze derivanti da una delle più grandi esperienze monocentriche con il dispositivo.
Introduzione
Lo shock cardiogeno (CS) da insufficienza ventricolare destra (RV) rimane una delle patologie cardiache più difficili da gestire e fa presagire un'elevata mortalità e morbilità1. Esistono tre stati patologici primari che possono causare insufficienza ventricolare sinistra: perdita di contrattilità miocardica, sovraccarico di volume e sovraccarico di pressione2. Dopo un trapianto di cuore, la perdita della contrattilità del ventricolo destro può essere secondaria a ischemia miocardica, infarto o infiammazione causata da miocardite o disfunzione primaria del trapianto3. Il sovraccarico di volume del ventricolo destro può essere secondario all'insufficienza valvolare destra, allo shunt o all'inadeguata eliminazione del volume (ad es. insufficienza renale) rispetto all'assunzione enterale o endovenosa4. Il sovraccarico di pressione del ventricolo destro può derivare da un peggioramento dell'ipertensione polmonare (pHTN), stenosi polmonare, embolia polmonare acuta o insufficienza cardiaca sinistra scompensata, la causa più comune di insufficienza ventricolare destra5. Le opzioni di trattamento percutaneo sono diventate uno dei pilastri per il trattamento della RC RV. Oltre alla terapia medica, sono disponibili diversi dispositivi per il trattamento dell'insufficienza ventricolare destra, tra cui l'ossigenazione extracorporea a membrana venoso-arteriosa (VA-ECMO), il dispositivo di assistenza ventricolare destra aperto/centrale (RVAD), Impella RP, il dispositivo di assistenza RV TandemHeart e il Protek Duo2.
Protek Duo è l'unico RVAD percutaneo minimamente invasivo (pRVAD) con una cannula a doppio lume che consente la deambulazione mentre il dispositivo è in posizione6 ed è sempre più utilizzato nel RV CS per scaricare il RV. Sebbene inizialmente approvato come dispositivo di ossigenazione extracorporea venoso-venosa a membrana (VV-ECMO), questo lavoro si concentrerà sul suo utilizzo per il supporto del ventricolo destro, poiché le strategie ambulatoriali VV-ECMO sono state descritte in precedenza7. Scarica il ventricolo destro deviando il sangue dall'arteria reumatoide all'arteria polmonare (PA) e consente la possibilità di collegare una pompa a flusso continuo extracorporea a flusso centrifugo con o senza ossigenatore per consentire un supporto ottimale del ventricolo destro. Il dispositivo è stato approvato per l'uso nel 2014 dalla Food and Drug Administration (FDA)8. Può fornire portate fino a 4,5-5 L/min 9,10. Il suo design del catetere a doppio lume estrae il sangue attraverso la cannula di afflusso prossimale nell'artrite reumatoide e lo incanala attraverso il PA centrale, bypassando essenzialmente il ventricolo destro.
La cannula ha due lumi distinti con un corpo rinforzato con filo. Due canali concentrici per il flusso bidirezionale all'interno di un'unica cannula consentono il drenaggio venoso e la reinfusione simultanea del sangue durante il supporto extracorporeo. La parte prossimale del dispositivo è separata e non cablata, consentendo un bloccaggio esterno per evitare il flusso sanguigno durante l'impianto e l'estrazione del dispositivo cannula. Per un posizionamento accurato del dispositivo, la cannula è contrassegnata con marcatori distali e prossimali per identificare la profondità di inserimento. I marcatori distali sono radiopachi, consentendo la visualizzazione del dispositivo all'imaging radiografico per determinare la posizione del catetere all'interno dell'atrio destro (RA). Insieme ai segni, ci sono fenestrazioni o fori sulla punta distale e sulla parte centrale del catetere. I sei fori laterali sulla punta distale consentono al sangue di fluire dal catetere all'interno dell'PA. I fori dell'albero centrale consentono al sangue deossigenato di fluire nel catetere dall'artrite reumatoide (Figura 1). Questo design consente l'uso del dispositivo pre, intra e post-operatorio durante tutto il continuum delle procedure che richiedono il bypass cardiopolmonare (CPB). Ad esempio, il dispositivo è stato utilizzato da noi in isolamento o come parte di un supporto temporaneo biventricolare prima di un dispositivo di assistenza ventricolare sinistra durevole (LVAD). È stato quindi convertito in una cannula di drenaggio venoso per CPB durante la procedura (con una "Y" che collega i due arti all'arto di drenaggio venoso del circuito) e quindi è tornato al bypass RA/PA per il supporto RVAD post-operatorio. Inoltre, la cannula è stata utilizzata anche come sfiato PA per lo scarico/sfiato del ventricolo sinistro (LV) nel contesto di VA-ECMO con distensione LV applicando il drenaggio venoso sia alle porte AR che PA, sempre nell'impostazione di preparazione per le procedure CPB e la successiva conversione in supporto RVAD.
Attualmente sono disponibili due dimensioni, la 29 Fr o la 31 Fr (Figura 2). Questi cateteri sono progettati per ottimizzare la facilità di inserimento e, pertanto, hanno un design affusolato per consentire alla porzione distale del dispositivo di passare attraverso tutte le strutture cardiache in modo sicuro. In particolare, il 29 Fr si assottiglia a 16 Fr e il 31 Fr si assottiglia a 18 Fr. Entrambe le dimensioni sono realizzate con gli stessi materiali. Secondo la FDA, entrambe le dimensioni sono identiche in termini di resistenza alla trazione, integrità del percorso, raggio di attorcigliamento e tassi di emolisi. Differiscono per quanto riguarda la rigidità della cannula e le proprietà di flusso di pressione, che ci si aspetta con una variazione del diametro della cannula. Nonostante le loro differenze, sono determinati ad essere equivalenti nelle capacità funzionali. Le dimensioni più grandi delle Fr sono tipicamente utilizzate per coloro che richiedono un maggiore flusso sanguigno per ottenere un supporto emodinamico ottimale11.
Un'indicazione essenziale per l'utilizzo del pRVAD è il guasto del ventricolo destro. Ciò include lo stato di fallimento del ventricolo destro dopo il posizionamento di LVAD, lo stato post-cardiotomia, l'infarto miocardico post-acuto o lo stato post-trapianto di cuore12. Questo dispositivo viene spesso utilizzato in combinazione con altre terapie come diuretici, agenti inotropi, vasopressori e vasodilatatori polmonari per fornire un supporto emodinamico ottimale individuale, lasciando il tempo per il rimodellamento del ventricolo destro nativo. È stato anche documentato che il dispositivo è stato utilizzato nella pHTN grave, come menzionato nell'esempio precedente, e nella miocardite acuta13. Nella nostra esperienza, abbiamo avuto successo lo svezzamento dal supporto e la dimissione dall'ospedale utilizzando la pRVADin pHTN grave; tuttavia, tali casi sono rari e, in generale, il supporto RVAD viene evitato nel contesto di ipertensione grave data l'aumento della pressione all'interno dei PA, e quindi favorirebbe la decompressione dei PA con VA-ECMO (strategie deambulatorie se è necessario un supporto prolungato) o AR a configurazioni di bypass dell'atrio sinistro quando possibile.
L'indice di pulsatilità dell'arteria polmonare (PAPI) è comunemente utilizzato con la valutazione clinica globale per identificare i pazienti che potrebbero trarre beneficio da una gestione minimamente invasiva con questo dispositivo. Il PAPI è una metrica emodinamica convalidata per valutare il grado e la presenza di insufficienza ventricolare destra. Viene calcolato utilizzando la pressione PA sistolica meno la pressione polmonare diastolica divisa per la pressione venosa centrale (CVP). I pazienti con una PAPI inferiore a 0,9 devono essere presi in considerazione per il supporto RV13. La potenza cardiaca erogata (CPO) può essere calcolata con il PAPI per differenziare i pazienti che possono beneficiare della terapia di supporto RV. Si calcola moltiplicando la pressione arteriosa media per la gittata cardiaca e dividendola per 451. Se il CPO è inferiore a 0,6, può essere giustificato il trattamento per il fallimento del ventricolo destro. Se il CPO è maggiore di 0,6, c'è spazio per l'interpretazione e la discussione di possibili altre terapie14. Tuttavia, la maggior parte delle prove raccomanda terapie RV se il PAPI è inferiore a 0,9, come affermato sopra. In definitiva, la decisione per il supporto meccanico si basa sulla valutazione clinica con queste metriche quantitative come preziose aggiunte nel processo decisionale.
Le controindicazioni all'uso di questo dispositivo di supporto circolatorio meccanico (MCS) includono qualsiasi grave patologia vascolare o ostruttiva del cuore destro, inclusa la stenosi o la trombosi della vena giugulare interna (IJ) esistente, la stenosi polmonare grave e la precedente sostituzione della valvola tricuspide, che preclude il posizionamento sicuro del dispositivo11. Un caso di sindrome acuta della vena cava superiore (SVC) dopo l'inserimento di un IJ Protek Duo idoneo ha richiesto una riconfigurazione emergente in una strategia di supporto alternativa. In assenza di grave stenosi della valvola tricuspide, la riparazione della valvola tricuspide non è una controindicazione all'uso del dispositivo. La sostituzione della valvola polmonare (PVR) non è una controindicazione e ci sono diversi rapporti in letteratura sull'uso di questo dispositivo all'interno di un PVR15. Una controindicazione relativa all'uso del pRVAD è una storia di pneumonectomia dovuta alla legatura di uno dei PA del ramo prossimale con questa procedura e la preoccupazione per lesioni da filo o cannula al moncone PA o un'eccessiva pressione sul moncone da parte del flusso RVAD. Inoltre, nei casi con radiazioni toraciche estese, il tessuto potrebbe non consentire la dilatazione e il posizionamento della cannula, precludendo il posizionamento di pRVAD.
Diverse complicazioni sono associate all'uso di questo dispositivo MCS. Un potenziale rischio nel trattamento dello shock del ventricolo destro con il dispositivo è lo smascheramento della disfunzione ventricolare sinistra o della disfunzione biventricolare precedentemente non riconosciuta. Ad esempio, a volte, con il fallimento del ventricolo destro, il ventricolo sinistro appare pseudonormale a causa di un significativo riempimento insufficiente del ventricolo sinistro. Tuttavia, con un RVAD in atto, il flusso in avanti è ottimizzato e un maggiore riempimento del ventricolo sinistro può smascherare la disfunzione del ventricolo sinistro. Molte volte, questi pazienti potrebbero dover essere convertiti in VA-ECMO. Inoltre, la natura protrombogena della cannula mette il paziente a rischio di eventi tromboembolici. Per combattere questo problema, è una terapia standard che tutti i pazienti siano trattati in concomitanza con anticoagulanti. Tuttavia, l'aggiunta della terapia anticoagulante ha il suo rischio di complicanze emorragiche come sanguinamento del sito di accesso, sanguinamento del tratto gastrointestinale, ictus emorragico e rischio di trombocitopenia indotta da eparina (HITT)16. Le interruzioni dell'anticoagulazione dovute a complicanze emorragiche possono causare trombosi della pompa. In questo contesto, il dispositivo deve essere sostituito con cautela. La diagnosi deve essere rapidamente chiarita tra le altre cause del deterioramento emodinamico acuto e del basso flusso del dispositivo, tra cui sepsi o ipovolemia/emorragia.
Nonostante tutte le sue possibili complicazioni, questa pRVAD sta diventando sempre più comune in molti ospedali negli Stati Uniti per la gestione non invasiva del fallimento del ventricolo destro. Il suo design portatile consente ai pazienti di sedersi, stare in piedi e persino deambulare liberamente se posizionato e fissato in modo appropriato. Può anche essere facilmente rimosso al letto del paziente dopo che il dispositivo è stato svezzato. Il dispositivo è approvato dalla FDA per l'uso fino a 6 giorni, ma ci sono state segnalazioni di utilizzo da settimane amesi 17. Il dispositivo può essere utilizzato per il supporto VV-ECMO aggiungendo un ossigenatore al circuito in qualsiasi momento durante l'utilizzo del dispositivo18. Il dispositivo da 31 Fr ha anche una versione RD (Rapid Deployment) illustrata nella Figura 3. La RD è stata principalmente citata in letteratura come un dispositivo di supporto ventricolare sinistro temporaneo utilizzato come ponte verso altri dispositivi di supporto con posizionamento tramite un approccio apicale per fornire un supporto LV minimamente invasivo19.
A differenza del Protek Duo, l'Impella RP è un dispositivo percutaneo utilizzato per il supporto del ventricolo destro che viene inserito nella vena femorale, richiede un rigoroso riposo a letto e non consente la deambulazione. Fornisce inoltre un flusso assiale rispetto al Protek Duo, che fornisce un flusso centrifugo. I dispositivi a flusso centrifugo hanno eventi di sanguinamento gastrointestinali inferiori con frequenze di ictus comparabili17. Le complicanze comunemente riportate della RP di Impella includono emorragie (42,9%), problemi vascolari (22,8%), frammentazione del dispositivo (34,2%), coagulazione del sistema (17,1%) e disconnessione del dispositivo (8,6%)20. Diversi altri dispositivi di supporto per camper2 sono attualmente in fase di studio. Potrebbero arrivare sul mercato in futuro, ma per ora questo dispositivo a doppia cannula rimane una scelta interessante come dispositivo percutaneo non invasivo per il trattamento a breve termine dell'insufficienza del ventricolo destro.
Protocollo
Il presente protocollo è approvato dal comitato etico per la ricerca umana del Centro medico dell'Università del Nebraska. Il protocollo segue le linee guida del comitato etico per la ricerca umana dello stesso ateneo.
1. Inserimento del dispositivo
NOTA: Questa procedura deve essere eseguita idealmente in una suite di fluoroscopia per garantire un posizionamento accurato del dispositivo.
- Preparare il paziente.
NOTA: Tutti i pazienti di età >18 anni, maschi o femmine, sono idonei a questa terapia se l'anatomia è adatta per l'accesso e la consegna appropriati del dispositivo. Anche le persone di età <18 anni possono essere prese in considerazione per il dispositivo, se l'anatomia è adatta.- Identificare ed esporre il sito di accesso.
NOTA: Sono disponibili quattro opzioni per l'inserimento di questo dispositivo cannula. Può essere posizionato tramite IJ destro (preferito), IJ sinistro, succlavia sinistra o vena succlavia destra. - Utilizzando una soluzione di preparazione a base di clorexidina o iodio (vedi Tabella dei materiali), pulire accuratamente il sito di accesso e le aree circostanti. Applicare un telo sterile per stabilire un campo sterile in modo standard.
- Identificare ed esporre il sito di accesso.
- Autosterilizzazione. Scrub, camice e guanto seguendo la tecnica sterile.
- Sterilizzare l'ecografo. Posizionare un coperchio sterile della sonda ecografica sul trasduttore a ultrasuoni (vedere la Tabella dei materiali).
- Utilizzando la guida ecografica, identificare l'accesso venoso.
NOTA: Escludere eventuali ostruzioni al flusso venoso all'interno del vaso bersaglio scansionando su e giù il vaso con la sonda a ultrasuoni. - Utilizzando la tecnica di Seldingermodificata 21, ottenere l'accesso alla vena.
- Anestetizzare iniettando fino a 10 ml di lidocaina all'1% nel tessuto sottocutaneo nel sito di accesso.
- Sotto guida ecografica, incannulare la vena utilizzando un ago per micropuntura da 5 Fr.
- Sotto guida fluoroscopica o ecocardiografica transesofagea (TEE), inserire un filo di micropuntura attraverso l'ago ~8-10 cm nella vena. Rimuovere l'ago, lasciando il filo in posizione.
NOTA: Assicurarsi di tenere sempre il filo per evitare l'embolizzazione. - Ingrandire il sito di puntura utilizzando una lama da 10, praticando una piccola incisione di 0,5 cm direttamente sopra il filo perpendicolare al filo.
NOTA: I pazienti tendono a sanguinare direttamente dopo questo passaggio. È bene avere l'attrezzatura prontamente disponibile per prevenire sanguinamenti eccessivi. Inoltre, potrebbe essere necessaria una garza sterile 4 x 4 da applicare nel sito di incisione per eliminare il sangue in eccesso. - Posizionare una guaina da 5 Fr sul filo. Rimuovere il filo lasciando la guaina in posizione.
- Quindi, inserire un filo da 0,035" attraverso la guaina da 5 Fr e ingrandirlo a un catetere di accesso multi-lume (MAC) da 9 lumen. Una volta ingrandito a 9 MAC, rimuovere il filo.
- Dopo il posizionamento della guaina, far galleggiare un catetere Swan Ganz in modo standard attraverso il MAC da 9 Fr (vedere la Tabella dei materiali) utilizzando la fluoroscopia o la guida TEE.
- Far avanzare un catetere con punta a palloncino (vedere la tabella dei materiali) attraverso la guaina ~10-20 mm, quindi gonfiare il palloncino con 1-2 cc di aria.
- In fluoroscopia, far avanzare il catetere gonfiato con punta a palloncino nell'artrite reumatoide attraverso la valvola tricuspide e il PA principale.
- Inserire un filo rigido di 0,035 pollici di diametro (vedere Tabella dei materiali) attraverso il catetere con punta a palloncino nel PA destro.
- Dopo aver sgonfiato il catetere con punta a palloncino, rimuovere il cigno lasciando il filo rigido in posizione.
- Dilatare in serie il sito di accesso utilizzando dilatatori sequenzialmente più grandi (Figura 3) posizionando i dilatatori uno per uno sul filo rigido dal più piccolo al più grande fino a 26 Fr utilizzando i dilatatori del dispositivo. Se si utilizza una cannula da 31 Fr, dilatare fino a 30 Fr.
- Contemporaneamente tenere il filo all'altezza della pelle e mantenere la pressione in modo intermittente per evitare sanguinamenti con la mano sinistra e guidare i dilatatori con l'altra mano.
NOTA: Questo pRVAD non viene fornito con un dilatatore da 30 Fr. Qui viene sostituito un dilatatore tracheale da 30 Fr (vedi Tabella dei materiali). Inoltre, si noti che ogni successiva dilatazione aumenta le dimensioni del sito di accesso e quindi ogni fase di dilatazione può causare un aumento del rischio di sanguinamento.
- Contemporaneamente tenere il filo all'altezza della pelle e mantenere la pressione in modo intermittente per evitare sanguinamenti con la mano sinistra e guidare i dilatatori con l'altra mano.
- Somministrare boli di eparina non frazionati per via endovenosa (IV) per ottenere un tempo di coagulazione attivato (ACT) di ~250, a seconda del rischio di sanguinamento del paziente.
NOTA: Potrebbe essere necessario ridurre l'obiettivo dell'ACT per i pazienti con un rischio di sanguinamento più elevato (ad esempio, sternotomia fresca). L'obiettivo ACT sopra elencato utilizza un dispositivo Hemochron (vedi Tabella dei materiali). Per raggiungere l'obiettivo ACT raccomandato, somministrare 70-100 unità/kg di eparina non frazionata EV. Nel caso in cui il livello terapeutico di ACT non venga raggiunto con il bolo iniziale, possono essere somministrati boli aggiuntivi in base al livello di ACT raggiunto, ma le linee guida non forniscono raccomandazioni precise sul dosaggio. - Una volta raggiunta l'ACT terapeutica, inserire il dispositivo pRVAD.
- Far avanzare l'introduttore e il gruppo cannula del dispositivo sul filo guida.
NOTA: La dimensione della cannula varia da paziente a paziente. Pertanto, la dimensione dell'assemblaggio della cannula dipende dalla cannula selezionata. - Prima di spingere il dispositivo attraverso la pelle sopra il filo, spingere il filo retrogrado attraverso il dispositivo fino a quando non si osserva che il filo fuoriesce dalla punta distale.
- Una volta osservato e fissato il filo, far avanzare la cannula introduttrice attraverso la pelle sopra il filo.
- Far avanzare il dispositivo oltre le valvole tricuspide e polmonare attraverso il PA principale e nel PA destro.
NOTA: Il corretto posizionamento è confermato dall'ecocardiografia, dalla trasduzione delle pressioni intracardiache sul catetere PA e/o dalla fluoroscopia. Si consiglia di dispiegare il dispositivo in profondità nel PA destro e quindi di riportarlo nella posizione appropriata appena distale alla biforcazione per evitare di aprire la cannula troppo poco profonda e impedire al dispositivo di prolassare nel ventricolo destro, che può essere catastrofico. Il dispositivo può essere distribuito anche nel PA sinistro, ma tende ad avere una curva più morbida nell'RPA.
- Far avanzare l'introduttore e il gruppo cannula del dispositivo sul filo guida.
- Rimuovere l'introduttore e il filo rigido quando il dispositivo si trova nella posizione desiderata (Figura 4).
- Mantenendo la posizione del dispositivo sotto visualizzazione con fluoroscopia, rimuovere prima l'introduttore e poi tirare delicatamente il filo rigido fino a rimuovere l'intero filo.
- Clamp la cannula sulle porte prossimale e distale (Figura 2).
- Rivalutare il posizionamento della cannula tramite TEE e/o fluoroscopia.
NOTA: In genere, il dispositivo viene inizialmente posizionato intenzionalmente con la punta nel PA destro, quindi con il filo e l'introduttore fuori, il dispositivo viene delicatamente retratto fino a quando la punta non è appena prossimale alla biforcazione PA su TEE e imaging fluoroscopico e almeno 3-4 cm oltre la valvola polmonare.
- Fissare la cannula del dispositivo in posizione.
2. Connessione, attivazione e manutenzione del dispositivo
- Dearizzare e collegare il tubo standard fornito nel kit del dispositivo.
- Assicurarsi che il circuito sia innescato e disaerato prima di collegare il tubo.
- Collegare il tubo di deflusso contrassegnato da una striscia rossa utilizzando il contatto fluido-fluido alla porta della cannula per il drenaggio del sangue di ritorno (dalla pompa al paziente).
- Collegare il tubo di mandata della pompa contrassegnato da una striscia blu utilizzando un contatto fluido-fluido alla porta della cannula per il drenaggio del sangue (dal paziente alla pompa).
- Rilasciare i morsetti.
- Accendere la pompa centrifuga a partire da 5.500 giri al minuto (RPM).
- Aumentare gradualmente i giri della pompa fino a raggiungere il livello di flusso desiderato.
- Ricontrollare il posizionamento della pompa.
NOTA: La verifica del posizionamento della punta della cannula può essere facilitata in questa fase, dato il flusso di colore alle porte di uscita sul TEE. - Fissare la pompa.
- Fissare la pompa utilizzando il giubbotto viaggiatore (vedere la Tabella dei materiali) o l'involucro (Figura 5) per mantenere la stabilità del dispositivo e consentire il comfort del paziente e la deambulazione.
- Eseguire la manutenzione del dispositivo.
- Monitorare il posizionamento del dispositivo con radiografie giornaliere del torace. Monitorare attentamente l'emodinamica del paziente mentre il dispositivo è inserito per garantire un adeguato supporto emodinamico.
- Monitora i laboratori ogni 6 ore, inclusi emocromo completo, pannello metabolico completo, elettroliti, acido lattico e saturazione venosa mista prelevata centralmente.
3. Rimozione del dispositivo
- Svezzare il dispositivo seguendo i passaggi seguenti.
- Ridurre gradualmente la velocità del dispositivo monitorando la risposta emodinamica e della funzione cardiaca.
NOTA: In genere, questo viene eseguito mentre si ottiene uno studio di turn-down dell'ecocardiogramma incentrato sulla funzione cardiaca con flussi più bassi sul dispositivo. L'acido lattico, la saturazione venosa mista e la funzionalità epatica/renale devono essere monitorati frequentemente. Se in qualsiasi momento si osserva un peggioramento della funzione del ventricolo destro o una disfunzione d'organo terminale osservata da laboratori anormali, il paziente ha fallito lo svezzamento del ventricolo destro e deve continuare il supporto.
- Ridurre gradualmente la velocità del dispositivo monitorando la risposta emodinamica e della funzione cardiaca.
- Se la funzione RV sembra adatta per la rimozione del dispositivo e il paziente si ossigena e ventila bene, svezzare la velocità e rimuovere la cannula.
- Prima di rimuovere la cannula, bloccare le porte prossimale e distale per evitare perdite di sangue.
- Rimuovere la cannula.
NOTA: Una volta che la cannula viene retratta nel punto in cui sono esposte le porte laterali atriali, questi siti sanguineranno e quindi la cannula deve essere tirata senza intoppi ma rapidamente. Una sutura riassorbibile a forma di otto 2-0 viene posizionata attraverso la pelle o il tessuto sottocutaneo per l'emostasi nel sito di ingresso.
Risultati
Il dispositivo ha inizialmente ottenuto l'autorizzazione della FDA negli Stati Uniti dopo un ampio studio di controllo randomizzato, che ha rivelato un miglioramento del 31% della sopravvivenza nel trattamento della sindrome da distress respiratorio acuto con il dispositivo utilizzato come VV_ECMO22. Alla fine, è stato approvato come bypass da RA a PA. Tuttavia, il dispositivo non è ancora stato approvato per l'uso come RVAD, sebbene in molti centri importanti il dispositivo venga già utilizzato come sostituto RVAD in molti casi. Attualmente sono in corso studi osservazionali multicentrici che valutano ulteriormente questo dispositivo nel contesto dello shock. Il percorso del supporto percutaneo per la CS è stato lungo e in continua evoluzione. Lo studio SHOCK originale ha aperto la strada ai dispositivi di supporto percutaneo in caso di shock. Un ampio studio di controllo randomizzato ha valutato la pompa a palloncino intra-aortica (IABP) come forma percutanea di supporto cardiopolmonare23. Dal debutto dello studio SHOCK, diversi dispositivi sono stati lanciati sul mercato per il trattamento della CS, incluso il dispositivo descritto.
Tuttavia, rimangono poche o nessuna guida sull'utilizzo di questi dispositivi negli urti per camper. Ad esempio, la più recente dichiarazione di consenso degli esperti della Society of Cardiovascular Angiography and Interventions (SCAI) del 2019 menziona solo brevemente lo shock del ventricolo destro. Afferma che si tratta di una forma unica di CS con un'elevata mortalità associata e suggerisce di valutare e monitorare i cateteri emodinamici PA per guidare ulteriormente la gestione24.
Nonostante la mancanza di una guida di consenso da parte degli esperti, la prevalenza dell'insufficienza ventricolare destra grave è in aumento. Sebbene confuso dalla possibile crescita della nostra capacità di diagnosticare l'insufficienza ventricolare sinistra e/o dall'aumento degli impianti di dispositivi di assistenza ventricolare sinistra e dei trapianti di cuore che predispongono entrambi all'insufficienza ventricolare sinistra, un individuo con questa diagnosi ha un tasso di mortalità associato del ~50% in 1 anno25. La maggior parte dei pazienti sottoposti a valutazione per questo tipo di MCS sono in stadio SCAI D/E CS, che sono rispettivamente pazienti in peggioramento e in extremis.
Il dispositivo descritto, un pRVAD temporaneo minimamente invasivo, ha dimostrato di ridurre drasticamente il tasso di mortalità a 1 anno in questa popolazione di pazienti al 15%-19%13,14. Si ritiene che il dispositivo raggiunga questo obiettivo attraverso il miglioramento di molteplici parametri emodinamici come la pressione arteriosa media, la CVP, la pressione AR, il lavoro dell'ictus del ventricolo destro, la saturazione venosa mista, la gittata cardiaca complessiva e consenta una diminuzione dei requisiti complessivi di pressore; pertanto, lasciando il tempo per il rimodellamento del ventricolo destro mostrato in un singolo studio centrato26. Sebbene il ventricolo destro sia fragile, tende anche ad essere abbastanza resistente e in grado di riprendersi con il trattamento appropriato, come dimostrato dalla popolazione CTEPH dopo tromboendoarteriectomia27.
I tassi di complicanze documentati con questo dispositivo variano in letteratura. I tassi di infezione, l'emorragia e gli eventi embolici possono essere osservati fino al 40% dei casi o solo nel 10% dei casi28. Sono comuni anche la trombosi venosa profonda post-uso e l'embolia polmonare. Tuttavia, non ci sono attualmente raccomandazioni per la sorveglianza dei coaguli dopo l'uso o raccomandazioni per la profilassi. La TR residua da moderata a grave può essere osservata in ~36% dei casi, emolisi correlata al dispositivo in ~14% dei casi e migrazione della cannula in ~7% dei casi. Gli studi hanno dimostrato che lo svezzamento del dispositivo può essere raggiunto con successo nell'85%-90% dei pazienti29. La conversione in RVAD chirurgica può essere necessaria in ~11% dei casi3. Circa ~10% dei pazienti muore con il supporto29. C'è un tasso di mortalità per tutte le cause in ospedale del 15% e un sorprendente tasso di sopravvivenza dell'81% a un anno (Tabella 1)11,26,30,31.

Figura 1: Cannula del dispositivo etichettata. Cannula RVAD con introduttore e parti etichettate. Questa figura è riprodotta con il permesso del riferimento32. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Cannule del dispositivo. Le cannule RVAD da 29 Fr, 31 Fr e RD. Questa figura è riprodotta con il permesso del riferimento32. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Dilatatori del dispositivo. Sono utilizzati per la dilatazione seriale del sito di accesso. Questa figura è riprodotta con il permesso del riferimento32. Clicca qui per visualizzare una versione più grande di questa figura.
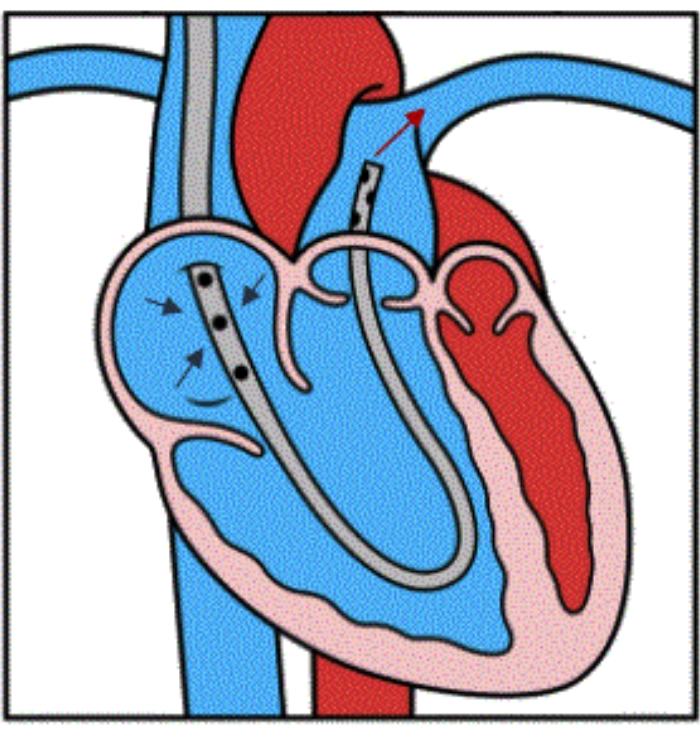
Figura 4: Illustrazione del flusso del dispositivo. Illustrazione che dimostri il corretto posizionamento del dispositivo all'interno del PA principale distale. Le tre frecce blu indicano il drenaggio venoso dall'artrite reumatoide nei fori laterali della cannula. La freccia rossa dimostra la reinfusione del sangue nel PA principale, bypassando il RV. Questa figura è riprodotta con il permesso del riferimento32. Clicca qui per visualizzare una versione più grande di questa figura.
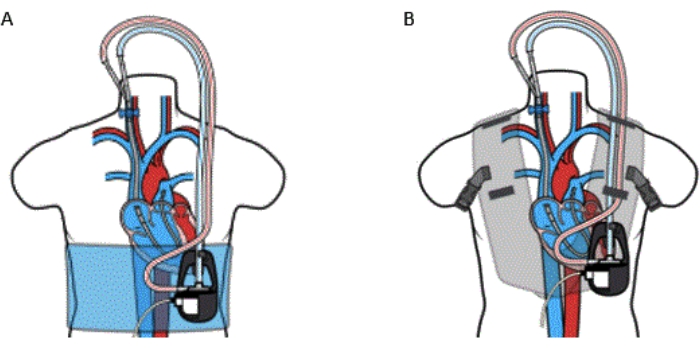
Figura 5: Cannula percutanea del dispositivo da RA a bypass PA con (A) avvolgimento e (B) giubbotto. Il kit VoyagerVest non deve essere utilizzato su pazienti con un'allergia nota al neoprene. Questa figura è riprodotta con il permesso del riferimento32. Clicca qui per visualizzare una versione più grande di questa figura.
| A. Complicazioni | |
| Tassi di infezione, emorragie ed eventi embolici | 10%-40% |
| TR residua da moderata a grave | ~36% |
| Emolisi correlata al dispositivo | ~14% |
| Migrazione della cannula | ~7% |
| B. Esito relativo al dispositivo | |
| Svezzamento riuscito del dispositivo | ~85%-90% |
| Conversione in RVAD chirurgico | ~11% |
| I pazienti sono morti durante il supporto | ~10% |
| Mortalità intraospedaliera | 15% |
| Tasso di sopravvivenza in un anno | ~81% |
Tabella 1: A. Complicanze di Protek Duo MCS; B. Risultati relativi al dispositivo
Discussione
Lo shock del ventricolo destro fa presagire una mortalità eccezionalmente elevata. Dovrebbe essere riconosciuto all'inizio del decorso della malattia e trattato in modo aggressivo. Il Protek Duo è un MCS all'avanguardia per il trattamento degli urti RV che può essere posizionato durante qualsiasi fase di shock SCAI. Alcuni passaggi critici nel posizionamento del dispositivo includono: ottenere l'accesso utilizzando la tecnica di Seldinger modificata21, dilatazione sequenziale del sito di accesso a una guaina Fr di dimensioni adeguate, far galleggiare un catetere con punta a palloncino nel PA principale, introduzione di un filo guida rigido attraverso il catetere con punta a palloncino nel PA principale, rimozione del catetere con punta a palloncino, somministrazione di eparina EV, e infine far avanzare il dispositivo sul filo rigido dopo aver raggiunto un livello terapeutico di ACT. Una volta che il dispositivo è stato confermato nella posizione corretta tramite fluoroscopia o ecocardiografia con o senza analisi dell'onda di pressione tramite il catetere PA, il filo e l'introduttore possono essere rimossi e il dispositivo può essere fissato in posizione. In rare situazioni di emergenza, questo dispositivo può essere posizionato accanto utilizzando TEE per la visualizzazione e/o utilizzando la forma d'onda della pressione PA per confermare il corretto posizionamento del dispositivo; tuttavia, se un paziente sta peggiorando in modo acuto ed è necessario un dispositivo di supporto al letto del paziente, potrebbe essere più appropriato passare all'ECMO venoso-arterioso o ad un'altra strategia di supporto. In caso contrario, questa procedura deve essere eseguita in una suite di fluoroscopia o all'interno di una sala operatoria.
Esistono diverse varianti di questa procedura documentate in letteratura. Il protocollo presentato in questo articolo deriva dalla nostra esperienza monocentrica. È importante riconoscere diverse possibili modifiche al protocollo delineato. Una modifica sarebbe la scelta del sito di accesso. Il sito di accesso consigliato per questa procedura è la vena IJ destra10. Questo accesso fornisce un accesso diretto al cuore destro e ha dimostrato di essere il meno problematico da impiantare. Tuttavia, i proceduralisti possono impiantare questo dispositivo attraverso la succlavia sinistra, l'IJ sinistro o la vena succlavia destra33. È elencato in ordine di preferenza, ad eccezione del giusto approccio succlaviano, che attualmente non viene utilizzato come opzione ma ha avuto successo in altre istituzioni. Uno di questi siti di accesso alternativi può essere preferito nei pazienti con occlusione del sito di accesso. Se si sospetta un'occlusione del sito di accesso, si raccomanda di visualizzare sia l'IJ sinistro che i siti di accesso succlavia utilizzando un'ecografia doppler per valutare la pervietà prima del dispiegamento del dispositivo. Può anche essere eseguito un venogramma per valutare l'accesso.
Ci sono alcuni avvertimenti che utilizzano l'accesso alternativo. Un problema riscontrato utilizzando l'approccio succlavia sinistro è un'incidenza non banale di trombosi succlavia34. Poiché ciò potrebbe impedire il futuro accesso alla dialisi utilizzando la vena succlavia, il sistema succlavia è stato utilizzato con cautela nei pazienti che si prevede necessitino di dialisi. Tipicamente, quando si utilizza l'approccio succlavia sinistro, una cannula di 31 Fr deve avere una lunghezza sufficiente. L'approccio IJ sinistro è più difficile da utilizzare dato il percorso altamente tortuoso nel PA destro. Dalla vena IJ sinistra, c'è una brusca virata di 90° per entrare nella vena anonima e poi passare nella vena cava superiore (SVC), che conduce nella RA. Questo turno inizialmente aggiunto con questo accesso potrebbe rendere difficile per il proceduralista effettuare il secondo turno verso il basso nell'RA e successivamente il terzo turno dall'RA attraverso il RV nel PA principale.
Proprio come può essere difficile posizionare la punta della cannula del dispositivo all'interno del PA principale utilizzando questi siti di accesso separati, il proceduralista può avere problemi a far galleggiare il catetere con punta a palloncino nel posizionamento corretto. Ciò potrebbe richiedere più tentativi di fluttuazione. In particolare, due punti principali rendono difficile galleggiare in posizione. Uno è dal camper al PA destro. In caso di problemi, provare a far avanzare il catetere durante la sistole e utilizzare la spinta del ventricolo e il flusso del sangue per aiutare a far galleggiare il cigno in posizione. La sfida per il secondo posto è dalla SVC alla RA. Questo è comune nei cuori trapiantati. A volte si sviluppa una cresta sulla linea di sutura SVC e sulla linea di sutura PA che può ostruire il passaggio del catetere con punta a palloncino. Se ciò accade, sostituisci la guaina sul filo con una guaina più lunga che passa oltre questa cresta nell'AR. Ciò garantirà che il catetere con punta a palloncino possa accedere al cuore destro. Inoltre, con il posizionamento di un dispositivo al momento del trapianto, questo è stato spesso fatto mentre il torace è ancora aperto, il che può garantire l'integrità delle linee di sutura anastomotica con il passaggio del dispositivo e preservare le opzioni RVAD aperte se il dispositivo non può essere distribuito con successo.
È necessario conoscere alcuni suggerimenti per la risoluzione dei problemi prima di eseguire questa procedura. Ad esempio, a volte, la rigidità della cannula può farla scendere preferenzialmente lungo la vena cava inferiore (IVC) invece di seguire la curva del filo dentro e attraverso la valvola tricuspide. Se questo non viene risolto con un filo rigido, considera di lasciare la cannula in vivo per un po'. Ciò consentirà alla cannula di ammorbidirsi dal calore all'interno del corpo e quindi diventare gradualmente più malleabile, consentendo una facile manipolazione del dispositivo per seguire la curva del filo. Anche le variazioni anatomiche possono rivelarsi difficili per gli operatori. Prestare attenzione all'anatomia SVC più piccola, aumentando il rischio di sindrome SVC. Anche il sanguinamento durante la procedura può essere un'altra complicanza. Sebbene sia meno comune essere una complicanza significativa poiché questo protocollo utilizza l'accesso venoso a bassa pressione. Ci si dovrebbe aspettare un po' di sanguinamento; Tuttavia, in genere è possibile evitare grandi quantità di sanguinamento. Ciò può essere ottenuto attraverso un'attenta dilatazione sequenziale del vaso di accesso. Applicare una compressione sulla pelle prossimale al sito di accesso per tamponare il vaso durante la rimozione di ciascun dilatatore. È necessario disporre di un'opzione alternativa per il supporto se il dispositivo non può essere distribuito. Al termine della procedura, è inoltre essenziale garantire un posizionamento appropriato del dispositivo, che il dispositivo sia sicuro e applicare un'imbottitura alle parti esterne della cannula vicino al corpo per evitare ulcere da pressione della testa, del cuoio capelluto, delle orecchie e di altre parti del corpo nelle vicinanze. Il dispositivo stesso è trombogeno e richiede un'anticoagulazione continua durante l'uso35. Qualsiasi controindicazione all'anticoagulazione sarebbe una controindicazione relativa all'uso di questo dispositivo. Può verificarsi anche un trombo dopo l'estrazione. Un grande calco di trombi viene riscontrato dalla cannula dall'artrite reumatoide e nella RVOT e, con un'esperienza minima, sono stati in grado di gestirlo con l'anticoagulazione.
Il rigurgito tricuspidale (TR) è una possibile complicanza2 associata all'uso di questa pRVAD. Quando la cannula passa attraverso la valvola tricuspide (TV), ostruisce i lembi TV e inibisce la corretta coaptazione dei lembi. In genere, questo non è un problema mentre la cannula è in posizione. Tuttavia, se c'è un danno residuo al televisore, potrebbe esserci una TR emodinamicamente significativa rivelata con l'estrazione del dispositivo. Una complicanza meno comune, ma forse più grave, è lo sviluppo di trombocitopenia ed emolisi correlate al dispositivo. Questo a volte può essere confuso con HITT16, che è anche comune in questa popolazione di pazienti. Infine, può verificarsi la migrazione della cannula. Questo è il punto in cui la cannula prolassa nel ventricolo destro o avanza nei PA destro o sinistro. Anche se, se la cannula favorisce l'AP destro o sinistro, di solito non è dannosa a seconda del flusso richiesto e di altre considerazioni anatomiche. Al contrario, avere la cannula troppo poco profonda può rischiare di prolasso al di sotto della valvola polmonare, che può essere emodinamicamente catastrofico. Pertanto, la punta distale del dispositivo deve essere almeno 3-4 cm distale rispetto alla valvola polmonare (discussa più avanti). La cannula deve essere fissata con cura durante il trasporto e lo spostamento del paziente per evitare lo spostamento della posizione della cannula.
Come con qualsiasi oggetto intravascolare o impianto, il dispositivo è a rischio di infezione, in particolare l'uso prolungato. Se l'infezione del dispositivo viene confermata, potrebbe essere necessario lo scambio o la conversione a una strategia di supporto alternativa (ad esempio, VA-ECMO). In situazioni terribili di un dispositivo infetto in cui il paziente non tollerava l'interruzione del supporto e l'ECMO VA-ECMO non era un'opzione praticabile, è stato posizionato un dispositivo a doppia cannula succlavia sinistra prima di rimuovere un dispositivo IJ destro infetto ed entrambi i dispositivi sono rimasti brevemente nel cuore allo stesso tempo. Quindi, non c'è stata alcuna interruzione nel supporto.
In conclusione, il dispositivo descritto è attualmente un dispositivo approvato dalla FDA per il trattamento del fallimento del ventricolo destro. Inoltre, il suo principale vantaggio è consentire la deambulazione in tandem, un maggiore comfort del paziente e tassi di infezione più bassi grazie alla sua capacità di evitare l'accesso all'inguine. Si prevede che studi e sperimentazioni cliniche futuri evidenzieranno ulteriormente i benefici e i risultati di questo dispositivo nella pratica clinica.
Divulgazioni
Poonam Velagapudi rivela i seguenti rapporti con l'industria: Ufficio del presidente - Abiomed, Opsens; comitato consultivo - Abiomed, Sanofi; pasti/spese di viaggio- Abiomed, Boston Scientific, Medtronic, Chiesi, Phillps.
Riconoscimenti
Questo manoscritto non sarebbe stato possibile senza l'eccezionale supporto dei miei mentori, il Dr. Poonam Velagapudi e il Dr. Anthony Castleberry e il supporto di tutti i dipartimenti cardiovascolari e cardiotoracici dell'University of Nebraska Medical Center. Non sono stati utilizzati fondi per la realizzazione di questo documento.
Materiali
| Name | Company | Catalog Number | Comments |
| Amplatzer Super Stiff Wire 0.035' x 145 cm | Boston Scientific | M001465631 | If not in stock, may use any stiff 0.035" wire. |
| Avalon Tracheal Dilator | Avalon Laboratories Inc., Rancho Dominguez, CA | 12210 | This comes in a set. The 30 Fr dilator is the only part used. |
| Full 29 Protek Duo Kit | LivaNova/ Tandem Life | 5820-2916 | Cannula, pump, holster, wrap |
| Full 31 Protek Duo | LivaNova/Tandem Life | 5820-3118 | Cannula, pump, holster, wrap |
| Hemochron Signature Elite ACT Testing Device and Supplies | Werfen North America | DCJACT-A and DCJACT-N | |
| Lidocaine | Pharmaceutical | Pfizer | |
| LifeSPARC Centrifugal Pump | LivaNova/ Tandem Life | 5840-2417 | |
| Micropuncture needle | Cook Medical | G56202 | 5 Fr |
| Multi-Lumen Access Catheter | Arrow/Teleflex | AK-21242-CDC | 9 Fr |
| Preparation solution | Pharmaceutical | NA | Chlorohexidine-based or iodine-based |
| Protek Duo Cannula 29Fr | LivaNova/ Tandem Life | 5140-4629 | Components: One 29 Fr ProtekDuo Veno-Venous Wire Reinforced Cannula with radiopaque tip markers, One 13 Fr Introducer |
| Protek Duo Cannula 31Fr | LivaNova/Tandem Life | 5140-5131 | - 31 Fr x 51 cm Veno-Venous Dual Lumen Cannula with Introducer |
| Protek Duo Insertion Kit | LivaNova/ Tandem Life | 5100-0014 | Components: balloon tipped PA catheter, one 0.035 stiff guidewire |
| Protek Duo RD Cannula | LivaNova/Tandem Life | 5820-3631 | Cannula, introducer |
| Swan Ganz Catheter | Edwards Lifesciences | 774F75 or 777F8 | |
| Ultrasound | Standard vascular ultrasound. | GE | |
| Ultrasound probe cover over the ultrasound transducer | Standard probe cover to match vascular ultrasound transducer | GE | |
| Voyager Vest Kit | LivaNova/Tandem Life | Contact LivaNova | Includes vest and wrap. Should not be used on patients with a known allergy to neoprene. |
Riferimenti
- Saxena, A., et al. Value of hemodynamic monitoring in patients with cardiogenic shock undergoing mechanical circulatory support. Circulation. 141 (14), 1184-1197 (2020).
- Arrigo, M., et al. Right ventricular failure: Pathophysiology, diagnosis and treatment. Cardiac Failure Review. 5 (3), 140-146 (2019).
- Jacob, M., et al. Right ventricular dysfunction post-heart transplantation. Right Ventricular Physiology, Adaptation and Failure in Congenital and Acquired Heart Disease. , 193-216 (2018).
- Haddad, F., et al. Right ventricular function in cardiovascular disease, part II. Circulation. 117 (13), 1717-1731 (2008).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Patel, N., et al. Percutaneous biventricular mechanical circulatory support with impella CP and Protek Duo Plus. Journal of Invasive Cardiology. 31 (2), 46 (2019).
- Banfi, C., et al. Veno-venous extracorporeal membrane oxygenation: cannulation techniques. Journal of Thoracic Disease. 8 (12), 3762-3773 (2016).
- Jayaraman, A. L., Cormina, D., Shah, P., Ramakrishma, H. Cannulation strategies in adult veno-arterial and veno-venous extracorporeal membrane oxygenation: Techniques, limitations, and special considerations. Annals of Cardiac Anaethesia. 20 (1), 11-18 (2017).
- Nicolias, C. D., et al. Use of Protek duo tandem heart for percutaneous right ventricular support in various clinical settings: A case series. Journal of the American College of Cardiology. 71 (11), 1314 (2018).
- Kang, G., Ha, R., Banerjee, D. Pulmonary artery pulsatility Index Predicts Right Ventricular Failure After Left Ventricular Assist Device Implantation. The Journal of Heart and Lung Transplantation. 35 (1), 67-73 (2016).
- Johnson, G. Protek Duo Veno-venous cannula. Food and Drug Administration. , (2017).
- Carrozzini, M., et al. Percutaneous RVAD with the Protek Duo for severe right ventricular primary graft dysfunction after heart transplant. The Journal of Heart and Lung Transplantation. 40 (7), 580-583 (2021).
- Salna, M., et al. Novel percutaneous dual-lumen cannula-based right ventricular assist device provides effective support for refractory right ventricular failure after left ventricular assist device implantation. Interactive Cardiovascular and Thoracic Surgery. 30 (4), 499-506 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit Cardiogenic Shock Initiative. Catheter Cardiovascular Intervention. 91 (3), 454-461 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2021).
- Memon, H. A., et al. Extracorporeal membrane oxygenation support through Protek Duo cannula: A case series. The American Journal of Respiratory and Critical Care Medicine. 201, 5115 (2020).
- Ravichandran, A. K., Baran, D. A., Stelling, K., Cowger, J. A., Salerno, C. T. Outcomes with the tandem Protek Duo dual lumen percutaneous right ventricular assist device. ASAIO Journal. 64 (4), 570-572 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2020).
- Belani, K., et al. Transapical Protek Duo rapid deployment cannula as temporary left ventricular assist device in a Jehovah's Witness. Journal of Cardiothoracic and Vascular Anesthesia. 35 (12), 3735-3742 (2020).
- Khalid, N., et al. Adverse events and modes of failure related to impella RP: Insights from the Manufacturer and User Facility Device Experience (MAUDE) database. Cardiovascular Revascularization Medicine. 20 (6), 503-506 (2019).
- Ramos, F., et al. Técnica modificada de Seldinger. Canalización de catéteres venosos centrales a través de catéteres venosos periféricos [Seldinger modified technique]. Revista de Enfermeria. 31 (12), 14-16 (2008).
- Peek, J., et al. Efficacy and economic assessment of conventional ventilator support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicenter randomized controlled trial. Lancet. 374 (9698), 1351-1363 (2009).
- Menon, V., et al. Cardiogenic shock: A summary of the randomized SHOCK trial. Congestive Heart Failure. 9 (1), 35-39 (2003).
- Baran, A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Santas, E., et al. Right ventricular dysfunction staging system for mortality risk stratification in heart failure with preserved ejection fraction. Journal of Clinical Medicine. 9 (3), 831 (2020).
- Kapur, N. K., et al. Effects of a percutaneous mechanical circulatory support device for medically refractory right ventricular failure. The Journal of Heart and Lung Transplant. 30 (12), 1360-1367 (2011).
- Murata, M., et al. Clinical significance of Guanylate Cyclase stimulator, riociguat, on right ventricular functional improvement in patients with pulmonary hypertension. Cardiology. 146 (1), 130-136 (2021).
- Aggarwal, V., et al. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheter Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Schmack, B., et al. Results of concomitant groin-free percutaneous temporary RVAD support using a centrifugal pump with a double-lumen jugular venous cannula in LVAD patients. Journal of Thoracic Disease. 11 (6), 913-920 (2019).
- Cheung, A. W., White, C. W., Davis, M. K., Freed, D. H. Short-term mechanical circulatory support for recovery from acute right ventricular failure: Clinical Outcomes. The Journal of Heart and Lung Transplantation. 33 (8), 794-799 (2014).
- Takayama, H., et al. A novel approach to percutaneous right-ventricular mechanical support. European Journal of Cardiothoracic Surgery. 41 (2), 423-426 (2011).
- D'Angelo, F., et al. Alternative insertion sites for permanent central venous access devices. European Journal of Surgical Oncology. 23 (6), 547-549 (1997).
- Hill, S., et al. Subclavian vein thrombosis: a continuing challenge. Surgery. 108 (1), 1-9 (1990).
- Silva, E., et al. Management of RVAD thrombosis in biventricular HVAD supported patients: Case series. ASAIO Journal. 65 (4), 36-41 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon