Method Article
Einführen, Aufrechterhalten und Entfernen des perkutanen Doppellumen-Kanülen-Unterstützungssystems für den Rechtsventrikel
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll bietet eine detaillierte Beschreibung eines perkutanen rechtsventrikulären Unterstützungssystems mit zwei Lumen und veranschaulicht Schritt-für-Schritt-Anweisungen für das sichere Implantieren, Verwalten und Entfernen des Geräts. Eine Anleitung zur Verwendung und zur Fehlerbehebung von Komplikationen aus einer der wichtigsten monozentrischen Erfahrungen ist ebenfalls enthalten.
Zusammenfassung
Der rechtsventrikuläre (RV) Schock, der klassischerweise durch einen erhöhten zentralvenösen Druck (CVP) mit normalem bis niedrigem Pulmonalarteriendruck (PA) und pulmonalem Kapillarkeildruck (PCWP) gekennzeichnet ist, bleibt unbehandelt weltweit eine bedeutende Ursache für Morbidität und Mortalität. Die Therapien zur Behandlung des RV-Schocks reichen von der medizinischen Behandlung bis hin zur dauerhaften oder perkutanen mechanischen Kreislaufunterstützung (MCS). Ein einzigartiges MCS-Gerät, ein perkutanes rechtsventrikuläres Unterstützungssystem (pRVAD), das 2014 von der Food and Drug Administration (FDA) für die Verwendung zugelassen wurde, funktioniert, indem es das RV vorübergehend über einen einzelnen, doppellumigen Katheter mit extrakorporaler mechanischer Unterstützung entlastet und in der Lage ist, Blut vom rechten Vorhof (RA) zur Haupt-PA zu leiten. Obwohl ursprünglich als venös-venöses extrakorporales Membranoxygenierungsgerät (VV-ECMO) zugelassen, konzentriert sich diese Arbeit auf den Einsatz von RV-Unterstützung, da bereits zuvor ambulante VV-ECMO-Strategien beschrieben wurden. Der Katheter wird am häufigsten durch die rechte Vena jugularis (IJ) in die PA eingeführt und an eine externe Pumpe angeschlossen, die einen Fluss von bis zu 5 l/min ermöglicht. Dieses Gerät kann eine attraktive Wahl für die Behandlung von RV-Schocks sein, da es perkutanes, minimal-invasives Einführen und Entfernen ermöglicht und die Möglichkeit bietet, den Patienten zu gehen, während das Gerät an Ort und Stelle ist. In diesem Protokoll werden die Geräte, hämodynamische Effekte, Indikationen, Kontraindikationen, Komplikationen, die derzeit in der Literatur verfügbare Forschung und Schritt-für-Schritt-Anleitungen zur Implantation, Verwaltung und Extraktion des Geräts ausführlich erläutert, zusammen mit der Anleitung zur Verwendung und Fehlerbehebung von Komplikationen aus einer der größten, monozentrischen Erfahrungen mit dem Gerät.
Einleitung
Der kardiogene Schock (CS) aufgrund eines rechtsventrikulären Versagens (RV) ist nach wie vor eine der am schwierigsten zu behandelnden kardialen Erkrankungen und deutet auf eine hohe Mortalität und Morbiditäthin 1. Es gibt drei primäre pathologische Zustände, die zu einem RV-Versagen führen können: Verlust der myokardialen Kontraktilität, Volumenüberlastung und Drucküberlastung2. Nach einer Herztransplantation kann der Verlust der RV-Kontraktilität sekundär zu einer Myokardischämie, einem Infarkt oder einer Entzündung führen, die durch eine Myokarditis oder eine primäre Transplantatdysfunktion verursacht wird3. Eine RV-Volumenüberlastung kann sekundär zu einer rechtsseitigen Klappeninsuffizienz, einem Shunt oder einer unzureichenden Volumeneliminierung (z. B. Nierenversagen) im Vergleich zur enteralen oder intravenösen Aufnahmesein 4. Eine Überlastung des RV-Drucks kann aus einer Verschlechterung der pulmonalen Hypertonie (pHTN), einer Lungenstenose, einer akuten Lungenembolie oder einer dekompensierten linksseitigen Herzinsuffizienz resultieren, der häufigsten Ursache für RV-Versagen5. Perkutane Behandlungsoptionen sind zu einer der Hauptstützen für die Behandlung von RV CS geworden. Neben der medikamentösen Therapie stehen mehrere Geräte zur Behandlung von RV-Versagen zur Verfügung, darunter die venös-arterielle extrakorporale Membranoxygenierung (VA-ECMO), das offene/zentrale rechtsventrikuläre Unterstützungssystem (RVAD), Impella RP, das TandemHeart RV-Unterstützungssystem und das Protek Duo2.
Das Protek Duo ist das einzige minimal-invasive perkutane RVAD (pRVAD) mit einer Dual-Lumen-Kanüle, die das Gehen ermöglicht, während das Gerät an Ort und Stelleist 6 und wird zunehmend in RV CS verwendet, um das RV zu entlasten. Obwohl ursprünglich als venös-venöses extrakorporales Membranoxygenierungsgerät (VV-ECMO) zugelassen, wird sich diese Arbeit auf seine Verwendung zur RV-Unterstützung konzentrieren, da ambulante VV-ECMO-Strategien bereits zuvor beschrieben wurden7. Es entlastet das RV, indem es Blut von der RA in die Lungenarterie (PA) leitet, und ermöglicht die Möglichkeit, eine extrakorporale Zentrifugalpumpe mit oder ohne Oxygenator anzubringen, um eine optimale RV-Unterstützung zu ermöglichen. Das Gerät wurde 2014 von der Food and Drug Administration (FDA)8 für den Einsatz zugelassen. Er kann Durchflüsse von bis zu 4,5-5 L/minliefern 9,10. Sein Dual-Lumen-Katheterdesign saugt Blut über die proximale Zuflusskanüle in der RA an und leitet es über die zentrale PA ab, wobei das RV im Wesentlichen umgangen wird.
Die Kanüle besteht aus zwei unterschiedlichen Lumen mit einem drahtverstärkten Körper. Zwei konzentrische Kanäle für einen bidirektionalen Fluss in einer einzigen Kanüle ermöglichen die gleichzeitige venöse Drainage und Reinfusion von Blut während der extrakorporalen Unterstützung. Der proximale Teil des Geräts ist getrennt und nicht verdrahtet, was eine externe Klemmung ermöglicht, um den Blutfluss während der Implantation und Extraktion des Kanülengeräts zu verhindern. Für eine genaue Positionierung des Geräts wird die Kanüle mit distalen und proximalen Markern markiert, um die Einführtiefe zu identifizieren. Die distalen Marker sind röntgendicht und ermöglichen eine Visualisierung des Geräts in der Röntgenbildgebung, um die Position des Katheters im rechten Vorhof (RA) zu bestimmen. Neben den Markierungen gibt es Fenestrationen oder Löcher an der distalen Spitze und im mittleren Teil des Katheters. Durch die sechs seitlichen Löcher an der distalen Spitze kann das Blut aus dem Katheter in die PA fließen. Durch die Löcher in der Mitte des Schaftes kann sauerstoffarmes Blut von der RA in den Katheter fließen (Abbildung 1). Dieses Design ermöglicht den prä-, intra- und postoperativen Einsatz des Geräts während des gesamten Kontinuums der Eingriffe, die einen kardiopulmonalen Bypass (CPB) erfordern. So wurde das Gerät von uns z.B. isoliert oder im Rahmen einer biventrikulären temporären Unterstützung vor einem dauerhaften linksventrikulären Unterstützungssystem (LVAD) eingesetzt. Es wurde dann während des Eingriffs in eine venöse Drainagekanüle für CPB umgewandelt (indem "Y" die beiden Gliedmaßen mit dem venösen Drainageglied des Kreislaufs verbindet) und dann postoperativ auf RA/PA-Bypass zur RVAD-Unterstützung zurückgeführt. Darüber hinaus wurde die Kanüle auch als PA-Beatmung für die linksventrikuläre (LV) Entlastung/Beatmung im Setting der VA-ECMO mit LV-Dehnung verwendet, indem sowohl der RA- als auch der PA-Port mit venöser Drainage versehen wurde, wiederum in der Vorbereitungseinstellung für die CPB-Verfahren und der anschließenden Umwandlung in eine RVAD-Unterstützung.
Derzeit sind zwei Grössen erhältlich, die 29 Fr oder 31 Fr (Abbildung 2). Diese Katheter sind so konzipiert, dass sie das Einführen erleichtern, und haben daher ein konisches Design, damit der distale Teil des Geräts sicher durch alle Herzstrukturen geleitet werden kann. Konkret verjüngt sich die 29 Fr zu 16 Fr und die 31 Fr zu 18 Fr. Beide Größen sind aus den gleichen Materialien gefertigt. Nach Angaben der FDA sind beide Größen in Bezug auf Zugfestigkeit, Integrität des Signalwegs, Knickradius und Hämolyseraten identisch. Sie unterscheiden sich hinsichtlich der Kanülensteifigkeit und der Druck-Strömungseigenschaften, was bei einer Änderung des Kanülendurchmessers zu erwarten ist. Trotz ihrer Unterschiede sind sie entschlossen, in ihren funktionalen Fähigkeiten gleichwertig zu sein. Die größeren Fr-Größen werden in der Regel für diejenigen verwendet, die mehr Blutfluss benötigen, um eine optimale hämodynamische Unterstützung zu erreichen11.
Ein wesentliches Indikat für die Verwendung des pRVAD ist das Versagen des refraktären RV. Dazu gehören der Status des RV-Versagens nach LVAD-Platzierung, der Status nach einer Kardiotomie, ein postakuter Myokardinfarkt oder der Status nach einer Herztransplantation12. Dieses Gerät wird häufig in Verbindung mit anderen Therapien wie Diuretika, inotropen Mitteln, Vasopressoren und pulmonalen Vasodilatatoren verwendet, um eine individuelle optimale hämodynamische Unterstützung zu bieten und gleichzeitig Zeit für den Umbau des nativen RV zu haben. Es wurde auch dokumentiert, dass das Gerät bei schwerem pHTN, wie im obigen Beispiel erwähnt, und akuter Myokarditis13 eingesetzt wurde. Nach unserer Erfahrung haben wir bei schwerem pHTN erfolgreich von der Unterstützung entwöhnt und aus dem Krankenhaus entlassen; Solche Fälle sind jedoch selten, und im Allgemeinen wird eine RVAD-Unterstützung bei schwerer Hypertonie bei erhöhtem Druck innerhalb der PAs vermieden und würde daher eine Dekompression der PAs mit VA-ECMO (ambulante Strategien, wenn eine längere Unterstützung erforderlich ist) oder RA zu linken Atrium-Bypass-Konfigurationen bevorzugen, wenn dies möglich ist.
Der Pulsatilitätsindex der Lungenarterie (PAPI) wird häufig bei der klinischen Gesamtbewertung verwendet, um Patienten zu identifizieren, die von einer minimalinvasiven Behandlung mit diesem Gerät profitieren könnten. Der PAPI ist eine validierte hämodynamische Metrik zur Beurteilung des Grades und des Vorhandenseins eines RV-Versagens. Er wird berechnet aus dem systolischen PA-Druck abzüglich des diastolischen Lungendrucks dividiert durch den zentralvenösen Druck (CVP). Patienten mit einem PAPI von weniger als 0,9 sollten für eine RV-Unterstützung in Betracht gezogen werden13. Die kardiale Leistungsabgabe (CPO) kann mit dem PAPI berechnet werden, um Patienten zu unterscheiden, die von einer RV-Unterstützungstherapie profitieren könnten. Sie wird berechnet, indem der mittlere arterielle Druck mit dem Herzzeitvolumen multipliziert und durch 451 dividiert wird. Wenn der CPO weniger als 0,6 beträgt, kann eine Behandlung des RV-Versagens gerechtfertigt sein. Ist der CPO größer als 0,6, besteht Interpretations- und Diskussionsspielraum für mögliche andere Therapien14. Die meisten Beweise empfehlen jedoch RV-Therapien, wenn der PAPI, wie oben erwähnt, weniger als 0,9 beträgt. Letztendlich basiert die Entscheidung für eine mechanische Unterstützung auf der klinischen Bewertung, wobei diese quantitativen Metriken als wertvolle Ergänzungen bei der Entscheidungsfindung dienen.
Zu den Kontraindikationen für die Verwendung dieses mechanischen Kreislaufunterstützungsgeräts (MCS) gehören schwere vaskuläre oder rechtsherzobstruktive Pathologien, einschließlich bestehender interner Jugularvenenstenose oder -thrombose, schwerer Lungenstenose und früherer Trikuspidalklappenersatz, der eine sichere Platzierung des Geräts ausschließt11. Ein Fall von akutem Syndrom der oberen Hohlvene (SVC) nach der Platzierung eines geeigneten IJ Protek Duo erforderte eine emergente Rekonfiguration auf eine alternative Unterstützungsstrategie. In Ermangelung einer schweren Stenose der Trikuspidalklappe ist die Reparatur der Trikuspidalklappe keine Kontraindikation für die Verwendung des Geräts. Der Ersatz der Pulmonalklappe (PVR) ist keine Kontraindikation, und in der Literatur gibt es mehrere Berichte über die Verwendung dieses Geräts innerhalb eines PVR15. Eine relative Kontraindikation für die Verwendung des pRVAD ist eine Pneumonektomie in der Vorgeschichte aufgrund einer Ligatur einer der proximalen Ast-PAs mit diesem Verfahren und die Besorgnis über eine Draht- oder Kanülenverletzung des PA-Stumpfes oder einen übermäßigen Druck auf den Stumpf durch den RVAD-Fluss. Darüber hinaus kann es in Fällen mit umfangreicher Thoraxbestrahlung sein, dass das Gewebe eine Dilatation und Platzierung der Kanüle nicht zulässt, was eine pRVAD-Platzierung ausschließt.
Mit der Verwendung dieses MCS-Geräts sind mehrere Komplikationen verbunden. Ein potenzielles Risiko bei der Behandlung eines RV-Schocks mit dem Gerät ist die Demaskierung einer LV-Dysfunktion oder einer bisher unerkannten biventrikulären Dysfunktion. Zum Beispiel erscheint das LV manchmal bei einem RV-Ausfall pseudonormal, da es zu einer erheblichen Unterfüllung des LV kommt. Mit einem RVAD wird jedoch die Vorwärtsströmung optimiert, und eine erhöhte Füllung des LV kann eine LV-Dysfunktion aufdecken. In vielen Fällen müssen diese Patienten auf VA-ECMO umgestellt werden. Darüber hinaus setzt die prothrombogene Natur der Kanüle den Patienten einem Risiko für thromboembolische Ereignisse aus. Um dieses Problem zu bekämpfen, ist es Standardtherapie, dass alle Patienten gleichzeitig mit Antikoagulation behandelt werden. Die zusätzliche Antikoagulationstherapie birgt jedoch ein eigenes Risiko für Blutungskomplikationen wie Blutungen an der Zugangsstelle, Blutungen im Magen-Darm-Trakt, hämorrhagische Schlaganfälle und das Risiko einer Heparin-induzierten Thrombozytopenie (HITT)16. Unterbrechungen der Antikoagulation aufgrund von Blutungskomplikationen können eine Pumpenthrombose verursachen. In dieser Einstellung muss das Gerät dringend ausgetauscht werden. Die Diagnose muss unter anderem für eine akute hämodynamische Verschlechterung und einen geringen Gerätefluss, einschließlich Sepsis oder Hypovolämie/Blutung, schnell geklärt werden.
Trotz all seiner möglichen Komplikationen wird diese pRVAD in vielen Krankenhäusern in den Vereinigten Staaten immer häufiger für die nicht-invasive Behandlung von RV-Versagen eingesetzt. Sein tragbares Design ermöglicht es den Patienten, frei zu sitzen, zu stehen und sogar zu gehen, wenn sie richtig positioniert und gesichert sind. Es kann sogar nach der Entwöhnung des Geräts einfach am Krankenbett entfernt werden. Das Gerät ist von der FDA für die Verwendung bis zu 6 Tagen zugelassen, aber es gibt Berichte über die Verwendung von Wochen bis Monaten17. Die Vorrichtung kann zur VV-ECMO-Unterstützung verwendet werden, indem der Schaltung an jeder beliebigen Stelle während der Verwendung der Vorrichtung18 ein Oxygenator hinzugefügt wird. Das 31 Fr-Gerät verfügt auch über eine RD-Version (Rapid Deployment), die in Abbildung 3 zu sehen ist. Die RD wurde in der Literatur hauptsächlich als temporäre linksventrikuläre Unterstützungsvorrichtung bezeichnet, die als Brücke zu anderen Unterstützungsvorrichtungen verwendet wird, wobei die Platzierung über einen apikalen Zugang erfolgt, um eine minimalinvasive LV-Unterstützung zu gewährleisten19.
Im Gegensatz zum Protek Duo handelt es sich bei dem Impella RP um ein perkutanes Gerät zur Unterstützung des Wohnmobils, das in die Oberschenkelvene eingeführt wird, eine strenge Bettruhe erfordert und kein Gehen zulässt. Es bietet auch eine axiale Strömung im Vergleich zum Protek Duo, der eine Zentrifugalströmung bietet. Zentrifugalflussmessgeräte weisen bei vergleichbaren Schlaganfallraten niedrigere gastrointestinale Blutungsereignisseauf 17. Zu den häufig berichteten Komplikationen der Impella RP gehören Blutungen (42,9 %), Gefäßprobleme (22,8 %), Gerätefragmentierung (34,2 %), Gerinnung des Systems (17,1 %) und Gerätetrennung (8,6 %)20. Mehrere andere RV-Unterstützungsgeräte2 werden derzeit untersucht. Sie könnten in Zukunft auf den Markt kommen, aber im Moment bleibt dieses Doppelkanülengerät eine attraktive Wahl als nicht-invasives perkutanes Gerät für die kurzfristige Behandlung von RV-Versagen.
Protokoll
Das vorliegende Protokoll wurde von der Ethikkommission für die Humanforschung des University of Nebraska Medical Center genehmigt. Das Protokoll folgt den Richtlinien der Ethikkommission für die Humanforschung derselben Universität.
1. Einsetzen des Gerätes
HINWEIS: Dieses Verfahren muss idealerweise in einer Fluoroskopie-Suite durchgeführt werden, um eine genaue Platzierung des Geräts zu gewährleisten.
- Bereiten Sie den Patienten vor.
HINWEIS: Jeder Patient >18 Jahre, ob männlich oder weiblich, kommt für diese Therapie in Frage, wenn die Anatomie für einen angemessenen Zugang und eine angemessene Verabreichung des Geräts geeignet ist. Personen < 18 Jahren können ebenfalls für das Gerät in Betracht gezogen werden, wenn die Anatomie geeignet ist.- Identifizieren Sie die Zugriffswebsite, und machen Sie sie verfügbar.
HINWEIS: Es gibt vier Möglichkeiten, diese Kanüle einzuführen. Es kann über die rechte Vena IJ (bevorzugt), die linke IJ, die Vena subclavia oder die Vena subclavia rechts platziert werden. - Reinigen Sie die Zugangsstelle und die Umgebung mit einer Vorbereitungslösung auf Chlorhexidin- oder Jodbasis (siehe Materialtabelle) gründlich. Tragen Sie ein steriles Tuch auf, um ein steriles Feld auf standardmäßige Weise einzurichten.
- Identifizieren Sie die Zugriffswebsite, und machen Sie sie verfügbar.
- Selbststerilisierbar. Peeling, Kittel und Handschuh nach der sterilen Technik.
- Sterilisieren Sie das Ultraschallgerät. Platzieren Sie eine sterile Abdeckung der Ultraschallsonde über dem Ultraschallschallkopf (siehe Materialtabelle).
- Identifizieren Sie unter Ultraschallkontrolle den venösen Zugang.
HINWEIS: Schließen Sie Behinderungen des venösen Flusses innerhalb des Zielgefäßes aus, indem Sie das Gefäß mit der Ultraschallsonde auf und ab scannen. - Mit der modifizierten Seldinger-Technik21 verschaffst du dir Zugang zur Vene.
- Anästhesieren Sie, indem Sie bis zu 10 ml 1% Lidocain in das Unterhautgewebe an der Zugangsstelle injizieren.
- Kanülieren Sie die Vene unter Ultraschallkontrolle mit einer 5 Fr Mikropunktionsnadel.
- Führen Sie unter Fluoroskopie oder transösophagealer echokardiographischer (TEE) Anleitung einen Mikropunktdraht durch die Nadel ~8-10 cm in der Vene ein. Entfernen Sie die Nadel und lassen Sie den Draht an Ort und Stelle.
HINWEIS: Achten Sie darauf, dass Sie sich immer am Draht festhalten, um eine Embolisation zu vermeiden. - Vergrößern Sie die Einstichstelle mit einer 10-Klinge, indem Sie einen kleinen 0,5 cm langen Schnitt direkt über dem Draht senkrecht zum Draht machen.
HINWEIS: Patienten neigen dazu, direkt nach diesem Schritt zu bluten. Es ist gut, die Ausrüstung griffbereit zu haben, um übermäßige Blutungen zu vermeiden. Möglicherweise muss auch eine sterile 4 x 4-Gaze an der Inzisionsstelle aufgetragen werden, um das überschüssige Blut zu entfernen. - Legen Sie eine 5 Fr Hülle über den Draht. Entfernen Sie den Draht und lassen Sie den Mantel an Ort und Stelle.
- Führen Sie dann einen 0,035-Zoll-Draht durch die 5-Fr-Schleuse und verkleinern Sie ihn auf einen 9-Lumen-Zugangskatheter (MAC). Entfernen Sie nach dem Upsize auf 9 MAC das Kabel.
- Nach dem Einsetzen der Hülle wird ein Swan Ganz-Katheter in standardmäßiger Weise durch den 9 Fr MAC (siehe Materialtabelle) mittels Fluoroskopie oder TEE-Führung gleiten lassen.
- Führen Sie einen Katheter mit Ballonspitze (siehe Materialtabelle) ~10-20 mm durch die Hülle und blasen Sie dann den Ballon mit 1-2 cm³ Luft auf.
- Unter Fluoroskopie schieben Sie den aufgeblasenen Katheter mit Ballonspitze durch die Trikuspidalklappe und die Haupt-PA in die RA vor.
- Führen Sie einen steifen Draht mit einem Durchmesser von 0,035 Zoll (siehe Materialtabelle) durch den Katheter mit Ballonspitze in die rechte PA ein.
- Nachdem Sie den Ballonkatheter entleert haben, entfernen Sie den Schwan, während Sie den steifen Draht an Ort und Stelle lassen.
- Erweitern Sie die Zugangsstelle seriell mit sequenziell größeren Dilatatoren (Abbildung 3), indem Sie die Dilatatoren nacheinander über den steifen Draht von klein bis zu groß bis zu 26 Fr mit den Gerätedilatatoren platzieren. Bei Verwendung einer Kanüle 31 Fr auf 30 Fr erweitern.
- Halten Sie gleichzeitig den Draht auf Hauthöhe und halten Sie intermittierend Druck aufrecht, um Blutungen zu vermeiden, und navigieren Sie mit der anderen Hand durch die Dilatatoren.
HINWEIS: Dieser pRVAD wird nicht mit einem 30 Fr Dilatator geliefert. Hier wird ein Trachealdilatator mit 30 Fr (siehe Materialtabelle) ersetzt. Beachten Sie auch, dass jede nachfolgende Dilatation die Größe der Zugangsstelle erhöht und daher jeder Schritt nach oben in der Dilatation ein erhöhtes Blutungsrisiko verursachen kann.
- Halten Sie gleichzeitig den Draht auf Hauthöhe und halten Sie intermittierend Druck aufrecht, um Blutungen zu vermeiden, und navigieren Sie mit der anderen Hand durch die Dilatatoren.
- Verabreichen Sie intravenös (IV) unfraktionierte Heparinboli, um eine aktivierte Gerinnungszeit (ACT) von ~250 zu erreichen, abhängig vom Blutungsrisiko des Patienten.
HINWEIS: Bei Patienten mit einem höheren Blutungsrisiko (z. B. frische Sternotomie) muss das ACT-Ziel möglicherweise niedriger angepasst werden. Für das oben aufgeführte ACT-Ziel wird ein Hemochron-Gerät verwendet (siehe Materialtabelle). Um das empfohlene ACT-Ziel zu erreichen, verabreichen Sie 70-100 Einheiten/kg i.v. unfraktioniertes Heparin. Falls der therapeutische ACT-Spiegel mit dem initialen Bolus nicht erreicht wird, können zusätzliche Boli auf der Grundlage des erreichten ACT-Niveaus verabreicht werden, genaue Dosierungsempfehlungen sind jedoch in den Leitlinien nicht enthalten. - Sobald eine therapeutische ACT erreicht ist, setzen Sie das pRVAD-Gerät ein.
- Schieben Sie die Einführ- und Kanülenbaugruppe des Geräts über den Führungsdraht.
HINWEIS: Die Kanülengröße variiert von Patient zu Patient. Daher hängt die Größe der Kanülenanordnung von der gewählten Kanüle ab. - Bevor Sie das Gerät durch die Haut über den Draht schieben, schieben Sie den Draht retrograd durch das Gerät, bis beobachtet wird, dass der Draht aus der distalen Spitze herauskommt.
- Sobald der Draht beobachtet und gesichert ist, schieben Sie die Einführkanüle durch die Haut über den Draht.
- Schieben Sie das Gerät an der Trikuspidal- und Pulmonalklappe vorbei durch die Haupt-PA in die rechte PA.
HINWEIS: Die korrekte Positionierung wird durch Echokardiographie, Transduktion des intrakardialen Drucks auf den PA-Katheter und/oder Durchleuchtung bestätigt. Es wird empfohlen, das Gerät tief in der rechten PA einzusetzen und es dann wieder in die entsprechende Position direkt distal der Bifurkation zu ziehen, um zu vermeiden, dass die Kanüle zu flach eingesetzt wird und das Gerät nicht in das Wohnmobil eindringt, was katastrophal sein kann. Das Gerät kann auch in der linken PA eingesetzt werden, hat aber tendenziell eine glattere Kurve in der RPA.
- Schieben Sie die Einführ- und Kanülenbaugruppe des Geräts über den Führungsdraht.
- Entfernen Sie die Einführhilfe und den steifen Draht, wenn sich das Gerät an der gewünschten Stelle befindet (Abbildung 4).
- Während Sie die Position des Geräts unter Visualisierung mit Fluoroskopie beibehalten, entfernen Sie zuerst den Einführknopf und ziehen Sie dann vorsichtig an dem steifen Draht, bis der gesamte Draht entfernt ist.
- Klemmen Sie die Kanüle an den proximalen und distalen Anschlüssen fest (Abbildung 2).
- Überprüfen Sie die Positionierung der Kanüle mittels TEE und/oder Fluoroskopie.
HINWEIS: In der Regel wird das Gerät zunächst absichtlich mit der Spitze in der rechten PA platziert, und dann wird das Gerät mit herausgezogenem Draht und Einführhebel vorsichtig zurückgezogen, bis sich die Spitze gerade noch in der Nähe der PA-Bifurkation auf der TEE und der fluoroskopischen Bildgebung und mindestens 3-4 cm hinter der Pulmonalklappe befindet.
- Befestigen Sie die Gerätekanüle.
2. Anschließen, Aktivieren und Warten des Geräts
- Entlüften Sie die im Gerätesatz enthaltenen Standardschläuche und schließen Sie sie an.
- Stellen Sie sicher, dass der Kreislauf grundiert und entlüftet ist, bevor Sie die Schläuche anschließen.
- Verbinden Sie den mit einem roten Streifen markierten Abflussschlauch durch Flüssigkeits-zu-Flüssigkeit-Kontakt mit dem Kanülenanschluss für den Rückfluss des Blutes (von der Pumpe zum Patienten).
- Verbinden Sie den mit einem blauen Streifen gekennzeichneten Pumpenzuflussschlauch mit einem Flüssigkeits-zu-Flüssigkeit-Kontakt mit dem Kanülenanschluss für die Blutdrainage (vom Patienten zur Pumpe).
- Lösen Sie die Klammern.
- Schalten Sie die Kreiselpumpe ab 5.500 Umdrehungen pro Minute (U/min) ein.
- Erhöhen Sie die Drehzahl der Pumpe schrittweise, bis der gewünschte Durchfluss erreicht ist.
- Überprüfen Sie die Positionierung der Pumpe erneut.
HINWEIS: Die Überprüfung der Positionierung der Kanülenspitze kann zu diesem Zeitpunkt aufgrund des Farbflusses an den Auslassöffnungen am TEE erleichtert werden. - Sichern Sie die Pumpe.
- Sichern Sie die Pumpe entweder mit der Voyager-Weste (siehe Materialtabelle) oder der Hülle (Abbildung 5), um die Stabilität des Geräts zu erhalten und den Patientenkomfort und das Gehen zu ermöglichen.
- Führen Sie die Wartung des Geräts durch.
- Überwachen Sie die Positionierung des Geräts mit täglichen Röntgenaufnahmen des Brustkorbs. Überwachen Sie die Hämodynamik des Patienten genau, während sich das Gerät befindet, um eine angemessene hämodynamische Unterstützung zu gewährleisten.
- Überwachen Sie die Laborwerte alle 6 Stunden, einschließlich eines vollständigen Blutbildes, eines umfassenden Stoffwechselpanels, von Elektrolyten, Milchsäure und einer zentral entnommenen gemischtvenösen Sättigung.
3. Entnahme des Gerätes
- Entwöhnen Sie das Gerät mit den folgenden Schritten.
- Verringern Sie die Geschwindigkeit des Geräts allmählich und überwachen Sie gleichzeitig die hämodynamische Reaktion und die Reaktion der Herzfunktion.
HINWEIS: In der Regel wird dies im Rahmen einer Echokardiogramm-Turndown-Studie durchgeführt, die sich auf die Herzfunktion mit geringeren Flüssen auf dem Gerät konzentriert. Milchsäure, gemischtvenöse Sättigung und Leber-/Nierenfunktion müssen häufig überwacht werden. Wenn zu irgendeinem Zeitpunkt eine Verschlechterung der RV-Funktion oder eine beobachtete Endorganfunktionsstörung durch abnormale Laborwerte beobachtet wird, hat der Patient die RV-Entwöhnung nicht bestanden und sollte die Unterstützung fortsetzen.
- Verringern Sie die Geschwindigkeit des Geräts allmählich und überwachen Sie gleichzeitig die hämodynamische Reaktion und die Reaktion der Herzfunktion.
- Wenn die RV-Funktion für die Entfernung des Geräts geeignet erscheint und der Patient gut mit Sauerstoff versorgt und beatmet wird, entwöhnen Sie die Geschwindigkeit und entfernen Sie die Kanüle.
- Bevor Sie die Kanüle entfernen, klemmen Sie die proximalen und distalen Ports fest, um ein Austreten von Blut zu verhindern.
- Entfernen Sie die Kanüle.
HINWEIS: Sobald die Kanüle an die Stelle zurückgezogen wird, an der die vorhofseitigen Anschlüsse freiliegen, bluten diese Stellen, und daher muss die Kanüle sanft, aber schnell gezogen werden. Eine resorbierbare Naht der Figur 2-0 wird zur Blutstillung an der Eintrittsstelle durch die Haut oder das Unterhautgewebe gelegt.
Ergebnisse
Das Gerät erhielt zunächst die FDA-Zulassung in den Vereinigten Staaten nach einer großen randomisierten Kontrollstudie, die eine 31-prozentige Verbesserung des Überlebens bei der Behandlung des akuten Atemnotsyndroms mit dem Gerät zeigte, das als VV_ECMOverwendet wurde 22. Schließlich wurde es als RA-zu-PA-Bypass zugelassen. Das Gerät ist jedoch noch nicht für den Einsatz als RVAD zugelassen, obwohl das Gerät in vielen großen Zentren bereits in vielen Fällen als RVAD-Ersatz eingesetzt wird. Derzeit gibt es laufende multizentrische Beobachtungsstudien, in denen dieses Gerät in der Schockumgebung weiter untersucht wird. Der Weg der perkutanen Unterstützung für CS ist lang und entwickelt sich ständig weiter. Die ursprüngliche SHOCK-Studie ebnete die Grenze für perkutane Unterstützungsgeräte bei Schock. In einer großen, randomisierten Kontrollstudie wurde die intraaortale Ballonpumpe (IABP) als perkutane Form der kardiopulmonalen Unterstützung untersucht23. Seit dem Debüt der SHOCK-Studie sind mehrere Geräte zur Behandlung von CS auf den Markt gekommen, darunter auch das beschriebene Gerät.
Es gibt jedoch wenig bis gar keine Anleitung zur Verwendung dieser Geräte bei Wohnmobilschocks. So wird beispielsweise in der jüngsten Expertenkonsenserklärung der Society of Cardiovascular Angiography and Interventions (SCAI) aus dem Jahr 2019 der RV-Schock nur kurz erwähnt. Er besagt, dass es sich um eine einzigartige Form von CS mit hoher assoziierter Mortalität handelt, und schlägt vor, hämodynamische PA-Katheter zu evaluieren und zu überwachen, um das Management weiter zu leiten24.
Trotz des Mangels an Expertenkonsens nimmt die Prävalenz schwerer Wohnmobilausfälle zu. Obwohl eine Person mit dieser Diagnose eine mögliche Zunahme unserer Fähigkeit, RV-Versagen zu diagnostizieren, und/oder die Zunahme von LV-Unterstützungsimplantaten und Herztransplantationen, die beide für RV-Versagen prädisponieren, verwirrt ist, hat eine Person mit dieser Diagnose eine assoziierte Sterblichkeitsrate von ~50% in 1 Jahr25. Die meisten Patienten, die auf diese Art von MCS untersucht werden, befinden sich weit im SCAI-Stadium D/E CS, das sich verschlechtert bzw. Extremis-Patienten aufweist.
Es hat sich gezeigt, dass das beschriebene Gerät, ein temporäres minimal-invasives pRVAD, die 1-Jahres-Mortalitätsrate in dieser Patientenpopulation drastisch auf 15%-19%13,14 senkt. Es wird angenommen, dass das Gerät dies durch eine Verbesserung mehrerer hämodynamischer Parameter wie des mittleren arteriellen Drucks, des CVP, des RA-Drucks, der RV-Schlaganfallarbeit, der gemischtvenösen Sättigung und des Gesamtherzzeitvolumens erreicht und eine Verringerung des Gesamtdruckbedarfs ermöglicht; Dies lässt Zeit für den Umbau von Wohnmobilen, der in einer einzigen zentrierten Studie gezeigt wurde26. Obwohl das RV fragil ist, neigt es auch dazu, recht widerstandsfähig zu sein und sich mit der entsprechenden Behandlung zu erholen, wie die CTEPH-Population nach Thromboendarteriektomie27 zeigt.
Die dokumentierten Komplikationsraten mit diesem Gerät variieren in der Literatur. Infektionsraten, Blutungen und embolische Ereignisse können in bis zu 40 % der Fälle oder nur in 10 % der Fälle beobachtetwerden 28. Tiefe Venenthrombosen und Lungenembolien nach der Anwendung sind ebenfalls häufig. Es gibt jedoch keine aktuellen Empfehlungen für die Blutgerinnselüberwachung nach der Verwendung oder Empfehlungen zur Prophylaxe. Eine verbleibende mittelschwere bis schwere TR kann in ~36 % der Fälle beobachtet werden, eine gerätebedingte Hämolyse in ~14 % der Fälle und eine Kanülenmigration in ~7 % der Fälle. Studien haben gezeigt, dass eine erfolgreiche Entwöhnung des Geräts bei 85 % bis 90 % der Patienten erreicht werden kann29. In ~11% der Fälle kann eine Umstellung auf chirurgische RVAD erforderlich sein3. Etwa ~10% der Patienten sterben an Unterstützung29. Es gibt eine Gesamtmortalitätsrate von 15 % im Krankenhaus und eine erstaunliche Überlebensrate von 81 % nach einem Jahr (Tabelle 1)11,26,30,31.

Abbildung 1: Beschriftete Gerätekanüle. RVAD-Kanüle mit Einführrohr und beschrifteten Teilen. Diese Abbildung wird mit Genehmigung von Referenz32 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Gerätekanülen. Die Kanülen 29 Fr, 31 Fr und RD RVAD. Diese Abbildung wird mit Genehmigung von Referenz32 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Dilatatoren der Bauelemente. Sie werden zur seriellen Dilatation der Zugangsstelle verwendet. Diese Abbildung wird mit Genehmigung von Referenz32 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
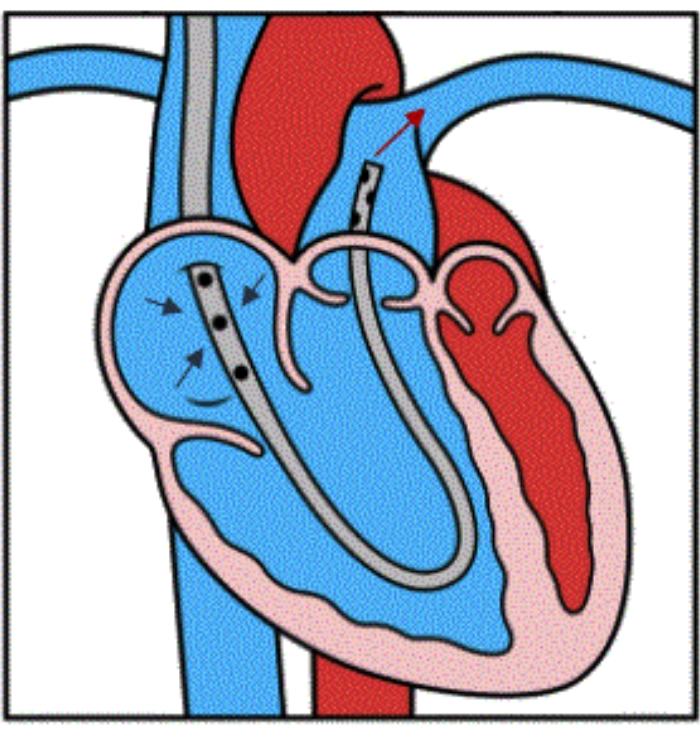
Abbildung 4: Abbildung des Geräteflusses. Die Abbildung zeigt die korrekte Platzierung des Geräts in der distalen Haupt-PA. Die drei blauen Pfeile zeigen den venösen Abfluss von der RA in die seitlichen Kanülenlöcher an. Der rote Pfeil zeigt die Reinfusion von Blut in die Haupt-PA unter Umgehung des RV. Diese Abbildung wird mit Genehmigung von Referenz32 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
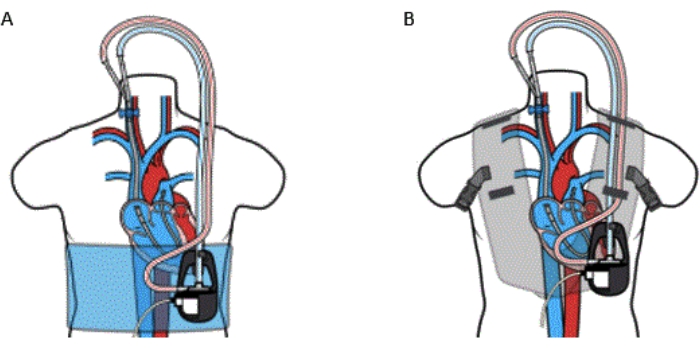
Abbildung 5: Perkutane Kanüle RA auf PA Bypass mit (A) Wrap und (B) Weste. Das VoyagerVest-Kit sollte nicht bei Patienten mit einer bekannten Allergie gegen Neopren verwendet werden. Diese Abbildung wird mit Genehmigung von Referenz32 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| A. Komplikationen | |
| Infektionsraten, Blutungen und embolische Ereignisse | 10%-40% |
| Restmäßige bis schwere TR | ~36% |
| Gerätebezogene Hämolyse | ~14% |
| Migration der Kanüle | ~7% |
| B. Gerätebezogenes Ergebnis | |
| Erfolgreiche Entwöhnung des Geräts | ~85%-90% |
| Umrüstung auf chirurgische RVAD | ~11% |
| Patienten starben an der Unterstützung | ~10% |
| Mortalität im Krankenhaus | 15% |
| Überlebensrate in einem Jahr | ~81% |
Tabelle 1: A. Komplikationen von Protek Duo MCS; B. Gerätebezogene Ergebnisse
Diskussion
Ein Schock im Wohnmobil deutet auf eine außergewöhnlich hohe Sterblichkeit hin. Sie sollte frühzeitig im Krankheitsverlauf erkannt und aggressiv behandelt werden. Das Protek Duo ist ein hochmodernes MCS für die Behandlung von Wohnmobil-Schocks, das in jeder der SCAI-Stoßphasen platziert werden kann. Zu den kritischen Schritten bei der Platzierung der Vorrichtung gehören: Verschaffen des Zugangs unter Verwendung der modifizierten Seldinger-Technik21, sequentielle Dilatation der Zugangsstelle auf eine Fr-Schleuse geeigneter Größe, Schieben eines Katheters mit Ballonspitze in die Haupt-PA, Einführen eines steifen Führungsdrahts durch den Katheter mit Ballonspitze in die Haupt-PA, Entfernen des Katheters mit Ballonspitze, Verabreichen von IV-Heparin, und schließlich das Gerät über den steifen Draht zu schieben, nachdem ein therapeutisches ACT-Niveau erreicht wurde. Sobald das Gerät durch Durchleuchtung oder Echokardiographie mit oder ohne Druckwellenanalyse über den PA-Katheter in der korrekten Position bestätigt wurde, können der Draht und der Einführknopf entfernt und das Gerät an Ort und Stelle befestigt werden. In seltenen Notsituationen kann dieses Gerät neben der Verwendung von TEE zur Visualisierung und/oder unter Verwendung der PA-Druckwellenform platziert werden, um die korrekte Positionierung des Geräts zu bestätigen. Wenn sich der Zustand eines Patienten jedoch akut verschlechtert und eine Stützvorrichtung am Krankenbett benötigt wird, kann es sinnvoller sein, auf venös-arterielle ECMO oder eine andere Unterstützungsstrategie umzustellen. Andernfalls muss dieser Eingriff in einem Durchleuchtungsraum oder in einem Operationssaal durchgeführt werden.
Es gibt mehrere Variationen dieses Verfahrens, die in der Literatur dokumentiert sind. Das in diesem Artikel vorgestellte Protokoll stammt aus unserer Erfahrung mit einem einzigen Zentrum. Es ist wichtig, mehrere mögliche Änderungen an dem skizzierten Protokoll zu erkennen. Eine Änderung wäre die Wahl des Zugangsortes. Die empfohlene Zugangsstelle für dieses Verfahren ist die rechte IJ-Vene10. Dieser Zugang ermöglicht einen direkten Zugang zum rechten Herzen und hat sich als am wenigsten problematisch bei der Implantation erwiesen. Verfahrenstechniker können diese Vorrichtung jedoch durch die linke Vena subclavia, die linke IJ oder die Vena subclavia33 implantieren. Er ist in der Reihenfolge nach Präferenz aufgeführt, mit Ausnahme des Rechtsschlüsselbein-Ansatzes, der derzeit nicht als Option verwendet wird, sich aber an anderen Institutionen bewährt hat. Eine dieser alternativen Zugangsstellen kann bei Patienten mit Verschluss der Zugangsstelle bevorzugt werden. Bei Verdacht auf einen Verschluss der Zugangsstelle wird empfohlen, sowohl die linke IJ als auch die Zugangsstelle subclavia mit einem Dopplerultraschall zu visualisieren, um die Durchgängigkeit vor dem Einsatz des Geräts zu beurteilen. Es kann auch ein Venogramm durchgeführt werden, um den Zugang zu beurteilen.
Es gibt ein paar Vorbehalte bei der Verwendung von alternativem Zugang. Ein Problem, das bei der Anwendung des linken Subclavia-Zugangs aufgetreten ist, ist die nicht triviale Inzidenz von Subclavia-Thrombosen34. Da dies den zukünftigen Dialysezugang über die Vena subclavia erschweren könnte, wurde das Subclavia-System bei Patienten, bei denen eine Dialyse zu erwarten war, vorsichtig eingesetzt. In der Regel muss bei Verwendung des linken Subclavia-Zugangs eine Kanüle der Größe 31 Fr eine ausreichende Länge haben. Der linke IJ-Ansatz ist angesichts des sehr gewundenen Verlaufs in den rechten PA schwieriger zu verwenden. Vom linken Erzgang IJ gibt es eine scharfe 90°-Kurve, um in den Erzgang innominat einzudringen und dann in die obere Hohlvene (SVC) zu gelangen, die in die RA mündet. Diese anfänglich hinzugefügte Abzweigung mit diesem Zugang könnte es für den Verfahrenstechniker schwierig machen, die zweite Abbiegung hinunter in die RA und anschließend die dritte Abbiegung von der RA durch das Wohnmobil in die Haupt-PA zu machen.
Genauso wie es schwierig sein kann, die Kanülenspitze des Geräts innerhalb der HauptPA mit diesen separaten Zugangsstellen zu positionieren, kann der Verfahrenstechniker Schwierigkeiten haben, den Katheter mit Ballonspitze in die richtige Position zu bringen. Dies kann mehrere Floating-Versuche erfordern. Bemerkenswert ist, dass es zwei Hauptpunkte sind, die es schwierig machen, in Position zu schweben. Man ist vom Wohnmobil in die rechtePA. Wenn es Probleme gibt, versuchen Sie, den Katheter während der Systole vorzuschieben und den Druck des Ventrikels und den Blutfluss zu nutzen, um den Schwan in Position zu bringen. Die Herausforderung um den zweiten Platz geht vom SVC an die RA. Dies ist bei transplantierten Herzen üblich. Manchmal bildet sich ein Grat an der SVC-Nahtlinie und der PA-Nahtlinie, die den Durchgang des Ballonkatheters behindern kann. Tauschen Sie in diesem Fall Ihre Schleuse über den Draht gegen eine längere Schleuse aus, die an diesem Grat vorbei in die RA führt. Dadurch wird sichergestellt, dass der Katheter mit Ballonspitze Zugang zum rechten Herzen erhält. Darüber hinaus wurde bei der Platzierung eines Geräts zum Zeitpunkt der Transplantation dies oft durchgeführt, während der Brustkorb noch offen war, was die Integrität der Anastomosen-Nahtlinien beim Durchgang des Geräts sicherstellen und offene RVAD-Optionen erhalten kann, wenn das Gerät nicht erfolgreich eingesetzt werden kann.
Man muss einige Tipps zur Fehlerbehebung kennen, bevor man dieses Verfahren durchführt. Zum Beispiel kann manchmal die Steifheit der Kanüle dazu führen, dass sie bevorzugt die untere Hohlvene (IVC) hinuntergeht, anstatt der Krümmung des Drahtes in und über die Trikuspidalklappe zu folgen. Wenn dies nicht mit einem steifen Draht behoben wird, sollten Sie in Erwägung ziehen, die Kanüle eine Weile in vivo zu lassen. Auf diese Weise kann die Kanüle durch die Wärme im Körper weicher werden und dann allmählich formbarer werden, was eine einfache Manipulation des Geräts ermöglicht, um der Krümmung des Drahtes zu folgen. Auch Variationen in der Anatomie können sich für den Bediener als Herausforderung erweisen. Seien Sie vorsichtig mit einer kleineren SVC-Anatomie, da dies das Risiko für das SVC-Syndrom erhöht. Auch Blutungen während des Eingriffs können eine weitere Komplikation sein. Es ist jedoch weniger üblich, dass es sich um eine signifikante Komplikation handelt, da dieses Protokoll einen venösen Niederdruckzugang verwendet. Es ist mit einer gewissen Blutung zu rechnen; Große Mengen an Blutungen können jedoch in der Regel vermieden werden. Dies kann durch eine sorgfältige sequentielle Dilatation des Zugangsgefäßes erreicht werden. Wenden Sie eine Kompression auf die Haut proximal der Zugangsstelle an, um das Gefäß während der Entfernung jedes Dilatators zu tamponieren. Es muss eine alternative Option für den Support geben, wenn das Gerät nicht bereitgestellt werden kann. Am Ende des Eingriffs ist es auch wichtig, eine angemessene Positionierung des Geräts sicherzustellen, dass das Gerät sicher ist, und die äußeren Teile der Kanüle in der Nähe des Körpers mit einer Polsterung zu versehen, um Druckgeschwüre des Kopfes, der Kopfhaut, der Ohren und anderer Körperteile in der Nähe zu vermeiden. Das Gerät selbst ist thrombogen und erfordert während des Gebrauchs eine kontinuierliche Antikoagulation35. Jede Kontraindikation für die Antikoagulation wäre eine relative Kontraindikation für die Verwendung dieses Geräts. Thrombus nach Extraktion kann ebenfalls auftreten. Ein großer Thrombusabdruck wird von der Kanüle aus der RA in das RVO gefunden, und mit minimaler Erfahrung konnten wir dies mit Antikoagulation in den Griff bekommen.
Die Trikuspidalinsuffizienz (TR) ist eine mögliche Komplikation2 im Zusammenhang mit der Anwendung dieses pRVAD. Wenn die Kanüle durch die Trikuspidalklappe (TV) verläuft, verstopft sie die TV-Segel und hemmt die korrekte Segelkoaptation. In der Regel ist dies kein Problem, solange die Kanüle an Ort und Stelle ist. Wenn jedoch Restschäden am Fernsehgerät vorhanden sind, kann bei der Geräteextraktion eine hämodynamisch signifikante TR festgestellt werden. Eine weniger häufige, aber möglicherweise schwerwiegendere Komplikation ist die Entwicklung von gerätebedingter Thrombozytopenie und Hämolyse. Dies kann manchmal mit HITT16 verwechselt werden, das ebenfalls in dieser Patientenpopulation häufig vorkommt. Schließlich kann es zu einer Kanülenmigration kommen. Hier prolapsiert die Kanüle entweder in den RV oder schiebt sich in die rechte oder linke PA vor. Wenn die Kanüle jedoch die rechte oder linke PA begünstigt, ist dies in der Regel nicht nachteilig, abhängig von der erforderlichen Strömung und anderen anatomischen Überlegungen. Umgekehrt kann eine zu flache Kanüle die Gefahr eines Vorfalls unterhalb der Pulmonalklappe bergen, was hämodynamisch katastrophal sein kann. Daher muss die distale Spitze des Geräts mindestens 3-4 cm distal zur Pulmonalklappe sein (siehe unten). Die Kanüle muss während des Transports und der Bewegung des Patienten vorsichtig gesichert werden, um ein Verschieben der Kanülenposition zu vermeiden.
Wie bei jedem intravaskulären Objekt oder Implantat besteht bei dem Gerät die Gefahr einer Infektion, insbesondere bei längerem Gebrauch. Wenn eine Geräteinfektion bestätigt wird, kann dies einen Austausch oder eine Konvertierung in eine alternative Unterstützungsstrategie (z. B. VA-ECMO) erfordern. In schlimmen Situationen, in denen ein infiziertes Gerät eine Unterbrechung der Unterstützung nicht tolerierte und VA-ECMO keine praktikable Option war, wurde eine Doppelkanüle mit linkem Schlüsselbein platziert, bevor ein infiziertes rechtes IJ-Gerät entfernt wurde, und beide Geräte blieben kurz gleichzeitig im Herzen. Es gab also keine Unterbrechung des Supports.
Zusammenfassend lässt sich sagen, dass es sich bei dem beschriebenen Gerät derzeit um ein von der FDA zugelassenes Gerät zur Behandlung von RV-Ausfall handelt. Darüber hinaus besteht sein Hauptvorteil darin, dass es eine Tandem-Ambulanz, einen höheren Patientenkomfort und niedrigere Infektionsraten ermöglicht, da der Zugang zur Leiste vermieden werden kann. Es wird erwartet, dass zukünftige Studien und klinische Studien die Vorteile und Ergebnisse dieses Geräts in der klinischen Praxis weiter hervorheben werden.
Offenlegungen
Poonam Velagapudi legt die folgenden Beziehungen zur Industrie offen: Sprecherbüro - Abiomed, Opsens; Beirat - Abiomed, Sanofi; Verpflegung/Reisekosten - Abiomed, Boston Scientific, Medtronic, Chiesi, Phillps.
Danksagungen
Dieses Manuskript wäre ohne die außergewöhnliche Unterstützung meiner Mentoren, Dr. Poonam Velagapudi und Dr. Anthony Castleberry, sowie ohne die Unterstützung der gesamten kardiovaskulären und kardiothorakalen Abteilung des University of Nebraska Medical Center nicht möglich gewesen. Für die Herstellung dieses Papiers wurden keine Mittel verwendet.
Materialien
| Name | Company | Catalog Number | Comments |
| Amplatzer Super Stiff Wire 0.035' x 145 cm | Boston Scientific | M001465631 | If not in stock, may use any stiff 0.035" wire. |
| Avalon Tracheal Dilator | Avalon Laboratories Inc., Rancho Dominguez, CA | 12210 | This comes in a set. The 30 Fr dilator is the only part used. |
| Full 29 Protek Duo Kit | LivaNova/ Tandem Life | 5820-2916 | Cannula, pump, holster, wrap |
| Full 31 Protek Duo | LivaNova/Tandem Life | 5820-3118 | Cannula, pump, holster, wrap |
| Hemochron Signature Elite ACT Testing Device and Supplies | Werfen North America | DCJACT-A and DCJACT-N | |
| Lidocaine | Pharmaceutical | Pfizer | |
| LifeSPARC Centrifugal Pump | LivaNova/ Tandem Life | 5840-2417 | |
| Micropuncture needle | Cook Medical | G56202 | 5 Fr |
| Multi-Lumen Access Catheter | Arrow/Teleflex | AK-21242-CDC | 9 Fr |
| Preparation solution | Pharmaceutical | NA | Chlorohexidine-based or iodine-based |
| Protek Duo Cannula 29Fr | LivaNova/ Tandem Life | 5140-4629 | Components: One 29 Fr ProtekDuo Veno-Venous Wire Reinforced Cannula with radiopaque tip markers, One 13 Fr Introducer |
| Protek Duo Cannula 31Fr | LivaNova/Tandem Life | 5140-5131 | - 31 Fr x 51 cm Veno-Venous Dual Lumen Cannula with Introducer |
| Protek Duo Insertion Kit | LivaNova/ Tandem Life | 5100-0014 | Components: balloon tipped PA catheter, one 0.035 stiff guidewire |
| Protek Duo RD Cannula | LivaNova/Tandem Life | 5820-3631 | Cannula, introducer |
| Swan Ganz Catheter | Edwards Lifesciences | 774F75 or 777F8 | |
| Ultrasound | Standard vascular ultrasound. | GE | |
| Ultrasound probe cover over the ultrasound transducer | Standard probe cover to match vascular ultrasound transducer | GE | |
| Voyager Vest Kit | LivaNova/Tandem Life | Contact LivaNova | Includes vest and wrap. Should not be used on patients with a known allergy to neoprene. |
Referenzen
- Saxena, A., et al. Value of hemodynamic monitoring in patients with cardiogenic shock undergoing mechanical circulatory support. Circulation. 141 (14), 1184-1197 (2020).
- Arrigo, M., et al. Right ventricular failure: Pathophysiology, diagnosis and treatment. Cardiac Failure Review. 5 (3), 140-146 (2019).
- Jacob, M., et al. Right ventricular dysfunction post-heart transplantation. Right Ventricular Physiology, Adaptation and Failure in Congenital and Acquired Heart Disease. , 193-216 (2018).
- Haddad, F., et al. Right ventricular function in cardiovascular disease, part II. Circulation. 117 (13), 1717-1731 (2008).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Patel, N., et al. Percutaneous biventricular mechanical circulatory support with impella CP and Protek Duo Plus. Journal of Invasive Cardiology. 31 (2), 46 (2019).
- Banfi, C., et al. Veno-venous extracorporeal membrane oxygenation: cannulation techniques. Journal of Thoracic Disease. 8 (12), 3762-3773 (2016).
- Jayaraman, A. L., Cormina, D., Shah, P., Ramakrishma, H. Cannulation strategies in adult veno-arterial and veno-venous extracorporeal membrane oxygenation: Techniques, limitations, and special considerations. Annals of Cardiac Anaethesia. 20 (1), 11-18 (2017).
- Nicolias, C. D., et al. Use of Protek duo tandem heart for percutaneous right ventricular support in various clinical settings: A case series. Journal of the American College of Cardiology. 71 (11), 1314 (2018).
- Kang, G., Ha, R., Banerjee, D. Pulmonary artery pulsatility Index Predicts Right Ventricular Failure After Left Ventricular Assist Device Implantation. The Journal of Heart and Lung Transplantation. 35 (1), 67-73 (2016).
- Johnson, G. Protek Duo Veno-venous cannula. Food and Drug Administration. , (2017).
- Carrozzini, M., et al. Percutaneous RVAD with the Protek Duo for severe right ventricular primary graft dysfunction after heart transplant. The Journal of Heart and Lung Transplantation. 40 (7), 580-583 (2021).
- Salna, M., et al. Novel percutaneous dual-lumen cannula-based right ventricular assist device provides effective support for refractory right ventricular failure after left ventricular assist device implantation. Interactive Cardiovascular and Thoracic Surgery. 30 (4), 499-506 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit Cardiogenic Shock Initiative. Catheter Cardiovascular Intervention. 91 (3), 454-461 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2021).
- Memon, H. A., et al. Extracorporeal membrane oxygenation support through Protek Duo cannula: A case series. The American Journal of Respiratory and Critical Care Medicine. 201, 5115 (2020).
- Ravichandran, A. K., Baran, D. A., Stelling, K., Cowger, J. A., Salerno, C. T. Outcomes with the tandem Protek Duo dual lumen percutaneous right ventricular assist device. ASAIO Journal. 64 (4), 570-572 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2020).
- Belani, K., et al. Transapical Protek Duo rapid deployment cannula as temporary left ventricular assist device in a Jehovah's Witness. Journal of Cardiothoracic and Vascular Anesthesia. 35 (12), 3735-3742 (2020).
- Khalid, N., et al. Adverse events and modes of failure related to impella RP: Insights from the Manufacturer and User Facility Device Experience (MAUDE) database. Cardiovascular Revascularization Medicine. 20 (6), 503-506 (2019).
- Ramos, F., et al. Técnica modificada de Seldinger. Canalización de catéteres venosos centrales a través de catéteres venosos periféricos [Seldinger modified technique]. Revista de Enfermeria. 31 (12), 14-16 (2008).
- Peek, J., et al. Efficacy and economic assessment of conventional ventilator support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicenter randomized controlled trial. Lancet. 374 (9698), 1351-1363 (2009).
- Menon, V., et al. Cardiogenic shock: A summary of the randomized SHOCK trial. Congestive Heart Failure. 9 (1), 35-39 (2003).
- Baran, A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Santas, E., et al. Right ventricular dysfunction staging system for mortality risk stratification in heart failure with preserved ejection fraction. Journal of Clinical Medicine. 9 (3), 831 (2020).
- Kapur, N. K., et al. Effects of a percutaneous mechanical circulatory support device for medically refractory right ventricular failure. The Journal of Heart and Lung Transplant. 30 (12), 1360-1367 (2011).
- Murata, M., et al. Clinical significance of Guanylate Cyclase stimulator, riociguat, on right ventricular functional improvement in patients with pulmonary hypertension. Cardiology. 146 (1), 130-136 (2021).
- Aggarwal, V., et al. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheter Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Schmack, B., et al. Results of concomitant groin-free percutaneous temporary RVAD support using a centrifugal pump with a double-lumen jugular venous cannula in LVAD patients. Journal of Thoracic Disease. 11 (6), 913-920 (2019).
- Cheung, A. W., White, C. W., Davis, M. K., Freed, D. H. Short-term mechanical circulatory support for recovery from acute right ventricular failure: Clinical Outcomes. The Journal of Heart and Lung Transplantation. 33 (8), 794-799 (2014).
- Takayama, H., et al. A novel approach to percutaneous right-ventricular mechanical support. European Journal of Cardiothoracic Surgery. 41 (2), 423-426 (2011).
- D'Angelo, F., et al. Alternative insertion sites for permanent central venous access devices. European Journal of Surgical Oncology. 23 (6), 547-549 (1997).
- Hill, S., et al. Subclavian vein thrombosis: a continuing challenge. Surgery. 108 (1), 1-9 (1990).
- Silva, E., et al. Management of RVAD thrombosis in biventricular HVAD supported patients: Case series. ASAIO Journal. 65 (4), 36-41 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten