Method Article
経皮的デュアルルーメンカニューレ右心室補助装置の挿入、維持、および除去
要約
本プロトコルは、経皮的デュアルルーメン右心室補助装置の詳細な説明を提供し、装置の安全な埋め込み、管理、および取り外しに関する段階的な指示を示しています。その使用と、最も重要な単一センターエクスペリエンスの1つからの複雑さのトラブルシューティングに関するガイダンスも含まれています。
要約
右心室(RV)ショックは、古典的には中心静脈圧(CVP)の上昇を特徴とし、肺動脈(PA)は正常から低、肺毛細血管楔入圧(PCWP)は、治療せずに放置すると、世界中で罹患率と死亡率の重要な原因となっています。RVショックの治療のための治療法は、医学的管理から耐久性または経皮的機械的循環サポート(MCS)まで多岐にわたります。2014年に食品医薬品局(FDA)によって使用が承認された経皮的右心室補助装置(pRVAD)である独自のMCSデバイスは、体外機械的サポートを備えた単一のデュアルルーメンカテーテルを介してRVを一時的にオフロードすることで機能し、右心房(RA)からメインPAに血液をシャントすることができます。当初は静脈静脈体外式膜型人工肺(VV-ECMO)デバイスとして承認されていましたが、この作業ではRVの使用に焦点を当てます 外来VV-ECMO戦略が以前に説明されているように、この作業はRVサポートの使用に焦点を当てます。カテーテルは、最も一般的には右内頸静脈(IJ)からPAに挿入され、外部ポンプに接続されるため、最大5 L / minの流れが可能になります。このデバイスは、経皮的で低侵襲の挿入と取り外し、およびデバイスが所定の位置にある間に患者の歩行を可能にする能力により、RVショックの治療に魅力的な選択肢となる可能性があります。このプロトコルでは、機器、血行動態の影響、適応症、禁忌、合併症、文献で現在利用可能な研究、およびデバイスの埋め込み、管理、および抽出方法に関する段階的な指示、およびデバイスを使用した最大規模の単一センター体験の1つからの複雑さの使用とトラブルシューティングに関するガイダンスについて詳しく説明します。
概要
右心室(RV)の失敗による心原性ショック(CS)は、依然として管理が最も困難な心臓病の1つであり、高い死亡率と罹患率を予兆しています1。RV不全を引き起こす可能性のある3つの主要な病理学的状態があります:心筋収縮性の喪失、体積過負荷、および圧力過負荷2。心臓移植後、RV収縮性の喪失は、心筋虚血、梗塞、または心筋炎または一次移植片機能障害によって引き起こされる炎症に続発する可能性があります3。RVボリューム過負荷は、経腸または静脈内摂取4と比較して、右側弁閉鎖、シャント、または不適切なボリューム除去(例:腎不全)に続発する可能性があります4。RV圧過負荷は、肺高血圧症(pHTN)、肺狭窄症、急性肺塞栓症、またはRV不全の最も一般的な原因である非代償性左側心不全の悪化に起因する可能性があります5。経皮的治療の選択肢は、RV CSの治療の主力の1つとなっています。RVの失敗を治療するためには、内科的治療以外にも、静脈動脈体外式膜型人工肺(VA-ECMO)、開放型/中心型右室補助装置(RVAD)、Impella RP、TandemHeart RV補助装置、Protek Duo2など、複数の装置が提供されています。
Protek Duoは、デバイスが所定の位置にある間6、RVをオフロードするためにRV CSでますます使用されている、デュアルルーメンカニューレを備えた唯一の低侵襲経皮的RVAD(pRVAD)です。当初は静脈静脈体外式膜型人工肺(VV-ECMO)デバイスとして承認されていましたが、この作業では、外来型VV-ECMO戦略が以前に説明されているように、RVサポートでの使用に焦点を当てます7。RAから肺動脈(PA)に血液をシャントすることでRVの負荷を軽減し、酸素供給器の有無にかかわらず遠心流の体外連続フローポンプを取り付けるオプションを可能にし、最適なRVサポートを可能にします。このデバイスは、2014年に食品医薬品局(FDA)8によって使用が承認されました。これは、最大4.5-5 L / min 9,10の流量を提供できます。そのデュアルルーメンカテーテル設計は、RAの近位流入カニューレを介して血液を引っ張り、中央PAを介して血液を漏斗状に送り込み、基本的にRVをバイパスします。
カニューレには、ワイヤーで補強されたボディを備えた2つの異なるルーメンがあります。1つのカニューレ内で双方向の流れを実現する2つの同心円状のチャネルにより、体外サポート中の静脈ドレナージと血液の再注入を同時に行うことができます。デバイスの近位部分は分離され、配線されていないため、カニューレデバイスの移植および抽出中の血流を防ぐための外部クランプが可能です。デバイスを正確に位置決めするために、カニューレには遠位および近位のマーカーがマークされており、挿入深度を識別します。遠位マーカーは放射線不透過性であるため、X線画像でデバイスを視覚化して、右心房(RA)内のカテーテルの位置を決定できます。マーキングに加えて、カテーテルの遠位端と中央部に開窓または穴があります。遠位端の6つのサイドホールにより、血液がカテーテルからPAに流れ込むことができます。ミッドシャフトの穴により、脱酸素化された血液がRAからカテーテルに流れ込むことができます(図1)。この設計により、心肺バイパス (CPB) を必要とする一連の手順を通じて、術前、術中、術後にデバイスを使用できます。たとえば、このデバイスは、耐久性のある左心室補助装置(LVAD)の前に、分離して、または両心室の一時的なサポートの一部として使用されました。その後、手術中に CPB 用の静脈ドレナージカニューレに変換され (「Y」で 2 つの手足を回路の静脈ドレナージ肢に接続することにより)、術後に RVAD サポートのために RA/PA バイパスに戻されました。さらに、カニューレは、RAポートとPAポートの両方に静脈ドレナージを適用することにより、LV拡張を伴うVA-ECMOの設定で、左心室(LV)のアンロード/ベント用のPAベントとしても使用され、再びCPB手順の準備設定とその後のRVADサポートへの変換で使用されました。
現在、29 Frと31 Frの2つのサイズがあります(図2)。これらのカテーテルは、挿入のしやすさを最適化するように設計されているため、デバイスの遠位部分がすべての心臓構造を安全に通過できるようにテーパー設計になっています。具体的には、29 Frは16 Frに、31 Frは18 Frにテーパーします。FDAによると、両方のサイズは、引張強度、経路の完全性、ねじれ半径、および溶血速度で同じです。それらは、カニューレの直径の変化に伴って予想されるカニューレの剛性と圧力-流特性に関して異なります。それらの違いにもかかわらず、機能的能力は同等であると判断されています。より大きなFrサイズは、通常、最適な血行動態サポートを達成するためにより多くの血流を必要とする人に使用されます11。
pRVADを使用するための重要な指標は、耐火性のRV故障です。これには、LVAD留置後のRV障害状態、心切開後の状態、急性心筋梗塞後、または心臓移植後の状態が含まれます12。このデバイスは、利尿薬、強心薬、昇圧剤、肺血管拡張薬などの他の治療法と組み合わせて使用 されることが多く、ネイティブRVのリモデリングのための時間を確保しながら、個々の最適な血行動態サポートを提供します。このデバイスは、上記の例で述べたように、重度のpHTNおよび急性心筋炎13にも使用されたことが文書化されています。私たちの経験では、pRVADin重度のpHTNを使用して、サポートからの離脱と退院に成功しました。ただし、そのようなケースはまれであり、一般に、RVAD サポートは、PA 内の圧力が上昇する重度の高血圧の設定では避けられるため、VA-ECMO (長時間のサポートが必要な場合は歩行器戦略) または RA で PA を減圧することを好みます 可能な場合は左心房バイパス構成。
肺動脈拍動指数 (PAPI) は、このデバイスによる低侵襲管理の恩恵を受ける可能性のある患者を特定するために、全体的な臨床評価で一般的に使用されます。PAPIは、RVの失敗の程度と存在を評価するための検証済みの血行動態指標です。これは、収縮期 PA 圧から拡張期肺圧を差し引いたものを中心静脈圧 (CVP) で割った値を使用して計算されます。PAPIが0.9未満の患者は、RVサポート13の対象となるべきです。心出力 (CPO) は、RV サポート療法の恩恵を受ける可能性のある患者を区別するために、PAPI で計算できます。これは、平均動脈圧に心拍出量を掛け、それを451で割ることによって計算されます。CPOが0.6未満の場合、RV不全の治療が正当化される場合があります。CPOが0.6より大きい場合、可能な他の治療法14の解釈と議論の余地があります。しかし、ほとんどのエビデンスでは、上記のようにPAPIが0.9未満であればRV療法を推奨している。最終的に、機械的サポートの決定は、意思決定における貴重な補助としてこれらの定量的指標を使用した臨床評価に基づいています。
この機械的循環補助装置(MCS)の使用に対する禁忌には、既存の内頸静脈(IJ)静脈狭窄症または血栓症、重度の肺狭窄症、および以前の三尖弁置換術を含む、重度の血管または右心閉塞性の病状が含まれ、これは装置の安全な配置を妨げる11。適切な IJ Protek Duo を配置した後の急性上大静脈 (SVC) 症候群の症例では、別のサポート戦略への緊急再構成が必要でした。三尖弁の重度の狭窄がない場合、三尖弁の修復はデバイスの使用に対する禁忌ではありません。肺動脈弁置換術 (PVR) は禁忌ではなく、PVR15 内でこのデバイスを使用した文献にはいくつかの報告があります。pRVADの使用に対する相対的な禁忌は、この手順による近位枝PAの1つの結紮による肺切除術の病歴と、PAの切り株へのワイヤーまたはカニューレの損傷、またはRVADの流れによる切り株への過度の圧力の懸念です。さらに、広範囲にわたる胸部放射線の場合、組織はカニューレの拡張と配置を許可しない可能性があり、pRVAD の配置を妨げます。
このMCSデバイスの使用には、いくつかの合併症が伴います。このデバイスでRVショックを治療する際の潜在的なリスクの1つは、LV機能障害または以前に認識されていなかった両心室機能障害のマスキングを解除することです。たとえば、RV の失敗により、LV の充填が大幅に不足しているため、LV が擬似正常に見えることがあります。ただし、RVAD を配置すると、順方向の流れが最適化され、LV の充填が増えると LV の機能障害が明らかになる可能性があります。多くの場合、これらの患者はVA-ECMOに変換する必要があるかもしれません。さらに、カニューレの血栓形成促進性により、患者は血栓塞栓症のリスクにさらされます。この問題に対処するために、すべての患者が抗凝固療法と同時に治療されることが標準的な治療法です。しかし、抗凝固療法の追加には、アクセス部位出血、消化管出血、出血性脳卒中、ヘパリン誘発性血小板減少症(HITT)のリスクなどの出血合併症のリスクが伴います16。出血合併症による抗凝固療法の中断は、ポンプ血栓症を引き起こす可能性があります。この設定では、デバイスを緊急に交換する必要があります。敗血症や血液量減少・出血など、急性血行動態の悪化やデバイス流量の低下など、他の原因の中でも診断を迅速に解明する必要があります。
その可能性のあるすべての合併症にもかかわらず、この pRVAD は、RV 障害の非侵襲的管理のために、米国中の多くの病院でより一般的になりつつあります。そのポータブルなデザインにより、患者は適切に配置され固定されていれば、自由に座ったり立ったり、さらには歩き回ったりすることができます。また、離乳後もベッドサイドで簡単に取り外すことができます。このデバイスは、最大6日間の使用がFDAに承認されていますが、数週間から17か月も使用したという報告があります。このデバイスは、デバイス18を使用しながら任意の時点で回路に酸素発生器を追加することにより、VV-ECMOサポートに使用することができます。31 Fr デバイスには、 図 3 に示す高速展開 (RD) バージョンもあります。RDは、主に文献で参照されており、他の支持装置への橋渡しとして使用され、低侵襲LVサポートを提供するための頂端アプローチ を介して 配置されます19。
Protek Duoとは対照的に、Impella RPは大腿静脈に挿入され、厳密な安静が必要で、歩行を許可しないRVサポートに使用される経皮的デバイスです。また、遠心流を提供するProtek Duoと比較して軸流を提供します。遠心流装置は、GI関連の出血イベントが低く、脳卒中率は同等です17。Impella RPの合併症として一般的に報告されているのは、出血(42.9%)、血管の問題(22.8%)、デバイスの断片化(34.2%)、システムの凝固(17.1%)、デバイスの切断(8.6%)などです20。現在、他のいくつかのRVサポートデバイス2 が研究されています。将来的には市場に出回る可能性がありますが、今のところ、このデュアルカニューレデバイスは、RV障害の短期治療のための非侵襲的経皮的デバイスとして魅力的な選択肢であり続けています。
プロトコル
現在のプロトコルは、ネブラスカ大学医療センターのヒト研究倫理委員会によって承認されています。このプロトコルは、同じ大学のヒト研究倫理委員会のガイドラインに従っています。
1. デバイスの挿入
注:この手順は、デバイスの正確な配置を確保するために、透視検査室で理想的に実行する必要があります。
- 患者を準備します。
注: 18 歳の男性または女性の > 歳の患者は、解剖学的構造がデバイスの適切なアクセスと送達に適している場合、この治療の対象となります。解剖学的構造が適切であれば、18歳<個人もデバイスの対象となる場合があります。- アクセス サイトを特定して公開します。
注意: このカニューレデバイスの挿入には4つのオプションがあります。右IJ(推奨)、左IJ、左鎖骨下静脈、または右鎖骨下静脈 を介して 配置できます。 - クロロヘキシジンベースまたはヨウ素ベースの調製液( 材料の表を参照)を使用して、アクセスサイトとその周辺を徹底的に清掃します。滅菌ドレープを適用して、標準的な方法で滅菌フィールドを確立します。
- アクセス サイトを特定して公開します。
- 自己滅菌します。スクラブ、ガウン、手袋は滅菌技術に従います。
- 超音波装置を滅菌します。滅菌済み超音波プローブカバーを超音波トランスデューサーの上に置きます( 資料の表を参照)。
- 超音波ガイドを使用して、静脈アクセスを特定します。
注:超音波プローブで血管を上下にスキャンすることにより、ターゲット血管内の静脈流の障害を排除します。 - 修正されたセルディンガー技術21を使用して、静脈にアクセスします。
- アクセス部位の皮下組織に最大 10 mL の 1% リドカインを注入して麻酔をかけます。
- 超音波ガイドの下で、5 Fr マイクロパンク針を使用して静脈をカニューレ挿入します。
- 透視法または経食道心エコー法(TEE)のガイダンスの下で、静脈の針にマイクロパンチャーワイヤーを~8〜10cm挿入します。針を取り外し、ワイヤーを所定の位置に残します。
注意: 塞栓を防ぐために、常にワイヤーをつかむようにしてください。 - 10枚刃を使用して穿刺部位を拡大し、ワイヤーに垂直なワイヤーの真上に0.5cmの小さな切開を行います。
注:患者はこのステップの直後に出血する傾向があります。過剰な出血を防ぐために、機器をすぐに利用できるようにしておくとよいでしょう。また、余分な血液をきれいにするために、切開部位に4 x 4の滅菌ガーゼを適用する必要がある場合があります。 - ワイヤーの上に5Frシースを置きます。シースを所定の位置に残したままワイヤーを取り外します。
- 次に、0.035インチのワイヤーを5 Frシースに通し、9マルチルーメンアクセスカテーテル(MAC)にアップサイズします。9 MACにアップサイズしたら、ワイヤーを取り外します。
- シース留置後、透視法またはTEEガイダンスを使用して、9 Fr MAC( 材料の表を参照)を介してスワンガンツカテーテルを標準的な方法で浮かせます。
- バルーン先端のカテーテル( 材料の表を参照)をシースに10~20mm前進させ、次にバルーンを1〜2ccの空気で膨らませます。
- 透視下で、膨らんだバルーン先端のカテーテルを三尖弁とメインPAを介してRAに進めます。
- 直径0.035インチの硬いワイヤー( 材料の表を参照)をバルーン先端カテーテルを通して右側のPAに挿入します。
- バルーン先端のカテーテルを収縮させた後、硬いワイヤーを所定の位置に残したままスワンを取り外します。
- デバイスの拡張器を使用して、最小から最大26 Frまでの硬いワイヤーに拡張器を1つずつ配置することにより、順番に大きな拡張器(図3)を使用してアクセス部位を連続的に拡張します。31 Frカニューレを使用する場合は、30 Frまで拡張します。
- 同時にワイヤーを皮膚の高さで保持し、左手で出血を防ぐために断続的に圧力を維持し、もう一方の手で拡張器をナビゲートします。
注:このpRVADには30 Fr拡張器は付属していません。ここでは、30 Fr気管拡張器( 材料の表を参照)が代用されます。また、その後の拡張ごとにアクセスサイトのサイズが増加するため、拡張のステップアップごとに出血リスクが増加する可能性があることに注意してください。
- 同時にワイヤーを皮膚の高さで保持し、左手で出血を防ぐために断続的に圧力を維持し、もう一方の手で拡張器をナビゲートします。
- 静脈内(IV)未分画ヘパリンボーラスを投与して、患者の出血リスクに応じて~250の活性化凝固時間(ACT)を達成します。.
注:出血リスクが高い患者の場合、ACTの目標を低く調整する必要がある場合があります(例:.、新鮮な胸骨切開術)。上記のACT目標は、ヘモクロンデバイスを使用しています( 材料の表を参照)。推奨されるACT目標を達成するには、70〜100ユニット/ kgのIV未分画ヘパリンを投与します。.最初のボーラスで治療用ACTレベルが達成されない場合、達成されたACTレベルに基づいて追加のボーラスを投与することができますが、ガイドラインでは正確な投与推奨は提供されていません。. - 治療的ACTが達成されたら、pRVADデバイスを挿入します。
- デバイスのイントロデューサーとカニューレアセンブリをガイドワイヤー上で進めます。
注:カニューレのサイズは患者によって異なります。したがって、カニューレアセンブリのサイズは、選択したカニューレによって異なります。 - デバイスをワイヤーを介して皮膚に押し込む前に、ワイヤーが遠位端から出ているのが観察されるまで、ワイヤーをデバイスを通して逆行させます。
- ワイヤーを観察して固定したら、イントロデューサーカニューレをワイヤー上の皮膚に通します。
- デバイスを三尖弁と肺動脈弁を過ぎてメインPAを通って右側のPAに進めます。
注: 正しい位置決めは、心エコー検査、PA カテーテルへの心臓内圧の伝達、および/または透視法によって確認されます。カニューレを浅すぎる展開を避け、デバイスがRVに脱出するのを防ぐために、デバイスを右PAの奥深くに展開し、分岐部のすぐ遠位に引き戻すことをお勧めします。このデバイスは左側のPAに展開することもできますが、RPAでは曲線が滑らかになる傾向があります。
- デバイスのイントロデューサーとカニューレアセンブリをガイドワイヤー上で進めます。
- デバイスが目的の場所にあるときは、イントロデューサーと硬いワイヤーを取り外します(図4)。
- 透視法で可視化した状態で装置の位置を保ちながら、まずイントロデューサーを取り外し、硬いワイヤー全体を引っ張ってワイヤー全体が剥がします。
- clamp カニューレを近位ポートと遠位ポートに取り付けます(図2)。
- TEEおよび/または透視法 による カニューレの位置を再評価します。
注:通常、デバイスは最初に先端を右PAに意図的に配置し、次にワイヤーとイントロデューサーを外側にして、先端がTEEおよび透視イメージングのPA分岐部にちょうど近位になり、肺動脈弁を少なくとも3〜4cm過ぎるまでデバイスを静かに引っ込めます。
- デバイスのカニューレを所定の位置に固定します。
2.デバイスの接続、アクティベーション、およびメンテナンス
- デバイスキットに付属の標準チューブを空気抜きして接続します。
- チューブを接続する前に、回路がプライミングされ、空気が抜かれていることを確認してください。
- 赤いストライプでマークされたアウトフローチューブを、流体間接触を使用してカニューレポートに接続し、血液ドレナージ(ポンプから患者まで)を戻します。
- 青いストライプでマークされたポンプインフローチューブを、血液ドレナージ(患者からポンプまで)のカニューレポートに流体間接触を使用して接続します。
- クランプを外します。
- 毎分5,500回転(RPM)で遠心ポンプをオンにします。
- 必要な流量レベルに達するまで、ポンプのRPMを徐々に増やします。
- ポンプの位置を再確認してください。
注意: カニューレ先端の位置を確認することは、TEEの出口ポートの色の流れを考えると、この段階で容易になる場合があります。 - ポンプを固定します。
- ボイジャーベスト( 資料の表を参照)またはラップ(図5)を使用してポンプを固定し、デバイスの安定性を維持し、患者の快適さと歩行を可能にします。
- デバイスのメンテナンスを実行します。
- 毎日の胸部X線写真でデバイスの位置を監視します。デバイスが装着されている間、患者の血行動態を注意深く監視して、適切な血行動態のサポートを確保します。
- 全血球計算、包括的な代謝パネル、電解質、乳酸、中央に描画された混合静脈飽和度など、6時間ごとにラボを監視します。
3. デバイスの取り外し
- 以下の手順に従ってデバイスを離乳します。
- 血行動態と心機能の反応を監視しながら、デバイスの速度を徐々に下げます。
注:通常、これは、デバイス上の流量が少ない心機能に焦点を当てた心エコー図ターンダウン研究を取得しながら実行されます。乳酸、混合静脈飽和、および肝臓/腎機能を頻繁に監視する必要があります。RV機能の悪化または異常な検査による末端器官機能障害の観察がいずれかの時点で観察された場合、患者はRV離脱に失敗したため、サポートを継続する必要があります。.
- 血行動態と心機能の反応を監視しながら、デバイスの速度を徐々に下げます。
- RV機能がデバイスの取り外しに適しているように見え、患者が酸素供給と換気が良好である場合は、速度を離してカニューレを取り外します。
- カニューレを取り外す前に、血液の漏れを防ぐために近位ポートと遠位ポートをクランプします。
- カニューレを取り外します。
注:カニューレを心房側のポートが露出している場所に引っ込めると、これらの部位は出血するため、カニューレをスムーズかつ迅速に引っ張る必要があります。2-0の8の字吸収性縫合糸を皮膚または皮下組織を通して配置し、入口で止血します。
結果
このデバイスは、大規模なランダム化比較試験の後、最初に米国でFDAの認可を取得し、VV_ECMO22として使用されたデバイスによる急性呼吸窮迫症候群の治療における生存率が31%改善したことが明らかになりました。最終的に、RAからPAへのバイパスとして承認されました。ただし、このデバイスはまだRVADとしての使用が承認されていませんが、多くの主要なセンターでは、多くの場合、デバイスはすでにRVADの代替として使用されています。現在、ショック環境でこのデバイスをさらに評価する多施設観察研究が進行中です。CSの経皮的サポートの道のりは長く、常に進化してきました。最初のSHOCKトライアルは、ショック状態における経皮的支持装置のフロンティアを開いた。大規模な無作為化比較試験では、経皮的心肺サポートとして大動脈内バルーンポンプ(IABP)が評価されました23。SHOCK試験のデビュー以来、記載されているデバイスを含むいくつかのデバイスがCSの治療薬として市場に出回っています。
ただし、RVショックでこれらのデバイスを使用するためのガイダンスはほとんどまたはまったくありません。例えば、2019年に発表された最新のSociety of Cardiovascular Angiography and Interventions(SCAI)の専門家のコンセンサスステートメントでは、RVショックについて簡単に言及されているだけです。それは、関連する死亡率が高いCSのユニークな形態であると述べており、管理をさらに導くためにPA血行動態カテーテルの評価と監視を提案しています24。
専門家のコンセンサスガイダンスが不足しているにもかかわらず、重度のRV失敗は有病率で増加しています。RV 障害を診断する能力が高まる可能性や、RV 障害の素因となる LV 補助装置インプラントと心臓移植の増加には困惑していますが、この診断を受けた個人は、1 年間で ~50% の死亡率を示しています25.このタイプのMCSで評価されるほとんどの患者は、それぞれ悪化している患者と極限の患者であるSCAIステージD / E CSにかなり入っています。
記載されたデバイス、一時的な低侵襲pRVADは、この患者集団の1年間の死亡率を15%〜19%に劇的に低下させることが示されています13,14。このデバイスは、平均動脈圧、CVP、RA圧、RV脳卒中作業、混合静脈飽和度、全体的な心拍出量などの複数の血行動態パラメーターの改善を通じてこれを達成し、全体的な昇圧要件の減少を可能にすると考えられています。したがって、RVのリモデリングのための時間を確保することは、単一の中心的な研究で示されている26。RVは壊れやすいですが、血栓内膜切除術後のCTEPH集団で示されているように、非常に弾力性があり、適切な治療で回復できる傾向があります27。
このデバイスで文書化された合併症の発生率は、文献によって異なります。感染率、出血、および塞栓性イベントは、症例の最大40%または症例のわずか10%で見られます28。使用後の深部静脈血栓症や肺塞栓症も一般的です。ただし、使用後の血栓監視に関する推奨事項や予防に関する推奨事項は現在のところありません。中等度から重度のTRの残存は症例の~36%で見られ、デバイス関連の溶血は症例の~14%で、カニューレの移動は症例の~7%で見られます。研究によると、デバイスの離脱は患者の85%〜90%で成功裏に達成できることが示されています29。手術用RVADへの転換は、~11%のケースで必要になる場合があります3。患者の約~10%がサポートで死亡します29.院内全死因死亡率は15%で、1年で81%という驚くべき生存率があります(表1)11,26,30,31。

図1:ラベル付きデバイスカニューレ。 RVADカニューレ、イントロデューサーと部品にラベルが貼られています。この図は、参考文献32の許可を得て転載しています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:デバイスのカニューレ。 29 Fr、31 Fr、およびRD RVADカニューレ。この図は、参考文献32の許可を得て転載しています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:デバイス拡張器。 これらは、アクセスサイトのシリアルディレーションに使用されます。この図は、参考文献32の許可を得て転載しています。 この図の拡大版を表示するには、ここをクリックしてください。
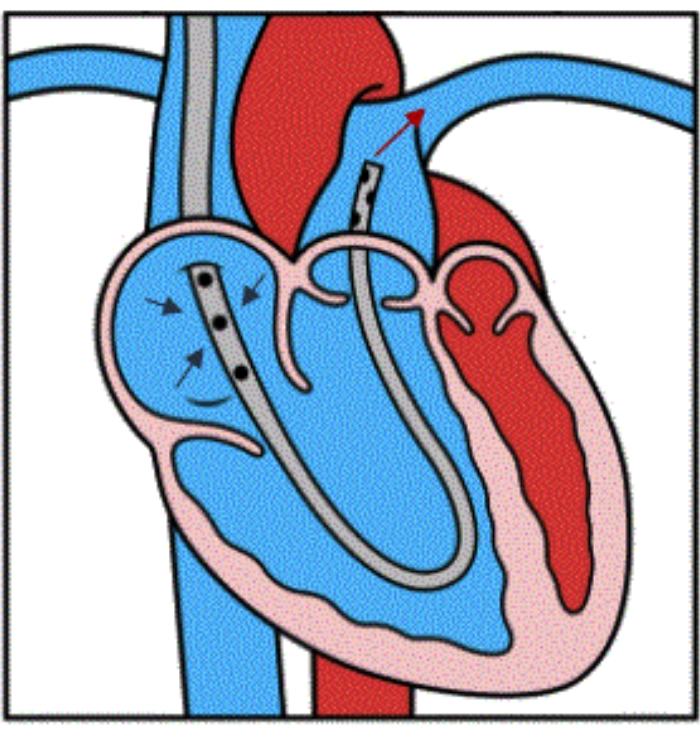
図 4: デバイス フローの図。 遠位メインPA内のデバイスの適切な配置を示す図。3つの青い矢印は、RAからカニューレ側の穴への静脈ドレナージを示しています。赤い矢印は、RVをバイパスしてメインPAに血液を再注入することを示しています。この図は、参考文献32の許可を得て転載しています。 この図の拡大版を表示するには、ここをクリックしてください。
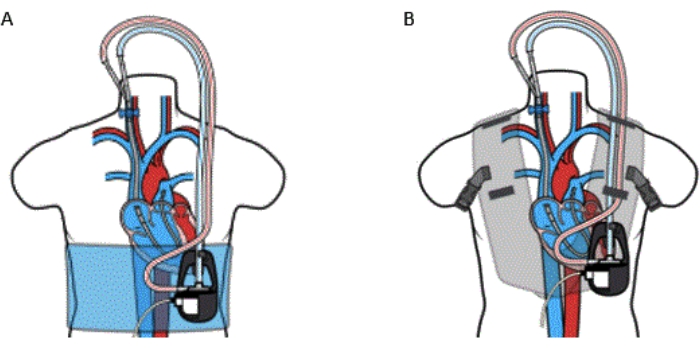
図5:経皮的デバイスカニューレRAからPAへのバイパス、(A)ラップと(B)ベスト付き。 VoyagerVestキットは、ネオプレンに対する既知のアレルギーを持つ患者には使用しないでください。.この図は、参考文献32の許可を得て転載しています。 この図の拡大版を表示するには、ここをクリックしてください。
| A. 合併症 | |
| 感染率、出血、塞栓性イベント。 | 10%-40% |
| 残存中等度から重度のTR | ~36パーセント |
| デバイス関連の溶血 | ~14% |
| カニューレの移行 | ~7% |
| B. デバイス関連の結果 | |
| デバイスの離乳が成功 | ~85%-90% |
| 外科用RVADへの変換 | ~11% |
| 患者は支援を受けて死亡しました | ~10% |
| 院内死亡率 | 15% |
| 1年後の生存率 | ~81% |
表1:A.Protek DuoMCSの合併症。B. デバイス関連の結果
ディスカッション
RVショックは、非常に高い死亡率の前兆です。これは、疾患の経過の早い段階で認識し、積極的に治療する必要があります。Protek Duoは、SCAIショックのどの段階でも配置できるRVショックの治療用の最先端のMCSです。装置の配置におけるいくつかの重要なステップには、修正されたセルディンガー技術21を使用してアクセスを取得すること、アクセス部位を適切なサイズのFrシースに逐次拡張すること、バルーン先端カテーテルをメインPAに浮かべること、バルーン先端カテーテルを通じてメインPAに硬いガイドワイヤーを導入すること、バルーン先端カテーテルを取り外すこと、IVヘパリンを投与すること、 そして最後に、治療的ACTレベルが達成された後、硬いワイヤー上でデバイスを前進させます。透視法または心エコー検査 によって デバイスが正しい位置に確認されたら、PAカテーテル による 圧力波分析の有無にかかわらず、ワイヤーとイントロデューサーを取り外して、デバイスを所定の位置に固定できます。まれな緊急事態では、このデバイスをTEEを使用して視覚化したり、PA圧力波形を利用してデバイスの正しい位置を確認したりするために、このデバイスを横に置いておくことができます。しかし、患者が急激に悪化し、ベッドサイドにサポートデバイスが必要な場合は、静脈動脈ECMOまたはその他のサポート戦略に変換する方が適切な場合があります。それ以外の場合、この手順は透視室または手術室内で実行する必要があります。
この手順には、文献に記載されているいくつかのバリエーションがあります。この記事で紹介するプロトコルは、単一センターでの経験から得られたものです。概説されたプロトコルに対するいくつかの可能な変更を認識することが重要です。1つの変更は、アクセスサイトの選択です。この手順の推奨アクセス部位は、右IJ静脈10です。このアクセスは、右の心臓への直接アクセスを提供し、移植するのが最も面倒でないことが証明されています。ただし、手続き医は、左鎖骨下静脈、左IJ静脈、または右鎖骨下静脈33を介してこのデバイスを埋め込むことができます。これは、現在オプションとして使用されていないが、他の機関で成功している右鎖骨下アプローチを除いて、好みの順にリストされています。これらの代替アクセス部位の1つは、アクセス部位閉塞を有する患者において好ましい場合がある。アクセス部位の閉塞が疑われる場合は、デバイス展開前にドップラー超音波を使用して左IJアクセス部位と鎖骨下アクセス部位の両方を視覚化し、開存性を評価することをお勧めします。アクセスを評価するために静脈造影も実施できます。
代替アクセスの使用には、いくつかの注意点があります。左鎖骨下アプローチを使用して遭遇する問題は、鎖骨下血栓症34の重大な発生率です。これにより、鎖骨下静脈を使用した将来の透析アクセスが妨げられる可能性があるため、透析が必要になると予想される患者には鎖骨下システムを慎重に使用しました。通常、左鎖骨下アプローチを使用する場合、31 Frサイズのカニューレには十分な長さが必要です。左IJアプローチは、右PAへの非常に曲がりくねったコースを考えると、より使いにくくなります。左のIJ静脈から、90°の急な回転があり、無名静脈に入り、上大静脈(SVC)に入り、RAにつながります。このアクセスで最初に追加されたターンは、手続き者がRAへの2回目のターンを行い、その後RAからRVを経由してメインPAへの3回目のターンを行うのを困難にする可能性があります。
これらの別々のアクセスサイトを使用して、デバイスのカニューレ先端をメインPA内に配置するのが難しいのと同様に、手続き医はバルーン先端のカテーテルを正しい位置に浮かべるのに問題に遭遇する可能性があります。これには、複数のフローティング試行が必要になる場合があります。特に、2つの主要なポイントが所定の位置に浮かぶのを困難にしています。1つはRVからrightPAへの道です。問題がある場合は、収縮期にカテーテルを前進させ、心室の押しと血液の流れを利用して、白鳥を所定の位置に浮かべてみてください。2位の挑戦はSVCからRAへの挑戦です。これは移植された心臓によく見られます。SVC縫合ラインとPA縫合ラインに隆起が発生し、バルーン先端カテーテルの通過が妨げられることがあります。これが発生した場合は、ワイヤー上のシースを、この尾根を過ぎてRAに入る長いシースと交換します。これにより、バルーン先端のカテーテルが右の心臓にアクセスできるようになります。さらに、移植時のデバイスの配置では、これは胸がまだ開いている間に行われることが多く、デバイスの通過に伴う吻合糸ラインの完全性を確保し、デバイスをうまく展開できない場合に開いているRVADオプションを維持できます。
この手順を実行する前に、いくつかのトラブルシューティングのヒントを知っておく必要があります。たとえば、カニューレの硬さにより、カニューレがワイヤーのカーブをたどって三尖弁に入るのではなく、下大静脈(IVC)を優先的に下る場合があります。これが硬いワイヤーで改善されない場合は、カニューレを しばらく生体内 に置いておくことを検討してください。これにより、カニューレは体内の暖かさから柔らかくなり、その後徐々に順応性が増し、ワイヤーの曲線に追従するデバイスの操作が容易になります。解剖学的構造のバリエーションも、オペレーターにとって難しいものになる可能性があります。SVCの解剖学的構造が小さいと、SVC症候群のリスクが高まるため、注意が必要です。処置中の出血も別の合併症になる可能性があります。ただし、このプロトコルは低圧静脈アクセスを使用しているため、重大な合併症になることはあまり一般的ではありません。多少の出血が予想されます。ただし、通常、大量の出血は避けることができます。これは、アクセス容器の慎重な逐次拡張によって達成できます。アクセス部位の近位にある皮膚に圧迫を加えて、各拡張器の取り外し中に血管をタンポナーデします。デバイスをデプロイできない場合のサポートには、別のオプションが必要です。手順の最後には、デバイスの適切な配置を確保し、デバイスが固定されていること、および頭、頭皮、耳、および近接する他の体の部分の褥瘡を避けるために、体の近くのカニューレの外部部分にパッドを適用することも不可欠です。装置自体は血栓形成性であり、使用中は継続的な抗凝固療法が必要である35。抗凝固療法に対する禁忌は、このデバイスを使用することに対する相対的な禁忌です。抽出後の血栓も発生する可能性があります。RAのカニューレからRVOTへの大きな血栓キャストに遭遇し、最小限の経験で、抗凝固療法でこれを管理することができました。
三尖弁逆流 (TR) は、この pRVAD の使用に関連する可能性のある合併症2 です。カニューレが三尖弁(TV)を通過すると、テレビの弁尖を塞ぎ、適切な弁尖の凝固を阻害します。通常、カニューレが所定の位置にある間は、これは問題になりません。ただし、テレビに損傷が残っている場合は、デバイスの抽出により血行力学的に有意なTRが明らかになる可能性があります。あまり一般的ではない合併症ですが、おそらくより深刻なのは、デバイス関連の血小板減少症と溶血の発症です。これは、この患者集団でも一般的なHITT16と混同されることがあります。最後に、カニューレの移行が発生する可能性があります。これは、カニューレがRVに脱出するか、右または左のPAに進む場所です。ただし、カニューレが右または左のPAに有利な場合、必要な流れやその他の解剖学的考慮事項によっては、通常は有害ではありません。逆に、カニューレが浅すぎると、肺動脈弁の下に脱出するリスクがあり、血行力学的に壊滅的な打撃となる可能性があります。したがって、デバイスの遠位先端は、肺動脈弁に対して少なくとも3〜4cm遠位にある必要があります(以下で詳しく説明します)。カニューレは、患者の輸送や移動中にカニューレの位置が外れないように注意して固定する必要があります。
他の血管内物体やインプラントと同様に、このデバイスは感染のリスクがあり、特に長期間の使用が危険です。デバイスの感染が確認された場合は、別のサポート戦略(VA-ECMOなど)への交換または変換が必要になる場合があります。感染したデバイスの悲惨な状況では、患者がサポートの中断を許容せず、VA-ECMOが実行可能な選択肢では、感染した右IJデバイスを取り外す前に左鎖骨下デュアルカニューレデバイスを配置し、両方のデバイスが同時に心臓に一時的に残りました。そのため、サポートが中断されることはありませんでした。
結論として、記載されているデバイスは現在、RVの失敗を治療するためのFDA承認のデバイスです。さらに、その主な利点は、鼠径部へのアクセスを避けることができるため、タンデム歩行、患者の快適性の向上、感染率の低下を可能にすることです。今後の研究や臨床試験では、このデバイスの臨床現場での利点と結果がさらに強調されることが期待されています。
開示事項
Poonam Velagapudiは、業界との次の関係を開示しています:スピーカーズビューロー-アビオメッド、オプセンズ;諮問委員会-アビオメッド、サノフィ。食事/旅費-アビオメッド、ボストンサイエンティフィック、メドトロニック、キエージ、フィルプス。
謝辞
この原稿は、私のメンターであるプーナム・ベラガプディ博士とアンソニー・キャッスルベリー博士の並外れたサポート、そしてネブラスカ大学医療センターの心臓血管および心臓胸部全体のサポートなしには不可能でした。この論文の作成には資金は使用されていません。
資料
| Name | Company | Catalog Number | Comments |
| Amplatzer Super Stiff Wire 0.035' x 145 cm | Boston Scientific | M001465631 | If not in stock, may use any stiff 0.035" wire. |
| Avalon Tracheal Dilator | Avalon Laboratories Inc., Rancho Dominguez, CA | 12210 | This comes in a set. The 30 Fr dilator is the only part used. |
| Full 29 Protek Duo Kit | LivaNova/ Tandem Life | 5820-2916 | Cannula, pump, holster, wrap |
| Full 31 Protek Duo | LivaNova/Tandem Life | 5820-3118 | Cannula, pump, holster, wrap |
| Hemochron Signature Elite ACT Testing Device and Supplies | Werfen North America | DCJACT-A and DCJACT-N | |
| Lidocaine | Pharmaceutical | Pfizer | |
| LifeSPARC Centrifugal Pump | LivaNova/ Tandem Life | 5840-2417 | |
| Micropuncture needle | Cook Medical | G56202 | 5 Fr |
| Multi-Lumen Access Catheter | Arrow/Teleflex | AK-21242-CDC | 9 Fr |
| Preparation solution | Pharmaceutical | NA | Chlorohexidine-based or iodine-based |
| Protek Duo Cannula 29Fr | LivaNova/ Tandem Life | 5140-4629 | Components: One 29 Fr ProtekDuo Veno-Venous Wire Reinforced Cannula with radiopaque tip markers, One 13 Fr Introducer |
| Protek Duo Cannula 31Fr | LivaNova/Tandem Life | 5140-5131 | - 31 Fr x 51 cm Veno-Venous Dual Lumen Cannula with Introducer |
| Protek Duo Insertion Kit | LivaNova/ Tandem Life | 5100-0014 | Components: balloon tipped PA catheter, one 0.035 stiff guidewire |
| Protek Duo RD Cannula | LivaNova/Tandem Life | 5820-3631 | Cannula, introducer |
| Swan Ganz Catheter | Edwards Lifesciences | 774F75 or 777F8 | |
| Ultrasound | Standard vascular ultrasound. | GE | |
| Ultrasound probe cover over the ultrasound transducer | Standard probe cover to match vascular ultrasound transducer | GE | |
| Voyager Vest Kit | LivaNova/Tandem Life | Contact LivaNova | Includes vest and wrap. Should not be used on patients with a known allergy to neoprene. |
参考文献
- Saxena, A., et al. Value of hemodynamic monitoring in patients with cardiogenic shock undergoing mechanical circulatory support. Circulation. 141 (14), 1184-1197 (2020).
- Arrigo, M., et al. Right ventricular failure: Pathophysiology, diagnosis and treatment. Cardiac Failure Review. 5 (3), 140-146 (2019).
- Jacob, M., et al. Right ventricular dysfunction post-heart transplantation. Right Ventricular Physiology, Adaptation and Failure in Congenital and Acquired Heart Disease. , 193-216 (2018).
- Haddad, F., et al. Right ventricular function in cardiovascular disease, part II. Circulation. 117 (13), 1717-1731 (2008).
- Kapur, N. K., et al. Mechanical circulatory support devices for acute right ventricular failure. Circulation. 136 (3), 314-326 (2017).
- Patel, N., et al. Percutaneous biventricular mechanical circulatory support with impella CP and Protek Duo Plus. Journal of Invasive Cardiology. 31 (2), 46 (2019).
- Banfi, C., et al. Veno-venous extracorporeal membrane oxygenation: cannulation techniques. Journal of Thoracic Disease. 8 (12), 3762-3773 (2016).
- Jayaraman, A. L., Cormina, D., Shah, P., Ramakrishma, H. Cannulation strategies in adult veno-arterial and veno-venous extracorporeal membrane oxygenation: Techniques, limitations, and special considerations. Annals of Cardiac Anaethesia. 20 (1), 11-18 (2017).
- Nicolias, C. D., et al. Use of Protek duo tandem heart for percutaneous right ventricular support in various clinical settings: A case series. Journal of the American College of Cardiology. 71 (11), 1314 (2018).
- Kang, G., Ha, R., Banerjee, D. Pulmonary artery pulsatility Index Predicts Right Ventricular Failure After Left Ventricular Assist Device Implantation. The Journal of Heart and Lung Transplantation. 35 (1), 67-73 (2016).
- Johnson, G. Protek Duo Veno-venous cannula. Food and Drug Administration. , (2017).
- Carrozzini, M., et al. Percutaneous RVAD with the Protek Duo for severe right ventricular primary graft dysfunction after heart transplant. The Journal of Heart and Lung Transplantation. 40 (7), 580-583 (2021).
- Salna, M., et al. Novel percutaneous dual-lumen cannula-based right ventricular assist device provides effective support for refractory right ventricular failure after left ventricular assist device implantation. Interactive Cardiovascular and Thoracic Surgery. 30 (4), 499-506 (2020).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit Cardiogenic Shock Initiative. Catheter Cardiovascular Intervention. 91 (3), 454-461 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2021).
- Memon, H. A., et al. Extracorporeal membrane oxygenation support through Protek Duo cannula: A case series. The American Journal of Respiratory and Critical Care Medicine. 201, 5115 (2020).
- Ravichandran, A. K., Baran, D. A., Stelling, K., Cowger, J. A., Salerno, C. T. Outcomes with the tandem Protek Duo dual lumen percutaneous right ventricular assist device. ASAIO Journal. 64 (4), 570-572 (2018).
- Vijayakumar, N., et al. Successful use of Protek Duo cannula to provide veno-venous extracorporeal membrane oxygenation and right ventricular support for acute respiratory distress syndrome in an adolescent with complex congenital heart disease. Perfusion. 36 (2), 200-203 (2020).
- Belani, K., et al. Transapical Protek Duo rapid deployment cannula as temporary left ventricular assist device in a Jehovah's Witness. Journal of Cardiothoracic and Vascular Anesthesia. 35 (12), 3735-3742 (2020).
- Khalid, N., et al. Adverse events and modes of failure related to impella RP: Insights from the Manufacturer and User Facility Device Experience (MAUDE) database. Cardiovascular Revascularization Medicine. 20 (6), 503-506 (2019).
- Ramos, F., et al. Técnica modificada de Seldinger. Canalización de catéteres venosos centrales a través de catéteres venosos periféricos [Seldinger modified technique]. Revista de Enfermeria. 31 (12), 14-16 (2008).
- Peek, J., et al. Efficacy and economic assessment of conventional ventilator support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicenter randomized controlled trial. Lancet. 374 (9698), 1351-1363 (2009).
- Menon, V., et al. Cardiogenic shock: A summary of the randomized SHOCK trial. Congestive Heart Failure. 9 (1), 35-39 (2003).
- Baran, A., et al. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheterization and Cardiovascular Interventions. 94 (1), 29-37 (2019).
- Santas, E., et al. Right ventricular dysfunction staging system for mortality risk stratification in heart failure with preserved ejection fraction. Journal of Clinical Medicine. 9 (3), 831 (2020).
- Kapur, N. K., et al. Effects of a percutaneous mechanical circulatory support device for medically refractory right ventricular failure. The Journal of Heart and Lung Transplant. 30 (12), 1360-1367 (2011).
- Murata, M., et al. Clinical significance of Guanylate Cyclase stimulator, riociguat, on right ventricular functional improvement in patients with pulmonary hypertension. Cardiology. 146 (1), 130-136 (2021).
- Aggarwal, V., et al. Current status of percutaneous right ventricular assist devices: First-in-man use of a novel dual lumen cannula. Catheter Cardiovascular Interventions. 88 (3), 390-396 (2016).
- Schmack, B., et al. Results of concomitant groin-free percutaneous temporary RVAD support using a centrifugal pump with a double-lumen jugular venous cannula in LVAD patients. Journal of Thoracic Disease. 11 (6), 913-920 (2019).
- Cheung, A. W., White, C. W., Davis, M. K., Freed, D. H. Short-term mechanical circulatory support for recovery from acute right ventricular failure: Clinical Outcomes. The Journal of Heart and Lung Transplantation. 33 (8), 794-799 (2014).
- Takayama, H., et al. A novel approach to percutaneous right-ventricular mechanical support. European Journal of Cardiothoracic Surgery. 41 (2), 423-426 (2011).
- D'Angelo, F., et al. Alternative insertion sites for permanent central venous access devices. European Journal of Surgical Oncology. 23 (6), 547-549 (1997).
- Hill, S., et al. Subclavian vein thrombosis: a continuing challenge. Surgery. 108 (1), 1-9 (1990).
- Silva, E., et al. Management of RVAD thrombosis in biventricular HVAD supported patients: Case series. ASAIO Journal. 65 (4), 36-41 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved