Method Article
Implantation transfémorale de la valve aortique assistée par lithotripsie intravasculaire
Dans cet article
Résumé
Il a été démontré que l’implantation transcathéter de la valve aortique (TAVI) génère les meilleurs résultats cliniques lorsqu’elle est réalisée par voie transfémorale percutanée. La lithotripsie intravasculaire (IVL) peut faciliter un processus transfémoral chez les patients atteints d’une maladie vasculaire ilio-fémorale calcifiée et de diamètres intraluminaux limites. Le présent protocole décrit l’AVTI transfémorale assistée par IVL.
Résumé
Au cours de la dernière décennie, l’implantation transcathéter de la valve aortique (TAVI) est devenue une thérapie bien établie pour les patients vieillissants souffrant de sténose symptomatique sévère de la valve aortique. Cela se reflète également dans les directives internationales récemment mises à jour sur la prise en charge des patients atteints de cardiopathie valvulaire. L’approche TAVI transfémorale (TF) s’est avérée supérieure aux stratégies d’accès alternatives. Avec l’introduction de la lithotripsie intravasculaire (IVL), les patients atteints de maladie vasculaire ilio-fémorale calcifiée et de diamètres intraluminaux limites sont également devenus des candidats pour le TF-TAVI percutané. De plus, l’IVL réduit le risque de complications vasculaires majeures en modifiant le calcium vasculaire superficiel et profond, modifiant ainsi la compliance des vaisseaux et contrôlant l’expansion luminale. De cette façon, il a été démontré que l’IVL facilite en toute sécurité l’administration de dispositifs TAVI par TF chez les patients atteints d’une maladie artérielle périphérique calcifiée. Le présent article vise à fournir une description détaillée, étape par étape, de la façon d’effectuer le TF-TAVI assisté par IVL en toute sécurité et efficacement. De plus, une revue de la littérature sur les résultats obtenus avec cette technologie est incluse, ainsi qu’une discussion concise sur cette approche TAVI unique.
Introduction
L’implantation transcathéter de la valve aortique (TAVI) s’est avérée être une thérapie précieuse pour les patients âgés souffrant de sténose valvulaire aortique sévère (SA) symptomatique dans toutes les catégories de risque chirurgical 1,2. Les données et les résultats sont plus convaincants pour les patients chez qui la procédure TAVI peut être réalisée par approche transfémorale (TF). L’ATVI par accès alternatif, tel que l’accès transsous-clavier, transaxillaire, transcarotidien, transcaval et transapical, peut également être envisagé. Cependant, les taux de complications signalés pour l’ATVI par l’accès alternatif sont plus élevés que pour l’ATVI-TF 3,4. Cela se reflète également dans les directives les plus récentes de l’UE et des États-Unis sur la prise en charge des patients atteints de cardiopathie valvulaire5, dans lesquelles le TF-TAVI joue un rôle de premier plan en tant qu’option de traitement pour les patients atteints de SA sévère symptomatique.
Bien qu’il existe un consensus sur le fait que la TF-TAVI devrait être la stratégie par défaut pour les patients ayant un accès ilio-fémoral approprié5, la maladie artérielle périphérique (MAP) n’est pas rare chez les patients dont la TAVI est prévue, compte tenu de leur âge avancé et de leurs comorbidités souvent multiples6. Il y a eu une évolution technologique rapide dans le domaine des TAVI au cours des dernières années, ce qui a permis d’obtenir des dispositifs TAVI avec des profils d’insertion plus bas et des systèmes d’administration plus flexibles. De plus, l’expérience accrue de l’opérateur a permis d’accroître l’utilisation d’une approche TF-TAVI entièrement percutanée. De nos jours, plus de 90 % des cas de TAVI sont réalisés de cette manière dans les centres de TAVI les plus avancés7.
Pourtant, un groupe de patients (5 % à 10 %) reste de bons candidats pour l’ATVI mais souffre d’AOMI sévèrement calcifiée. Pour beaucoup de ces patients, l’introduction de la lithotripsie intravasculaire périphérique (IVL) a ouvert la possibilité d’être traité par TF-TAVI. Lors de l’utilisation de l’IVL, on génère des ondes de pression soniques à l’aide de lithotripteurs miniaturisés, d’émetteurs intégrés dans un ballon. Une bulle de vapeur est créée à l’intérieur du ballon qui se dilate et s’effondre rapidement en délivrant de l’énergie électrique. Cela génère des ondes de pression soniques, similaires dans leur forme d’onde à celles utilisées lors de la lithotripsie extracorporelle de la néphrolithiase. Ces ondes se propagent à travers le vaisseau avec une pression de pointe positive d’environ 50 atm, fissurant et modifiant ainsi le calcium vasculaire superficiel et profond, modifiant finalement la compliance du vaisseau et permettant une expansion luminale contrôlée 8,9,10 (Figure 1). De cette façon, il a été démontré que l’IVL facilite l’administration de TF des dispositifs TAVI chez les patients atteints d’AOMI calcifiée de manière sûre 11,10,13. Ces ballons IVL sont disponibles en différents diamètres allant de 3,5 mm à 7 mm avec une longueur de 60 mm.
Le présent article vise à fournir une description détaillée de la réalisation d’un TF-TAVI assisté par IVL de manière sûre et efficace. De plus, une revue de la littérature sur les résultats obtenus avec cette technologie est incluse, ainsi qu’une discussion concise sur cette nouvelle approche TAVI.
Les patients (hommes/femmes) présentant une anatomie ilio-fémorale malade correspondant aux critères suivants pourraient convenir à une TF-TAVI assistée par IVL (Figure 2) : (1) Maladie vasculaire ilio-fémorale avec une longueur de lésion de <20 mm et un arc calcique de ±270°, ayant un diamètre de lumière minimal de >3,0 mm, (2) Maladie vasculaire ilio-fémorale avec une longueur de lésion de <20 mm et un calcium d’arc ±360°, ayant un diamètre minimal de lumière de >4,0 mm, (3) une maladie vasculaire ilio-fémorale avec une longueur de lésion de >20 mm et un arc calcique de ±270°, ayant un diamètre de lumière minimal de >3,5 mm, et (4) une maladie vasculaire ilio-fémorale avec une longueur de lésion de >20 mm et un calcium d’arc de ±360°, possédant un diamètre de lumière minimal de >4,5 mm. Ces recommandations sont fondées sur l’opinion d’experts et sur la pratique locale.
Protocole
Le protocole est approuvé par le comité d’éthique de la recherche humaine de l’hôpital universitaire de Copenhague, et les études sont menées conformément aux directives dudit comité d’éthique. Conformément aux politiques locales, tous les patients ont donné leur consentement éclairé pour la procédure TAVI, la tomodensitométrie cardiaque et les données anonymes pour la recherche.
1. Planification préopératoire
- Inspectez les vaisseaux aorta-ilio-fémoraux allant de la valve aortique, en passant par l’arc aortique, jusqu’à l’artère fémorale commune (AFC) et la bifurcation fémorale. Pour une évaluation précise, effectuez une angiographie par tomodensitométrie (TDM) dédiée14 et effectuez une reconstruction tridimensionnelle (3D) basée sur l’angiographie à l’aide d’un logiciel dédié15 (voir Tableau des matériaux).
- Évaluer visuellement le degré de tortuosité du vaisseau.
- Évaluer visuellement le degré et l’ampleur de la calcification des vaisseaux (arc, morphologie, etc.)16. Portez une attention particulière aux taches calcifiées d’une circonférence calcifiée de >270°.
- Mesurer le diamètre luminal minimal (DLM), le diamètre luminal maximal et le diamètre luminal moyen au site des calcifications et des sténoses les plus critiques16.
- Décider de la faisabilité d’une approche TF pour TAVI. Évaluer la nécessité et les avantages d’une approche de TF assistée par IVL. Tenez compte des recommandations de la figure 2.
- Déterminer la région d’intérêt pour un éventuel traitement IVL : bifurcation iliaque, artère iliaque commune et/ou artère iliaque externe.
- Déterminer le site d’accès/de ponction TAVI préféré en se référant à l’angiographie CT préprocédurale ; Il s’agit de la bifurcation fémorale et de la tête du fémur.
- Décidez du diamètre et de la longueur des endoprothèses (non) couvertes si cela est nécessaire dans des situations de sauvetage vasculaire.
2. Obtention d’un accès vasculaire
- Appliquez une anesthésie locale en injectant ~10-20 mL de solution de xylocaïne (10 mg/mL) dans la peau et le tissu sous-cutané au site de ponction préféré pour TAVI. Confirmez l’effet de l’anesthésie en testant la sensibilité de la peau à l’aide d’une aiguille.
- Effectuez une ponction échoguidée du CFA et insérez un fil-guide de 0,035" (voir tableau des matériaux).
REMARQUE : Évitez une ponction CFA trop près de la bifurcation fémorale, car cela pourrait compliquer et compromettre l’option de pose d’une endoprothèse de secours de l’AFC en cas de défaillance du dispositif de fermeture vasculaire. Vérifiez cela par fluoroscopie. - Faites une incision cutanée de 2-3 cm et insérez un dilatateur 7 F-8 F (voir tableau des matériaux) sur le fil.
- Gardez le fil-guide de 0,035" dans l’artère et retirez le dilatateur 7 F-8 F. Décidez de la stratégie de fermeture vasculaire (par exemple, fermeture basée sur les sutures, la fermeture par bouchon, etc.) et effectuez des manœuvres de pré-fermeture si nécessaire.
- Insérez la gaine 7 F-8 F (voir Tableau des matériaux) sur le fil.
- Administrer de l’héparine par voie intraveineuse selon le protocole local (p. ex., 100 UI/kg).
3. Utilisation et positionnement d’un fil de sécurité
- Lors d’une intervention percutanée sur un site traité IVL, placez un fil de sécurité sur le site d’accès principal et un fil dans l’aorte abdominale. Conservez strictement ce fil même après la rétraction du système TAVI et de la gaine d’insertion de grand alésage.
REMARQUE : Si le site d’accès TAVI principal n’est pas malade, il n’est pas absolument nécessaire de positionner un fil de sécurité sur le site de ponction principal. - En cas de maladie vasculaire au niveau du site d’accès TAVI, envisager un fil de sécurité traversant le site de ponction principal, soit introduit par un accès artériel secondaire controlatéral (par exemple, à travers une gaine de 6 F-8 F de long), ipsilatéral inférieur ou transradial. Utilisez ce fil de sécurité pour traiter les complications vasculaires au niveau de la ponction et/ou des sites traités par IVL.
- Choisissez un fil de sécurité de 0,018" (qui est suffisamment rigide, voir le tableau des matériaux) pour administrer des ballons vasculaires et/ou des stents, si nécessaire, mais avec un embout souple et non traumatique. Maintenez ce fil de sécurité en place pendant toute la procédure TAVI jusqu’à la confirmation d’une bonne fermeture vasculaire.
4. Configuration du système IVL
- Introduisez un fil-guide de 0,014 po, de préférence avec des caractéristiques de soutien supplémentaires, dans la gaine 7F-8F au niveau du site d’accès principal du TAVI. Ne poussez pas ce fil sur l’arc aortique.
- Allumez le générateur IVL et connectez-y le câble de connexion (voir Tableau des matériaux).
- Choisissez un cathéter IVL de 110 cm de long avec une longueur de ballonnet de 60 mm et des diamètres allant de 3,5 à 8 mm sur un système OTW (voir le tableau des matériaux).
REMARQUE : Il y a trois ports à l’extrémité distale du cathéter : un pour connecter le connecteur IVL, un pour gonfler et dégonfler le ballonnet, et un qui s’adapte au fil-guide de 0,014". - Préparez le cathéter/ballonnet IVL en suivant les étapes ci-dessous.
- Aspirer 5 mL d’un produit de contraste à 50 % (voir le tableau des matières) et un mélange salin à 50 % dans une seringue de 20 mL. Connectez-vous à l’orifice de gonflage/dégonflage du cathéter à ballonnet.
- Tirez sur la seringue pour aspirer l’air et remplacez cet air à l’intérieur du cathéter par le mélange de liquide dans la seringue. Répétez l’opération au moins trois fois.
- Remplissez un dispositif d’indégonflage (voir le tableau des matériaux) avec 50 % de solution saline/50 % de produit de contraste. Débranchez la seringue de 20 ml et connectez l’indégonfleur à l’orifice de gonflage du cathéter IVL à l’aide d’un robinet d’arrêt à trois voies en position intermédiaire, en veillant à ce qu’aucun air ne soit introduit dans le système.
- Rincez l’orifice de sortie du fil-guide à l’extrémité distale du cathéter IVL avec une solution saline.
- Enroulez le câble de connexion dans un couvercle stérile.
- Connectez le cathéter IVL de manière stérile au câble de connexion. Enroulez du ruban adhésif ou un élastique autour de la connexion entre le cathéter stérile et le couvercle stérile pour l’empêcher de glisser.
- Appuyez sur le bouton de thérapie du générateur IVL. La lumière passera de l’orange au vert.
REMARQUE : N’appuyez pas sur le bouton de thérapie à moins que le ballon ne soit rempli de 50 % de sérum physiologique / 50 % de produit de contraste (sinon, cela risque d’endommager les émetteurs de lithotripsie). Le système IVL est maintenant prêt à l’emploi (Figure 1).
5. Traitement IVL
- Mouillez le ballonnet et la tige du cathéter IVL avant de l’insérer pour activer le revêtement hydrophile.
- Insérez le cathéter IVL sur le fil (OTW) dans la gaine 7 F-8 F (site d’accès principal).
- Utilisez la fluoroscopie pour positionner les bandes de marqueurs dans la région d’intérêt.
- Gonflez le ballon IVL à 4 atm. Documentez le positionnement et le gonflage corrects à l’aide de la fluoroscopie. Assurez-vous qu’aucun air n’est visible dans le ballon gonflé.
- Appuyez sur le bouton d’activation situé sur la poignée du connecteur et maintenez-le enfoncé. Maintenez la position pendant 10 s pour appliquer un cycle de 30 impulsions IVL. Des clics audibles et des flashs lumineux confirmeront que la thérapie est administrée.
- A la fin des 30 impulsions IVL, augmentez le gonflage du ballon IVL à 6 atm. Maintenez cette pression pendant 4 s.
- Dégonflez le ballon et maintenez la pression négative pendant 30 s pour vous assurer qu’il est vide. Répétez cette action deux fois de plus.
- Répétez les étapes 5.3 à 5.7 pour un nombre maximum de 10 cycles avec 30 impulsions IVL (300 impulsions au total).
- Vérifiez que le ballonnet est complètement dégonflé avant de retirer le cathéter IVL.
- Remplacez le fil-guide de 0,014 » par un fil-guide de 0,018 »-0,035 », en fonction de la planification ultérieure (étapes 5.11-5.12).
- Si nécessaire, effectuez une angioplastie transluminale percutanée (ATP) supplémentaire avec un ballonnet non conforme (par exemple, 6-8 mm).
- Assurez-vous qu’un fil-guide rigide de 0,035" est en place avant d’insérer la gaine d’introduction TAVI de grand alésage dans le site d’accès principal.
- Continuez la procédure TAVI, comme d’habitude.
6. Fermeture vasculaire après TAVI
- Avant de retirer la gaine d’insertion, vérifiez la position du fil de sécurité. Ayez toujours à l’esprit une option de secours pour une intervention percutanée avec des ballons et/ou des stents (non) couverts et prête dans le laboratoire de cathétérisme.
- Effectuer la fermeture vasculaire à l’aide d’un dispositif de fermeture vasculaire à base de suture ou de bouchon (voir le tableau des matériaux).
- Pose la fermeture vasculaire par injection de contraste, soit à partir du site d’accès secondaire, soit à travers une gaine 6 F qui a remplacé la gaine d’insertion de gros calibre.
REMARQUE : Une angiographie par soustraction numérique (DSA) peut être utile pour mieux identifier les complications vasculaires possibles17. Sélectionnez et utilisez le mode DSA sur votre module et demandez au patient de retenir sa respiration pendant l’enregistrement. - Si une complication vasculaire survient, traitez en conséquence. Par exemple, placez un stent couvert en cas d’extravasation importante et un stent découvert dans une dissection en spirale, etc.
Résultats
Le traitement IVL (Figure 1) de l’AOMI calcifiée a été étudié pour la première fois dans l’étude européenne de pré-commercialisation DISRUPT-PAD18. L’étude a montré une augmentation aiguë du diamètre des vaisseaux chez 35 patients après un traitement IVL périphérique au prix de lésions vasculaires minimes. L’essai multicentrique DISRUPT-PAD II19 a confirmé ces résultats chez 60 patients. DISRUPT PAD III20 a été conçu comme une étude multicentrique prospective du monde réel dans laquelle 306 patients ont été randomisés 1:1 pour le traitement IVL ou PTA de la maladie artérielle fémoro-poplitée sévèrement calcifiée. Le succès de l’intervention, défini comme une sténose résiduelle <30 % sans dissection limitant le débit après dilatation par ballonnet, était plus important dans le groupe IVL que dans le groupe ATP classique (65,8 % contre 50,4 % ; p = 0,01). De plus, dans le groupe ATP (1,4 % contre 6,8 %; p = 0,03), les dissections limitant le débit étaient plus fréquentes.
Compte tenu de ces résultats prometteurs, l’IVL est de plus en plus utilisée pour permettre l’administration de TF de dispositifs de grand calibre, comme nécessaire dans le TAVI et la réparation endovasculaire de l’aorte (thoracique) ((T)EVAR). Le tableau 1 donne un aperçu des registres faisant état de l’utilisation de l’IVL pour faciliter TF-TAVI 11,13,21,22. L’administration du dispositif TAVI a été couronnée de succès dans tous les cas, avec de faibles taux de complications. Le registrede Copenhague 11 a rapporté la plus grande série monocentrique à ce jour, dans laquelle 50 patients ont été inclus et traités. La sélection des patients a été basée sur les recommandations de TDM décrites à la figure 2. Les 50 cas d’ITVA ont été réalisés avec succès, sans complications vasculaires majeures définies par VARC-2 (tableau 1). Aucune perforation ou rupture vasculaire n’a été documentée, et une seule dissection s’est produite, qui a été traitée avec une endoprothèse non couverte. Il y avait un taux relativement plus élevé d’échec du dispositif de fermeture vasculaire (14 %), ce qui a nécessité l’utilisation d’un stent couvert chez 5 patients (10 %)11. Cela souligne une fois de plus le degré d’AOMI chez ces patients et la nécessité d’une planification préopératoire diligente et de l’utilisation de mesures de sécurité pendant l’ATVI dans cette population de patients.

Figure 1 : Système IVL. (A) Les composants du système IVL. (B, C) L’analyse par micro-tomodensitométrie montre des « micro-fissures » dans la paroi vasculaire calcifiée après un traitement IVL. IVL, lithotripsie intravasculaire ; OTW, sur le fil ; PTA, angioplastie transluminale percutanée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
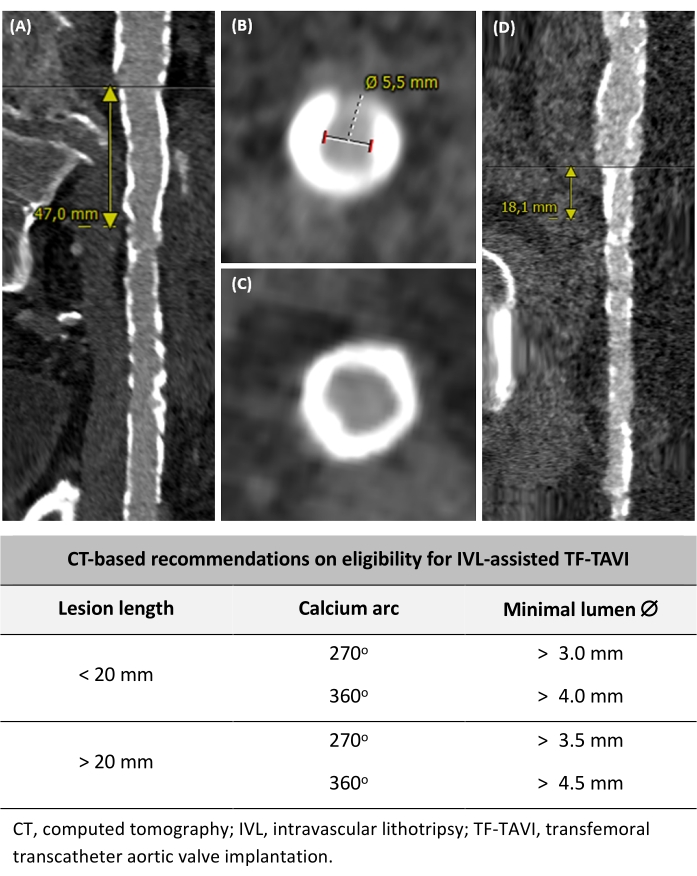
Figure 2 : Détermination de l’éligibilité au TF-TAVI assisté par IVL. (A) Long segment de vaisseau calcifié >20 mm de longueur. (B) Arc calcique à 270° et mesure du diamètre minimal de la lumière. (C) Arc calcique circonférentiel à 360°. (D) Lésion sévèrement calcifiée mais focale mesurant <20 mm. Sur la base des critères de tomodensitométrie préopératoires, des recommandations sur l’éligibilité au TF-TAVI assisté par IVL sont également incluses. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Sawaya et al.11 | Nardi et coll.22 | Armstrong et coll.21 | Price et coll.13 | |
| N = 50 | N = 108 | N = 17 | N = 9 | |
| Âge | 78,3 ± 6,7 | 80,5 ± 6,2 | 72,5 ± 8,3 | 79,3 ± 9,8 |
| Type de procédure | ||||
| TAVI | 50 (100%) | 108 (100%) | 4 (24%) | 4 (44%) |
| TEVAR | - | - | - | 1 (11%) |
| EVAR | - | - | 13 (76%) | 1 (11%) |
| EVAR fenestré | - | - | - | 3 (33%) |
| Diamètre du récipient de référence, mm | 8,7 ± 2,2 | 9.1 (8.3-10.0) | 8,4 ± 2,5 | N/A |
| Diamètre des vaisseaux sténose, % | 55 ± 13 | 50 ± 11 | 79 ± 19 | N/A |
| Longueur de la lésion cible, mm | 37 ± 16 | 20 (12-30) | 43 ± 22 | 42 ± 31 |
| Taille du cathéter IVL | ||||
| 5,0 x 60 millimètre | - | 2 (1.8%) | N/A | 0 (0) |
| 6,0 x 60 millimètre | - | 8 (7.1%) | N/A | 4 (40%) |
| 6,5 x 60 millimètre | - | 6 (5.4%) | N/A | 0 (0) |
| 7,0 x 60 millimètre | 50 (100%) | 96 (85.7%) | N/A | 6 (60%) |
| # impulsions par lésion | N/A | 300 (270-300) | 234 ± 144 | N/A |
| Livraison TF réussie | 50 (100%) | 108 (100%) | 17 (100%) | 9 (100%) |
| Complications | ||||
| Perforation | 0 (0) | 0 (0) | 0 (0) | 1 (11%) |
| Rupture | 0 (0) | 1 (0.9%) | 0 (0) | 0 (0) |
| Dissection – pose d’une endoprothèse | 1 (2%) | 2 (1.8%) | 0 (0) | 2 (22%) |
Tableau 1 : Études sur l’accès transfémoral de gros calibre assisté par IVL. Les valeurs sont moyennes ± ET ou N ( %). N/A, non disponible ; IVL, lithotripsie intravasculaire ; EVAR, réparation endovasculaire de l’aorte ; TAVI, implantation transcathéter de la valve aortique ; TF, transfémorale ; TEVAR, réparation endovasculaire de l’aorte thoracique.
Dossier supplémentaire 1 : Pourquoi viser à maximiser l’ITVA par une approche TF percutanée ? Avantages possibles des procédures TAVI par voie transfémorale percutanée par rapport aux approches alternatives. TAVI, implantation transcathéter de la valve aortique ; TF, transfémorale. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Depuis l’introduction de l’ATVI comme option de traitement pour les patients atteints de SA symptomatique sévère, des études et des registres ont démontré que l’approche TAVI par TF génère un meilleur succès procédural et des taux de complications plus faibles 3,4,23. En conséquence, la plupart des centres cherchent aujourd’hui à effectuer la plupart de leurs procédures TAVI par approche TF percutanée23.
L’introduction de l’IVL en tant que nouvel outil dans l’arsenal TAVI a permis d’augmenter le nombre de patients éligibles au TF-TAVI et offre aux opérateurs la possibilité d’effectuer le TF-TAVI de manière plus sûre et plus efficace en cas d’AOMI calcifiée. Dans l’exemple de Copenhague, l’utilisation de l’IVL a fait passer de 90 % à 95 % le pourcentage de cas d’IVV pouvant être traités par l’approche TF, sans augmenter le risque de complications vasculaires7.
Lorsque l’on envisage un TF-TAVI assisté par IVL, une sélection appropriée des patients est d’une importance capitale pour réaliser ces cas avec succès et sans complications. Un algorithme basé sur la tomodensitométrie a été proposé par le groupe11 de Copenhague et a également été mis en œuvre avec succès dans d’autres pays nordiques et de l’ouest de l’UE. Il est également essentiel de comprendre que l’apposition de la paroi du ballon est importante dans la transmission de l’énergie à la paroi du vaisseau10. Dans la pratique, la plupart des ballons IVL de 6 mm à 7 mm ont été utilisés dans le contexte de 22, car le diamètre extérieur des systèmes de largage et des gaines d’introduction de TAVI actuels est de 16 F à 22 F (c’est-à-dire 5,3 à 7,3 mm). Sur la base des données disponibles dans la littérature, la fiabilité du TF-TAVI assisté par IVL s’est déjà avérée fiable, ce qui a permis de réussir à 100 % la livraison des systèmes TAVI22. C’est encourageant, surtout si l’on considère les accouchements transcathéter valvulaires (THV) plus difficiles avec un accès TAVI alternatif.
Enfin, il convient de souligner que des mesures de sécurité diligentes doivent être prises lors de l’engagement dans des cas difficiles de TF-TAVI avec une maladie vasculaire ilio-fémorale sévèrement calcifiée. Même les essais récents de pointe sur l’ATVI montrent encore une incidence de 6 à 8 % de complications vasculaires majeures24. Ce risque ne fait qu’augmenter lorsque l’on traite des patients avec un accès plus hostile25,26. Cependant, avec une bonne planification préopératoire et des mesures de sécurité appropriées pendant l’ITAO, les taux de complications vasculaires importantes peuvent être maintenus proches de zéro. De nombreuses stratégies de sauvetage sont disponibles7, s’appuyant principalement sur un site d’accès secondaire. Une approche classique consiste à effectuer un croisement à partir d’un site d’accès fémoral controlatéral et à faire avancer un fil de sécurité dans le récipient d’accès principal, en passant par le site de ponction principal. De plus, un accès distal ipsilatéral ou transradial peut être considéré comme introduisant un fil de sécurité. Si une complication vasculaire survient, que ce soit au niveau du site de ponction traité par IVL ou principal, un ballonnet d’occlusion et/ou un stent (non) couvert peuvent être déployés rapidement et efficacement pour sauver les problèmes vasculaires. L’utilisation de telles stratégies de sauvetage permet d’assurer la sécurité lors du traitement de ces cas difficiles de TF-TAVI, ce qui est indispensable dans la pratique actuelle, car la marche précoce et la sortie le lendemain sont devenues plus courantes dans de nombreux centres TAVI27,28.
L’approche actuelle souffre de certaines limites. À l’heure actuelle, il n’existe pas de lignes directrices ou d’instructions bien définies pour indiquer quels patients sont aptes à recevoir une TF-TAVI assistée par IVL. Sur la base de l’expérience acquise dans de grands centres TAVI, un algorithme basé sur la tomodensitométrie a été proposé11. Cependant, ces valeurs seuils peuvent être différentes selon l’expérience de l’équipe d’intervention. Il est essentiel de vérifier que l’équipe interventionnelle possède les compétences et l’expertise nécessaires pour effectuer des interventions vasculaires périphériques percutanées et que tous les outils/matériaux sont présents dans le laboratoire de cathétérisme lors de l’intervention dans ces cas. Le traitement IVL ajoute également un coût économique spécifique à la procédure TAVI ; cependant, l’évitement de l’anesthésie générale, la nécessité d’une surveillance en soins intensifs, d’une plaie chirurgicale et la possibilité d’une déambulation précoce29 et d’une sortie27,28 devraient (largement) compenser ce coût supplémentaire pour le traitement IVL. De plus, l’accès transfémoral est associé à une moindre exposition aux rayonnements de l’opérateur30 (Dossier supplémentaire 1).
Si un patient est jugé inapte à la TF-TAVI après une analyse CT-angio minutieuse avant la procédure, une TAVI par accès alternatif est généralement envisagée. Cependant, ces stratégies sont plus invasives, nécessitent une expérience spécifique, sont souvent absentes dans les centres TAVI à faible volume et sont associées à des taux de complications périprocédurales plus élevés 3,4. L’ATP classique par ballonnet pourrait également être envisagée chez les patients présentant un accès ilio-fémoral à la limite acceptable pour le TF-TAVI. Cette stratégie est moins coûteuse et plus rapide, mais pourrait également être associée à un gain luminal moindre et à un risque accru de complications vasculaires majeures16, comme indiqué dans le sentier DISRUPT PAD III20 pour les interventions sous le genou. Des recherches supplémentaires sur ce sujet sont nécessaires.
Une autre stratégie alternative consiste à utiliser une technique dite de « pavage et fissure », dans laquelle plusieurs endoprothèses couvertes sont implantées dans l’axe ilio-fémoral comme des sortes d'« endo-conduits », provoquant une rupture contrôlée des vaisseaux d’accès et entraînant une dilatation à des diamètres plus grands31. L’avantage de cette technique est qu’elle protège contre la perforation vasculaire étendue, la rupture et la dissection. D’autre part, cette technique présente également de multiples inconvénients : coût élevé, risque de resténose et caractère plus invasif.
Déclarations de divulgation
Le Prof. Dr. De Backer a reçu des honoraires de conférencier de Shockwave Medical Inc. Tous les autres auteurs ne signalent pas les conflits d’intérêts pertinents.
Remerciements
Les auteurs n’en ont aucun à reconnaître.
matériels
| Name | Company | Catalog Number | Comments |
| 0.014” guidewire | Floppy II Extra Support Guide Wire, Abbott, USA | 22299M | |
| 0.035’’ stiff guidewire | Amplatz superstiff j-tip 7 cm floppy, Boston Scientific, USA | M001465020 | |
| 20 mL syringe | |||
| 6 F or 8 F femoral sheat | Radifocus Introducer II, Terumo | RS*B70N10MRD and RS*B80N10MRD | |
| 6-8 F Arrow sheat 35 cm- if contralateral access | Teleflex | CL07635 and CL07835 | |
| Arterial puncture needle | Percutaneous entry thinwall needle, Cook Medical | SDN18-18-7.0 | |
| Contrast solution | Visipaque 350, GE Healthcare | ||
| CT angiography-based 3D reconstruction dedicated software | 3mensio, Pie Medical, The Netherlands | ||
| Diagnostic catheter | 6F IMA diagnostic catheter, Cordis | 534-6605 | |
| Echo probe sterile cover | CIV-flex transducer cover, CIVCO | 610-1212 | |
| Indeflator device (20 mL) | Everest 30, Medtronic | AC3200 | |
| IVL Connector Cable | Shockwave medical | IVLCC | |
| IVL generator | Shockwave medical | IVLGCC | |
| Local anesthetic | Xylocain 10 mg/mL, Aspen | ||
| Non-compliant balloon | Z-MED II balloon 6 to 8 mm, Numed Canada inc. | PDZ622 | |
| Safety wire | 0.018’’ Platinum Plus guidewire, Boston Scientific, USA | M0014666050 | |
| Shockwave M5/M5+ catheter (7 mm-8 mm diameter) | Shockwave medical | M5IVL7060 - M5PIVL7060 - M5PIVL8060 | |
| Standard J-wire | angiodyn guide wire j-tip, B. Braun | 5050200 | |
| Sterile cover for shockwave connector cable | camera drape, Mönlycke health care | ||
| Three-way stopcock | |||
| Unfractionated heparin | 10 mL vials of 1000 IE/mL, Amgros I/S | ||
| Vascular closure device | Perclose Prostyle device, Abbott, USA | 12773-02 | |
| Vascular echo probe | |||
| Manta VCD, Essential Medical, USA | 2156NE, 2115NE |
Références
- Mack, M. J., et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. The New England Journal of Medicine. 380 (18), 1695-1705 (2019).
- Popma, J. J., et al. Transcatheter aortic-valve replacement with a self-expanding valve in low-risk patients. New England Journal of Medicine. 380 (18), 1706-1715 (2019).
- Blackstone, E. H., et al. Propensity-matched comparisons of clinical outcomes after transapical or transfemoral transcatheter aortic valve replacement. A placement of aortic transcatheter valves (PARTNER)-I trial substudy. Circulation. 131 (22), 1989-1999 (2015).
- Siontis, G. C. M., et al. Transcatheter aortic valve implantation vs. surgical aortic valve replacement for treatment of severe aortic stenosis: a meta-analysis of randomized trials. European Heart Journal. 37 (47), 3503-3512 (2016).
- Vahanian, A., et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 43 (7), 561-632 (2021).
- Ueshima, D., et al. The impact of pre-existing peripheral artery disease on transcatheter aortic valve implantation outcomes: A systematic review and meta-analysis. Catheterization and Cardiovascular Interventions. 95 (5), 993-1000 (2020).
- Costa, G., Bieliauskas, G., Fukutomi, M., Ihlemann, N., Søndergaard, L., De Backer, O. Feasibility and safety of a fully percutaneous transcatheter aortic valve replacement program. Catheterization and Cardiovascular Interventions. 97 (3), 418-424 (2021).
- Cleveland, R. O., McAteer, J. A. Chapter 38, The physics of shock wave lithotripsy. Smith's Textbook on Endourology. 1, 529-558 (2007).
- Dini, C. S., et al. Intravascular lithotripsy for calcific coronary and peripheral artery stenoses. EuroIntervention. 15 (8), 714-721 (2019).
- Kereiakes, D. J., et al. Principles of intravascular lithotripsy for calcific plaque modification. JACC: Cardiovascular Interventions. 14 (12), 1275-1292 (2021).
- Sawaya, F. J., et al. Intravascular lithotripsy-assisted transfemoral TAVI: The Copenhagen experience and literature review. Frontiers in Cardiovascular Medicine. 8, 1-7 (2021).
- Nardi, G., et al. Peripheral intravascular lithotripsy to facilitate transfemoral TAVR: a multicentric prospective registry. European Heart Journal. 42, 1-11 (2021).
- Price, L. Z., Safir, S. R., Faries, P. L., McKinsey, J. F., Tang, G. H. L., Tadros, R. O. Shockwave lithotripsy facilitates large-bore vascular access through calcified arteries. Journal of Vascular Surgery Cases and Innovative Techniques. 7 (1), 164-170 (2021).
- Blanke, P., et al. Computed Tomography Imaging in the context of Transcatheter Aortic Valve Implantation (TAVI)/Transcatheter Aortic Valve Replacement (TAVR): An expert consensus document of the Society of Cardiovascular Computed Tomography. JACC: Cardiovascular Imaging. 12 (1), 1-24 (2019).
- Okuyama, K., et al. Transfemoral access assessment for transcatheter aortic valve replacement: evidence-based application of computed tomography over invasive angiography. Circulation Cardiovascular Imaging. 8 (1), 001995 (2015).
- Staniloae, C. S., et al. Systematic transfemoral transarterial transcatheter aortic valve replacement in hostile vascular access. Structural Heart. 3 (1), 34-40 (2019).
- El-Mawardy, M., et al. Impact of femoral artery puncture using digital subtraction angiography and road mapping on vascular and bleeding complications after transfemoral transcatheter aortic valve implantation. EuroIntervention. 12 (13), 1667-1673 (2017).
- Marianne, B., et al. Safety and performance of lithoplasty for treatment of calcified peripheral artery lesions. Journal of the American College of Cardiology. 70 (7), 908-910 (2017).
- Brodmann, M., et al. Primary outcomes and mechanism of action of intravascular lithotripsy in calcified, femoropopliteal lesions: Results of Disrupt PAD II. Catheterization and cardiovascular interventions Official journal of the Society for Cardiac Angiography & Interventions. 93 (2), 335-342 (2019).
- Tepe, G., et al. Intravascular lithotripsy for peripheral artery calcification: 30-day outcomes from the randomized Disrupt PAD III Trial. JACC: Cardiovascular Interventions. 14 (12), 1352-1361 (2021).
- Armstrong, E. J., et al. Intravascular lithotripsy for treatment of calcified, stenotic iliac arteries: a cohort analysis from the Disrupt PAD III Study. Cardiovascular revascularization medicine including molecular interventions. 21 (10), 1262-1268 (2020).
- Nardi, G., et al. Peripheral intravascular lithotripsy of iliofemoral arteries to facilitate transfemoral TAVI: a multicentre prospective registry. EuroIntervention. , (2021).
- Carroll, J. D., et al. STS-ACC TVT Registry of transcatheter aortic valve replacement. Journal of the American College of Cardiology. 76 (21), 2492-2516 (2020).
- Scarsini, R., et al. Impact of complications during transfemoral transcatheter aortic valve replacement: How can they be avoided and managed. Journal of the American Heart Association. 8 (18), 013801 (2019).
- Hayashida, K., et al. Transfemoral aortic valve implantation new criteria to predict vascular complications. JACC. Cardiovascular interventions. 4 (8), 851-858 (2011).
- Stefan, T., et al. Percutaneous aortic valve replacement. Journal of the American College of Cardiology. 59 (2), 113-118 (2012).
- Barbanti, M., et al. Optimising patient discharge management after transfemoral transcatheter aortic valve implantation: the multicentre European FAST-TAVI trial. EuroIntervention. 15 (2), 147-154 (2019).
- Wood, D. A., et al. The vancouver 3M (multidisciplinary, multimodality, but minimalist) clinical pathway facilitates safe next-day discharge home at low-, medium-, and high-volume transfemoral transcatheter aortic valve replacement centers. JACC: Cardiovascular Interventions. 12 (5), 459-469 (2019).
- Vendrik, J., et al. Early mobilisation after transfemoral transcatheter aortic valve implantation: results of the MobiTAVI trial. Netherlands Heart Journal: Monthly journal of the Netherlands Society of Cardiology and the Netherlands Heart Foundation. 28 (5), 240-248 (2020).
- Aquino, A., et al. Radiation exposure during transcatheter valve replacement: what cardiac surgeons need to know. The Annals of Thoracic Surgery. 109 (1), 118-122 (2020).
- Asciutto, G., Aronici, M., Resch, T., Sonesson, B., Kristmundsson, T., Dias, N. V. Endoconduits with "Pave and Crack" technique avoid open ilio-femoral conduits with sustainable mid-term results. European Journal of Vascular and Endovascular Surgery. 54 (4), 472-479 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon