Method Article
Intravaskuläre Lithotripsie-assistierte transfemorale Transkatheter-Aortenklappenimplantation
In diesem Artikel
Zusammenfassung
Es hat sich gezeigt, dass die Transkatheter-Aortenklappenimplantation (TAVI) die besten klinischen Ergebnisse erzielt, wenn sie mit dem perkutanen transfemoralen Zugang durchgeführt wird. Die intravaskuläre Lithotripsie (IVL) kann einen transfemoralen Prozess bei Patienten mit verkalkter iliofemoraler Gefäßerkrankung und grenzwertigen intraluminalen Durchmessern erleichtern. Das vorliegende Protokoll beschreibt die IVL-assistierte transfemorale TAVI.
Zusammenfassung
In den letzten zehn Jahren hat sich die Transkatheter-Aortenklappenimplantation (TAVI) zu einer etablierten Therapie für alternde Patienten entwickelt, die an einer symptomatischen schweren Aortenklappenstenose leiden. Dies spiegelt sich auch in den kürzlich aktualisierten internationalen Leitlinien zur Behandlung von Patienten mit Herzklappenerkrankungen wider. Ein transfemoraler (TF) TAVI-Ansatz hat sich gegenüber alternativen Zugangsstrategien als überlegen erwiesen. Mit der Einführung der intravaskulären Lithotripsie (IVL) sind auch Patienten mit verkalkter iliofemoraler Gefäßerkrankung und grenzwertigen intraluminalen Durchmessern zu Kandidaten für perkutane TF-TAVI geworden. Darüber hinaus reduziert IVL das Risiko schwerwiegender vaskulärer Komplikationen, indem es das oberflächliche und tiefe vaskuläre Kalzium modifiziert, wodurch die Gefäßcompliance verändert und die luminale Expansion kontrolliert wird. Auf diese Weise hat sich gezeigt, dass IVL die TF-Verabreichung von TAVI-Geräten bei Patienten mit verkalkter peripherer arterieller Verschlusskrankheit sicher erleichtert. Der vorliegende Artikel zielt darauf ab, eine detaillierte Schritt-für-Schritt-Beschreibung zu geben, wie IVL-gestützte TF-TAVI sicher und effizient durchgeführt werden kann. Darüber hinaus ist eine Literaturübersicht über die mit dieser Technologie erzielten Ergebnisse sowie eine kurze Diskussion über diesen einzigartigen TAVI-Ansatz enthalten.
Einleitung
Die Transkatheter-Aortenklappenimplantation (TAVI) hat sich als wertvolle Therapie für ältere Patienten erwiesen, die an einer symptomatischen schweren Aortenklappenstenose (AS) in allen chirurgischen Risikokategorien leiden 1,2. Die Daten und Ergebnisse sind am überzeugendsten für diejenigen Patienten, bei denen das TAVI-Verfahren im transfemoralen (TF) Ansatz durchgeführt werden kann. Eine TAVI durch alternativen Zugang, wie z. B. transsubclavialer, transaxillärer, transkarotiden, transkavaler und transapikaler Zugang, kann ebenfalls in Betracht gezogen werden. Die Komplikationsraten, die für TAVI durch alternativen Zugang berichtet wurden, sind jedoch höher als TF-TAVI 3,4. Dies spiegelt sich auch in den jüngsten Leitlinien der EU und der USA zur Behandlung von Patienten mit Herzklappenerkrankungen5 wider, in denen TF-TAVI als Behandlungsoption für Patienten mit symptomatischer schwerer AS eine herausragende Rolle spielt.
Obwohl Konsens darüber besteht, dass TF-TAVI die Standardstrategie für Patienten mit ordnungsgemäßem iliofemoralen Zugang sein sollte5, ist die periphere arterielle Verschlusskrankheit (pAVK) bei Patienten, die für eine TAVI geplant sind, aufgrund ihres fortgeschrittenen Alters und ihrer oft multiplen Komorbiditäten nicht ungewöhnlich6. In den letzten Jahren hat sich die Technologie im TAVI-Bereich rasant weiterentwickelt, was zu TAVI-Geräten mit niedrigeren Einführprofilen und flexibleren Verabreichungssystemen geführt hat. Darüber hinaus hat die zunehmende Erfahrung der Bediener die Verwendung eines vollständig perkutanen TF-TAVI-Ansatzes erhöht. Heutzutage werden mehr als 90 % der TAVI-Fälle auf diese Weise in den modernsten TAVI-Zentren durchgeführt7.
Dennoch bleibt eine Gruppe von Patienten (5%-10%) gute Kandidaten für TAVI, leidet aber an stark verkalkter pAVK. Für viele dieser Patienten hat die Einführung der peripheren intravaskulären Lithotripsie (IVL) die Möglichkeit eröffnet, sich mit TF-TAVI behandeln zu lassen. Bei der Verwendung von IVL erzeugt man Schalldruckwellen mit miniaturisierten Lithotriptern, die in einen Ballon integriert sind. Im Inneren des Ballons entsteht eine Dampfblase, die sich schnell ausdehnt und durch die Abgabe elektrischer Energie zusammenbricht. Dabei entstehen Schalldruckwellen, die in ihrer Wellenform denen ähneln, die bei der extrakorporalen Lithotripsie der Nephrolithiasis verwendet werden. Diese Wellen wandern mit einem positiven Spitzendruck von etwa 50 atm durch das Gefäß, wodurch sowohl das oberflächliche als auch das tiefe vaskuläre Kalzium gerissen und modifiziert werden, wodurch letztendlich die Gefäßnachgiebigkeit verändert und eine kontrollierte luminale Expansion ermöglichtwird 8,9,10 (Abbildung 1). Auf diese Weise hat sich gezeigt, dass IVL die TF-Verabreichung von TAVI-Geräten bei Patienten mit verkalkter pAVK auf sichere Weise erleichtert 11,10,13. Diese IVL-Ballons sind in verschiedenen Durchmessern zwischen 3,5 mm und 7 mm mit einer Länge von 60 mm erhältlich.
Der vorliegende Artikel zielt darauf ab, eine detaillierte Beschreibung der sicheren und effizienten Durchführung von IVL-gestützten TF-TAVI zu geben. Darüber hinaus ist eine Literaturübersicht über die mit dieser Technologie erzielten Ergebnisse sowie eine kurze Diskussion über diesen neuen TAVI-Ansatz enthalten.
Patienten (männlich/weiblich) mit einer erkrankten iliofemoralen Anatomie, die den folgenden Kriterien entspricht, könnten für eine IVL-assistierte TF-TAVI in Frage kommen (Abbildung 2): (1) iliofemorale Gefäßerkrankung mit einer Läsionslänge von <20 mm und einem Kalziumbogen von ±270°, mit einem minimalen Lumendurchmesser von >3,0 mm, (2) iliofemorale Gefäßerkrankung mit einer Läsionslänge von <20 mm und Kalzium eines Bogens von ±360°, mit einem minimalen Lumendurchmesser von >4,0 mm, (3) iliopathogene Gefäßerkrankung mit einer Läsionslänge von >20 mm und einem Calciumbogen von ±270°, mit einem minimalen Lumendurchmesser von >3,5 mm, und (4) iliofemorale Gefäßerkrankung mit einer Läsionslänge von >20 mm und Calcium mit einem Bogen von ±360°, mit einem minimalen Lumendurchmesser von >4,5 mm. Diese Empfehlungen basieren auf Expertenmeinungen und der lokalen Praxis.
Protokoll
Das Protokoll wurde von der Ethikkommission für die Humanforschung des Universitätskrankenhauses Kopenhagen genehmigt, und die Studien werden nach den Richtlinien der genannten Ethikkommission durchgeführt. Gemäß den lokalen Richtlinien gaben alle Patienten eine Einverständniserklärung für das TAVI-Verfahren, Herz-CT-Scans und anonyme Daten für die Forschung.
1. Vorverfahrensplanung
- Untersuchen Sie die aorta-iliofemoralen Gefäße, die von der Aortenklappe über den Aortenbogen bis hinunter zur Arteria femoralis communis (CFA) und der Femurbifurkation reichen. Für eine genaue Auswertung führen Sie eine spezielle Computertomographie (CT)-Angiographie14 durch und führen eine angiographiebasierte dreidimensionale (3D) Rekonstruktion mit einer speziellen Software15 durch (siehe Materialtabelle).
- Beurteilen Sie visuell den Grad der Tortuosität des Schiffes.
- Visuelle Beurteilung des Grades und der Menge der Gefäßverkalkung (Lichtbogen, Morphologie usw.)16. Achten Sie besonders auf verkalkte Stellen mit einem verkalkten Umfang von >270°.
- Messen Sie den minimalen Luminaldurchmesser (MLD), den maximalen Luminaldurchmesser und den mittleren Luminaldurchmesser an der Stelle der kritischsten Verkalkungen und Stenosen16.
- Entscheidung über die Machbarkeit eines TF-Ansatzes für TAVI. Bewerten Sie die Notwendigkeit und den Nutzen eines IVL-gestützten TF-Ansatzes. Berücksichtigen Sie die in Abbildung 2 dargestellten Empfehlungen.
- Bestimmen Sie die Region, die für eine mögliche IVL-Behandlung von Interesse ist: Beckenbifurkation, Arteria iliaca communis und/oder Arteria iliaca externa.
- Bestimmen Sie die bevorzugte TAVI-Zugangs-/Punktionsstelle unter Bezugnahme auf die präprozedurale CT-Angiographie; Dies betrifft die Femurbifurkation und den Femurkopf.
- Entscheiden Sie über den Durchmesser und die Länge von (un)bedeckten Stents, wenn dies in Gefäßrettungssituationen erforderlich ist.
2. Erlangung eines Gefäßzugangs
- Wenden Sie eine Lokalanästhesie an, indem Sie ~10-20 ml Xylocain-Lösung (10 mg/ml) in die Haut und das Unterhautgewebe an der bevorzugten Einstichstelle für TAVI injizieren. Bestätigen Sie die Wirkung der Anästhesie, indem Sie die Hautempfindlichkeit mit einer Nadel testen.
- Führen Sie eine echogeführte Punktion des CFA durch und führen Sie einen 0,035"-Führungsdraht ein (siehe Materialtabelle).
HINWEIS: Vermeiden Sie eine CFA-Punktion zu nahe an der Femurbifurkation, da dies die Option für ein Bailout-Stenting des CFA im Falle eines Versagens der Gefäßverschlussvorrichtung erschweren und beeinträchtigen kann. Überprüfen Sie dies durch Durchleuchtung. - Machen Sie einen Hautschnitt von 2-3 cm und führen Sie einen 7 F-8 F Dilatator (siehe Materialtabelle) über den Draht ein.
- Halten Sie den 0,035" Führungsdraht in der Arterie und entfernen Sie den 7 F-8 F Dilatator. Entscheiden Sie sich für eine Gefäßverschlussstrategie (z. B. Naht-, Plug-basierter Verschluss usw.) und führen Sie bei Bedarf Manöver vor dem Verschluss durch.
- Führen Sie die Scheide 7 F-8 F (siehe Materialtabelle) über den Draht ein.
- Verabreichen Sie intravenöses Heparin gemäß dem lokalen Protokoll (z. B. 100 I.E./kg).
3. Verwendung und Positionierung eines Sicherungsseils
- Bei einem perkutanen Eingriff an einer IVL-behandelten Stelle ist ein Sicherheitsdraht über der Hauptzugangsstelle und ein Draht in der Bauchschlagader zu positionieren. Bewahren Sie diesen Draht auch nach dem Zurückziehen des TAVI-Systems und der Einführschleuse mit großer Bohrung strikt auf.
HINWEIS: Wenn die TAVI-Hauptzugangsstelle nicht erkrankt ist, ist es nicht unbedingt erforderlich, einen Sicherheitsdraht über der Hauptpunktionsstelle zu verlegen. - Im Falle einer Gefäßerkrankung an der TAVI-Zugangsstelle sollte ein Sicherheitsdraht in Betracht gezogen werden, der die Hauptpunktionsstelle kreuzt und entweder durch einen kontralateralen (z. B. durch eine 6 F-8 F lange Schleuse), einen unteren ipsilateralen oder einen transradialen sekundären arteriellen Zugang eingeführt wird. Verwenden Sie diesen Sicherheitsdraht zur Behandlung von Gefäßkomplikationen an den Punktions- und/oder IVL-behandelten Stellen.
- Wählen Sie einen 0,018-Zoll-Sicherungsdraht (der steif genug ist, siehe Materialtabelle), um bei Bedarf Gefäßballons und/oder Stents zu verabreichen, jedoch mit einer schlaffen, nicht traumatischen Spitze. Lassen Sie diesen Sicherheitsdraht während des gesamten TAVI-Eingriffs an Ort und Stelle, bis ein guter Gefäßverschluss bestätigt ist.
4. Einrichtung des IVL-Systems
- Führen Sie einen 0,014-Zoll-Führungsdraht, vorzugsweise mit zusätzlichen stützenden Eigenschaften, in den Mantel 7F-8F an der TAVI-Hauptzugangsstelle ein. Schieben Sie diesen Draht nicht über den Aortenbogen.
- Schalten Sie den IVL-Generator ein und schließen Sie das Anschlusskabel (siehe Materialtabelle) daran an.
- Wählen Sie einen 110 cm langen IVL-Katheter mit einer Ballonlänge von 60 mm und Durchmessern von 3,5 bis 8 mm auf einem Over-the-Wire-System (OTW) (siehe Materialtabelle).
HINWEIS: Am distalen Ende des Katheters befinden sich drei Anschlüsse: einer zum Anschließen des IVL-Anschlusses, einer zum Aufblasen und Entleeren des Ballons und einer für den 0,014-Zoll-Führungsdraht. - Bereiten Sie den IVL-Katheter/-Ballon vor, indem Sie die folgenden Schritte ausführen.
- Aspirieren Sie 5 mL mit einem Kontrast von 50 % (siehe Materialtabelle) und 50 % Kochsalzlösung in eine 20 mL Spritze. Anschluss an die Aufblas-/Entleerungsöffnung des Ballonkatheters.
- Ziehen Sie an der Spritze, um Luft abzusaugen, und ersetzen Sie diese Luft im Katheter durch das Flüssigkeitsgemisch in der Spritze. Wiederholen Sie dies mindestens dreimal.
- Füllen Sie ein Indeflatorgerät (siehe Materialtabelle) mit 50 % Kochsalzlösung und 50 % Kontrastmittel. Trennen Sie die 20-ml-Spritze und verbinden Sie den Indeflator mit einem Dreiwege-Absperrhahn in einer Zwischenposition mit der Aufblasöffnung des IVL-Katheters, um sicherzustellen, dass keine Luft in das System gelangt.
- Spülen Sie die Führungsdrahtaustrittsöffnung am distalen Ende des IVL-Katheters mit einer Kochsalzlösung.
- Wickeln Sie das Anschlusskabel in eine sterile Hülle.
- Verbinden Sie den IVL-Katheter steril mit dem Anschlusskabel. Wickeln Sie etwas Klebeband oder ein Gummiband um die Verbindung zwischen dem sterilen Katheter und der sterilen Abdeckung, um ein Verrutschen zu verhindern.
- Drücken Sie die Therapietaste am IVL-Generator. Das Licht wechselt von orange auf grün.
HINWEIS: Drücken Sie die Therapietaste nur, wenn der Ballon mit 50 % Kochsalzlösung und 50 % Kontrastmittel gefüllt ist (andernfalls besteht die Gefahr, dass die Lithotripsie-Strahler beschädigt werden). Das IVL-System ist nun einsatzbereit (Abbildung 1).
5. IVL-Behandlung
- Machen Sie den Ballon und den Schaft des IVL-Katheters vor dem Einführen nass, um die hydrophile Beschichtung zu aktivieren.
- Führen Sie den IVL-Katheter über den Draht (OTW) in die Schleuse 7 F-8 F (Hauptzugangsstelle) ein.
- Verwenden Sie die Fluoroskopie, um die Markerbänder an der interessierenden Region zu positionieren.
- Blasen Sie den IVL-Ballon auf 4 atm auf. Dokumentieren Sie die korrekte Positionierung und das Aufblasen mittels Fluoroskopie. Stellen Sie sicher, dass keine Luft im aufgeblasenen Ballon sichtbar ist.
- Halten Sie die Aktivierungstaste am Steckergriff gedrückt. Halten Sie die Taste 10 s lang gedrückt, um einen Zyklus mit 30 IVL-Impulsen anzuwenden. Akustisches Klicken und leuchtendes Aufblitzen bestätigen, dass die Therapie durchgeführt wurde.
- Erhöhen Sie am Ende der 30 IVL-Impulse das Aufblasen des IVL-Ballons auf 6 atm. Halten Sie diesen Druck für 4 s.
- Lassen Sie die Luft aus dem Ballon und halten Sie den Unterdruck 30 s lang, um sicherzustellen, dass er leer ist. Wiederholen Sie diesen Vorgang noch zwei weitere Male.
- Wiederholen Sie die Schritte 5.3-5.7 für maximal 10 Zyklen mit 30 IVL-Impulsen (insgesamt 300 Impulse).
- Vergewissern Sie sich, dass der Ballon vollständig entleert ist, bevor Sie den IVL-Katheter entfernen.
- Tauschen Sie den 0,014"-Führungsdraht gegen einen 0,018"-0,035" Führungsdraht aus, je nach weiterer Planung (Schritte 5.11-5.12).
- Bei Bedarf ist eine zusätzliche perkutane transluminale Angioplastie (PTA) mit einem nicht konformen Ballon (z. B. 6-8 mm) durchzuführen.
- Stellen Sie sicher, dass ein 0,035" steifer Führungsdraht an Ort und Stelle ist, bevor Sie den TAVI-Einführmantel mit großem Durchmesser in die Hauptzugangsstelle einführen.
- Setzen Sie das TAVI-Verfahren wie gewohnt fort.
6. Gefäßverschluss nach TAVI
- Überprüfen Sie vor dem Entfernen der Einführschleuse die Position des Sicherungsdrahtes. Haben Sie immer eine Bailout-Option für perkutane Eingriffe mit Ballons und/oder (un)bedeckten Stents im Kopf und stehen im Katheterlabor bereit.
- Führen Sie einen Gefäßverschluss mit einem Gefäßverschluss auf Naht- oder Plug-Basis durch (siehe Materialtabelle).
- Beurteilt den Gefäßverschluss mit Kontrastmittelinjektion, entweder von der sekundären Zugangsstelle oder durch eine 6 F-Schleuse, die die Einführschleuse mit großer Bohrung ersetzt.
HINWEIS: Eine digitale Subtraktionsangiographie (DSA) kann hilfreich sein, um mögliche vaskuläre Komplikationen besser zu erkennen17. Wählen und verwenden Sie den DSA-Modus an Ihrem Modul und bitten Sie den Patienten, während der Aufzeichnung den Atem anzuhalten. - Tritt eine Gefäßkomplikation auf, ist entsprechend zu behandeln. Platzieren Sie zum Beispiel einen abgedeckten Stent bei einer signifikanten Extravasation und einen unbedeckten Stent bei einer Spiraldissektion usw.
Ergebnisse
Die IVL-Behandlung (Abbildung 1) der kalzifizierten pAVK wurde erstmals in der europäischen DISRUPT-PAD-Studie vor der Markteinführunguntersucht 18. Die Studie zeigte eine akute Zunahme des Gefäßdurchmessers bei 35 Patienten nach einer peripheren IVL-Behandlung auf Kosten einer nur minimalen Gefäßverletzung. Die multizentrische DISRUPT-PAD II-Studie19 bestätigte diese Ergebnisse bei 60 Patienten. DISRUPT PAD III20 wurde als reale, prospektive, multizentrische Studie konzipiert, in der 306 Patienten 1:1 auf IVL- oder PTA-Behandlung einer stark verkalkten femoropoplitealen arteriellen Erkrankung randomisiert wurden. Der prozedurale Erfolg, definiert als Reststenose <30% ohne flussbegrenzende Dissektion nach Ballondilatation, war in der IVL-Gruppe größer als in der klassischen PTA-Gruppe (65,8% vs. 50,4%; p = 0,01). Darüber hinaus traten in der PTA-Gruppe (1,4 % vs. 6,8 %; p = 0,03) häufiger flussbegrenzende Dissektionen auf.
In Anbetracht dieser vielversprechenden Ergebnisse wird IVL zunehmend eingesetzt, um die TF-Verabreichung von großvolumigen Geräten zu ermöglichen, wie sie bei TAVI und (thorakaler) endovaskulärer Aortenreparatur ((T)EVAR) benötigt werden. Tabelle 1 gibt einen Überblick über die Register, die über die Verwendung von IVL zur Erleichterung von TF-TAVI berichten 11,13,21,22. Die Auslieferung des TAVI-Gerätes war in allen Fällen erfolgreich, mit geringen Komplikationsraten. Das Kopenhagener Register11 meldete die bisher größte monozentrische Serie, in die 50 Patienten eingeschlossen und behandelt wurden. Die Patientenauswahl basierte auf den in Abbildung 2 beschriebenen CT-Empfehlungen. Alle 50 TAVI-Fälle wurden erfolgreich durchgeführt, ohne dass VARC-2-definierte schwerwiegende vaskuläre Komplikationen auftraten (Tabelle 1). Es wurden keine Gefäßperforationen oder -rupturen dokumentiert und es kam nur zu einer Dissektion, die mit einem nicht abgedeckten Stent behandelt wurde. Bei 5 Patienten (10 %) war die Rate des Versagens von Gefäßverschlussvorrichtungen relativ höher (14 %), was die Verwendung eines abgedeckten Stents erforderlich machte11. Dies unterstreicht einmal mehr den Grad der pAVK bei diesen Patienten und die Notwendigkeit einer sorgfältigen präprozeduralen Planung und des Einsatzes von Sicherheitsmaßnahmen während der TAVI in dieser Patientenpopulation.

Abbildung 1: IVL-System. (A) Die IVL-Systemkomponenten. (B,C) Mikro-CT-Scan-Analyse, die nach der IVL-Behandlung "Mikrorisse" in der verkalkten Gefäßwand zeigt. IVL, intravaskuläre Lithotripsie; OTW, über die Leitung; PTA, perkutane transluminale Angioplastie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
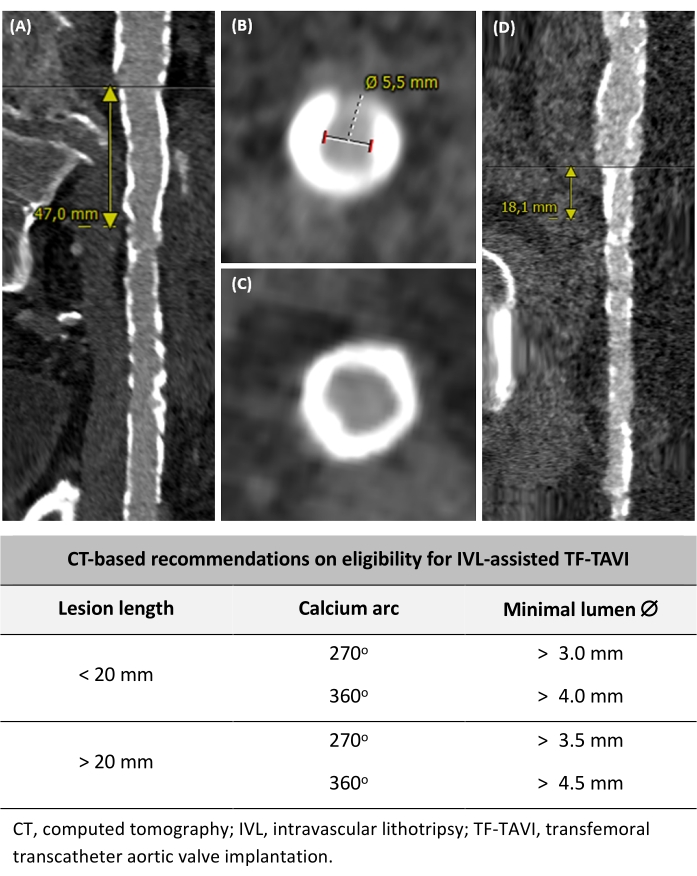
Abbildung 2: Bestimmung der Eignung für IVL-gestütztes TF-TAVI. (A) Langes kalzifiziertes Gefäßsegment >20 mm Länge. (B) 270° Calciumbogen und Messung des minimalen Lumendurchmessers. (C) Umlaufender 360° Calciumbogen. (D) Stark verkalkte, aber fokale Läsion von <20 mm. Basierend auf präprozeduralen CT-Kriterien sind auch Empfehlungen zur Eignung für IVL-gestützte TF-TAVI enthalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Sawaya et al.11 | Nardi et al.22 | Armstrong et al.21 | Price et al.13 | |
| N = 50 | N = 108 | N = 17 | N = 9 | |
| Alter | 78,3 ± 6,7 | 80,5 ± 6,2 | 72,5 ± 8,3 | 79,3 ± 9,8 |
| Art der Prozedur | ||||
| TAVI | 50 (100%) | 108 (100%) | 4 (24%) | 4 (44%) |
| TEVAR | - | - | - | 1 (11%) |
| EVAR | - | - | 13 (76%) | 1 (11%) |
| Gefenstertes EVAR | - | - | - | 3 (33%) |
| Durchmesser des Referenzgefäßes, mm | 8,7 ± 2,2 | 9.1 (8.3-10.0) | 8,4 ± 2,5 | N/A |
| Gefäßdurchmesser Stenose, % | 55 ± 13 | 50 ± 11 | 79 ± 19 | N/A |
| Länge der Zielläsion, mm | 37 ± 16 | 20 (12-30) | 43 ± 22 | 42 ± 31 |
| Größe des IVL-Katheters | ||||
| 5,0 x 60 mm | - | 2 (1.8%) | N/A | 0 (0) |
| 6,0 x 60 mm | - | 8 (7.1%) | N/A | 4 (40%) |
| 6,5 x 60 mm | - | 6 (5.4%) | N/A | 0 (0) |
| 7,0 x 60 mm | 50 (100%) | 96 (85.7%) | N/A | 6 (60%) |
| # Impulse pro Läsion | N/A | 300 (270-300) | 234 ± 144 | N/A |
| Erfolgreiche TF-Lieferung | 50 (100%) | 108 (100%) | 17 (100%) | 9 (100%) |
| Komplikationen | ||||
| Perforation | 0 (0) | 0 (0) | 0 (0) | 1 (11%) |
| Bruch | 0 (0) | 1 (0.9%) | 0 (0) | 0 (0) |
| Dissektion – Stenting | 1 (2%) | 2 (1.8%) | 0 (0) | 2 (22%) |
Tabelle 1: Studien zum IVL-assistierten transfemoralen Zugang mit großem Bohrloch. Die Werte sind mittlere ± SD oder N (%). N/A, nicht verfügbar; IVL, intravaskuläre Lithotripsie; EVAR, endovaskuläre Aortenreparatur; TAVI, Transkatheter-Aortenklappenimplantation; TF, transfemoral; TEVAR, thorakale endovaskuläre Aortenreparatur.
Ergänzende Datei 1: Warum sollte die TAVI durch den perkutanen TF-Ansatz maximiert werden? Mögliche Vorteile von TAVI-Verfahren durch perkutanen transfemoralen Zugang im Vergleich zu alternativen Zugängen. TAVI, Transkatheter-Aortenklappenimplantation; TF, transfemoral. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Seit der Einführung von TAVI als Behandlungsoption für Patienten mit schwerer symptomatischer AS haben Studien und Register gezeigt, dass der TAVI-by-TF-Ansatz zu einem besseren Verfahrenserfolg und niedrigeren Komplikationsraten führt 3,4,23. Infolgedessen versuchen die meisten Zentren heutzutage, die meisten ihrer TAVI-Eingriffe nach dem perkutanen TF-Ansatz durchzuführen23.
Die Einführung der IVL als neues Instrument im TAVI-Arsenal hat zu einer erhöhten Anzahl von Patienten geführt, die für TF-TAVI geeignet sind, und bietet den Betreibern die Möglichkeit, TF-TAVI bei kalzifizierter pAVK sicherer und effizienter durchzuführen. Am Beispiel von Kopenhagen hat der Einsatz von IVL den Prozentsatz der TAVI-Fälle, die mit dem TF-Ansatz behandelt werden konnten, von 90 % auf 95 % erhöht, ohne das Risiko von Gefäßkomplikationen zu erhöhen7.
Wenn eine IVL-assistierte TF-TAVI in Betracht gezogen wird, ist die richtige Patientenauswahl von größter Bedeutung, um diese Fälle erfolgreich und ohne Komplikationen durchzuführen. Ein CT-basierter Algorithmus wurde von der Kopenhagener Gruppe11 vorgeschlagen und auch in anderen nordischen und westlichen EU-Ländern erfolgreich implementiert. Es ist auch wesentlich zu verstehen, dass die Wandapposition des Ballons wichtig ist, um die Energie auf die Gefäßwand10 zu übertragen. In der Praxis wurden meist 6 mm bis 7 mm IVL-Ballons im Zusammenhang mit 22 verwendet, da der Außendurchmesser der aktuellen TAVR-Verabreichungssysteme/Einführhüllen 16 F bis 22 F (d. h. 5,3 bis 7,3 mm) beträgt. Basierend auf den verfügbaren Daten in der Literatur hat sich die IVL-gestützte TF-TAVI bereits als zuverlässig erwiesen, was zu einer 100%igen erfolgreichen TF-Verabreichung der TAVI-Systeme führte22. Dies ist ermutigend, insbesondere angesichts der schwierigeren Entbindungen von Transkatheter-Herzklappen (THV) mit alternativem TAVI-Zugang.
Abschließend sollte betont werden, dass bei schwierigen TF-TAVI-Fällen mit stark verkalkten iliofemoralen Gefäßerkrankungen sorgfältige Sicherheitsmaßnahmen ergriffen werden müssen. Selbst neuere hochmoderne TAVI-Studien zeigen immer noch eine Inzidenz von 6 % bis 8 % schwerer vaskulärer Komplikationen24. Dieses Risiko steigt nur bei der Behandlung von Patienten mit einem feindlicheren Zugang25,26. Mit einer guten Planung vor dem Eingriff und den richtigen Sicherheitsmaßnahmen während der TAVI können jedoch signifikante vaskuläre Komplikationsraten nahe Null gehalten werden. Es gibt viele Bailout-Strategien7, die sich in erster Linie auf einen sekundären Zugangsstandort stützen. Ein klassischer Ansatz besteht darin, eine Überkreuzung von einer kontralateralen Femurzugangsstelle durchzuführen und einen Sicherungsdraht im Hauptzugangsgefäß durch die Hauptpunktionsstelle zu schieben. Auch ein distaler ipsilateraler oder transradialer Zugang kann in Betracht gezogen werden, um einen Sicherungsdraht einzuführen. Tritt eine Gefäßkomplikation auf, entweder an der IVL-behandelten oder an der Hauptpunktionsstelle, kann ein Okklusionsballon und/oder ein (un)bedeckter Stent schnell und effizient eingesetzt werden, um Gefäßprobleme zu retten. Die Anwendung solcher Bailout-Strategien bietet Sicherheit bei der Behandlung dieser schwierigen TF-TAVI-Fälle, was in der aktuellen Praxis ein Muss ist, da die frühe Ambulation und die Entlassung am nächsten Tag in vielen TAVI-Zentren zur Routine geworden sind27,28.
Der derzeitige Ansatz unterliegt gewissen Einschränkungen. Derzeit gibt es keine klar definierten Richtlinien oder Anweisungen, die angeben, welche Patienten für eine IVL-assistierte TF-TAVI geeignet sind. Basierend auf den Erfahrungen in großen TAVI-Zentren wurde ein CT-basierter Algorithmus vorgeschlagen11. Diese Grenzwerte können jedoch je nach Erfahrung des Interventionsteams unterschiedlich sein. Es ist wichtig zu überprüfen, ob das Interventionsteam über die Fähigkeiten und das Fachwissen verfügt, um perkutane periphere vaskuläre Eingriffe durchzuführen, und dass alle Werkzeuge/Materialien im Katheterlabor vorhanden sind, wenn in diesen Fällen behandelt wird. Die IVL-Behandlung fügt dem TAVI-Verfahren auch spezifische wirtschaftliche Kosten hinzu. Es wird jedoch erwartet, dass die Vermeidung einer Vollnarkose, die Notwendigkeit einer intensivmedizinischen Überwachung, einer Operationswunde und die Möglichkeit einer frühen Ambulation29 und Entlassung 27,28 diese zusätzlichen Kosten für die IVL-Behandlung (weitgehend) kompensieren werden. Darüber hinaus ist der transfemorale Zugang mit einer geringeren Strahlenbelastung des Bedienersverbunden 30 (Zusatzdatei 1).
Wenn ein Patient nach sorgfältiger präprozeduraler CT-Angio-Analyse als ungeeignet für eine TF-TAVI erachtet wird, wird in der Regel eine TAVI mit alternativem Zugang in Betracht gezogen. Diese Strategien sind jedoch invasiver, erfordern spezifische Erfahrung, fehlen oft in TAVI-Zentren mit geringerem Volumen und sind mit höheren periprozeduralen Komplikationsraten verbunden 3,4. Eine klassische Ballon-PTA könnte auch bei Patienten mit grenzwertig akzeptablem iliofemoralem Zugang für TF-TAVI in Betracht gezogen werden. Diese Strategie ist kostengünstiger und zeiteffizienter, könnte aber auch mit einem geringeren Luminalgewinn und einem erhöhten Risiko für schwere vaskuläre Komplikationen16 verbunden sein, wie in der Studie DISRUPT PAD III20 für Eingriffe unterhalb des Knies berichtet wurde. Weitere Forschung zu diesem Thema ist erforderlich.
Eine weitere alternative Strategie ist die Anwendung einer sogenannten "Pave-and-Crack"-Technik, bei der mehrere abgedeckte Stents als eine Art "Endo-Conduits" in die iliofemorale Achse implantiert werden, was zu einem kontrollierten Bruch der Zugangsgefäße und zu einer Dilatation auf größere Durchmesser führt31. Der Vorteil dieser Technik besteht darin, dass sie vor ausgedehnten Gefäßperforationen, -rupturen und -dissektionen schützt. Auf der anderen Seite hat diese Technik auch mehrere Nachteile: hohe Kosten, Risiko von Restenose und invasiverer Charakter.
Offenlegungen
Prof. Dr. De Backer erhielt Honorare für Vorträge von Shockwave Medical Inc. Alle anderen Autoren berichten nicht über relevante Interessenkonflikte.
Danksagungen
Die Autoren haben keine zu würdigen.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.014” guidewire | Floppy II Extra Support Guide Wire, Abbott, USA | 22299M | |
| 0.035’’ stiff guidewire | Amplatz superstiff j-tip 7 cm floppy, Boston Scientific, USA | M001465020 | |
| 20 mL syringe | |||
| 6 F or 8 F femoral sheat | Radifocus Introducer II, Terumo | RS*B70N10MRD and RS*B80N10MRD | |
| 6-8 F Arrow sheat 35 cm- if contralateral access | Teleflex | CL07635 and CL07835 | |
| Arterial puncture needle | Percutaneous entry thinwall needle, Cook Medical | SDN18-18-7.0 | |
| Contrast solution | Visipaque 350, GE Healthcare | ||
| CT angiography-based 3D reconstruction dedicated software | 3mensio, Pie Medical, The Netherlands | ||
| Diagnostic catheter | 6F IMA diagnostic catheter, Cordis | 534-6605 | |
| Echo probe sterile cover | CIV-flex transducer cover, CIVCO | 610-1212 | |
| Indeflator device (20 mL) | Everest 30, Medtronic | AC3200 | |
| IVL Connector Cable | Shockwave medical | IVLCC | |
| IVL generator | Shockwave medical | IVLGCC | |
| Local anesthetic | Xylocain 10 mg/mL, Aspen | ||
| Non-compliant balloon | Z-MED II balloon 6 to 8 mm, Numed Canada inc. | PDZ622 | |
| Safety wire | 0.018’’ Platinum Plus guidewire, Boston Scientific, USA | M0014666050 | |
| Shockwave M5/M5+ catheter (7 mm-8 mm diameter) | Shockwave medical | M5IVL7060 - M5PIVL7060 - M5PIVL8060 | |
| Standard J-wire | angiodyn guide wire j-tip, B. Braun | 5050200 | |
| Sterile cover for shockwave connector cable | camera drape, Mönlycke health care | ||
| Three-way stopcock | |||
| Unfractionated heparin | 10 mL vials of 1000 IE/mL, Amgros I/S | ||
| Vascular closure device | Perclose Prostyle device, Abbott, USA | 12773-02 | |
| Vascular echo probe | |||
| Manta VCD, Essential Medical, USA | 2156NE, 2115NE |
Referenzen
- Mack, M. J., et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. The New England Journal of Medicine. 380 (18), 1695-1705 (2019).
- Popma, J. J., et al. Transcatheter aortic-valve replacement with a self-expanding valve in low-risk patients. New England Journal of Medicine. 380 (18), 1706-1715 (2019).
- Blackstone, E. H., et al. Propensity-matched comparisons of clinical outcomes after transapical or transfemoral transcatheter aortic valve replacement. A placement of aortic transcatheter valves (PARTNER)-I trial substudy. Circulation. 131 (22), 1989-1999 (2015).
- Siontis, G. C. M., et al. Transcatheter aortic valve implantation vs. surgical aortic valve replacement for treatment of severe aortic stenosis: a meta-analysis of randomized trials. European Heart Journal. 37 (47), 3503-3512 (2016).
- Vahanian, A., et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 43 (7), 561-632 (2021).
- Ueshima, D., et al. The impact of pre-existing peripheral artery disease on transcatheter aortic valve implantation outcomes: A systematic review and meta-analysis. Catheterization and Cardiovascular Interventions. 95 (5), 993-1000 (2020).
- Costa, G., Bieliauskas, G., Fukutomi, M., Ihlemann, N., Søndergaard, L., De Backer, O. Feasibility and safety of a fully percutaneous transcatheter aortic valve replacement program. Catheterization and Cardiovascular Interventions. 97 (3), 418-424 (2021).
- Cleveland, R. O., McAteer, J. A. Chapter 38, The physics of shock wave lithotripsy. Smith's Textbook on Endourology. 1, 529-558 (2007).
- Dini, C. S., et al. Intravascular lithotripsy for calcific coronary and peripheral artery stenoses. EuroIntervention. 15 (8), 714-721 (2019).
- Kereiakes, D. J., et al. Principles of intravascular lithotripsy for calcific plaque modification. JACC: Cardiovascular Interventions. 14 (12), 1275-1292 (2021).
- Sawaya, F. J., et al. Intravascular lithotripsy-assisted transfemoral TAVI: The Copenhagen experience and literature review. Frontiers in Cardiovascular Medicine. 8, 1-7 (2021).
- Nardi, G., et al. Peripheral intravascular lithotripsy to facilitate transfemoral TAVR: a multicentric prospective registry. European Heart Journal. 42, 1-11 (2021).
- Price, L. Z., Safir, S. R., Faries, P. L., McKinsey, J. F., Tang, G. H. L., Tadros, R. O. Shockwave lithotripsy facilitates large-bore vascular access through calcified arteries. Journal of Vascular Surgery Cases and Innovative Techniques. 7 (1), 164-170 (2021).
- Blanke, P., et al. Computed Tomography Imaging in the context of Transcatheter Aortic Valve Implantation (TAVI)/Transcatheter Aortic Valve Replacement (TAVR): An expert consensus document of the Society of Cardiovascular Computed Tomography. JACC: Cardiovascular Imaging. 12 (1), 1-24 (2019).
- Okuyama, K., et al. Transfemoral access assessment for transcatheter aortic valve replacement: evidence-based application of computed tomography over invasive angiography. Circulation Cardiovascular Imaging. 8 (1), 001995(2015).
- Staniloae, C. S., et al. Systematic transfemoral transarterial transcatheter aortic valve replacement in hostile vascular access. Structural Heart. 3 (1), 34-40 (2019).
- El-Mawardy, M., et al. Impact of femoral artery puncture using digital subtraction angiography and road mapping on vascular and bleeding complications after transfemoral transcatheter aortic valve implantation. EuroIntervention. 12 (13), 1667-1673 (2017).
- Marianne, B., et al. Safety and performance of lithoplasty for treatment of calcified peripheral artery lesions. Journal of the American College of Cardiology. 70 (7), 908-910 (2017).
- Brodmann, M., et al. Primary outcomes and mechanism of action of intravascular lithotripsy in calcified, femoropopliteal lesions: Results of Disrupt PAD II. Catheterization and cardiovascular interventions Official journal of the Society for Cardiac Angiography & Interventions. 93 (2), 335-342 (2019).
- Tepe, G., et al. Intravascular lithotripsy for peripheral artery calcification: 30-day outcomes from the randomized Disrupt PAD III Trial. JACC: Cardiovascular Interventions. 14 (12), 1352-1361 (2021).
- Armstrong, E. J., et al. Intravascular lithotripsy for treatment of calcified, stenotic iliac arteries: a cohort analysis from the Disrupt PAD III Study. Cardiovascular revascularization medicine including molecular interventions. 21 (10), 1262-1268 (2020).
- Nardi, G., et al. Peripheral intravascular lithotripsy of iliofemoral arteries to facilitate transfemoral TAVI: a multicentre prospective registry. EuroIntervention. , (2021).
- Carroll, J. D., et al. STS-ACC TVT Registry of transcatheter aortic valve replacement. Journal of the American College of Cardiology. 76 (21), 2492-2516 (2020).
- Scarsini, R., et al. Impact of complications during transfemoral transcatheter aortic valve replacement: How can they be avoided and managed. Journal of the American Heart Association. 8 (18), 013801(2019).
- Hayashida, K., et al. Transfemoral aortic valve implantation new criteria to predict vascular complications. JACC. Cardiovascular interventions. 4 (8), 851-858 (2011).
- Stefan, T., et al. Percutaneous aortic valve replacement. Journal of the American College of Cardiology. 59 (2), 113-118 (2012).
- Barbanti, M., et al. Optimising patient discharge management after transfemoral transcatheter aortic valve implantation: the multicentre European FAST-TAVI trial. EuroIntervention. 15 (2), 147-154 (2019).
- Wood, D. A., et al. The vancouver 3M (multidisciplinary, multimodality, but minimalist) clinical pathway facilitates safe next-day discharge home at low-, medium-, and high-volume transfemoral transcatheter aortic valve replacement centers. JACC: Cardiovascular Interventions. 12 (5), 459-469 (2019).
- Vendrik, J., et al. Early mobilisation after transfemoral transcatheter aortic valve implantation: results of the MobiTAVI trial. Netherlands Heart Journal: Monthly journal of the Netherlands Society of Cardiology and the Netherlands Heart Foundation. 28 (5), 240-248 (2020).
- Aquino, A., et al. Radiation exposure during transcatheter valve replacement: what cardiac surgeons need to know. The Annals of Thoracic Surgery. 109 (1), 118-122 (2020).
- Asciutto, G., Aronici, M., Resch, T., Sonesson, B., Kristmundsson, T., Dias, N. V. Endoconduits with "Pave and Crack" technique avoid open ilio-femoral conduits with sustainable mid-term results. European Journal of Vascular and Endovascular Surgery. 54 (4), 472-479 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten