Method Article
الكشف عن عدوى هيليكوباكتر بيلوري ومقاومة المضادات الحيوية عن طريق تحليل تفاعل البوليميراز المتسلسل الكمي للبراز
* These authors contributed equally
In This Article
Summary
يستخدم البروتوكول أخذ عينات غير جراحية من البراز جنبا إلى جنب مع تفاعل متسلسل كمي للبوليميراز لتقديم طريقة تشخيص مريحة وسريعة لعدوى هيليكوباكتر بيلوري ومقاومتها للكلاريثرومايسين والكينولونات.
Abstract
تنتشر بكتيريا الملوية البوابية على نطاق واسع في جميع أنحاء العالم، حيث أن ما يقرب من 50٪ من سكان العالم لديهم تاريخ من الإصابة بعدوى الملوية البوابية. في الصين ، يتراوح معدل الإصابة من 40٪ إلى 70٪. ترتبط الملوية البوابية بشكل أساسي بأمراض الجهاز الهضمي مثل التهاب المعدة المزمن وقرحة المعدة وقرحة الاثني عشر. حاليا ، يتضمن العلاج السريري لعدوى الملوية البوابية إما العلاج الثلاثي أو الرباعي. ومع ذلك ، أدى الاستخدام المكثف للمضادات الحيوية إلى تطوير مقاومة المضادات الحيوية في بكتيريا الملوية البوابية. لذلك ، يعد اكتشاف كل من الملوية البوابية ومقاومتها للمضادات الحيوية أمرا بالغ الأهمية لتوجيه العلاج السريري.
تشمل طرق تشخيص الملوية البوابية اختبار تنفس اليوريا (UBT) ، واختبار المستضد ، واختبار الأجسام المضادة المصلية ، والتنظير الداخلي ، واختبار اليورياز السريع (RUT) ، والثقافة البكتيرية. في حين أن الطرق الثلاث الأولى غير جراحية ، إلا أنها لا تسمح بالتعافي البكتيري ، وبالتالي لا يمكن استخدامها لاختبار المقاومة. الطرق الثلاث الأخيرة غازية ومكلفة وتتطلب خبرة فنية عالية وقد تسبب ضررا للمرضى.
لذلك، فإن الطريقة السريعة غير الغازية للكشف المتزامن عن عدوى الملوية البوابية ومقاومة المضادات الحيوية لها أهمية سريرية قصوى للاستئصال الفعال للملوية البوابية. تهدف هذه الورقة إلى تقديم بروتوكول محدد يجمع بين تفاعل البوليميراز المتسلسل الكمي (qPCR) وتقنية مسبار الفلورسنت TaqMan للكشف السريع عن عدوى الملوية البوابية ومقاومة المضادات الحيوية. توفر هذه الطريقة طريقة مريحة وسريعة وغير جراحية لتشخيص عدوى الملوية البوابية ومقاومتها ، على عكس الثقافة البكتيرية التقليدية والتقنيات الأخرى. يستخدم qPCR لتحديد العدوى واكتشاف الطفرات في جينات 23S rRNA و gyrA ، والتي ترتبط بمقاومة الكلاريثرومايسين والكينولونات ، على التوالي. بالمقارنة مع تقنيات الاستزراع التقليدية ، يوفر هذا النهج طريقة غير جراحية وفعالة من حيث التكلفة وفعالة من حيث الوقت للكشف عن عدوى هيليكوباكتر بيلوري وتحديد مقاومتها للمضادات الحيوية.
Introduction
هيليكوباكتر بيلوري هي بكتيريا سالبة الجرام حلزونية الشكل يمكن أن تصيب ظهارة المعدة البشرية1 باستمرار. في عام 1994 ، صنفت منظمة الصحة العالمية الملوية البوابية على أنها مادة مسرطنة من المجموعة 1 لسرطان المعدة ، مع ~ 3٪ من الأفراد المصابين في النهاية يصابون بالمرض2. أشارت مراجعة منهجية نشرت مؤخرا إلى أن اتجاها عاما لزيادة معدل مقاومة الملوية البوابية للمضادات الحيوية لوحظ في العقد الماضي ، والذي وصل إلى مستويات مقلقة في جميع أنحاء العالم ، وخاصة مقاومة الكلاريثرومايسين3. في الصين ، أظهرت أحدث بيانات المسح أن الانتشار الكلي لبكتيريا الملوية البوابية بين سكان المناطق الحضرية الصينيين يبلغ 27.08٪. وبلغت معدلات مقاومة كلاريثرومايسين والليفوفلوكساسين 50.83٪ و47.17٪4، وهي أعلى من الولايات المتحدة (ليفوفلوكساسين 37.6٪، كلاريثرومايسين 31.5٪)5وأوروبا (ليفوفلوكساسين 15.8٪ وكلاريثرومايسين 21.4٪)6. وبالتالي ، فإن التشخيص والعلاج المبكر والدقيق أمر بالغ الأهمية. ومع ذلك، فإن المقاومة المتزايدة للمضادات الحيوية للملوية البوابية تقلل بشكل كبير من فعالية العلاج، مما يسلط الضوء على الحاجة الملحة لإجراء بحوث مستمرة في تشخيصها وعلاجها.
تصنف طرق تشخيص الملوية البوابية إلى تقنيات جراحية وغيرجراحية 7. تشمل الطرق الغازية الفحص النسيجي المرضي واختبار اليورياز السريع (RUT) والثقافةالبكتيرية 8. يعتمد الفحص النسيجي المرضي على المعالجة والمراقبة المجهرية لعينات الخزعة ، مع دقة محدودة بالتحضير النسيجي والخبرة في علم الأمراض9. يكتشف RUT الملوية البوابية من خلال نشاط اليورياز ، الذي يحلل اليوريا لإنتاج الأمونيا ، مما يؤدي إلى تحول قلوي في الكاشف ، مما يشير إلى وجود البكتيريا9. إنه بسيط وفعال من حيث التكلفة. غالبا ما يكون للثقافة البكتيرية ، التي تعتبر "المعيار الذهبي" ، معدل نجاح أقل من 50٪ بسبب الخصائص الفسيولوجية الفريدة ل H. pylori10.
تشمل الطرق غير الغازية اختبار تنفس اليوريا 13C / 14C (UBT) ، والتشخيص المصلي ، واختبار مستضد البراز (SAT) 11. يعمل اختبار التنفس على مبدأ مشابه لمبدأ RUT ، حيث يكتشف ثاني أكسيد الكربونالمسمى نظائريا في هواء الزفير لتأكيد العدوى12. يكشف التشخيص المصلي عن الأجسام المضادة التي قد تستمر بعد الاستئصال البكتيري ، مما يجعل من الصعب تقييم فعالية العلاج13. يكتشف اختبار مستضد البراز مستضدات خاصة بالملوية البوابية في عينات البراز ، مما يوفر طريقة موثوقة غير جراحية مع معدل أقل من الإيجابيات الكاذبة ودقة جيدة لتشخيص العدوى النشطة14.
كل طريقة تشخيص لها مزاياهاوقيودها 15. بصرف النظر عن الاستزراع البكتيري ، تكافح الطرق الأخرى للكشف عن مقاومة المضادات الحيوية ، بينما تعوق معدلات النجاح المنخفضة16. في الآونة الأخيرة ، تم تطبيق طرق التشخيص الجزيئي مثل تفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي (qPCR) على نطاق واسع للكشف عن الميكروبات17. يمكن ل qPCR اكتشاف الملوية البوابية بدقة وتحليل الطفرات الجينية المقاومة ، مما يوفر رؤية أكثر شمولا للعدوى18.
تم تصميم مجسات الفلورسنت للارتباط على وجه التحديد بتسلسل مستهدف في الحمض النووي أثناء عملية qPCR. عادة ما يتم تصنيف هذه المجسات بصبغة فلورية ، والتي تصدر إشارة عندما يرتبط المسبار بهدفه ويتم شقه بواسطة البوليميراز أثناء التضخيم. يوفر هذا قياسا في الوقت الفعلي لعملية تفاعل البوليميراز المتسلسل (PCR). تشتهر مجسات الفلورسنت بخصوصيتها العالية نظرا للتصميم الفريد للمسبار ، والذي يضمن اكتشاف تسلسل الحمض النووي المستهدف فقط ، مما يقلل من فرص الارتباط غير المحدد ويحسن خصوصية الفحص. هذا يجعل تقنية مسبار الفلورسنت مفيدة بشكل خاص للكشف عن الأهداف منخفضة الوفرة ، مثل الحمض النووي لبكتيريا الملوية البوابية في عينات البراز. في حين أن SYBR Green هي صبغة ملزمة للحمض النووي شائعة الاستخدام في تفاعل البوليميراز المتسلسل ، إلا أنها يمكن أن ترتبط بأي حمض نووي مزدوج الشريطة ، مما قد يؤدي إلى تضخيم غير محدد وإيجابيات خاطئة.
لا يوفر زراعة هيليكوباكتر بيلوري من العينات السريرية بيانات مقاومة المضادات الحيوية مباشرة. في المقابل ، فإن qPCR القائم على مسبار الفلورسنت أسرع وأكثر ملاءمة ويمكن تكييفه للكشف المتزامن عن الملوية البوابية وعلامات مقاومة المضادات الحيوية. لا تقدم هذه الطريقة نتائج أسرع من طرق الاستزراع التقليدية فحسب ، بل تسمح أيضا بالكشف المتزامن عن جينات مقاومة المضادات الحيوية ، مما يعزز بشكل كبير من كفاءة الكشف والراحة. توفر هذه الطريقة طريقة مريحة وسريعة وغير جراحية لتشخيص عدوى الملوية البوابية ومقاومتها ، على عكس الثقافة البكتيرية التقليدية والتقنيات الأخرى.
هناك مسألتان حاسمتان يجب مراعاتهما لمقاومة الملوية البوابية للمضادات الحيوية: 1) اتساق النمط الجيني والنمط الظاهري ، 2) مقاومة الأدوية المتعددة. وجدت دراسة واسعة النطاق متعددة المراكز في الصين أن أنماط المقاومة المزدوجة للكلاريثرومايسين / ليفوفلوكساسين كانت 26.1٪. أظهرت الأنماط الظاهرية والأنماط الجينية للبكتيريا البوابية المقاومة للكلاريثرومايسين والليفوفلوكساسين اتفاقا مرضيا (معامل كابا = 0.810 و 0.782 ، على التوالي)19. لذلك ، من الممكن استخدام طريقة qPCR للكشف عن عدوى الملوية البوابية ومقاومة الأدوية. يتم استخدام طرق اختبار مستضد البراز (SAT) و qPCR بشكل متزايد بسبب سهولة أخذ العينات. حساسية وخصوصية ودقة طرق الكشف عن الملوية البوابية هي كما يلي: qPCR > UBT > SAT > RUT> CagA IgG > الثقافة20. جميع الطرق غير الغازية مناسبة للفحص الأولي. نظرا لأن qPCR يمكنه أيضا اكتشاف جينات مقاومة الأدوية ، فإن qPCR والثقافة سيكونان أكثر ملاءمة لتوجيه العلاج.
تظهر الأساليب المبتكرة الأخرى ، مثل خوارزميات الذكاء الاصطناعي (الذكاء الاصطناعي) جنبا إلى جنب مع الصور بالمنظار21 ، والموائع الدقيقةالرقمية 22 ، و RPA-CRISPR / Cas12a23 ، من الناحية النظرية كفاءة تشخيصية جيدة وآفاق تطبيق واعدة. ومع ذلك، فإن qPCR هي حاليا أكثر تقنيات البيولوجيا الجزيئية تطورا مع القدرة على توفير حل متميز لتشخيص وعلاج عدوى الملوية البوابية .
Protocol
تلتزم هذه الدراسة بالمبادئ التوجيهية الأخلاقية التي وضعتها لجنة الأخلاقيات في مستشفى الشعب بمقاطعة قوانغدونغ ، الجامعة الطبية الجنوبية ، قوانغتشو ، الصين (رقم الموافقة: KY2024-445-01). يمكن العثور على معلومات مفصلة حول المواد المستخدمة في هذا البحث (الكواشف والمواد الكيميائية والمعدات والبرامج) في جدول المواد.
1. اختيار المشاركين
- اختر المشاركين في الفئة العمرية من 18 إلى 60 عاما.
- اختر المشاركين الذين قد يخضعون لفحص عدوى هيليكوباكتر بيلوري ، مثل المرضى الذين يعانون من أعراض مثل التهاب المعدة أو القرحة الهضمية أو عسر الهضم ، وكذلك الأفراد الذين لا تظهر عليهم أعراض.
- استبعاد المرضى الذين استخدموا المضادات الحيوية أو العوامل المحتوية على البزموت (مثل كبسولات سترات البزموت البوتاسيوم أو كبسولات البكتين البزموت الغروية أو أقراص مركب البزموت الألومنيوم) من الدراسة أو الأدوية الصينية المضادة للميكروبات خلال الشهر الماضي ، أو أولئك الذين استخدموا مثبطات مضخة البروتون أو مضادات مستقبلات H2 (مثل أوميبرازول أو بانتوبرازول أو رابيبرازول أو سيميتيدين أو نيزاتيدين) خلال الأسبوعين الماضيين. استبعاد النساء أيضا خلال فترة الحيض من الدراسة.
2. جمع عينات البراز
ملاحظة: قدم القسم 2 كتعليمات للمشاركين.
- تأكد من أن العبوة الخارجية لمجموعة أخذ العينات غير تالفة وضمن تاريخ انتهاء الصلاحية. قم بإزالة المواد من المجموعة.
- ضع ورقة تجميع البراز البيضاء في وعاء المرحاض وتغوط (لتجنب التلوث بالبول).
- باستخدام ملعقة ، اجمع جزءا من البراز بحجم حبة عريضة تقريبا (~ 5 جم) وانقله إلى حاوية العينة.
- ضع ملعقة أخذ العينات ، جنبا إلى جنب مع عينة البراز ، في أنبوب التجميع ، مع التأكد من ارتفاع مستوى السائل بالقرب من خط أخذ العينات الموضح على الأنبوب.
- شد غطاء الأنبوب بإحكام. اقلب الأنبوب عدة مرات لضمان الخلط الشامل للعينة مع المحلول الحافظ.
- تخزين العينة في الثلاجة حتى تسليمها إلى المختبر السريري للتعرف التالي على بكتيريا الملوية البوابية وتقييم ملامح مقاومة المضادات الحيوية عبر qPCR.
3. استخراج الحمض النووي
ملاحظة: أكمل جميع الإجراءات داخل خزانة السلامة الحيوية لتجنب التلوث.
- اقلب أنبوب حفظ العينة واخلطه جيدا. انقل 1.0 مل من محلول العينة البرازية إلى أنبوب طرد مركزي دقيق.
- بعد خلط أنابيب الطرد المركزي ، ضعها في حمام معدني عند 80 درجة مئوية لمدة 10 دقائق ، مع خلط متقطع لمدة 30 ثانية في الدقيقة الخامسة. بمجرد أن تبرد الأنابيب إلى درجة حرارة الغرفة ، قم بجهاز الطرد المركزي عند 10,000 × جم لمدة 5 دقائق وجمع المادة الطافية لمزيد من المعالجة.
- اقلب اللوحة المكونة من 96 بئرا عدة مرات لإعادة تعليق الخرز المغناطيسي. قم بإزالة ختم رقائق الألومنيوم بعناية ، مع الحرص على تجنب الاهتزاز لمنع الانسكاب.
- أضف 200 ميكرولتر من العينة المحضرة (من الخطوة 3.2) إلى كل بئر من الصفيحة المكونة من 96 بئرا التي تحتوي على عازلة التحلل ، مما يضمن أن كل بئر يتوافق مع عينة واحدة. ضع اللوحة المكونة من 96 بئرا في حجرة العينة المخصصة لأداة استخراج الحمض النووي للاستخراج الآلي.
- قم بتخزين أي عينات متبقية وعينات الحمض النووي المستخرجة عند -20 درجة مئوية لحفظها على المدى الطويل واستخدامها في المستقبل.
4. qPCR الكشف عن الأحماض النووية الملوية البوابية وطفرات مقاومة الكلاريثرومايسين والكينولونات
- خذ الكواشف من منطقة تخزين الكاشف وقم بإذابة الثلج في درجة حرارة الغرفة.
ملاحظة: تم استخدام هذه المجموعة للكشف النوعي عن الملوية البوابية الحمض النووي ، بما في ذلك الطفرات في جين 23S rRNA (A2143G ، A2143C ، A2144G) وجين gyrA (261A ، 261G ، 260T ، 271A ، 271T ، 272G). كانت البادئات ، والمجسات ، وإنزيم Taq ، وإنزيم UNG ، و dNTPs متوفرة في المجموعة. تم تضمين الجينات المستهدفة من الملوية البوابية و β-أكتين البشري في مراقبة الجودة الإيجابية. تم اختيار جينβ الأكتين البشري كمراقبة داخلية للجودة. - بناء على عدد العينات المراد اختبارها ، استخدم N + 2 نسخ من الكاشف المجفف بالتجميد ، حيث يمثل N عدد العينات المراد اختبارها و 2 يمثل QCs السلبية والإيجابية.
- جهاز طرد مركزي لفترة وجيزة للتأكد من أن المسحوق المجفف بالتجميد يستقر في قاع الأنابيب. افتح غطاء الكاشف المجفف بالتجميد (مع الحرص على تجنب أي انسكاب للمسحوق) وأضف 25 ميكرولتر لكل بئر من الأحماض النووية المستخرجة من العينات المراد اختبارها ، بالإضافة إلى الضوابط الإيجابية والسلبية. أغلق الأنابيب بإحكام.
- دوامة كواشف PCR لمدة 8-10 ثوان ، ثم الطرد المركزي لفترة وجيزة لمدة 3-5 ثوان لتجنب تكوين الفقاعة.
- ضع لوحة qPCR سعة 96 بئر على جهاز qPCR. اضبط برنامج ركوب الدراجات على النحو التالي: أولا ، احتضان خليط التفاعل (الذي يحتوي على بادئات ، مجسات ، بوليميراز Taq ، إنزيم UNG ، dNTPs ، إلخ) عند 42 درجة مئوية و 95 درجة مئوية (كلتا الخطوتين في دورة واحدة) لمدة دقيقتين ؛ ثم ، دورة 10x مع 10 ثوان عند 95 درجة مئوية و 45 ثانية عند 65 درجة مئوية ؛ أخيرا ، قم بدورة 35x مع 10 ثوان عند 95 درجة مئوية و 45 ثانية عند 58 درجة مئوية للتمسخ والتلدين والتمديد.
- اضبط معلمات الكشف عن إشارة التألق على النحو التالي: وضع العلامات الفلورية ROX على الجينات المحفوظة للملوية البوابية ؛ ملصقات الفلورسنت FAM لجينات مقاومة الملوية البوابية كلاريثرومايسين. وضع العلامات الفلورية السداسية على H. بوابيس جينات مقاومة الكينولون. وتم استخدام الملصقات الفلورية CY5 لجين β-أكتين البشري كعنصر تحكم داخلي للمجموعة. جمع البيانات عند 58 درجة مئوية. عند الانتهاء من التفاعل ، تأكد من حفظ البيانات لتحليلها في المستقبل.
- قم بتحليل البيانات باستخدام برنامج خاص ب qPCR ، حيث تحدد الأداة تلقائيا عتبة خط الأساس. تحديد جميع معايير التشخيص ، بما في ذلك وجود عدوى أو مقاومة هيليكوباكتر بيلوري ، على قيمة CT ≤30 ؛ تأكد من أنها تظهر منحنى مميز على شكل حرف S.
النتائج
تطبيق qPCR للكشف عن عدوى هيليكوباكتر بيلوري ومقاومة المضادات الحيوية في عينات البراز
قمنا بتصميم بادئات ومجسات بناء على الطفرات النقطية في الجينات المحفوظة ل Helicobacter pylori ، وكذلك في جين 23S rRNA وجين gyrA . تم تصنيف هذه البادئات والمجسات بأصباغ فلورية مختلفة ثم استخدمت للكشف عن qPCR. كانت نتائج مراقبة الجودة لتجارب qPCR ضمن النطاق الموصى به ، مما يشير إلى نتائج اكتشاف موثوقة (الشكل 1). في هذه الدراسة ، اخترنا خمس عينات تمثيلية (S1-S5) لتوصيف موثوقية البروتوكول التجريبي (الشكل 2 والجدول 1). S1 هي عينة بدون عدوى الملوية البوابية ، بينما S2-S5 هي عينات ذات ملامح مقاومة مختلفة للأدوية.
بالنسبة للعينات الإيجابية لعدوى هيليكوباكتر بيلوري ، أظهرت العينة S2 قيم التصوير المقطعي المحوسب ضمن نطاق الكشف فقط عن هيليكوباكتر بيلوري ، مما يشير إلى أن هذه العينة إيجابية للبكتيريا الملوية البوابية وحساسة لكل من كلاريثرومايسين والكينولون ، مما يسمح بالعلاج بأي من الدواءين. أظهرت العينة S3 قيم التصوير المقطعي المحوسب ضمن نطاق الكشف لكل من عدوى هيليكوباكتر بيلوري ومقاومة كلاريثرومايسين ، مع عدم اكتشاف قيم التصوير المقطعي المحوسب لمقاومة الكينولون ، مما يشير إلى أن العينة S3 من مريض مقاوم للكلاريثروميسين. وبالمثل ، كان للعينة S4 قيم CT ضمن نطاق الكشف عن عدوى هيليكوباكتر بيلوري ومقاومة الكينولون ، مع عدم اكتشاف قيم التصوير المقطعي المحوسب لمقاومة كلاريثرومايسين ، مما يشير إلى مقاومة الكينولونات ويوصي بالعلاج بالكلاريثرومايسين. أخيرا ، كان للعينة S5 قيم CT يمكن اكتشافها في جميع الاختبارات ، مما يشير إلى أن العينة إيجابية ل Helicobacter pylori وتظهر مقاومة مزدوجة لكل من كلاريثرومايسين والكينولونات. وبالتالي ، يجب أن ينظر الأطباء في خيارات العلاج البديلة. بالمقارنة مع طرق الكشف عن هيليكوباكتر بيلوري الأخرى ، فإن هذا النهج لا يسهل الحصول على العينة فحسب ، بل يسمح أيضا بالكشف المتزامن عن هيليكوباكتر بيلوري وملف مقاومته ، مما يوفر نتائج موثوقة لتوجيه قرارات العلاج المناسبة.
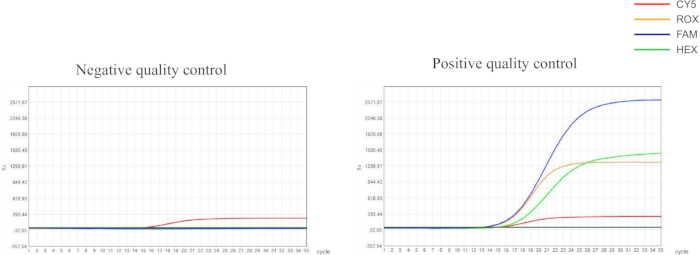
الشكل 1: نتائج مراقبة الجودة للضوابط السلبية والإيجابية. يجب أن تعرض عناصر التحكم السلبية منحنى نمو على شكل حرف S لقناة الكشف CY5 بقيمة CT ≤ 30.00. وينبغي ألا تظهر إشارات التألق لقنوات FAM وHEX وROX زيادات كبيرة، مع > قيم التصوير المقطعي المحوسب 30.00 أو لا توجد إشارة ملحوظة؛ وينبغي أن تقدم عناصر التحكم الإيجابية منحنيات على شكل حرف S في جميع قنوات الكشف بقيم التصوير المقطعي المحوسب ≤ 00.30. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الكشف عن هيليكوباكتر بيلوري ومقاومته للمضادات الحيوية في عينات البراز بواسطة qPCR. يمثل كل لون إشارة فلورية ، وتمثل إشارات الفلورسنت المختلفة جينات مختلفة. قنوات الفلورة: الملصقات الفلورية ROX (برتقالية) من H. البوابية الجينات المحفوظة. ملصقات الفلورسنت FAM (الأزرق) من H. pylori كلاريثرومايسين الجينات المقاومة; وضع العلامات الفلورية السداسية (الخضراء) من جينات مقاومة الملوية البوابية الكينولونية. وضع العلامات الفلورية CY5 (أحمر) لجين التحكم الداخلي. عينة الأنماط الظاهرية: S1 هي عينة سالبة لعدوى الملوية البوابية (لا توجد إشارة أعلى من العتبة) ؛ S2 هي عينة إيجابية الملوية البوابية بدون مقاومة للمضادات الحيوية (إشارة ROX فوق العتبة) ؛ S3 هي عينة إيجابية الملوية البوابية مع مقاومة للكلاريثرومايسين (إشارة FAM فوق العتبة). S4 هي عينة موجبة الملوية البوابية مع مقاومة للكينولونات (إشارة HEX فوق العتبة) ؛ S5 هي عينة إيجابية الملوية البوابية مقاومة لكل من كلاريثرومايسين والكينولونات (إشارة FAM و HEX فوق العتبة). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| عينة | H.Pylori (ROX) | كلاريثرومايسين (FAM) | الكينولونات (HEX) | CY5 | |||
| +/- | التصوير المقطعي المحوسب | +/- | التصوير المقطعي المحوسب | +/- | التصوير المقطعي المحوسب | التصوير المقطعي المحوسب | |
| S1 | - | - | - | - | - | - | 9.96 |
| S2 | + | 23.08 | - | - | - | - | 12.66 |
| S3 | + | 19.58 | + | 22.41 | - | - | 11.4 |
| S4 | + | 20.65 | - | - | + | 26.06 | 14.59 |
| S5 | + | 19.82 | + | 22.49 | + | 21.65 | 9.48 |
| سلبي | - | - | - | - | - | - | 14.73 |
| موجب | + | 12.7 | + | 14.47 | + | 13.07 | 14.78 |
الجدول 1: نتائج الكشف عن عدوى الملوية البوابية و qPCR لمقاومة الكلاريثرومايسين والكينولون. يقدم الجدول النتائج النوعية لعدوى الملوية البوابية. يشير اكتشاف طفرات جين 23S rRNA إلى مقاومة الكلاريثرومايسين ، بينما تشير طفرات جينات gyrA إلى مقاومة الكينولون. الرموز: +/- ، النتيجة النوعية ؛ + ، نتيجة إيجابية ؛ - ، نتيجة سلبية.
Discussion
في السنوات الأخيرة ، تم تطبيق طرق الكشف الجزيئي على نطاق واسع في مجال علم الأحياء الدقيقة ، مما أدى إلى تغيير كبير في الإدارة السريرية للعديد من الأمراض المعدية. تعمل هذه الطرق على المستوى الجيني ، مما يسمح ليس فقط بتأكيد وجود البكتيريا ولكن أيضا باختبار التصنيف الجيني ومقاومة المضادات الحيوية. يفضل بشكل متزايد تفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي (qPCR) بسبب وقت المعالجة القصير والحساسية العالية والدقة وانخفاض مخاطر التلوث المتبادل. لقد أصبح يستخدم على نطاق واسع في المختبرات السريرية لتشخيص عدوى هيليكوباكتر بيلوري .
يسمح الجمع بين حلول حفظ جمع عينات البراز وطرق الكشف عن الجينات بالفحص السريع والفعال ل H. pylori والمزيد من اختبارات مقاومة المضادات الحيوية من خلال تحليل الطفرات في جين كلاريثرومايسين 23S rRNA وجين quinolone gyrA . يمكن لهذه الطريقة تقييم حساسية الملوية البوابية ومقاومتها للأدوية. تحتوي طرق الكشف عن مستضد البراز السابقة على قيود ملحوظة ، مثل انخفاض الدقة والاستقرار بسبب انخفاض تركيزات المستضد وتدهور المستضد في العينات. بالإضافة إلى ذلك ، قد تفتقر طرق الكشف عن المستضد التقليدية إلى الحساسية والخصوصية الكافية في العينات المعقدة ، مما يؤثر على موثوقية النتائج.
لمعالجة هذه المشكلات ، نقترح طريقة تجمع بين عينات البراز وتقنية تفاعل البوليميراز المتسلسل الكمي (qPCR). يعزز هذا النهج بشكل كبير حساسية الكشف ودقته ، مما يجعل اختبار البراز أكثر موثوقية وكفاءة ، ويوفر نتائج عالية الجودة للاستخدام السريري.
معايير مراقبة الجودة ضرورية للكشف عن qPCR. تشمل مراقبة الجودة لدينا المعايرة الدورية للجهاز ، والتحقق من أداء نظام الكشف ، وتقييم كفاءة استخراج الحمض النووي ، ومراقبة الجودة لكل دفعة من التجارب. أولا ، تتم معايرة أدوات أخذ العينات الخاصة بنا كل 6 أشهر ، ويتم معايرة معدات الاستخراج ومعدات التضخيم سنويا. بالإضافة إلى ذلك ، تتم المعايرة لكل دفعة من الكواشف. بعد المعايرة، يمكننا التحقق من صحة أدائنا لنظام الكشف، بما في ذلك أداة PCR الكمية Macrostone 96S الفلورية، ومجموعات الكشف عن طفرات الملوية البوابية والمقاومة، وكواشف الاستخراج، بالإضافة إلى أنابيب أخذ العينات والماصات والنصائح المقابلة. معدل المطابقة ، وحد الكشف ، والتفاعل المتقاطع ، والقدرة على مقاومة التداخل ، والدقة تلبي احتياجاتنا. تم تحديد تركيزات منتجات الحمض النووي بواسطة جهاز اختبار تركيز الحمض النووي لتلبية معايير القبول لكفاءة استخراج الحمض النووي. كان تركيز الحمض النووي أعلى من 10 نانوغرام / ميكرولتر. كان A260 / A280 بين 1.6 و 2.0. يجب إعادة استخراج العينات غير المؤهلة. تكون النتائج صالحة فقط عندما تكون مراقبة الجودة اليومية تحت السيطرة. بالنسبة لاختبار مقاومة الملوية البوابية والمضادات الحيوية (كلاريثرومايسين والكينولونات) ، تكون معايير مراقبة الجودة كما يلي: يجب أن تعرض الضوابط السلبية منحنى نمو على شكل حرف S لقناة الكشف CY5 بقيمة CT ≤ 30.00 ؛ وينبغي ألا تظهر إشارات التألق لقنوات FAM وHEX وROX زيادات كبيرة بقيم التصوير المقطعي المحوسب >30.00 أو لا توجد إشارة ملحوظة؛ وينبغي أن تقدم عناصر التحكم الإيجابية منحنيات على شكل حرف S في جميع قنوات الكشف بقيم التصوير المقطعي المحوسب ≤ 00.30. يجب استيفاء هذه الشروط في نفس التجربة. خلاف ذلك ، سيتم اعتبار الاختبار غير صالح ويجب إعادة اختباره. لاحظ أنه نظرا لقيود الملكية التجارية ، لا يمكن تقديم معلومات عن تسلسل التمهيدي والمسبار في هذه الورقة.
في دراسة سابقة ، استخدم الباحثون منهجية مماثلة لتلك المستخدمة في هذه الورقة ، مما يدل على أن اختبار RT-PCR لعدوى الملوية البوابية في عينات البراز أظهر أداء تشخيصيا استثنائيا24. على وجه التحديد ، حقق الاختبار حساسية بنسبة 99.1٪ ، وخصوصية 100٪ ، ودقة تشخيصية بنسبة 99.1٪ ، والتي تتماشى بشكل وثيق مع نتائج عينات خزعة المعدة (93.9٪) (Kappa = 0.929 ، ص < 0.001). أكد هذا الاتفاق الرائع أن اختبار RT-PCR يمكن اعتباره طريقة غير جراحية موثوقة للغاية.
علاوة على ذلك ، قيمت الدراسة أيضا قدرة RT-PCR البرازي في الكشف عن مقاومة المضادات الحيوية في الملوية البوابية ، مع التركيز بشكل خاص على مقاومة كلاريثرومايسين والليفوفلوكساسين. بالنسبة لمقاومة كلاريثرومايسين ، تم تحديد 43 حالة (37.3٪) في عينات البراز ، بحساسية 79.6٪ ، وخصوصية 98.4٪ ، ودقة تشخيصية 78.0٪ (Kappa = 0.788 ، ص < 0.001). وبالمثل ، بالنسبة لمقاومة الليفوفلوكساسين ، تم الكشف عن 37 حالة (32.1٪) ، مما أسفر عن حساسية 86.3٪ ، وخصوصية 91.1٪ ، ودقة تشخيصية 74.4٪ (Kappa = 0.739 ، ص < 0.001). كانت هذه النتائج متسقة للغاية مع تلك المستمدة من عينات خزعة المعدة (مقاومة كلاريثرومايسين في 54 حالة، ومقاومة الليفوفلوكساسين في 36 حالة)، مما يشير إلى أن اختبار RT-PCR البرازي فعال في الكشف عن مقاومة المضادات الحيوية، ويمتذل خصوصية عالية وحساسية مقبولة لكل من المضادات الحيوية. ويدعم التحقق من صحة هذه المنهجية في الدراسة السابقة موثوقيتها وقابليتها للتطبيق في سياق هذه الورقة.
في حين أن بروتوكول الكشف عن البراز القائم على qPCR يمثل تقدما ملحوظا في مجال التشخيص غير الجراحي للملوية البوابية ، فإن العديد من القيود تتطلب دراسة دقيقة. أولا ، استخدام عينات البراز يجعل الطريقة تتأثر بجودة العينة. قد تنجم السلبيات الكاذبة عن انخفاض الأحمال البكتيرية في البراز ، خاصة في الناقلات التي لا تظهر عليها أعراض أو المرضى الذين يعانون من عدوى في مرحلة مبكرة ، حيث يكون تساقط الملوية البوابية في الجهاز الهضميمتقطعا 25. علاوة على ذلك ، عند أخذ عينات البراز ، يمكن أن تختلف كمية البكتيريا اعتمادا على مكان أخذ العينة. يتناقض هذا بشكل ملحوظ مع الطرق الغازية ، مثل زراعة خزعة المعدة ، التي تأخذ عينات مباشرة من الغشاء المخاطي في المعدة وبالتالي فهي أقل تأثرا بالتقلبات في الحمل البكتيري. ثانيا ، على الرغم من أن نهج التضخيم المستهدف للبروتوكول محدد ، إلا أنه قد يفشل في اكتشاف طفرات المقاومة النادرة أو الناشئة التي لم يتم دمجها في تصميم التمهيدي ، مما قد يؤدي إلى ملفات تعريف مقاومة غير مكتملة26.
يجب أن تركز الأبحاث المستقبلية على التطورات المنهجية لتعزيز قدرات الكشف عن الطفرات ، بما في ذلك اعتماد تفاعل البوليميراز المتسلسل الرقمي (dPCR) لتحسين تحديد طفرات المقاومة منخفضةالوفرة 27. تتطلب لوحات التحقيق توسعا استراتيجيا لتشمل تعدد الأشكال ذات الصلة سريريا. يوفر إجراء دراسات متعددة المراكز لتقييم منهجيات التشخيص بشكل مقارن - بما في ذلك UBT ، واختبار تفاعل البوليميراز المتسلسل في الغشاء المخاطي في المعدة أو البراز ، واكتشاف المستضد - بيانات أداء تشخيصية شاملة للممارسة السريرية ، وبالتالي تعزيز توحيد بروتوكولات اختبار PCR في البراز. من شأن هذه التحسينات مجتمعة أن تعزز فائدة qPCR في البراز كأداة تشخيصية غير جراحية ، بينما لا تزال مهمة لتوجيه العلاج الدقيق بالمضادات الحيوية.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح متنافسة.
Acknowledgements
تم تمويل هذه الدراسة من قبل مؤسسة أبحاث المواهب المتقدمة التابعة لمستشفى مقاطعة قوانغدونغ الشعبية [رقم المنحة. KY012023293]. تم دعم هذا العمل من قبل شركة Jiangsu Mole Bioscience Co. لم يكن للممولين أي دور في تصميم الدراسة أو جمع البيانات وتحليلها أو قرار النشر أو إعداد المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| BSC-1500IIA2-X | BIOBASE | SEDA 20143222263 | Biosafety cabinet |
| Disposable fecal collection and storage tube | Mole | Collect fecal specimens | |
| E-Centrifuge | WEALTEC | Centrifuge the residual liquid off the wall of the tube | |
| Helicobacter pylori nucleic acid, clarithromycin, and quinolone resistance mutation detection kit | Mole | Detection of Helicobacter pylori infection and antibiotic resistance; freeze-dried H. pylori reagent (containing primers, probes, Taq polymerase, UNG enzyme, dNTPs, etc.), a positive control for H. pylori (containing Helicobacter pylori and human β-actin target genes), and a negative control for H. pylori (containing human β-actin target genes) | |
| Mole 96M automated nucleic acid extractor | Mole | For DNA extraction | |
| Nucleic acid extraction kit | Mole | To extract nucleic acid; contains lysis buffer (guanidine salt, tris hydroxymethyl aminomethane, Tween-20, sodium chloride), Wash Buffer 1 (sodium chloride), Wash Buffer 2 (tris hydroxymethyl aminomethane, Tween-20), Wash Buffer 3 (magnetic beads, Tween-20), Wash Buffer 4 (nuclease-free water), and Elution Buffer (tris hydroxymethyl aminomethane), along with a magnetic rack | |
| SLAN Fully automatic medical PCR analysis system | HONGSHI | Data Analysis | |
| SLAN-96S Real-Time PCR machine | HONGSHI | Fluorescent quantitative PCR amplification | |
| Ultra-low temperature freezers (DW-YL450) | MELING | SEDA 20172220091 | -20 °C for storing reagents |
| Vortex-5 | Kylin-bell | For mixing reagent |
References
- Yuan, C., et al. The global prevalence of and factors associated with Helicobacter pylori infection in children: a systematic review and meta-analysis. Lancet Child Adolesc Health. 6 (3), 185-194 (2022).
- Watari, J., et al. Helicobacter pylori associated chronic gastritis, clinical syndromes, precancerous lesions, and pathogenesis of gastric cancer development. World J Gastroenterol. 20 (18), 5461-5473 (2014).
- Yu, Y., et al. Global primary antibiotic resistance rate of Helicobacter pylori in recent 10 years: A systematic review and meta-analysis. Helicobacter. 29 (3), e13103 (2024).
- Wang, L., et al. cross-sectional surveillance of Helicobacter pylori prevalence and antibiotic resistance to clarithromycin and levofloxacin in urban China using the string test coupled with quantitative PCR. Lancet Microbe. 5 (6), e512-e513 (2024).
- Ho, J. J. C., Navarro, M., Sawyer, K., Elfanagely, Y., Moss, S. F. Helicobacter pylori antibiotic resistance in the United States between 2011 and 2021: A systematic review and meta-analysis. American J Gastroenterol. 117 (8), 1221-1230 (2022).
- Megraud, F., et al. Helicobacter pylori resistance to antibiotics in Europe in 2018 and its relationship to antibiotic consumption in the community. Gut. 70 (10), 1815-1822 (2021).
- Guevara, B., Cogdill, A. G. Helicobacter pylori: A review of current diagnostic and management strategies. Dig Dis Sci. 65 (7), 1917-1931 (2020).
- Rotimi, O., Cairns, A., Gray, S., Moayyedi, P., Dixon, M. F. Histological identification of Helicobacter pylori: Comparison of staining methods. J Clin Pathol. 53 (10), 756-759 (2000).
- Lim, L. L., Ho, K. Y., Ho, B., Salto-Tellez, M. Effect of biopsies on sensitivity and specificity of ultra-rapid urease test for detection of Helicobacter pylori infection: A prospective evaluation. World J Gastroenterol. 10 (13), 1907-1910 (2004).
- Hortelano, I., Moreno, Y., Vesga, F. J., Ferrús, M. A. Evaluation of different culture media for detection and quantification of H. pylori in environmental and clinical samples. Int Microbiol. 23 (4), 481-487 (2020).
- Wang, Y. K., et al. Diagnosis of Helicobacter pylori infection: Current options and developments. World J Gastroenterol. 21 (40), 11221-11235 (2015).
- Gisbert, J. P., Pajares, J. M. Review article: 13C-Urea breath test in the diagnosis of Helicobacter pylori infection -- a critical review. Aliment Pharmacol Ther. 20 (10), 1001-1017 (2004).
- Laheij, R. J., Straatman, H., Jansen, J. B., Verbeek, A. L. Evaluation of commercially available Helicobacter pylori serology kits: A review. J Clin Microbiol. 36 (10), 2803-2809 (1998).
- Gisbert, J. P., Pajares, J. M. Stool antigen test for the diagnosis of Helicobacter pylori infection: A systematic review. Helicobacter. 9 (4), 347-368 (2004).
- Benigno, T. G. D. S., et al. pylori primary strains and virulence genotypes in the Northeastern region of Brazil. Rev Inst Med Trop Sao Paulo. 64, e47 (2022).
- Savoldi, A., Carrara, E., Graham, D. Y., Conti, M., Tacconelli, E. Prevalence of antibiotic resistance in Helicobacter pylori: A systematic review and meta-analysis in World Health Organization regions. Gastroenterology. 155 (5), 1372-1382.e17 (2018).
- Kalach, N., et al. Usefulness of gastric biopsy-based real-time polymerase chain reaction for the diagnosis of Helicobacter pylori infection in children. J Pediatr Gastroenterol Nutr. 61 (3), 307-312 (2015).
- Han, X., et al. Quantitative PCR of string-test collected gastric material: A feasible approach to detect Helicobacter pylori and its resistance against clarithromycin and levofloxacin for susceptibility-guided therapy. Helicobacter. 28 (4), e12985 (2023).
- Zhong, Z., et al. A retrospective study of the antibiotic-resistant phenotypes and genotypes of Helicobacter pylori strains in China. Am J Cancer Res. 11 (10), 5027-5037 (2021).
- Hussein, R. A., Al-Ouqaili, M. T. S., Majeed, Y. H. Detection of Helicobacter pylori infection by invasive and non-invasive techniques in patients with gastrointestinal diseases from Iraq: A validation study. PloS One. 16 (8), e0256393 (2021).
- Bang, C. S., Lee, J. J., Baik, G. H. Artificial intelligence for the prediction of Helicobacter pylori infection in endoscopic images: Systematic review and meta-analysis of diagnostic test accuracy. J Med Internet Res. 22 (9), e21983 (2020).
- Liu, J., et al. Rapid and multi-target genotyping of Helicobacter pylori with digital microfluidics. Biosens Bioelectron. 256, 116282 (2024).
- Liu, H., Wang, J., Hu, X., Tang, X., Zhang, C. A rapid and high-throughput Helicobacter pylori RPA-CRISPR/Cas12a-based nucleic acid detection system. Clin Chim Acta. 540, 117201 (2023).
- Fan, C. J., et al. Diagnostic accuracy of a real-time PCR assay for detection of Helicobacter pylori and resistance to clarithromycin and levofloxacin directly from stool. Eur Rev Med Pharmacol Sci. 28 (12), 3836-3840 (2024).
- Patel, S. K., Pratap, C. B., Jain, A. K., Gulati, A. K., Nath, G. Diagnosis of Helicobacter pylori: what should be the gold standard. World J Gastroenterol. 20 (36), 12847-12859 (2014).
- Celiberto, F., et al. The state of the art of molecular fecal investigations for Helicobacter pylori (H. pylori) antibiotic resistances. Int J Mol Sci. 24 (5), 4361 (2023).
- Yang, H., Hu, B. Diagnosis of Helicobacter pylori infection and recent advances. Diagnostics. 11 (8), 1305 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved