Method Article
İnsan Plazmasından Astrosit Kaynaklı Hücre Dışı Veziküllerin Zenginleştirilmesi
Bu Makalede
Özet
Bu protokol, insan plazmasından astrosit kaynaklı hücre dışı veziküllerin (ADEV'ler) zenginleştirilmesini tanımlar. EV'lerin polimer çökeltme ile ayrılmasına ve ardından ADEV'lerin ACSA-1 tabanlı immüno-yakalanmasına dayanır. ADEV'lerin analizi, sıvı biyopsi ile non-invaziv olarak yaşayan hastaların inflamatuar yolaklarındaki değişiklikleri incelemek için ipuçları sunabilir.
Özet
Hücre dışı veziküller (EV'ler), hücresel iletişim ve atıkların giderilmesi için tüm hücreler tarafından salgılanan biyolojik nanopartiküllerdir. Fizyolojik ve patolojik durumlarda diğer hücrelere etki ederek ve yüklerini onlara aktararak çok çeşitli işlevlere katılırlar. Biyosıvılardaki varlıkları göz önüne alındığında, EV'ler hastalık süreçlerini incelemek için mükemmel bir kaynağı temsil eder ve biyobelirteç keşfi için sıvı bir biyopsi olarak kabul edilebilir. EV analizinin çekici bir yönü, menşe hücrelerinin belirteçlerine dayalı olarak seçilebilmeleri ve böylece kargolarındaki belirli bir dokunun ortamını yansıtabilmeleridir. Bununla birlikte, EV izolasyon yöntemleriyle ilgili en büyük handikaplardan biri, metodolojik fikir birliklerinin ve standartlaştırılmış protokollerin olmamasıdır. Astrositler, beyinde önemli rollere sahip glial hücrelerdir. Nörodejeneratif hastalıklarda, astrosit reaktivitesi, EV kargosunun değişmesine ve anormal hücresel iletişime yol açarak hastalığın ilerlemesini kolaylaştırabilir / artırabilir. Bu nedenle, astrosit EV'lerin analizi, biyobelirteçlerin ve potansiyel hastalık hedeflerinin keşfedilmesine yol açabilir. Bu protokol, insan plazmasından astrosit türevli EV'lerin (ADEV'ler) zenginleştirilmesi için 2 aşamalı bir yöntemi tanımlar. İlk olarak, EV'ler polimer bazlı çökeltme yoluyla defibrine plazmadan zenginleştirilir. Bunu, yeniden askıya alınan EV'lerin manyetik bir alana yerleştirilmiş bir kolona yüklendiği manyetik mikro boncuklarla ACSA-1 tabanlı immüno-yakalama yoluyla ADEV'lerin zenginleştirilmesi takip eder. Manyetik olarak etiketlenmiş ACSA-1+ EV'ler sütun içinde tutulurken, diğer EV'ler içinden akar. Kolon mıknatıstan çıkarıldıktan sonra, ADEV'ler ayrıştırılır ve depolama ve analiz için hazır hale gelir. Astrosit belirteçlerinin zenginleşmesini doğrulamak için, glial fibriler asidik protein (GFAP) veya hücre içi kökenli diğer spesifik astrositik belirteçler elüatta ölçülebilir ve akış ile karşılaştırılabilir. Bu protokol, astrositle ilgili belirteçleri incelemek için bir platform olarak kullanılabilecek plazmadan ADEV'leri zenginleştirmek için kolay, zaman açısından verimli bir yöntem önermektedir.
Giriş
Hücre dışı veziküller (EV'ler), proteinleri, lipitleri ve nükleik asitleri taşıyan her tür hücre tarafından salgılanan heterojen bir membranöz nanopartikül grubudur1. Mikroveziküller (100-1000 nm), eksozomlar (30-100 nm) ve apoptotik cisimler (1000-5000 nm), menşe yerleri 2,3 ile ayırt edilen ana EV tiplerini oluşturur. EV'ler, antijen sunumu ve bağışıklık tepkileri4, reseptör geri dönüşümü, metabolit eliminasyonu5 ve hücresel iletişim6 gibi önemli fizyolojik süreçleri düzenler. Bu süreçlerin düzenlenmesi, EV hücre zarında zenginleştirilmiş proteinler ile alıcı hücrelerdeki hedefler arasında doğrudan bağlanma ve/veya kargolarının alıcı hücrenin sitoplazmasında içselleştirilmesi ve serbest bırakılması yoluyla gerçekleşebilir7. EV'ler temel hücresel işlevleri yerine getirirken, kanser ve nöroloji alanlarında patolojik bir bakış açısıyla artan bir ilgi görmüşlerdir. Gerçekten de, birkaç çalışma, EV'lerin Alzheimer hastalığı10,11 gibi nörodejeneratif hastalıklarda tümör hücresi göçünü 8,9 teşvik etmeye veya tohum toksik protein agregatlarına yardımcı olabileceğini göstermiştir.
EV'ler, menşe hücreleriyle ilgili hücre yüzeyi belirteçlerine dayalı olarak biyosıvılardan seçilebilir ve zenginleştirilebilir, böylece kargolarındaki belirli bir dokunun ortamını yansıtır 12,13,14,15,16,17,18,19,20. Ek olarak, kan, beyin omurilik sıvısı (BOS), tükürük, idrar ve anne sütündeki varlıkları göz önüne alındığında, EV'ler tanı için mükemmel, invaziv olmayan bir araçtır ve biyobelirteç keşfi için sıvı biyopsi olarak kabul edilebilir. Bu, BOS dışındaki erişilebilir sıvılarda beyin analitlerini incelemenin zorlukları göz önüne alındığında, nörolojiye özel bir ilgi alanıdır.
Astrositler, nöro-vasküler iletişimin kesişme noktasında oldukları için artan ilgi kazanmıştır21. Fizyolojik koşullar altında, kan-beyin bariyerinin korunmasından, nörotransmiterlerin geri dönüşümünden, nöronlara ve diğer glial hücrelere besin ve büyüme faktörlerinin sağlanmasından 22,23,24 ve ayrıca pro-inflamatuardan anti-enflamatuar durumlara kadar metabolik plastisiteleri göz önüne alındığında nöro-immün savunmadan sorumludurlar ve bunun tersi de geçerlidir 25,26,27. Astrositlerin düzenleyici işlevlerini yerine getirdikleri önemli bir mekanizma, EV'ler aracılığıyla iletişimdir28,29. Reaktif astrositoz, Alzheimer hastalığı,30 çoklu sistem atrofisi (MSA), ilerleyici supranükleer palsi (PSP)31 ve amyotrofik lateral skleroz (ALS)32 gibi çeşitli nörodejeneratif hastalıkların önemli bir özelliğidir. Astrosit reaktivitesi, EV kargosunun değişmesine, inflamatuar mediatörlerin salınmasına ve anormal hücresel iletişime yol açabilir, böylece patolojinin yayılmasını kolaylaştırabilir ve nörodejenerasyonayol açabilir 10,11. Bu nedenle, astrositten türetilmiş EV'leri (ADEV'ler) ve kargolarındaki değişiklikleri incelemek, nörodejeneratif süreçleri invaziv olmayan bir şekilde incelemek için çekici bir kaynaktır.
Şu anda, EV'lerin izolasyonu için her biri kendine özgü avantaj ve dezavantajlara sahip çeşitli metodolojiler mevcuttur33. İlgilenilen nihai uygulamaya bağlı olarak, belirli bir kullanım için hangi yöntemin daha uygun olduğunu düşünmek önemlidir. Nöroloji alanında ve daha spesifik olarak, astrosit çalışmalarında, polimer bazlı çökeltme ve ardından immünocapture, ağırlıklı olarak kullanılan yöntemolmuştur 12,18,19,20,34. Bununla birlikte, aynı yaklaşım uygulandığında bile, EV izolasyonu için uygulanan farklı adımlardaki çalışmalar arasında heterojenlik devam etmektedir. Bu nedenle, astrosit EV çalışmalarını ve tekrarlanabilirliği incelemek için açık, adım adım standartlaştırılmış bir metodolojiye ihtiyaç vardır. Polimer bazlı çökeltme, karmaşık ekipman gerektirmeyen hızlı ve basit bir prosedür olduğu için biyobelirteç taramasını kolaylaştırır ve biyolojik aktivitelerini etkilemeden yüksek EV verimine yol açar35.
Mevcut protokol, ADEV'lerin insan plazmasından zenginleştirilmesi için ayrıntılı, basit, iki aşamalı bir yöntemi tanımlamaktadır. Toplam EV fraksiyonunun polimer bazlı bir çökeltilmesine ve ardından astrosit EV'lerin immüno-yakalanmasına dayanır. Astrositlerin önemli işlevleri göz önüne alındığında, ADEV'lerin analizi, invaziv olmayan bir şekilde incelenebilecek biyobelirteçlerin ve beyin inflamatuar yollarının keşfi için ışık tutabilir.
Protokol
Bu protokolde açıklanan araştırma, Sant Pau Nörodejenerasyon Girişimi (SPIN) kohortundan, Barselona, İspanya'dan her iki cinsiyetten sağlıklı yetişkin donörlerden (yaş aralığı 65.9-81.3 yıl, %45.5 kadın) alınan insan plazma örnekleri ile gerçekleştirilmiştir36. Katılımcılar bilgilendirilmiş onam verdiler. Çalışma, Helsinki Bildirgesi'nde yer alan tıbbi araştırmalar için uluslararası etik yönergeler ve İspanyol yasalarına uygun olarak yürütülmüştür. Sant Pau Araştırma Etik Komitesi (CEIC), SPIN kohortundan insan plazma örneklerinin toplanması ve saklanması için protokolü gözden geçirdi ve onayladı (#16/2013).
1. Astrosit EV'lerin insan plazmasından zenginleştirilmesi
NOT: Bu protokol, insan plazma örneklerinin kullanımını içerir. Bu protokolde kullanılan reaktifler ve laboratuvar materyali ile ilgili tüm detaylar Malzeme Tablosunda yer almaktadır. Bu prosedür için özel bir ekipman gerekmez, ancak lütfen her üretici tarafından ayrı ayrı belirtildiği şekilde her bir reaktifin güvenlik hususlarını gözden geçirin.
- Numune toplama ve saklama
- Plazma toplanması için standartlaştırılmış protokolleri izleyerek lavanta EDTA vakutainer tüplerinde kan toplayın36,37. Plazma ayırma için toplandıktan sonra 30-120 dakika içinde 4 ° C'de 10 dakika boyunca 2000 x g'da santrifüjleyin. Süpernatan olarak görünen üst berrak sıvı olan plazmayı 500 μL'lik alikotlarda ayırın.
- Hücre kalıntılarını temizlemek için, alikotları oda sıcaklığında 15 dakika boyunca 3000 x g'da santrifüjleyin. Süpernatanı kurtarın. Plazmayı analize kadar -80 °C'de saklayın. Biyoakışkan analizlerinde yaygın bir uygulama olduğu gibi, numuneleri depolamadan önce ayırın ve üçten fazla donma-çözülme döngüsünden kaçının.
- Toplam EV zenginleştirme
NOT: Kullanılan tüm reaktifler 0,22 μm'lik bir filtreden filtrelenmelidir.- 500 μL plazma örneğini çözün. Pıhtılaşma faktörlerini gidermek için 1:100 oranında trombin ekleyin. Üç kez ters çevirerek karıştırın ve oda sıcaklığında 5 dakika bekletin.
- Dulbecco'nun fosfat tamponlu salin (DPBS) çalışma solüsyonu ile hacmi 1 mL'ye ulaşacak şekilde tamamlayın: DPBS + 3x konsantre proteaz inhibitörü kokteyli (10x proteaz inhibitörü kokteyl stoğundan seyreltilmiş). Ters çevirerek karıştırın.
- Numuneleri 6000 x g'da 4 °C'de 20 dakika santrifüjleyin. Süpernatanı kurtarın. 1 mL'ye ulaşmak için hacmi DBPS çalışma solüsyonu ile tamamlayın.
- 252 μL EV çökeltme çözeltisi ekleyin ve üç kez ters çevirerek karıştırın. 4 °C'de 60 dakika inkübe edin.
- Toplam EV fraksiyonunu (pelet) çökeltmek için numuneleri 1500 x g'da 20 ° C'de 4 dakika santrifüjleyin. Süpernatanın 1 mL'sini toplayın. EV zenginleştirme belirteçlerinin (EV yok) negatif kontrolü olarak kullanmak için fraksiyonu EV tükenmiş plazma olarak etiketleyin ve -80 °C'de saklayın.
- Kalan peleti 1500 x g'da 4 °C'de 5 dakika santrifüjleyin. Kalan süpernatanı atın. Pelet, konsantre proteaz ve fosfataz inhibitörleri içeren 500 μL ultra saf su içinde yeniden süspanse edin (nihai konsantrasyon 3x, 100x'lik bir stoktan seyreltilmiş, Malzeme Tablosuna bakınız).
- Köpürmeyi önleyerek peleti gevşetmek için kuvvetlice yukarı ve aşağı pipetleyin; Tamamen yeniden süspansiyon olana kadar oda sıcaklığında 30 dakika boyunca döner bir tüp çalkalayıcı üzerinde girdap yapın ve çalkalayın. Pelet resüspanitasyonunun tam olduğundan emin olun, çünkü bu, sonraki immünocapture adımı için kritik bir adımdır.
- ADEV'lerin İmmün Yakalama
NOT: ADEV'ler astrosit işaretleyicileri taşır. İmmünoyakalama yoluyla ADEV zenginleştirmesi için seçilen belirteç GLAST'tır. Glutamat-aspartat taşıyıcı (UniProtKB-P43003) anlamına gelen GLAST, ağırlıklı olarak beyincik ve serebral neokorteksteki astrositler tarafından eksprese edilen en bol glutamat taşıyıcısıdır38. Anti-GLAST (ACSA-1, astrosit hücre yüzeyi antijeni-1) antikoru, LAST'ın hücre dışı bir epitopu için spesifiktir ve astrositlerin tanımlanması için geliştirilmiştir. İnsan plazmasından ADEV'lerin immüno-yakalanması için en yaygın kullanılan hedeftir 12,20,34.- Toplam EV preparatını içeren her numuneye 10 μL anti-GLAST (ACSA-1) biyotinile antikor ekleyin. İyice ve yavaşça karıştırın. Döner bir tüp çalkalayıcı üzerinde 4 ° C'de 1 saat inkübe edin.
- Monoklonal anti-biyotin antikorlarına (fare IgG1) konjuge 10 μL manyetik mikroboncuk ekleyin. İyice ve yavaşça karıştırın. Döner bir tüp çalkalayıcı üzerinde 4 ° C'de 1 saat inkübe edin.
- Bir MACS ayırıcının manyetik alanına bir mikro sütun yerleştirin. Kolonu 500 μL PBS-0.5% sığır serum albümini (BSA) ile durulayarak hazırlayın. Akışı atın.
- EV/ACSA-1/mikro boncuk süspansiyonunu kolona yükleyin. Bu adımda piston ile itmeyin. Akışı toplayın. Bunu astrositik olmayan EV'ler (ADEV Yok) olarak etiketleyin ve gerekirse kontrol olarak saklayın.
- Kolonu 500 μL PBS-0.5% BSA ile iki kez yıkayın. Akışı atın.
- Kolonu manyetik ayırıcıdan çıkarın ve düşük yapışma özelliğine sahip 1,5 mL'lik bir toplama tüpüne yerleştirin. Kolona 500 μL PBS-%0,5 BSA pipetleyin. Bir piston ile kolona sıkıca itin ve elüatı toplayın.
- ACSA-1+ EV'ler (ADEV'ler) olarak etiketleyin. Parçalanmamış EV'leri kısa süreler için -20 °C'de veya daha uzun süreler (>6 ay) için -80 °C'de saklayın.
NOT: Anti-ACSA-1 antikorları GLAST-1/EAAT-1 epitopuna bağlanacaktır. Manyetik mikro boncuklar, anti-ACSA-1-EV kompleksine afinite ile bağlanacaktır. MACS mikro kolonları, etiketli ADEV'leri korumak için gerekli olan bir mıknatısa yerleştirildiğinde güçlü bir manyetik alan oluşturmak için optimize edilmiş bir matris içerir.
ADEV zenginleştirme prosedürünün şematik gösterimi için Şekil 1'e bakınız.
- EV'lerin Parçalanması
NOT: İntraveziküler belirteçlerin tespiti için EV'lerin tamamen parçalanması gerekir. Kimyasal ve ardından mekanik lizis gibi iki ardışık yöntemin kullanılması önerilir.- 150 μL ekstraksiyon reaktifi başına 100 μL numune oranında protein ekstraksiyon reaktifi ( Malzeme Tablosuna bakınız) ekleyerek EV'lerin kimyasal bir lizisini gerçekleştirin. 1x nihai konsantrasyona ulaşmak için 100x proteaz ve fosfataz inhibitörleri ekleyin. Kuvvetlice girdap yapın ve oda sıcaklığında 15 dakika bekletin.
- İki aşamalı bir prosedürle mekanik bir parçalama gerçekleştirin: kimyasal olarak parçalanan EV solüsyonunu bir şırıngadan iki kez geçirin (G29 iğnesi). Ardından, numuneleri ultrasonik soğuk su banyosunda 45 saniye boyunca sonikleştirin. Parçalanmış EV'leri -80 °C'de dondurun.
- Numuneleri 37 °C'de 5 dakika çözdürün. Parçalanmış EV'lerin depolanması için -80 °C'de tekrar dondurun. Analizden önce 37 ° C'de 5 dakika tekrar çözdürün.

Şekil 1: Astrositten türetilmiş EV'lerin zenginleştirilmesi için iki aşamalı prosedürün şematik gösterimi. İlk adımda, EV'ler defibrine insan plazmasından polimer bazlı çökeltme ve santrifüjleme adımları ile zenginleştirilir. Total EV resüspansyonundan sonra, astrosit EV'ler daha sonra biyotinile anti-GLAST (ACSA-1) antikorları ve anti-biyotin manyetik mikroboncuklar ile immünocapture ile seçilir. Kısaltmalar: ACSA-1 = astrosit hücre yüzeyi antijeni-1; ADEV'ler = astrosit kaynaklı hücre dışı veziküller; DPBS = Dulbecco'nun fosfat tamponlu tuzlu suyu; EV'ler = hücre dışı veziküller; GLAST = glutamat-aspartat taşıyıcı; ADEV yok = astrositik olmayan hücre dışı veziküller; EV yok = Hücre dışı vezikül yok (EV tükenmiş plazma); PIC = proteaz inhibitörü kokteyli; RT = oda sıcaklığı. BioRender ile oluşturulan figür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Protokol doğrulaması
- İmmün yakalama öncesi toplam EV fraksiyonunun karakterizasyonu
- Western blot analizi için parçalanmış toplam EV'ler (polimer çökeltmeden sonra yeniden süspanse edilmiş pelet) ve seyreltilmiş plazma numuneleri kullanın. Numuneleri 4x Laemmli numune tamponu (15 μL numune için 5 μL) ile destekleyin, 90 °C'de 10 dakika kaynatın ve %10 lekesiz akrilamid jellere yükleyin.
- Tris/Glisin/SDS tamponunda 30 dakika boyunca 80 V'ta ve ardından 40 dakika boyunca 200 V'ta SDS-poliakrilamid jel elektroforezi (SDS-PAGE) gerçekleştirin. SDS-PAGE'i takiben, jeli cam plakalardan çıkarın ve 1 dakikalık bir UV uyarımından sonra toplam protein içeriğini görselleştirin.
- Proteinleri jelden metanolle aktive edilen 0.2 μm PVDF membranına 25 V, 2.5 A'da 10 dakika boyunca yarı kuru bir sistemden aktarın (ekipmanla ilgili ayrıntılar için Malzeme Tablosuna bakın). Transferden sonra, zarı oda sıcaklığında 5 dakika boyunca bloke edici tamponda bloke edin ve ardından Alix (1:1000), CD9 (1:1000) veya Calnexin'e (1:1000) karşı birincil antikorlarla gece boyunca 4 ° C'de inkübe edin; Ayrıntılar için Malzeme Tablosuna bakın.
- Membranı% 0.1 Tween 20 (TBST) ile Tris tamponlu salin içinde 10 dakika boyunca üç kez yıkayın ve bloke edici tamponda 1: 7500'de seyreltilmiş bir tavşan önleyici HRP ikincil antikoru ile oda sıcaklığında 1 saat inkübe edin. Membranı TBST'de 10 dakika boyunca dört kez yıkayın. Tüm yıkama ve inkübasyon adımlarını, zarın bir tezgah külbütörü üzerinde hafifçe çalkalanması ile gerçekleştirin.
- Kemilüminesan çözeltiyi peroksit tamponu ile 1: 1 oranında karıştırın ve zarları oda sıcaklığında 5 dakika inkübe edin. Bir kemilüminesans görüntüleme sistemi kullanarak bantları ortaya çıkarın ve elde edin (ayrıntılar için Malzeme Tablosuna bakın).
- ADEV fraksiyonunda astrosite özgü belirteçlerin zenginleştirilmesinin doğrulanması
NOT: Glial fibriler asidik protein (GFAP), astrositik hücrelerdeki ana ara filament proteinidir ve gelişim sırasında hücre iskeletlerinin önemli bir unsurudur. GFAP, iyi bilinen bir astrosit belirteci olan beyin dokusunda ve biyosıvılarda tespit edilebilir39. Bu nedenle, bu belirteç, ADEV fraksiyonundaki astrosit türevi belirteçlerin zenginleştirilmesini göstermek için ticari bir biyobelirteç algılama teknolojisi kullanılarak ölçüldü. Bu biyobelirteç teknolojisi, tek protein moleküllerinin geleneksel immünotestlerden 1.000 kat daha fazla hassasiyetle ölçülmesine izin veren ultra hassas bir tekniktir. Bu teknik, belirli hedeflere40,41 bağlanmak üzere tasarlanmış antikorlarla birleştirilmiş paramanyetik mikropartiküllerin kullanımına dayanmaktadır (bkz. Malzeme Tablosu).- Biyobelirteç analizi için parçalanmış EV numuneleri kullanın. Astrosit belirteçlerinin zenginleşmesini test etmek için, ticari bir ultra duyarlı immünolojik test kullanarak elüattaki (ADEV'ler) GFAP seviyelerini akışla (ADEV yok) karşılaştırın.
- Numuneleri 1:4 oranında seyreltin (25 μL EV + 75 μL tahlil tamponu), kalibratörleri hazırlayın ve testi, üreticinin talimatlarında belirtildiği gibi biyobelirteç tespit ekipmanında gerçekleştirin (bkz. Numuneler doğrudan plaka üzerinde seyreltilebilir.
- Numuneleri ve kalibratörleri çift olarak test edin. GFAP testi için kantifikasyon aralığı 1.37-1000 pg / mL idi. Kalibrasyon eğrisinden GFAP konsantrasyonlarını hesaplamak için üreticinin yazılım analiz platformunu kullanın.
- Astrosit belirteçlerinin zenginleştirilmesi için protokolün varyasyon katsayısını (CV) tahmin etmek için, havuzlanmış insan plazma örneklerinin aynı kopyalarından elde edilen ADEV preparatlarındaki GFAP seviyelerini ölçün ve CV'yi standart sapma / ortalama x 100 olarak hesaplayın. Bu protokolde CV, N = 10 özdeş plazma örneği kullanılarak hesaplandı.
- EV markörlerinin zenginleştirilmesinin ADEV fraksiyonunda doğrulanması
- EV belirteçlerinin zenginleştirilmesini doğrulamak için, üreticinin tavsiyelerine uygun olarak, parçalanmış seyreltilmemiş EV numunelerinde Alix ve CD81 seviyelerini ELISA ile ölçün ( Malzeme Tablosuna bakınız). Numuneleri ve kalibratörleri çift olarak test edin.
- Bir mikroplaka okuyucu kullanarak plakaları 450 nm ve 570 nm'de okuyun. Alix ve CD81 konsantrasyonlarını hesaplamak için doğrusal bir kalibrasyon eğrisi kullanın. Alix testi için kantifikasyon aralığı 47-3000 pg/mL ve CD81 için 0.156-10 ng/mL idi.
- ADEV'lerin boyut ve morfolojisinin karakterizasyonu
- Nanopartikül izleme analizi
- Taze parçalanmamış EV preparatlarının partikül konsantrasyonunu ve boyut dağılımını ölçmek için nanopartikül izleme analizini (NTA) kullanın.
- Taze, parçalanmamış ADEV süspansiyonlarını (10 μL) cihazın algılama aralığına (20-100 parçacık/çerçeve) göre filtrelenmiş PBS ile seyreltin, verilen yazılımı kullanarak, aşağıdaki ayarlarla üç adet 60 s video kaydedin: 30 au'da şırınga akış hızı, 13'te kamera seviyesi ve 5'te algılama eşiği. Giriş numunesi hacmi, EV yeniden süspansiyon hacmi ve NTA okuması için gerekli seyreltme için partikül konsantrasyonlarını düzeltin.
NOT: Matris etkisini ve EV'lerin yeniden askıya alındığı ortamın saflığını doğrulamak için EV araç çözümünü içeren bir numunenin önceden görselleştirilmesi önerilir.
- Kriyo-elektron mikroskobu
- Taze, parçalanmamış ADEV süspansiyonlarında (4 μL) EV'lerin varlığını ve morfolojisini doğrulamak için kriyo-elektron mikroskobu (Cryo-EM) kullanın. Aşağıdaki ayarlarla Holey karbon ızgaraları üzerinde ticari bir dalma dondurucu kullanarak numuneleri vitrifiye edin: 3,9 μL numune, bekleme süresi 10 s, leke süresi 2 s.
- Bir kriyo-iş istasyonunda sıvı etan-nitrojene daldırın. Transmisyon elektron mikroskobu analizi için ızgaraları -179 °C'de tutulan bir kriyo tutucuya aktarın. EV'leri 200 kV'luk bir hızlanma geriliminde çalışan ve bir CCD kamera ile donatılmış bir iletim elektron mikroskobu ile inceleyin. Yazılım kullanarak mikrograflar edinin.
- Nanopartikül izleme analizi
- Lipoprotein ko-çökeltisinin analizi
- Seyreltilmemiş plazmada, parçalanmış toplam EV örneklerinde ve parçalanmış ADEV örneklerinde insan ApoB seviyelerini, ticari bir otoanalizör için uyarlanmış ticari bir kit kullanarak bir immünotürbidimetrik testle belirleyin (daha fazla ayrıntı için Malzeme Tablosuna bakın).
- ADEV'lerde inflamatuar belirteçlerin analizi
- 25 inflamatuar markörün konsantrasyonunu ölçmek için boncuk bazlı bir test kullanın (Malzeme Tablosuna bakınız): eotaksin, IFN Alfa2, IFN Gama, IL-1 Alfa, IL-1 Beta, IL-3, IL-6, IL-8, IL-10, IL-12 (p40), IL-12 (p70), IL-15, IL-17A, IL-17E / IL-25, IL-17F, IL-18, IP-10, MCP-1, MCP-3, MDC, MIP-1 Alfa, MIP-1 Beta, TGF Alfa, TNF Alfa, TNF Beta.
- Parçalanmış seyreltilmemiş EV preparatları (25 μL) kullanın ve numuneleri, üreticinin talimatlarını izleyerek boncuklarla gece boyunca 4°C'de inkübe edin. Plakayı yıkayın, 25 μL tespit antikorları ile inkübe edin ve oda sıcaklığında çalkalama ile 1 saat inkübe edin.
- Her oyuğa 25 μL Streptavidin-PE ekleyin ve oda sıcaklığında 30 dakika inkübe edin. 150 μL kılıf sıvısı ekleyin ve çalkalama altında 5 dakika inkübe edin. Sisteme bağlı plaka okuyucudaki plakayı okuyun.
NOT: Bu teknik, floresan kaplı manyetik mikro boncukların yüzeyine bağlanan antikorların kullanıldığı immünolojik testlere dayanmaktadır. Bu teknoloji, mikro kürecikleri farklı boyalarla renklerine göre dahili olarak kodlar. Her bir mikroküre türü, belirli bir yakalama antikoru ile kaplanır, öyle ki, birden fazla konjuge boncuk, numunelere gömülü analitleri yakalar ve aynı anda düzinelerce analitin kantitatif multipleks tespitine izin verir. Sistem, sinyal algılama için boncuk tabanlı çoğullanmış immünoassay platformunu kullanır43.
3. Veri analizi
- Ticari yazılımlarla istatistiksel analizler yapın. Shapiro-Wilk testi ile veri normalliğini değerlendirin. Mann-Whitney U testi ile iki gruplu karşılaştırmaları ve Kruskal-Wallis testi ve Dunn'ın post-hoc düzeltmesi ile üç gruplu karşılaştırmaları test edin. Anlamlılığı p < 0,05 olarak ayarlayın.
Sonuçlar
Sağlıklı vericilerden toplanan plazmadan ADEV'lerin izolasyonu başarıyla gerçekleştirildi. Toplam EV fraksiyonunu elde etmek için polimer bazlı bir çökeltme yöntemi kullanıldı, ardından ADEV'leri elde etmek için manyetik mikro boncuklarla bir immüno-yakalama yapıldı.
İmmüno-yakalama adımından önce toplam EV fraksiyonunun Western blot analizi, EV preparatlarında kalneksin (hücresel kontaminasyon belirteci) eksikliğini ve Alix ve transmembran protein CD9'un varlığını gösterdi (Şekil 2A).
İmmün yakalamayı takiben, ADEV fraksiyonunda veziküler ve astrositik belirteçlerin varlığı ve zenginleşmesi doğrulandı. GFAP konsantrasyonları, ADEV'lerde ADEV fraksiyonu olmayan (akış) ile karşılaştırıldığında anlamlı olarak daha yüksekti ve altı kat zenginleşme gösterdi (p = 0.008). Bu, ADEV fraksiyonundaki EV'lerin ağırlıklı olarak astrositik kökenini doğrulamaktadır (Şekil 2B). 10 özdeş numuneden ADEV preparatları arasında GFAP miktar tayininin CV'si %25 idi.
ADEV preparatlarında veziküler belirteçlerin varlığını doğrulamak için iki belirteç incelendi: klasik bir sitozolik veziküler belirteç olan Alix42 ve transmembran protein CD8144. Alix seviyeleri, ADEV fraksiyonunda serbest plazma (p = 0.001) ve EV yok olarak adlandırılan EV tükenmiş plazma ile karşılaştırıldığında daha yüksekti (p = 0.0007; Şekil 2C). ADEV'ler ayrıca serbest plazma ile karşılaştırıldığında CD81'in zenginleşmesini gösterdi (p = 0.03; Şekil 2D).
ADEV popülasyonunu daha fazla karakterize etmek için, boyut ve sayım profili NTA ile ve morfoloji kriyo-EM ile analiz edildi. NTA analizi, küçük EV'lerin (mikro-parçacıklar ± eksozomlar) boyutuyla tutarlı olarak ortalama 93,7 2,7 nm büyüklüğünde homojen bir EV profili gösterdi. Ayrıca, kriyo-EM ile karakterizasyon, EV'lerin varlığını ve beklenen morfolojisini daha da doğruladı (Şekil 2E).
Lipoproteinlerin EV'lerle birlikte çökelebileceği göz önüne alındığında, ApoB seviyeleri farklı fraksiyonlarda analiz edildi. Sonuçlar, immünocapture adımından sonra, ADEV preparatlarında ApoB seviyelerinin minimal olduğunu, plazmada daha yüksek olduğunu göstermektedir (p = 0.005; Şekil 2F).
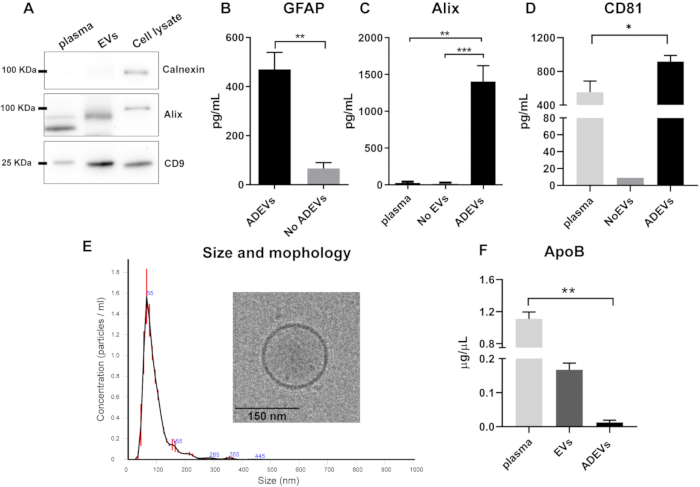
Şekil 2: Toplam EV ve ADEV fraksiyonlarının karakterizasyonu. (A) Toplam EV preparatlarında kalneksin eksikliği ve Alix ve CD9 varlığını gösteren temsili Western blot. (B) ADEV fraksiyonu, ADEV olmayanlara kıyasla daha yüksek GFAP seviyeleri gösterdi (ADEV, n = 7; ADEV yok, n = 7; p = 0.008). (C) ADEV'lerde plazma (p = 0.001) ve EV yok (p = 0.0007) ile karşılaştırıldığında daha yüksek Alix seviyeleri tespit edildi; plazma: n = 6; EV yok: n = 6; ADEVS: n = 16. (D) ADEV fraksiyonunda plazma ile karşılaştırıldığında daha yüksek CD81 seviyeleri tespit edildi (p = 0.003); Plazma: N = 5; EV yok: n = 1 (CD81, dokuz EV yok örneğinden sekizinde tespit edilemedi); ADEVS: n = 17 olur. (E) NTA analizi, medyan boyutu 93.7 ± 2.7 nm olan ve veziküler özelliği kriyo-EM ile doğrulanan partiküllerin varlığını ortaya çıkardı. (F) ApoB, ADEV fraksiyonunda plazma ile karşılaştırıldığında anlamlı olarak daha düşüktü (p = 0.005); plazma: n = 4; EV'ler: n = 4; ADEVS: n = 4 olur. Kısaltmalar: ADEV'ler = astrosit türevi hücre dışı veziküller; Alix = programlanmış hücre ölümü 6 etkileşen protein (PDCD6IP); ApoB = Apolipoprotein B; EV'ler = polimer bazlı çökeltmeden sonra toplam hücre dışı vezikül preparatları; GFAP = glial fibriler asidik protein; ADEV yok = astrositik olmayan hücre dışı veziküller; EV yok = Hücre dışı vezikül yok (EV tükenmiş plazma). (B) için iki kuyruklu Mann Whitney testi (**p < 0.01), (C,D,F) için Kluskal-Wallis ve Dunn'ın çoklu karşılaştırma testleri (*p < 0.05, **p < 0.01 ve ***p < 0.0001) kullanıldı. Grafikler ortalamayı gösterir ve hata çubukları standart hatayı gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Son olarak, bu protokolün uygulanabilirliği, inflamatuar belirteçleri ölçmek için ADEV'ler kullanılarak incelenmiştir. Paneldeki 25 inflamatuar sitokinlerin tümü, sağlıklı donörlerden elde edilen ADEV'lerde tespit edilebilir (Şekil 3).

Şekil 3. ADEV fraksiyonundaki inflamatuar sitokinlerin miktar tayini. Sağlıklı donörlerden alınan ADEV'lerde 25 inflamatuar sitokinden oluşan bir panel, hepsinin saptanabilir ve diferansiyel olarak eksprese edildiğini ortaya koydu (HC, n = 3). Grafikte ortalama, hata çubukları ise standart hatayı gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
EV'ler, teşhis ve tedavi potansiyelleri nedeniyle biyomedikal araştırmalara büyük ilgi görmüştür. Şu anda, EV izolasyon yöntemleriyle ilgili en büyük handikaplardan biri, metodolojik fikir birliği ve standartlaştırılmış protokollerin olmamasıdır. Bu çalışma, astrosit EV'lerin polimer bazlı çökeltme ve GLAST immünocapture yoluyla insan plazmasından zenginleştirilmesi için ayrıntılı bir protokol sağlar.
EV'lerin vücut sıvılarından izolasyonu için her biri kendi avantajları ve sınırlamaları olan farklı metodolojiler mevcuttur. Basitliği, kullanım kolaylığı, zaman alıcı olmaması, belirli bir alete ihtiyaç duymaması, EV veriminin yüksek olması ve nörolojide EV biyobelirteç çalışmalarında yaygın olarak kullanılmasınedeniyle polimer bazlı bir yaklaşım seçilmiştir 12,18,19,20 ve sonuçların karşılaştırılmasına olanak tanır. Bununla birlikte, boyut dışlama kromatografisi gibi alternatif yöntemler de test edilebilir. Polimer bazlı yöntemlere yönelik yaygın bir eleştiri, lipoproteinlerin EV'lerle birlikte birlikte çökeltilmesidir. Bununla birlikte, ACSA-1 antikorları ile ek immünocapture adımı ve müteakip yıkamalar, ApoB analizinde görüldüğü gibi, ADEV'lere seçici olarak bağlanarak, lipoproteinlerle kontaminasyonu en aza indirerek bu sınırlamanın üstesinden gelebilir. Kantitatif çalışmalar için bu protokolü kullanırken, özellikle küçük örneklem boyutlarında tahlil içi CV dikkate alınmalıdır. Bu prosedürün bir başka sınırlaması, minimal polimer izlerinin, kütle spektrometresi gibi belirli aşağı akış analizlerine müdahale edebilmesidir. Bu nedenle, bu protokolün sonraki analitik yöntemlerle kombinasyonu, her bir özel kullanım için test edilmelidir.
Bu çalışmada açıklanan protokol, ADEV fraksiyonundaki astrositik ve veziküler belirteçlerin zenginleştirilmesi için doğrulanmıştır. Astrosit EV immünop yakalaması, hedef olarak GLAST kullanılarak gerçekleştirildi ve ek bir astrositik belirteç olan GFAP'nin altı kat zenginleştirilmesiyle gösterildiği gibi EV'lerin astrositik kökenini doğruladı. Bu prosedür, sağlıklı yaşlı yetişkinlerin insan plazmasından ADEV zenginleştirmesi için test edilmiş ve optimize edilmiş olsa da, protokoldeki bazı adımlar, kullanılacak sonraki uygulamaya göre değiştirilebilir ve uyarlanabilir. Örneğin, sonraki immünopresipitasyon için pelet resüspansiyonu için ultra saf su kullanılması tercih edilir. Ek olarak, hem antikorun hem de manyetik boncukların inkübasyon aşaması (zaman ve konsantrasyon), ADEV'leri istenildiği gibi konsantre etmek veya seyreltmek için modifiye edilebilir.
Protokoldeki kritik adımlar, immünocapture adımından önce EV peletinin mekanik olarak yeniden askıya alınmasını içerir. Peletlenmiş EV'ler, yeniden süspansiyon sırasında köpürmeyi önleyerek çok dikkatli bir şekilde işlenmelidir. Plazmada bulunan aktif proteazları inhibe etmek için tamponlarda 3x konsantre proteaz inhibitörlerinin kullanımına da dikkat edilmelidir. Ayrıca, kolonda tutulan ADEV'lerin elüsyonundan önce piston ile kolona adım adım itilmemesi çok önemlidir.
Alzheimer hastalığı ve travmatik beyin hasarı olan bireylerden ADEV'leri izole etmek için bu yaklaşımı (polimer bazlı çökeltme + immünopresipitasyon) kullanan çalışmalar olsa da 12,20,34, ADEV'ler diğer hücre kökenlerinden (örneğin nöronlar) EV'ler açısından yeterince araştırılmamıştır ve daha fazla araştırmayı hak etmektedir.
Alzheimer hastalığı ve Down sendromu gibi bazı nörodejeneratif hastalıklar, endozomal anormallikler ve artmış EV sekresyonu ile ilişkilendirilmiştir 45,46,47. Daha yüksek EV sekresyonunu hesaba katmanın bir yolu, bu çalışmada yapıldığı gibi Alix ve CD81 gibi bir EV markörünün veya ilgilenilen analitin seviyelerini normalleştirmek için CD63 veya CD9 gibi diğer tetraspaninlerin seviyelerini ölçmektir. Astrositik ve EV belirteçlerinin zenginleştirilmesini doğrulamanın yanı sıra, protokolün ADEV'lerdeki inflamatuar sitokinleri ölçmek için faydası test edildi. Multipleks bir platform kullanılarak, ADEV fraksiyonunda 25 sitokin ve kemokinin saptanabilir ve kantitatif konsantrasyonları elde edildi.
Bu nedenle, bu prosedür, bir biyobelirteç keşif platformu olarak kullanılabilecek EV'lerin yanı sıra astrosit ile ilgili moleküler mekanizmaların ve yolların incelenmesi için invaziv olmayan bir aracın toplanmasına izin verir. Gerçekten de, ADEV'lerin incelenmesi nörolojik hastalıklar alanlarında büyük bir potansiyele sahiptir, çünkü ADEV kargosu astrosit fenotipini ve farklı hastalık aşamaları boyunca değişiklikleri keşfetmek için bir kaynak olarak kullanılabilir.
Bu makale metodolojiyi kapsamlı bir şekilde açıklarken, bu yöntemin avantajlarını ve sınırlamalarını ve uygun uygulanabilirliği göz önünde bulundurmak önemlidir. Gerçekten de, EV alanında, Uluslararası Hücre Dışı Veziküller Derneği'nin (International Society for Extracellular Veziküller)48 MISEV kılavuzlarında belirtilen kapsamlı araştırma önerileri ve doğrulama adımları ve EV çalışmaları hakkında metodolojik bilgilerin raporlanması için EV izleme platformu49 gibi önemli standardizasyon çabaları bulunmaktadır.
Açıklamalar
Dr. Belbin, gönderilen çalışmanın dışında ADx NeuroSciences'tan kişisel ücretler aldığını bildirdi. Dr. Alcolea, sunulan çalışmanın dışında Fujirebio-Europe, Roche, Nurtricia, Krka Farmacéutica, Zambon S.A.U. ve Esteve'den danışma kurulu hizmetleri ve/veya onursal konuşmacı için kişisel ücretler aldığını bildirdi. Dr. Lleó, sunulan çalışmanın dışında Fujirebio-Europe, Roche, Biogen, Grifols ve Nutricia için danışman olarak veya danışma kurullarında görev yapmıştır. Dr. Fortea, sunulan çalışmanın dışında AC Immune, Novartis, Lundbeck, Roche, Fujirebio ve Biogen'den danışma kurullarında, yargı komitelerinde veya konuşmacı onurlarında hizmet için kişisel ücretler aldığını bildirdi. Dr. Alcolea, Belbin, LLeó ve Dr. Fortea, nörodejeneratif hastalıkta sinaptopati belirteçleri için bir patente sahip olduklarını bildirmektedir (ADx, EPI8382175.0 lisanslıdır). Başka bir açıklama bildirilmedi. Diğer tüm yazarların ifşa edecek başka bir şeyi yoktur.
Teşekkürler
Yazarlar, numune işleme ve hazırlama konusunda Soraya Torres, Shaimaa El Bounasri El Bennadi ve Oriol Sanchez Lopez'in yardımlarına teşekkür etmek isterler. Ayrıca, Barselona Malzeme Bilimi Enstitüsü ICTS "NANBIOSIS", ünite 6'dan (Biyoing, Biyomalzemeler ve Nanotıpta CIBER Birimi) José Amable Bernabé, Universitat Autonoma de Barcelona'daki Elektron Mikroskobu Birimi'nden Marti de Cabo Jaume, Sant Pau Biyomedikal Araştırma Enstitüsü (IIB-Sant Pau) Akış Sitometrisi Platformu'ndan Dr. Marta Soler Castany ve Lia Ros Blanco'nun işbirliğini de takdir etmek isteriz. ayrıca IIB-Sant Pau'daki lipid ile ilişkili hastalıkların patofizyolojisi grubundan Dr. Joan Carles Escolà-Gil, sırasıyla NTA, cryo-EM, Luminex ve ApoB tayinlerinde yardım için.
Yazarlar, Jérôme Lejeune Vakfı'ndan (Proje #1941 ve #1913'ten MFI ve MCI'ye), Instituto de Salud Carlos III'ten (PI20/01473'ten JF'ye, PI20/01330'dan AL'ye, PI18/00435'ten DA'ya ve INT19/00016'dan DA'ya), Ulusal Sağlık Enstitüsü'nden (1R01AG056850-01A1, R21AG056974 ve JF'ye R01AG061566), Alzheimer Derneği ve Küresel Beyin Sağlığı Enstitüsü'nden (GBHI_ALZ-18-543740'tan MCI'ye), Frontotemporal Dejenerasyon Derneği (Klinik Araştırma Doktora Sonrası Bursu, AFTD 2019–2021) ODI'ye ve Societat Catalana de Neurologia'ya (Premi Beca Fundació SCN 2020'den MCI'ye). Bu çalışma aynı zamanda CIBERNED programı (Program 1, Alzheimer Hastalığından AL'ye ve SIGNAL çalışması) tarafından da desteklenmiştir. SS, Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España) tarafından "Juan de la Cierva-Incorporación" (IJC2019-038962-I) Doktora Sonrası hibesi almıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
Referanslar
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır