Method Article
إثراء الحويصلات خارج الخلية المشتقة من الخلايا النجمية من البلازما البشرية
In This Article
Summary
يصف هذا البروتوكول إثراء الحويصلات خارج الخلية المشتقة من الخلايا النجمية (ADEVs) من البلازما البشرية. يعتمد على فصل المركبات الكهربائية عن طريق ترسيب البوليمر ، يليه الالتقاط المناعي القائم على ACSA-1 ل ADEVs. قد يقدم تحليل ADEVs أدلة لدراسة التغيرات في المسارات الالتهابية للمرضى الأحياء ، بشكل غير جراحي عن طريق الخزعة السائلة.
Abstract
الحويصلات خارج الخلية (EVs) هي جسيمات نانوية بيولوجية تفرزها جميع الخلايا للاتصال الخلوي والتخلص من النفايات. يشاركون في مجموعة واسعة من الوظائف من خلال العمل على شحناتهم ونقلها إلى خلايا أخرى في الظروف الفسيولوجية والمرضية. نظرا لوجودها في السوائل الحيوية ، تمثل المركبات الكهربائية مصدرا ممتازا لدراسة عمليات المرض ويمكن اعتبارها خزعة سائلة لاكتشاف المؤشرات الحيوية. يتمثل أحد الجوانب الجذابة في تحليل EV في أنه يمكن اختيارها بناء على علامات خليتها الأصلية ، مما يعكس بيئة نسيج معين في حمولتها. ومع ذلك ، فإن أحد المعوقات الرئيسية المتعلقة بطرق عزل المركبات الكهربائية هو عدم وجود إجماعات منهجية وبروتوكولات موحدة. الخلايا النجمية هي خلايا دبقية لها أدوار أساسية في الدماغ. في الأمراض التنكسية العصبية ، قد يؤدي تفاعل الخلايا النجمية إلى تغيير شحنة EV والاتصال الخلوي الشاذ ، مما يسهل / يعزز تطور المرض. وبالتالي ، قد يؤدي تحليل الخلايا النجمية EVs إلى اكتشاف المؤشرات الحيوية والأهداف المحتملة للأمراض. يصف هذا البروتوكول طريقة من خطوتين لإثراء المركبات الكهربائية المشتقة من الخلايا النجمية (ADEVs) من البلازما البشرية. أولا ، يتم إثراء المركبات الكهربائية من البلازما منزوعة التيجن عن طريق الترسيب القائم على البوليمر. يتبع ذلك إثراء ADEVs من خلال التقاط المناعة المستند إلى ACSA-1 بالخرز الدقيق المغناطيسي ، حيث يتم تحميل المركبات الكهربائية المعلقة على عمود يوضع في مجال مغناطيسي. يتم الاحتفاظ بالمركبات الكهربائية ACSA-1+ المصنفة مغناطيسيا داخل العمود ، بينما تتدفق المركبات الكهربائية الأخرى من خلاله. بمجرد إزالة العمود من المغناطيس ، يتم مسح ADEVs وتكون جاهزة للتخزين والتحليل. للتحقق من صحة إثراء علامات الخلايا النجمية ، يمكن قياس البروتين الحمضي الليفي الدبقي (GFAP) ، أو غيرها من العلامات الفلكية المحددة ذات الأصل داخل الخلايا ، في التمطيخ ومقارنته بالتدفق. يقترح هذا البروتوكول طريقة سهلة وفعالة من حيث الوقت لإثراء ADEVs من البلازما والتي يمكن استخدامها كمنصة لفحص العلامات ذات الصلة بالخلايا النجمية.
Introduction
الحويصلات خارج الخلية (EVs) هي مجموعة غير متجانسة من الجسيمات النانوية الغشائية التي تفرزها جميع أنواع الخلايا ، وتحمل البروتينات والدهون والأحماض النووية1. تشكل الحويصلات الدقيقة (100-1000 نانومتر) ، والإكسوسومات (30-100 نانومتر) ، والأجسام موت الخلايا المبرمج (1000-5000 نانومتر) أنواع المركبات الكهربائية الرئيسية ، كما تتميز بموقعها الأصلي2،3. تنظم المركبات الكهربائية العمليات الفسيولوجية المهمة ، مثل عرض المستضد والاستجابات المناعية4 ، وإعادة تدوير المستقبلات ، والتخلص من المستقلب5 ، والاتصال الخلوي6. قد يحدث تنظيم هذه العمليات عن طريق الارتباط المباشر بين البروتينات المخصبة في غشاء الخلية EV والأهداف في الخلايا المتلقية ، و / أو من خلال استيعاب وإطلاق حمولتها في سيتوبلازم الخليةالمتلقية 7. بينما تؤدي المركبات الكهربائية وظائف خلوية أساسية ، فقد اكتسبت اهتماما متزايدا من منظور مرضي في مجالات السرطان وعلم الأعصاب. في الواقع ، أظهرت العديد من الدراسات أن المركبات الكهربائية يمكن أن تساعد في تعزيز هجرة الخلايا السرطانية8،9 أو مجاميع البروتين السامة للبذور في الأمراض التنكسية العصبية ، مثل مرض الزهايمر10،11.
يمكن اختيار المركبات الكهربائية وإثرائها من السوائل الحيوية بناء على علامات سطح الخلية المتعلقة بخليتها الأصلية ، مما يعكس بيئة نسيج معين في حمولتها12،13،14،15،16،17،18،19،20. بالإضافة إلى ذلك ، نظرا لوجودها في الدم والسائل الدماغي النخاعي (CSF) واللعاب والبول وحليب الثدي ، تمثل المركبات الكهربائية أداة ممتازة وغير جراحية للتشخيص ، ويمكن اعتبارها خزعة سائلة لاكتشاف المؤشرات الحيوية. هذا له أهمية خاصة في علم الأعصاب ، نظرا لصعوبات دراسة تحليلات الدماغ في السوائل التي يمكن الوصول إليها بخلاف السائل الدماغي النخاعي.
اكتسبت الخلايا النجمية اهتماما متزايدا ، لأنها عند تقاطع الاتصال العصبيالوعائي 21. في ظل الظروف الفسيولوجية ، فهي مسؤولة عن الحفاظ على الحاجز الدموي الدماغي ، وإعادة تدوير الناقلات العصبية ، وإمداد العناصر الغذائية وعوامل النمو للخلايا العصبية والخلايا الدبقيةالأخرى 22،23،24 بالإضافة إلى الدفاع المناعي العصبي ، نظرا لمرونة التمثيل الغذائي من الحالات المؤيدة للالتهابات إلى الحالات المضادة للالتهابات والعكس صحيح25،26،27. تتمثل إحدى الآليات المهمة التي تنجز بها الخلايا النجمية وظائفها التنظيمية في الاتصال من خلال المركبات الكهربائية28،29. يعد التقام النجمي التفاعلي سمة مميزة رئيسية للعديد من الأمراض التنكسية العصبية ، مثل مرض الزهايمر ،30 ضمور الجهاز المتعدد (MSA) ، والشلل فوق النووي التقدمي (PSP) 31 ، والتصلب الجانبي الضموري (ALS) 32. قد يؤدي تفاعل الخلايا النجمية إلى تغيير شحنة EV ، وإطلاق وسطاء التهابيين ، واتصال خلوي شاذ ، مما يسهل انتشار علم الأمراض ويؤدي إلى التنكس العصبي10،11. لذلك ، فإن دراسة المركبات الكهربائية المشتقة من الخلايا النجمية (ADEVs) والتغيرات في حمولتها هي مورد جذاب لفحص العمليات التنكسية العصبية بطريقة غير جراحية.
حاليا ، توجد العديد من المنهجيات لعزل المركبات الكهربائية ، ولكل منها مزاياها وعيوبهاالمقابلة 33. من الضروري النظر في الطريقة الأكثر ملاءمة لاستخدام معين ، اعتمادا على التطبيق النهائي محل الاهتمام. في مجال علم الأعصاب ، وبشكل أكثر تحديدا ، في دراسات الخلايا النجمية ، كان الترسيب القائم على البوليمر متبوعا بالالتقاط المناعي هو الطريقة المستخدمة فيالغالب 12،18،19،20،34. ومع ذلك ، حتى عند تطبيق نفس النهج ، لا يزال هناك عدم تجانس بين الدراسات في الخطوات المختلفة المطبقة لعزل المركبات الكهربائية. لذلك ، هناك حاجة إلى منهجية موحدة واضحة خطوة بخطوة لتسهيل دراسات الخلايا النجمية EV ودراسة قابلية التكاثر. يسهل هطول الأمطار القائم على البوليمر فحص المؤشرات الحيوية نظرا لأنه إجراء سريع وبسيط لا يتطلب معدات معقدة ، مما يؤدي إلى إنتاجية عالية من المركبات الكهربائية دون التأثير على نشاطها البيولوجي35.
يصف البروتوكول الحالي طريقة مفصلة وبسيطة من خطوتين لإثراء ADEVs من البلازما البشرية. يعتمد على ترسيب قائم على البوليمر لإجمالي جزء EV ، متبوعا بالتقاط مناعي للخلايا النجمية EVs. بالنظر إلى الوظائف المهمة للخلايا النجمية ، قد يلقي تحليل ADEVs الضوء على اكتشاف المؤشرات الحيوية والمسارات الالتهابية للدماغ التي يمكن دراستها بطريقة غير جراحية.
Protocol
تم إجراء البحث الموصوف في هذا البروتوكول مع عينات بلازما بشرية من متبرعين بالغين أصحاء من كلا الجنسين (الفئة العمرية 65.9-81.3 سنة ، 45.5٪ إناث) ، من مجموعة مبادرة سانت باو حول التنكس العصبي (SPIN) ، برشلونة ، إسبانيا36. أعطى المشاركون موافقة مستنيرة. أجريت الدراسة وفقا للمبادئ التوجيهية الأخلاقية الدولية للبحوث الطبية الواردة في إعلان هلسنكي والقانون الإسباني. قامت لجنة أخلاقيات البحث في سانت باو (CEIC) بمراجعة واعتماد بروتوكول جمع وتخزين عينات البلازما البشرية من مجموعة SPIN (# 16/2013).
1. إثراء الخلايا النجمية EVs من البلازما البشرية
ملاحظة: يتضمن هذا البروتوكول استخدام عينات البلازما البشرية. يتم تضمين جميع التفاصيل حول الكواشف والمواد المختبرية المستخدمة في هذا البروتوكول في جدول المواد. لا توجد معدات خاصة مطلوبة لهذا الإجراء ، ومع ذلك ، يرجى مراجعة اعتبارات السلامة لكل كاشف ، كما هو محدد على حدة من قبل كل مصنع
- جمع العينات وتخزينها
- اجمع الدم في أنابيب التفريغ EDTA اللافندر ، باتباع بروتوكولات موحدة لجمع البلازما36،37. جهاز طرد مركزي عند 2000 × جم لمدة 10 دقائق عند 4 درجات مئوية في غضون 30-120 دقيقة بعد التجميع لفصل البلازما. افصل البلازما ، وهي السائل العلوي الصافي الذي يظهر كمادة طافية ، في 500 ميكرولتر من الحصص الزائدة.
- لإزالة بقايا الخلية ، قم بالطرد المركزي للحصص عند 3000 × جم لمدة 15 دقيقة في درجة حرارة الغرفة. استعادة المادة الطافية. قم بتخزين البلازما عند -80 درجة مئوية حتى التحليل. كما هو شائع في تحليلات السوائل الحيوية ، قم بتقسيم العينات قبل التخزين وتجنب أكثر من ثلاث دورات تجميد وذوبان.
- إجمالي تخصيب المركبات الكهربائية
ملاحظة: يجب تصفية جميع الكواشف المستخدمة من خلال مرشح 0.22 ميكرومتر.- قم بإذابة 500 ميكرولتر من عينات البلازما. أضف الثرومبين بنسبة 1: 100 لإزالة عوامل التخثر. امزج عن طريق الانعكاس ثلاث مرات واتركه لمدة 5 دقائق في درجة حرارة الغرفة.
- أكمل الحجم للوصول إلى 1 مل مع محلول المحلول الملحي المخزن بالفوسفات (DPBS) من Dulbecco: كوكتيل مثبط البروتياز المركز DPBS + 3x (مخفف من مخزون كوكتيل مثبط البروتياز 10x). امزج عن طريق الانعكاس.
- الطرد المركزي للعينات عند 6000 × جم لمدة 20 دقيقة عند 4 درجات مئوية. استعادة المادة الطافية. أكمل الحجم باستخدام حل عمل DBPS للوصول إلى 1 مل.
- أضف 252 ميكرولتر من محلول هطول الأمطار EV واخلطه عن طريق الانعكاس ثلاث مرات. احتضان عند 4 درجات مئوية لمدة 60 دقيقة.
- قم بالطرد المركزي للعينات عند 1500 × جم لمدة 20 دقيقة عند 4 درجات مئوية لترسيب إجمالي جزء EV (الحبيبات). اجمع 1 مل من المادة الطافية. قم بتسمية الكسر على أنه بلازما مستنفدة من EV لاستخدامه كتحكم سلبي في علامات تخصيب EV (بدون EVs) وتخزينه عند -80 درجة مئوية.
- الطرد المركزي الحبيبات المتبقية عند 1500 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية المتبقية. أعد تعليق الحبيبات في 500 ميكرولتر من الماء فائق النقاء الذي يحتوي على مثبطات البروتياز والفوسفاتيز المركزة (التركيز النهائي 3x ، مخفف من مخزون 100x ، انظر جدول المواد).
- الماصة لأعلى ولأسفل بقوة لفك الحبيبات ، وتجنب الرغوة ؛ دوامة وتحريك على شاكر أنبوب دوار لمدة 30 دقيقة في درجة حرارة الغرفة حتى إعادة التعليق الكامل. تأكد من إعادة تعليق الحبيبات بالكامل ، لأنها خطوة حاسمة لخطوة التقاط المناعة اللاحقة.
- التقاط المناعة لمرض ADEVs
ملاحظة: تحمل ADEVs علامات الخلايا النجمية. العلامة المختارة لتخصيب ADEV عن طريق التقاط المناعة هي GLAST. GLAST ، الذي يرمز إلى ناقل الغلوتامات الأسبارتات (UniProtKB-P43003) ، هو ناقل الغلوتامات الأكثر وفرة الذي تعبر عنه في الغالب الخلايا النجمية في المخيخ والقشرة المخية المخيةالحديثة 38. الجسم المضاد المضاد للبلاست (ACSA-1 ، مستضد سطح الخلية النجمية -1) خاص بحتومة خارج الخلية من GLAST وقد تم تطويره لتحديد الخلايا النجمية. إنه الهدف الأكثر استخداما للاحتجاز المناعي ل ADEVs من البلازما البشرية12،20،34.- أضف 10 ميكرولتر من الجسم المضاد المضاد للبيوتينيل المضاد للبلاست (ACSA-1) إلى كل عينة تحتوي على إجمالي مستحضر EV. تخلط جيدا وبلطف. احتضان لمدة 1 ساعة عند 4 درجات مئوية على شاكر أنبوب دوارة.
- أضف 10 ميكرولتر من الميكروبيدات المغناطيسية المترافقة مع الأجسام المضادة أحادية النسيلة المضادة للبيوتين (الفأر IgG1). تخلط جيدا وبلطف. احتضان لمدة 1 ساعة عند 4 درجات مئوية على شاكر أنبوب دوارة.
- ضع عمودا صغيرا في المجال المغناطيسي لفاصل MACS. قم بإعداد العمود عن طريق شطفه ب 500 ميكرولتر من PBS-0.5٪ ألبومين مصل الأبقار (BSA). تجاهل التدفق.
- قم بتحميل تعليق EV / ACSA-1 / microbead على العمود. لا تضغط مع المكبس في هذه الخطوة. اجمع التدفق. قم بتسمية هذا على أنه مركبات كهربائية غير فلكية (بدون ADEVs) واحتفظ به كعنصر تحكم إذا لزم الأمر.
- اغسل العمود مرتين باستخدام 500 ميكرولتر من PBS-0.5٪ BSA. تجاهل التدفق.
- قم بإزالة العمود من الفاصل المغناطيسي وضعه في أنبوب تجميع منخفض الالتصاق سعة 1.5 مل. الماصة 500 ميكرولتر من PBS-0.5٪ BSA على العمود. ادفع بقوة باستخدام مكبس في العمود واجمع التصفيف.
- قم بتسمية ACSA-1+ EVs (ADEVs). قم بتخزين المركبات الكهربائية غير المحللة عند -20 درجة مئوية لفترات قصيرة أو عند -80 درجة مئوية لفترات أطول (>6 أشهر).
ملاحظة: سوف ترتبط الأجسام المضادة ل ACSA-1 بحتمة GLAST-1 / EAAT-1. سوف ترتبط الميكروبيدات المغناطيسية بتقارب مع مركب ACSA-1-EV. تحتوي أعمدة MACS الصغيرة على مصفوفة محسنة لتوليد مجال مغناطيسي قوي عند وضعها في مغناطيس ، وهو مطلوب للاحتفاظ ب ADEVs المصنفة.
للحصول على تمثيل تخطيطي لإجراء تخصيب ADEV ، انظر الشكل 1.
- تحلل المركبات الكهربائية
ملاحظة: يجب أن تكون المركبات الكهربائية محللة بالكامل للكشف عن العلامات داخل الحويصل. يوصى باستخدام طريقتين متتابعتين ، مثل المواد الكيميائية متبوعة بالتحلل الميكانيكي.- قم بإجراء التحلل الكيميائي للمركبات الكهربائية عن طريق إضافة كاشف استخراج البروتين (انظر جدول المواد) بنسبة عينة 100 ميكرولتر لكل كاشف استخراج 150 ميكرولتر. أضف 100x من البروتياز ومثبطات الفوسفاتيز للوصول إلى تركيز نهائي 1x. دوامة بقوة واتركها في درجة حرارة الغرفة لمدة 15 دقيقة.
- قم بإجراء التحلل الميكانيكي بإجراء من خطوتين: قم بتمرير محلول EV المحلل كيميائيا عبر حقنة مرتين (إبرة G29). بعد ذلك ، صوتنة العينات لمدة 45 ثانية في حمام الماء البارد بالموجات فوق الصوتية. قم بتجميد المركبات الكهربائية المحللة عند -80 درجة مئوية.
- قم بإذابة العينات عند 37 درجة مئوية لمدة 5 دقائق. قم بالتجميد مرة أخرى عند -80 درجة مئوية لتخزين المركبات الكهربائية المحللة. قم بإذابة الثلج مرة أخرى لمدة 5 دقائق عند 37 درجة مئوية قبل التحليل.

الشكل 1: تمثيل تخطيطي للإجراء المكون من خطوتين لإثراء المركبات الكهربائية المشتقة من الخلايا النجمية. في الخطوة الأولى ، يتم إثراء المركبات الكهربائية من البلازما البشرية منزوعة الضربات عن طريق خطوات الترسيب والطرد المركزي القائمة على البوليمر. بعد إعادة تعليق EV بالكامل ، يتم بعد ذلك اختيار الخلايا النجمية EVs عن طريق التقاط المناعة مع الأجسام المضادة المضادة للبلاست الحيوي (ACSA-1) والميكروبات المغناطيسية المضادة للبيوتين. الاختصارات: ACSA-1 = مستضد سطح الخلية النجمية -1 ؛ ADEVs = حويصلات خارج الخلية المشتقة من الخلايا النجمية ؛ DPBS = محلول ملحي مخزن بالفوسفات من Dulbecco. EVs = حويصلات خارج الخلية ؛ GLAST = ناقل الغلوتامات الأسبارتات ؛ لا ADEVs = حويصلات خارج الخلية غير النجمية. لا توجد مركبات كهربائية = لا حويصلات خارج الخلية (بلازما مستنفدة من EV) ؛ الموافقة المسبقة عن علم = كوكتيل مثبط للبروتياز ؛ RT = درجة حرارة الغرفة. الشكل الذي تم إنشاؤه باستخدام BioRender. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. التحقق من صحة البروتوكول
- توصيف الجزء الكلي للمركبات الكهربائية قبل التقاط المناعة
- استخدم إجمالي المركبات الكهربائية المحلل (الحبيبات المعلقة بعد ترسيب البوليمر) وعينات البلازما المخففة لتحليل اللطخة الغربية. استكمل العينات بمحلول عينة Laemmli 4x (5 ميكرولتر لكل 15 ميكرولتر من العينة) ، واغليها لمدة 10 دقائق عند 90 درجة مئوية ، ثم قم بتحميلها على 10٪ من المواد الهلامية الخالية من البقع.
- قم بإجراء الرحلان الكهربائي لجل SDS-polyacrylamide (SDS-PAGE) في المخزن المؤقت Tris / Glycine / SDS عند 80 فولت لمدة 30 دقيقة ، متبوعا ب 200 فولت لمدة 40 دقيقة. بعد SDS-PAGE ، قم بإزالة الجل من الألواح الزجاجية وتصور إجمالي محتوى البروتين بعد إثارة الأشعة فوق البنفسجية لمدة 1 دقيقة.
- انقل البروتينات من الجل إلى غشاء PVDF 0.2 ميكرومتر منشط بالميثانول من خلال نظام شبه جاف عند 25 فولت ، 2.5 أمبير لمدة 10 دقائق (انظر جدول المواد للحصول على تفاصيل حول المعدات). بعد النقل ، قم بحظر الغشاء في المخزن المؤقت المانع لمدة 5 دقائق في درجة حرارة الغرفة ثم احتضانه طوال الليل عند 4 درجات مئوية مع الأجسام المضادة الأولية ل Alix (1: 1000) أو CD9 (1: 1000) أو Calnexin (1: 1000) ؛ انظر جدول المواد للحصول على التفاصيل.
- اغسل الغشاء في محلول ملحي مخزن في تريس مع 0.1٪ توين 20 (TBST) ثلاث مرات لمدة 10 دقائق واحتضنه لمدة ساعة واحدة في درجة حرارة الغرفة باستخدام جسم مضاد ثانوي مضاد للأرانب HRP مخفف عند 1: 7500 في المخزن المؤقت للحظر. اغسل الغشاء في TBST أربع مرات لمدة 10 دقائق. قم بإجراء جميع عمليات الغسيل وخطوات الحضانة مع تحريك لطيف للغشاء على مقعد الروك.
- امزج المحلول الكيميائي بنسبة 1: 1 مع المخزن المؤقت للبيروكسيد واحتضان الأغشية لمدة 5 دقائق في درجة حرارة الغرفة. كشف العصابات واكتساب العصابات باستخدام نظام التصوير الكيميائي (انظر جدول المواد للحصول على التفاصيل).
- التحقق من صحة تخصيب العلامات الخاصة بالخلايا النجمية في جزء ADEV
ملاحظة: البروتين الحمضي الليفي الدبقي (GFAP) هو بروتين الخيوط الوسيط الرئيسي في الخلايا النجمية وعنصر أساسي في الهيكل الخلوي أثناء التطور. يمكن اكتشاف GFAP في أنسجة المخ والسوائل الحيوية كونها علامة نجمية معروفة39. لذلك ، تم تحديد هذه العلامة باستخدام تقنية الكشف عن العلامات الحيوية التجارية لإثبات إثراء العلامات المشتقة من الخلايا النجمية في جزء ADEV. تقنية المؤشرات الحيوية هذه هي تقنية فائقة الحساسية تسمح بقياس جزيئات البروتين الفردي بحساسية تصل إلى 1,000 مرة أكبر من المواصفات المناعية التقليدية. تعتمد هذه التقنية على استخدام الجسيمات الدقيقة المغناطيسية إلى جانب الأجسام المضادة المصممة للارتباط بأهداف محددة40،41 (انظر جدول المواد).- استخدم عينات EV المحللة لتحليل المؤشرات الحيوية. لاختبار إثراء علامات الخلايا النجمية ، قارن مستويات GFAP في التصفية (ADEVs) مقابل التدفق (No ADEVs) باستخدام مقايسة مناعية تجارية فائقة الحساسية.
- قم بتخفيف العينات بنسبة 1: 4 (25 ميكرولتر من EVs + 75 ميكرولتر من المخزن المؤقت للفحص) ، وقم بإعداد أجهزة المعايرة ، وإجراء الفحص في معدات الكشف عن العلامات الحيوية ، على النحو المحدد في تعليمات الشركة المصنعة (انظر جدول المواد). يمكن تخفيف العينات مباشرة على اللوحة.
- اختبر العينات وأجهزة المعايرة في نسختين. كان نطاق القياس الكمي لمقايسة GFAP 1.37-1000 بيكوغرام / مل. استخدم منصة تحليل البرامج الخاصة بالشركة المصنعة لحساب تركيزات GFAP من منحنى المعايرة.
- لتقدير معامل التباين (CV) لبروتوكول تخصيب علامات الخلايا النجمية ، قم بقياس مستويات GFAP في مستحضرات ADEV التي تم الحصول عليها من مكررات متطابقة من عينات البلازما البشرية المجمعة وحساب السيرة الذاتية كانحراف معياري / متوسط × 100. في هذا البروتوكول ، تم حساب السيرة الذاتية باستخدام N = 10 عينات بلازما متطابقة.
- التحقق من صحة تخصيب علامات EV في جزء ADEV
- للتحقق من صحة تخصيب علامات EV ، قم بقياس مستويات Alix و CD81 بواسطة ELISA (انظر جدول المواد) في عينات EV غير المخففة ، باتباع توصيات الشركة المصنعة. اختبار العينات والمعايرات في نسختين.
- اقرأ اللوحات عند 450 نانومتر و 570 نانومتر باستخدام قارئ الألواح الدقيقة. استخدم منحنى معايرة خطي لحساب تركيزات Alix و CD81. كان نطاق القياس الكمي لمقايسة Alix 47-3000 بيكوغرام / مل وبالنسبة ل CD81 كان 0.156-10 نانوغرام / مل.
- توصيف حجم وتشكل ADEVs
- تحليل تتبع الجسيمات النانوية
- استخدم تحليل تتبع الجسيمات النانوية (NTA) لقياس تركيز الجسيمات وتوزيع حجم مستحضرات المركبات الكهربائية الطازجة غير المحللة.
- قم بتخفيف معلقات ADEV الطازجة غير المحللة (10 ميكرولتر) مع PBS مفلتر وفقا لنطاق الكشف عن الجهاز (20-100 جسيم / إطار) ، باستخدام البرنامج المرفق ، قم بتسجيل ثلاثة مقاطع فيديو بحجم 60 ثانية مع الإعدادات على النحو التالي: معدل تدفق المحقنة عند 30 A.u. ، ومستوى الكاميرا عند 13 ، وعتبة الكشف عند 5. قم بتصحيح تركيزات الجسيمات لحجم عينة الإدخال ، وحجم إعادة تعليق EV ، والتخفيف اللازم لقراءة NTA.
ملاحظة: يوصى بالتصور المسبق لعينة تحتوي على حل مركبة EV للتحقق من تأثير المصفوفة ونقاء الوسيط الذي يتم فيه تعليق المركبات الكهربائية.
- المجهر الإلكتروني بالتبريد
- استخدم الفحص المجهري الإلكتروني بالتبريد (Cryo-EM) لتأكيد وجود وتشكل Evs في معلقات ADEV الطازجة غير المحللة (4 ميكرولتر). قم بتزجيج العينات باستخدام مجمد غاطس تجاري على شبكات الكربون Holey بالإعدادات التالية: 3.9 ميكرولتر من العينة ، وقت الانتظار 10 ثوان ، وقت اللطخة 2 ثانية.
- انغمس في النيتروجين الإيثاني السائل في محطة عمل للتبريد. انقل الشبكات إلى حامل تبريد يتم الاحتفاظ به عند -179 درجة مئوية لتحليل المجهر الإلكتروني للإرسال. افحص المركبات الكهربائية باستخدام مجهر إلكتروني ناقل حركة يعمل بجهد متسارع يبلغ 200 كيلو فولت ومجهز بكاميرا CCD. الحصول على الصور المجهرية باستخدام البرنامج.
- تحليل تتبع الجسيمات النانوية
- تحليل ترسيب البروتين الدهني المشترك
- تحديد مستويات ApoB البشرية في البلازما غير المخففة ، وعينات المركبات الكهربائية الإجمالية المحللة ، وعينات ADEV المحللة باستخدام مقايسة تعكر المناعة باستخدام مجموعة تجارية مكيفة لمحلل تلقائي تجاري (انظر جدول المواد لمزيد من التفاصيل).
- تحليل العلامات الالتهابية في ADEVs
- استخدم فحصا قائما على الخرزة (انظر جدول المواد) لتقدير تركيز 25 علامة التهابية: eotaxin و IFN Alpha2 و IFN Gamma و IL-1 Alpha و IL-1 Beta و IL-3 و IL-6 و IL-8 و IL-10 و IL-12 (p40) و IL-12 (p70) و IL-15 و IL-17A و IL-17E / IL-25 و IL-17F و IL-18 و IP-10 و MCP-1 و MCP-3 و MDC و MIP-1 Alpha و MIP-1 Beta و TGF Alpha و TNF Alpha و TNF Beta.
- استخدم مستحضرات EV غير المخففة (25 ميكرولتر) واحتضان العينات بالخرز طوال الليل عند 4 درجات مئوية ، باتباع تعليمات الشركة المصنعة. اغسل اللوحة ، واحتضن ب 25 ميكرولتر من الأجسام المضادة للكشف ، واحتضن لمدة ساعة واحدة مع التحريض في درجة حرارة الغرفة.
- أضف 25 ميكرولتر من Streptavidin-PE إلى كل بئر واحتضنه لمدة 30 دقيقة في درجة حرارة الغرفة. أضف 150 ميكرولتر من سائل الغمد واحتضنه لمدة 5 دقائق تحت التحريض. اقرأ اللوحة الموجودة على قارئ اللوحة المرفق بالنظام.
ملاحظة: تعتمد هذه التقنية على المقايسات المناعية باستخدام الأجسام المضادة التي ترتبط بسطح الميكروبيدات المغناطيسية المطلية بالفلورسنت. تقوم هذه التقنية بترميز الكريات المجهرية داخليا حسب لونها بأصباغ مختلفة. كل نوع من أنواع الكرة المجهرية مغطى بجسم مضاد معين للالتقاط ، بحيث تلتقط الخرزات المترافقة المتعددة التحليلات المضمنة في العينات ، مما يسمح بالكشف الكمي عن تعدد الإرسال لعشرات التحليلات في وقت واحد. يستخدم النظام منصة المقايسة المناعية متعددة الإرسال القائمة على الخرزة للكشف عنالإشارات 43.
3. تحليل البيانات
- إجراء التحليلات الإحصائية باستخدام البرامج التجارية. تقييم طبيعية البيانات باستخدام اختبار Shapiro-Wilk. اختبر المقارنات المكونة من مجموعتين مع اختبار Mann-Whitney U ومقارنات من ثلاث مجموعات مع اختبار Kruskal-Wallis وتصحيح Dunn اللاحق. اضبط الأهمية عند p < 0.05.
النتائج
تم بنجاح عزل ADEVs عن البلازما التي تم جمعها من المتبرعين الأصحاء. تم استخدام طريقة ترسيب قائمة على البوليمر للحصول على إجمالي جزء EV ، متبوعا بالتقاط مناعي باستخدام حبات ميكروبية مغناطيسية للحصول على ADEVs.
أشار تحليل اللطخة الغربية لجزء EV الكلي قبل خطوة التقاط المناعة إلى نقص الكالنيكسين (علامة التلوث الخلوي) ووجود أليكس وبروتين الغشاء CD9 في مستحضرات EV (الشكل 2 أ).
بعد التقاط المناعة ، تم التحقق من صحة وجود وإثراء العلامات الحويصلية والنجمية في جزء ADEV. كانت تركيزات GFAP أعلى بشكل ملحوظ في ADEVs مقارنة بالجزء الخالي من ADEV (التدفق) ، مما يدل على تخصيب ستة أضعاف (p = 0.008). هذا يؤكد الأصل النجمي في الغالب للمركبات الكهربائية في جزء ADEV (الشكل 2 ب). كانت السيرة الذاتية للقياس الكمي للبرنامج العالمي لمعالجة الرسومات الإجمالية عبر مستحضرات ADEV من 10 عينات متطابقة 25٪.
من أجل تأكيد وجود علامات حويصلية في مستحضرات ADEV ، تم فحص علامتين: Alix ، وهي علامة حويصلية عصلية كلاسيكية42 ، وبروتين الغشاء CD8144. كانت مستويات Alix أعلى في جزء ADEV مقارنة بالبلازما الحرة (p = 0.001) ، وكذلك مع البلازما المستنفدة EV ، والتي يشار إليها باسم عدم وجود EVs (p = 0.0007 ؛ الشكل 2 ج). كما أظهرت ADEVs تخصيب CD81 مقارنة بالبلازما الحرة (p = 0.03; الشكل 2 د).
لتوصيف مجموعة ADEV بشكل أكبر ، تم تحليل ملف تعريف الحجم والعدد بواسطة NTA والتشكل بواسطة cryo-EM. أظهر تحليل NTA مظهرا متجانسا للمركبات الكهربائية بمتوسط حجم 93.7 ± 2.7 نانومتر ، بما يتفق مع حجم المركبات الكهربائية الصغيرة (الحويصلات الدقيقة والإكسوسومات). علاوة على ذلك ، أكد التوصيف بواسطة cryo-EM وجود المركبات الكهربائية ومورفولوجيتها المتوقعة (الشكل 2E).
بالنظر إلى أن البروتينات الدهنية قد تترسب مع المركبات الكهربائية ، فقد تم تحليل مستويات ApoB عبر كسور مختلفة. تظهر النتائج أنه بعد خطوة الالتقاط المناعي ، تكون مستويات ApoB ضئيلة في مستحضرات ADEV ، حيث تكون أعلى في البلازما (p = 0.005 ؛ p = 0.005 ؛ p = 0.005 ؛ p = 0.005 ؛ p = 0.005 ؛ p = 0.005 ؛ p = 0.005 ؛ p = 0.005 ؛ p = 0.005 ؛ p = الشكل 2F).
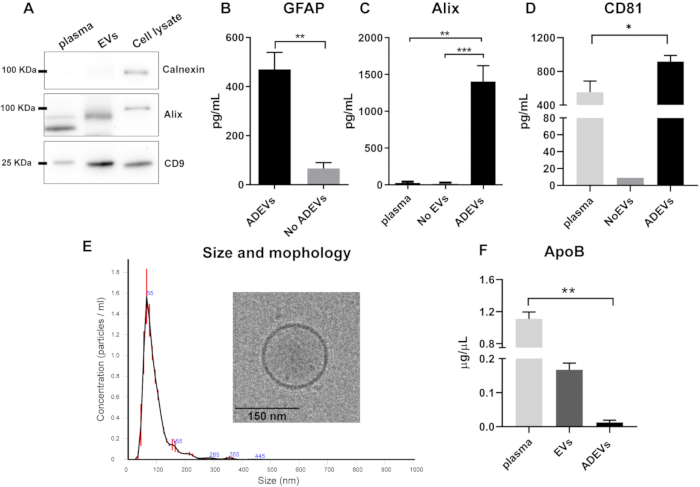
الشكل 2: توصيف إجمالي كسور EV و ADEV. (أ) لطخة غربية تمثيلية تظهر نقص calnexin ووجود Alix و CD9 في إجمالي مستحضرات EV. (ب) أظهر جزء ADEV مستويات متزايدة من GFAP مقارنة بعدم وجود ADEVs (ADEV، n = 7; لا ADEV ، ن = 7 ؛ ص = 0.008). (ج)تم الكشف عن مستويات أعلى من Alix في ADEVs مقارنة بالبلازما (p = 0.001) و No EVs (p = 0.0007). البلازما: ن = 6 ؛ لا توجد مركبات كهربائية: ن = 6 ؛ ADEVS: ن = 16. (د) تم الكشف عن مستويات أعلى من CD81 في جزء ADEV مقارنة بالبلازما (p = 0.003) ؛ البلازما: ن = 5 ؛ لا توجد مركبات كهربائية: ن = 1 (كان CD81 غير قابل للاكتشاف في ثماني من أصل تسع عينات من المركبات الكهربائية) ؛ ADEVS: ن = 17. (ه) كشف تحليل NTA عن وجود جسيمات بحجم متوسط 93.7 ± 2.7 نانومتر والتي تم تأكيد خصائصها الحويصلية بواسطة cryo-EM. (و) كان ApoB أقل بشكل ملحوظ في جزء ADEV مقارنة بالبلازما (p = 0.005). البلازما: ن = 4 ؛ المركبات الكهربائية: ن = 4 ؛ ADEVS: ن = 4. الاختصارات: ADEVs = حويصلات خارج الخلية المشتقة من الخلايا النجمية ؛ أليكس = موت الخلية المبرمج 6 بروتين متفاعل (PDCD6IP) ؛ ApoB = صميم البروتين الشحمي ب ؛ EVs = إجمالي مستحضرات الحويصلة خارج الخلية بعد هطول الأمطار القائم على البوليمر ؛ GFAP = البروتين الحمضي الليفي الدبقي ؛ لا ADEVs = حويصلات خارج الخلية غير النجمية. لا توجد EVs = لا توجد حويصلات خارج الخلية (بلازما مستنفدة من EV). بالنسبة للعلامة (B) ، تم استخدام اختبار مان ويتني ثنائي الذيل (** p < 0.01) وبالنسبة ل (C ، D ، F) ، تم استخدام اختبارات المقارنات المتعددة ل Kluskal-Wallis و Dunn (* p < 0.05 ، ** p < 0.01 و ***p < 0.0001). توضح الرسوم البيانية المتوسط وتظهر أشرطة الخطأ الخطأ المعياري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
أخيرا ، تم فحص قابلية تطبيق هذا البروتوكول باستخدام ADEVs لتحديد علامات الالتهاب. كان من الممكن اكتشاف جميع السيتوكينات الالتهابية البالغ عددها 25 في اللوحة في ADEVs التي تم الحصول عليها من متبرعين أصحاء (الشكل 3).

الشكل 3. القياس الكمي للسيتوكينات الالتهابية في جزء ADEV. كشفت لجنة مكونة من 25 من السيتوكينات الالتهابية في ADEVs من متبرعين أصحاء أن جميعها يمكن اكتشافها والتعبير عنها بشكل تفاضلي (HC ، ن = 3). يوضح الرسم البياني المتوسط وتظهر أشرطة الخطأ الخطأ المعياري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
اكتسبت المركبات الكهربائية اهتماما قويا بالبحوث الطبية الحيوية نظرا لإمكاناتها التشخيصية والعلاجية. حاليا ، أحد المعوقات الرئيسية المتعلقة بطرق عزل المركبات الكهربائية هو الافتقار إلى الإجماع المنهجي والبروتوكولات الموحدة. توفر هذه الدراسة بروتوكولا مفصلا لإثراء الخلايا النجمية EVs من البلازما البشرية عن طريق الترسيب القائم على البوليمر والالتقاط المناعي GLAST.
توجد منهجيات مختلفة لعزل المركبات الكهربائية عن سوائل الجسم ، ولكل منها مزاياها وقيودها. تم اختيار نهج قائم على البوليمر بسبب بساطته ، وسهولة استخدامه ، وعدم استهلاكه للوقت ، وعدم الحاجة إلى أداة معينة ، وإنتاجية عالية للمركبات الكهربائية ، ولأنه يستخدم على نطاق واسع في دراسات المؤشرات الحيوية للمركبات الكهربائية في علم الأعصاب12،18،19،20 ، مما يسمح بمقارنة النتائج. ومع ذلك ، يمكن أيضا اختبار طرق بديلة مثل كروماتوغرافيا استبعاد الحجم. من الانتقادات الشائعة للطرق القائمة على البوليمر الترسيب المشترك للبروتينات الدهنية مع المركبات الكهربائية. ومع ذلك ، فإن خطوة التقاط المناعة الإضافية مع الأجسام المضادة ACSA-1 والغسالات اللاحقة يمكن أن تتغلب على هذا القيد عن طريق الارتباط الانتقائي ب ADEVs ، وتقليل التلوث بالبروتينات الدهنية ، كما يتضح من تحليل ApoB. عند استخدام هذا البروتوكول للدراسات الكمية ، يجب مراعاة السيرة الذاتية للفحص الداخلي ، خاصة مع أحجام العينات الصغيرة. قيد آخر لهذا الإجراء هو أن الحد الأدنى من آثار البوليمر يمكن أن يتداخل مع بعض التحليلات النهائية ، مثل قياس الطيف الكتلي. لذلك ، يجب اختبار الجمع بين هذا البروتوكول والطرق التحليلية اللاحقة لكل استخدام محدد.
تم التحقق من صحة البروتوكول الموصوف في هذه الدراسة لإثراء العلامات الفلكية والحويصلية في جزء ADEV. تم إجراء التقاط مناعة الخلايا النجمية EV باستخدام GLAST كهدف والتحقق من صحة الأصل النجمي للمركبات الكهربائية كما هو موضح في التخصيب ستة أضعاف لعلامة فلكية إضافية ، GFAP. على الرغم من أن هذا الإجراء قد تم اختباره وتحسينه لإثراء ADEV من البلازما البشرية لكبار السن الأصحاء ، إلا أنه يمكن تعديل خطوات معينة في البروتوكول وتكييفها وفقا للتطبيق النهائي المراد استخدامه. على سبيل المثال ، يفضل استخدام الماء عالي النقاء لإعادة تعليق الحبيبات للترسيب المناعي اللاحق. بالإضافة إلى ذلك ، يمكن تعديل خطوة حضانة كل من الأجسام المضادة والخرز المغناطيسي (الوقت والتركيز) لتركيز أو تخفيف ADEVs حسب الرغبة.
تشمل الخطوات الحاسمة في البروتوكول إعادة التعليق الميكانيكي لحبيبات EV قبل خطوة التقاط المناعة. يجب معالجة المركبات الكهربائية المحببة بعناية فائقة ، وتجنب الرغوة أثناء إعادة التعليق. يجب أيضا الانتباه إلى استخدام مثبطات البروتياز المركزة 3x في المخازن المؤقتة ، لتثبيط البروتياز النشط الموجود في البلازما. علاوة على ذلك ، من الأهمية بمكان عدم الدفع باستخدام المكبس على العمود في خطوات قبل شطف ADEVs المحتفظ بها في العمود.
في حين أن هناك دراسات تستخدم هذا النهج (الترسيب القائم على البوليمر + الترسيب المناعي) لعزل ADEVs عن الأفراد المصابين بمرض الزهايمر وإصابات الدماغ الرضحية12،20،34 ، لا تزال ADEVs قيد التحقيق فيما يتعلق بالمركبات الكهربائية من أصول الخلايا الأخرى (على سبيل المثال ، الخلايا العصبية) وتستحق المزيد من البحث.
ارتبطت بعض الأمراض التنكسية العصبية ، مثل مرض الزهايمر ومتلازمة داون ، بتشوهات داخلية وزيادة إفراز EV45،46،47. تتمثل إحدى طرق حساب إفراز EV العالي في تحديد مستويات علامة EV ، مثل Alix و CD81 ، كما هو الحال في هذه الدراسة ، أو رباعي السبانين الآخرين ، مثل CD63 أو CD9 ، لتطبيع مستويات التحليل محل الاهتمام. إلى جانب التحقق من صحة إثراء العلامات النجمية وعلامات EV ، تم اختبار فائدة البروتوكول لقياس السيتوكينات الالتهابية في ADEVs. باستخدام منصة متعددة الإرسال ، تم الحصول على تركيزات كمية وقابلة للاكتشاف من 25 سيتوكينات وكيموكينات في جزء ADEV.
لذلك ، يسمح هذا الإجراء بجمع المركبات الكهربائية التي يمكن استخدامها كمنصة لاكتشاف المؤشرات الحيوية ، بالإضافة إلى أداة غير جراحية لدراسة الآليات والمسارات الجزيئية المتعلقة بالخلايا النجمية. في الواقع ، تتمتع دراسة ADEVs بإمكانيات هائلة في مجالات الأمراض العصبية ، حيث يمكن استخدام شحنة ADEV كمورد لاستكشاف النمط الظاهري للخلايا النجمية والتغيرات على طول مراحل المرض المختلفة.
في حين أن هذه المخطوطة تصف المنهجية على نطاق واسع ، فمن الضروري مراعاة مزايا وقيود هذه الطريقة وقابلية التطبيق المناسبة. في الواقع ، هناك جهود توحيد مهمة في مجال المركبات الكهربائية ، مثل التوصيات البحثية المكثفة وخطوات التحقق الموضحة في إرشادات MISEV من الجمعية الدولية للحويصلات خارج الخلية48 ، ومنصة مسار EV للإبلاغ عن المعلومات المنهجية حول دراسات EV49.
Disclosures
أفاد الدكتور بيلبين بتلقي رسوم شخصية من ADx NeuroSciences خارج العمل المقدم. أفاد الدكتور ألكوليا بتلقي رسوم شخصية مقابل خدمات المجلس الاستشاري و / أو أتعاب المتحدث من Fujirebio-Europe و Roche و Nurtricia و Krka Farmacéutica و Zambon S.A.U. و Esteve خارج العمل المقدم. عمل الدكتور ليو كمستشار أو في المجالس الاستشارية لشركة Fujirebio-Europe و Roche و Biogen و Grifols و Nutricia خارج العمل المقدم. أفاد الدكتور فورتيا بتلقي رسوم شخصية مقابل الخدمة في المجالس الاستشارية أو لجان التحكيم أو أتعاب المتحدثين من AC Immune و Novartis و Lundbeck و Roche و Fujirebio و Biogen خارج العمل المقدم. أفاد الدكتورون ألكوليا وبيلبين وLLeó و Fortea بأنهم يحملون براءة اختراع لعلامات اعتلال التشابك المشابك في الأمراض التنكسية العصبية (مرخصة ل ADx ، EPI8382175.0). لم يتم الإبلاغ عن أي إفصاحات أخرى. جميع المؤلفين الآخرين ليس لديهم شيء آخر يكشفون عنه.
Acknowledgements
يود المؤلفون أن يشعروا بالإشادة بمساعدة ثريا توريس وشيماء البننصري البندي وأوريول سانشيز لوبيز في التعامل مع العينات وإعدادها. نود أيضا أن نعرب عن تقديرنا لتعاون خوسيه أمابل برنابي ، من ICTS "NANBIOSIS" ، الوحدة 6 (وحدة CIBER في التكنولوجيا الحيوية والمواد الحيوية والطب النانوي) في معهد برشلونة لعلوم المواد ، مارتي دي كابو جاومي من وحدة المجهر الإلكتروني في جامعة برشلونة المستقلة ، والدكتورة مارتا سولير كاستاني وليا روس بلانكو من منصة قياس التدفق الخلوي في معهد سانت باو للبحوث الطبية الحيوية (IIB-Sant Pau) ، بالإضافة إلى الدكتورة جوان كارليس إسكولا جيل من مجموعة الفيزيولوجيا المرضية للأمراض المرتبطة بالدهون في IIB-Sant Pau للمساعدة في تحديد NTA و cryo-EM و Luminex و ApoB ، على التوالي.
يقر المؤلفون بالدعم المالي المقدم من مؤسسة جيروم ليجون (المشروع # 1941 و # 1913 إلى مؤسسة التمويل الأصغر و MCI) ، ومعهد سالوڈ كارلوس الثالث (PI20 / 01473 إلى JF ، و PI20 / 01330 إلى AL ، و PI18 / 00435 إلى DA ، و INT19 / 00016 إلى DA) ، والمعهد الوطني للصحة (1R01AG056850-01A1 ، R21AG056974 ، و R01AG061566 إلى JF) ، وجمعية الزهايمر والمعهد العالمي لصحة الدماغ (GBHI_ALZ-18-543740 إلى MCI) ، جمعية التنكس الجبهي الصدغي (زمالة ما بعد الدكتوراه للأبحاث السريرية ، AFTD 2019-2021) إلى ODI ، و Societat Catalana de Neurologia (Premi Beca Fundació SCN 2020 to MCI). تم دعم هذا العمل أيضا من قبل برنامج CIBERNED (البرنامج 1 ، مرض الزهايمر إلى دراسة AL و SIGNAL. حصلت SS على منحة ما بعد الدكتوراه "Juan de la Cierva-Incorporación" (IJC2019-038962-I) من قبل Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España).
Materials
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
References
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved